Method Article
Determinazione del tasso di trasporto di xenobiotici e nanomateriali attraverso la placenta con il
In questo articolo
Riepilogo
Gli Ex vivo Dual ricircolo modello perfusione placentare umano può essere usato per studiare il trasferimento di xenobiotici e nanoparticelle attraverso la placenta umana. In questo protocollo video si descrive l'attrezzatura e le tecniche necessarie per una corretta esecuzione di un perfusione placentare.
Abstract
Decenni fa, la placenta umana è stato pensato per essere una barriera impenetrabile tra madre e feto. Tuttavia, la scoperta di difetti alla nascita talidomide-indotta e molti studi successivi seguito si mostrò il contrario. Oggi diversi xenobiotici nocivi come la nicotina, eroina, metadone o droghe, nonché agenti inquinanti ambientali sono stati descritti per superare questa barriera. Con il crescente uso della nanotecnologia, la placenta rischia di entrare in contatto con nuove nanoparticelle sia accidentalmente attraverso l'esposizione o intenzionalmente, nel caso di potenziali applicazioni nanomedical. I dati provenienti da esperimenti su animali non possono essere estrapolati per l'uomo perché la placenta è la più specie-specifico organo dei mammiferi 1. Pertanto, l'ex vivo doppio ricircolo di perfusione placentare umano, sviluppato da Panigel et al. Nel 1967 2 e continuamente modificato da Schneider et al. Nel 1972 3, può servire come un eccellente modello di tØ studiare il trasferimento di xenobiotici o particelle.
Qui, ci concentriamo sul duplice ex vivo a ricircolo di protocollo di perfusione placentare umano e il suo ulteriore sviluppo per acquisire risultati riproducibili.
La placenta sono stati ottenuti dopo il consenso informato delle madri di gravidanze non complicate termine sottoposti a parto cesareo. I vasi fetali e materni di un cotiledone intatto stati cannulati e perfusi almeno per cinque ore. Come un modello di particelle particelle di polistirene fluorescente con dimensioni di 80 e 500 nm di diametro sono stati aggiunti al circuito materna. Le 80 particelle nm sono stati in grado di attraversare la barriera placentare e fornire un esempio perfetto per una sostanza che viene trasferita attraverso la placenta al feto, mentre le particelle di 500 nm sono stati mantenuti nel tessuto placentare o circuito materna. Il modello di perfusione ex vivo umano placentare è uno dei pochi modelli che forniscono informazioni attendibili suil comportamento di trasporto di xenobiotici in una importante barriera tessuto che fornisce i dati rilevanti predittivi e clinici.
Introduzione
La placenta è un organo complesso che è responsabile per lo scambio di ossigeno, anidride carbonica, nutrienti e prodotti di scarto e allo stesso tempo in grado di mantenere i due circuiti di sangue della madre e la crescita del feto separati tra loro. Inoltre, impedisce il rifiuto del figlio da parte del sistema immunitario materno e secerne ormoni per mantenere la gravidanza. La barriera cellulare si forma dalle cellule cytotrophoblast che si fondono e formano un vero sincizio senza membrane cellulari laterali 4,5. Tutta la placenta è organizzato in diversi cotiledoni, che contengono un albero dei villi fetali e rappresentano una unità funzionale della placenta.
Lo studio della funzione di barriera placentare è stata intensificata con la scoperta delle malformazioni indotte talidomide nel 1960. Per ovvie ragioni non possono essere eseguiti studi traslocazione con le donne in gravidanza. Di conseguenza, vari modelli alternativi sono stati sviluppati 6,7 . Il modello in questione più promettente e probabilmente più clinico è il modello ex vivo umano placentare perfusione sviluppato da Panigel e collaboratori 2,3.
Molte donne sono esposte a diversi xenobiotici quali farmaci o sostanze inquinanti ambientali durante la gravidanza 8. Per alcuni farmaci che sono stati già somministrati regolarmente durante la gravidanza, studi in vivo può essere eseguita confrontando la concentrazione ematica materna con quella nel sangue del cordone ombelicale. Tuttavia, in genere ci sono solo informazioni limitate sulla farmacocinetica e-dinamica nel feto e la teratogenicità di tali sostanze.
Per esempio gli oppiacei come l'eroina attraversa facilmente la barriera placentare e può portare alla restrizione della crescita intrauterina, parto prematuro o aborto spontaneo 9,10. Quindi, in caso di astinenza mancante durante la gravidanza si raccomanda una terapia sostitutiva con metadone. L'exvivo modello perfusione placentare umano ha rivelato che il trasferimento di metadone nella circolazione fetale è trascurabile 11, che correla bene con la-a-sangue materno rapporto di concentrazione calcolata cordone sangue dopo la consegna 12.
La nanotecnologia è un settore in crescita soprattutto in medicina. Così, sotto la naturale fine (<2,5 micron di diametro) e le particelle ultrafini (<0,1 micron di diametro) nei fumi degli incendi boschivi, eruzioni vulcaniche e in polvere del deserto, l'esposizione a nanomateriali ingegnerizzati (almeno una dimensione <0,1 micron 13 ) è in aumento. Questo ha sollevato interrogativi circa il potenziale tossicologico di nanomateriali ingegnerizzati. Anche se nessun pericolo umana potrebbe essere ancora dimostrata, ci sono i principali studi sperimentali indicano che le nanoparticelle ingegnerizzate possono causare reazioni avverse biologici che portano a risultati tossicologici 14. Recentemente, alcuni studi hanno indicato che l'esposizione prenatale ainquinamento dell'aria è collegato ad un bisogno respiratorio superiore e infiammazione delle vie aeree in neonati e bambini 15,16. Inoltre, le piccole nanoparticelle potrebbero essere utilizzati come trasportatori di farmaci per trattare specificamente, sia il feto o la madre. Pertanto, diventa evidente che sono necessari studi approfonditi di xenobiotici distinti o nanomateriali e la loro capacità di attraversare la barriera placentare. Una panoramica reale sugli studi in corso sulla permeabilità placentare di nanomateriali ingegnerizzati è riassunto nella Menezes et al. 2011 17 e Buerki-Thurnherr et al. 2012 7.
La doppia ex vivo ricircolazione modello perfusione placentare umano fornisce un sistema controllato e affidabile per studiare il trasporto placentare di vari composti endogeni ed esogeni 3,11,12,18,19 e una vasta gamma di altre funzioni della placenta come meccanismi responsabili della sviluppo di stati patologici come preeclampsia 20-22. In questo protocollo ci concentriamo principalmente sul set up, la gestione e il metodo che permette lo studio di accumulo, effetti e tassi di traslocazione di un ampio set di xenobiotici o nanoparticelle.
Protocollo
1. Preparazione del sistema di perfusione
- Configurare il sistema di perfusione costituito da un bagno d'acqua, una camera di perfusione, due colonne per l'ossigenazione, due pompe peristaltiche, due trappole bolla, due riscaldatori di flusso e un sensore di pressione (Figura 1). Collegare questi componenti con sezioni di tubi composti di materiali siliconici e cloruro di polivinile secondo lo schema della figura 2. Infine ci sono due circuiti che rappresentano rispettivamente il circuito fetale e materna.
- Accendere il bagno d'acqua, i riscaldatori di flusso ed il riscaldamento per la camera di perfusione. La temperatura dovrebbe essere di 37 ° C.
- Riscaldare il fluido di perfusione (NCTC-135 coltura tissutale diluito 1:2 con tampone di Earle (6,8 g / l di cloruro di sodio, 0,4 g / l di cloruro di potassio, 0,14 g / L di fosfato monosodico, 0,2 g / L di magnesio solfato, 0,2 g / l di cloruro di calcio, 2 g / L di glucosio) supplementato con glucosio (1 g / L), destrano 40 (10 g / L), sieroalbumina bovina (10 g/ L), eparina sodica (2,500 IU / L), amoxicillina (250 mg / L) e bicarbonato di sodio (2,2 g / L); pH 7.4) nel bagnomaria.
- Consecutivamente sciacquare i sistemi arteriosa del circuito fetale e materno with a) 200 ml di acqua distillata, b) 50 ml di idrossido di sodio 1%, c) 1% acido fosforico ed) ancora 200 ml di acqua distillata (portata: 15 - 20 ml / min).
- Collegare la cannula fetale (Ø 1,2 millimetri; ago smussato deve essere collegata a un alato set di infusione ago modificato) per il tubo arterioso fetale.
- Sciacquare i sistemi arteriosa del circuito fetale e materno con il mezzo di perfusione finché tutte le provette contengano medie (portata: 15-20 ml / min). Durante questa fase riempire le trappole bolla e rimuovere tutte le bolle a valle della trappola. Poi fermare le pompe. E 'davvero importante che i tubi arteriosi afferenti sono sempre liberi di bolle, altrimenti dopo incannulamento soprattutto le belle vasi fetali possono rompersi.
- Accendere il flusso di gas. Il circuito materna è ossigenato with 5% di anidride carbonica e aria sintetica 95% e il circuito fetale con il 5% di biossido di carbonio e 95% di azoto.
- Avviare la registrazione del sensore di pressione.
2. Cannulating la Placenta
- Ottenere placenta intatta da gravidanze non complicate termine dopo il taglio cesareo primario. Consenso scritto deve essere data (è stato ottenuto nel caso dei nostri studi) dalle madri prima della consegna e lo studio deve essere approvato dal comitato etico locale (è stato il caso nei nostri studi). Primo controllo visivo deve essere effettuato da ostetriche per assicurare una placenta sana e intatta.
- Incannulamento della placenta è un passaggio fondamentale! Durante la perfusione ogni piccola perturbazione nel tessuto può portare ad una perdita tra la circolazione materna e fetale. La placenta deve essere ottenuto entro 30 minuti dopo la consegna.
- Selezionare un cotiledone intatto nella zona marginale della placenta senza interruzioni visibili sul lato materno. Alla piastra corionica,legare entrambi i rami collegati al dell'arteria ombelicale e vena a monte al lato incannulazione tardi (verso il cordone ombelicale) utilizzando materiale di sutura chirurgica. Fai sempre due nodi.
- Incannulare l'arteria fetale prima. Le arterie placentari fetali sono sempre più piccoli e più sottili delle vene.
- Fai una sutura intorno all'arteria del feto, ma non legarlo immediatamente. Tenere il recipiente con una pinza, tagliare accuratamente il vaso e mettere la piccola cannula (Ø 1,2 mm) in arteria. Poi legare la sutura (due nodi).
- Procedere con la vena fetale nello stesso modo, ma usare una cannula più grande (Ø 1,5-1,8 mm; ago smussato deve essere collegata a un alato set di infusione ago modificato).
- Accendere la pompa fetale (2 ml / min). Se non ci sono perdite visibili e sangue emana dalla cannula vena fetale, aumentare lentamente il flusso fino a 4 ml / min. Osservare la pressione nell'arteria fetale, non dovrebbe superare i 70 mmHg. Se il liquido che fuoriesce al feto o di maternal cannula fissarli con un altro sutura.
- Posizionare la placenta sul supporto del tessuto con il lato fetale e tirare la membrana placentare e tessuto sopra le punte. Alla fine il cotiledone perfuso dovrebbe essere al centro del foro nel supporto del tessuto.
- Stabilizzare la parte dove solo la membrana contiene la placenta con una membrana di silicone (Ø 1 mm) o in alternativa ai due pezzi parafilm.
- Montare il supporto del tessuto completo, stringere le viti e tagliare il tessuto sovrastante. Si prega di notare che il venoso e arterioso cannule non vengano schiacciati, ma invece giacevano nei piccoli canali del supporto del tessuto.
- Ruotare il supporto del tessuto a testa in giù, metterlo nella camera di perfusione e di aggiungere la copertina. Ora, il lato materno dovrebbe essere al top. Controllare sempre se il circuito del feto è ancora intatta e il mezzo sta fluendo fuori del tubo vena fetale.
- Accendere la pompa di materna (12 ml / min). Introdurre i tre smussato cannule (Ø 0.8 mm) e al secoloe estremità del tubo arteria materna nello spazio intervilloso penetrando la piastra deciduali. Per riportare il perfusato al circuito materna messo una provetta come drenaggio venoso anch'esso collegato con la pompa materna nella posizione più bassa nella parte superiore della camera di perfusione.
- Collegare la cannula venosa fetale al tubo vena fetale.
3. L'esecuzione della fase di pre-e Sperimentale di perfusione
- Per consentire al tessuto di recuperare dal periodo ischemico dopo la consegna e per scovare il sangue nello spazio intervilloso, un open di pre-fase di 20 min è necessario. Ciò significa che la vena materna e fetale non stanno portando al serbatoio arteriosa contenente il medium di perfusione. Raccogliere il deflusso venoso fetale e materna in una bottiglia e gettarla via dopo la prima fase.
- Per valutare l'integrità della perfusione eseguire un'altra pre-fase di 20 min, ma in un circuito chiuso. Utilizzare due serbatoi separati con il mezzo di perfusioneper il circuito fetale e materna e chiudere i circuiti guidando il deflusso venoso fetale torna nel serbatoio fetale e materno venoso torna nel serbatoio materna.
- Per l'esperimento perfusione principale preparare due beute da 120 ml di mezzo di perfusione (una per la materna e una per il serbatoio fetale). Aggiungere la radiomarcato 14 C-antipyrine (4 nCi / ml; serve come controllo positivo; ATTENZIONE: sostanza radioattiva) e la xenobiotici o nanoparticelle fluorescente che si vuole analizzare al serbatoio materna. Mescolare bene il perfusato materna.
- Avviare l'esperimento scambiando il medium di perfusione puro con i due palloni preparati (serbatoi fetale e materna). Chiudere i circuiti guidando il feto venoso torna nel serbatoio fetale e materno venoso torna nel serbatoio materna.
- Continuare la perfusione per 6 ore e prelevare campioni regolarmente. Risospendere sempre il mezzo nel fetale e maternaserbatoio prima del ritiro.
- Controllare la pressione in arteria fetale (non dovrebbe superare i 70 mmHg), pH in entrambi i circuiti (dovrebbe essere in un range fisiologico 7.2-7.4) e il volume di entrambi i serbatoi (perdita di volume fetale non deve superare 4 ml / hr) durante la perfusione . Se necessario regolare i valori di pH utilizzando sia l'acido cloridrico o idrossido di sodio.
- Se la perdita di volume nel serbatoio fetale supera 4 ml / hr c'è una perdita nel tessuto e si deve interrompere la perfusione. Il tasso di successo di una perfusione per 6 ore senza perdita è di circa il 15-20%.
- Fermare la perfusione dopo 6 ore. Spegni le pompe, bagno d'acqua, riscaldatori di flusso e flusso di gas.
- Rimuovere la placenta dal supporto del tessuto, tagliare il cotiledone perfuso (più luminoso del tessuto unperfused) e si pesa.
- Prelevare campioni da unperfused (parte della placenta che è stato tagliato in principio; potrebbe essere già in fase di pre-fase) e perfusione tissutale (ciascuna di circa 1 g) e conservarli a -20 ° Cfino omogeneizzazione o in azoto liquido per la successiva analisi. Fissare un altro campione di tessuto in formalina 4% per la valutazione istopatologica. I campioni dovrebbero comprendere tutti gli strati della placenta.
- Pulire le provette dopo perfusione ordine successivo risciacquo sistemi arteriosa del circuito fetale e materno con a) 200 ml di acqua distillata, b) 50 ml di idrossido di sodio 1%, c) 50 ml di 1% di acido fosforico e d) di nuovo 200 ml di acqua distillata (flusso: 15-20 ml / min).
L'intera procedura di lavoro dell'esperimento perfusione placenta è mostrata in Figura 3.
4. Analizzando i campioni
- Centrifugare i campioni perfusato per 10 min a 800 xg prima dell'analisi per rimuovere residui eritrociti. Prendete il surnatante per l'ulteriore analisi. I campioni possono essere lasciati notte a 4 ° C. Per l'analisi della produzione di leptina e hCG i campioni possono essere conservati a -20 ° C.
- Per valutare la permeabilità delplacenta analizzare il C-14 antipyrine da scintillazione liquida. Mescolare 300 ml di campioni fetali e materni con 3 ml di cocktail di scintillazione e misura per 5 minuti in un contatore beta.
- Per valutare il trasferimento delle nanoparticelle fluorescenti o xenobiotici di interesse leggere la fluorescenza a 485 nm di eccitazione e di emissione di 528 nm in un lettore di micropiastre (lunghezza d'onda sono indicati per l'analisi del marchio verde giallo che abbiamo usato per le nanoparticelle).
- Per determinare la fattibilità del tessuto placentare durante la perfusione misura il consumo di glucosio e la produzione di lattato nel circuito fetale e materno con un sistema automatizzato di gas del sangue. Inoltre, valutare la produzione di ormoni placentare umano choriongonadotropin (hCG) e leptina nei campioni di tessuto omogeneizzati e le perfusati by enzyme-linked test immunoenzimatico (ELISA).
Risultati
La Figura 4A mostra i profili di perfusione di piccole particelle di polistirene (80 nm) che sono stati trasportati attraverso la placenta più grandi rispetto a particelle di polistirene (500 nm), che non sono state trasferite al compartimento fetale. Ciascun punto di dati rappresenta la concentrazione di particella medio al dato punto di almeno tre esperimenti indipendenti tempo. Per polistirolo nanoparticelle il trasferimento placentare è formato-dipendente 19. Dopo 3 h di placenta perfusione già il 20-30% dei inizialmente aggiunti 80 particelle di polistirene nm è stata trasferita dalla materna al circuito fetale, mentre le particelle di polistirene 500 nm non apparivano nel circuito fetale anche dopo 6 ore di perfusione. Tuttavia, la concentrazione materna delle particelle 500 nm è in diminuzione. Immagini di fluorescenza sulla sezione istologica del tessuto dopo perfusione mostrato che queste particelle si accumulano nei villi della placenta (dati non mostrati). Figura 4B raffigura un caratteristico profilo perfusione del radioattivo 14 C-antipirina. Antipyrine come una piccola molecola lipofila si distribuisce sopra la barriera placentare mediante diffusione passiva e serve come controllo per l'integrità dei circuiti. Dopo 4-6 ore di perfusione un equilibrio tra la concentrazione antipyrine fetale e materna dovrebbe essere costruito 23. Per valutare e confrontare la velocità di trasporto placentare di xenobiotici è di solito visualizzata la (F / M) Rapporto di concentrazione del farmaco feto-a-materna (Figura 5).
Attraverso l'analisi del lattato e ormone placentare (choriongonadotropin umana e leptina) di produzione così come consumo di glucosio potrebbero essere monitorati la vitalità e la funzionalità del tessuto placentare durante la perfusione (Figura 6). I valori per le perfusioni con xenobiotici dovrebbero essere sempre nello stesso intervallo di valori di perfusione controllo senza xenobiotici. Inoltre, histop valutazione athological del tessuto placentare perfuso potrebbe essere eseguita. Un confronto con i non-perfuso tessuto placentare potrebbe quindi rivelare cambiamenti patologici a causa di perfusione (ad esempio la contaminazione batterica) e quindi potrebbe servire un altro parametro di controllo di qualità.
Ulteriori risultati rappresentativi ottenuti con il doppio ricircolo modello di perfusione ex vivo umano placentare sono stati pubblicati recentemente 11,19.

Figura 1. Ex vivo perfusione placentare umana set-up. 1) Bagno di acqua con serbatoi materne e fetali, 2) camera di perfusione, 3) gorgogliatore, 4) colonne ossigenatori, e 5) scaldacqua istantaneo.
load/50401/50401fig2.jpg "/>
Figura 2. Rappresentazione schematica del modello in vivo perfusione placentare umana ex FA: arteria fetale; FV:. Vena fetale, MA: arteria materna; MV: vena materna; BT: gorgogliatore; PS: sensore di pressione
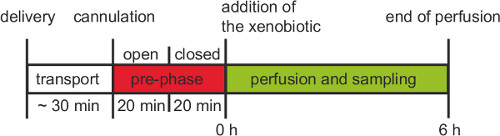
Figura 3. Procedura di lavoro di un esperimento perfusione ex vivo umano placentare. Dopo il parto la placenta deve essere cannulato entro 30 min. Prima della fase 6 hr sperimentale con ricircolo di pre-fase e chiuso di pre-fase di apertura deve essere eseguita per almeno 20 minuti ciascuna.

Figura 4. Profili di perfusione di particelle di polistirene e 14 </ Sup> C-antipirina 19. Profilo Perfusione di particelle di polistirene nelle misure 80 nm (n = 4) e 500 nm (n = 3). Inizialmente 25 mcg / ml e 4,2 particelle nCi / ml 14 C-antipyrine stati aggiunti al circuito materna. La quantità di particelle (A) e 14 C-antipirina (B) sono stati misurati nei circuiti materni (M, simboli pieni) e fetale (F, simboli aperti) dopo i punti di tempo indicati. Visualizzato è la concentrazione media ± SE. Clicca qui per ingrandire la figura .
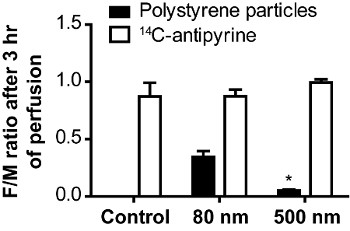
Figura 5. Taglia-dipendente trasferimento di particelle di polistirene attraverso la placenta umana 19. I rapporti tra le concentrazioni fetali e materni di 14 C-antipyrine e polistirolo particelle erano calculated dopo 180 min di perfusione placenta. I dati rappresentano la media ± SE di almeno tre esperimenti indipendenti. La colonna di controllo raffigura perfusioni senza particelle, ma con 14 C-antipirina. (* P <0,05 rispetto al valore del rapporto di 80 nm).

Figura 6. Vitalità del tessuto placentare durante la perfusione 19. (A) consumo di glucosio e la produzione di lattato nella placenta perfuso. Mostrato è la somma delle variazioni del contenuto totale nei circuiti (fetale e materna) nel tempo diviso per il peso del cotiledone perfuso. (B) produzione netto normalizzato (NP divisa per tenore di tessuto iniziale T0) degli ormoni placentari choriongonadotropin umana e leptina. I dati rappresentano la media ± SE di a lEast 3 esperimenti indipendenti.
Discussione
Sotto il duplice perfusione ricircolo mostrato qui, ci sono diverse altre configurazioni sperimentali possibili a seconda della questione che deve essere risolta. Perfusione placentare particolarmente aperta sono comunemente utilizzati per valutare la clearance del farmaco a concentrazioni steady-state 3. La perfusione ricircolo set-up può essere applicato anche per confermare trasporto attivo di sostanze endogene o esogene. Per questo approccio la stessa concentrazione del xenobiotici deve essere aggiunto alla materna e la circolazione fetale. Supposto che vi è il trasporto attivo contro il gradiente di concentrazione, l'accumulo della sostanza in esame sia in uno dei due circuiti può osservare 24. Di nota, l'aggiunta della sostanza di prova solo al circuito fetale è anche fattibile e può rivelare il meccanismo di trasporto attraverso la barriera placentare di questa particolare sostanza 25.
Il protocollo è evoluto nel corso timE e possono variare tra i diversi gruppi di ricerca in particolare concernenti la portata, composizione del terreno di perfusione, forma di ossigenazione e riscaldamento 26,27. Soprattutto la portata può influenzare il momento in cui si verifica il trasferimento transplacentare. Per controllare questo, l'aggiunta di un composto di riferimento passivamente trasportati come antipyrine è importante. La velocità di trasferimento del xenobiotici può sempre essere confrontato con la velocità di trasferimento di antipyrine (rapporto F / M dovrebbe essere sopra 0,75) 26. Poiché il trasferimento antipyrine limite principale è il flusso e superficie di scambio, questo confronto prende disomogeneità nel flusso e la dimensione del cotiledone perfuso in considerazione che potrebbe variare tra gli esperimenti. Inoltre, FITC-destrano potrebbe essere aggiunto al circuito fetale per servire come controllo per l'integrità della barriera 26. Perdita di volume fetale è anche usato come marcatore per l'integrità della barriera. Di solito una perdita fetale fluido fino a 4 ml / h è consentito 28, ma lari è limite generalmente accettato.
Ovviamente, ci sono alcuni svantaggi del metodo di perfusione ex vivo umano placentare come inter-individuali variazioni e una bassa percentuale di successo (15-20%). Inoltre, un periodo di 6 ore perfusione non può simulare un trattamento farmacologico cronico e pertanto non può completamente escludere il trasferimento di un xenobiotico dopo esposizione a lungo termine. Un altro limite del modello è che soprattutto il trasferimento transplacentare a termine è valutata mentre il tasso di trasporto nei primi anni di gestazione, quando la barriera è più spessa rimane ancora sconosciuta. In effetti, la perfusione del primo trimestre placente è possibile, ma la disponibilità di queste placente è piuttosto limitato. Tuttavia, fino ad ora il metodo di perfusione placentare ex vivo è l'unico modello per studiare il trasporto di vari xenobiotici o nanoparticelle organizzata in tessuto placentare umano. Mentre tossicodinamica nel modello umano perfusione ex vivo possono essere analizzati solo al pltessuto acental, gli esperimenti sugli animali possono infatti fornire anche informazioni sulla embriotossicità. Però, a causa delle differenze anatomiche della barriera placentare tra uomo e roditori questi risultati non possono essere estrapolati all'uomo 4,5. Un'altra possibilità di indagare il trasferimento transplacentare può essere modelli di coltura cellulare come cytotrophoblasts primarie, linee cellulari coriocarcinoma, isolato vescicole di membrana plasmatica o espianti di tessuto placentare 29. Il modello più utilizzato è la linea cellulare Bewo; queste cellule sono derivate da un coriocarcinoma gestazionale maligna e possono formare un monostrato confluente su una membrana permeabile, così Studi di trasporto può essere eseguita. I risultati degli studi di trasporto che utilizzano il modello di cellulare Bewo correlano bene con i risultati ottenuti nella ex vivo perfusione placentare umano 30. Tuttavia, per studiare i dettagli di trasporto del farmaco (come il contributo di una proteina di trasporto specifico) e il metabolismo, il modello cellulare Bewo può essere mminerale fattibile soprattutto perché è più facile da maneggiare e suscettibile di manipolazione come espressione di trasportatori o enzimi geneticamente modificati, ma per quanto riguarda gli studi generali trasferimento dei farmaci l'affidabilità di questo modello è limitata. Manca il flusso sanguigno e l'integrità del monostrato deve essere attentamente valutata in quanto dipende da diversi fattori come le condizioni di coltura cellulare, semina densità, durata di esposizione e la membrana inserto 6,29.
Diversi xenobiotici e nanoparticelle anche legano varie proteine plasmatiche che possono influenzare in modo significativo il trasferimento transplacentare 31; considerando il legame alle proteine plasmatiche è quindi importante. Il mezzo di perfusione contenente siero albumina bovina, la proteina plasmatica più frequente. Recentemente, uno studio ha dimostrato che i coefficienti di trasferimento di varie sostanze ottenute con il modello di perfusione ex vivo placentare umano correlano bene con il sangue del cordone in vivo per maternarapporti di concentrazione nel sangue quando i rapporti di trasferimento siano stati regolati in base al punto di proteine plasmatiche 12 vincolante.
Nel complesso, il modello di perfusione ex vivo placentare è un metodo valido ed affidabile per studiare il trasporto attraverso la placenta umana ed in vivo prevedere il passaggio transplacentare di xenobiotici e nanoparticelle.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo lavoro è sostenuto finanziariamente dalla Fondazione nazionale svizzera, (PNR programma 64, concedere nessun 4064-131.232).
Materiali
| Name | Company | Catalog Number | Comments |
| NCTC-135 medium | ICN Biomedicals, Inc. | 10-911-22C | could be replaced by Medium 199 from Sigma (M3769) |
| Sodium chloride (NaCl) | Sigma-Aldrich, Fluka | 71381 | |
| Potassium chloride (KCl) | Hospital pharmacy | also possible: Sigma (P9541) | |
| Monosodium phosphate (NaH2PO4 · H2O) | Merck | 106346 | |
| Magnesium sulfate (MgSO4 · H2O) | Sigma-Aldrich, Fluka | 63139 | |
| Calcium chloride (CaCl, anhydrous) | Merck | 102388 | |
| D(+) Glucose (anhydrous) | Sigma-Aldrich, Fluka | 49138 | |
| Sodium bicarbonate (NaHCO3) | Merck | 106329 | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | 31389 | |
| Bovine serum albumin (BSA) | Applichem | A1391 | |
| Amoxicilline (Clamoxyl) | GlaxoSmithKline AG | 2021101A | |
| Sodium heparin | B. Braun Medical AG | 3511014 | |
| Sodium hydoxide (NaOH) pellets | Merck | 106498 | CAUTION: corrosive |
| Ortho-phosphoric acid 85% (H3PO4) | Merck | 100573 | CAUTION: corrosive |
| Maternal gas mixture: 95% synthetic air, 5% CO2 | PanGas AG | ||
| Fetal gas mixture: 95% N2, 5% CO2 | PanGas AG | ||
| Antipyrine (N-methyl-14C) | American Radiolabeled Chemicals, Inc. | ARC 0108-50 μCi | CAUTION: radioactive material (specific activity: 55mCi/mmol) |
| Scintillation cocktail (IrgaSafe Plus) | Zinsser Analytic GmbH | 1003100 | |
| Polystyrene particles 80 nm | Polyscience, Inc. | 17150 | |
| Polystyrene particles 500 nm | Polyscience, Inc. | 17152 | |
| EQUIPMENT | |||
| Water bath | VWR | 462-7001 | |
| Thermostat | IKA-Werke GmbH Co. KG | 3164000 | |
| Peristaltic pumps | Ismatec | ISM 833 | |
| Bubble traps (glass) | UNI-GLAS Laborbedarf | ||
| Flow heater | UNI-GLAS Laborbedarf | ||
| Pressure sensor + Software for analyses | MSR Electronics GmbH | 145B5 | |
| Notebook | Hewlett Packard | ||
| Miniature gas exchange oxygenator | Living Systems Instrumentation | LSI-OXR | |
| Tygon Tube (ID: 1.6 mm; OD: 4.8 mm) | Ismatec | MF0028 | |
| Tubes for pumps (PharMed BPT; ID: 1.52 mm) | Ismatec | SC0744 | |
| Blunt cannulae ( 0.8 mm) | Polymed Medical Center | 03.592.81 | |
| Blunt cannulae ( 1.2 mm) | Polymed Medical Center | 03.592.90 | |
| Blunt cannulae ( 1.5 mm) | Polymed Medical Center | 03.592.94 | |
| Blunt cannulae ( 1.8 mm) | Polymed Medical Center | 03.952.82 | |
| Parafilm | VWR | 291-1212 | |
| Perfusion chamber with tissue holder (plexiglass) | Internal technical department | Similar equipment is available from Hemotek Limited, UK | |
| Surgical suture material (PremiCron) | B. Braun Medical AG | C0026005 | |
| Winged Needle Infusion Set (21G Butterfly) | Hospira, Inc. | ASN 2102 | |
| Multidirectional stopcock (Discofix C-3) | B. Braun Medical AG | 16494C | |
| Surgical scissors | B. Braun Medical AG | BC304R | |
| Dissecting scissors | B. Braun Medical AG | BC162R | |
| Needle holder | B. Braun Medical AG | BM200R | |
| Dissecting forceps | B. Braun Medical AG | BD215R | |
| Automated blood gas system | Radiometer Medical ApS | ABL800 FLEX | |
| Multi-mode microplate reader | BioTek | Synergy HT | |
| Liquid scintillation analyzer | GMI, Inc. | Packard Tri-Carb 2200 | |
| Scintillation tubes 5.5 ml | Zinsser Analytic GmbH | 3020001 | |
| Tissue Homogenizer | OMNI, Inc. | TH-220 | |
| pH meter + electrode | VWR | 662-2779 | |
Riferimenti
- Ala-Kokko, T. I., Myllynen, P., Vahakangas, K. Ex vivo perfusion of the human placental cotyledon: implications for anesthetic pharmacology. Int. J. Obstet. Anesth. 9, 26-38 (2000).
- Panigel, M., Pascaud, M., Brun, J. L. Radioangiographic study of circulation in the villi and intervillous space of isolated human placental cotyledon kept viable by perfusion. J. Physiol. (Paris). 59, 277 (1967).
- Schneider, H., Panigel, M., Dancis, J. Transfer across the perfused human placenta of antipyrine, sodium and leucine. Am. J. Obstet. Gynecol. 114, 822-828 (1972).
- Enders, A. C., Blankenship, T. N. Comparative placental structure. Adv. Drug Deliv. Rev. 38, 3-15 (1999).
- Takata, K., Hirano, H. Mechanism of glucose transport across the human and rat placental barrier: a review. Microsc. Res. Tech. 38, 145-152 (1997).
- Saunders, M. Transplacental transport of nanomaterials. Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 1, 671-684 (2009).
- Buerki-Thurnherr, T., von Mandach, U., Wick, P. Knocking at the door of the unborn child: engineered nanoparticles at the human placental barrier. Swiss Med. Wkly. 142, w13559 (2012).
- Gendron, M. P., Martin, B., Oraichi, D., Berard, A. Health care providers' requests to Teratogen Information Services on medication use during pregnancy and lactation. Eur. J. Clin. Pharmacol. 65, 523-531 (2009).
- Burns, L., Mattick, R. P., Lim, K., Wallace, C. Methadone in pregnancy: treatment retention and neonatal outcomes. Addiction. 102, 264-270 (2007).
- von Mandach, U. Drug use in pregnancy. Ther. Umsch. 62, 29-35 (2005).
- Malek, A., Obrist, C., Wenzinger, S., von Mandach, U. The impact of cocaine and heroin on the placental transfer of methadone. Reprod. Biol. Endocrinol. 7, 61 (2009).
- Hutson, J. R., Garcia-Bournissen, F., Davis, A., Koren, G. The human placental perfusion model: a systematic review and development of a model to predict in vivo transfer of therapeutic drugs. Clin. Pharmacol. Ther. 90, 67-76 (2011).
- International Organization for Standardization (ISO). Technical Specification (ISO/TS) 27687. Nanotechnologies – Terminology and definitions for nano-objects – Nanoparticles, nanofibre and nanoplate. , (2008).
- Pietroiusti, A. Health implications of engineered nanomaterials. Nanoscale. 4, 1231-1247 (2012).
- Latzin, P., Roosli, M., Huss, A., Kuehni, C. E., Frey, U. Air pollution during pregnancy and lung function in newborns: a birth cohort study. Eur. Respir. J. 33, 594-603 (2009).
- Lacasana, M., Esplugues, A., Ballester, F. Exposure to ambient air pollution and prenatal and early childhood health effects. Eur. J. Epidemiol. 20, 183-199 (2005).
- Menezes, V., Malek, A., Keelan, J. A. Nanoparticulate drug delivery in pregnancy: placental passage and fetal exposure. Curr. Pharm. Biotechnol. 12, 731-742 (2011).
- Muhlemann, K., Menegus, M. A., Miller, R. K. Cytomegalovirus in the perfused human term placenta in vitro. Placenta. 16, 367-373 (1995).
- Wick, P., et al. Barrier capacity of human placenta for nanosized materials. Environ. Health Perspect. 118, 432-436 (2010).
- Dancis, J. Why perfuse the human placenta. Contrib Gynecol. Obstet. 13, 1-4 (1985).
- May, K., et al. Perfusion of human placenta with hemoglobin introduces preeclampsia-like injuries that are prevented by alpha1-microglobulin. Placenta. 32, 323-332 (2011).
- Guller, S., et al. Protein composition of microparticles shed from human placenta during placental perfusion: Potential role in angiogenesis and fibrinolysis in preeclampsia. Placenta. 32, 63-69 (2011).
- Challier, J. C. Criteria for evaluating perfusion experiments and presentation of results. Contrib. Gynecol. Obstet. 13, 32-39 (1985).
- Kraemer, J., Klein, J., Lubetsky, A., Koren, G. Perfusion studies of glyburide transfer across the human placenta: implications for fetal safety. Am. J. Obstet. Gynecol. 195, 270-274 (2006).
- leal, J. K., et al. Modification of fetal plasma amino acid composition by placental amino acid exchangers in vitro. J. Physiol. 582, 871-882 (2007).
- athiesen, L., et al. Quality assessment of a placental perfusion protocol. Reprod. Toxicol. 30, 138-146 (2010).
- Myllynen, P., et al. Preliminary interlaboratory comparison of the ex vivo dual human placental perfusion system. Reprod Toxicol. 30, 94-102 (2010).
- Malek, A., Sager, R., Schneider, H. Maternal-fetal transport of immunoglobulin G and its subclasses during the third trimester of human pregnancy. Am. J. Reprod. Immunol. 32, 8-14 (1994).
- Prouillac, C., Lecoeur, S. The role of the placenta in fetal exposure to xenobiotics: importance of membrane transporters and human models for transfer studies. Drug Metab. Dispos. 38, 1623-1635 (2010).
- Poulsen, M. S., Rytting, E., Mose, T., Knudsen, L. E. Modeling placental transport: correlation of in vitro BeWo cell permeability and ex vivo human placental perfusion. Toxicol. In Vitro. 23, 1380-1386 (2009).
- Mathiesen, L., Rytting, E., Mose, T., Knudsen, L. E. Transport of benzo[alpha]pyrene in the dually perfused human placenta perfusion model: effect of albumin in the perfusion medium. Basic Clin. Pharmacol. Toxicol. 105, 181-187 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon