Method Article
קביעת תעריף הובלת xenobiotics ו ננו מעבר לשליה באמצעות
In This Article
Summary
לשעבר vivo מודל זלוף שליה אנושי הסירקולציה המחודשת כפול יכול לשמש כדי לחקור את העברת xenobiotics ו חלקיקים ברחבי שליית האדם. בפרוטוקול וידאו זה אנו מתארים את הציוד וטכניקות הנדרשות לביצוע מוצלח של זלוף שליה.
Abstract
לפני עשרות שנים שליית האדם נחשב מחסום בלתי חדיר בין האם והעובר. עם זאת, הגילוי של מומים מולדים-Induced תלידומיד ומחקרים רבים מאוחר יותר לאחר מכן הוכיח את ההפך. היום כמה xenobiotics מזיק כמו ניקוטין, הרואין, מתדון או תרופות, כמו גם מזהמים סביבתיים תואר להתגבר על המכשול הזה. עם השימוש הגובר של ננוטכנולוגיה, השלייה עשויה לבוא במגע עם חלקיקי רומן או בטעות או במכוון באמצעות חשיפה במקרה של יישומי nanomedical פוטנציאליים. נתונים מניסויים בבעלי החיים לא ניתן להסיק לבני אדם, כי השליה היא האיבר של היונקים מינים הספציפיים ביותר 1. לכן, vivo לשעבר זלוף שליה אנושי הסירקולציה המחודשת כפול, שפותח על ידי Panigel et al. בשינה 1967 2 ורציפות שונה על ידי שניידר ואח'. בשנת 1972 3, יכול לשמש כמודל לא מצויןo ללמוד את העברת xenobiotics או חלקיקים.
כאן, אנו מתמקדים כפול vivo לשעבר הסירקולציה המחודשת פרוטוקול זלוף שליה אנושי ופיתוח נוסף שלה לרכישת תוצאות לשחזור.
Placentae התקבלו לאחר הסכמה מדעת מהאמהות מהריונות טווח מסובכים שעברו לידה בניתוח קיסרית. כלי העובריים ואימהיים של טבורית השלמה היו cannulated וperfused לפחות במשך חמש שעות. כמודל חלקיקי חלקיקי פוליסטירן שכותרתו fluorescently עם גדלים של 80 ו -500 ננומטר בקוטר נוספו למעגל האימהי. ה -80 ננומטר החלקיקים הצליחו לחצות את מחסום השליה ולספק דוגמה מושלמת לחומר אשר מועבר על פני השליה לעובר ואילו 500 ננומטר החלקיקים נשמרו ברקמת השליה או מעגל אימהי. מודל זלוף השליה לשעבר vivo האנושי הוא אחד מכמה מודלים המספקים מידע אמין עלהתנהגות ההובלה של xenobiotics במחסום רקמה חשוב, אשר מספק נתונים רלוונטיים לניבוי וקליניים.
Introduction
השליה היא איבר מורכב האחראית על חילופי חמצן, פחמן דו חמצני, חומרים מזינים וחומרי פסולת ובו בזמן מסוגל לשמור על שני המעגלים של האם והעובר הגדל מופרד אחד מהשני בדם. בנוסף, הוא מונע דחייה של הילד על ידי מערכת החיסון האימהית ומפריש הורמונים כדי לשמור על הריון. המכשול הסלולרי נוצר על ידי תאי cytotrophoblast שהפתיל וליצור syncytium אמיתי בלי קרום תא לרוחב 4,5. כל השליה מאורגנת בכמה פסיגים, המכילים עץ אחד villous עוברי ומייצגים יחידה תפקודית אחת מהשליה.
המחקר של תפקוד מחסום השליה הוגבר עם הגילוי של מומים המושרה התלידומיד בשנתי ה -1960. מסיבות מובנות לא ניתן לבצע מחקרי טרנסלוקציה עם נשים בהריון. כתוצאה מכך, מודלים חלופיים שונים פותחו 6,7 . המודל הרלוונטי המבטיח ביותר וכנראה הקליני ביותר הוא מודל vivo לשעבר אנושי השליה זלוף שפותח על ידי Panigel ועמיתים לעבודה 2,3.
נשים רבות נחשפות לxenobiotics שונה כגון תרופות או מזהמים סביבתיים במהלך ההריון שלהם 8. לחלק מתרופות שכבר מנוהלות באופן קבוע במהלך הריון, במחקרי vivo יכול להתבצע על ידי השוואה של ריכוז הדם האימהי עם זה בדם של חבל טבור. עם זאת, בדרך כלל יש מידע מוגבל בלבד על הפרמקוקינטיקה ו- דינמיקה בעובר וteratogenicity של חומרים אלה.
לדוגמא אופיאטים כמו הרואין לחצות בקלות את מחסום השליה ויכול להוביל להגבלת צמיחה תוך רחמי, לידה מוקדמת או הפלה ספונטנית 9,10. לכן, במקרה של התנזרות חסרה בזמן הריון טיפול בתחליפי מתדון עם מומלץ. לשעברמודל זלוף שליה אנושי vivo חשף כי העברת מתדון למחזור הדם של העובר היא 11 זניחים, שקושר היטב עם הדם האימהי ליחס מחושב דם טבורי הריכוז לאחר לידת 12.
הננוטכנולוגיה היא תחום צומח ובמיוחד בתחום הרפואה. לכן, באופן טבעי מתחת לקנס (<2.5 מיקרומטר קוטר) וחלקיקי ultrafine (<0.1 מיקרומטר קוטר) בעשן של שריפות יער, התפרצויות הרי געש ואבק במדבר, החשיפה לננו מהונדס (ממד אחד לפחות <0.1 מיקרומטר 13 ) הולך וגדל. זה העלה שאלות לגבי הפוטנציאל של ננו טוקסיקולוגי מהונדס. למרות שאין סכנה לבני אדם ניתן יהיה להוכיח זאת, יש מחקרים ניסיוניים עיקריים מצביעים על כך שחלקיקים מהונדסים יכולים לגרום לתגובות ביולוגיות שליליות מובילות לתוצאות toxicological 14. לאחרונה, חלק מהמחקרים מצביעים על כך שחשיפה טרום לידתי כדיזיהום אוויר קשור לצורך גבוה יותר בדרכי הנשימה ודלקת בדרכי נשימה בתינוקות ובילדים 15,16. בנוסף, חלקיקים קטנים עשויים לשמש כנשאים תרופות לטיפול או לעובר או לאם באופן ספציפי. לכן, הוא הופך להיות ברור כי מחקרים מקיפים של xenobiotics או ננו שונים וביכולתם לחצות את מחסום השליה נדרשים. סקירה בפועל על המחקרים השוטפים על חדירות שליה לננו המהונדסים מסוכמים במנזס et al. 2011 17 וBuerki-Thurnherr et al. 2012 7.
הכפול vivo לשעבר הסירקולציה המחודשת מודל זלוף שליה אנושי מספק מערכת מבוקרת ואמינה לחקר התחבורה השליה של אנדוגני השונים ותרכובות אקסוגניים 3,11,12,18,19 ומגוון רחב של פונקציות אחרות של השליה כמו מנגנונים אחראים ל התפתחות של מצבים פתולוגיים כמו רעלת הריון 20-22. בפרוטוקול זה אנו מתמקדים בעיקר להגדיר, טיפול ושיטה המאפשר מחקר של הצטברות, תופעות ושיעורי טרנסלוקציה של מערך רחב של xenobiotics או חלקיקים.
Protocol
1. הכנת מערכת זלוף
- להגדיר את מערכת זלוף בהיקף של אמבט מים, חדר זלוף, בשתי עמודות עבור חמצון, שתי משאבות peristaltic, שתי מלכודות בועה, שני תנורי זרימה וחיישן לחץ אחד (איור 1). רכיבים אלה להתחבר עם קטעי צינורות מורכבים מחומרי כלוריד סיליקון ופוליוויניל על פי התכנית באיור 2. סוף סוף יש שני מעגלים המייצגים את המעגל העוברי ואימהי, בהתאמה.
- הפעל את האמבטיה במים, זרימה ואת תנורי חימום לתא זלוף. הטמפרטורה צריכה להיות 37 מעלות צלזיוס
- לחמם את מדיום זלוף (NCTC-135 מדיום תרבית רקמת דילול 01:02 עם החיץ של ארל (6.8 גר '/ L נתרן כלורי, אשלגן כלורי 0.4 גר' / ל ', 0.14 גר' / ל 'מונוסודיום פוספט, מגנזיום סולפט 0.2 גר' / ל ', 0.2 גר' / סידן כלוריד L, 2 גרם גלוקוז / L) בתוספת גלוקוז (ז 1 / L), dextran 40 (10 גר '/ ל'), אלבומין בסרום השור (10 גר '/ L), הפרין נתרן (2,500 IU / L), amoxicilline (250 מ"ג / ליטר) וסודיום ביקרבונט (2.2 גר '/ ל'); pH 7.4) באמבט המים.
- רצף לשטוף את מערכות עורקים של המעגל העוברי ואימהי עם מיליליטר מים מזוקקים 200), ב) 50 הידרוקסיד מיליליטר 1% נתרן, ג) 1% חומצה זרחתית ו-D) שוב מים מזוקקים 200 מ"ל (קצב זרימה: 15 - 20 מ"ל / דקה).
- חבר את הצינורית העוברית (O 1.2 מ"מ; מחט קהה צריכה להיות מחובר לסט עירוי מחט מכונף שונה) לצינורות דם העוברי.
- שוטפים את מערכות עורקים של המעגל העוברי ואימהי עם מדיום זלוף עד שכל הצינורות מכילים בינוניים (קצב זרימה: מ"ל / דקה 15-20). במהלך שלב זה למלא את מלכודות הבועה ולהסיר את כל בועות במורד הזרם של המלכודת. אז להפסיק את המשאבות. זה באמת חשוב כי צינורות העורקים מביא תמיד חופשיים של בועות, אחרת אחרי cannulation במיוחד את כלי העובר העדינים יכולים להיקרע.
- הפעל את זרימת הגז. המעגל האימהי הוא מחומץ wi5% דו תחמוצת הפחמן, וה 95% אוויר סינטטי ומעגל העוברי עם 5% פחמן דו חמצני ו 95% חנקן.
- התחל את ההקלטה של חיישן הלחץ.
2. Cannulating השליה
- השג placentae ללא פגע מהריונות מסובכים טווח לאחר ניתוח קיסרי ראשוני. יש הסכמה בכתב שיינתן (הושג במקרה של המחקרים שלנו) על ידי אמהות לפני הלידה ויש המחקר שיאושר על ידי ועדת האתיקה המקומית (שהיה במקרה במחקרים שלנו). שליטה חזותית ראשונה צריך להיעשות על ידי מיילדות כדי להבטיח שליה בריאה ושלמה.
- Cannulation של השליה הוא שלב קריטי! במהלך זלוף כל שיבוש קטן ברקמות יכול להוביל לדליפה בין מחזור הדם האימהי ועוברי. יש לשליה להתקבל תוך 30 דקות לאחר לידה.
- בחר טבורית ללא פגע באזור השולי של השליה ללא הפרעות נראות לעין בצד האימהי. בצלחת כוריוני,לקשור את שני הענפים הקשורים של עורק טבור וריד במעלה הזרם לצד cannulation מאוחר יותר (לכיוון חבל הטבור) על ידי שימוש בחומר תפר כירורגי. הפוך תמיד שני קשרים.
- Cannulate העורק העוברי הראשונה. עורקי השליה העובריים הם תמיד קטנים יותר ודקים יותר מהוורידים.
- הפוך תפר סביב העורק העוברי, אבל לא לקשור אותו באופן מיידי. החזק את הכלי עם מלקחיים, לחתוך את הכלי בזהירות ולשים את הצינורית הקטנה (מ"מ Ø 1.2) בעורק. ואז לקשור את התפר (שני קשרים).
- להמשיך עם הווריד העוברי באותו אופן, אלא להשתמש בצינורית גדולה יותר (O 1.5-1.8 מ"מ; מחט קהה צריכה להיות מחוברת לסט עירוי מחט מכונף שונה).
- הפעל את משאבת העובר (2 מ"ל / דקה). אם אין נזילה נראית לעין ודם נובע מצינורית הווריד העוברית, להגביר את הזרימה באיטיות עד 4 מ"ל / דקה. שימו לב ללחץ בעורק העובר, זה לא יעלה על 70 מ"מ כספית. אם דולף החוצה נוזל בעובר או בת זוגrnal צינורית לתקן אותם עם תפר אחר.
- מניחים את השליה על בעל הרקמה העוברי עם הצד ולמשוך את קרום השליה ורקמות על הקוצים. בסופו של טבורית perfused צריכה להיות באמצע החור בבעל הרקמות.
- לייצב את החלק שבו רק הקרום מחזיק את השליה עם קרום סיליקון (1 מ"מ O) או לחלופין שתי חתיכות parafilm.
- להרכיב את בעל הרקמה השלם, להדק את הברגים ולחתוך את הרקמה העילית. שים לב שהוורידים והעורקים cannulae לא צבטו אלא שכב בתעלות הקטנות של בעל הרקמה.
- סובב את בעל הרקמה הפוך, הכניס אותו לתוך תא זלוף ולהוסיף את הכיסוי. עכשיו, בצד האימהי צריך להיות בחלק העליון. בדקו תמיד אם המעגל העוברי עדיין לא נפגע ובינוני זורם מצינור הווריד העוברי.
- הפעל את המשאבה האימהית (12 מ"ל / דקה). להציג את השלושה הבוטה cannulae (O 0.8 מ"מ) בשעה הסוף הדואר של צינור העורקים האימהי אל תוך חלל intervillous על ידי חדירת צלחת decidual. כדי לחזור perfusate למעגל האימהי לשים צינור ניקוז ורידים כאחד שזה קשור גם עם המשאבה האימהית למיקום הנמוך ביותר בחלקו העליון של תא זלוף.
- חבר את הצינורית לווריד העוברית וריד הצינור העוברי.
3. ביצוע השלב טרום וניסויית של זלוף
- כדי לאפשר לרקמות להתאושש מתקופת איסכמי לאחר לידה וכדי לשטוף את הדם בחלל intervillous, שלב טרום פתיחה של 20 דקות היא הכרחית. זה אומר וריד האימהי ועוברי לא מוביל בחזרה למאגר המכיל עורקים בינוניים זלוף. לאסוף את יצוא הוורידים העוברי ואימהי בבקבוק וזורקים אותו לאחר השלב טרום.
- על מנת להעריך את היושרה של זלוף לבצע עוד לפני שלב של 20 דקות, אבל במעגל סגור. השתמש בשני מאגרים נפרדים עם מדיום זלוףלמעגל העוברי ואימהי ולסגור המעגלים על ידי מוביל יצוא הוורידים העוברי בחזרה במאגר העוברי ויצוא חזרה ורידים האימהי במאגר האימהי.
- לצורך ניסוי זלוף העיקרי להכין שתי צלוחיות עם 120 מ"ל זלוף בינוני (אחד לאחד האימהית והעוברי למאגר). הוסף 14 C-antipyrine radiolabeled (4 NCI / מ"ל; משמש כביקורת חיובית; זהירות: חומר רדיואקטיבי) וxenobiotic או חלקיקים שכותרתו fluorescently שאחד רוצה לנתח למאגר האימהי. מערבבים היטב perfusate האימהי.
- התחל את הניסוי על ידי החלפת מדיום זלוף הטהור עם שתי צלוחיות סיים (מאגרים עובריים ואימהיים). סגור את המעגלים על ידי מוביל יצוא חזרה ורידים העוברי במאגר העוברי ויצוא חזרה ורידים האימהי במאגר האימהי.
- המשך לזלוף 6 שעות ולקחת דגימות באופן קבוע. תמיד resuspend הבינוני בעובר ואימהימאגר לפני הנסיגה.
- לשלוט בלחץ בעורק העובר (לא תעלה על 70 מ"מ כספית), pH בשני המעגלים (צריך להיות בטווח פיסיולוגי 7.2-7.4) והנפח של שני מאגרים (אובדן נפח עוברי לא יעלה על 4 מ"ל / שעה) במהלך זלוף . אם יש צורך להתאים את ערכי ה-pH או באמצעות חומצה הידרוכלורית או נתרן הידרוקסידי.
- אם אובדן הנפח במאגר העובר עולה על 4 מ"ל / שעה יש דליפה ברקמה וצריך לעצור את טפטוף. שיעור ההצלחה של זלוף ל6 שעות ללא דליפה הוא כ 15-20%.
- לעצור את טפטוף לאחר 6 שעות. לכבות את המשאבות, אמבט מים, תנורי חימום זרימה וזרימת גז.
- הסר את השליה מבעל הרקמות, לחתוך טבורית perfused (בהירה יותר מרקמות unperfused) ולשקול אותו.
- לקחת דגימות מunperfused (חלק מהשליה שנחתכה בתחילת; יכול להיות כבר נלקח במהלך השלב טרום) ורקמות perfused (כל גרם על 1) ולאחסן אותם ב -20 מעלות צלזיוסעד הומוגניזציה או בחנקן נוזלי לניתוח מאוחר יותר. תקן את דגימת רקמות אחרת בפורמלין 4% להערכת histopathological. הדגימות צריכה לכלול את כל השכבות של השליה.
- יש לנקות את הצינורות לאחר זלוף על ידי שטיפה ברציפות מערכות העורקים של המעגל העוברי ואימהי עם מיליליטר מים מזוקקים 200), ב) 50 הידרוקסיד מיליליטר 1% נתרן, ג) 1% חומצה זרחתית 50 מ"ל וד) שוב מים מזוקקים 200 מ"ל (זרימה: מ"ל / דקה 15-20).
הליך העבודה השלם של ניסוי זלוף השליה מתואר באיור 3.
4. ניתוח דוגמאות
- צנטריפוגה דגימות perfusate עבור 10 דקות ב 800 XG לפני ניתוח כדי להסיר אריתרוציטים שיורית. קח את supernatant לניתוח נוסף. ניתן להשאיר את דגימות לילה בשעה 4 ° C. לניתוח של ייצור הלפטין וhCG ניתן לאחסן את הדגימות ב -20 ° C.
- כדי להעריך את החדירות שלשליה לנתח C-14 antipyrine ידי נצנץ נוזלי. מערבבים 300 μl של הדגימות עובריות ואימהיות עם קוקטייל 3 מיליליטר נצנץ ומדד במשך 5 דקות בדלפק בטא.
- על מנת להעריך את ההעברה של חלקיקי הניאון או xenobiotic עניין לקרוא את הקרינה בעירור 485 ננומטר ופליטת ננומטר 528 בקורא microplate (אורכי גל שצוין הם לניתוח של התווית הירוקה הצהובה שהיינו לחלקיקים).
- כדי לקבוע את הכדאיות של רקמת השליה במהלך זלוף מדד צריכת גלוקוז וייצור חומצת החלב במעגל העוברי ואימהי עם מערכת גז דם אוטומטית. בנוסף, להעריך את הייצור של ההורמונים האנושי choriongonadotropin השליה (hCG) ולפטין בדגימות הרקמה הומוגני ואת perfusates ידי assay immunosorbent אנזים צמוד (ELISA).
תוצאות
איור 4 א מציג את פרופילי הטפטוף של חלקיקי פוליסטירן קטנים (80 ננומטר) שהובלו על פני השליה בהשוואה לחלקיקי פוליסטירן גדולים יותר (500 ננומטר), אשר לא הועברו לתא העוברי. כל נקודת נתונים מייצגת את ריכוז החלקיקים הממוצע לנקודת הזמן נתון של לפחות 3 ניסויים בלתי תלויים. לחלקיקי פוליסטירן העברת השליה היא 19 גודל תלוי. לאחר 3 שעות של זלוף השליה כבר 20-30% מחלקיקי פוליסטירן 80 ננומטר הוסיפו בתחילה מהאימהי הועברו למעגל העוברי, ואילו 500 החלקיקים פוליסטירן ננומטר לא מופיעים במעגל העוברי גם לאחר 6 שעות של זלוף. עם זאת, הריכוז האימהי של 500 חלקיקי ננומטר הולך ופוחת. תמונות הקרינה על סעיף היסטולוגית של הרקמה אחרי זלוף הראו כי חלקיקים אלה מצטברים בסיסי השלייה של (מידע לא מוצג). איור 4 מציג פרופיל זלוף אופייני ל14 radiolabeled C-antipyrine. Antipyrine כמולקולה קטנה lipophilic מופץ על מחסום השליה באמצעות דיפוזיה פסיבית ומשמש כשלט ליושרה של המעגלים. לאחר 4-6 שעות של זלוף שיווי משקל בין ריכוז antipyrine העוברי ואימהי צריך להיות בנוי 23. כדי להעריך ולהשוות את שיעור ההובלה של השליה xenobiotics ריכוז יחס התרופה עוברית לאימהי (נ / ז) מוצג בדרך כלל (איור 5).
באמצעות הניתוח של הורמון חומצת החלב ושליה (choriongonadotropin ולפטין אנושיים) ייצור, כמו גם צריכת גלוקוז הכדאיות והפונקציונליות של רקמת השליה במהלך זלוף יכולים להיות במעקב (איור 6). את הערכים עבור הזלפות עם xenobiotic תמיד צריכים להיות באותו הטווח כערכים מזלוף השליטה ללא xenobiotic. בנוסף, histop הערכת athological של רקמת השליה perfused יכולה להתבצע. לאחר מכן השוואה עם רקמת שליה שאינה יכולה לחשוף perfused שינויים פתולוגיים בשל זלוף (זיהום חיידקים לדוגמה), ולכן יכולה לשמש כפרמטר בקרת איכות אחרת.
תוצאות נציג נוספות שהושגו עם המודל לשעבר vivo כפול הסירקולציה המחודשת אנושי השליה זלוף פורסמו לאחרונה 11,19.

איור 1. זלוף שליה האנושי Ex vivo ההגדרה. 1) אמבט מים עם מאגרים אימהיים ועובריים, 2) חדר זלוף, 3) מלכודת בועה, 4) עמודות oxygenator, ו5) דוד זרימה.
load/50401/50401fig2.jpg "/>
איור 2. איור סכמטי של מודל זלוף השליה האנושי vivo לשעבר אנגלי: עורק עוברי; FV:. וריד עוברי; תואר שני: עורק אימהי; MV: וריד אימהי; BT: מלכודת בועה; נ.ב.: חיישן לחץ
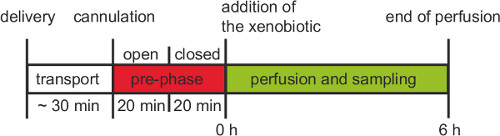
איור 3. עובד הליך של ניסוי זלוף שליה לשעבר vivo אנושי. לאחר לידת השליה צריכה להיות cannulated בתוך 30 דקות. לפני שלב 6 שעות ניסיוני עם סחרור מראש שלב וסגור מראש שלב פתוח יש לבצע לפחות 20 דקות כל אחד.

איור 4. פרופילי טפטוף של חלקיקי פוליסטירן ו -14 </ Sup> C-19 antipyrine. פרופיל הטפטוף של חלקיקי פוליסטירן בגדלים 80 ננומטר (n = 4) ו500 ננומטר (n = 3). בתחילה 25 חלקיקי מיקרוגרם / מ"ל ו 4.2 NCI / 14 מיליליטר C-antipyrine נוספו למעגל האימהי. הסכום של חלקיקים () ו14 C-antipyrine (ב ') נמדדו במעגלים האימהיים (ז, סמלים מוצקים) ועובריים (F, סמלים פתוחים) אחרי הנקודות זמן המצוינות. מוצג הוא הריכוז הממוצע ± SE. לחץ כאן לצפייה בדמות גדולה.
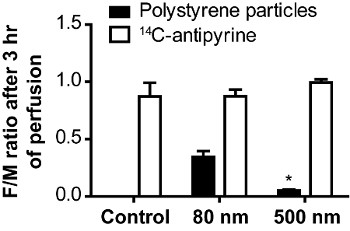
איור 5. גודל תלוי העברה של חלקיקי פוליסטירן ברחבי השליה האנושית 19. היחסים בין ריכוזים עובריים והאימהיים של 14 חלקיקי C-antipyrine וקלקר היו Calculated לאחר 180 דקות של זלוף השליה. הנתונים מייצגים את ממוצע ± SE של לפחות 3 ניסויים בלתי תלויים. עמודת השליטה מתארת הזלפות בלי חלקיקים, אבל עם 14 C-antipyrine. (* P <0.05 בהשוואה ל 80 ערך יחס ננומטר).

איור 6. יכולת קיום של רקמת השליה במהלך זלוף 19. () צריכת גלוקוז וייצור חומצת החלב בשלית perfused. הוצג הוא הסכום של שינויים בתוכן הכולל במעגלים (עוברי ואימהי) לאורך הזמן מחולקים במשקל של טבורית perfused. (ב) הפקת נטו מנורמלת (מחולק לפי תוכן NP רקמה ראשוני T0) של הורמוני השליה choriongonadotropin והאנושי לפטין. הנתונים מייצגים את ממוצע ± SE של בL3 ניסויים עצמאיים ממזרח.
Discussion
מתחת לזלוף הסירקולציה המחודשת הכפול הראה כאן, ישנם מספר תצורות ניסיוניות אחרות אפשריות, תלויות בשאלה אשר צריכה להיות ענה. הזלפות שליה במיוחד פתוחות משמשות בדרך כלל כדי להעריך את אישור התרופה בריכוז המצב יציב 3. זלוף הסירקולציה המחודשת ההגדרה יכול להיות מיושם גם כדי לאשר את ההעברה פעילה של חומרים אנדוגניים או אקסוגני. לגישה זו את אותו הריכוז של xenobiotic יש להוסיף להאם וזרימת הדם העוברית. להניח כי קיימת תחבורה פעילה נגד מפל הריכוזים, הצטברות של חומר בדיקה בכל אחד משני המעגלים אפשר לראות 24. ראוי לציין, התוספת של חומר הבדיקה רק למעגל העוברי היא גם אפשרית ויכולה לחשוף את המנגנון של הובלה על פני מחסום השליה של חומר מסוים זה 25.
הפרוטוקול התפתח במשך טיםדואר ויכול להשתנות בין קבוצות מחקר שונות במיוחד בנוגע לקצב הזרימה, ההרכב של מדיום זלוף, צורה של חמצון וחימום 26,27. במיוחד את קצב הזרימה יכול להשפיע על הזמן שבו מתרחשת העברת transplacental. כדי לשלוט בזה, התוספת של מתחם התייחסות מועבר פסיבי כמו antipyrine היא חשובה. קצב ההעברה של xenobiotic ניתן תמיד בהשוואה לקצב ההעברה של antipyrine (יחס F / M צריך להיות מעל 0.75) 26. מאז העברת antipyrine מוגבלת בעיקר על ידי הזרימה ומשטח חליפין, השוואה זו לוקחת הבדלים בזרימה בגודל של טבורית perfused בחשבון שיכול להשתנות בין הניסויים. בנוסף, FITC-dextran ניתן להוסיף למעגל העוברי לשמש כשליטה על שלמותו של המכשול 26. אובדן נפח עוברי משמש גם כסמן לשלמות המחסום. בדרך כלל ירידה בעובר נוזל עד 4 מ"ל / שעה מותר 28, אבלמחדש אין גבול מקובל.
כמובן, יש כמה חסרונות של שיטת לשעבר vivo אנושי השליה זלוף כמו וריאציות בין פרט ושיעור הצלחה נמוך (15-20%). יתר על כן, תקופת טפטוף של 6 שעות לא יכולה לדמות טיפול תרופתי כרוני, ולכן לא ניתן לשלול את העברת xenobiotic לחלוטין לאחר חשיפה ארוכת טווח. מגבלה נוספת של המודל היא שבעיקר העברת transplacental בטווח מוערכת בעוד שיעור התחבורה בגיל הריון מוקדמים כאשר המכשול הוא עבה יותר נשאר עדיין אינו ידוע. ואכן, טפטוף של placentae השליש הראשון אפשרי אבל הזמינות של placentae אלה היא מוגבל למדי. עם זאת, עד עכשיו שיטת זלוף השליה לשעבר vivo היא המודל היחיד ללימודי התחבורה של xenobiotics השונים או חלקיקים ברקמת שליה אנושית מאורגנת. אמנם ניתן לנתח toxicodynamics במודל זלוף האנושי לשעבר vivo רק בplרקמת acental, ניסויים בבעלי החיים אכן יכולים לספק גם מידע על embryotoxicity. אמנם, בגלל ההבדלים אנטומיים של מחסום השליה בין בני אדם ומכרסמים לא ניתן להסיק את התוצאות הללו לבני אדם 4,5. אפשרות נוספת לחקור העברת transplacental עשויה להיות מודלים תרבית תאים כמו cytotrophoblasts העיקרי, קווים סלולריים choriocarcinoma, שלפוחית קרום פלזמה מבודדת או explants רקמת שליה 29. המודל הנפוץ ביותר הוא הקו הסלולרי BeWo; תאים אלה נגזרים מchoriocarcinoma הריונית ממארת ויכולים להיוצר monolayer ומחוברת בקרום חדיר, ולכן ניתן לבצע מחקרי תחבורה. תוצאות של מחקרי תחבורה באמצעות מודל תא BeWo לתאם גם עם תוצאות שהתקבלו בvivo זלוף השליה האנושי לשעבר 30. עם זאת, כדי ללמוד את הפרטים של תחבורה תרופה (לדוגמא תרומתו של חלבון תחבורה ספציפי) ואת חילוף חומרים, מודל תא BeWo עשוי להיות מ 'עפרות אפשרי בעיקר כי זה קל יותר לטפל ורגיש למניפולציה כמו ביטוי של מובילים או אנזימים שעברו שינוי גנטי, אך לגבי מחקרי העברת סמים כלליים האמינות של הדגם הזה היא מוגבלת. היא חסרה את זרימת דם ויש לו את היושרה של monolayer להיות מוערכת בזהירות שכן הוא תלוי במספר גורמים כמו תנאי תרבית תאים, זריעת צפיפות, משך חשיפה וקרום הוספת 6,29.
xenobiotics שונה וגם חלקיקים נקשרים לחלבוני פלזמה שונים אשר יכול להשפיע באופן משמעותי העברת transplacental 31; שוקל מחייב לחלבוני פלזמה ולכן הוא חשוב. זלוף הבינוני מכיל סרום שור אלבומין, חלבון הפלזמה השכיח ביותר. לאחרונה, מחקר הראה כי יחסי ההעברה של חומרים שונים שהושגו עם מודל זלוף השליה לשעבר vivo האנושי לתאם גם עם בדם טבורי לvivo אימהייחסי ריכוז בדם, כאשר יחסי ההעברה הותאמו על פי היקף 12 מחייבים חלבון פלזמה.
בסך הכל, מודל זלוף השליה לשעבר vivo הוא שיטה תקפה ומהימנה כדי ללמוד את ההובלה על פני השליה האנושית ולחזות במעבר transplacental vivo של xenobiotics חלקיקים.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכת כלכלית על ידי הקרן הלאומית שוויצרי, (תכנית מפד"ל 64, אין להעניק 4064-131,232).
Materials
| Name | Company | Catalog Number | Comments |
| NCTC-135 medium | ICN Biomedicals, Inc. | 10-911-22C | could be replaced by Medium 199 from Sigma (M3769) |
| Sodium chloride (NaCl) | Sigma-Aldrich, Fluka | 71381 | |
| Potassium chloride (KCl) | Hospital pharmacy | also possible: Sigma (P9541) | |
| Monosodium phosphate (NaH2PO4 · H2O) | Merck | 106346 | |
| Magnesium sulfate (MgSO4 · H2O) | Sigma-Aldrich, Fluka | 63139 | |
| Calcium chloride (CaCl, anhydrous) | Merck | 102388 | |
| D(+) Glucose (anhydrous) | Sigma-Aldrich, Fluka | 49138 | |
| Sodium bicarbonate (NaHCO3) | Merck | 106329 | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | 31389 | |
| Bovine serum albumin (BSA) | Applichem | A1391 | |
| Amoxicilline (Clamoxyl) | GlaxoSmithKline AG | 2021101A | |
| Sodium heparin | B. Braun Medical AG | 3511014 | |
| Sodium hydoxide (NaOH) pellets | Merck | 106498 | CAUTION: corrosive |
| Ortho-phosphoric acid 85% (H3PO4) | Merck | 100573 | CAUTION: corrosive |
| Maternal gas mixture: 95% synthetic air, 5% CO2 | PanGas AG | ||
| Fetal gas mixture: 95% N2, 5% CO2 | PanGas AG | ||
| Antipyrine (N-methyl-14C) | American Radiolabeled Chemicals, Inc. | ARC 0108-50 μCi | CAUTION: radioactive material (specific activity: 55mCi/mmol) |
| Scintillation cocktail (IrgaSafe Plus) | Zinsser Analytic GmbH | 1003100 | |
| Polystyrene particles 80 nm | Polyscience, Inc. | 17150 | |
| Polystyrene particles 500 nm | Polyscience, Inc. | 17152 | |
| EQUIPMENT | |||
| Water bath | VWR | 462-7001 | |
| Thermostat | IKA-Werke GmbH Co. KG | 3164000 | |
| Peristaltic pumps | Ismatec | ISM 833 | |
| Bubble traps (glass) | UNI-GLAS Laborbedarf | ||
| Flow heater | UNI-GLAS Laborbedarf | ||
| Pressure sensor + Software for analyses | MSR Electronics GmbH | 145B5 | |
| Notebook | Hewlett Packard | ||
| Miniature gas exchange oxygenator | Living Systems Instrumentation | LSI-OXR | |
| Tygon Tube (ID: 1.6 mm; OD: 4.8 mm) | Ismatec | MF0028 | |
| Tubes for pumps (PharMed BPT; ID: 1.52 mm) | Ismatec | SC0744 | |
| Blunt cannulae ( 0.8 mm) | Polymed Medical Center | 03.592.81 | |
| Blunt cannulae ( 1.2 mm) | Polymed Medical Center | 03.592.90 | |
| Blunt cannulae ( 1.5 mm) | Polymed Medical Center | 03.592.94 | |
| Blunt cannulae ( 1.8 mm) | Polymed Medical Center | 03.952.82 | |
| Parafilm | VWR | 291-1212 | |
| Perfusion chamber with tissue holder (plexiglass) | Internal technical department | Similar equipment is available from Hemotek Limited, UK | |
| Surgical suture material (PremiCron) | B. Braun Medical AG | C0026005 | |
| Winged Needle Infusion Set (21G Butterfly) | Hospira, Inc. | ASN 2102 | |
| Multidirectional stopcock (Discofix C-3) | B. Braun Medical AG | 16494C | |
| Surgical scissors | B. Braun Medical AG | BC304R | |
| Dissecting scissors | B. Braun Medical AG | BC162R | |
| Needle holder | B. Braun Medical AG | BM200R | |
| Dissecting forceps | B. Braun Medical AG | BD215R | |
| Automated blood gas system | Radiometer Medical ApS | ABL800 FLEX | |
| Multi-mode microplate reader | BioTek | Synergy HT | |
| Liquid scintillation analyzer | GMI, Inc. | Packard Tri-Carb 2200 | |
| Scintillation tubes 5.5 ml | Zinsser Analytic GmbH | 3020001 | |
| Tissue Homogenizer | OMNI, Inc. | TH-220 | |
| pH meter + electrode | VWR | 662-2779 | |
References
- Ala-Kokko, T. I., Myllynen, P., Vahakangas, K. Ex vivo perfusion of the human placental cotyledon: implications for anesthetic pharmacology. Int. J. Obstet. Anesth. 9, 26-38 (2000).
- Panigel, M., Pascaud, M., Brun, J. L. Radioangiographic study of circulation in the villi and intervillous space of isolated human placental cotyledon kept viable by perfusion. J. Physiol. (Paris). 59, 277 (1967).
- Schneider, H., Panigel, M., Dancis, J. Transfer across the perfused human placenta of antipyrine, sodium and leucine. Am. J. Obstet. Gynecol. 114, 822-828 (1972).
- Enders, A. C., Blankenship, T. N. Comparative placental structure. Adv. Drug Deliv. Rev. 38, 3-15 (1999).
- Takata, K., Hirano, H. Mechanism of glucose transport across the human and rat placental barrier: a review. Microsc. Res. Tech. 38, 145-152 (1997).
- Saunders, M. Transplacental transport of nanomaterials. Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 1, 671-684 (2009).
- Buerki-Thurnherr, T., von Mandach, U., Wick, P. Knocking at the door of the unborn child: engineered nanoparticles at the human placental barrier. Swiss Med. Wkly. 142, w13559 (2012).
- Gendron, M. P., Martin, B., Oraichi, D., Berard, A. Health care providers' requests to Teratogen Information Services on medication use during pregnancy and lactation. Eur. J. Clin. Pharmacol. 65, 523-531 (2009).
- Burns, L., Mattick, R. P., Lim, K., Wallace, C. Methadone in pregnancy: treatment retention and neonatal outcomes. Addiction. 102, 264-270 (2007).
- von Mandach, U. Drug use in pregnancy. Ther. Umsch. 62, 29-35 (2005).
- Malek, A., Obrist, C., Wenzinger, S., von Mandach, U. The impact of cocaine and heroin on the placental transfer of methadone. Reprod. Biol. Endocrinol. 7, 61 (2009).
- Hutson, J. R., Garcia-Bournissen, F., Davis, A., Koren, G. The human placental perfusion model: a systematic review and development of a model to predict in vivo transfer of therapeutic drugs. Clin. Pharmacol. Ther. 90, 67-76 (2011).
- International Organization for Standardization (ISO). Technical Specification (ISO/TS) 27687. Nanotechnologies – Terminology and definitions for nano-objects – Nanoparticles, nanofibre and nanoplate. , (2008).
- Pietroiusti, A. Health implications of engineered nanomaterials. Nanoscale. 4, 1231-1247 (2012).
- Latzin, P., Roosli, M., Huss, A., Kuehni, C. E., Frey, U. Air pollution during pregnancy and lung function in newborns: a birth cohort study. Eur. Respir. J. 33, 594-603 (2009).
- Lacasana, M., Esplugues, A., Ballester, F. Exposure to ambient air pollution and prenatal and early childhood health effects. Eur. J. Epidemiol. 20, 183-199 (2005).
- Menezes, V., Malek, A., Keelan, J. A. Nanoparticulate drug delivery in pregnancy: placental passage and fetal exposure. Curr. Pharm. Biotechnol. 12, 731-742 (2011).
- Muhlemann, K., Menegus, M. A., Miller, R. K. Cytomegalovirus in the perfused human term placenta in vitro. Placenta. 16, 367-373 (1995).
- Wick, P., et al. Barrier capacity of human placenta for nanosized materials. Environ. Health Perspect. 118, 432-436 (2010).
- Dancis, J. Why perfuse the human placenta. Contrib Gynecol. Obstet. 13, 1-4 (1985).
- May, K., et al. Perfusion of human placenta with hemoglobin introduces preeclampsia-like injuries that are prevented by alpha1-microglobulin. Placenta. 32, 323-332 (2011).
- Guller, S., et al. Protein composition of microparticles shed from human placenta during placental perfusion: Potential role in angiogenesis and fibrinolysis in preeclampsia. Placenta. 32, 63-69 (2011).
- Challier, J. C. Criteria for evaluating perfusion experiments and presentation of results. Contrib. Gynecol. Obstet. 13, 32-39 (1985).
- Kraemer, J., Klein, J., Lubetsky, A., Koren, G. Perfusion studies of glyburide transfer across the human placenta: implications for fetal safety. Am. J. Obstet. Gynecol. 195, 270-274 (2006).
- leal, J. K., et al. Modification of fetal plasma amino acid composition by placental amino acid exchangers in vitro. J. Physiol. 582, 871-882 (2007).
- athiesen, L., et al. Quality assessment of a placental perfusion protocol. Reprod. Toxicol. 30, 138-146 (2010).
- Myllynen, P., et al. Preliminary interlaboratory comparison of the ex vivo dual human placental perfusion system. Reprod Toxicol. 30, 94-102 (2010).
- Malek, A., Sager, R., Schneider, H. Maternal-fetal transport of immunoglobulin G and its subclasses during the third trimester of human pregnancy. Am. J. Reprod. Immunol. 32, 8-14 (1994).
- Prouillac, C., Lecoeur, S. The role of the placenta in fetal exposure to xenobiotics: importance of membrane transporters and human models for transfer studies. Drug Metab. Dispos. 38, 1623-1635 (2010).
- Poulsen, M. S., Rytting, E., Mose, T., Knudsen, L. E. Modeling placental transport: correlation of in vitro BeWo cell permeability and ex vivo human placental perfusion. Toxicol. In Vitro. 23, 1380-1386 (2009).
- Mathiesen, L., Rytting, E., Mose, T., Knudsen, L. E. Transport of benzo[alpha]pyrene in the dually perfused human placenta perfusion model: effect of albumin in the perfusion medium. Basic Clin. Pharmacol. Toxicol. 105, 181-187 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved