Method Article
Rilevazione di segnalazione Effettistica-Complessi valle di BMP4 utilizzo In situ PLA, una legatura di prossimità Assay
In questo articolo
Riepilogo
Qui si mostrano come utilizzare Ligation analisi di prossimità (PLA), con una combinazione di anticorpi per visualizzare proteina morfogenetica dell'osso (BMP) di segnalazione nelle cellule fisso. Questa tecnica ci ha permesso di seguire l'accumulo nucleare di BMP endogene attivate effettore complessi e quantificare i loro livelli nel corso del tempo sotto BMP4 stimolazione.
Abstract
BMP sono responsabili di una vasta gamma di effetti sullo sviluppo e biologici. Attivare i recettori BMP (fosforilare) la Smad1/5/8 effettori, che poi, formano un complesso con Smad4 e traslocare al nucleo dove funzionano come fattori di trascrizione di avviare BMP effetti specifici a valle 1. Tradizionali tecniche di immunofluorescenza con anticorpi anti-fosfo Smad peptidi mostrano bassa sensibilità, elevato background e offrono quantificazione lordo si basano sulla intensità del segnale degli anticorpi in particolare se questa è fotosensibile fluorescenti. Inoltre, fosfo-Smads non possono essere tutti in complesso con Smad4 e impegnati nella trascrizione attivo.
In situ PLA è una tecnologia in grado di rilevare le interazioni proteina con elevata specificità e sensibilità 2-4. Questa nuova tecnologia di riconoscimento coppie di anticorpi con l'amplificazione del DNA surrogato della proteina. Si genera un localizzata, segnale discreto in una forma di macchie rivelare l'esatta posizione dell'evento riconoscimento. Il numero di segnali possono essere contate e confrontate fornendo una misurazione. Abbiamo applicato in situ PLA, utilizzando il kit Duolink, con una combinazione di anticorpi, che consente il rilevamento degli effettori segnalazione BMP phospho-Smad1/5/8 e Smad4 solo quando questi si trovano in prossimità cioè in un complesso, che si verifica solo con segnalazione attivazione. Questo ha permesso per la prima volta, la visualizzazione e la misurazione del endogene BMP segnalazione con alta specificità e sensibilità in un esperimento in corso a tempo stimolazione BMP4.
Protocollo
1. Placcatura di Cellule e trattamento con BMP
- Cellule in coltura Neuro2a GMEM supplementato con 10% FBS, 1x aminoacidi non essenziali (NEAM), 1x piruvato di sodio e 1x L-glutammina. Dividere le celle utilizzando tripsina (0,05%-EDTA) e la piastra 15,000-20,000 cellule per bene in un 16-scivolo e da camera.
Cultura HEK293T o Cos7 cellule in DMEM supplementato con 10% FBS, 1x L-glutamina e 1 penicillina / streptomicina. Sterilizzare diapositive polysine immergendole in etanolo al 70% e l'uso della penna Immedge disegnare 1 cm 2 pozzi. Dividere le celle utilizzando tripsina (0,05%-EDTA) e la piastra 20,000-25,000 cellule per pozzetto in 50 microlitri di media. - Incubare le cellule a 37 ° C in un umidificata, 5% CO 2 incubatore.
- Dopo 24 h sostituire il mezzo con i livelli di free GMEM (integrata con 0,1% di albumina, NEAM 1x, 1x piruvato di sodio e 1x L-glutamina) per Neuro2a o con i livelli di free DMEM (integrato con L-Glutamina e 1 penicillina / streptomicina) per HEK293T / Cos7 e incubare le cellule per 2-3 h. Mantenere tre pozzi con le cellule in condizioni normali di coltura (10% FBS) da utilizzare come controlli.
- Trattare le cellule con dorsomorphin (inibitore del pathway BMP, 2 mM) o BMP4 (25 ng / ml) per il tempo desiderato (ad esempio per 10 min-1 h) 5.
2. Fissazione e permeabilizzazione
- Preparare il fissativo, 4% PFA. Pesare 4 g di PFA per preparare una soluzione al 4% in 100 ml di PBS. Riscaldare la soluzione a 50 ° C fino a quando non è chiara. Filtrare la soluzione attraverso un filtro a 0,22 micron e conservare a 4 ° C fino all'uso. Usa fissativo fresco (non persistono per più di 2 giorni).
- Aspirare il terreno dai pozzetti e lavare con 1xPBS. Non pipettare le soluzioni direttamente sulle cellule in quanto ciò può causare il distacco delle cellule. Prima di passare alla fase successiva, se scivoli da camera vengono utilizzati rimuovere le camere, ma lasciare il silicio attorno ai pozzi.
- Aggiungere 50 microlitri PFA 4% e incubare per 10 minuti, a temperatura ambiente, senza mescolare.
- Lavare le cellule con PBS per 3 x 5 minuti in una vaschetta Coplin con agitazione a temperatura ambiente.
- Trattare le cellule con lo 0,5% Triton X-100 in PBS per 10 minuti senza agitazione a temperatura ambiente.
- Lavare le cellule con il 0,05% di Tween 20 in TBS (TBS-T) per 3 x 5 minuti in una vaschetta Coplin con agitazione a temperatura ambiente.
3. Blocco
- Preleva il TBS-T. Aggiungere una goccia di soluzione Duolink Blocco II (1x) per bene.
- Incubare i vetrini in un pre-riscaldato camera umida per 1 ora a 37 ° C.
4. Anticorpi primari
- Mescolare e diluire aP-Smad1/5/8 (policlonale di coniglio) a 1:100 e a-Smad4 (monoclonale di topo) a 1:100 nel diluente anticorpale II Duolink (1x). Preparare anche aP-Smad1/5/8 e a-Smad4 solo alle stesse concentrazioni da utilizzare per i controlli.
- Rubinetto la soluzione di saturazione da diapositive. Rimuovere il blocco soluzione molto possibile, ma fare molta attenzione a non lasciare le pile a secco prima di aggiungere l'anticorpo. Aggiungere 40 ml di soluzioni di anticorpi nei pozzetti. In un solo bene aggiungere diluente anticorpale come un ulteriore controllo negativo.
5. PLA sonde
- Diluire le due sonde PLA (Duolink II anti-mouse MINUS e Duolink II anti-coniglio PLUS) 1:5 con il diluente anticorpale.
- Rubinetto la soluzione primaria di anticorpi da diapositive. Lavare le diapositive 2 volte 5 minuti ciascuno con tampone 1x Duolink II lavaggio A in una vaschetta Coplin con agitazione a temperatura ambiente.
- Preleva il tampone di lavaggio A da diapositive e aggiungere la soluzione PLA sonda (40 microlitri / pozzetto).
Incubare i vetrini in un pre-riscaldato camera umida per 1 ora a 37 ° C.
6. Legatura
- Il vortice Duolink II magazzino Legatura (5x) e diluire 1:5 in acqua ad elevata purezza e mescolare. Quando si calcola il volume di acqua, tener conto del volume della ligasi che verrà aggiunto ad una diluizione finale di 1:40 poco prima l'aggiunta della miscela nei pozzetti.
- Rubinetto la soluzione della sonda PLA da diapositive. Lavare i vetrini nella soluzione di lavaggio 1x A per 2 volte ogni 5 minuti in una vaschetta Coplin con agitazione a temperatura ambiente.
- Estrarre la ligasi dal freezer utilizzando un blocco di congelamento (-20 ° C). Aggiungere la ligasi alla soluzione Ligation (preparata in 6.1) ad una diluizione 1:40 e vortice.
- Preleva il tampone di lavaggio A da diapositive e aggiungere la legatura-ligasi soluzione ad ogni pozzetto (40 microlitri / pozzetto). Incubare i vetrini in un pre-riscaldato camera umida per 30 minuti a 37 ° C.
7. Amplificazione
Nota: reagenti sensibili alla luce. Tenere le diapositive al riparo dalla luce.
- Diluire il Amplificazione Duolink II stock (5x) 1:5 in acqua ad elevata purezza e mescolare. Quando si calcola il volume di acqua tener conto del volume della polimerasi, che verrà aggiunto ad una diluizione finale di 1:80 poco prima che l'aggiunta del mix di secoloe pozzi.
- Tocca al largo della legatura-ligasi soluzione da diapositive. Lavare i vetrini in tampone di lavaggio 1x A con per 2 volte 2 minuti ciascuna in una vaschetta Coplin con agitazione a temperatura ambiente.
- Estrarre la polimerasi dal congelatore utilizzando un blocco di congelamento (-20 ° C). Aggiungere la polimerasi alla soluzione di amplificazione (preparata in 7.1) ad una diluizione 1:80 e vortice.
- Preleva il tampone di lavaggio A da diapositive e aggiungere il Amplificazione-Polymerase soluzione ad ogni pozzetto (40 microlitri / pozzetto). Incubare i vetrini in un pre-riscaldato camera umida per 100 minuti a 37 ° C.
8. Preparazione per l'imaging
Nota: reagenti sensibili alla luce. Tenere le diapositive al riparo dalla luce.
- Preleva il Amplificazione-polimerasi soluzione da diapositive e lavarsi per 2 volte ogni 10 minuti in 1x Duolink II tampone di lavaggio B in una vaschetta Coplin con agitazione a temperatura ambiente.
- Immergere i vetrini nel tampone di lavaggio 0,1 x B.
- Togliere il silicone dal 16-scivolo completamente bene. Aggiungi ~ 40μl del II Duolink Mezzo di montaggio con DAPI sul coprioggetto e appoggiarlo sopra i campioni premendolo leggermente in modo che non ci siano bolle d'aria sotto il vetrino. Fissare e sigillare il coprioggetto sul vetrino con smalto. Attendere almeno 15 minuti prima di procedere alla imaging.
- Analizzare i campioni con un microscopio confocale o fluorescenza. Ottenere immagini digitali.
9. Quantificazione
Nota: reagenti sensibili alla luce. Tenere le diapositive al riparo dalla luce.
- Usa Duolink ImageTool a contare i segnali sulle immagini per ottenere una misurazione del livello di segnalazione.
- Confrontare le misure e fare un grafico.
10. Rappresentante Risultati
Il risultato di un esperimento in situ PLA presenta macchie fluorescenti discreti. La posizione del segnale dipende dalle specifiche proteine studiate.
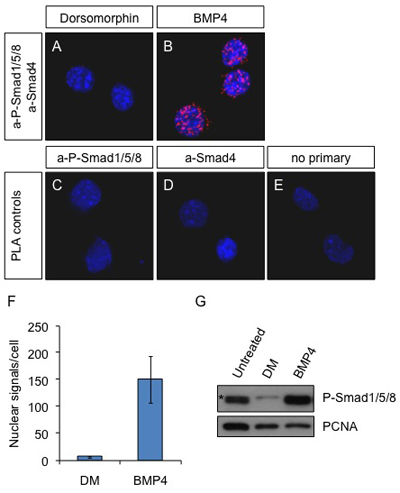
Figura 1. PLA in situ sulle cellule Neuro2a dopo la stimolazione BMP4. Le cellule sono state trattate con mM dorsomorphin 2 (inibitore della via BMP) (A) o 25 ng / ml BMP4 (B) per 60 minuti o non trattata (CE). Anticorpi contro P-Smad1/5/8 e Smad4 sono stati utilizzati per rilevare i complessi attivi in A e B. Gli anticorpi primari aP-Smad1/5/8 solo (C) e una-Smad4 solo (D) o omissione del primario anticorpi (E) sono stati utilizzati come controlli. Blu: DAPI; Rosso: segnale di PLA. Immagini sono state ottenute con un microscopio confocale Leica SP5.
(F) I segnali di PLA sono stati contati con il software Duolink ImageTool e il numero medio di macchie nel nucleo per cella è presentato nel grafico. (G), le cellule Neuro2a sono stati lasciati non trattati o trattati con Dorsomorphin (2 mM) o BMP4 (25 ng / ml) per 60 min. Le cellule sono state lisate e le proteine sono stati sottoposti a SDS-PAGE ed analizzati mediante immunoblotting con aP-Smad1/5/8 e a-PCNA il caricamento di controllo. (*) Non specifica banda. Si noti che il aP-Smad1/5/8 anticorpi non può distinguere tra i 3 differenti proteine presenti nei complessi con Smad4.
Discussione
La visualizzazione di complessi proteici in situ è molto richiesto, in particolare per gli studi di segnalazione in cui l'interazione delle proteine e modificazione delle proteine sono i mezzi che le cellule utilizzano per l'invio di un segnale da loro superficie al nucleo. Non è stato possibile visualizzare e quantificare i complessi tra due proteine endogene in situ con immunofluorescenza prima. Co-localizzazione di anticorpi mostre bassa risoluzione e non può essere utilizzato per visualizzare l'interazione vera. PLA è una nuova tecnica che i ricercatori hanno iniziato a utilizzare in sistemi diversi con grande successo, 6, 7. Qui, ci dimostrano come utilizzare PLA non solo di visualizzare, ma anche di quantificare i complessi endogena tra effettori Smad attivato a valle della stimolazione BMP nel tempo. Abbiamo utilizzato cellule di coltura di tessuto differenti tra cui Neuro2a e invocato anticorpi commerciali cresciuto a specie diverse (mouse a-Smad4 e coniglio aP-Smad1/5/8) per raggiungere questo obiettivo (fig. 1). Questo metodo ci ha permesso, per la prima volta, per vedere l'attivazione di BMP effettrici complessi nel tempo e non solo la presenza del fosforilata Smad1/5/8, che non possono essere tutti impegnati in complessi attivi con Smad4. Abbiamo contato i segnali (Fig. 1F) e rispetto la misura con la quantificazione ottenute da immunoblot delle stesse cellule 8 (figura 1G). Siamo giunti alla conclusione che il numero delle macchie di fornire una misurazione accurata comparativa dei livelli di segnale nel tempo. La tecnica è stata applicata anche su altre linee cellulari (HEK293T e Cos7) con risultati simili (dati non riportati).
Il principio della tecnologia si basa su due sonde uniche fornite con il kit Duolink. Ogni sonda PLA è costituito da un anticorpo secondario collegato a un oligonucleotide sintetico unico, che agisce come reporter. La vicinanza delle sonde permette di legatura del DNA nel punto esatto in cui sono attaccati a queste sonde di prossimità. La distanza del oligonucleotidi, che permette l'ibridazione del DNA e la legatura è piccolo (40 nm <) e quindi, solo le proteine che interagiscono può permettere la legatura. Il DNA legatura possono poi essere amplificate e analizzate con ibridazione di oligonucleotidi etichetta della sequenza amplificata. L'amplificazione è specifica in quanto dipende da DNA-DNA principi di ibridazione e fornisce anche ad alta sensibilità, come il DNA è amplificato legatura diverse volte con conseguente valorizzazione della manifestazione legatura iniziale. Il DNA amplificato viene rilevato tramite l'ibridazione con oligonucleotidi etichettati e produce un luogo visibile e piuttosto grande. Come gli spot possono essere contati, il segnale di PLA fornisce non solo le informazioni esatte spaziale (la posizione degli eventi interazione), ma anche un modo obiettivo di quantificare questi eventi 2-4.
Altre tecniche che vengono impiegate per la rilevazione delle interazioni proteiche sono co-immunoprecipitazione, immunofluorescenza e fluorescente Resonance Energy Transfer (FRET). Co-immunoprecipitazione test sono ampiamente utilizzati consente l'isolamento di complessi proteici. Il metodo è accompagnato da immunoblotting che significa che le proteine deve essere espressa a livelli relativamente elevati per poter essere rilevato. I problemi di fondo alto o legame non specifico di alcune proteine ai talloni sono a volte difficili da superare in co-immunoprecipitazione. Inoltre, la co-immunoprecipitazione test permettono la rilevazione di proteine che possono essere parte di un complesso di proteine, ma non riescono a distinguere quelli che sono nelle immediate vicinanze interagire fisicamente con l'altro. Inoltre, il co-immunoprecipitazione non può fornire la quantificazione nella risoluzione singola cella o le informazioni sulla localizzazione dei complessi proteina nella cellula. Rilevazione di co-esistenza di complessi proteici in una cella o un vano cella immunofluorescenza si basa sulla sovrapposizione di segnali diffusi e, quindi, ha una bassa risoluzione spaziale e non può fornire informazioni accurate sulle interazioni delle proteine. Quantificazione del segnale di immunofluorescenza può essere fatto da stima visiva solo se la differenza è diverse volte, e non possono essere accurate o misurabili, come le macchie PLA. FRET permette la visualizzazione di complessi proteici in cellule vive e supera la necessità di anticorpi e l'esposizione della epitopo. Tuttavia, FRET di solito dipende la sovraespressione di proteine artificiali fusa, che potrebbero non riflettere l'complessi proteici endogeni come nel PLA.
Condizioni di blocco del protocollo di PLA sono critici come aggregazione degli anticorpi si possono verificare ed aumentare lo sfondo. Alternative condizioni di blocco possono essere trovati nelle schede del prodotto anticorpi. Controlli appropriati con omissione anticorpo primario e secondario di fornire informazioni su cosa possa essere andato male e hanno bisogno di essere sempre inclusi. E 'importante schermo anticorpi diversi che darà il minimo background quando vengono utilizzati da soli e il miglior segnale quando sono insieme. Fissazione di cells è critica come oltre la fissazione può causare complessi proteici a snaturare e degradare completamente, mentre la fissazione insufficiente può portare alla perdita di complessi proteici durante le fasi della procedura. Questo può essere controllato abbassando la concentrazione del fissativo al 3% o limitando il tempo di fissazione. Tuttavia, la fissazione dipende anche dal fatto che gli anticorpi primari riconoscono proteine denaturate o meno. Come la tecnica PLA è molto sensibile, particolare attenzione è necessaria per mantenere i tempi di incubazione e le condizioni micro uguali tra diversi campioni.
I campioni non deve essere lasciato ad asciugare in ogni caso prima che il passo finale. L'essiccazione dei campioni può portare a un aumento di fondo. La rimozione completa della soluzione di bloccaggio è anche fondamentale per evitare di fondo. I tamponi di lavaggio deve sempre essere portato a temperatura ambiente prima dell'uso, la temperatura bassa rallenta le reazioni enzimatiche. Per la risoluzione dei problemi consultare il manuale del kit.
E 'utile utilizzare le macchie di accertare la localizzazione sub-cellulare del segnale di PLA (per esempio DAPI, actina ecc). Qui abbiamo usato DAPI (nel mezzo di montaggio) per colorare i nuclei. PLA è compatibile con l'uso di immunofluorescenza con anticorpi per determinare il tipo cellulare o un compartimento cellulare (non mostrati qui). Quantificazione precisa può essere fatta contando i segnali e l'uso di software specifici (Image Tool Duolink, Olink Biosience).
In conclusione abbiamo dimostrato come utilizzare in situ PLA, utilizzando il kit per rilevare Duolink BMP segnalazione nelle cellule fisse e ha presentato i suoi vantaggi: facile da usare, molto sensibile, senza sfondo, e una capacità unica di quantificare attivo BMP segnalazione in situ.
La limitazione di applicare questa tecnica per studiare le interazioni delle proteine differenti dipende dalla disponibilità e qualità degli anticorpi primari che riconoscono le proteine sotto inchiesta.
Divulgazioni
Riconoscimenti
Questa ricerca è finanziata dalla MRC e le sovvenzioni BBSRC. Ringraziamo Agata Zieba e Katerina Pardalis nel laboratorio di Ulf Landegren, Università di Uppsala per aiutare con la creazione di la tecnica e utili consigli. Biosience Olink per assistenza tecnica e la presentazione.
Materiali
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| GMEM | Invitrogen | 21710025 | ||
| DMEM | Invitrogen | 21063029 | ||
| FBS | AutogenBioclear | 7.01 | ||
| Non-essential Amino Acids | Invitrogen | 11149068 | ||
| Sodium Pyruvate | Invitrogen | 11360070 | ||
| Penicillin / Streptomycin | Invitrogen | 15140122 | ||
| L-glutamine | Invitrogen | 25030-054 | ||
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300-054 | ||
| 16-well chamber slides | Lab-Tek | 178599 | ||
| Polysine | VWR | 631-0107 | ||
| Cover glass | VWR | 631-0138 | ||
| a-pSmad1/5/8 | Cell Signaling | 9511 | ||
| a-Smad4 (B8) | Santa Cruz Biotechnology | sc-7966 | ||
| Dorsomorphin | Merck | 171260-10MG | ||
| Recombinant Mouse BMP-4 | R&D | 5020-BP-010 | ||
| PFA | Sigma-Aldrich | P6148 | ||
| Triton-X 100 | Sigma-Aldrich | T8787 | ||
| Tween-20 | Promega | H5151 | ||
| Duolink II Detection Reagents (Orange) | OLINK | 92007-0100 | ||
| Duolink II PLA probe anti-Mouse MINUS | Olink Bioscience | 92004-0100 | ||
| Duolink II PLA probe anti-Rabbit PLUS | Olink Bioscience | 92002-0100 | ||
| Duolink II Mounting Medium with DAPI | Olink Bioscience | 82040-0005 | ||
| Duolink II Wash Buffers Fluorescence | Olink Bioscience | 82049 |
Riferimenti
- Miyazono, K., Kamiya, Y., Morikawa, M. B. o. n. e. morphogenetic protein receptors and signal transduction. J Biochem. 147, 35-51 (2010).
- Gustafsdottir, S. M. Proximity ligation assays for sensitive and specific protein analyses. Anal Biochem. 345, 2-9 (2005).
- Soderberg, O. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3, 995-1000 (2006).
- Soderberg, O. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Yu, P. B. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4, 33-41 (2008).
- Baan, B. In situ proximity ligation detection of c-Jun/AP-1 dimers reveals increased levels of c-Jun/Fra1 complexes in aggressive breast cancer cell lines in vitro and in vivo. Mol Cell Proteomics. 9, 1982-1990 .
- Massinen, S. Functional interaction of DYX1C1 with estrogen receptors suggests involvement of hormonal pathways in dyslexia. Hum Mol Genet. 18, 2802-2812 (2009).
- Thymiakou, E., Zannis, V. I., Kardassis, D. Physical and functional interactions between liver X receptor/retinoid X receptor and Sp1 modulate the transcriptional induction of the human ATP binding cassette transporter A1 gene by oxysterols and retinoids. Biochemistry. 46, 11473-11483 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon