Method Article
איתור של מפעיל איתות, מתחמי Downstream של BMP4 שימוש באתרו PLA, Assay קשירת הסמיכות
In This Article
Summary
כאן אנו מראים כיצד להשתמש קשירת הסמיכות Assay (PLA), עם שילוב של נוגדנים לדמיין המוךפו"גנטי שהולך עצם חלבון (BMP) איתות תאים קבוע. טכניקה זו אפשרה לנו לעקוב אחר הצטברות הגרעין של BMP אנדוגני מופעל מפעיל, מתחמי ולכמת רמות שלהם לאורך זמן תחת גירוי BMP4.
Abstract
BMPs אחראים מגוון רחב של השפעות ביולוגיות התפתחותיים. קולטנים BMP להפעיל (phosphorylate) Smad1/5/8 effectors, אשר לאחר מכן, בצורה מורכבת עם Smad4 ו translocate לגרעין שם הם מתפקדים גורמי תעתוק ליזום השפעות BMP במורד ספציפי 1. מסורתית חיסונית הקרינה טכניקות עם נוגדנים נגד phospho-Smad פפטידים התערוכה רגישות נמוכה, רקע גבוה להציע כימות ברוטו כפי שהם מסתמכים על עוצמת האות נוגדן במיוחד אם זה רגיש לאור ניאון. בנוסף, phospho-Smads לא יכול כל להיות מורכב עם Smad4 ועסק שעתוק פעיל.
באתרו PLA היא טכנולוגיה מסוגל לאתר אינטראקציות חלבון עם סגוליות גבוהה ורגישות 2-4. זו טכנולוגיה חדשה לזוגות נוגדן הכרה עם הגברה של פונדקאית DNA של החלבון. זה יוצר אות מקומי, דיסקרטי בצורה של כתמים לחשוף את המיקום המדויק של האירוע הכרה. מספר אותות ניתן לספור והשוו מתן המדידה. אנו ליישם PLA באתרו, באמצעות ערכת Duolink, עם שילוב של נוגדנים המאפשר זיהוי של effectors איתות BMP ו phospho-Smad1/5/8 Smad4 רק כאשר אלה נמצאים בסמיכות כלומר במתחם, אשר מתרחשת רק עם איתות ההפעלה. זו אפשרה, לראשונה, את להדמיה ומדידה של BMP אנדוגני איתות עם ייחוד רגישות גבוהה בניסוי הזמן כמובן תחת גירוי BMP4.
Protocol
1. ציפוי של תאים וטיפול עם BMP
- התרבות תאים Neuro2a ב GMEM בתוספת 10% FBS, 1x שאינם חיוניים חומצות אמינו (NEAM), 1x pyruvate נתרן 1x-L-גלוטמין. פצל את התאים באמצעות טריפסין (0.05%, EDTA) ו 15.000-20.000 צלחת התאים היטב לכל שקופית 16-באר קאמרית.
תרבות HEK293T או Cos7 תאים DMEM בתוספת 10% FBS, 1x-L-גלוטמין ו 1x פניצילין / סטרפטומיצין. לעקר שקופיות polysine ידי שיקוע שלהם אתנול 70% באמצעות עט Immedge לשאוב מבארות 1 2 ס"מ. פצל את התאים באמצעות טריפסין (0.05%, EDTA) ו 20.000-25.000 צלחת התאים לכל טוב בינוני 50 μl. - דגירה התאים ב 37 מעלות צלזיוס humidified, 5% CO 2 באינקובטור.
- אחרי 24 שעות להחליף את מדיום עם סרום חינם GMEM (בתוספת 0.1% אלבומין, NEAM 1x, 1x pyruvate נתרן 1x-L-גלוטמין) עבור Neuro2a או עם סרום חינם DMEM (בתוספת L-גלוטמין ו 1x פניצילין / סטרפטומיצין) עבור HEK293T / Cos7 ו דגירה התאים עבור 2-3 ח שמור שלוש בארות עם תאים בתנאים culturing נורמלי (כלומר 10% FBS) כדי להשתמש בהם שולטת.
- פנקו את התאים dorsomorphin (מעכב של מסלול BMP, 2 מיקרומטר) או BMP4 (25 ng / ml) בפעם הרצוי (למשל עבור h 10 min-1) 5.
2. קיבוע ו Permeabilization
- הכן את מקבע, PFA 4%. לשקול 4 גרם של PFA להכין פתרון 4% 100 מ"ל PBS. חם הפתרון על 50 מעלות צלזיוס עד ברור. סנן את הפתרון דרך פילטר 0.22 מיקרומטר ולאחסן ב 4 ° C עד השימוש. השתמש מקבע טרי (לא מאוחסן במשך יותר מ 2 ימים).
- לשאוב את המדיום מבארות ולשטוף עם 1xPBS. אל פיפטה פתרונות ישירות על התאים כמו זה עלול לגרום ניתוק של התאים. לפני שנמשיך לשלב הבא, אם שקופיות קאמרית משמשים להסרת תאים, אך להשאיר את סיליקון סביב הבארות.
- הוסף 50 μl PFA 4% ו דגירה עבור 10min, ב RT, ללא תסיסה.
- לשטוף את התאים עם PBS דקות 3 5 x בצנצנת Coplin בהתרגשות על RT.
- פנקו את התאים עם 0.5% Triton X-100 ב PBS במשך 10 דקות ללא תסיסה ב RT.
- לשטוף את התאים Tween 0,05 20% TBS (TBS-T) עבור 3 דקות 5 x בצנצנת Coplin בהתרגשות ב RT.
3. חסימת
- הקש את TBS-T. הוסף טיפה אחת של פתרון Duolink חסימת II (1x) לכל טוב.
- דגירה השקופיות בחדר מחומם מראש לחות עבור h 1 ב 37 ° C.
4. ראשי נוגדנים
- מערבבים לדלל aP-Smad1/5/8 (ארנב polyclonal) בשעה 1:100 ו-Smad4 (עכבר חד שבטיים) בשעה 1:100 ב II Duolink נוגדן diluent (1x). הכן גם aP-Smad1/5/8 ו-Smad4 לבד הריכוזים אותו לשמש שולטת.
- הקש את פתרון חסימת מן השקופיות. הסר כפתרון חסימת רב ככל האפשר, אבל לטפל נוספת לא לתת התאים היבשים לפני הוספת נוגדנים. הוסף 40 μl של פתרונות נוגדנים הבארות. באחד גם להוסיף diluent נוגדן רק כפקד שליליות נוספות.
5. PLA בדיקות
- לדלל את שתי חלליות PLA (Duolink II אנטי עכבר מינוס Duolink השנייה נגד ארנב PLUS) 01:05 ב diluent נוגדן.
- הקש את הפתרון הנוגדן העיקרי מן השקופיות. שטפו את השקופיות 2 פעמים 5 דקות כל אחד עם הצפת 1x Duolink לשטוף II בצנצנת Coplin בהתרגשות ב RT.
- הקש את הצפת לשטוף משקופיות ומוסיפים את הפתרון בדיקה PLA (40 μl / טוב).
דגירה השקופיות בחדר מחומם מראש לחות עבור h 1 ב 37 ° C.
6. קשירת
- המערבולת השנייה Duolink מניות קשירת (5x) ו 01:05 לדלל במים טוהר לערבב גבוהה. בעת חישוב נפח המים, לקחת בחשבון את נפח האנזים אשר יתווספו בדילול סופי של 1:40 בדיוק לפני תוספת של לערבב את הבארות.
- הקש את הפתרון בדיקה PLA מן השקופיות. שטפו את השקופיות הצפת לשטוף 1x עבור 2 פעמים 5 דקות כל אחד בצנצנת Coplin בהתרגשות ב RT.
- קח את האנזים מהמקפיא באמצעות לחסום הקפאה (-20 ° C). מוסיפים את האנזים לפתרון קשירת (שהוכנו 6.1) בשעה 1:40 דילול מערבולת ו.
- הקש את הצפת לשטוף משקופיות ומוסיפים את הפתרון קשירת האנזים, זה טוב (40 μl / טוב). דגירה השקופיות בחדר מחומם מראש לחות למשך 30 דקות ב 37 ° C.
7. הגברה
הערה: חומרים כימיים רגישים לאור. שמור את השקופיות מוגן מפני אור.
- לדלל את המניות השנייה Duolink הגברה (5x) 01:05 במים טוהר לערבב גבוהה. בעת חישוב נפח המים לקחת בחשבון את עוצמת הקול של פולימראז כי יתווספו בדילול סופי של 1:80 בדיוק לפני תוספת של לערבב כדי הדואר בארות.
- הקש את הפתרון, קשירת האנזים מן השקופיות. שטפו את השקופיות הצפת לשטוף 1x עם עבור 2 פעמים 2 דקות כל אחד בצנצנת Coplin בהתרגשות ב RT.
- קח את פולימראז מהמקפיא באמצעות לחסום הקפאה (-20 ° C). מוסיפים את פולימראז לפתרון הגברה (שהוכנו 7.1) בשעה 1:80 דילול מערבולת ו.
- הקש את הצפת לשטוף משקופיות ומוסיפים את פתרון הגברה-פולימראז זה טוב (40 μl / טוב). דגירה השקופיות בחדר מחומם מראש לחות עבור 100 דקות ב 37 ° C.
8. הכנה הדמיה
הערה: חומרים כימיים רגישים לאור. שמור את השקופיות מוגן מפני אור.
- הקש את פתרון הגברה-פולימראז משקופיות ולשטוף עבור 2 פעמים 10min כל 1x Duolink II לשטוף הצפת B בצנצנת Coplin בהתרגשות ב RT.
- טובלים את השקופיות 0.1 x לשטוף הצפת B.
- הסר את סיליקון משקופית 16-הבאר לחלוטין. הוסף את ~ 40μl של השנייה Duolink הרכבה בינונית עם DAPI על coverslip ומניחים בעדינות על זה את דגימות לחיצה אותו מעט, כך אין בועות אוויר תחת להחליק את המכסה. תיקון ו לאטום את coverslip בשקופית באמצעות לק. חכו לפחות 15 דקות לפני שתמשיך הדמיה.
- ניתוח דגימות במיקרוסקופ confocal או פלואורסצנטי. השג תמונות דיגיטליות.
9. קביעת כמות
הערה: חומרים כימיים רגישים לאור. שמור את השקופיות מוגן מפני אור.
- השתמש Duolink ImageTool לספור את האותות על התמונות כדי לקבל מדידה של רמת איתות.
- השווה את המדידות ולעשות גרף.
10. נציג תוצאות
התוצאה של הניסוי PLA באתרו מראה כתמים ניאון כמו בדידים. מיקומה של האות תלוי חלבונים ספציפיים למד.
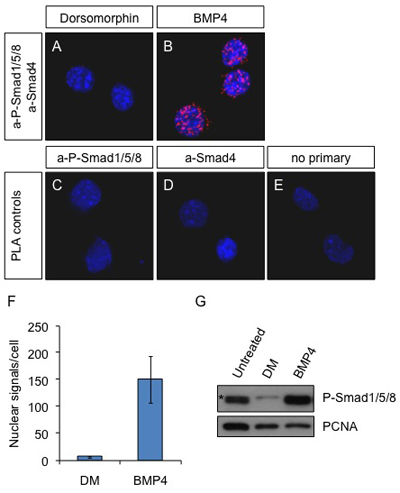
איור 1. PLA באתרו על תאים Neuro2a לאחר גירוי BMP4. תאים שטופלו 2 מיקרומטר dorsomorphin (מעכב של מסלול BMP) (א) או 25 ng / ml BMP4 (ב) במשך 60 דקות או מטופל (CE). נוגדנים נגד P-Smad1/5/8 ו Smad4 שימשו כדי לאתר את מתחמי פעיל A ו-B נוגדנים העיקרי aP-Smad1/5/8 לבד (C) ו-Smad4 לבד (ד) או מחדל של הראשוני נוגדנים (E) שימשו שולטת. כחול: DAPI: אדום: אותות PLA. התמונות התקבלו עם מיקרוסקופ SP5 confocal לייקה.
(F) האותות PLA נמנו עם התוכנה Duolink ImageTool ואת המספר הממוצע של כתמי בגרעין לכל תא מוצגת על הגרף. (ז) בתאים Neuro2a היו מטפלים או מטופלים עם Dorsomorphin (2 מיקרומטר) או BMP4 (25 ng / ml) עבור 60 דקות. התאים היו lysed ואת החלבונים היו נתונים SDS-PAGE ונותחו על ידי immunoblotting עם aP-Smad1/5/8 ו-PCNA כמו טעינה מלאה. (*) הלא ספציפית הלהקה. שים לב נוגדן aP-Smad1/5/8 לא ניתן להבחין בין 3 חלבונים שונים נוכח מורכבות עם Smad4.
Discussion
ויזואליזציה של קומפלקסים חלבונים באתרו הוא ביקוש רב, במיוחד ללימודי איתות שבו אינטראקציה חלבון חלבון שינוי הם האמצעים כי התאים לשימוש שולח איתות מפני השטח שלהם לגרעין. זה לא היה ניתן לחזות ולכמת קומפלקסים בין שני חלבונים אנדוגניים באתרו עם immunofluorescence לפני. Co-לוקליזציה של נוגדנים מוצגים ברזולוציה נמוכה ולא ניתן להשתמש בהם כדי לחזות אינטראקציה אמיתית. PLA היא טכניקה חדשה כי החוקרים התחילו להשתמש במערכות שונות בהצלחה רבה 6, 7. כאן, אנו מדגימים כיצד להשתמש PLA לא רק לדמיין אלא גם לכמת מתחמי אנדוגני בין effectors Smad מופעל הזרם לאורך זמן של גירוי BMP. השתמשנו שונים כולל תאים בתרבית רקמה Neuro2a ו הסתמכה על נוגדנים מסחרי וגדל מינים שונים (עכבר ו-Smad4 ארנב aP-Smad1/5/8) כדי להשיג את זה (איור 1). שיטה זו אפשרה לנו, בפעם הראשונה, כדי לראות את ההפעלה של BMP-מתחמי מפעיל לאורך זמן ולא רק את נוכחותם של Smad1/5/8 פוספורילציה, אשר לא יכול להיות כל העוסקים מתחמי פעיל עם Smad4. ספרנו את האותות (תאנה 1F) והשווה את המדידה עם כימות המתקבל immunoblot של תאים באותו 8 (דמות 1G). הגענו למסקנה כי מספר המקומות מספקים מדידה השוואתית מדויקת של איתות רמות לאורך זמן. השיטה יושמה גם על שורות תאים אחרים (HEK293T ו Cos7) עם תוצאות דומות (מידע לא מוצג).
העיקרון של הטכנולוגיה מבוססת על שתי בדיקות ייחודי המסופק עם ערכת Duolink. כל בדיקה PLA מכיל נוגדנים משני המחובר oligonucleotide סינתטי ייחודי, אשר משמש ככתב. קרבתו של בדיקות ה-DNA מאפשר קשירת על המיקום המדויק שבו אלו בדיקות מחוברים בסמיכות. המרחק של oligonucleotides, המאפשר הכלאה דנ"א קשירת קטן (40nm <) ולכן, חלבונים רק כי אינטראקציה יכולה להרשות קשירת. הדנ"א ligated אז יכול להיות מוגבר מזוהה עם הכלאה של oligonucleotides שכותרתו רצף מוגבר. הגברה הוא ספציפי כמו זה תלוי DNA-DNA עקרונות ההכלאה וגם מספק רגישות גבוהה כמו ה-DNA ligated מוגבר פי כמה וכתוצאה מכך שיפור של האירוע קשירת הראשונית. דנ"א מוגבר הוא זוהה על ידי הכלאה עם oligonucleotides שכותרתו ומייצרת מקום גלוי גדול למדי. כמו כתמים ניתן לספור, את האות PLA מספק לא רק את המידע המרחבי המדויק (את המיקום של האירועים אינטראקציה), אלא גם דרך לכימות אובייקטיבי של האירועים הללו 2-4.
טכניקות אחרות, כי הם מועסקים לצורך זיהוי של אינטראקציות חלבון כוללים שיתוף immunoprecipitation, immunofluoresence ו תהודה פלורסנט העברת אנרגיה (סריג). Co-immunoprecipitation מבחני נמצאים בשימוש נרחב המאפשר בידוד של קומפלקסים חלבונים. השיטה מלווה immunoblotting כלומר חלבונים חייב לבוא לידי ביטוי ברמות גבוהות יחסית כדי להיות מזוהה. בעיות רקע גבוה או שאינו ספציפי המחייב של חלבונים מסוימים החרוזים הם לפעמים קשה להתגבר immunoprecipitation שיתוף. בנוסף, שיתוף immunoprecipitation מבחני לאפשר זיהוי של חלבונים יכולה להיות חלק ממכלול חלבון אך אינה יכולה להבחין אלה נמצאים בסמיכות פיזית מאוד באינטראקציה אחד עם השני. יתר על כן, שיתוף immunoprecipitations לא יכול לספק quantitation ברזולוציה תא יחיד או מידע על לוקליזציה של קומפלקסים חלבונים בתא. איתור של דו קיום של קומפלקסים חלבונים בתא או תא תא על ידי immunofluoresence מבוססת על חפיפה של אותות מתפזרת ולכן, יש ברזולוציה מרחבית נמוכה, לא יכול לספק מידע מדויק על אינטראקציות חלבון. כימות האות immunofluoresence יכול להיעשות על ידי הערכה ויזואלית רק אם ההבדל הוא פי כמה וכמה, ולא ניתן למדידה מדויקת או כמו כתמים PLA. סריג מאפשר הדמיה של קומפלקסים חלבונים בתאים חיים מתגבר הצורך נוגדנים חשיפת epitope. עם זאת, סריג בדרך כלל תלוי overexpression של חלבונים התמזגו מלאכותיים, אשר לא תשקף את קומפלקסים חלבונים אנדוגניים כפי PLA.
התנאים חסימת את פרוטוקול PLA הם קריטיים כמו צבירה נוגדנים עלולה להתרחש ולהגדיל את הרקע. התנאים חסימת אלטרנטיבית ניתן למצוא גיליונות מוצר נוגדן. בקרות מתאימות עם השמטה הנוגדן הראשוני והמשני לספק מידע על מה אולי השתבש והם צריכים להיכלל תמיד. חשוב מסך נוגדנים שונים שייתן את הרקע לפחות כאשר הם משמשים לבד את האות הטוב ביותר כאשר הם ביחד. קיבוע של cells הוא קריטי כמו מעל לתקן עלול לגרום קומפלקסים חלבונים באופן מלא לפגל ו לבזות, ואילו קיבעון מספיק עלול להוביל לאובדן של קומפלקסים חלבונים במהלך השלבים של ההליך. זה יכול להיות נשלט על ידי הפחתת הריכוז של מקבע כדי 3% או על ידי הגבלת זמן קיבעון. עם זאת, קיבעון תלוי גם בשאלה האם נוגדנים העיקרית לזהות חלבונים מפוגל או לא. כמו טכניקה PLA רגיש מאוד, טיפול מיוחד נדרש כדי לשמור על פי הדגירה ותנאי המיקרו שווה בין מדגמים שונים.
דוגמאות לא צריך להשאיר לייבוש על מקרה לפני השלב הסופי. ייבוש של הדגימות יכול להוביל רקע מוגבר. הסרה מלאה של פתרון חסימת חיוני גם כדי למנוע רקע. מאגרים לשטוף צריך תמיד להביא לטמפרטורת החדר לפני השימוש, כמו טמפרטורה נמוכה מאטה את תגובות אנזימטיות. עבור פתרון בעיות נוסף עיין במדריך של קיט.
כדאי להשתמש כתמים לברר את לוקליזציה המשנה הסלולר של האות PLA (למשל DAPI, אקטין וכו '). כאן השתמשנו DAPI (במדיום הרכבה) להכתים את הגרעינים. PLA תואם השימוש immunofluorescence עם נוגדנים כדי לקבוע את סוג התא או תא סלולרי (לא מוצג כאן). כימות מדויק יכול להיעשות על ידי ספירת אותות שימוש בתוכנות מסוימות (כלי Duolink תמונה, Olink Biosience).
לסיכום אנו הדגימו כיצד להשתמש ב-PLA באתרו, באמצעות ערכת Duolink לזהות BMP איתות בתאי קבוע והציגו יתרונות: קל לשימוש, רגיש מאוד, לא רקע, יכולת ייחודית לכמת BMP פעיל איתות באתרם.
המגבלה של החלת בטכניקה זו כדי ללמוד אינטראקציות חלבון שונה תלוי בזמינות ובאיכות של נוגדנים העיקרי לזהות את החלבונים תחת חקירה.
Disclosures
Acknowledgements
מחקר זה מומן על ידי MRC ואת מענקי BBSRC. אנו מודים אגתה Zieba וקתרינה Pardalis במעבדה של אולף Landegren, אופסלה על העזרה עם הקמת טכניקה ועצות שימושיות. Olink Biosience לעזרה טכנית את המצגת.
Materials
| Name | Company | Catalog Number | Comments |
| GMEM | Invitrogen | 21710025 | |
| DMEM | Invitrogen | 21063029 | |
| FBS | AutogenBioclear | 7.01 | |
| Non-essential Amino Acids | Invitrogen | 11149068 | |
| Sodium Pyruvate | Invitrogen | 11360070 | |
| Penicillin / Streptomycin | Invitrogen | 15140122 | |
| L-glutamine | Invitrogen | 25030-054 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300-054 | |
| 16-well chamber slides | Lab-Tek | 178599 | |
| Polysine | VWR international | 631-0107 | |
| Cover glass | VWR international | 631-0138 | |
| a-pSmad1/5/8 | Cell Signaling Technology | 9511 | |
| a-Smad4 (B8) | Santa Cruz Biotechnology, Inc. | sc-7966 | |
| Dorsomorphin | Merck & Co., Inc. | 171260-10MG | |
| Recombinant Mouse BMP-4 | R&D Systems | 5020-BP-010 | |
| PFA | Sigma-Aldrich | P6148 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Promega Corp. | H5151 | |
| Duolink II Detection Reagents (Orange) | Olink Bioscience | 92007-0100 | |
| Duolink II PLA probe anti-Mouse MINUS | Olink Bioscience | 92004-0100 | |
| Duolink II PLA probe anti-Rabbit PLUS | Olink Bioscience | 92002-0100 | |
| Duolink II Mounting Medium with DAPI | Olink Bioscience | 82040-0005 | |
| Duolink II Wash Buffers Fluorescence | Olink Bioscience | 82049 |
References
- Miyazono, K., Kamiya, Y., Morikawa, M. B. o. n. e. morphogenetic protein receptors and signal transduction. J Biochem. 147, 35-51 (2010).
- Gustafsdottir, S. M. Proximity ligation assays for sensitive and specific protein analyses. Anal Biochem. 345, 2-9 (2005).
- Soderberg, O. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3, 995-1000 (2006).
- Soderberg, O. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Yu, P. B. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4, 33-41 (2008).
- Baan, B. In situ proximity ligation detection of c-Jun/AP-1 dimers reveals increased levels of c-Jun/Fra1 complexes in aggressive breast cancer cell lines in vitro and in vivo. Mol Cell Proteomics. 9, 1982-1990 .
- Massinen, S. Functional interaction of DYX1C1 with estrogen receptors suggests involvement of hormonal pathways in dyslexia. Hum Mol Genet. 18, 2802-2812 (2009).
- Thymiakou, E., Zannis, V. I., Kardassis, D. Physical and functional interactions between liver X receptor/retinoid X receptor and Sp1 modulate the transcriptional induction of the human ATP binding cassette transporter A1 gene by oxysterols and retinoids. Biochemistry. 46, 11473-11483 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved