Method Article
Il rilascio di dopamina a singoli terminali presinaptici visualizzate con FFNs
In questo articolo
Riepilogo
Un nuovo mezzo per misurare la neurotrasmissione otticamente con analoghi della dopamina fluorescenti.
Abstract
Il sistema nervoso trasmette i segnali tra i neuroni attraverso il rilascio dei neurotrasmettitori durante la fusione delle vescicole sinaptiche. Per osservare l'assorbimento e il rilascio dei neurotrasmettitori dai singoli terminali presinaptici direttamente, abbiamo progettato fluorescenti falsi neurotrasmettitori come substrato per il trasportatore della vescicole sinaptiche monoamine. L'utilizzo di questi sonde per il rilascio di dopamina nello striato immagine, abbiamo fatto alcune osservazioni pertinenti alla plasticità sinaptica. Abbiamo trovato che la frazione delle vescicole sinaptiche per il rilascio dei neurotrasmettitori stimolo era dipendente dalla frequenza dello stimolo. Un cineticamente distinte popolazione "riserva" delle vescicole sinaptiche non è stata osservata in queste condizioni sperimentali. Una frequenza dipendente dalla eterogeneità dei terminali presinaptici stato rivelato che era dipendente in parte sui recettori della dopamina D2, che indica un meccanismo per dipendente dalla frequenza di codifica di selezione presinaptico.
Hui Zhang e Niko gubernator G. contribuito in maniera uguale a questo lavoro.
Protocollo
Questo metodo è stato utilizzato nella ricerca riportata in gubernator et al. Science 324 (5933). 1441-1444 (2009) .
1. Preparazione acuta fette striatale
- Prima di preparare acuta fettine striatali, si deve ossigenare il liquido cerebrospinale artificiale (ASCF) e raffreddare con ghiaccio per almeno 15 minuti prima l'estrazione del cervello. Tenere il freddo ghiaccio ACSF e ossigenato durante la dissezione. ACSF (in mM): NaCl 125, KCl 2.5, NaHCO 3 26, CaCl 2 2,4, MgSO4 1.3, KH 2 PO 4 0,3, glucosio 10, HEPES 5, pH 7,3-7,4, 290-295 mOsm.
- Decapitare topo maschio senza anestesia.
- Estrarre l'intero cervello dal mouse, e montarlo sul vassoio vibratome immessi sul vibratome con Krazy Glue ®. Estrazione del cervello e di montaggio deve essere fatto entro 2 minuti. Durante questo tempo, assicurarsi di mantenere il freddo ghiaccio ACSF e ossigenato per mantenere il tessuto sano.
- Tagliate le fette coronali del cervello striatale a spessore 250μm tra bregma 1,54-0,62 1. Tre fette si ottiene che possono poi essere tagliato in 6 fette di mezzo con un ago.
- Incubare le fette di cervello in ACSF ossigenata a temperatura ambiente per almeno 1 ora prima del caricamento della sonda. Fette di buon display FFN511 carico e rimane attivo per le immagini fino a 4 ore dopo la preparazione fetta.
2. Caricamento FFN511
- Preparare FFN511 soluzione di carico (10μM FFN511 in ACSF); anche preparare 100μM ADVASEP-7 in ACSF. Tutte le soluzioni devono essere preparate di fresco e ossigenato almeno 15 minuti prima di caricare in fette.
- Individualmente incubare fetta con FFN511 soluzione di carico per 30 minuti a temperatura ambiente.
- Quindi rimuovere il colorante legato al tessuto extracellulare incubando la fetta caricata in ossigenato 100μM ADVASEP-7 ACSF per 30 minuti a temperatura ambiente 2. Fette sono ora pronti per l'imaging.
3. Imaging FFN511 in fettine di cervello
Imaging di FFN511 nel fette viene eseguita utilizzando microscopio a scansione laser multiphoton. Stiamo usando una prateria di Ultima multiphoton microscopio a scansione laser (Stavamo usando un obiettivo Zeiss LSM 510 NLO multiphoton microscopio a scansione laser in precedenza e alcuni risultati sono stati ottenuti con il microscopio Zeiss).
- Posizionare il FFN511-caricato fetta nella camera di registrazione (RC-27L, Warner) e con superfuse ACSF ossigenato ad un flusso di 1-2 ml al minuto. Poi posto l'arpa platino con corde di nylon sulla parte superiore della fetta per minimizzare i movimenti durante l'esperimento. Per ridurre ulteriormente il movimento, permettono la fetta si stabilizzi per almeno 10 minuti nella camera prima di imaging.
- Visualizzare e localizzare il corpo striato dorsale con luminescenza in campo chiaro con un obiettivo 10x immersione in acqua.
- Posto e la posizione degli elettrodi di tungsteno bipolare intrecciato in questa regione se si esegue un esperimento di stimolazione. L'area di imaging ideale si trova nel raggio di 300 micron tra le due punte degli elettrodi bipolari stimolante. Posto questa regione al centro del campo visivo.
- Immagine FFN511 marcato terminali striatali sotto (0,9 NA) obiettivo ultravioletti 63x immersione in acqua. FFN511 è eccitato a 760 nm con un laser da Mai Tai Fisica spettrale e fluorescenza ottimale di terminali striatali è visto attraverso un filtro passa banda (480-520 nm). Le immagini vengono catturate in 12-bit con formato 75 x 75 micron regioni di interesse a 512 x 512 pixel di risoluzione. Per stimolato esperimenti decolorazione, per compensare z turno, una serie z di immagini 5-7, separati da 1 micron nel piano z, si ottiene per ogni periodo di tempo.
4. FFN511 decolorante
Il FFN511 etichetta può essere decolorato sia un'alta concentrazione di KCl (usiamo 70 mm KCl), (+)-amfetamina solfato (AMPH, 20 mM), o la stimolazione elettrica. Nell'esperimento decolorazione KCl, quando una soluzione ad alta ACSF potassio viene applicata la fetta cervello, il FFN511 destains etichetta entro 2 minuti. Record xyz-t immagini per tracciare FFN511 decolorazione nel tempo. Di seguito sono descritte stimolazione elettrica-dipendente decolorazione terminale della dopamina:
- Per tenere traccia FFN511 decolorazione nel tempo, xyz-t immagini vengono registrate. Per garantire minimo movimento della fetta (meno di 4 micron di z) e non photobleaching dai, immagini in tempo laser serie il controllo della z-stack dovrebbe essere ottenuto per almeno 5 minuti prima della stimolazione. In caso contrario, regolare la potenza del laser.
- A seguito di queste immagini di controllo, continuare la xyz-t immagini mentre inizio la stimolazione a frequenza di 1, 4 o 20 Hz. Gli stimoli a 1, 4 o 20 Hz (300 ms x 1 mA) vengono applicati al corpo striato a livello locale da parte di un Iso-Flex isolatore stimolo innescato da un Maestro-8 generatore di impulsi (AMPI, Gerusalemme, Israele) con elettrodi bipolari. Per ridurre al minimola variazione della depolarizzazione dei siti di rilascio, abbiamo utilizzato un protocollo di stimolazione applicare il 150% della massima intensità di stimolazione determinata dalla voltammetria ciclica.
- Utilizzare il software appropriato per l'analisi di imaging. Nel nostro laboratorio usiamo Immagine J (Wayne Rosband, National Institutes of Health, Rockville, MD) e personalizzato il software scritto in IDL (Systems Research, Boulder, CO) per quantificare la fluorescenza puncta e le modifiche con Time3.
Risultati Represenative
La figura 1 mostra FFN511 caricamento in fetta striatale è ora completa. Immagini rappresentative con obiettivo 10x e 60x sono mostrati in Fig.1. L'etichettatura selettiva dei terminali della dopamina può essere decolorato del 20 mM anfetamine.
La Figura 2 mostra decolorazione di FFN511 etichettatura KCl alto.
La figura 3 mostra decolorazione di FFN511 etichettatura locali stimolazione elettrica.
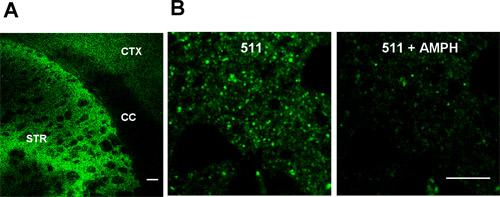
Figura 1 FFN511 etichette terminali della dopamina nel vivo fette acuta cortico-striatali (A) Etichettatura di FFN511 in acuto vivere cortico-striatale fetta:.. Etichettatura abbondante nello striato (STR), etichettatura rado nella corteccia (CTX), e nessuna etichetta in corpo calloso (CC). Scala grafica:. 100 micron (B) decolorante della FFN511 dallo striato da anfetamine. Pannelli di sinistra: prima di anfetamine; pannelli di destra: dopo 20 minuti di 20 mM anfetamine. Scala grafica: 10 micron.
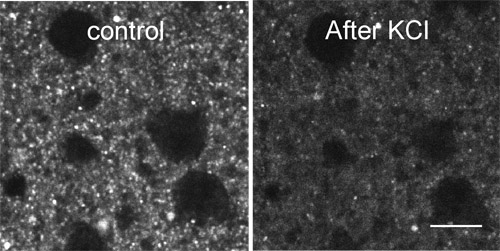
Figura 2. Decolorante di FFN511 etichettatura KCl alto. Etichettatura FFN511 è decolorato entro 2 minuti di applicazione mM KCl 70 in ACSF. Scala grafica: 10μm.
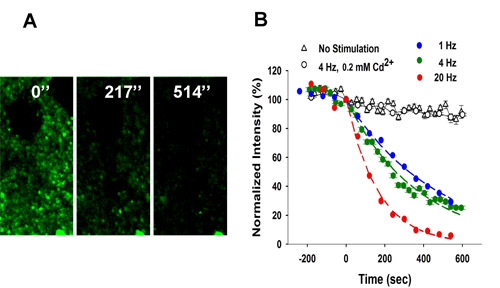
Figura 3. Dipendente dalla frequenza di decolorazione FFN511 etichettatura striato. (A) stimolazione locale a 4 Hz portato decolorazione dai terminali. Stimolazione iniziata al tempo t = 0. Scala grafica: 5 micron (B) decolorante di FFN511 a 4 Hz è Ca 2 + - e dipendente dalla frequenza.. Controlli ricevuto alcuna stimolazione (153 puncta da 3 fette). Decolorazione con cloruro di cadmio (200 mM) era identico a controlli non stimolate (475 puncta da 5 fette). Le curve di decolorazione per ogni frequenza di stimolazione erano idonei da una singola funzione di decadimento esponenziale e l'emivita (t 1 / 2) valori calcolati come τ x 0,693 (1 Hz: 765 puncta da 9 fette, 4 Hz: 410 puncta da 7 fette, 20 Hz: 416 puncta da 6 fette). Si prega di fare riferimento al microscopio video da 2-fotone microscopia di FFN511 decolorazione durante esocitosi in un preparato striato fetta cervello.
Discussione
In questo video, dimostriamo un metodo per visualizzare neurotrasmissione otticamente con analoghi della dopamina fluorescenti. FFN511 è la prima generazione di FFNs abbiamo sviluppato. Anche se è stato progettato prendendo di mira i neuroni trasportatore vescicolare delle monoamine (VMAT2) che porta neurotrasmettitori monoamine dal citoplasma in vescicole sinaptiche, e le etichette in particolare i terminali della dopamina nello striato e catecolamine presunta e / o terminali della serotonina nella corteccia (come mostrato nella Scienza carta), un periodo di carico appropriata è fondamentale per la specificità in quanto è relativamente FFN511 idrofobo. Abbiamo scoperto che l'incubazione per più di 40 minuti si tradurrà in ampi colorazione aspecifica a fette dello striato. La specificità può essere direttamente determinato da decolorazione con un'alta concentrazione di KCl, che dovrebbe causare il rilascio di FFN all'interno funzionale vescicole sinaptiche. L'esposizione della fetta di FFN511 per meno di 15 minuti si tradurrà in debole segnale fluorescente a causa del carico insufficiente del colorante nei terminali. In questo protocollo, utilizziamo 100μM ADVASEP-7 per rimuovere il colorante legato al tessuto extracellulare. Questo passaggio non è necessario, ma se è omesso, il tempo di washout in ACSF deve essere prolungata. In sintesi, a seconda della preparazione si è scelto, sarà necessario modificare il periodo di concentrazione e di carico per determinare l'etichettatura ottimale.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
D. Il Sames grazie Harold G. & Leila Y. Mathers Charitable Foundation e della Columbia University Iniziative in Scienze e Ingegneria.
D. Sames e D. Sulzer ringraziare la Fondazione McKnight per le innovazioni tecnologiche nel McKnight Premio Neuroscienze
D. Sulzer grazie NIDA, NIMH, e il Picower e Fondazioni Malattia di Parkinson.
H. grazie Zhang NARSAD.
RH Edwards ringrazia la Michael J. Fox Foundation, la National Parkinson Foundation, NIDA e NIMH.
Ringraziamo Robert Burke per 6-OHDA iniezioni e consulenza, Sonders Marchio di discussione utile, Merek Siu per la programmazione di analisi delle immagini, e Jan Schmoranzer per l'assistenza tecnica con l'installazione di microscopia TIRF.
Materiali
| Name | Company | Catalog Number | Comments |
| FFN511 (8-(2-Amino-ethyl)-2,3,5,6-tetrahydro-1H,4H-11-oxa-3a-aza-benzo[de]anthracen-10-one) | Columbia University - Dalibor Sames Lab | ||
| ADVASEP-7 | CyDex | AR-OA7-005 | |
| RC-27L Recording chamber | Warner Instruments | 64-0375 | |
| PELCO PrepEze 6-Well Holder | Ted Pella, Inc. | 36157-1 | For slice incubation |
| Master-8 pulse stimulator and Iso- Flex stimulus isolator | AMPI |
Riferimenti
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxi coordinators. , (1997).
- Kay, A. R. Imaging synaptic activity in intact brain and slices with FM1-43 in C. elegans, lamprey, and rat. Neuron. 24, 8098-8117 (1999).
- Bamford, N. S. Heterosynaptic dopamine neurotransmission selects sets of corticostriatal terminals. Neuron. 42, 653-653 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon