Method Article
La liberación de dopamina en los terminales presinápticos individuales visualizados con FFNs
En este artículo
Resumen
Una nueva forma de medir la neurotransmisión ópticamente con análogos fluorescentes de la dopamina.
Resumen
El sistema nervioso transmite señales entre las neuronas a través de la liberación de neurotransmisores durante la fusión de vesículas sinápticas. Para observar la captación de neurotransmisores y liberación de terminales presinápticas individuales directamente, hemos diseñado fluorescentes neurotransmisores falsos como sustrato para el transportador de monoamina vesicular sináptica. El uso de estas sondas para liberar la imagen de la dopamina en el estriado, que hizo varias observaciones pertinentes a la plasticidad sináptica. Hemos encontrado que la fracción de la liberación de las vesículas sinápticas del neurotransmisor por estímulo depende de la frecuencia del estímulo. A cinéticamente distintas "reserva" de la población de vesículas sinápticas no se observó en estas condiciones experimentales. Una heterogeneidad depende de la frecuencia de las terminales presinápticas se reveló que se depende en parte de los receptores D2 de la dopamina, lo que indica un mecanismo para dependientes de la frecuencia de codificación de la selección pre-sináptica.
Hui Zhang y Gubernator Niko G. contribuyeron igualmente a este trabajo.
Protocolo
Este método se utilizó en la investigación publicada en Gubernator et al., Science 324 (5933). 1441-1444 (2009) .
1. Preparación aguda rebanadas estriatales
- Antes de preparar las rebanadas estriatal aguda, se debe oxigenar el líquido cefalorraquídeo artificial (ASCF) y enfriar con hielo durante al menos 15 minutos antes de la extracción del cerebro. Mantener el frío de hielo y ACSF oxigenada durante la disección. ACSF (en mM): NaCl 125, KCl 2,5, NaHCO3 26, CaCl2 2,4, MgSO4 1,3, KH 2 PO 4 0,3, glucosa 10, HEPES 5, pH 7,3-7,4, 290-295 mOsm.
- Decapitar ratón macho sin anestesia.
- Extraer todo el cerebro del ratón, y montarlo en la bandeja de vibratome colocado en el vibratome utilizando pegamento Krazy ®. Extracción del cerebro y el montaje se debe hacer en 2 minutos. Durante este tiempo, asegúrese de mantener el frío de hielo ACSF y oxigenado para mantener el tejido sano.
- Corte coronal rodajas de cerebro del cuerpo estriado en espesor de 250 micras entre bregma desde 1.54 hasta 0.62 1. Tres rebanadas se obtiene que puede ser cortado en 6 rodajas de media con una aguja.
- Se incuban las rodajas de cerebro en ACSF oxigenada a temperatura ambiente durante al menos 1 hora antes de la carga de la sonda. Rebanadas de buena exhibición FFN511 de carga y permanecer activos para obtener imágenes de hasta 4 horas después de la preparación rebanada.
2. Cargando FFN511
- Prepare FFN511 solución de carga (10μM FFN511 en ACSF); también preparan 100μM ADVASEP-7 en ACSF. Todas las soluciones deben ser recién preparadas, oxigenada por lo menos 15 minutos antes de cargarlos en los cortes.
- Individualmente se incuban con una solución de corte de carga FFN511 durante 30 minutos a temperatura ambiente.
- A continuación, retire el tinte unido al tejido extracelular mediante la incubación de la corte en carga oxigenada 100μM ADVASEP-7 ACSF durante 30 minutos a temperatura ambiente 2. Rodajas ya están listos para la imagen.
3. Imágenes FFN511 en las rebanadas de cerebro
Imágenes de FFN511 en los cortes se realiza mediante microscopio de barrido láser multifotónica. Estamos utilizando una pradera Ultima multifotónica microscopio de barrido láser (Estábamos utilizando un Zeiss LSM 510 NLO multifotónica microscopio de barrido láser anteriormente y algunos resultados se obtuvieron con el microscopio Zeiss).
- Coloque la rebanada FFN511 cargada en la cámara de grabación (RC-27L, Warner) y superfuse con ACSF oxigenada con un caudal de 2.1 ml por minuto. A continuación, coloque un arpa de platino con cuerdas de nylon en la parte superior de la rebanada para minimizar el movimiento durante el experimento. Para minimizar aún más el movimiento, permiten el corte se estabilice por lo menos 10 minutos en la cámara antes de la imagen.
- Visualizar y localizar el cuerpo estriado dorsal, con la luminiscencia de campo claro en un objetivo de inmersión en agua 10 veces.
- Lugar y la posición de los electrodos de tungsteno bipolar trenzado en esta región si se realiza un experimento de estimulación. El área de imagen ideal se encuentra a menos de 300 m entre las dos puntas del electrodo bipolar estimulante. Situar a la región en el centro del campo visual.
- Imagen FFN511 marcado con terminales estriatales en un 63x (0,9 NA) objetivo de inmersión de agua ultravioleta. FFN511 se excita a 760 nm con un láser Mai Tai de la Física y de fluorescencia espectral óptimo de los terminales del cuerpo estriado se ve a través de un filtro pasa banda (480-520 nm). Las imágenes se capturan en formato de 12-bit con 75 x 75 m de las regiones de interés de 512 píxeles de resolución x 512. Para estimular los experimentos de decoloración, para compensar el eje Z de turno, un z-series de imágenes 5.7, separados por un m en el plano z, se obtiene para cada período de tiempo.
4. FFN511 decolorante
La etiqueta puede ser FFN511 desteñido, ya sea por alta concentración de KCl (utilizamos 70 mM KCl), (+)-anfetamina sulfato (AMPH, 20 M), o la estimulación eléctrica. En el experimento de decoloración KCl, cuando una solución de potasio ACSF alta se aplica a la porción del cerebro, el FFN511 destains etiqueta en 2 minutos. Registro xyz-t imágenes para realizar un seguimiento FFN511 decoloración con el tiempo. A continuación se describe la estimulación eléctrica dependiente de decoloración de terminales de dopamina:
- Para realizar el seguimiento FFN511 decoloración con el tiempo, xyz-t se graban las imágenes. A fin de garantizar un mínimo movimiento de la porción (menos de 4 m en el eje Z) y no photobleaching por el láser, imágenes de la serie de control de tiempo de la z-stack se debe obtener por lo menos 5 minutos antes de la estimulación. En caso contrario, ajustar la potencia del láser.
- A raíz de estas imágenes de control, continuar con la imagen xyz-t, mientras que iniciar la estimulación a frecuencias de 1, 4 o 20 Hz. Estímulos a los 1, 4 o 20 Hz (300 ms x 1 mA) se aplican en el cuerpo estriado a nivel local por un aislador de estímulo Iso-Flex provocado por un maestro-8 generador de impulsos (AMPI, Jerusalén, Israel), utilizando electrodos bipolares. Para reducir al mínimola variación en la despolarización de los sitios de liberación, hemos utilizado un protocolo de estimulación de aplicar el 150% de la intensidad de la estimulación máxima determinada por voltametría cíclica.
- Utilice el software adecuado para el análisis de imágenes. En nuestro laboratorio, el uso de la imagen J (Wayne Rosband, Institutos Nacionales de Salud, Rockville, MD) y software a medida, escrito en IDL (Research Systems, Boulder, CO) para cuantificar la fluorescencia de puntos lagrimales y los cambios con tiempo3.
Resultados represenative
La figura 1 muestra FFN511 carga en parte del cuerpo estriado se ha completado. Imágenes representativas con el objetivo de 10x y 60x se muestran en la Figura 1. El etiquetado selectiva de los terminales de dopamina puede ser desteñido por las anfetaminas M 20.
La figura 2 muestra decoloración de FFN511 etiquetado por KCl alta.
La Figura 3 muestra decoloración de FFN511 etiquetado mediante la estimulación eléctrica local.
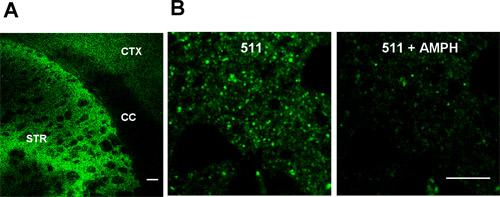
Figura 1 FFN511 etiquetas de terminales de dopamina en vivo corticotalamoestriatales rodajas aguda (A) Etiquetado de FFN511 aguda en vivo corticotalamoestriatales corte:.. Etiquetado abundante en el cuerpo estriado (STR), etiquetado más escaso en la corteza (CTX), y no en la etiqueta cuerpo calloso (CC). Barra de escala:. 100 micras (B) Decoloración de FFN511 del cuerpo estriado por las anfetaminas. Paneles de la izquierda: antes de las anfetaminas, los paneles de la derecha: después de 20 minutos de la anfetamina M 20. Barra de escala: 10 micras.
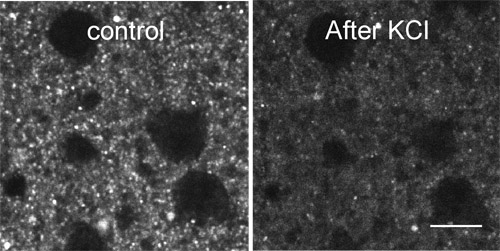
Figura 2. Decoloración de FFN511 etiquetado por KCl alta. Etiquetado FFN511 es destained dentro de la aplicación de 2 minutos de KCl 70 en ACSF. Barra de escala: 10μm.
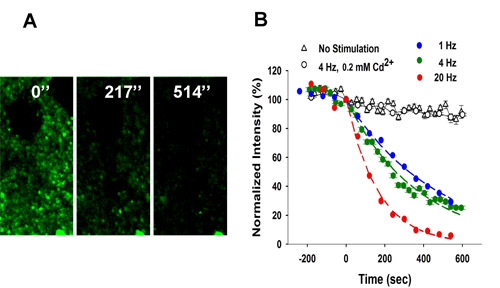
Figura 3. Dependiente de la frecuencia de decoloración de FFN511 etiquetado en el cuerpo estriado. (A) la estimulación local de 4 Hz como resultado de decoloración de los terminales. La estimulación se inició en t = 0. Barra de escala: 5 micras (B) Decoloración de FFN511 a 4 Hz es Ca 2 + - y dependientes de la frecuencia.. Controles no recibieron la estimulación (153 puntos lagrimales de 3 rebanadas). Decoloración con cloruro de cadmio (200 M) era idéntico a los controles sin estimular (475 puntos lagrimales de 5 rebanadas). Las curvas de decoloración para cada frecuencia de estimulación se forma por una función de decaimiento exponencial de una sola y la vida media (t 1 / 2) los valores calculados como τ x 0.693 (1 Hz: 765 puntos lagrimales de 9 rebanadas, 4 Hz: 410 puntos lagrimales de 7 segmentos, 20 Hz: 416 puntos lagrimales de 6 porciones). Por favor refiérase a la micrografía de vídeo de 2-fotones microscopía de FFN511 decoloración durante la exocitosis en la preparación del cerebro rebanada del cuerpo estriado.
Discusión
En este vídeo, se demuestra un método para visualizar la neurotransmisión ópticamente con análogos fluorescentes de la dopamina. FFN511 es la primera generación de FFNs que hemos desarrollado. A pesar de que fue diseñado por objetivo el transportador vesicular de monoaminas neuronales (VMAT2) que lleva la monoamino neurotransmisores desde el citoplasma en vesículas sinápticas y, específicamente, las etiquetas de terminales de dopamina en el estriado y catecolaminas presunta y / o terminales de la serotonina en la corteza (como se muestra en la ciencia papel), un período de carga adecuada es fundamental para la especificidad desde FFN511 es relativamente hidrofóbica. Se encontró que la incubación de más de 40 minutos se traducirá en manchas extensas inespecíficos en rebanadas estriatales. La especificidad puede ser directamente determinado por decoloración utilizando una alta concentración de KCl, que hace que la liberación de FFN dentro de las vesículas sinápticas funcionales. La exposición de la división para FFN511 de menos de 15 minutos se traducirá en una señal débil fluorescencia debido a la carga insuficiente de la tintura en las terminales. En este protocolo, el uso de 100μM ADVASEP-7 para quitar el tinte obligado a tejido extracelular. Este paso no es necesario, pero si se omite, el tiempo de lavado en ACSF debe ser prolongado. En resumen, dependiendo de la preparación que se elija, tendrá que modificar el período de concentración y de carga para determinar el etiquetado óptima.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
D. El Sames gracias Harold G. & Y. Mathers Leila Charitable Foundation y la Universidad de Columbia iniciativas en ciencia e ingeniería.
D. Sames y Sulzer D. agradecer a la Fundación McKnight de las innovaciones tecnológicas en McKnight Premio de Neurociencia
D. Sulzer gracias NIDA, NIMH, y el Picower y Fundaciones Enfermedad de Parkinson.
H. Zhang NARSAD gracias.
HR Edwards gracias al Michael J. Fox Foundation, la Fundación Nacional de Parkinson, el NIDA y el NIMH.
Damos las gracias a Robert Burke por 6-OHDA inyecciones y asesoramiento, Sonders Marcar útil para el debate, Merek Siu para la programación de análisis de imágenes, y Schmoranzer Jan de apoyo técnico con la configuración de la microscopía TIRF.
Materiales
| Name | Company | Catalog Number | Comments |
| FFN511 (8-(2-Amino-ethyl)-2,3,5,6-tetrahydro-1H,4H-11-oxa-3a-aza-benzo[de]anthracen-10-one) | Columbia University - Dalibor Sames Lab | ||
| ADVASEP-7 | CyDex | AR-OA7-005 | |
| RC-27L Recording chamber | Warner Instruments | 64-0375 | |
| PELCO PrepEze 6-Well Holder | Ted Pella, Inc. | 36157-1 | For slice incubation |
| Master-8 pulse stimulator and Iso- Flex stimulus isolator | AMPI |
Referencias
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxi coordinators. , (1997).
- Kay, A. R. Imaging synaptic activity in intact brain and slices with FM1-43 in C. elegans, lamprey, and rat. Neuron. 24, 8098-8117 (1999).
- Bamford, N. S. Heterosynaptic dopamine neurotransmission selects sets of corticostriatal terminals. Neuron. 42, 653-653 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados