פלאק אסאי: שיטה לקביעת טיטר ויראלי כיחידות יוצרות פלאק (PFU)
Overview
מקור: עדדה אנדרסון1, רולף לוד1
1 המחלקה למדעים קליניים לונד, החטיבה לרפואת זיהומים, המרכז הביו-רפואי, אוניברסיטת לונד, 221 00 לונד, שוודיה
וירוסים שמדביקים אורגניזמים פרוקריוטים, הנקראים בקטריופאג'ים או פשוט פאג'ים, זוהו בתחילת המאהה-20 על ידי Twort (1) ו-d'Hérelle (2) באופן עצמאי. מאז הוכרו פאג'ים בזכות ערכם הטיפולי (3) והשפעתם על בני האדם (4), כמו גם על מערכות אקולוגיות גלובליות (5). החששות הנוכחיים עוררו עניין מחודש בשימוש בפאג'ים כחלופה לאנטיביוטיקה מודרנית לטיפול במחלות זיהומיות (6). בעיקרו של דבר כל מחקר פאג 'מסתמך על היכולת לטהר ולכומת וירוסים, הידוע גם בשם טיטר ויראלי. בתחילה תואר בשנת 1952, זו הייתה מטרתו של ההסתה הלוח (7). עשרות שנים והתקדמות טכנולוגית מרובה לאחר מכן, ההסתה של הלוח נותרה אחת השיטות המהימנות ביותר לקביעת טיטר ויראלי (8).
בקטריופאג'ים להתקיים על ידי הזרקת החומר הגנטי שלהם לתאים מארחים, חטיפת המכונות לייצור של חלקיקי פאג 'חדשים, ובסופו של דבר גורם המארח לשחרר ויריונים צאצאים רבים באמצעות תמוגה התא. בגלל גודלם הדק, לא ניתן לצפות בבקטריופאג'ים באמצעות מיקרוסקופיה קלה בלבד; לכן, סריקת מיקרוסקופיית אלקטרונים נדרשת (איור 1). בנוסף, לא ניתן לטפח פאג'ים על לוחות אגר תזונתיים כמו חיידקים, שכן הם זקוקים לתאים מארחים כדי לטרוף.

איור 1: ניתן לחקור את המורפולוגיה של בקטריופאג', המודגמת כאן על ידי E. coli phage, באמצעות סריקת מיקרוסקופיית אלקטרונים. רוב הבקטריופאג'ים שייכים ל- Caudovirales (בקטריופאג'ים זנב). זה פאג ' מסוים יש מבנה זנב קצר מאוד וראש icosahedral, הצבתו במשפחה של Podoviruses.
ה-plaque assay (איור 2) מבוסס על שילוב של תאים מארחים, המועדפים על צמיחת שלב היומן, לתוך המדיום. זה יוצר שכבה צפופה, עגום של חיידקים מסוגל לקיים צמיחה ויראלית. פאג' מבודד יכול להדביק, לשכפל בתוך תא אחד ולתייג אותו. עם כל תא lysed, סמוכים מרובים להידבק מיד. מספר מחזורים פנימה, ניתן לראות אזור ברור (פלאק) בלוח העכיר (איור 2B/איור 3A),המציין את נוכחותו של מה שהיה בתחילה חלקיק בקטריופאג' יחיד. לפיכך, ניתן לקבוע את מספר יחידות יצירת הלוח לכל אמצעי אחסון (כלומר PFU/mL) של מדגם, ממספר הלוחות שנוצרו.
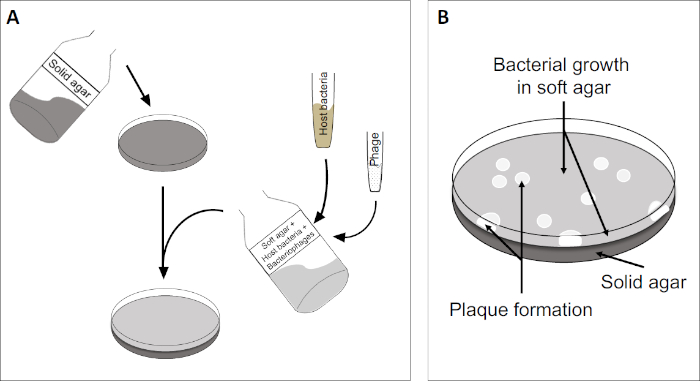
איור 2: בדיקת יחידות יוצרות פלאק (PFU) היא שיטה נפוצה לקביעת מספר הבקטריופאג'ים במדגם. (A) הבסיס של צלחת פטרי סטרילי מכוסה במדיום מודי מתאים, ואחריו תערובת של מדיה רכה, תאים מארחים רגישים ודילול של דגימת הבקטריופאג'. שים לב כי השעיית פאג 'יכול, במקרים מסוימים, גם להיות מפוזר באופן שווה על פני השטח של אגר רך כבר מוצק. (B) צמיחת החיידקים המארחים יוצרת מדשאה של תאים בשכבת אגר העליונה. שכפול בקטריופאג' מייצר אזורים ברורים, או לוחות, הנגרמים על ידי תמה של תאים מארחים.
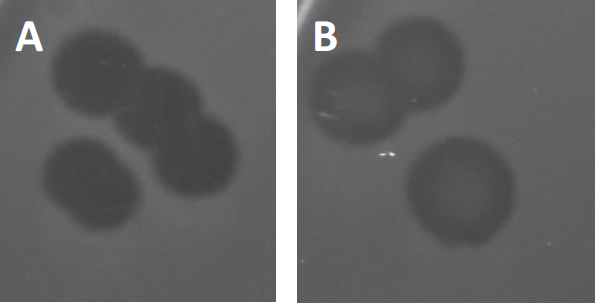
איור 3: תוצאות בדיקות PFU מראות לוחות מרובים שנוצרו על ידי בקטריופאג'ים. בשל תמוגה של תאים מארחים רגישים, ניתן לראות פלאקים כאזורי ניקוי במדשאה החיידקית, עם (A) אישור מלא, או (B) צמיחה מחדש חלקית הנגרמת על ידי יצירת חיידקים עמידים (או אולי על ידי פאג'ים ממוזגים במחזור ליזוזניים).
פאג'ים ממוזגים מסוימים יכולים לאמץ את מה שמכונה מחזור חיים ליזוזני, בנוסף לצמיחה הטיקית שתוארה בעבר. בליסוגניה, הנגיף מניח מצב סמוי באמצעות שילוב של החומר הגנטי שלו בגנום של התא המארח (9), לעתים קרובות מעניק עמידות לזיהומי פאג 'נוספים. זה מתגלה לפעמים דרך ערנות קלה של הלוח (איור 3B). ראוי לציין עם זאת, כי לוחות יכולים גם להיראות מטושטשים עקב צמיחה מחדש של חיידקים שפיתחו עמידות פאג 'ללא תלות בזיהומים פאג 'קודמים.
וירוסים יכולים לצרף, או ספיחה, למגוון מוגבל בלבד של חיידקים מארחים (10). טווחי המארחים מוגבלים עוד יותר על ידי אסטרטגיות אנטי ויראליות תאיות כגון מערכת CRISPR-Cas (11). ההתנגדות/הרגישות כלפי פאג'ים ספציפיים המוצגים על ידי תת-קבוצות חיידקיות שימשה היסטורית לסיווג זני חיידקים לסוגי פאג' שונים (איור 4). למרות שהיעילות של שיטה זו עלתה כעת על טכניקות רצף חדשניות, הקלדת פאג 'עדיין יכולה לספק מידע בעל ערך על אינטראקציות חיידקים-פאג ', למשל, להקל על העיצוב של קוקטייל פאג 'לשימוש קליני.

איור 4: רגישות פיג' לזני חיידקים שונים. צלחות אגר רכות עם זן אקנה Cutibacterium (A) AD27 ו (B) AD35, נצפו עם 21 בקטריופאג'ים שונים C. רק פאג' 11 הצליחו להדביק ולהרוג את AD27 בעוד שזן AD35 הראה רגישות כלפי כל הפאג'ים. טכניקה זו, המכונה הקלדת פאג ', יכולה לשמש לחלוקת מינים וזנים חיידקיים לתת-קבוצות שונות המבוססות על רגישות פאג '.
Procedure
1. הגדרת
- לפני תחילת כל עבודה מעורבים חיידקים, ודא כי חלל העבודה מעוקר (למשל ניגב עם 70% אתנול). תמיד ללבוש חלוק מעבדה וכפפות, לשמור על שיער ארוך קשור לאחור, ולהבטיח כי כל הפצעים מוגנים היטב במיוחד.
- בסיום, לעקר את כל המשטחים ולשטוף / לעקר ביסודיות ידיים ופרקי כף היד.
2. פרוטוקול
- הכנת מדיה LB
הערה: בהתאם לזן החיידקי המארח ולבקטריופאג ', מדיום נוזלי אחר עשוי להתאים יותר לפולחן הראשוני של זן החיידקים המארח או מדיום מוצק אחר עשוי להתאים יותר לצמיחה הבאה. מרק ליסוגניה (LB) משמש בפרוטוקול זה עבור המרק והאג.- מערבבים 4 גרם LB במים מזוקקים 200 מ"ל, משולש, עבור מרק LB, אגר התחתון המוצק, ואת אגר העליון הרך. כל הפתרונות צריכים להיות מוכנים במיכלים המסוגלים להחזיק נפח כפול מהנפח הסופי כדי למנוע גלישה בזמן השעבוד האוטומטי.
הערה: אם מבצעים את ההסתה במשולש, הכינו כמות כפולה של אגר תחתון LB. - התאם את רמת ה-pH של כל שלושת הפתרונות ל-7.4 באמצעות NaOH או HCl לפי הצורך.
- הוסיפו 3 גרם כוח אגר לבקבוק אגר התחתון כדי ליצור תמיסה של 1.5% אגר לאגר המוצק
- הוסיפו 1.2 גרם של כוח אגר לבקבוק אגר העליון כדי להכין תמיסה של 0.6% אגר לאגר רך.
- מניחים את הבקבוקים, עם כובעים מהודקים למחצה, ב- autoclave להגדיר 121 מעלות צלזיוס במשך 20 דקות כדי לעקר את הפתרונות. סגור את המכסים ברגע שהריצה תסתיים כדי למנוע זיהום.
- כאשר מדיה LB הגיע לטמפרטורה של כ 45-50 מעלות צלזיוס, להוסיף 450 μL של סטרילי 1 M CaCl2 לכל שלושת פתרונות 200 mL LB כדי להפוך את הריכוז הסופי של 2.25 מ"מ.
- יוצקים 15 מ"ל עליקוטים של מדיום אגר מוצק לתוך מנות פטרי סטריליות (הימנעו מרעד כדי למנוע הקצפה) ואפשרו לאגר להתמצק במשך כמה שעות או לילה בטמפרטורת החדר(איור 4A). ניתן לאחסן צלחות במהופך ב-4 מעלות צלזיוס למשך מספר ימים.
- מערבבים 4 גרם LB במים מזוקקים 200 מ"ל, משולש, עבור מרק LB, אגר התחתון המוצק, ואת אגר העליון הרך. כל הפתרונות צריכים להיות מוכנים במיכלים המסוגלים להחזיק נפח כפול מהנפח הסופי כדי למנוע גלישה בזמן השעבוד האוטומטי.
- פולחן של תאים מארחים
- יום אחד לפני ההסתערות, להוסיף 10 μL של תרבות E. coli כדי 10 מ"ל של מרק LB.
- לדגור את החיידקים ב 37°C לילה ב 160 סל"ד באינקובטור רועד.
- בבוקר של ה- assay, להוסיף 0.5 מ"ל של תרבות הלילה כדי 10 מ"ל של LB טרי.
הערה: אם אתה מבצע את ההסתה במשולש, להכין כפול מהכמות של תרבות זו. - לדגור ב 37°C ב 160 סל"ד באינקובטור רועד עד שתרבית החיידקים היא בצמיחה שלב יומן. זה יכול להיקבע באופן ספקטרופוטומטרי על ידי OD600 של 0.5-0.7.
- שמור את התרבות בטמפרטורת החדר עד החיידקים הם להוסיף אגר LB העליון.
- דילול סדרתי פי 10 של בקטריופאג'
- הוסף 180μL של מרק LB לשבע בארות בשורה הראשונה של צלחת 96-well
הערה: מומלץ לבצע את הדילול בטריפליקאט על מנת להגביר את האמינות הסטטיסטית שלו. כדי לעשות זאת, להכין דילול נוסף של הבקטריופאג 'בשורות השנייה והשלישית של הצלחת. - בזהירות מערבולת מדגם הבקטריופאג המקורי כדי להבטיח הומוגניות ולהעביר 20 μL לתוך הבאר הראשונה.
- מערבבים היטב את הדגימה על ידי צנרת ולמטה.
- העבר 20 μL של ההשעיה המתקבלת לתוך הבאר השנייה.
- המשך הדילול הסדרתי על ידי העברת 20 μL של הפתרון בבאר השנייה לתוך הבאר השלישית, וכן הלאה, עד הבאר השישית, עוזב את השביעי גם שליטה שלילית שאליה לא יתווסף פאג'-השעיה. זה ייצור טווח דילול של 10-1-10-6.
- הוסף 180μL של מרק LB לשבע בארות בשורה הראשונה של צלחת 96-well
- ציפוי
- סמן את הבסיס של מנות פטרי (שהוכנו בעבר בשלב 2.1.7) עם שם, תאריך ותיאור מדגם קצר (כולל גורם דילול דגימת הפאג '). מחממים מראש את מנות הפטרי באינקובטור 37 מעלות שעה לפני ההסתה.
- ממיסים את אגר-מדיום רך מוצק (נעשה בדרך כלל באמצעות מיקרוגל; אגר מוצק נמס ב 85°C), ולתת לו להגיע סביב 45 מעלות צלזיוס. ניתן למקם את המדיה המחוממת באמבט מים בטמפרטורה של 45 מעלות צלזיוס למשך שעה אחת כדי להגיע לטמפרטורה מתאימה. זה צריך להיות חם מספיק כדי להישאר בצורה נוזלית, אבל מגניב מספיק כדי לא להרוג חיידקים הוסיף.
- ערבבו תרבית חיידקים של 4 מ"ל (משלב 2.2) עם אגר רך במשקל 35 מ"ל (ב-45 מעלות צלזיוס). מערבולת כדי להפיץ את התאים באופן שווה, אך להימנע מרעד כדי למנוע הקצפה (איור 4A).
- סמן מבחנה סטרילית אחת עבור כל אחד שלבי הדילול הסדרתיים ואחת לדגימת הבקרה, בסך הכל 7 מבחנות מסומנות. מניחים 5 mL aliquots של תערובת אגר חיידקי / אגר רך מ שלב 2.4.3 לתוך 7 צינורות. עבוד במהירות בשלב 2.4.6 מכיוון שנפחים קטנים כאלה של מדיה מבוססת אגר יתגבשו במהירות בטמפרטורת החדר.
- הוסף 100 μL של מדגם הבקרה (בשלב 2.3) למבחנת הבקרה והסתובב בזהירות. השליכו את קצה הפיפטה המשומש והעבירו את אותו נפח מכל אחת מדגימות הבקטריופאג' המדוללות באופן סדרתי (שלב 2.3) למבחנות המתאימות להן, מסתחררות לערבב.
- העבירו מיד את תערובות 5 מ"ל לצלחות אגר עם התווית, המחוממות מראש, המוצקות(איור 4A). מערבבים בעדינות את הצלחות כדי להפיץ את התערובות.
הערה: אם אתה מבצע את ההסתה במשולש, חזור על שלבים 2.4.3-6 פעמיים נוספות. - לאטום כל צלחת עם סרט מעבדה, ולאפשר לשתי השכבות להתמצק כראוי בטמפרטורת החדר (כ -15 דקות) לפני הצבתם כלפי מעלה כלפי מטה אינקובטור 37 מעלות צלזיוס, מגרה צמיחה של החיידקים והפאג ', במשך 24 שעות או עד פלאקים לפתח, זה בדרך כלל לוקח בערך 1-5 ימים עבור לוחות להופיע (איור 4B), אבל התזמון משתנה במידה ניכרת בהתאם לתנאי הדגירה, בינוני, ואת המינים החיידקיים.
3. ניתוח נתונים ותוצאות
-
ספירת לוחות
- ודא כי אין לוחות גלויים בלוחות המסומנים "שליטה", כמו זה יצביע על זיהום ויראלי.
- התחל עם הצלחות המסומנות 10-6, המכיל את דגימת הבקטריופאג ' המדוללת ביותר. לספור את הלוחות מבלי להסיר את המכסה, סימון אותם עם עט כמו שאתה הולך כדי לציין אילו לוחות כבר נספרו.
- תספור את הלוחיות הנותרות. כמה צלחות עשויות להיות מעט מדי או יותר מדי לוחות לספור. השתמש בצלחות עם 10-150 לוחות לניתוח נוסף.
-
חישוב PFU
- חלק את מספר הלוחות על ידי גורם הדילול,(למשל. 10-6 עבור המדגם המדולל ביותר) כדי להגביר את מספר יחידות יצירת פלאק (PFU) ב 100 μL של תערובת פאג '.
הערה: אם מבצעים את ההסתה בשלושה טריפלים, השתמשו במספר הממוצע של לוחות משלוש הצלחות. - כדי לקבוע את הריכוז (ב PFU / mL) של המדגם המקורי, להכפיל על ידי גורם דילול נוסף של 10, שכן רק 100 μL של מדגם היה מצופה.
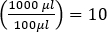 (כלומר)
(כלומר) - חשב את הערך הממוצע של PFU / mL עבור כל הדילולים שהיו בין 10 ל 150 לוחות כדי להשיג תוצאה אמינה יותר.
- חלק את מספר הלוחות על ידי גורם הדילול,(למשל. 10-6 עבור המדגם המדולל ביותר) כדי להגביר את מספר יחידות יצירת פלאק (PFU) ב 100 μL של תערובת פאג '.
Application and Summary
למרות ההתקדמות הטכנולוגית המרובה, תקן הפלאק נשאר תקן הזהב לקביעת טיטר ויראלי (כ- PFU) וחיוני לבידוד אוכלוסיות בקטריופאג 'טהורות. תאים מארחים רגישים מעובדים בשכבה העליונה של צלחת אגר דו שכבתית, ויוצרים מיטה הומוגנית המאפשרת שכפול ויראלי. האירוע הראשוני שבו בקטריופאג' מבודד במחזור חיים ליטי מדביק תא, משכפל בתוכו, ובסופו של דבר מתבודד ממנו, קטן מכדי לצפות בו. עם זאת, virions שוחרר ידביק תאים סמוכים, ולאחר מכן מעורר אזור סליקה, או פלאק, המציין את נוכחותו של PFU יחיד.
References
- Twort, F. An investigation on the nature of ultra-microscopic viruses. Lancet. 186 (4814): 1241-1243. (1915)
- d'Hérelle, F. An invisible antagonist microbe of dysentery bacillus. Comptes Rendus Hebdomadaires Des Seances De L Academie Des Sciences. 165: 373-375. (1917)
- Cisek AA, Dąbrowska I, Gregorczyk KP, Wyżewski Z. Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages. Current Microbiology. 74 (2):277-283. (2017)
- Mirzaei MK, Maurice CF. Ménage à trois in the human gut: interactions between host, bacteria and phages. Nature Reviews Microbiology. 15 (7):397. (2017)
- Breitbart M, Bonnain C, Malki K, Sawaya NA. Phage puppet masters of the marine microbial realm. Nature Microbiology. 3 (7):754-766. (2018)
- Leung CY, Weitz JS. Modeling the synergistic elimination of bacteria by phage and the innate immune system. Journal of Theoretical Biology. 429:241-252. (2017)
- Dulbecco R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proceedings of the National Academy of Sciences of the United States of America. 38 (8):747-752. (1952)
- Juarez D, Long KC, Aguilar P, Kochel TJ, Halsey ES. Assessment of plaque assay methods for alphaviruses. J Virol Methods. 187 (1):185-9. (2013)
- Clokie MRJ, Millard AD, Letarov AV, Heaphy S. 2011. Phages in nature. Bacteriophage. 1 (1):31-45. (2011)
- Moldovan R, Chapman-McQuiston E, Wu XL. On kinetics of phage adsorption. Biophys J. 93 (1):303-15. (2007)
- Garneau JE, Dupuis M-È, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S.. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320):67. (2010)
Tags
Skip to...
Videos from this collection:

Now Playing
פלאק אסאי: שיטה לקביעת טיטר ויראלי כיחידות יוצרות פלאק (PFU)
Microbiology
185.8K Views

מהם וירוסים
Microbiology
111.0K Views

מבנה ויראלי
Microbiology
60.8K Views

מחזור ליטי של בקטריופאג׳ים
Microbiology
69.7K Views

מחזור ליזוגני של בקטריופאג׳ים
Microbiology
61.3K Views

מחזורי חיים של רטרו-וירוסים
Microbiology
45.3K Views

שחלוף ויראלי
Microbiology
23.1K Views

מוטציות ויראליות
Microbiology
32.0K Views

זיהום
Microbiology
6.2K Views

תגובה חיסונית נגד פתוגנים נגיפיים
Microbiology
439 Views

פלאק אסאי: שיטה לקביעת טיטר ויראלי כיחידות יוצרות פלאק (PFU)
Microbiology
185.8K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved