斑块测定:确定病毒性皮石为斑块形成单位(PFU)的方法
Overview
资料来源:蒂尔德·安徒森1号,罗尔夫·卢德1
1临床科学隆德系,感染医学系,生物医学中心,隆德大学,221 00 隆德,瑞典
感染原核生物的病毒,称为噬菌体或简称噬菌体,在20世纪初由Twort(1)和d'Hérelle(2)独立发现。自那时以来,噬菌体因其治疗价值(3)及其对人类(4)以及全球生态系统(5)的影响而得到广泛认可。目前的关切促使人们重新关注使用噬菌体作为现代抗生素替代治疗传染病的方法(6)。基本上,所有的噬菌体研究都依赖于纯化和量化病毒的能力,也称为病毒性小子。最初描述在1952年,这是斑块测定的目的(7)。几十年后,多项技术进步,斑块测定仍然是确定病毒性牙点(8)的最可靠的方法之一。
噬菌体通过将遗传物质注入宿主细胞,劫持机器来生产新的噬菌体颗粒,并最终导致宿主通过细胞解释释放许多后代病毒。由于其微小的大小,噬菌体不能只用光显微镜观察;因此,扫描电子显微镜是必需的(图1)。此外,噬菌体不能像细菌一样在营养琼脂板上培养,因为它们需要宿主细胞来捕食。

图1:噬菌体形态,这里以大肠杆菌噬菌体为例子,可以用扫描电子显微镜进行研究。大多数噬菌体属于考多病毒(尾噬菌体)。这种特殊的噬菌体有一个很短的尾巴结构和一个食道头,把它放在波多病毒家族。
斑块测定(图2)基于将宿主细胞(优先用于对数相生长)并入培养基。这创造了一个密集,浑浊的细菌层,能够维持病毒生长。分离的噬菌体随后可以感染、在一个细胞内复制和分莱。每个分莱细胞,多个相邻的细胞立即被感染。在几个周期中,在原本浑浊的板块中可以观察到一个清晰的区域(斑块),表明最初是单个噬菌体粒子的存在。因此,样品每体积(即PFU/mL)的斑块形成单位数量可以从产生的斑块数量中确定。
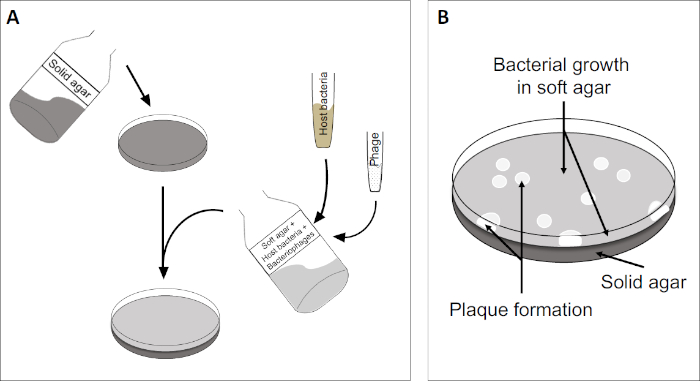
图2:检测斑块形成单元(PFU)是确定样品中噬菌体数量的常见方法。(A)无菌培养皿的基底覆盖着适当的固体营养介质,然后是软培养基、易感宿主细胞的混合物和原噬菌体样本的稀释。请注意,在某些情况下,噬菌体悬浮液也可以均匀地分布在已经凝固的软琼脂表面。(B)宿主细菌的生长在琼脂层形成细胞草坪。噬菌体复制产生由宿主细胞解致引起的透明区域或斑块。
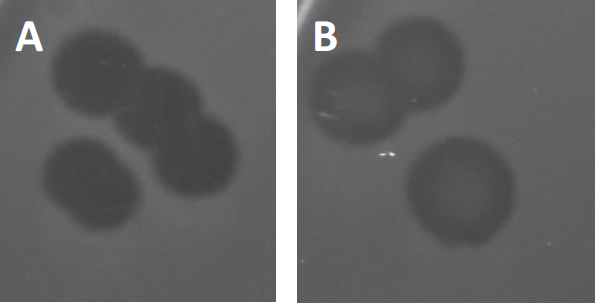
图3:PFU测试结果显示,噬菌体产生的多斑块。由于易感宿主细胞的赖清,斑块可被视为细菌草坪上的清除区,要么具有(A)完全清除,要么(B)由产生耐药细菌(或可能是由耐温噬菌体)引起的部分再生致源循环)。
除了以前描述的溶血生长外,某些温带噬菌体可以采用所谓的溶源性生命周期。在地合体中,病毒通过将其遗传物质纳入宿主细胞(9)的基因组而假定为潜伏状态,这通常对进一步的噬菌体感染具有抵抗力。这有时通过斑块的轻微云彩(图3B)来揭示。然而,值得注意的是,斑块也可能显得模糊,由于细菌的再生长,已经进化了抵抗噬菌体,独立于以前的噬菌体感染。
病毒可以附着或吸附,只有有限的宿主细菌(10)。宿主范围受到细胞内抗病毒策略(如CRISPR-Cas系统(11)的进一步限制。细菌亚群对特定噬菌体表现出的抗药性/敏感性历来被用来将细菌菌株分类为不同的噬菌体类型(图4)。虽然这种方法的有效性现已被新的测序技术所超越,但噬菌体类型仍然可以提供有关细菌-噬菌体相互作用的宝贵信息,例如,促进为临床使用设计噬菌体鸡尾酒.

图4:不同细菌菌株的噬菌体敏感性。软琼脂板与可爱痤疮菌株(A)AD27和(B)AD35,被发现与21种不同的C.痤疮噬菌体。只有噬菌体11能够感染和杀死AD27,而AD35菌株对所有噬菌体表现出敏感性。这种技术,称为噬菌体类型,可用于根据噬菌体易感性将细菌种类和菌株分成不同的亚群。
Procedure
1. 设置
- 在开始任何涉及微生物的工作之前,请确保工作空间已消毒(例如,用 70% 乙醇擦拭)。始终穿着实验室外套和手套,保持长发绑在背上,并确保任何伤口都特别好保护。
- 完成后,对所有表面进行消毒,彻底清洗/消毒手和手腕。
2. 议定书
- LB 介质准备
注意:根据宿主细菌菌株和噬菌体的不同,不同的液体介质可能更适合于宿主细菌菌株的初始培养,或者不同的固体介质可能更适合后续生长。莱索根汤 (LB) 用于此协议中的肉汤和琼脂。- 混合 4 g LB 在 200 mL 蒸馏水中,在三重,为 LB 肉汤, 固体底部琼脂, 和软顶部琼脂.所有解决方案都应在容器中制备,其容量应为最终体积的两倍,以防止高压灭菌时溢出。
注意:如果以三重分法执行测定,则准备将 LB 底部琼脂的量翻倍。 - 根据需要,使用 NaOH 或 HCl 将所有三种解决方案的 pH 量调整为 7.4。
- 在底部琼脂瓶中加入 3 g 的琼脂能量,为固体琼脂制作 1.5% 的琼脂溶液
- 在顶部琼脂瓶中加入 1.2 g 的琼脂能量,使软琼脂的琼脂溶液为 0.6%。
- 将装有半紧固盖的瓶子放入设定为 121°C 的高压灭菌器中 20 分钟,对溶液进行消毒。运行完成后立即关闭盖子,以防止污染。
- 当 LB 介质温度达到约 45-50°C 时,在 200 mL LB 溶液中加入 450 μL 无菌 1 M CaCl2,最终浓度为 2.25 mM。
- 将固体琼脂介质的15 mL等分倒入无菌培养皿中(避免晃动以防止发泡),让琼脂在室温下凝固数小时或过夜(图4A)。板材可在4°C上下倒存储数天。
- 混合 4 g LB 在 200 mL 蒸馏水中,在三重,为 LB 肉汤, 固体底部琼脂, 和软顶部琼脂.所有解决方案都应在容器中制备,其容量应为最终体积的两倍,以防止高压灭菌时溢出。
- 宿主细胞的培养
- 在测定前一天,将10μL的大肠杆菌培养剂加入10 mL的LB汤中。
- 在摇动的培养箱中,在37°C下以160rpm在160rpm下孵育细菌。
- 在测定的早晨,将0.5 mL的过夜培养添加到10 mL的新鲜LB中。
注意:如果要在三次测定中执行测定,请准备此区域性的两倍。 - 在摇动的培养箱中以160rpm在37°C下孵育,直到细菌培养处于对数阶段生长。这可以通过 0.5-0.7 的 OD600 分光度来确定。
- 将培养物保持在室温下,直到细菌被添加到顶部 LB 琼脂。
- 噬菌体10倍的连续稀释
- 将 180μL 的 LB 肉汤添加到 a 第一行的 7 口井中,以 96 孔板
注意:建议对三联产品进行稀释,以提高其统计可靠性。为此,在板的第二行和第三行准备噬菌体的额外稀释剂。 - 小心地涡涡原噬菌体样品,以确保均匀性,并将20μL转移到第一口井中。
- 通过移液和向下混合样品。
- 将产生的悬浮液的 20 μL 转移到第二口井中。
- 继续连续稀释,将第二口井中的20μL溶液转移到第三口井,等等,直到第六口井,留下第七口和负对照,不会添加噬菌体悬浮液。这将创建 10-1 -10-6的稀释范围。
- 将 180μL 的 LB 肉汤添加到 a 第一行的 7 口井中,以 96 孔板
- 电镀
- 用名称、日期和简短的样品描述(包括噬菌体样品稀释因子)标记培养皿的底座(以前在步骤 2.1.7 中准备)。在测定前一小时在37°C培养箱中预热培养皿。
- 融化凝固的软琼脂介质(通常使用微波进行;凝固的琼脂在85°C下熔化),并让它接近45°C。加热介质可置于 45°C 水浴中,约 1 小时,达到适当的温度。它应该足够热,以保持液体形式,但足够凉爽,不杀死添加的细菌。
- 将 4 mL 细菌培养物(从步骤 2.2 起)与 35 mL LB 软琼脂混合(在 45°C 下)。旋转均匀分布细胞,但避免晃动,以防止发泡 (图4A)。
- 为每个连续稀释步骤标记一个无菌试管,为控制样品标记一个无菌试管,总共标记 7 个试管。将细菌培养剂/软琼脂混合物的5 mL等分从步骤2.4.3放入7管中。通过步骤 2.4.6 快速工作,因为这种小体积的基于琼脂的介质将在室温下迅速凝固。
- 将 100 μL 的控制样本(从步骤 2.3)添加到控制试管中,并小心旋转。丢弃用过的移液器尖端,并将相同的体积从每个序列稀释的噬菌体样品(步骤 2.3)传输到各自的试管,旋转混合。
- 立即将 5 mL 混合物转移到贴有标签的预热固体琼脂板上(图4A)。轻轻旋转板,甚至分散混合物。
注意:如果要在三重中执行测定,请重复步骤 2.4.3-6 两次。 - 用实验室薄膜密封每个板,并在室温下(约15分钟)使两层正确凝固,然后再将其从37°C培养箱上侧放置,刺激细菌和噬菌体的生长,持续24小时或直到斑块发育,它通常需要大约1-5天的斑块出现(图4B),但时间差异很大,取决于孵育条件,培养和细菌物种。
3. 数据分析和结果
-
计数斑块
- 确保标有"控制"的板中看不到斑块,因为这将表示病毒污染。
- 从标有10-6的板开始,含有最稀释的噬菌体样本。在不取下盖子的情况下对斑块进行计数,在进行标记时用笔标记它们,以指示哪些斑块已计数。
- 计算剩余的盘子。有些盘子的斑块可能太少或太多,无法计数。使用带有 10-150 块板的板进行进一步分析。
-
计算 PFU
- 将斑块数量除以稀释系数(例如,最稀释样品的10-6),以获得100μL噬菌体混合物中的斑块形成单位(PFU)数量。
注意:如果以三联形式执行测定,则使用三个板的平均斑块数。 - 要确定原始样品的浓度(以PFU/mL为单位),再乘以10的额外稀释系数,因为只镀了100μL的样品。(
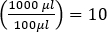 即)
即) - 计算具有 10 到 150 块斑块的所有稀释液的 PFU/mL 的平均值,以获得更可靠的结果。
- 将斑块数量除以稀释系数(例如,最稀释样品的10-6),以获得100μL噬菌体混合物中的斑块形成单位(PFU)数量。
Application and Summary
尽管多项技术进步,斑块测定仍然是测定病毒性牙酸盐(作为PFU)的黄金标准,对纯噬菌体种群的分离至关重要。易感宿主细胞在两层琼脂板的上部涂层中培养,形成均匀的床,实现病毒复制。在溶质生命周期中分离的噬菌体感染细胞,在细胞内复制并最终将其解伤的初始事件太小,无法观察。然而,释放的病毒会感染相邻的细胞,随后产生一个清除区,或斑块,表示存在单个PFU。
References
- Twort, F. An investigation on the nature of ultra-microscopic viruses. Lancet. 186 (4814): 1241-1243. (1915)
- d'Hérelle, F. An invisible antagonist microbe of dysentery bacillus. Comptes Rendus Hebdomadaires Des Seances De L Academie Des Sciences. 165: 373-375. (1917)
- Cisek AA, Dąbrowska I, Gregorczyk KP, Wyżewski Z. Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages. Current Microbiology. 74 (2):277-283. (2017)
- Mirzaei MK, Maurice CF. Ménage à trois in the human gut: interactions between host, bacteria and phages. Nature Reviews Microbiology. 15 (7):397. (2017)
- Breitbart M, Bonnain C, Malki K, Sawaya NA. Phage puppet masters of the marine microbial realm. Nature Microbiology. 3 (7):754-766. (2018)
- Leung CY, Weitz JS. Modeling the synergistic elimination of bacteria by phage and the innate immune system. Journal of Theoretical Biology. 429:241-252. (2017)
- Dulbecco R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proceedings of the National Academy of Sciences of the United States of America. 38 (8):747-752. (1952)
- Juarez D, Long KC, Aguilar P, Kochel TJ, Halsey ES. Assessment of plaque assay methods for alphaviruses. J Virol Methods. 187 (1):185-9. (2013)
- Clokie MRJ, Millard AD, Letarov AV, Heaphy S. 2011. Phages in nature. Bacteriophage. 1 (1):31-45. (2011)
- Moldovan R, Chapman-McQuiston E, Wu XL. On kinetics of phage adsorption. Biophys J. 93 (1):303-15. (2007)
- Garneau JE, Dupuis M-È, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S.. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320):67. (2010)
Tags
跳至...
此集合中的视频:

Now Playing
斑块测定:确定病毒性皮石为斑块形成单位(PFU)的方法
Microbiology
185.7K Views

创建维诺格拉茨基柱:在沉积物样本中丰富微生物物种的方法
Microbiology
128.3K Views

连续稀释和电镀:微生物枚举
Microbiology
314.1K Views

富集培养:在选择性和微分介质上培养有氧和厌氧微生物
Microbiology
131.8K Views

纯培养和条纹电镀:从混合样品中分离单一细菌菌落
Microbiology
165.7K Views

16S rRNA测序:基于PCR的技术,用于识别细菌物种
Microbiology
188.0K Views

生长曲线:使用菌落成形单位和光学密度测量生成生长曲线
Microbiology
293.3K Views

抗生素敏感性测试:Epsilo计测试,以确定两种抗生素的MIC值,并评估抗生素协同效应
Microbiology
93.5K Views

显微镜和染色:革兰克、胶囊和内孔染色
Microbiology
362.5K Views

使用自适应氯化钙程序对大肠杆菌细胞的转化
Microbiology
86.3K Views

结合:将阿霉素耐药性从捐赠者转移到受体大肠杆菌的方法
Microbiology
38.1K Views

噬菌体转导:将氨基青霉素耐药性从捐赠者转移到受体大肠杆菌的方法
Microbiology
28.9K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。