מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Overview
מקור: תומאס צ'אפי1, תומאס ס גריפית2,3,4, וקתרין ל. שוורטפיגר1,3,4
1 המחלקה לרפואת מעבדה ופתולוגיה, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
2 המחלקה לאורולוגיה, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
3 מרכז הסרטן הבונים החופשיים, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
4 המרכז לאימונולוגיה, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
ניתוחים פתולוגיים של מקטעי רקמות יכולים לשמש כדי לקבל הבנה טובה יותר של מבנה רקמות נורמלי ולתרום להבנתנו את מנגנוני המחלה. ביופסיות רקמות, בין אם מחולים או ממודלים ניסיוניים ב- vivo, נשמרות לעתים קרובות על ידי תיקון בפורמלין או paraformaldehyde והטבעה שעוות פרפין. זה מאפשר אחסון לטווח ארוך עבור הרקמות להיות חתך. רקמות נחתכות למקטעים דקים (5 מיקרומטר) באמצעות מיקרוטום והמקטעים דבקים בשקופיות זכוכית. מקטעי הרקמות יכולים להיות מוכתמים בנוגדנים, המאפשרים זיהוי של חלבונים ספציפיים בתוך מקטעי הרקמה. כתמים בנוגדנים הצמודים לפלורופורים (הידועים גם בשם פלואורוכרום) - תרכובות הפולטות אור באורכי גל ספציפיים כאשר הם מתרגשים מלייזר - ידועה בשם אימונופלואורסצנטיות. היכולת לזהות חלבונים בתוך סעיף יכולה לספק מידע כגון הטרוגניות של סוג התא בתוך הרקמה, הפעלה של מסלולי איתות ספציפיים וביטוי של סמנים ביולוגיים. בהתאם פלואורופורים בשימוש וסוג של מיקרוסקופ זמין לניתוח, צבעים מרובים ניתן להשתמש, המאפשר ניתוח multiplexed של מטרות.
הפרוטוקול הבא מתאר את הצעדים הבסיסיים הכרוכים בהכתמת אימונופלואורסצנטיות של מקטעי רקמות מוטבעים בפרפין. חשוב לציין כי פרוטוקול זה לא יכלול פרטים על קיבוע הרקמה, תהליך הטמעת פרפין או חתך של הרקמות. לאחר רקמות כבר חתך והונח על שקופיות זכוכית, הם rehydrated באמצעות סדרה של דגירות אתנול מדורג (EtOH). החלקים הם דגירה עם ריאגנט חסימה כדי להפחית כריכה לא ספציפית של נוגדן לחלק הרקמה. לאחר מכן, החלקים מסומנים בנוגדן ראשוני שעשוי או לא יכול להיות מתויג ישירות עם פלואורופור. אם הנוגדן העיקרי אינו מסומן ישירות, החלקים הם דגירה עם נוגדן משני שכותרתו פלואורופור. נוגדנים שונים עשויים לדרוש תנאי הכתמה שונים, ולכן הצעות לאופטימיזציה של נוגדנים כלולים. לאחר הכביסה כדי להסיר את כל הנוגדנים הלא מאוגדים, השקופיות מותקנות עם מדיה המכילה DAPI כדי לתייג את הגרעין באופן פלואורסצנטי. לאחר שהמדיה ההרכבה התייבשה, ניתן לדמיין את השקופיות באמצעות מיקרוסקופ עם לייזרים שיכולים לזהות את הפלורופורים השונים.
Procedure
1. הגדרת
- פרוטוקול הכתמים הטיפוסי כולל את השלבים הבאים:
- לחות מחדש של מקטעי הרקמות בשקופיות באמצעות סדרה של אתנולים מדורגים.
- דגירה של מקטעי הרקמה עם חוצץ חסימה, אשר יסייע לחסום כריכה לא ספציפית של נוגדן לרקמה ולהפחית פלואורסצנטיות ברקע.
- הסרת מאגר החסימה ודגורת החלק בנוגדן העיקרי, ואז הנוגדן יקשור את מטרת הפפטיד שלו.
- הסרת הנוגדן העיקרי ושטיפת החלקים בהרחבה במאגר הכביסה.
- דגירה של החלקים בנוגדן משני כדי לאפשר כריכה לנוגדן ראשוני, אם הנוגדן העיקרי אינו מסומן ישירות עם פלואורופור ונוגדן משני נדרש.
- שוטף את הנוגדן המשני מהמגלשות.
- הרכבת השקופיות במדיה הרכבה ומאפשרת להם להתייבש לפני הדמיה על מיקרוסקופ פלואורסצנטי.
- הפריטים הבאים נדרשים: מחזיקי שקופיות (זכוכית או פלסטיק), צנצנות, פיפטות, עט פאפ, תא לח, פתקי כיסוי ומדיה הרכבה עם DAPI.
- קסילן משמש להתייבשות של שקופיות. קסילן מסוכן ויש להשתמש בו במכסה אדים יחד עם PPE מתאים, כולל כפפות וחלוק מעבדה.
- מתכונים למאגרים, פתרונות ות reagents
-
אתנולים מדורגים
אתנול - 160 מ"ל 200 הוכחה EtOH ו 40mL ddH2O
אתנול - 140 מ"ל 200 הוכחה EtOH ו 60mL ddH2O -
פתרון אחזור אנטיגן
10 מ"מ נתרן סיטראט, pH 6.0 -
חוסם מאגר
סרום 100 μL מן החיה המארחת שממנו נוגדן משני נעשה
900 מיקרול 1X PBS
הערה: זהו אמצעי האחסון עבור 10 מקטעים; כוונן את עוצמת הקול עבור כ- 100 מאגר μL לכל מקטע, לפי הצורך. - מאגר כביסה (1X PBS)
-
אתנולים מדורגים
2. פרוטוקול
- התייבשות עם קסילן ואתנולים
- מקם שקופיות לתוך מחזיק שקופיות ולאחר מכן הטביע את השקופיות בפתרון 100% קסילן isomers, להבטיח כי השקופיות מכוסות לחלוטין עם פתרון.
- מגלשות דגירה ב-100% האיסומרים של קסילן למשך 3 דקות. חזור פעמיים עבור סך של 3 דגירה נפרדת. הקפד לנגב את מתלה השקופיות במגבת נייר לפני המעבר לפתרון חדש כדי למזער את הזיהום.
הערה: מומלץ כי דגירה זו מבוצעת בשלוש מכולות נפרדות. - דגירה שקופיות ב 100% EtOH במשך 2 דקות. חזור פעמיים עבור סך של 3 דגירה נפרדת.
הערה: מומלץ כי דגירה זו מבוצעת בשלוש מכולות נפרדות. - דגירה שקופיות ב 95% EtOH במשך 2 דקות.
- דגירה שקופיות ב 80% EtOH במשך 2 דקות.
- דגירה שקופיות ב 70% EtOH במשך 2 דקות.
- דגירה שקופיות ב 1X PBS במשך 5 דקות.
- (אופציונלי) אחזור אנטיגן כדי לחשוף אפיטופים מזוהה על ידי הנוגדן העיקרי
הערה 1: הליך זה תלוי מאוד בנוגדן המשמש ומומלץ לבצע הליכי מיטוב ראשוניים כדי לקבוע את הדרישה לאחזור אנטיגן.
הערה 2: הליך זה לא בוצע עם כתמי F4/80 המוצגים להלן. יש למטב את הדרישה לאחזור אנטיגן עם כל נוגדן חדש.- הנח שקופיות במחזיק מגלשות פלסטיק או זכוכית עמיד בחום, והבטח שהמתלה מלא במגלשות כדי להבטיח חלוקת חום אחידה. ניתן להשתמש בשקופיות ריקות אם יש פחות דוגמאות מאשר חריצים בארון התקשורת.
- מקם ארון תקשורת ב 1000 מל של פתרון אנטיגן ללא חצייה ב 2L - 10 מל אנטיגן ללא חצייה מלאי כדי 990mL מים.
- מיקרוגל על גבוה במשך 20 דקות בסך הכל, לוודא שקופיות להישאר מכוסה במים.
- מצננים שקופיות במשך 20 דקות בכלוב.
- לשטוף את ארון התקשורת של השקופיות במחזיקי שקופיות המכילים ddH2O למשך 5 דקות כל אחד. יש לחזור פעמיים על הפעולה עבור 3 דגרות נפרדות באמצעות ddH2O טרי בכל פעם. ניתן לשטוף את השקופיות באותו מחזיק שקופיות במהלך כל שטיפה.
- דגירה שקופיות ב 1X PBS במשך 5 דקות.
- עיגול מקטעים עם עט פאפ. זה יאפשר שימוש בנפח מינימלי של חוצצים הדרושים כדי לכסות את מקטעי הרקמה. אין לאפשר לחלקי רקמות להתייבש.
- הוסף מאגר חסימה לכל מקטע. כמות המאגר הדרושה לכיסוי המקטע תשתנה בהתאם לגודל המקטע אך עשויה לנוע בין 25-500 μL. יש להשתמש במאגר מספיק כדי ליצור חרוז המכסה את כל משטח המקטע כולל הקצוות.
הערה: הבחירה של חסימת מאגר עשויה להשתנות בהתאם לנוגדן הנמצא בשימוש. לדוגמה, 10% סרום מן החיה המארחת שבה הנוגדן המשני הועלה עשוי לשמש כדי להפחית כריכה לא ספציפית של הנוגדן המשני (לדוגמה, סרום עז רגיל יכול לשמש אם הנוגדן המשני גדל בעז). מיטוב של מאגר חסימה צריך להתבצע עבור כל נוגדן ראשי. כדי להכתים חלקי גידול מאמרי עם F4/80, 0.1 מ"ל של 10% סרום עזים רגיל PBS שימש. - לדגור על החלקים בחסימת חוצץ בתא לח במשך שעה אחת בטמפרטורת החדר או 4 מעלות צלזיוס עד 24 שעות. התא הלח מבטיח שהמקטעים לא יתייבשו.
- הסר את מאגר החסימה על-ידי ניקוזו מהשקופית. לחלופין, ניתן להסיר את מאגר החסימה באמצעות פיפטה, אם כי הדאג לא לגעת בסעיף עם קצה הפיפטה.
- לדלל את הנוגדן העיקרי בחסימת מאגר.
הערה: הדילול הנכון יצטרך להיקבע עבור כל נוגדן וסוג מדגם. אופטימיזציה תכלול ביצוע סדרה של דילול כדי לזהות כתמים אופטימליים. כדי להכתים מקטעי גידול במלאית עם F4/80, מקטעי רקמות דוגרו בן לילה ב 4°C ב 0.1 מ"ל חולדה נגד F4/80 נוגדן מדולל 1:100 ב 1% סרום עז נורמלי PBS. - מוסיפים את הנוגדן העיקרי לכל מקטע ודגרים בתא לח עד 16 שעות (לילה) ב-4 מעלות צלזיוס. השאר לפחות מקטע אחד במאגר חסימה ללא נוגדן ראשוני שישמש כפקד, אשר יסייע לזהות כריכה לא ספציפית על ידי הנוגדן המשני.
- רוקן את הנוגדן הראשי או את מאגר החסימה מהקטע, ושטוף מקטעים עם PBS על-ידי הצבת שקופיות בארון תקשורת של שקופיות והצבת מחזיק שקופיות עם PBS 1x. לשטוף 3 פעמים במשך 10 דקות בכל פעם.
- לדלל את הנוגדן המשני 1: 200 בחסימת מאגר. הדילול יכול להיות ממוטב בהתאם לנוגדן המשני.
- מוסיפים את הנוגדן המשני לכל המקטעים, כולל השליטה, ודגור במשך שעה בתא לח המוגן מפני אור.
- מסננים את הנוגדן המשני מהחלקים, ושטפים 3 פעמים ב- PBS במשך 10 דקות בכל פעם.
- הוסף 2-3 טיפות של מדיה הרכבה המכיל DAPI לשקופיות והנח כיסוי על הדגימות. אם המדיה הרכבה אינה סוג ייבוש מהיר של מדיה, ייתכן שיהיה צורך לאטום את הקצוות של השקופית עם שעוות פרפין מומסת או לק ציפורניים כדי למנוע דליפה ולשמור על הדגימות לטווח ארוך.
- אפשר לשקופיות להתייבש למשך הלילה בחושך, וצלם את המקטעים באמצעות מיקרוסקופ פלואורסצנטי.
3. ניתוח נתונים ותוצאות
- מקטעים מוכתמים מנותחים באמצעות מיקרוסקופ פלואורסצנטי. הפרטים הספציפיים של לכידת תמונה וניתוח יהיו תלויים במפרטים של המיקרוסקופ והתוכנה המשמשת לביצוע הניתוח. בדרך כלל, ניתן להצלים תמונות כתמונות בצבע בודד וחופפות ליצירת תמונות מרובות צבעים. ניתן לכמת תאים חיוביים באחוזים על-ידי ספירת מספר התאים שהוכתמו באופן חיובי וחלוקה במספר הכולל של תאים מוכתמים ב- DAPI בתוך מקטע. עבור F4/80 כתמים של מקטעי גידול מאמרי, באמצעות חבילת יישום לייקה התוכנה, גירסה 3.8, תחת הכרטיסיה רכישה ובמצב רכישת שכבת-על תמונה, DAPI ו- RFP היו שניהם זמינים. חשיפה, רווח וגאמה הותאמו (20.0 מיל', 1.0x ו- 1.53 בהתאמה עבור DAPI ו- 944.2 מיל'ור, 1.0x ו- 1.08 בהתאמה עבור RFP), אם כי הדבר משתנה בין ניסויים. לחצן 'רכוש שכבת-על' שימש ליצירת תמונות שכבת-על של חשיפות DAPI ו- RFP.
- התמונה שלהלן (איור 1) מציגה תמונה חיסונית לדוגמה של קטע גידול המוכתם ב- F4/80, המזהה אנטיגן על מקרופאגים ותאי מיאלואיד אחרים. המקטע נטען באמצעות מדיית הרכבה המכילה DAPI והגרעין מוצג בכחול.
Results
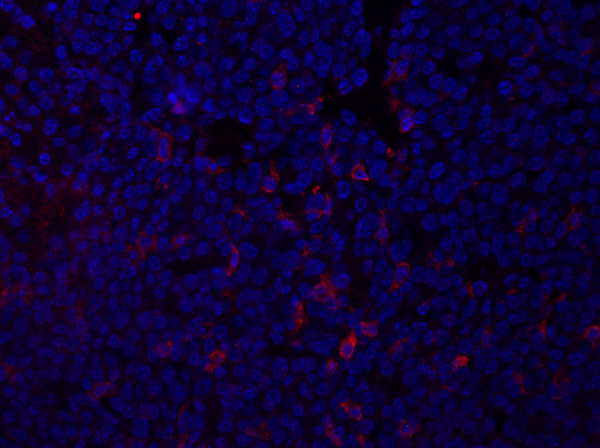
איור 1:כתמי F4/80 של גידול בממארי. לאחר הקיבעון, גידול ממארי עכבר היה חתך ומוכתם עם אנטי F4/80 והותקן באמצעות מדיה הרכבה המכילה DAPI. כתמים מוצגים על ידי משטח התא F4/80 מכתים באדום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הנתונים המתקבלים מההדמיה יספקו מידע על עוצמת ולוקליזציה של הביטוי של חלבון העניין בתוך סעיף הרקמה. בהתאם לחלבון הנבדק, נתונים אלה יכולים גם לספק מידע לגבי התדירות של אוכלוסיות תאים ספציפיות בתוך קטע הרקמה. ניתן לכמת זאת על ידי ספירת מספר התאים המוכתמים באופן חיובי והשוואה עם אוכלוסיית התאים הכוללת.
Application and Summary
אימונופלואורסצנטיות מאפשרת לחקור ביטוי חלבון ולוקליזציה בהקשר של קטע רקמות. טכניקה זו יכולה לשמש כדי להבין כיצד רקמות משתנות בהקשר של המחלה על ידי בחינת לוקליזציה של חלבון או מספר תאים ברקמות רגילות ומחלות. ניתן לקבוע ולקשר שינויים בשינויים בתבניות ביטוי או בתבניות ביטוי לתכונות ספציפיות של הדגימות.
References
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Tags
Skip to...
Videos from this collection:

Now Playing
מיקרוסקופיה חיסונית: כתמי אימונופלואורסצנטיות של מקטעי רקמות משובצים בפרפין
Immunology
53.9K Views

ציטומטריית זרימה ומיון תאים המופעלים על-ידי פלואורסצנטיות (FACS): בידוד של לימפוציטים מסוג Splenic B
Immunology
93.2K Views

מיון תאים המופעל מגנטי (MACS): בידוד של לימפוציטים T תימיים
Immunology
23.0K Views

אליסה אסייס: עקיפה, כריך ותחרותי
Immunology
239.1K Views

אליספוט אסאי: זיהוי של IFN-γ הפרשת טחול
Immunology
28.8K Views

אימונוהיסטוכימיה ואימונוציטוכימיה: הדמיית רקמות באמצעות מיקרוסקופיה קלה
Immunology
79.1K Views

יצירת נוגדנים: ייצור נוגדנים חד שבטיים באמצעות היברידיות
Immunology
43.6K Views

מיקרוסקופיית פלואורסצנטיות קונפוקלית: טכניקה לקביעת לוקליזציה של חלבונים בפיברובלסטים של עכברים
Immunology
43.3K Views

טכניקות מבוססות אימונופרציפיטציה: טיהור חלבונים אנדוגניים באמצעות חרוזי אגרוז
Immunology
87.8K Views

ניתוח מחזור התא: הערכת התפשטות תאי CD4 ו- CD8 T לאחר גירוי באמצעות כתמי CFSE וציטומטריית זרימה
Immunology
24.3K Views

העברת תאים מאמצת: הצגת טחול עכבר תורם לעכבר מארח והערכה של הצלחה באמצעות FACS
Immunology
22.5K Views

ת לבדיקת מוות בתא: כרום שחרר את ההסתה של היכולת הציטוטוקסית
Immunology
151.4K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved