מבנה פרוקן
Overview
מקור: תמרה מ. פאוורס, המחלקה לכימיה, אוניברסיטת טקסס A&M
בשנת 1951, קיילי ופאוסון דיווחו לטבע על סינתזה של תרכובת אורגניומטלית חדשה, פרוקן. 1 בדו"ח המקורי שלהם, פאוזון הציע מבנה עבור פרוקן שבו הברזל הוא מקשר בסינגל (קשרים סיגמא) לאטום פחמן אחד של כל ליגנד ציקלופנטדין(איור 1, מבנה I). 1,2,3 דו"ח ראשוני זה הוביל לעניין נרחב במבנה של פרוקן, ומדענים מובילים רבים השתתפו בהבהרה המבנה של מולקולה חדשה ומעניינת זו. וילקינסון ווודוורד מיהרו להציע פורמוליזציה חלופית שבה הברזל "תקוע" בין שני ליגנדים ציקלופנטיים, עם כריכה שווה לכל 10 אטומי הפחמן(איור 1, מבנה II). 4 כאן, נסנתז פרוקן ונחליט, בהתבסס על נתונים ניסיוניים (IR ו- 1H NMR), איזה ממבנים אלה נצפה. בנוסף, נלמד את האלקטרוכימיה של פרוקן על ידי איסוף וולטמוגרם מחזורי. במהלך ניסוי זה, אנו מציגים את כלל 18 האלקטרונים ודנים בספירת אלקטרונים ערכית עבור מתחמי מתכת מעבר.
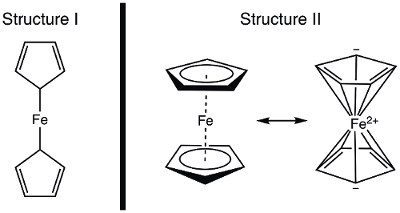
איור 1. שני מבנים מוצעים של פרוקן.
Principles
כלל 18 אלקטרונים וספירת אלקטרונים ערכית כוללת:
בעת ציור מבני נקודות לואיס, חשוב לזכור את כלל השמינייה, הקובע כי אטומים של יסודות הקבוצה העיקריים יש 8 אלקטרונים במעטפת הערכיות שלהם. עם זאת, כלל התמנון אינו מחזיק עבור מתכות מעבר, אשר יש תשעה מסלולי הערכה (אחד s, שלושה p, וחמישה d מסלולית) ובכך יכול להכיל עד 18 אלקטרונים. לכן, כלל של 18 אלקטרונים חל על מתחמי מתכת מעבר. כמו כלל השמינין, ישנם יוצאים מן הכלל לכלל 18 האלקטרונים, אך באופן כללי, מתחמי מתכת מעבר עם 18 אלקטרונים ערכיים נחשבים לתרכובות יציבות מאוד.
ישנן שתי שיטות שניתן להשתמש בהן כדי לקבוע את ספירת האלקטרונים הערכית הכוללת של קומפלקס מתכת מעבר: המודל היוני (הטעון) והמודל הקוולנטי (הניטרלי). 5 יישום נכון של כל שיטה צריך להוליד את אותה ספירת אלקטרונים כוללת. שני הדגמים משתמשים בשלושה סיווגי ליגנד הנקראים סוגי X, L ו- Z. כל סוג ליגנד תורם מספר שונה של אלקטרונים לספירת האלקטרונים הכוללת ותלוי בשיטה בה נעשה שימוש. ליגנדים מסוג X כוללים קבוצות אניון כגון הלידים, הידרוקסיד ואלחוקסידים. ליגנדים מסוג L כוללים תורמים בודדים כגון אמינים ופוספינים. לבסוף, ליגנדים מסוג Z הם מקבלי זוגות אלקטרונים; לכן, ליגנדים מסוג Z הם חומצות לואיס נייטרליות, כגון BR3. נשקול את המולקולה Co(NH3)3Cl3 כדי להדגים את שתי השיטות (איור 2).

איור 2. דוגמה לספירת אלקטרונים, Co(NH3)3Cl3.
מודל יוני:
ראשית, תן דעתך למספר האלקטרונים שתרמו האטום המרכזי. Co נמצא בקבוצה 9 של הטבלה המחזורית ולכן יש לו 9 אלקטרונים ערכיים. במודל היוני, יש לקחת בחשבון את מצב החמצון של המתכת. מאז מצב החמצון של Co ב Co(NH3)3Cl3 הוא +3, המספר הכולל של אלקטרונים ערכיים תרמו על ידי המתכת במודל יוני הוא 6 e−(טבלה 1). במודל היוני, ליגנדים מסוג X ו-L תורמים 2 e− לספירת האלקטרונים הכוללת, בעוד שליגנדים מסוג Z אינם תורמים אלקטרונים. לדוגמה Co(NH3)3Cl3,ישנם שני סוגי ליגנד נוכחים. Cl הוא ליגנד מסוג X ו- NH3 הוא ליגנד מסוג L. באמצעות המודל היוני, ספירת האלקטרונים הכוללת היא 18 e− (טבלה 1).
טבלה 1. e− ספירה של Co(NH3)3Cl3 באמצעות המודלים יוניים וקוולנטיים
| ליגנד/אטום מרכזי | סוג ליגנד |
e− תרומה
(מודל יוני) |
e− תרומה
(מודל קוולנטי) |
| Co | n/a | 6 e− | 9 e− |
| 3 NH3 | L | 3 x (2 e−) | 3 x (2 e−) |
| 3 קל | X | 3 x (2 e−) | 3 x (1 e−) |
| תשלום של יון | n/a* | − (0) | |
| Total e− count | 18 e− | 18 e− | |
*המטען של היון המכיל מתכת אינו כלול בספירת האלקטרונים הכוללת באמצעות המודל היוני. המטען נמצא במצב החמצון של המתכת (אלקטרונים שנתרמו על ידי האטום המרכזי).
מודל קוולנטי:
עבור המודל הקוולנטי, התרומה e− מהאטום המרכזי שווה למספר הכולל של ערכיות e− עבור האטום הניטרלי (במקרה זה 9 e−). ליגנדים מסוג X תורמים 1 e−, ליגנדים מסוג L תורמים 2 e−,וליגנדים מסוג Z תורמים 0 e−. לבסוף, אם המולקולה היא יונית, יש להפחית את מטען היון המכיל את מרכז המתכת מהמתכת בתוספת האלקטרונים של ליגנד. באמצעות המודל הקוולנטי, ספירת האלקטרונים הכוללת עבור Co(NH3)3Cl3 היא גם 18 e− (טבלה 1).
ספירת אלקטרונים עבור פרוקן ו- Ferrocenium Cation:
באמצעות המודל הקוולנטי, Fe יש 8 e−. אם אנו רואים את הקשר בפרוקן כמו זה במבנה I, ליגנדים cyclopentadiene (Cp) הם תורמים מסוג X ולכן כל אחד לתרום 1 אלקטרון(טבלה 2). לכן, יהיו לנו 10 אלקטרונים ערכיים. עם זאת, במבנה II, כל טבעת Cp תורמת 5 אלקטרונים (L2סוג X ליגנד), שם יש לנו שני קשרים כפולים (כל אחד מהם הם 2 אלקטרונים, תורמים מסוג L), ותורם X אחד (הרדיקלי). זה נותן סך של 18 אלקטרונים(טבלה 2).
טבלה 2. ספירת אלקטרונים עבור פרוקן (Fc) ופרוקניום (Fc+) cation באמצעות המודל הקוולנטי
| ליגנד/ אטום מרכזי | מבנה I | מבנה II | ||||
| סוג ליגנד | פ"ק | FC+ | סוג ליגנד | פ"ק | FC+ | |
| פה. | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| CP | X | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| תשלום של יון | − (0) | − (+1) | תשלום של יון | − (0) | − (+1) | |
| סה"כ ספירת אלקטרונים | 10 e− | 9 e− | סה"כ ספירת אלקטרונים | 18 e− | 17 e− | |
פרוקן עובר בקלות חמצון 1 e− כדי להניב קטיון פרוקניום(משוואה 1).
 (1)
(1)
בואו ניקח בחשבון את ספירת האלקטרונים המתקבלת עבור חופשת הפרוקניום של מבנים I ו- II. על 1 e− חמצון, פרוקן הופך יוני. לכן, יש להפחית את המטען (+1) של חופשת הפרוקניום מאלקטרוני הערכיות(טבלה 2). חיסור תוצאות המטען בספירת האלקטרונים הכוללת של 9 e− ו- 17 e− עבור מבנה I ומבנה II, בהתאמה.
איזה מבנה של פרוקן נכון?:
אם מבנה I נכון, עם רק 10 אלקטרונים ערכיים, פרוקן יהיה מאוד תגובתי ב Fe. חמצון כדי להניב את קטיעת הפרוקניום יהיה מאתגר למדי במקרה זה, שכן מבנה I של פרוקן הוא חסר אלקטרונים. מצד שני, מבנה II של פרוקן מציית לכלל 18 האלקטרונים ולכן עולה בקנה אחד עם פרוקן להיות תרכובת יציבה. במקרה זה, חמצון של פרוקן לcation פרוקניום יניב 17 e− מינים. בהתבסס על ספירת אלקטרונים, ניתן לחזות כי פרוקן תערוכות מבנה II; בואו נחשוב איך להדגים את המבנה הנכון באופן ספקטרוסקופי.
לפני פרסום נתונים מבניים, המבנה של פרוקן הוסיק תכונותיו המגנטיות הספקטרוסקופיות, כמו גם תגובתיות שלה. בואו ניקח בחשבון את ספקטרום IR שהיינו חוזים עבור שני המבנים. מבנה I מציג שני פרוטונים לא שוויוניים מבחינה כימית ולכן צריך להוליד יותר ממצב מתיחה C-H אחד בספקטרום IR. לעומת זאת, מבנה II מציג סוג יחיד של קשר C-H ולכן צריך להציג מתיחה C-H אחת. אם ספקטרוסקופיית NMR הייתה זמינה בשנות החמישים, גם זה היה מספק רמז: שתי תהודה בספקטרום 1H למבנה I, ותהודה אחת למבנה II הייתה צפויה. בניסוי זה, אנו לסנתז פרוקן ולהשתמש בנתונים ספקטרוסקופיים כדי לספק ראיות למבנה שלה.
Procedure
1. פיצוח הציקלופנטדין דימר (איור 3)
ציקלופנטדיאן עובר תגובה דילס-אלדר עם עצמו לתת דיציקלופנטדיאן. תגובה זו היא הפיכה, ולכן פיצוח מתבצע באמצעות העיקרון של La Châtelier כדי להניע את התגובה ההפוכה על ידי זיקוק מונומר cyclopentadiene (b.p. 42 °C) הרחק דימר dicyclopentadiene (b.p. 170 °C (B.p. 170 °C). תגובת הדממה איטית כאשר הציקלופנטאדין נשמר קר, אך יש להכין אותו טרי לסנתז פרוקן בהצלחה.
- לבקבוקון עגול בגודל 25 מ"ל, יש להוסיף מוט ערבוב ו-10 מ"ל דימר דיציקלופנטין.
זהירות: היזהר להשתמש רק דיציקלופנטדיאן וציקלופנטיאן במכסה אדים כי שניהם כימיקלים צחנה. - חברו את הבקבוקון התחתון העגול למנגנון זיקוק חלקי (ראו מודול "זיקוק שברים" בסדרת יסודות הכימיה האורגנית), והנחו באמבט שמן על צלחת חמה מערבבת. הקפידו לקבל את הבקבוקונים הנאספים באמבט קרח. מהדק את המנגנון במקום.
- מניחים את הצלחת החמה ל 160 °C (70 °F) ומערבבים בעדינות את הפתרון.
- זיקוק חלקי ~ 5 מ"ל של מונומר Cp מן העמעם (39-42 °C (39 °F).

איור 3. פיצוח של דיציקלופנטיאן.
2. סינתזה של פרוקן (איור 4)
- לבקבוק שלנק 100 מ"ל, הוסיפו מוט ערבוב ו-15 גרם של KOH טחון דק.
זהירות: KOH הוא מאוד מאכל hygroscopic! KOH צריך להיות הקרקע במכסה המנוע מאוורר היטב ומשמש מיד לאחר ההכנה. - מוסיפים 30 מ"ל של 1,2-דימטוקסיתאן לבקבוק תוך כדי ערבוב.
- מחברים את הבקבוקון לחנקן ומניחים מחיצת גומי על צוואר הבקבוקון.
- תוך ערבוב תחת חנקן, להוסיף 2.75 מ"ל של ציקלופנטדין באמצעות מזרק. אפשר לזה לערבב לפחות 10 דקות לפני תוספת הברזל.
- בזמן שהתגובה מעוררת, הוסיפו מוט מוקפץ, 3.25 גרם של FeCl2טחון ·4H2O, ו- DMSO של 12.5 מ"ל לאגף שלנק נפרד של 50 מ"ל. מניחים מחיצה על הצוואר ומערבבים מתחת לחנקן עד שכל הברזל נמס.
- קנולה להעביר את פתרון הברזל לפתרון cyclopentadienyl תחת חנקן טיפה במהלך 30 דקות. לקבלת הליך מפורט יותר, אנא עיין בסרטון "סינתזה של מטלוקן טי(III) באמצעות טכניקת קו שלנק" בסדרה זו של כימיה אנאורגנית.
- לאחר השלמת התוספת, מערבבים במשך 30 דקות נוספות.
- בינתיים, בכיס קריר 45 מ"ל של 6 M HCl על ידי הוספת קרח כתוש (50 גרם) ישירות לפתרון.
- לאחר השלמת התגובה, יוצקים את התערובת על התערובת, ומערבבים במשך כמה דקות. גבישים כתומים אמורים להיווצר.
- אסוף את הגבישים על משפך Büchner (מצויד בנייר מסנן), ולשטוף את המשקעים במים.
- אפשר למוצקים להתייבש באוויר.
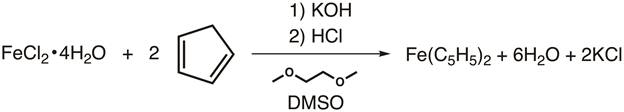
איור 4. סינתזה של פרוקן.
3. טיהור פרוקן. לטהר את המוצר על ידי sublimation (עבור הליך מפורט יותר, אנא עיין "טיהור של פרוקן על ידי Sublimation" וידאו).
4. אפיון פרוקן
- הכן ואסוף ספקטרום 1H NMR של פרוקן.
- לאסוף ספקטרום IR של פרוקן.
- לאסוף וולטמוגרם מחזורי של פרוקן (ראה את "וולטמטריה מחזורית" וידאו בסדרה יסודות של כימיה אנליטית).
Results
אפיון פרוקן:
1 H NMR (כלורופורם-d,300 מגה-הרץ, δ, ppm): 4.15 (ים).
ספקטרום 1H NMR של פרוקן מראה בבירור תהודה אחת, עולה בקנה אחד עם מבנה II.
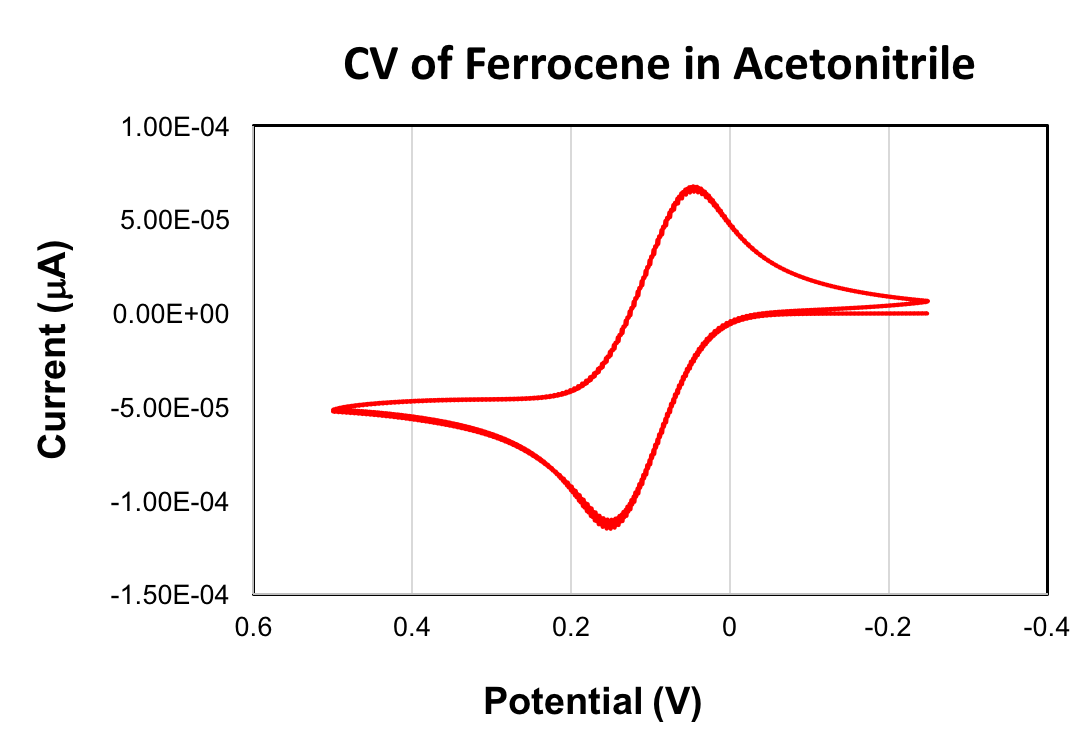
קורות חיים של פרוקן ניתנים להלן. ערך E1/2 שהושג עבור חמצון של פרוקן היה +90 mV (acetonitrile, קצב סריקה 100 mV /s, 0.1 M (Bu4N)PF 6 , אלקטרודה עובדפחמןמזוגג). זוג פרוקן / פרוקניום redox משמש בדרך כלל התייחסות וולטמטריה מחזורית. בעת שימוש כהפניה, הערך E1/2 של פרוקן מוגדר שווה ל- 0 V.
Application and Summary
בסרטון זה דנו בפרוקן ובתפקיד שמילא בהתפתחות הכימיה האורגנומטלית. פרוקן היה מסונתז ומאופיין בספקטרוסקופיית 1H NMR ו- IR. שתי הספקטרום עולות בקנה אחד עם מבנה 18 e− II, שבו הברזל "תקוע" בין שני ליגנדים ציקלופנטדיים, עם כריכה שווה לכל 10 אטומי הפחמן(איור 1, מבנה II). חמצון של פרוקן לcation פרוקניום נצפתה אלקטרוכימית.
בשנת 1973, בעקבות האפיון המבני של פרוקן, וילקינסון היה אחד משני כימאים שזכו בפרס נובל לכימיה "על עבודתו החלוצית ... על הכימיה של האורגנומטלי, מה שנקרא מתחמי סנדוויץ'". 6 עבודתו השפיעה והרחיבה מאוד את התחום המתהווה של הכימיה האורגנומטלית. בעוד שהתרכובת האורגנומטלית הראשונה הוכנה בשנת 1849, רק בשנות החמישים נעשו התקדמות משמעותית להבנת האופן שבו מתכות יכולות להתחבר לאטומי פחמן. כיום, תחום הכימיה האורגנומטלית, או הכימיה של תרכובות היוצרות קשרים מתכתיים-פחמן, הוא מרכזי ביישומים רבים. זה כולל: אנרגיה, תאים סולאריים רגישים לצבע, קטליזה, פילמור, גילוי תרופות וסינתזה, מערכות ביו-אורגניות ודיודות אורגניות פולטת אור (OLEDs). 7
פרוקן עצמו ממלא גם תפקיד פעיל בתחום הכימיה האורגנומטלית. פרוקן משתתף בקלות בהחלפה ארומטית אלקטרופילית; למעשה, זה 100,000 פעמים יותר תגובתי מאשר בנזן בתגובות אלה. פרוקן מצא יישום נרחב כמרכיב מבני של ליגנדים בידנטאט קטליזה אורגנומטלית. לדוגמה, 1,1'-bis (דיפנילפוספינו) פרוקן (dppf) הוא ליגנד כלאט המשמש קטליזה הומוגנית. ליגנד dppf chelates 1st,2nd, ומתכות מעבר בשורההשלישית כולל ני, PD ו- Pt. [1,1'-Bis (דיפנילפוספינו) פרוקן]פלדיום (II) דיכלוריד הוא דוגמה לזרז צימוד צולב פלדיום להיווצרות קשר C-C ו- C-heteroatom (איור 5). 8 בסרטון "MO התיאוריה של מתחמי מתכת מעבר", אנו לסנתז שני מתחמי מתכת הכוללים dppf.
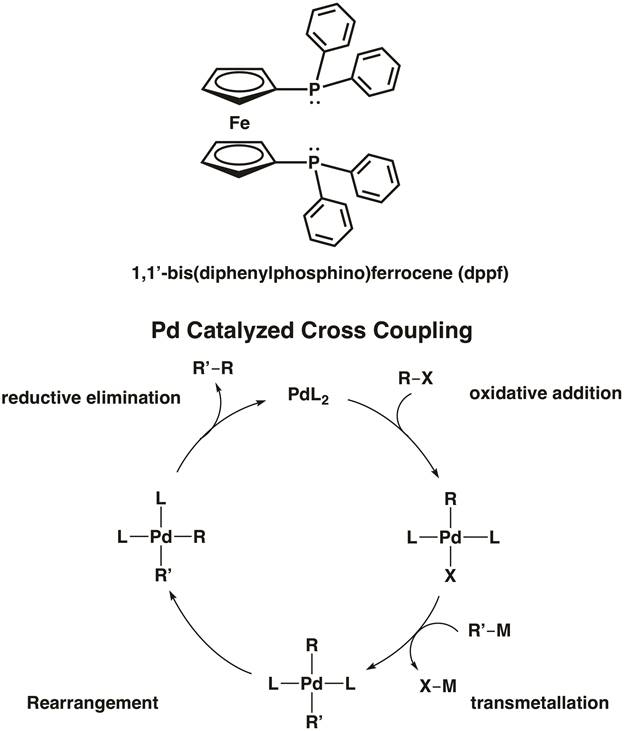
איור 5. [1,1'-Bis (דיפנילפוספינו) פרוקן]פלדיום (II) דיכלוריד הוא זרז צימוד צולב להיווצרות אג"ח C-C ו- C-X.
References
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).
Tags
Skip to...
Videos from this collection:

Now Playing
מבנה פרוקן
Inorganic Chemistry
79.4K Views

סינתזה של מטלוקן Ti(III) בטכניקת קו שלנק
Inorganic Chemistry
31.6K Views

חיישני תא כפפות וטילמאה
Inorganic Chemistry
18.6K Views

טיהור פרוקן על ידי תת-הכרתיות
Inorganic Chemistry
54.5K Views

שיטת אוונס
Inorganic Chemistry
68.4K Views

עקיפה של קריסטל ואבקה
Inorganic Chemistry
104.3K Views

ספקטרוסקופיית תהודה פרמגנטית אלקטרונית (EPR)
Inorganic Chemistry
25.4K Views

Mössbauer Spectroscopy
Inorganic Chemistry
22.0K Views

אינטראקציה בסיס חומצה לואיס ב Ph3P-BH3
Inorganic Chemistry
38.8K Views

יישום תורת הקבוצות לספקטרוסקופיית IR
Inorganic Chemistry
45.1K Views

תורת מסלולית מולקולרית (MO)
Inorganic Chemistry
35.3K Views

גלגלי משוטים מרופדים ממתכת מתכתית
Inorganic Chemistry
15.3K Views

תאים סולאריים רגישים לצבע
Inorganic Chemistry
15.8K Views

סינתזה של קומפלקס קובלט נושא חמצן(II)
Inorganic Chemistry
51.6K Views

ייזום פוטוכימי של תגובות פילמור רדיקליות
Inorganic Chemistry
16.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved