Method Article
מודל הזרקת Cisterna Magna זעיר פולשני למחקרי גרורות לפטומנינגיאליות בעכברים
In This Article
Summary
הפרוטוקול מתאר שיטה להזרקת תאי גידול דרך מסלול הניקוב המלעורי לתוך ציסטרנה מגנה הגורמת בעוצמה לגרורות לפטומנינגיאליות בעכברים, ומפחיתה את הטראומה ואת עומס הגידול החוץ-גולגולתי.
Abstract
גרורות לפטומנינגיאליות (LM), התפשטות תאים סרטניים לתוך לפטומנינגים מלאים בנוזל המוח השדרתי (CSF), היא סיבוך נדיר אך הרסני של גידולים מוצקים מתקדמים. לחולים עם LM יש לעתים קרובות פרוגנוזה גרועה, כאשר ההישרדות נמדדת בשבועות עד חודשים. פיתוח מודלים in vivo המשכפלים במדויק את המורכבות של LM חיוני להבנת המנגנונים התאיים והפתולוגיים שלו ולהערכת טיפולים פוטנציאליים. מודלים של LM עכברים נוצרים בדרך כלל באמצעות הזרקת תאי גידול תוך-לבביים, עורק הצוואר או ציסטרנה מגנה. עם זאת, זריקות תוך לב או קרוטיד גורמות לרוב לעומס משמעותי על גידולים חוץ-גולגולתיים ומוחיים, מה שמסבך את ההדמיה הביולוגית ומוביל לתמותה שאינה קשורה ל-LM. בינתיים, הזרקת סיטרנה מגנה קונבנציונלית דורשת הליכים פולשניים, כגון חתך בעור ודיסקציה של שרירים, מה שהופך אותה לטראומטית ועתירת משאבים. כאן אנו מתארים הליך זעיר פולשני להזרקת תאי גידול לחלל הלפטומנינגיאלי דרך בור המים ללא צורך בחתך בעור. גישה זו מפחיתה היווצרות גידול חוץ-גולגולתי, ממזערת טראומה כירורגית ומקצרת את הזמן והטיפול לאחר הניתוח הנדרשים בהשוואה לשיטות כירורגיות אחרות. חשוב לציין, הוא גורם באופן עקבי ל-LM עם חדירת פרנכימה מוחית מינימלית, כפי שאושר על ידי מיקרוסקופיה דו-פוטונית וניתוח היסטולוגי. גישה יעילה זו מציעה מודל יעיל ואמין לחקר LM במחקר פרה-קליני.
Introduction
המחלה הגרורתית נותרה האתגר הגדול ביותר עבור חולים עם סרטן מתקדם. גרורות לפטומנינגיאליות (LM) מתייחסות להתפשטות של תאים סרטניים ל-pia mater, ל-arachnoid mater ולחלל התת-עכבישי. LM מגידולים מוצקים הופך נפוץ יותר ויותר בסרטן ריאות (9%-25%), סרטן השד (5%-20%) ומלנומה (6%-18%)1,2, בעיקר בשל הישרדות ארוכה יותר וטכניקות אבחון משופרות. תאי סרטן יכולים לפלוש למרחב הלפטומנינגיאלי במספר דרכים, כולל 1) פלישה ישירה דרך מבנים היקפיים כגון דורה, עצם ועצבים; 2) התפשטות המטוגנית דרך מערכת הוורידים; ו-3) כניסה דרך מחזור הדם העורקי, שבו תאים סרטניים מחליקים דרך כלי דם מנופחים לתוך מקלעת הכורואיד ולאחר מכן לחדרים המלאים בנוזל המוחהשדרתי 3,4,5. תאי גידול הנכנסים לחלל הלפטומנינגיאלי נתקלים באתגרים מרובים, כולל מחסור בגורמי גדילה, מתווכים מטבוליים מוגבלים ומצבים היפוקסיים6. עם זאת, בשל היעדר כלים וטכניקות מתאימות, כיצד תאי הגידול מנווטים במסלולים אלה ומתגברים על תנאים לא מסבירי פנים כדי ליישב את המרחב הפטומנינגיאלי אינו מובן היטב. למרות ההתקדמות בטיפולים רב-מודאליים, כולל רדיותרפיה, טיפול מערכתי וטיפול בהזרקה תוך-תקלית, הפרוגנוזה עבור חולי LM נותרה גרועה, כאשר ההישרדות נעה בדרך כלל בין 2 ל-4 חודשים 3,7,8,9. לפיכך, יש צורך דחוף בהבנה עמוקה יותר של הביולוגיה של גרורות לפטומנינגיאליות כדי לשפר את הטיפולים הקיימים ולפתח טיפולים חדשים וממוקדים. השגת מטרה זו דורשת פיתוח של מודלים in vivo המסכמים את התכונות המורכבות של LM.
בניגוד לגרורות באיברים כמו כבד, עצם ומוח, LM מתפתח בדרך כלל שנים לאחר אבחון הגידול הראשוני 10,11,12. באופן דומה, במודלים של עכברים עם גרורות ספונטניות, LM נדיר בשל השכיחות הנמוכה שלו והעובדה שעכברים בדרך כלל נכנעים לגרורות באתרים אחרים. ניתן ליצור מודלים ניסיוניים של LM עכברים בשיטות שונות, כולל עורק תוך-לבבי, עורק תוך-צוואר, או לחילופין, הזרקה ישירה לבור המים או לחדרי המוח. בעוד שהזרקה תוך-קרדיולוגית של תאים סרטניים נמצאת בשימוש נרחב9, היא גורמת לעתים קרובות לעומס גידול חוץ-גולגולתי משמעותי, הגורם לתמותה שאינה קשורה ל-LM. גישות חלופיות, כגון הזרקת תאי גידול דרך עורק הצוואר13,14, דורשות משאבים מיוחדים נרחבים וגורמות לחתכים כירורגיים גדולים, שהם טראומטיים. יתר על כן, שיטה זו מובילה בעיקר לגרורות בתוך רקמות המוח עצמן, ולא לפטומנינג, והיא גוזלת זמן ולא יעילה לביסוס מודלים של LM15. הזרקה לבור המגנה מאפשרת העברה ישירה של תאי הגידול לחלל הלפטומנינגיאל. מספר מחקרים השתמשו בגישה זו כדי לחקור מנגנוני LM ולהעריך טיפולים חדשים 6,16,17.
בכתב יד זה, אנו מציגים פרוטוקול נוח להזרקת מגנה טרנס-ציסטרנה הכולל ניקור מלעורי ישיר כדי ליצור במהירות וביציבות כמות גדולה יותר של עכברים עם LM. שיטה זו עוקפת את מחסום המוח-דם ולכן מאפשרת קסנוגרפט יעיל של תאי הגידול בחלל הלפטומנינג. זה גם מפחית משמעותית את הטראומה הכירורגית ואת זמן ההליך תוך גרימת LM באופן אמין בעכברים. אישרנו את התרחשות LM עם חדירה מינימלית לפרנכימה של המוח, כפי שאומת על ידי מיקרוסקופ דו-פוטוני וניתוח היסטולוגי. לכן, המודל המתקבל משכפל נאמנה את המיקרו-סביבה המורכבת של LM, ומספק כלי רב ערך לחקר מנגנונים תאיים ופתולוגיים הקשורים למחלה ולהערכת טיפולים פוטנציאליים.
Protocol
כל ההליכים בבעלי חיים בכתב יד זה נבדקו ואושרו על ידי הוועדה לסקירת רווחת בעלי חיים ואתיקה במעבדה (ZJU20230155). עכברי C57BL/6J ו-NSG התקבלו ושוכנו בתנאים נטולי פתוגנים ספציפיים במרכז חיות המעבדה של ZJU. פרוטוקול זה משתמש בקו תאי סרטן הריאה של העכברים, קרצינומה של ריאות לואיס (LLC1), וקו תאי סרטן ריאה אנושיים, A549, שניהם מסומנים ב-GFP ובלוציפראז גחלילית. שני קווי התאים מסופקים באדיבות על ידי ד"ר שיאנג ה. פ. ז'אנג (מכללת ביילור לרפואה, ארה"ב)18. כאן, אנו משתמשים בתאי LLC1 כדוגמה. הליך הזרקת תאי A549 כמעט זהה, פרט לכך ש-6 x 104 תאי A549 הוזרקו לעכברי NSG.
1. הכנת תאים סרטניים להזרקה
- תרבית 1.0 x 106 תאי LLC1 ב-DMEM בתוספת 10% סרום בקר עוברי (FBS) ו-0.1 מ"ג/מ"ל פניצילין-סטרפטומיצין ב-37 מעלות צלזיוס באינקובטור של 5% CO2 . כאשר התאים מגיעים למפגש של 70%-90%, נסה אותם למשך דקה אחת באמצעות 2 מ"ל של תמיסת טריפסין/EDTA של 0.25%. צנטריפוגה של התאים ב-300 x גרם למשך 3 דקות, שטפו אותם פי 2 עם PBS קר כקרח, והשעו אותם מחדש ב-1 מ"ל של מי מלח עם חוצץ פוספט (PBS).
- להעריך את ריכוז התאים ברי קיימא באמצעות תמיסת טריפאן בלו והמוציטומטר19. ודא שחיוניות התא גדולה מ-90%, כאשר רוב התאים הם יחידים. התאם את ריכוז התאים ל-2 x 106 תאים/מ"ל ב-PBS קר כקרח.
- יש לשים 50 מיקרוליטר של תרחיף התא לצינורות מיקרו-צנטריפוגה נפרדים כדי למנוע פיפטינג חוזר ונשנה.
- שמור את תרחיפי התאים על קרח עד שהם מוכנים להזרקה. הזרקו 10 מיקרוליטר של תאי LLC1 עם תווית GFP-Luciferase לכל עכבר בפרוטוקול זה, המתאימים ל-2 x 104 תאים לעכבר.
הערה: התאם את מספר התא לפי הצורך על סמך הקינטיקה הגרורתית של קווי התאים המוזרקים.
2. הכנת עכברים
הערה: במחקר זה נעשה שימוש בעכברי C57BL/6J זכרים, בגילאי 6-8 שבועות.
- חיטוי כל המכשירים הכירורגיים והכפפות ארוזים בווילונות כירורגיים. חטאו את הספסל והציוד הלא כירורגי עם 75% אתנול, ולאחר מכן כסו את אזור העבודה בווילונות עמידים למים.
- הכינו כלוב מגורים נקי לבעלי חיים וכרית חימום להתאוששות לאחר ההליך.
- להרדים את העכבר על ידי הזרקה תת עורית של 2% טריברומו-אתנול (200 מ"ג/ק"ג). בדוק את עומק ההרדמה באמצעות בדיקת צביטה לפני שתמשיך. יש למרוח משחת עיניים סטרילית כדי להגן על העיניים מפני נזק לקרנית לאחר הרדמת העכבר.
- לגלח את הפרווה מאזור העורף האחורי באמצעות קוצץ, ולאחר מכן למרוח קרמים להסרת הפרווה לחלוטין באותו אזור.
- מקם את העכבר על הבטן כשצווארו מונח מעל צינור צנטריפוגה של 15 מ"ל. אבטח את הראש והגב התחתון עם סרט וממשש את הרווח בין העורף לחוליה C1 עם האצבע המורה (איור 1).
- יש לחטא את אזור העורף האחורי בשלושה סבבי ניגוב עם 75% צמר גפן סטרילי ספוג אתנול, ולאחר מכן קרצוף כירורגי בטאדין. מכסים את החלקים הלא סטריליים של החיה בווילון סטרילי.
3. הזרקת Cisterna magna
הערה: טכניקות אספטיות נדרשות לשלבים הבאים, כולל שימוש בציוד מגן אישי וכפפות סטריליות.
- צנרת בעדינות את תרחיף התא ושואבת 10 מיקרוליטר להזרקה עם מזרק אינסולין 31G, 8 מ"מ.
- משש את האזור שבין העורף ל-C1 של העכבר באצבע המורה כדי לאתר את אתר הניקוב המדויק בשוליים החציוניים התחתונים של הגולגולת העורפית האחורית. סמן אתר זה במידת הצורך.
- הכנס את המחט בזווית של 45°-50° לתוך בור המים דרך אתר הניקוב המזוהה, והתקדם לעומק של 4 מ"מ. תחושת פריצת דרך מובהקת מצביעה על כך שהמחט נכנסה בהצלחה לבור המים.
- אם קשה לאתר את אתר הניקוב, בצע חתך קטן של 3-5 מ"מ בגובה האוזן כדי לחשוף את קו האמצע האחורי. אם נדרש חתך כירורגי, יש לתת מלוקסיקם (5 מ"ג/ק"ג/יום) ובופרנורפין (0.1 מ"ג/ק"ג) תת עורית שעה אחת לפני הניתוח.
- הזרקו לאט את מתלה התאים על ידי קידום בוכנת המזרק, תוך שמירה על יציבות המזרק כשהיד מונחת על השולחן.
- לאחר החיסון, החזק את המזרק במקומו למשך 10 שניות נוספות כדי לאפשר ללחץ התוך גולגולתי להתאזן לאחר מכן, משוך את המחט ולחץ על מקום הניקוב בעזרת צמר גפן סטרילי למשך 1-2 דקות.
4. טיפול לאחר הזרקה
- העבירו את בעלי החיים לכלובים נקיים על כרית חימום ועקבו אחריהם מקרוב עד שיתאוששו לחלוטין.
- במקרה שנעשה חתך, סגור את הפצע באמצעות דבק רקמות וקליפסים. יש לתת תרופות נוספות לשיכוך כאבים במשך 2-3 ימים לאחר הניתוח כדי לשלוט בכאב ולסייע בהחלמה.
- יש לעקוב מקרוב אחר העכברים במשך 7 ימים לאחר ההליך ולבדוק את הפעילות הגופנית של בעלי החיים ואת המראה סביב מקום ההזרקה מדי יום.
5. הערכת צמיחת גידול לפטומנינגיאלי
- הדמיית ביולומינסנציה
- להרדים את העכבר ולתת D-לוציפרין (150 מיקרוגרם/גרם) בווריד הרטרואורביטלי. הנח את העכברים בתא ההדמיה, ומקם אותם בקונוס אף ייעודי על סעפת ההרדמה. השתמש בבלבולי אור בין בעלי חיים כדי למזער את הפרעות האות.
- דמיינו את בעלי החיים מיד באמצעות מערכת IVIS עם זמן חשיפה בין 0.5 שניות ל-2 דקות6. אשר חיסון מוצלח של תאי גידול בחלל הלפטומנינגיאלי על ידי אות ביולומינסנט מפוזר על פני הראש וחוט השדרה (איור 2A).
- עקוב אחר התקדמות LM על ידי הדמיית ביולומינסנציה כל 4 ימים. התאמת מרווחי הדמיה על סמך קינטיקה של צמיחת הגידול.
- ניתוח היסטולוגי
- להרדים את העכברים כאשר הם היו פחות פעילים באופן משמעותי או איבדו 20% ממשקל גופם ולחתוך את העור והצלעות כדי לחשוף את חלל בית החזה שלהם. הכנס בזהירות צינורית קהה לחדר השמאלי וקדם את הצינורית לתוך אבי העורקים העולה. החדרו את החיה עם 20 מ"ל PBS דרך הצינורית לאט.
- השתמש במספריים כדי להסיר את הראש ולבצע חתך בקרקפת בקו האמצע כדי לחשוף את הגולגולת. כרתו את הרקמות הרכות שמסביב. חותכים לאורך רכס המסלול, ואז מכניסים מספריים לתוך הפורמן מגנום, ומתקדמים בזהירות לאורך המשטח הפנימי של הגולגולת בלחץ כלפי מעלה כדי למנוע נזק לרקמות.
- הסר את עצמות הגולגולת, ולאחר מכן חלץ בעדינות את המוח. קבע את המוח ב-4% פרפורמלדהיד ב-4 מעלות צלזיוס למשך 24 שעות ולאחר מכן אזן אותו לתמיסת PBS סוכרוז של 15% למשך 24 שעות, ואחריה תמיסת PBS סוכרוז 30% למשך 24 שעות נוספות ב-4 מעלות צלזיוס.
- הניחו את הטישו בקריומולד מלא בתרכובת טמפרטורת חיתוך אופטימלית (OCT) ולאחר מכן אחסנו אותה על קרח יבש למשך 30 דקות20.
- חותכים את המוח המוטבע ב-OCT למקטעים בעובי 10 מיקרומטר באמצעות קריוסטט. אחסן את החלקים במקפיא של -80 מעלות צלזיוס עד ליישום נוסף.
- בצע צביעת המטוקסילין/אאוזין (H&E) על שקופיות המוח21. נוכחותם של תאי גידול בקצה המוח מצביעה על כך שגרורות מתרחשות אך ורק בחלל הלפטומנינגיאלי (איור 3 וטבלה 1).
- מיקרוסקופיה דו-פוטונית
- להרדים את העכברים עם LM. הסר את הקרקפות המכסות את משטח הגולגולת הגבי בעזרת מלקחיים ומספריים. השתמש בלהב אזמל כדי להסיר את הפריאוסטאום הדק מפני השטח של הגולגולת.
- דק את הגולגולת בעזרת מקדחה שוחקת עד שכלי הפיאל נראים דרך הגולגולת הדלילה. ייצב את אזור התצפית של ראש העכבר עם כיסוי ראש משולש המאובטח על ידי דבק רקמות22,23.
- יש לתת 0.025 מ"ל של 5% (w/v) TRITC-dextan בווריד אינפרא-אורביטלי כדי לסמן את כלי הדם22.
- בצע מיקרוסקופיה דו-פוטונית דרך חלונות ההדמיה ושחזר את המרחב הפטומנינגיאלי (איור 4). זיהוי העצם על ידי פלואורסצנציה הרמונית שנייה בפליטה של 450 ננומטר עם עירור של 900 ננומטר24. דמיין תאי גידול המסומנים ב-GFP וכלי דם מסומנים בדקסטרן על ידי איסוף אותות פלואורסצנטיים בפליטה של 507 ננומטר ו-572 ננומטר עם עירור של 900 ננומטר ו-1000 ננומטר, בהתאמה.
- מיקרוסקופ פלואורסצנטי סטריאו
- הסר את מוח העכבר והנח אותו מתחת לסטריאומיקרוסקופ. דמיינו תאים עם תווית GFP באמצעות ערכת מסננים ספציפית ל-GFP (איור 5).
תוצאות
איור 1 ממחיש את מיקום העכבר להזרקה ואת אתר הניקוב ממבט רוחבי וקדמי. איור 2 מציג תמונות ביולומינסנציה מייצגות in vivo של בעלי חיים שנבדקו ליצירת LM באמצעות גישות שונות. תאי LLC1 המסומנים ב-GFP-luciferase הוזרקו לבעלי החיים בדרכים שונות, ואחריהם הדמיה ביולוגית. כפי שמוצג באיור 2A, 10 ימים לאחר הזרקת מגנה תוך-בורית, האות הביולוגי היה נוכח במוח העכבר והופץ לאורך חוט השדרה, מה שמצביע על השתלה מוצלחת של תאי גידול בחלל הלפטומנינגאלי. לעומת זאת, הזרקות תוך-צוואריות של תאי גידול יצרו בעיקר גרורות פרנכימליות במוח ללא מעורבות משמעותית בלפטומנינגים 21 יום לאחר ההזרקה (איור 2B). בשיטת ההזרקה התוך-לבבית, הדמיה ביולומינסנציה ממצב שכיבה מראה שרוב הגרורות גדלות באיברים חוץ-גולגולתיים (משמאל), ותמונות מנקודת המבט הנוטה אישרו שאף אחד משלושת העכברים לא פיתח LM (מימין; איור 2C). אותה התפלגות של תאי גידול נצפתה 10 ימים לאחר הזרקת הבור מגנה של 6 x 104 (10 מיקרוליטר) תאי A549 עם תווית GFP-לוציפראז בעכברי NSG (איור 2D), מה שמצביע על כך שגישה כזו מייצרת LM בצורה חזקה בזני עכברים שונים עם קווי תאים שונים.
איור 3 מציג תמונות מייצגות של צביעה היסטולוגית ואימונופלואורסצנטית של רקמות המוח לאחר 14 יום של הזרקת תאי גידול דרך הבור. צביעת המטוקסילין-אאוזין (H&E) מראה את רוב האזורים הגידוליים הממוקמים בחלל הלפטומנינגיאלי (איור 3A). איור 3B מראה שרוב תאי הגידול המסומנים ב-GFP היו מקובצים בקרום המוח ובחדרים, בעוד שתאי הגידול באזור הפרנכימה הם בעיקר תאים בודדים. איור 4 מציג תמונות מייצגות של שני פוטונים של המרחב הלפטומנינגיאלי של עכבר עם LM. עצם הגולגולת (כחולה) זוהתה על ידי איסוף הקרינה ההרמונית השנייה בפליטה של 450 ננומטר עם עירור של 900 ננומטר24. כלי הדם (אדום) סומנו על ידי TRITC-dextan (70 kDa). תאי גידול עם תווית GFP (ירוק) נמצאו בין עצם הגולגולת (כחול) לפרנכימה של המוח, במיוחד באזור הלפטומנינגיאל. איור 5 מראה את נוכחותם של תאי גידול עם תווית GFP על פני השטח של המוח, המומחשים באמצעות מיקרוסקופ פלואורסצנטי סטריאו. טבלה 1 מציגה את ההשוואה בין שלוש השיטות.

איור 1: הכנה של בעלי חיים ואתר ניקוב להזרקה תוך-בוריתית. (A) העכבר מונח במצב שכיבה, כשצווארו עטוף מעל צינור צנטריפוגה בנפח 15 מ"ל. הראש והגב התחתון מאובטחים באמצעות סרט. המחט מוחדרת בזווית של 45°-50° לתוך בור המים בשוליים התחתונים החציוניים. (B) המחט מוחדרת בשוליים התחתונים החציוניים של הגולגולת העורפית האחורית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
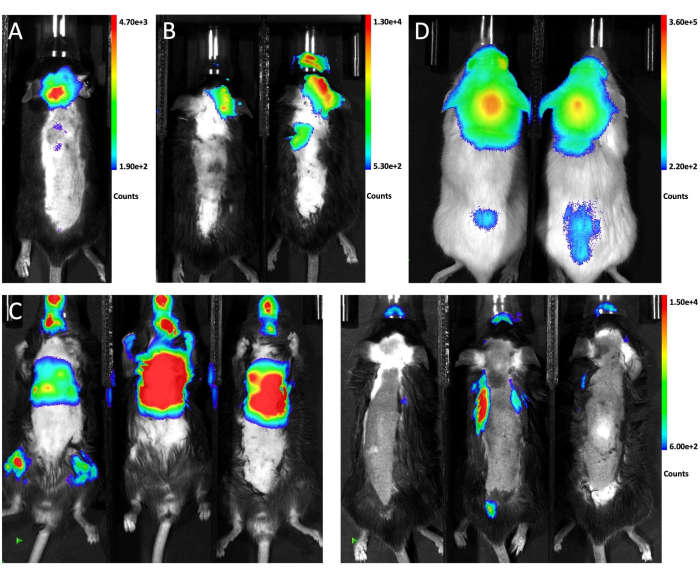
איור 2: תמונות ביולומינסנציה מייצגות in vivo של עכברים המקבלים שיטות הזרקה שונות. (א) אות הביו-לומינסנציה in vivo של החיה כולה לאחר הזרקת מגנה תוך-צידנית של תאי LLC1. (B) תמונת הביו-לומינסנציה in vivo של העכברים לאחר הזרקה תוך-צווארית של תאי LLC1. (C) אות הביו-לומינסנציה in vivo של העכברים לאחר הזרקה תוך לבבית של תאי LLC1. הצד השמאלי מראה את המבט על השכיבה והצד הימני מראה את המבט השכיבה. (D) תמונת הביו-לומינסנציה של עכברי NSG לאחר הזרקת תאי A549 דרך ה-cisterna magna.a אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.
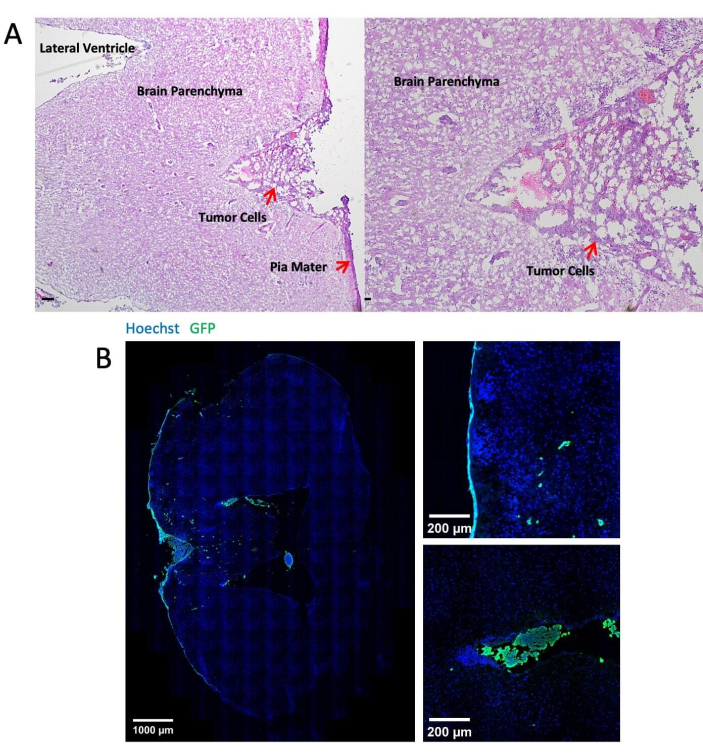
איור 3: תמונות מייצגות של צביעה היסטולוגית ואימונופלואורסצנטית. (A) צביעה מייצגת של H&E מראה תאי LLC1 שהופקדו בעיקר על פני השטח של קרומי המוח ובחדרים. סרגל קנה מידה = 25 מיקרומטר. (B) תמונות צביעה אימונו-פלואורסצנטיות של המוח הנושא גידול LLC1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: תמונות מייצגות של שני פוטונים של עכבר עם LM. תאי גידול המסומנים ב-GFP (ירוק) נמצאים אך ורק בין הגולגולת (כחול) לפרנכימה של המוח (אדום). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: תמונות מייצגות של מיקרוסקופ פלואורסצנטי סטריאו. (A) שדה ראייה גלובלי של מוח עכבר מתחת למיקרוסקופ. (B) תאי גידול עם תווית GFP הוצגו על פני השטח של המוח, שפולטים פלואורסצנטיות ירוקה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| משך ההליך/דקה | שכיחות LM נצפתה 14 יום לאחר ההזרקה | שיעור הגידול החוץ-גולגולתי | שיעור גידולים פרנכימליים גדולים במוח | |
| הזרקת מגנה תוך-בור מים | ~5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| הזרקת עורק תוך קרוטיד | ~20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| הזרקה תוך קרדיולוגית | ~5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
טבלה 1: השוואה בין שלוש שיטות הזרקה שונות מבחינת משך הניתוח, שכיחות גרורות לפטומנינגיאל, גידולים חוץ-גולגולתיים ושיעור גידולים פרנכימליים גדולים במוח.
Discussion
LM הוא מצב אגרסיבי וקטלני. ברגע שתאי הגידול שולחים גרורות לחלל המלא בנוזל השדרה, הם מתפשטים במהירות בכל מערכת העצבים המרכזית25. תאים אלה מתיישבים ופולשים לעצבי המוח, חוט השדרה, הגולגולת ועמוד השדרה, מה שמוביל בסופו של דבר להידרדרות נוירולוגית מהירה ובסופו של דבר למוות17. כדי להבין טוב יותר את המנגנונים הפתופיזיולוגיים הבסיסיים ולהעריך אסטרטגיות טיפוליות פוטנציאליות, חיוני לפתח מודל יעיל in vivo המסכם את התהליך הגרורתי ואת המיקרו-סביבה שמסביב בגרורות לפטומנינגיאליות.
דוח קודם הראה כי ניתן לגרום ל-LM במודלים של עכברים על ידי הזרקה ישירה של תאי גידול להמיספרה הימנית של המוחהקטן 15. עם זאת, גישה זו לרוב לא מצליחה לייצר גרורות באזור התת-מצחי או בחוט השדרה הדיסטלי בחלק מהנבדקים. מחקר שנערך לאחרונה הראה כי גידולים שמקורם בתאי סרטן ריאה של תאים קטנים שעברו מוטציה, כאשר הם מושתלים תת עורית, עלולים להתפשט באופן ספונטני לחלל הלפטומנינגיאלי לאחר תקופת חביון ממושכת14. בעקבות התרחבות במבחנה של תאי גידול מ-LM ספונטני, המחברים הקימו בהצלחה תת-קו תאים המסוגל לפתח LM עם חדירת פרנכימה מוחית מינימלית באמצעות הזרקה תוך צווארית. בעוד שהליך זה לוכד את המהלך הטבעי של התפשטות גרורתית למרחב הלפטומנינגאלי, הוא אינו יעיל וגוזל זמן, מכיוון שרוב העכברים מתים מגרורות באיברים אחרים לפני ש-LM יכול להתפתח במלואו. בנוסף, גישה זו מחייבת מיקרו-כירורגיה מתוחכמת, המטילה טראומה ניכרת על הנושא26. לחלופין, הזרקה ישירה של תאי גידול לתוך הבור מגנה הביאה למעורבות לפטומנינגיאלית נרחבת, הדומה מאוד למצב שנצפה בחולי LM15. עם זאת, חלק משיטות ההזרקה התוך-ציסטרניות דורשות דיסקציה של העור והשרירים, וכתוצאה מכך טראומה משמעותית וסיכון מוגבר לזיהום תוך גולגולתי, מה שעלול לשנות את המאפיינים הפתופיזיולוגיים של LM.
כאן, תיארנו שיטה זעיר פולשנית להזרקת תאי גידול לבור המים דרך מסלול ניקוב מלעור. בניגוד לגישות כירורגיות אחרות, זריקות מלעוריות נמנעות משלבים פולשניים כמו חתך בעור, ובכך ממזערות את הסיכון לזיהום. עם מיקום מדויק, ניתן להשלים את ההליך תוך דקות ספורות, מה שמפחית משמעותית את זמן הטיפול הניתוחי ואחרי הניתוח. יתר על כן, הזרקה ישירה של תאי גידול לבור המים משפרת את ההשתלטות של תאי הגידול בתוך החלל הלפטומנינגיאלי תוך הפחתת השכיחות של קולוניזציה של איברים חוץ-גולגולתיים (טבלה 1).
קיימים כמה שיקולים קריטיים ומידע לפתרון בעיות עבור הפרוטוקול. למרות שאנו מצפים שההליך הנוכחי יפחית את הצורך בכוח אדם מיומן מאוד ויפשט את כל התהליך, עדיין קריטי למפעיל לזהות במדויק את אתר הפנצ'ר. המפעילים צריכים להכיר את האנטומיה של העכבר, במיוחד את הפוסה הגולגולתית האחורית ואזור צוואר הרחם, כדי להבטיח מיקום מדויק. אם המחט נתקלת במשטח גרמי במהלך ההחדרה, אתר הניקוב עשוי להיות גבוה מדי ויש לכוונן אותו כלפי מטה כראוי. כדי להבטיח הזרקות מוצלחות, אנו ממקמים ומאבטחים את בעלי החיים מעל צינור צנטריפוגה של 15 מ"ל כדי לחשוף את אתר ההזרקה במלואו. מצאנו גם שמזרק האינסולין 31G, 8 מ"מ מתפקד טוב יותר ממזרק המילטון הקונבנציונלי לניקוב בור המים. סביר להניח שהסיבה לכך היא שהמחט של מזרק המילטון פחות יעילה בחדירה לשכבות רקמות עבות ומספקת פחות שליטה במהלך ההחדרה. העומק (4 מ"מ) והזווית (45°-50°) של החדרת המחט הם קריטיים. עומק מוגזם עלול להוביל לצמיחת גידול בגזע המוח, בעוד שעומק לא מספיק עלול לגרום לגידולים תת עוריים. לפיכך, כדי למזער את הסיכון למוות בשוגג כתוצאה מעלייה פתאומית בלחץ התוך גולגולתי, יש לבצע את ההזרקה לאט ככל האפשר.
עם זאת, פרוטוקול זה אינו חף ממגבלות. בניגוד לשיטות המסורתיות, ההליך המתואר מסתמך על מיקום מדויק של בעלי חיים ועל המשוב הסנסציוני של המפעיל, המציג מידה של שונות. עם שליטה קפדנית בעומק ההזרקה ותרגול חוזר, ניתן להשיג אחוזי הצלחה גבוהים. חסרון מרכזי נוסף של ההליך הנוכחי הוא שהוא עוקף את השלבים המוקדמים של מפל גרורתי ולכן אינו מסוגל לסכם את כל מהלך ה-LM בחולים. בסך הכל, ההליך המוצג הוא פשוט מבחינה טכנית ויעיל ביותר להקמת מודלים של LM עכברים, המייצג פלטפורמה פרה-קלינית רבת ערך למחקרים הקשורים ל-LM.
Disclosures
המחברים מצהירים שאין ניגוד עניינים.
Acknowledgements
המחברים מודים לחברי מעבדת ג'אנג על הדיונים החשובים והסיוע שלהם לאורך המחקר הזה. WZ נתמך על ידי קרנות המחקר הבסיסיות של האוניברסיטאות המחוזיות של ג'ג'יאנג (2023QZJH60), תוכנית קרן המדע לחוקרים צעירים מצטיינים מהקרן הלאומית למדעי הטבע של סין (588020-X42306/041), וקרן הסטארט-אפים מהמכון למדעי החיים של אוניברסיטת ג'ג'יאנג.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
References
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved