Method Article
Modelo de inyección mínimamente invasiva de cisterna magna para estudios de metástasis leptomeníngeas en ratones
En este artículo
Resumen
El protocolo describe un método para inyectar células tumorales a través de la vía de punción percutánea en la cisterna magna que induce de forma robusta la metástasis leptomeníngea en ratones, reduciendo el trauma y la carga tumoral extracraneal.
Resumen
La metástasis leptomeníngea (LM), la diseminación de las células cancerosas a las leptomeninges llenas de líquido cefalorraquídeo (LCR), es una complicación poco frecuente pero devastadora de los tumores sólidos avanzados. Los pacientes con LM a menudo tienen un pronóstico precario, con una supervivencia medida en semanas o meses. El desarrollo de modelos in vivo que reproduzcan con precisión las complejidades de la LM es esencial para comprender sus mecanismos celulares y patológicos y evaluar posibles terapias. Los modelos murinos de LM generalmente se crean a través de la inyección intracardíaca, de la arteria carótida o de la cisterna magna de las células tumorales. Sin embargo, las inyecciones intracardíacas o carotídeas a menudo resultan en una carga sustancial de tumores extracraneales y cerebrales, lo que complica las imágenes bioluminiscentes y conduce a una mortalidad no relacionada con la LM. Mientras tanto, la inyección convencional de cisterna magna requiere procedimientos invasivos, como la incisión en la piel y la disección muscular, lo que la hace traumática y requiere muchos recursos. En este artículo, describimos un procedimiento mínimamente invasivo para la inyección de células tumorales en el espacio leptomeníngeo a través de la cisterna magna sin necesidad de una incisión en la piel. Este enfoque reduce la formación de tumores extracraneales, minimiza el trauma quirúrgico y acorta el tiempo y la atención postoperatoria necesarios en comparación con otros métodos quirúrgicos. Es importante destacar que induce consistentemente LM con una infiltración mínima del parénquima cerebral, como lo confirman la microscopía de dos fotones y el análisis histológico. Este enfoque simplificado ofrece un modelo eficiente y fiable para el estudio de la LM en la investigación preclínica.
Introducción
La enfermedad metastásica sigue siendo el mayor desafío para los pacientes con cánceres avanzados. La metástasis leptomeníngea (LM) se refiere a la diseminación de las células cancerosas al espacio piamadre, aracnoideo y subaracnoideo. La LM de tumores sólidos es cada vez más frecuente en el cáncer de pulmón (9%-25%), el cáncer de mama (5%-20%) y el melanoma (6%-18%)1,2, en gran medida debido a la mayor supervivencia y a la mejora de las técnicas diagnósticas. Las células cancerosas pueden invadir el espacio leptomeníngeo por múltiples rutas, que incluyen 1) invasión directa a través de estructuras periféricas como la duramadre, el hueso y los nervios; 2) diseminación hematógena a través del sistema venoso; y 3) entrada a través de la circulación arterial, donde las células cancerosas se deslizan a través de los vasos fenestrados hacia el plexo coroideo y posteriormente hacia los ventrículos llenos de líquido cefalorraquídeo 3,4,5. Las células tumorales que ingresan al espacio leptomeníngeo enfrentan múltiples desafíos, incluida la privación de factores de crecimiento, intermedios metabólicos limitados y condiciones hipóxicas6. Sin embargo, debido a la falta de herramientas y técnicas adecuadas, la forma en que las células tumorales navegan por estas vías y superan condiciones inhóspitas para colonizar el espacio leptomeníngeo es poco conocida. A pesar de los avances en las terapias multimodales, como la radioterapia, el tratamiento sistémico y la terapia con inyección intratecal, el pronóstico de los pacientes con LM sigue siendo malo, con una supervivencia que suele oscilar entre 2 y 4 meses 3,7,8,9. Por lo tanto, existe una necesidad urgente de una comprensión más profunda de la biología de la metástasis leptomeníngea para mejorar los tratamientos actuales y desarrollar nuevas terapias dirigidas. Lograr esto requiere el desarrollo de modelos in vivo que recapitulen las características complejas de LM.
A diferencia de las metástasis en órganos como el hígado, los huesos y el cerebro, la LM suele desarrollarse años después del diagnóstico del tumor primario 10,11,12. De manera similar, en modelos de ratón con metástasis espontáneas, la LM es rara debido a su baja incidencia y al hecho de que los ratones suelen sucumbir a las metástasis en otros sitios. Los modelos experimentales de LM murina se pueden crear a través de varios métodos, incluyendo intracardiaco, arteria intracarótida o, alternativamente, inyección directa en la cisterna magna o ventrículos cerebrales. Si bien la inyección intracardíaca de células cancerosas es ampliamente utilizada9, a menudo resulta en una carga tumoral extracraneal significativa, causando mortalidad no relacionada con la LM. Los abordajes alternativos, como la inyección de células tumorales a través de la arteria carótida13,14, requieren amplios recursos especializados y dan lugar a grandes incisiones quirúrgicas, que son traumáticas. Además, este método también conduce principalmente a la metástasis dentro de los propios tejidos cerebrales, en lugar de leptomeninges, y es lento e ineficiente para establecer modelos de LM15. La inyección en la cisterna magna permite la entrega directa de células tumorales al espacio leptomeníngeo. Varios estudios han utilizado este enfoque para investigar los mecanismos de la LM y evaluar nuevos tratamientos 6,16,17.
En este manuscrito se presenta un conveniente protocolo de inyección trans-cisterna magna que implica una punción percutánea directa para generar de forma rápida y estable una mayor cantidad de ratones con LM. Este método evita la barrera hematoencefálica y, por lo tanto, permite un xenoinjerto eficiente de células tumorales en el espacio de las leptomeninges. También reduce significativamente el trauma quirúrgico y el tiempo del procedimiento, al tiempo que induce de manera confiable la LM en ratones. Confirmamos la aparición de LM con mínima infiltración en el parénquima cerebral, verificada por microscopía de dos fotones y análisis histológico. Por lo tanto, el modelo resultante replica fielmente el complejo microambiente de LM, proporcionando una herramienta valiosa para estudiar los mecanismos celulares y patológicos asociados a la enfermedad y evaluar posibles terapias.
Protocolo
Todos los procedimientos con animales en este manuscrito fueron revisados y aprobados por el Comité de Revisión de Ética y Bienestar Animal de Laboratorio (ZJU20230155) de ZJU. Los ratones C57BL/6J y NSG se obtuvieron y se alojaron en condiciones libres de patógenos específicos en el Centro de Animales de Laboratorio de ZJU. Este protocolo utiliza la línea celular de cáncer de pulmón murino, carcinoma de pulmón de Lewis (LLC1), y la línea celular de cáncer de pulmón humano, A549, ambas marcadas con GFP y luciferasa de luciérnaga. Ambas líneas celulares son amablemente proporcionadas por el Dr. Xiang H. F. Zhang (Baylor College of Medicine, EE.UU.)18. Aquí, usamos celdas LLC1 como ejemplo. El procedimiento para la inyección de células A549 es casi idéntico, excepto que se inyectaron 6 x 104 células A549 en ratones NSG.
1. Preparación de las células cancerosas para la inyección
- Cultivo de 1,0 x 106 células LLC1 en DMEM suplementado con 10% de suero fetal bovino (FBS) y 0,1 mg/mL de penicilina-estreptomicina a 37 °C en una incubadora de 5% de CO2 . Cuando las células alcancen el 70%-90% de confluencia, tripsinícelas durante 1 minuto utilizando 2 mL de solución de tripsina/EDTA al 0,25%. Centrifugar las células a 300 x g durante 3 min, lavarlas 2 veces con PBS helado y volver a suspenderlas en 1 ml de solución salina tamponada con fosfato (PBS).
- Evaluar la concentración de células viables utilizando una solución de azul de tripano y un hemocitómetro19. Asegúrese de que la viabilidad de la célula sea superior al 90%, y que la mayoría de las células sean únicas. Ajuste la concentración de celdas a 2 x 106 celdas/mL en PBS helado.
- Alícuota 50 μL de la suspensión celular en tubos de microcentrífuga separados para evitar el pipeteo repetido.
- Mantenga las suspensiones celulares en hielo hasta que estén listas para la inyección. Inyecte 10 μL de células LLC1 marcadas con GFP-luciferasa por ratón en este protocolo, lo que corresponde a 2 x 104 células por ratón.
NOTA: Ajuste el número de células según sea necesario en función de la cinética metastásica de las líneas celulares inyectadas.
2. Preparación de ratones
NOTA: En este estudio, se utilizaron ratones machos C57BL/6J, de 6 a 8 semanas de edad.
- Autoclave todos los instrumentos quirúrgicos y guantes embalados con paños quirúrgicos. Desinfecte el equipo de trabajo y el equipo no quirúrgico con etanol al 75%, luego cubra el área de trabajo con cortinas impermeables.
- Prepare una jaula limpia para animales y una almohadilla térmica para la recuperación posterior al procedimiento.
- Anestesiar al ratón inyectando por vía subcutánea tribromoetanol al 2% (200 mg/kg). Verifique la profundidad de la anestesia con una prueba de pellizco antes de continuar. Aplique un ungüento oftálmico estéril para proteger los ojos del daño corneal una vez que el ratón esté anestesiado.
- Afeita el pelaje de la región occipital posterior con una maquinilla, seguido de la aplicación de cremas depilatorias para eliminar completamente el pelaje en la misma región.
- Coloque el ratón boca abajo con el cuello colocado sobre un tubo de centrífuga de 15 ml. Asegure la cabeza y la parte inferior de la espalda con cinta adhesiva y palpe el espacio entre el occipucio y la vértebra C1 con el dedo índice (Figura 1).
- Desinfecte la región occipital posterior con tres rondas de limpieza con hisopos de algodón estériles empapados en etanol al 75%, seguidos de un exfoliante quirúrgico betadine. Cubra las partes no estériles del animal con un paño estéril.
3. Inyección de cisterna magna
NOTA: Se requieren técnicas asépticas para los siguientes pasos, incluido el uso de equipo de protección personal y guantes estériles.
- Pipetear suavemente la suspensión celular y aspirar 10 μL para inyección con una jeringa de insulina de 31 G y 8 mm.
- Palpar el área entre el occipucio y C1 del ratón con el dedo índice para localizar el sitio preciso de la punción en el margen medio inferior del cráneo occipital posterior. Marque este sitio si es necesario.
- Inserte la aguja en un ángulo de 45°-50° en la cisterna magna a través del sitio de punción identificado, avanzando hasta una profundidad de 4 mm. Una sensación distintiva de avance indica que la aguja ha entrado con éxito en la cisterna magna.
- Si el sitio de la punción es difícil de localizar, haga una pequeña incisión de 3-5 mm a la altura de la oreja para exponer la línea media posterior. Si se requiere una incisión quirúrgica, administrar Meloxicam (5 mg/kg/día) y Buprenorfina (0,1 mg/kg) por vía subcutánea 1 h antes de la cirugía.
- Inyecte lentamente la suspensión celular avanzando el émbolo de la jeringa, manteniendo la jeringa firme con la mano colocada sobre la mesa.
- Después de la inoculación, mantenga la jeringa en su lugar durante 10 segundos adicionales para permitir que la presión intracraneal se equilibre. A continuación, retire la aguja y presione el lugar de la punción con un bastoncillo de algodón estéril durante 1-2 minutos.
4. Cuidados posteriores a la inyección
- Transfiera a los animales a jaulas limpias en una almohadilla térmica y vigílelos de cerca hasta que se hayan recuperado por completo.
- En caso de que se haga una incisión, cierre la herida con pegamento tisular y clips. Administre analgésicos adicionales durante 2-3 días después de la cirugía para controlar el dolor y ayudar a la recuperación.
- Monitoree de cerca a los ratones durante 7 días después del procedimiento y verifique diariamente las actividades físicas de los animales y la apariencia que rodea el sitio de la inyección.
5. Evaluación del crecimiento tumoral leptomeníngeo
- Imágenes de bioluminiscencia
- Anestesiar al ratón y administrar D-luciferina (150 μg/g) en la vena retroorbitaria. Coloque los ratones en la cámara de imágenes, colocándolos en un cono nasal designado en el colector de anestesia. Utilice deflectores de luz entre animales para minimizar la interferencia de la señal.
- Visualice a los animales inmediatamente utilizando el sistema IVIS con un tiempo de exposición entre 0,5 s y 2 min6. Confirmar la inoculación exitosa de células tumorales en el espacio leptomeníngeo mediante una señal bioluminiscente dispersiva a través de la cabeza y la médula espinal (Figura 2A).
- Monitorizar la progresión de la LM mediante imágenes de bioluminiscencia cada 4 días. Ajuste los intervalos de imágenes en función de la cinética de crecimiento tumoral.
- Análisis histológico
- Anestesiar a los ratones cuando eran significativamente menos activos o habían perdido el 20% de su peso corporal y cortar la piel y las costillas para exponer su cavidad torácica. Inserte con cuidado una cánula de punta roma en el ventrículo izquierdo y avance la cánula hacia la aorta ascendente. Perfundir al animal con 20 mL de PBS a través de la cánula lentamente.
- Use unas tijeras para quitar la cabeza y haga una incisión en la línea media del cuero cabelludo para exponer el cráneo. Extirpe los tejidos blandos circundantes. Corte a lo largo de la cresta orbital, luego inserte unas tijeras en el foramen magnum y avance con cuidado a lo largo de la superficie interna del cráneo con presión hacia arriba para evitar daños en los tejidos.
- Retire los huesos craneales y luego extraiga suavemente el cerebro. Fijar el cerebro en paraformaldehído al 4% a 4 °C durante 24 h y luego equilibrarlo en una solución de PBS al 15% de sacarosa durante 24 h, seguida de una solución de PBS al 30% de sacarosa durante otras 24 h a 4 °C.
- Coloque el tejido en un molde criomático lleno de compuesto de temperatura óptima de corte (OCT) y luego guárdelo en hielo seco durante 30 min20.
- Corte el cerebro incrustado en OCT en secciones de 10 μm de grosor con un criostato. Almacene las secciones en un congelador a -80 °C hasta su nueva aplicación.
- Realizar la tinción de hematoxilina/eosina (H&E) en los portaobjetos cerebrales21. La presencia de células tumorales en el borde del cerebro indica que la metástasis ocurre exclusivamente en el espacio leptomeníngeo (Figura 3 y Tabla 1).
- Microscopía de dos fotones
- Anestesiar a los ratones con LM. Retire el cuero cabelludo que cubre la superficie dorsal del cráneo con pinzas y tijeras. Use una hoja de bisturí para extraer el periostio delgado de la superficie del cráneo.
- Adelgace el cráneo con un taladro abrasivo hasta que los vasos del pial sean visibles a través del cráneo adelgazado. Estabilice el área de observación de la cabeza del ratón con un cabezal triangular asegurado por adhesivo tisular 22,23.
- Administrar 0,025 mL de TRITC-dextrano al 5% (p/v) en una vena infraorbitaria para etiquetar los vasos sanguíneos22.
- Realizar microscopía de dos fotones a través de las ventanas de imagen y reconstruir el espacio leptomeníngeo (Figura 4). Detecte el hueso por fluorescencia armónica de segundo a 450 nm de emisión con excitación de 900 nm24. Visualice las células tumorales marcadas con GFP y los vasos marcados con dextrano mediante la recopilación de señales de fluorescencia con una emisión de 507 nm y 572 nm con una excitación de 900 nm y 1000 nm, respectivamente.
- Microscopio estereoscópico de fluorescencia
- Retire el cerebro del ratón y colóquelo bajo un microscopio estereoscópico. Visualice las celdas marcadas con GFP mediante un conjunto de filtros específicos de GFP (Figura 5).
Resultados
La Figura 1 ilustra la ubicación del ratón para la inyección y el sitio de punción desde las vistas lateral y frontal. La Figura 2 muestra imágenes representativas de bioluminiscencia in vivo de animales probados para generar LM a través de diferentes enfoques. Las células LLC1 marcadas con GFP-luciferasa se inyectaron en los animales a través de diferentes rutas, seguidas de imágenes bioluminiscentes. Como se muestra en la Figura 2A, 10 días después de la inyección de magna dentro de la cisterna, la señal bioluminiscente estaba presente en el cerebro del ratón y se distribuyó a lo largo de la médula espinal, lo que indica un injerto exitoso de células tumorales en el espacio leptomeníngeo. Por el contrario, las inyecciones intracarótidas de células tumorales generaron predominantemente metástasis en el parénquima cerebral sin afectación significativa de leptomeninges 21 días después de la inyección (Figura 2B). Para el método de inyección intracardíaca, las imágenes de bioluminiscencia desde la posición supina muestran que la mayoría de las metástasis crecen en los órganos extracraneales (izquierda), y las imágenes desde la vista prona confirmaron que ninguno de los tres ratones desarrolló LM (derecha; Figura 2C). La misma distribución de células tumorales se observó 10 días después de la inyección de cisterna magna de 6 x 104 (10 μL) células A549 marcadas con GFP-luciferasa en ratones NSG (Figura 2D), lo que sugiere que este enfoque genera LM de manera robusta en diferentes cepas de ratones con diferentes líneas celulares.
La Figura 3 muestra imágenes representativas de la tinción histológica e inmunofluorescente de los tejidos cerebrales después de 14 días de inyección de células tumorales a través de la cisterna magna. La tinción con hematoxilina-eosina (H&E) muestra la mayoría de las áreas tumorales localizadas en el espacio leptomeníngeo (Figura 3A). La Figura 3B muestra que la mayoría de las células tumorales marcadas con GFP se agruparon en las meninges y los ventrículos, mientras que las células tumorales en la región del parénquima son en su mayoría células individuales. La Figura 4 presenta imágenes representativas de dos fotones del espacio leptomeníngeo de un ratón con LM. El hueso craneal (azul) se detectó recogiendo la fluorescencia del segundo armónico a 450 nm de emisión con excitación de 900 nm24. La vasculatura (rojo) fue marcada con TRITC-dextrano (70 kDa). Se encontraron células tumorales marcadas con GFP (verde) entre el hueso craneal (azul) y el parénquima cerebral, específicamente dentro de la región leptomeníngea. La figura 5 muestra la presencia de células tumorales marcadas con GFP en la superficie cerebral, visualizadas mediante un microscopio de fluorescencia estereoscópica. En la Tabla 1 se muestra la comparación entre los tres métodos.

Figura 1: Preparación del animal y sitio de punción para la inyección de magna intracisterna. (A) El ratón se coloca en posición prona, con el cuello cubierto por un tubo de centrífuga de 15 mL. La cabeza y la parte inferior de la espalda están aseguradas con cinta adhesiva. La aguja se inserta en un ángulo de 45°-50° en la cisterna magna en el margen inferior mediano. (B) La aguja se inserta en el margen inferior mediano del cráneo occipital posterior. Haga clic aquí para ver una versión más grande de esta figura.
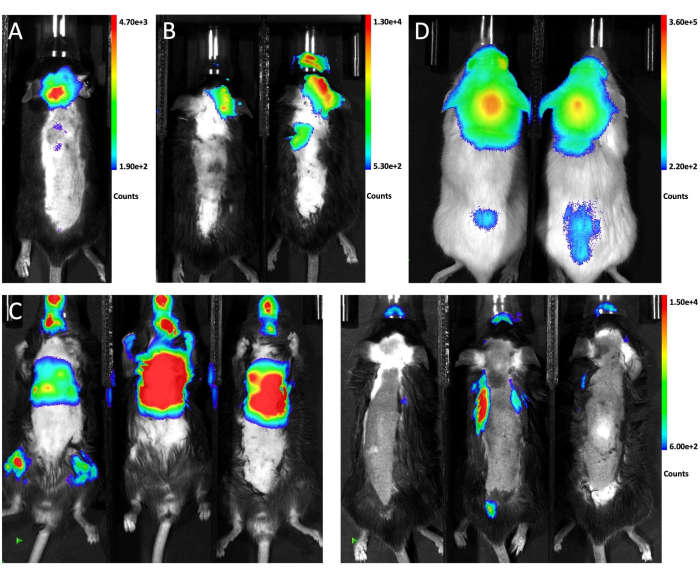
Figura 2: Imágenes representativas de bioluminiscencia in vivo de ratones que recibieron diferentes métodos de inyección. (A)La señal de bioluminiscencia in vivo de todo el animal después de la inyección de células LLC1 dentro de la cisterna magna. (B) La imagen de bioluminiscencia in vivo de los ratones después de la inyección intracarótida de células LLC1. (C) La señal de bioluminiscencia in vivo de los ratones después de la inyección intracardíaca de células LLC1. El lado izquierdo muestra la vista supina y el lado derecho muestra la vista prona. (D) La imagen de bioluminiscencia de los ratones NSG después de la inyección de células A549 a través de la cisterna magna.a Haga clic aquí para ver una versión más grande de esta figura.
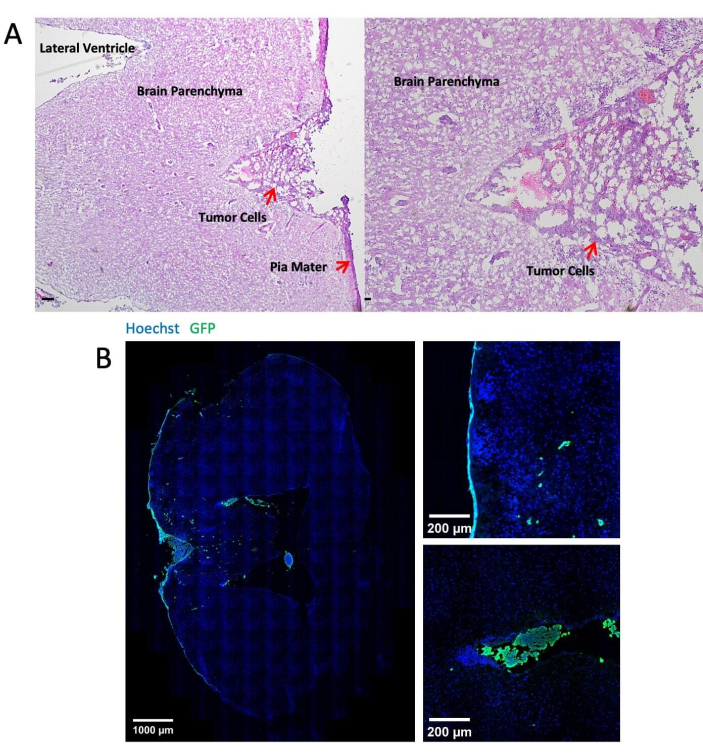
Figura 3: Imágenes representativas de la tinción histológica e inmunofluorescente. (A) La tinción representativa de H&E muestra células LLC1 depositadas principalmente en la superficie de las meninges y en los ventrículos. Barra de escala = 25 μm. (B) Imágenes de tinción inmunofluorescente del cerebro portador de tumores LLC1. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes representativas de dos fotones de un ratón con LM. Las células tumorales marcadas con GFP (verde) se encuentran exclusivamente entre el cráneo (azul) y el parénquima cerebral (rojo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Imágenes representativas del microscopio de fluorescencia estereoscópica. (A) Campo visual global del cerebro del ratón bajo el microscopio. (B) Se presentaron células tumorales marcadas con GFP en la superficie del cerebro, que emiten fluorescencia verde. Haga clic aquí para ver una versión más grande de esta figura.
| Duración del procedimiento/min | Incidencia de LM observada 14 días después de la inyección | Tasa de tumores extracraneales | Tasa de tumores grandes de parénquima encefálico | |
| Inyección magna intra-cisterna | ~5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| Inyección intracarótida | ~20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| Inyección intracardíaca | ~5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
Tabla 1: Comparación de tres métodos de inyección diferentes en cuanto a la duración de la operación, la incidencia de metástasis leptomeníngeas, tumores extracraneales y la tasa de tumores grandes del parénquima cerebral.
Discusión
La LM es una afección agresiva y mortal. Una vez que las células tumorales hacen metástasis en el espacio lleno de líquido cefalorraquídeo, se diseminan rápidamente por todo el sistema nervioso central25. Estas células se asientan e invaden el cerebro, la médula espinal, los nervios craneales y espinales, lo que en última instancia conduce a un rápido deterioro neurológico yfinalmente a la muerte. Para comprender mejor los mecanismos fisiopatológicos subyacentes y evaluar las posibles estrategias terapéuticas, es crucial desarrollar un modelo in vivo eficiente que recapitule el proceso metastásico y el microambiente circundante en la metástasis leptomeníngea.
Un informe previo ha demostrado que la LM puede ser inducida en modelos murinos mediante la inyección directa de células tumorales en el hemisferio cerebeloso derecho15. Sin embargo, este enfoque a menudo no produce metástasis en la región subfrontal o en la médula espinal distal en algunos sujetos. Un estudio reciente demostró que los tumores derivados de células mutadas de cáncer de pulmón de células pequeñas, cuando se implantan por vía subcutánea, pueden diseminarse espontáneamente al espacio leptomeníngeo después de un período de latencia prolongado14. Tras la expansión in vitro de células tumorales a partir de LM espontánea, los autores establecieron con éxito una sublínea celular capaz de desarrollar LM con una infiltración mínima del parénquima cerebral a través de la inyección intracarótida en la arteria carótida. Si bien este procedimiento capta el curso natural de la diseminación metastásica al espacio leptomeníngeo, es ineficiente y requiere mucho tiempo, ya que la mayoría de los ratones mueren por metástasis en otros órganos antes de que la LM pueda desarrollarse completamente. Además, este abordaje requiere una microcirugía sofisticada, que impone un trauma considerable al sujeto26. Alternativamente, la inyección directa de células tumorales en la cisterna magna resultó en una extensa afectación leptomeníngea, que se asemeja mucho a la condición observada en los pacientes con LM15. Sin embargo, algunos métodos de inyección intracisternal requieren disección de la piel y el músculo, lo que resulta en un traumatismo significativo y un mayor riesgo de infección intracraneal, lo que puede alterar las características fisiopatológicas de la LM.
En este trabajo describimos un método mínimamente invasivo para inyectar células tumorales en la cisterna magna a través de una vía de punción percutánea. A diferencia de otros enfoques quirúrgicos, las inyecciones percutáneas evitan los pasos invasivos, como la incisión en la piel, minimizando así el riesgo de infección. Con un posicionamiento preciso, el procedimiento se puede completar en solo unos minutos, lo que reduce significativamente el tiempo de atención tanto operatoria como postoperatoria. Además, la inyección directa de células tumorales en la cisterna magna mejora el injerto de células tumorales dentro del espacio leptomeníngeo y reduce la incidencia de colonización de órganos extracraneales (Tabla 1).
Hay algunas consideraciones críticas e información de solución de problemas para el protocolo. Aunque esperamos que el procedimiento actual reduzca la necesidad de personal altamente calificado y simplifique todo el proceso, sigue siendo fundamental que el operador identifique con precisión el sitio de punción. Los operadores deben estar familiarizados con la anatomía del ratón, en particular con la fosa craneal posterior y la región cervical, para garantizar un posicionamiento preciso. Si la aguja encuentra una superficie ósea durante la inserción, el sitio de punción puede estar demasiado alto y debe ajustarse hacia abajo de manera adecuada. Para garantizar el éxito de las inyecciones, colocamos y aseguramos a los animales sobre un tubo de centrífuga de 15 ml para exponer completamente el lugar de la inyección. También descubrimos que la jeringa de insulina 31G de 8 mm funciona mejor que la jeringa Hamilton convencional para perforar la cisterna magna. Es probable que esto se deba a que la aguja de la jeringa Hamilton es menos eficaz para penetrar capas gruesas de tejido y proporciona menos control durante la inserción. La profundidad (4 mm) y el ángulo (45°-50°) de inserción de la aguja son cruciales. La profundidad excesiva puede conducir al crecimiento tumoral en el tronco encefálico, mientras que la profundidad insuficiente puede resultar en tumores subcutáneos. Por lo tanto, para minimizar el riesgo de muerte accidental por un aumento repentino de la presión intracraneal, la inyección debe realizarse lo más lentamente posible.
Sin embargo, este protocolo no está exento de limitaciones. A diferencia de los métodos tradicionales, el procedimiento descrito se basa en la posición precisa de los animales y en la retroalimentación sensacional del operador, que introduce un grado de variabilidad. Con un control cuidadoso de la profundidad de inyección y la práctica repetida, se puede lograr una alta tasa de éxito. Otra desventaja importante del procedimiento actual es que evita los primeros pasos de la cascada metastásica y, por lo tanto, no puede recapitular todo el curso de la LM en los pacientes. En general, el procedimiento presentado es técnicamente sencillo y altamente eficiente para establecer modelos murinos de LM, lo que representa una valiosa plataforma preclínica para estudios relacionados con LM.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores agradecen a los miembros del laboratorio Zhang por sus valiosas discusiones y asistencia a lo largo de este estudio. W.Z. cuenta con el apoyo de los Fondos de Investigación Fundamental para las Universidades Provinciales de Zhejiang (2023QZJH60), el Programa del Fondo de Ciencia para Jóvenes Académicos Distinguidos de la Fundación Nacional de Ciencias Naturales de China (588020-X42306/041) y el fondo inicial del Instituto de Ciencias de la Vida de la Universidad de Zhejiang.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
Referencias
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados