Method Article
Minimalinvasives Cisterna magna-Injektionsmodell für Studien zur leptomeningealen Metastasierung bei Mäusen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt ein Verfahren zur Injektion von Tumorzellen über den perkutanen Punktionsweg in die Cisterna magna, das bei Mäusen eine robuste leptomeningeale Metastasierung induziert und so das Trauma und die extrakranielle Tumorlast reduziert.
Zusammenfassung
Die leptomeningeale Metastasierung (LM), die Ausbreitung von Krebszellen in die mit Liquor (CSF) gefüllten Leptomeningen, ist eine seltene, aber verheerende Komplikation bei fortgeschrittenen soliden Tumoren. Patienten mit LM haben oft eine schlechte Prognose, das Überleben wird in Wochen bis Monaten gemessen. Die Entwicklung von In-vivo-Modellen , die die Komplexität von LM genau nachbilden, ist für das Verständnis ihrer zellulären und pathologischen Mechanismen und die Bewertung potenzieller Therapien unerlässlich. Maus-LM-Modelle werden typischerweise durch intrakardiale, Carotis-Arterien- oder Cisterna magna-Injektion von Tumorzellen erstellt. Intrakardiale oder Carotis-Injektionen führen jedoch häufig zu einer erheblichen extrakraniellen und Hirntumorbelastung, was die biolumineszierende Bildgebung erschwert und zu einer Mortalität führt, die nicht mit LM zusammenhängt. In der Zwischenzeit erfordert die konventionelle Cisterna magna-Injektion invasive Verfahren wie Hautschnitte und Muskeldissektionen, was sie sowohl traumatisch als auch ressourcenintensiv macht. Hier beschreiben wir ein minimal-invasives Verfahren zur Injektion von Tumorzellen in den leptomeningealen Raum durch die Cisterna magna, ohne dass ein Hautschnitt erforderlich ist. Dieser Ansatz reduziert die extrakranielle Tumorbildung, minimiert das chirurgische Trauma und verkürzt die Zeit und den postoperativen Pflegeaufwand im Vergleich zu anderen chirurgischen Methoden. Wichtig ist, dass es konsistent LM mit minimaler Infiltration des Hirnparenchyms induziert, was durch Zwei-Photonen-Mikroskopie und histologische Analyse bestätigt wurde. Dieser optimierte Ansatz bietet ein effizientes und zuverlässiges Modell für die Untersuchung von LM in der präklinischen Forschung.
Einleitung
Die metastasierende Erkrankung bleibt die größte Herausforderung für Patienten mit fortgeschrittenen Krebserkrankungen. Die leptomeningeale Metastasierung (LM) bezieht sich auf die Ausbreitung von Krebszellen auf die Pia mater, die Arachnoidea mater und den Subarachnoidalraum. LM aus soliden Tumoren wird bei Lungenkrebs (9 %-25 %), Brustkrebs (5 %-20 %) und Melanomen (6 %-18 %)1,2 immer häufiger, was vor allem auf ein längeres Überleben und verbesserte Diagnosetechniken zurückzuführen ist. Krebszellen können auf verschiedenen Wegen in den leptomeningealen Raum eindringen, darunter 1) direkte Invasion durch periphere Strukturen wie Dura mater, Knochen und Nerven; 2) hämatogene Ausbreitung durch das Venensystem; und 3) Eintritt durch den arteriellen Kreislauf, wo Krebszellen durch gefensterte Gefäße in den Plexus choroideus und anschließend in die mit Liquor gefüllten Ventrikel gleiten 3,4,5. Tumorzellen, die in den leptomeningealen Raum gelangen, sehen sich mit mehreren Herausforderungen konfrontiert, darunter der Entzug von Wachstumsfaktoren, begrenzte metabolische Zwischenprodukte und hypoxische Bedingungen6. Aufgrund des Mangels an geeigneten Werkzeugen und Techniken ist jedoch nur unzureichend verstanden, wie Tumorzellen diese Wege navigieren und unwirtliche Bedingungen überwinden, um den leptomeningealen Raum zu besiedeln. Trotz Fortschritten bei multimodalen Therapien, einschließlich Strahlentherapie, systemischer Behandlung und intrathekaler Injektionstherapie, bleibt die Prognose für LM-Patienten schlecht, wobei das Überleben in der Regel zwischen 2 und 4 Monaten liegt 3,7,8,9. Daher besteht ein dringender Bedarf an einem tieferen Verständnis der Biologie der leptomeningealen Metastasen, um die derzeitigen Behandlungen zu verbessern und neue, zielgerichtete Therapien zu entwickeln. Um dies zu erreichen, müssen In-vivo-Modelle entwickelt werden, die die komplexen Merkmale von LM rekapitulieren.
Im Gegensatz zu Metastasen in Organen wie Leber, Knochen und Gehirn entwickelt sich LM in der Regel Jahre nach der Diagnose des Primärtumors 10,11,12. In ähnlicher Weise ist LM in Mausmodellen mit spontanen Metastasen selten, da es eine geringe Inzidenz aufweist und Mäuse typischerweise Metastasen an anderen Stellen erliegen. Experimentelle murine LM-Modelle können durch verschiedene Methoden erstellt werden, einschließlich intrakardialer, intrakarotisartiger Arterie oder alternativ durch direkte Injektion in die Cisterna magna oder zerebrale Ventrikel. Die intrakardiale Injektion von Krebszellen ist zwar weit verbreitet9, führt jedoch häufig zu einer signifikanten extrakraniellen Tumorlast, die zu einer Mortalität führt, die nicht mit LM zusammenhängt. Alternative Ansätze, wie die Injektion von Tumorzellen durch die Halsschlagader13,14, erfordern umfangreiche spezialisierte Ressourcen und führen zu großen chirurgischen Schnitten, die traumatisch sind. Darüber hinaus führt diese Methode in erster Linie zu Metastasen im Hirngewebe selbst und nicht zu Leptomeningen und ist zeitaufwändig und ineffizient für die Etablierung von LM-Modellen15. Die Injektion in die Cisterna magna ermöglicht die direkte Abgabe von Tumorzellen in den leptomeningealen Raum. Mehrere Studien haben diesen Ansatz verwendet, um LM-Mechanismen zu untersuchen und neue Behandlungen zu evaluieren 6,16,17.
In diesem Manuskript stellen wir ein praktisches transcisterna magna-Injektionsprotokoll vor, das eine direkte perkutane Punktion beinhaltet, um schnell und stabil eine größere Anzahl von Mäusen mit LM zu erzeugen. Diese Methode umgeht die Gehirn-Blut-Schranke und ermöglicht somit eine effiziente Xenotransplantation von Tumorzellen im Leptomeninge-Raum. Es reduziert auch das chirurgische Trauma und die Eingriffszeit erheblich und induziert zuverlässig LM bei Mäusen. Wir bestätigten das Auftreten von LM mit minimaler Infiltration in das Hirnparenchym, was durch Zwei-Photonen-Mikroskopie und histologische Analyse bestätigt wurde. Daher repliziert das resultierende Modell die komplexe Mikroumgebung von LM originalgetreu und bietet ein wertvolles Werkzeug zur Untersuchung krankheitsassoziierter zellulärer und pathologischer Mechanismen und zur Bewertung potenzieller Therapien.
Protokoll
Alle tierexperimentellen Verfahren in diesem Manuskript wurden von der ZJU-Labortierschutz- und Ethikprüfungskommission (ZJU20230155) überprüft und genehmigt. C57BL/6J- und NSG-Mäuse wurden aus dem ZJU-Versuchstierzentrum gewonnen und unter spezifisch pathogenfreien Bedingungen untergebracht. Dieses Protokoll verwendet die murine Lungenkrebszelllinie, das Lewis-Lungenkarzinom (LLC1), und die humane Lungenkrebszelllinie A549, die beide mit GFP und Glühwürmchen-Luziferase markiert sind. Beide Zelllinien werden freundlicherweise von Dr. Xiang H. F. Zhang (Baylor College of Medicine, USA)18 zur Verfügung gestellt. Hier verwenden wir LLC1-Zellen als Beispiel. Das Verfahren zur Injektion von A549-Zellen ist nahezu identisch, mit der Ausnahme, dass 6 x 104 A549-Zellen in NSG-Mäuse injiziert wurden.
1. Vorbereitung von Krebszellen für die Injektion
- Kultivieren Sie 1,0 x 106 LLC1-Zellen in DMEM, ergänzt mit 10 % fötalem Rinderserum (FBS) und 0,1 mg/ml Penicillin-Streptomycin bei 37 °C in einem 5 % CO2 -Inkubator. Wenn die Zellen eine Konfluenz von 70 % bis 90 % erreichen, trypsinisieren Sie sie 1 Minute lang mit 2 ml 0,25 % Trypsin/EDTA-Lösung. Zentrifugieren Sie die Zellen bei 300 x g für 3 min, waschen Sie sie 2x mit eiskaltem PBS und suspendieren Sie sie wieder in 1 mL phosphatgepufferter Kochsalzlösung (PBS).
- Die Konzentration lebensfähiger Zellen ist mit einer Trypanblau-Lösung und einem Hämozytometer19 zu bestimmen. Stellen Sie sicher, dass die Zellviabilität mehr als 90 % beträgt, wobei die Mehrheit der Zellen einzeln ist. Stellen Sie die Zellkonzentration auf 2 x 106 Zellen/ml in eiskaltem PBS ein.
- Aliquotieren Sie 50 μl der Zellsuspension in separate Mikrozentrifugenröhrchen, um wiederholtes Pipettieren zu vermeiden.
- Bewahren Sie die Zellsuspensionen bis zur Injektion auf Eis auf. Injizieren Sie 10 μl GFP-Luciferase-markierte LLC1-Zellen pro Maus in diesem Protokoll, entsprechend 2 x 104 Zellen pro Maus.
HINWEIS: Passen Sie die Zellzahl nach Bedarf basierend auf der metastatischen Kinetik der injizierten Zelllinien an.
2. Vorbereitung der Mäuse
HINWEIS: In dieser Studie wurden männliche C57BL/6J-Mäuse im Alter von 6-8 Wochen verwendet.
- Autoklavieren Sie alle chirurgischen Instrumente und Handschuhe, die mit OP-Abdecktüchern gefüllt sind. Desinfizieren Sie die Tischgeräte und nicht-chirurgischen Geräte mit 75 % Ethanol und decken Sie dann den Arbeitsbereich mit wasserdichten Vorhängen ab.
- Bereiten Sie einen sauberen Haltungskäfig und ein Wärmekissen für die Genesung nach dem Eingriff vor.
- Betäuben Sie die Maus durch subkutane Injektion von 2 % Tribromethanol (200 mg/kg). Überprüfen Sie die Narkosetiefe mit einem Pinch-Test, bevor Sie fortfahren. Tragen Sie eine sterile Augensalbe auf, um die Augen vor Hornhautschäden zu schützen, sobald die Maus betäubt ist.
- Rasieren Sie das Fell aus der hinteren Hinterhauptregion mit einer Schermaschine und tragen Sie anschließend Enthaarungscremes auf, um das Fell in derselben Region vollständig zu entfernen.
- Positionieren Sie die Maus in Bauchlage mit dem Hals über einem 15-ml-Zentrifugenröhrchen. Sichern Sie den Kopf und den unteren Rücken mit Klebeband und tasten Sie den Raum zwischen Hinterhaupt und C1-Wirbel mit dem Zeigefinger ab (Abbildung 1).
- Desinfizieren Sie den hinteren Hinterhauptbereich durch drei Wischrunden mit 75 % ethanolgetränkten sterilen Wattestäbchen, gefolgt von einem chirurgischen Betadin-Peeling. Decken Sie die unsterilen Teile des Tieres mit einem sterilen Tuch ab.
3. Cisterna magna Injektion
HINWEIS: Für die folgenden Schritte sind aseptische Techniken erforderlich, einschließlich der Verwendung von persönlicher Schutzausrüstung und sterilen Handschuhen.
- Pipettieren Sie die Zellsuspension vorsichtig und aspirieren Sie 10 μl zur Injektion mit einer 31G-Insulinspritze mit 8 mm.
- Palpieren Sie den Bereich zwischen dem Hinterhauptbein und C1 der Maus mit dem Zeigefinger, um die genaue Punktionsstelle am unteren Medianrand des hinteren Hinterhauptschädels zu lokalisieren. Markieren Sie diese Seite bei Bedarf.
- Führen Sie die Nadel in einem Winkel von 45°-50° durch die identifizierte Einstichstelle in die Cisterna magna ein und dringen Sie bis zu einer Tiefe von 4 mm vor. Ein deutliches Durchbruchsgefühl zeigt an, dass die Nadel erfolgreich in die Cisterna magna eingedrungen ist.
- Wenn die Einstichstelle schwer zu lokalisieren ist, machen Sie einen kleinen Schnitt von 3-5 mm auf Ohrhöhe, um die hintere Mittellinie freizulegen. Wenn ein chirurgischer Schnitt erforderlich ist, verabreichen Sie Meloxicam (5 mg/kg/Tag) und Buprenorphin (0,1 mg/kg) subkutan 1 h vor der Operation.
- Injizieren Sie die Zellsuspension langsam, indem Sie den Spritzenkolben vorschieben und die Spritze ruhig halten, während Sie die Hand auf den Tisch legen.
- Halten Sie die Spritze nach der Inokulation weitere 10 s an Ort und Stelle, damit sich der intrakranielle Druck ausgleichen kann. Ziehen Sie dann die Nadel zurück und drücken Sie mit einem sterilen Wattestäbchen 1-2 Minuten lang auf die Einstichstelle.
4. Pflege nach der Injektion
- Bringen Sie die Tiere in saubere Käfige auf einem Heizkissen und überwachen Sie sie genau, bis sie sich vollständig erholt haben.
- Falls ein Schnitt gemacht wird, verschließen Sie die Wunde mit Gewebekleber und Klammern. Verabreichen Sie 2-3 Tage nach der Operation zusätzliche Schmerzmittel, um die Schmerzen zu kontrollieren und die Genesung zu unterstützen.
- Überwachen Sie die Mäuse nach dem Eingriff 7 Tage lang engmaschig und überprüfen Sie täglich die körperlichen Aktivitäten der Tiere und das Erscheinungsbild in der Umgebung der Injektionsstelle.
5. Beurteilung des Wachstums von leptomeningealen Tumoren
- Biolumineszenz-Bildgebung
- Betäuben Sie die Maus und verabreichen Sie D-Luciferin (150 μg/g) in die retroorbitale Vene. Legen Sie die Mäuse in die Bildgebungskammer und positionieren Sie sie in einem dafür vorgesehenen Nasenkonus auf dem Anästhesieverteiler. Verwenden Sie Lichtleitbleche zwischen den Tieren, um Signalstörungen zu minimieren.
- Bilden Sie die Tiere sofort mit dem IVIS-System mit einer Belichtungszeit zwischen 0,5 s und 2 minab 6. Bestätigen Sie die erfolgreiche Inokulation von Tumorzellen im leptomeningealen Raum durch ein dispersives Biolumineszenzsignal über den Kopf und das Rückenmark (Abbildung 2A).
- Überwachen Sie das Fortschreiten der LM alle 4 Tage durch Biolumineszenz-Bildgebung. Passen Sie die Bildgebungsintervalle basierend auf der Kinetik des Tumorwachstums an.
- Histologische Analyse
- Betäuben Sie die Mäuse, wenn sie deutlich weniger aktiv waren oder 20 % ihres Körpergewichts verloren hatten, und schnitten Sie die Haut und die Rippen, um ihre Brusthöhle freizulegen. Führen Sie vorsichtig eine Kanüle mit stumpfer Spitze in die linke Herzkammer ein und schieben Sie die Kanüle in die aufsteigende Aorta vor. Perfundieren Sie das Tier langsam mit 20 mL PBS durch die Kanüle.
- Verwenden Sie eine Schere, um den Kopf zu entfernen, und machen Sie einen Schnitt in der Mitte der Kopfhaut, um den Schädel freizulegen. Schneiden Sie die umgebenden Weichteile heraus. Schneiden Sie entlang des Orbitakamms, führen Sie dann eine Schere in das Foramen magnum ein und schieben Sie sich vorsichtig mit Aufwärtsdruck entlang der inneren Oberfläche des Schädels, um Gewebeschäden zu vermeiden.
- Entfernen Sie die Schädelknochen und extrahieren Sie dann vorsichtig das Gehirn. Fixieren Sie das Gehirn 24 h lang in 4 % Paraformaldehyd bei 4 °C und äquilibrieren Sie es dann 24 h lang in 15 % Saccharose-PBS-Lösung, gefolgt von 30 % Saccharose-PBS-Lösung für weitere 24 Stunden bei 4 °C.
- Legen Sie das Gewebe in eine Kryoform, die mit Optimum Cutting Temperature (OCT) gefüllt ist, und lagern Sie es dann 30 min20 auf Trockeneis.
- Schneiden Sie das OCT-eingebettete Gehirn mit einem Kryostaten in 10 μm dicke Abschnitte. Lagern Sie die Abschnitte bis zur weiteren Anwendung in einem -80 °C heißen Gefrierschrank.
- Es wird eine Hämatoxylin/Eosin (H&E)-Färbung auf den Objektträgern des Gehirnsdurchgeführt 21. Das Vorhandensein von Tumorzellen am Hirnrand deutet darauf hin, dass Metastasen ausschließlich im leptomeningealen Raum auftreten (Abbildung 3 und Tabelle 1).
- Zwei-Photonen-Mikroskopie
- Betäuben Sie die Mäuse mit LM. Entfernen Sie die Kopfhaut, die die dorsale Schädeloberfläche bedeckt, mit einer Pinzette und einer Schere. Verwenden Sie eine Skalpellklinge, um das dünne Periost von der Schädeloberfläche zu entfernen.
- Dünnen Sie den Schädel mit einem Schleifbohrer aus, bis die Pialgefäße durch den ausgedünnten Schädel sichtbar sind. Stabilisieren Sie den Beobachtungsbereich des Mauskopfes mit einem dreieckigen Kopfstück, das mit Gewebekleber22,23 befestigt ist.
- 0,025 ml 5 % (w/v) TRITC-Dextran in eine infraorbitale Vene verabreichen, um die Blutgefäße zu markieren22.
- Führen Sie eine Zwei-Photonen-Mikroskopie durch die Bildgebungsfenster durch und rekonstruieren Sie den leptomeningealen Raum (Abbildung 4). Detektion des Knochens durch zweite harmonische Fluoreszenz bei 450 nm Emission mit 900 nm Anregung24. Visualisieren Sie GFP-markierte Tumorzellen und Dextran-markierte Gefäße durch Sammeln von Fluoreszenzsignalen bei 507 nm und 572 nm Emission bei 900 nm bzw. 1000 nm Anregung.
- Stereo-Fluoreszenzmikroskop
- Entfernen Sie das Gehirn der Maus und legen Sie es unter ein Stereomikroskop. Visualisieren Sie GFP-markierte Zellen mit einem GFP-spezifischen Filtersatz (Abbildung 5).
Ergebnisse
Abbildung 1 zeigt die Platzierung der Maus für die Injektion und die Einstichstelle aus der Seiten- und Frontansicht. Abbildung 2 zeigt repräsentative in vivo Biolumineszenzbilder von Tieren, die mit verschiedenen Ansätzen auf die Erzeugung von LM getestet wurden. GFP-Luciferase-markierte LLC1-Zellen wurden den Tieren auf verschiedenen Wegen injiziert, gefolgt von biolumineszierender Bildgebung. Wie in Abbildung 2A gezeigt, war 10 Tage nach der Magna-Injektion in der Zisterne das biolumineszierende Signal im Gehirn der Maus vorhanden und entlang des Rückenmarks verteilt, was auf eine erfolgreiche Transplantation von Tumorzellen im leptomeningealen Raum hinweist. Im Gegensatz dazu erzeugten intrakarotisartige Injektionen von Tumorzellen überwiegend Hirnparenchymmetastasen ohne signifikante Beteiligung an Leptomeningen 21 Tage nach der Injektion (Abbildung 2B). Für die intrakardiale Injektionsmethode zeigt die Biolumineszenz-Bildgebung aus der Rückenlage, dass die meisten Metastasen in extrakraniellen Organen wachsen (links), und Bilder aus der Bauchlage bestätigten, dass keine der drei Mäuse LM entwickelte (rechts; Abbildung 2C). Die gleiche Verteilung der Tumorzellen wurde 10 Tage nach der Zisternen-Magna-Injektion von 6 x 104 (10 μl) GFP-Luciferase-markierten A549-Zellen in NSG-Mäusen beobachtet (Abbildung 2D), was darauf hindeutet, dass ein solcher Ansatz in verschiedenen Mausstämmen mit unterschiedlichen Zelllinien robust LM erzeugt.
Abbildung 3 zeigt repräsentative Bilder der histologischen und immunfluoreszierenden Färbung von Hirngewebe nach 14-tägiger Injektion von Tumorzellen durch die Cisterna magna. Die Hämatoxylin-Eosin (H&E)-Färbung zeigt die Mehrzahl der Tumorareale, die sich im leptomeningealen Raum befinden (Abbildung 3A). Abbildung 3B zeigt, dass die meisten GFP-markierten Tumorzellen in den Hirnhäuten und Ventrikeln geclustert waren, während Tumorzellen in der Parenchymregion meist Einzelzellen sind. Abbildung 4 zeigt repräsentative Zwei-Photonen-Bilder des leptomeningealen Raums einer Maus mit LM. Der Schädelknochen (blau) wurde durch Sammeln der zweiten harmonischen Fluoreszenz bei 450 nm Emission mit 900 nm Anregung24 detektiert. Das Gefäßsystem (rot) wurde mit TRITC-Dextran (70 kDa) markiert. GFP-markierte Tumorzellen (grün) wurden zwischen dem Schädelknochen (blau) und dem Hirnparenchym gefunden, genauer gesagt in der leptomeningealen Region. Abbildung 5 zeigt das Vorhandensein von GFP-markierten Tumorzellen auf der Gehirnoberfläche, sichtbar gemacht mit einem Stereofluoreszenzmikroskop. Tabelle 1 zeigt den Vergleich zwischen den drei Methoden.

Abbildung 1: Vorbereitung und Einstichstelle des Tieres für die Injektion von Intra-Cisterna magna. (A) Die Maus wird in Bauchlage gebracht, wobei ihr Hals über ein 15-ml-Zentrifugenröhrchen gelegt wird. Der Kopf und der untere Rücken sind mit Klebeband gesichert. Die Nadel wird in einem Winkel von 45°-50° in die Cisterna magna am medianen unteren Rand eingeführt. (B) Die Nadel wird am medianen unteren Rand des hinteren Hinterhauptschädels eingeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
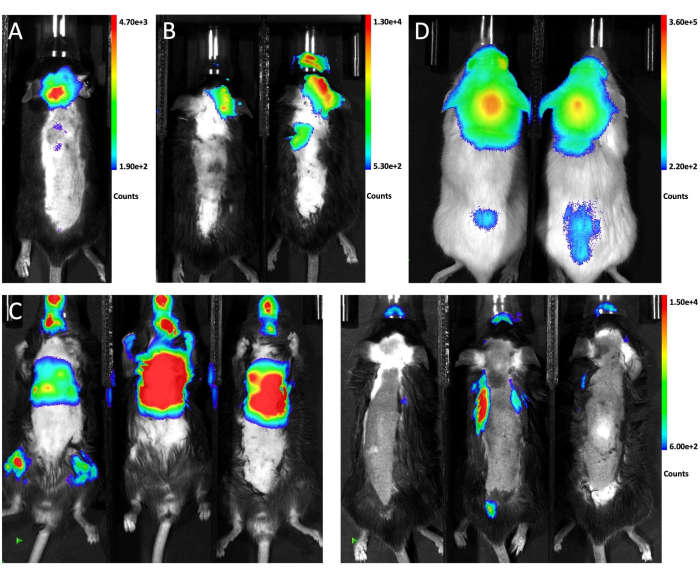
Abbildung 2: Repräsentative in vivo Biolumineszenzbilder von Mäusen, die verschiedene Injektionsmethoden erhielten. (ein)Das in vivo Biolumineszenzsignal des gesamten Tieres nach intra-cisterna magna Injektion von LLC1-Zellen. (B) Das in vivo Biolumineszenzbild der Mäuse nach intrakarotiser Injektion von LLC1-Zellen. (C) Das in vivo Biolumineszenzsignal der Mäuse nach intrakardialer Injektion von LLC1-Zellen. Die linke Seite zeigt die Rückenlage und die rechte Seite die Bauchlage. (D) Das Biolumineszenzbild von NSG-Mäusen nach der Injektion von A549-Zellen durch die Cisterna magna.a Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
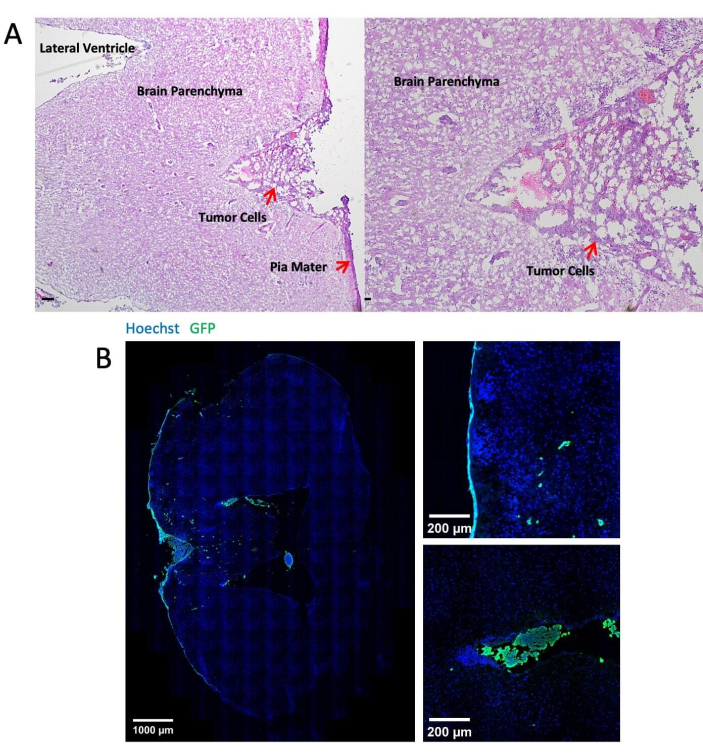
Abbildung 3: Repräsentative Bilder der histologischen und Immunfluoreszenzfärbung. (A) Die repräsentative H&E-Färbung zeigt LLC1-Zellen, die hauptsächlich auf der Oberfläche der Hirnhäute und in den Ventrikeln abgelagert sind. Maßstabsbalken = 25 μm. (B) Immunfluoreszenz-Färbebilder des tumortragenden Gehirns LLC1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Zwei-Photonen-Bilder einer Maus mit LM. Tumorzellen, die mit GFP markiert sind (grün), befinden sich ausschließlich zwischen dem Schädel (blau) und dem Hirnparenchym (rot). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Repräsentative Bilder des Stereofluoreszenzmikroskops. (A) Globales Gesichtsfeld des Gehirns von Mäusen unter dem Mikroskop. (B) GFP-markierte Tumorzellen wurden auf der Gehirnoberfläche präsentiert, die grüne Fluoreszenz emittieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Dauer der Behandlung/min | Inzidenz von LM 14 Tage nach der Injektion beobachtet | Rate extrakranieller Tumoren | Rate großer Hirnparenchymtumoren | |
| Magna-Injektion in der Zisterne | ~5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| Injektion der Arteria carotis (intrakarotis) | ~20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| Intrakardiale Injektion | ~5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
Tabelle 1: Vergleich von drei verschiedenen Injektionsmethoden in Bezug auf die Operationsdauer, die Inzidenz von leptomeningealen Metastasen, extrakraniellen Tumoren und die Rate großer Hirnparenchymtumoren.
Diskussion
LM ist eine aggressive und tödliche Erkrankung. Sobald die Tumorzellen in den mit Liquor gefüllten Raum metastasiert haben, verbreiten sie sich schnell im gesamten Zentralnervensystem25. Diese Zellen siedeln sich an und dringen in das Gehirn, das Rückenmark, den Hirn- und Spinalnerven ein, was schließlich zu einer raschen neurologischen Verschlechterung und schließlich zum Tod führt17. Um die zugrundeliegenden pathophysiologischen Mechanismen besser zu verstehen und mögliche therapeutische Strategien zu evaluieren, ist es entscheidend, ein effizientes in vivo-Modell zu entwickeln, das den Metastasierungsprozess und die umgebende Mikroumgebung bei leptomeningealen Metastasen rekapituliert.
Ein früherer Bericht hat gezeigt, dass LM in Mausmodellen induziert werden kann, indem Tumorzellen direkt in die rechte Kleinhirnhemisphäre injiziert werden15. Bei diesem Ansatz gelingt es jedoch bei einigen Probanden oft nicht, Metastasen im subfrontalen Bereich oder im distalen Rückenmark zu erzeugen. Eine kürzlich durchgeführte Studie zeigte, dass Tumore, die von mutierten kleinzelligen Lungenkrebszellen abstammen, wenn sie subkutan implantiert werden, sich nach einer verlängerten Latenzzeit spontan in den leptomeningealen Raum ausbreiten können14. Nach der in vitro-Expansion von Tumorzellen aus spontanem LM etablierten die Autoren erfolgreich eine Zellsublinie, die in der Lage ist, LM mit minimaler Hirnparenchyminfiltration durch intrakarotisartige Injektion zu entwickeln. Dieses Verfahren erfasst zwar den natürlichen Verlauf der Metastasierung in den leptomeningealen Raum, ist aber ineffizient und zeitaufwändig, da die meisten Mäuse an Metastasen in anderen Organen sterben, bevor sich LM vollständig entwickeln kann. Darüber hinaus erfordert dieser Ansatz eine ausgeklügelte Mikrochirurgie, die dem Probanden ein erhebliches Trauma auferlegt26. Alternativ führte die direkte Injektion von Tumorzellen in die Cisterna magna zu einer ausgedehnten leptomeningealen Beteiligung, die der bei LM-Patienten beobachteten Erkrankung sehr ähnlichist 15. Einige intrazisternale Injektionsmethoden erfordern jedoch eine Haut- und Muskeldissektion, was zu einem erheblichen Trauma und einem erhöhten Risiko für intrakranielle Infektionen führt, die die pathophysiologischen Merkmale von LM verändern können.
In dieser Arbeit wurde eine minimalinvasive Methode zur Injektion von Tumorzellen in die Cisterna magna über einen perkutanen Punktionsweg beschrieben. Im Gegensatz zu anderen chirurgischen Ansätzen werden bei perkutanen Injektionen invasive Schritte wie Hautschnitte vermieden und dadurch das Infektionsrisiko minimiert. Durch die präzise Positionierung kann der Eingriff in nur wenigen Minuten abgeschlossen werden, wodurch sowohl die operative als auch die postoperative Pflegezeit erheblich verkürzt werden. Darüber hinaus verbessert die direkte Injektion von Tumorzellen in die Cisterna magna die Transplantation von Tumorzellen im leptomeningealen Raum und senkt gleichzeitig die Inzidenz der extrakraniellen Organbesiedlung (Tabelle 1).
Es gibt einige wichtige Überlegungen und Informationen zur Problembehandlung für das Protokoll. Obwohl wir davon ausgehen, dass das derzeitige Verfahren den Bedarf an hochqualifiziertem Personal reduzieren und den gesamten Prozess vereinfachen würde, ist es für den Bediener immer noch von entscheidender Bedeutung, die Einstichstelle genau zu identifizieren. Der Bediener sollte mit der Anatomie der Maus vertraut sein, insbesondere mit der hinteren Schädelgrube und dem zervikalen Bereich, um eine genaue Positionierung zu gewährleisten. Wenn die Nadel während des Einstechens auf eine knöcherne Oberfläche trifft, kann die Einstichstelle zu hoch sein und sollte entsprechend nach unten angepasst werden. Um eine erfolgreiche Injektion zu gewährleisten, positionieren und sichern wir die Tiere über einem 15-ml-Zentrifugenröhrchen, um die Injektionsstelle vollständig freizulegen. Wir fanden auch heraus, dass die 31G, 8 mm Insulinspritze beim Punktieren der Zisterne magna besser abschneidet als die herkömmliche Hamilton-Spritze. Dies liegt wahrscheinlich daran, dass die Nadel der Hamilton-Spritze weniger effektiv in dicke Gewebeschichten eindringt und weniger Kontrolle beim Einführen bietet. Die Tiefe (4 mm) und der Winkel (45°-50°) des Einstechens der Nadel sind entscheidend. Eine zu hohe Tiefe kann zu einem Tumorwachstum im Hirnstamm führen, während eine zu geringe Tiefe zu subkutanen Tumoren führen kann. Um das Risiko eines Unfalltodes durch einen plötzlichen Anstieg des Hirndrucks zu minimieren, sollte die Injektion so langsam wie möglich durchgeführt werden.
Dieses Protokoll ist jedoch nicht ohne Einschränkungen. Im Gegensatz zu den traditionellen Methoden beruht das beschriebene Verfahren auf einer genauen Positionierung der Tiere und dem sensationellen Feedback des Bedieners, was eine gewisse Variabilität mit sich bringt. Bei sorgfältiger Kontrolle der Injektionstiefe und wiederholtem Üben kann eine hohe Erfolgsquote erzielt werden. Ein weiterer großer Nachteil des derzeitigen Verfahrens besteht darin, dass es die frühen Schritte der metastasierenden Kaskade umgeht und daher nicht in der Lage ist, den gesamten Verlauf der LM bei Patienten zu rekapitulieren. Insgesamt ist das vorgestellte Verfahren technisch unkompliziert und hocheffizient für die Etablierung von murinen LM-Modellen und stellt eine wertvolle präklinische Plattform für LM-bezogene Studien dar.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Die Autoren danken den Mitgliedern des Zhang-Labors für ihre wertvollen Diskussionen und Unterstützung während dieser Studie. W.Z. wird unterstützt durch die Fundamental Research Funds for the Zhejiang Provincial Universities (2023QZJH60), das Science Fund Program for Distinguished Young Scholars der National Natural Science Foundation of China (588020-X42306/041) und den Startup-Fonds des Life Sciences Institute der Zhejiang University.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
Referenzen
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten