Method Article
用于小鼠软脑膜转移研究的微创 Cisterna Magna 注射模型
摘要
该方案描述了一种通过经皮穿刺途径将肿瘤细胞注射到大脑池的方法,该方法可强烈诱导小鼠软脑膜转移,减少创伤和颅外肿瘤负荷。
摘要
软脑膜转移 (LM) 是癌细胞扩散到充满脑脊液 (CSF) 的软脑膜中,是晚期实体瘤的一种罕见但具有破坏性的并发症。LM 患者通常预后不良,生存期为数周至数月。开发准确复制 LM 复杂性的 体内 模型对于了解其细胞和病理机制以及评估潜在疗法至关重要。小鼠 LM 模型通常是通过心脏内、颈动脉或脑池大注射肿瘤细胞来创建的。然而,心内或颈动脉注射通常会导致大量的颅外和脑肿瘤负荷,使生物发光成像复杂化,并导致与 LM 无关的死亡。同时,传统的大池注射需要侵入性手术,例如皮肤切口和肌肉解剖,这使其既具有创伤性又耗费资源。在这里,我们描述了一种通过大脑池将肿瘤细胞注射到软脑膜腔而无需皮肤切口的微创手术。与其他手术方法相比,这种方法减少了颅外肿瘤的形成,最大限度地减少了手术创伤,并缩短了所需的时间和术后护理。重要的是,它始终以最小的脑实质浸润诱导 LM,这已通过双光子显微镜和组织学分析得到证实。这种简化的方法为临床前研究中研究 LM 提供了一种高效可靠的模型。
引言
转移性疾病仍然是晚期癌症患者面临的最大挑战。软脑膜转移 (LM) 是指癌细胞扩散到软脑膜、蛛网膜和蛛网膜下腔。实体瘤的 LM 在肺癌 (9%-25%)、乳腺癌 (5%-20%) 和黑色素瘤 (6%-18%) 中越来越常见1,2,这主要是由于更长的生存期和改进的诊断技术。癌细胞可通过多种途径侵入软脑膜腔,包括 1) 直接侵入硬脑膜、骨骼和神经等外周结构;2) 血行经静脉系统播散;3) 通过动脉循环进入,癌细胞通过有孔血管滑入脉络丛,随后进入充满脑脊液的脑室 3,4,5。进入软脑膜间隙的肿瘤细胞面临多重挑战,包括生长因子的剥夺、代谢中间体的受限和缺氧条件6。然而,由于缺乏适当的工具和技术,人们对肿瘤细胞如何驾驭这些途径并克服不适宜居住的条件以在软脑膜间隙定植知之甚少。尽管多模式疗法取得了进展,包括放疗、全身治疗和鞘内注射疗法,但 LM 患者的预后仍然很差,生存期通常为 2 至 4 个月 3,7,8,9。因此,迫切需要更深入地了解软脑膜转移的生物学特性,以改进当前的治疗方法并开发新的靶向疗法。要实现这一目标,需要开发概括 LM 复杂特征的体内模型。
与肝脏、骨骼和大脑等器官的转移不同,LM 通常在诊断出原发性肿瘤后数年发生 10,11,12。同样,在自发性转移的小鼠模型中,LM 很少见,因为它的发生率低,而且小鼠通常会死于其他部位的转移。实验性小鼠 LM 模型可以通过各种方法创建,包括心内、颈内动脉,或者直接注射到大脑池或脑室中。虽然癌细胞的心内注射被广泛使用9,但它通常会导致显著的颅外肿瘤负荷,从而导致与 LM 无关的死亡。替代方法,例如通过颈动脉注射肿瘤细胞13,14,需要广泛的专业资源,并导致手术切口大,这是创伤性的。此外,这种方法还主要导致脑组织本身的转移,而不是软脑膜,并且对于建立 LM 模型来说既耗时又效率低下15。注射到大脑池可以将肿瘤细胞直接输送到软脑膜腔。几项研究使用这种方法来研究 LM 机制并评估新疗法 6,16,17。
在本手稿中,我们提出了一种方便的经脑池 magna 注射方案,涉及直接经皮穿刺以快速稳定地产生大量 LM 小鼠。这种方法绕过了脑血屏障,因此能够在软脑膜间隙中对肿瘤细胞进行有效的异种移植。它还显着减少了手术创伤和手术时间,同时可靠地在小鼠中诱导 LM。我们证实了 LM 的发生,浸润到脑实质中最小,经双光子显微镜和组织学分析验证。因此,所得模型忠实地复制了 LM 的复杂微环境,为研究疾病相关的细胞和病理机制以及评估潜在疗法提供了有价值的工具。
研究方案
本稿件中的所有动物程序均由 ZJU-实验动物福利与伦理审查委员会 (ZJU20230155) 审查和批准。C57BL/6J 和 NSG 小鼠购自浙江大学实验动物中心,并在无特异性病原体的条件下饲养。该方案使用小鼠肺癌细胞系 Lewis 肺癌 (LLC1) 和人肺癌细胞系 A549,均用 GFP 和萤火虫荧光素酶标记。两种细胞系均由 Xiang H. F. Zhang 博士(美国贝勒医学院)友情提供18。这里,我们以 LLC1 单元为例。注射 A549 细胞的程序几乎相同,只是将 6 x 104 个 A549 细胞注射到 NSG 小鼠中。
1. 注射用癌细胞的制备
- 在 37 °C 下,在 5% CO2 培养箱中,在补充有 10% 胎牛血清 (FBS) 和 0.1 mg/mL 青霉素-链霉素的 DMEM 中培养 1.0 x 106 个 LLC1 细胞。当细胞达到 70%-90% 汇合时,使用 2 mL 0.25% 胰蛋白酶/EDTA 溶液对其进行胰蛋白酶消化 1 分钟。将细胞以 300 x g 离心 3 分钟,用冰冷的 PBS 洗涤 2 次,然后将它们重新悬浮在 1 mL 磷酸盐缓冲盐水 (PBS) 中。
- 使用台盼蓝溶液和血细胞计数器评估活细胞的浓度19。确保细胞活力大于 90%,大多数细胞是单个细胞。在冰冷的 PBS 中将细胞浓度调节至 2 x 106 个细胞/mL。
- 将 50 μL 细胞悬液分装到单独的微量离心管中,以避免重复移液。
- 将细胞悬液放在冰上,直到准备好注射。在该方案中,每只小鼠注射 10 μL GFP-荧光素酶标记的 LLC1 细胞,相当于每只小鼠 2 x 104 个细胞。
注意:根据注射细胞系的转移动力学,根据需要调整细胞数量。
2. 小鼠制备
注意:在本研究中,使用了 6-8 周龄的雄性 C57BL/6J 小鼠。
- 对所有手术器械和装有手术单的手套进行高压灭菌。用 75% 乙醇对台式和非手术设备进行消毒,然后用防水窗帘覆盖工作区域。
- 准备一个干净的动物笼子和一个加热垫,以便术后恢复。
- 通过皮下注射 2% 三溴乙醇 (200 mg/kg) 麻醉小鼠。在继续之前,使用捏合试验检查麻醉深度。涂抹无菌眼药膏,以保护小鼠麻醉后眼睛免受角膜损伤。
- 使用剪刀剃掉枕骨后部区域的毛皮,然后涂抹脱毛膏以完全去除同一区域的毛皮。
- 将鼠标俯卧放置,将其脖子放在 15 mL 离心管上。用胶带固定头部和下背部,并用食指触诊枕骨和 C1 椎骨之间的空间(图 1)。
- 用 75% 乙醇浸泡的无菌棉签擦拭三轮,然后用优碘手术擦洗对枕叶后部区域进行消毒。用无菌窗帘覆盖动物的非无菌部分。
3. 大池注射液
注意: 以下步骤需要无菌技术,包括使用个人防护设备和无菌手套。
- 轻轻吸取细胞悬液,并吸出 10 μL 用于 31G、8 mm 胰岛素注射器注射。
- 用食指触诊小鼠枕骨和 C1 之间的区域,以定位枕骨后颅骨正中下缘的精确穿刺部位。如有必要,请标记此站点。
- 将针头以 45°-50° 角插入大池,通过确定的穿刺部位,推进至 4 毫米的深度。明显的突破感表明针头已成功进入大池。
- 如果穿刺部位难以定位,请在耳朵水平做一个 3-5 毫米的小切口,露出后中线。如果需要手术切口,手术前 1 小时皮下注射美洛昔康 (5 mg/kg/天)和丁丙诺啡 (0.1 mg/kg)。
- 通过推进注射器柱塞缓慢注射细胞悬液,将手放在桌子上保持注射器稳定。
- 接种后,将注射器再固定 10 秒,以平衡颅内压。然后,拔出针头并用无菌棉签按压穿刺部位 1-2 分钟。
4. 注射后护理
- 将动物转移到加热垫上的清洁笼子中,并密切监测它们,直到它们完全恢复。
- 如果做切口,请使用纸巾胶和夹子闭合伤口。手术后 2-3 天服用额外的止痛药,以控制疼痛并帮助恢复。
- 手术后 7 天密切监测小鼠,并每天检查动物的身体活动和注射部位周围的外观。
5. 软脑膜肿瘤生长的评估
- 生物发光成像
- 麻醉小鼠并在眶后静脉施用 D-荧光素 (150 μg/g)。将小鼠放入成像室,将它们放置在麻醉歧管上指定的鼻锥中。在动物之间使用挡光板以尽量减少信号干扰。
- 使用 IVIS 系统立即对动物进行成像,曝光时间在 0.5 秒到 2 分钟6 之间。通过穿过头部和脊髓的分散生物发光信号确认肿瘤细胞在软脑膜间隙成功接种(图 2A)。
- 每 4 天通过生物发光成像监测 LM 的进展。根据肿瘤生长动力学调整成像间隔。
- 组织学分析
- 当小鼠明显不那么活跃或体重减轻 20% 时麻醉它们,并切开皮肤和肋骨以暴露它们的胸腔。小心地将钝头套管插入左心室,然后将套管推进升主动脉。通过套管缓慢灌注动物 20 mL PBS。
- 用剪刀去除头部,并在头皮中线切开以露出颅骨。切除周围的软组织。沿眶嵴切开,然后将剪刀插入枕骨大孔,并小心地沿着颅骨内表面向上按压推进,以避免组织损伤。
- 取出颅骨,然后轻轻提取大脑。将大脑在4%多聚甲醛中于4°C固定24小时,然后将其平衡到15%蔗糖PBS溶液中24小时,然后在4°C下再平衡30%蔗糖PBS溶液24小时。
- 将组织放入装有最佳切割温度 (OCT) 化合物的低温模具中,然后将其存放在干冰上 30 分钟20 分钟。
- 使用低温恒温器将 OCT 包埋的大脑切成 10 μm 厚的切片。将切片储存在 -80 °C 冰箱中直至进一步应用。
- 在脑载玻片21 上进行苏木精/伊红 (H&E) 染色。大脑边缘存在肿瘤细胞表明转移仅发生在软脑膜间隙(图 3 和 表 1)。
- 双光子显微镜
- 用 LM 麻醉小鼠。用镊子和剪刀去除覆盖颅骨背表面的头皮。使用手术刀刀片从颅骨表面去除薄的骨膜。
- 用磨料钻头稀释颅骨,直到透过变薄的颅骨可以看到软脑膜血管。用组织粘合剂固定的三角形头件稳定小鼠头部的观察区域22,23。
- 在眶下静脉中施用 0.025 mL 的 5% (w/v) TRITC-葡聚糖以标记血管22。
- 通过成像窗口进行双光子显微镜检查并重建软脑膜空间(图 4)。通过 450 nm 发射的二次谐波荧光和 900 nm 激发24 检测骨。通过分别在 900 nm 和 1000 nm 激发下收集 507 nm 和 572 nm 发射的荧光信号,可视化 GFP 标记的肿瘤细胞和葡聚糖标记的血管。
- 立体荧光显微镜
- 取出小鼠大脑并将其置于立体显微镜下。使用 GFP 特异性过滤器组可视化 GFP 标记的细胞(图 5)。
结果
图 1 从侧面和正面视图说明了注射鼠标的位置和穿刺部位。 图 2 显示了通过不同方法测试生成 LM 的动物的代表性 体内 生物发光图像。通过不同途径将 GFP-荧光素酶标记的 LLC1 细胞注射到动物体内,然后进行生物发光成像。如图 2A 所示,脑池内 magna 注射后 10 天,生物发光信号存在于小鼠的大脑中并沿脊髓分布,表明肿瘤细胞成功植入软脑膜间隙。相比之下,颈动脉内注射肿瘤细胞主要产生脑实质转移,注射后 21 天软脑膜没有显着参与(图 2B)。对于心内注射法,仰卧位的生物发光成像显示大多数转移瘤生长在颅外器官(左),俯卧位的图像证实三只小鼠均未发生 LM(右; 图 2C)。在 NSG 小鼠中大水箱注射 6 x 104 (10 μL) GFP-荧光素酶标记的 A549 细胞 10 天后观察到肿瘤细胞的相同分布(图 2D),表明这种方法在不同细胞系的不同小鼠品系中稳健地产生 LM。
图 3 显示了通过大脑池注射肿瘤细胞 14 天后脑组织的组织学和免疫荧光染色的代表性图像。苏木精-伊红 (H&E) 染色显示大部分肿瘤区域位于软脑膜间隙(图 3A)。 图 3B 显示大多数 GFP 标记的肿瘤细胞聚集在脑膜和脑室中,而实质区域的肿瘤细胞大多是单细胞。 图 4 显示了使用 LM 的小鼠软脑膜间隙的代表性双光子图像。通过在 900 nm 激发24 处收集 450 nm 发射的二次谐波荧光来检测颅骨(蓝色)。脉管系统 (红色) 用 TRITC-葡聚糖 (70 kDa) 标记。在颅骨 (蓝色) 和脑实质之间发现 GFP 标记的肿瘤细胞 (绿色),特别是在软脑膜区域内。 图 5 显示了大脑表面存在 GFP 标记的肿瘤细胞,使用立体荧光显微镜进行可视化。表 1 显示了三种方法之间的比较。

图 1:脑池内大注射的动物准备和穿刺部位。 (A) 将小鼠置于俯卧位,其脖子披在 15 mL 离心管上。头部和下背部用胶带固定。针头以 45°-50° 的角度插入正中下缘的大池。(B) 针头插入枕骨后颅骨的正中下缘。 请单击此处查看此图的较大版本。
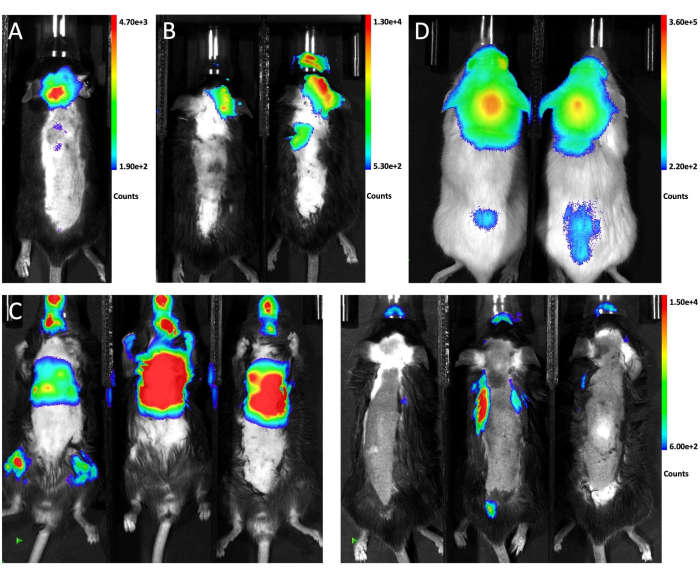
图 2:接受不同注射方法的小鼠的代表性体内生物发光图像。 (一)脑池内大细胞注射 LLC1 细胞后全动物的体内生物发光信号。(B) 颈动脉内注射 LLC1 细胞后小鼠的体内生物发光图像。(C) 小鼠心脏内注射 LLC1 细胞后的体内生物发光信号。左侧显示仰卧位,右侧显示俯卧位。(D) NSG 小鼠通过大池注射 A549 细胞后的生物发光图像。请单击此处查看此图的较大版本。
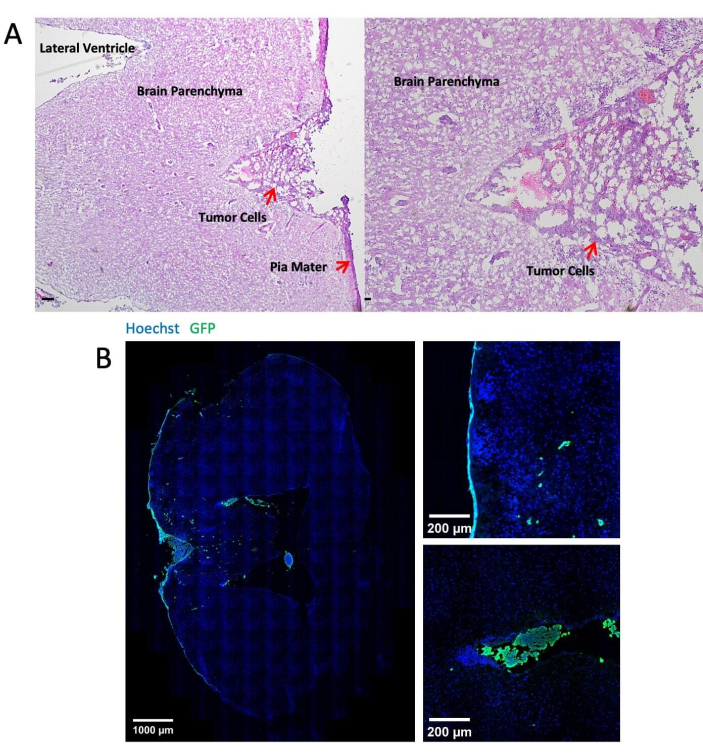
图 3:组织学和免疫荧光染色的代表性图像。 (A) 代表性 H&E 染色显示 LLC1 细胞主要沉积在脑膜表面和脑室中。比例尺 = 25 μm。(B) LLC1 荷瘤脑的免疫荧光染色图像。 请单击此处查看此图的较大版本。

图 4:使用 LM 的鼠标的代表性双光子图像。 用 GFP(绿色)标记的肿瘤细胞仅存在于颅骨(蓝色)和脑实质(红色)之间。 请单击此处查看此图的较大版本。

图 5:立体荧光显微镜的代表性图像。(A) 显微镜下小鼠大脑的整体视野。(B) GFP 标记的肿瘤细胞呈现在脑表面,发出绿色荧光。 请单击此处查看此图的较大版本。
| 程序持续时间/分钟 | 注射后 14 天观察到的 LM 发生率 | 颅外肿瘤的发生率 | 大脑实质肿瘤的发生率 | |
| 池内 magna 注射 | ~5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| 颈动脉内注射 | ~20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| 心内注射 | ~5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
表 1: 3 种不同注射方法在手术时间、软脑膜转移发生率、颅外肿瘤和大脑实质肿瘤发生率方面的比较。
讨论
LM 是一种侵袭性和致命性疾病。一旦肿瘤细胞转移到充满脑脊液的空间,它们就会迅速扩散到整个中枢神经系统25。这些细胞沉降并侵入大脑、脊髓、颅神经和脊神经,最终导致神经功能迅速恶化并最终死亡17。为了更好地了解潜在的病理生理机制并评估潜在的治疗策略,开发一种高效的 体内 模型来概括软脑膜转移中的转移过程和周围微环境至关重要。
先前的报告表明,通过将肿瘤细胞直接注射到右小脑半球,可以在小鼠模型中诱导 LM15。然而,这种方法通常无法在某些受试者的额下区域或远端脊髓产生转移。最近的一项研究表明,来自突变小细胞肺癌细胞的肿瘤,当皮下植入时,可能会在长时间的潜伏期后自发扩散到软脑膜腔14。在自发性 LM 肿瘤细胞 体外 扩增后,作者成功建立了一种细胞亚系,能够通过颈内动脉注射以最小的脑实质浸润形成 LM。虽然该程序捕捉了转移性播散到软脑膜间隙的自然过程,但它效率低下且耗时,因为大多数小鼠在 LM 完全发育之前就死于其他器官的转移。此外,这种方法需要复杂的显微外科手术,这会给受试者带来相当大的创伤26。或者,将肿瘤细胞直接注射到大脑池中导致广泛的软脑膜受累,这与在 LM 患者中观察到的情况非常相似15。然而,一些脑池内注射方法需要皮肤和肌肉解剖,导致严重创伤和颅内感染风险增加,这可能会改变 LM 的病理生理学特征。
在这里,我们描述了一种通过经皮穿刺途径将肿瘤细胞注射到大脑池的微创方法。与其他手术方法相比,经皮注射避免了皮肤切口等侵入性步骤,从而最大限度地降低了感染风险。通过精确定位,该程序可以在几分钟内完成,从而显着减少手术和术后护理时间。此外,将肿瘤细胞直接注射到大脑池中可改善肿瘤细胞在软脑膜腔内的植入,同时降低颅外器官定植的发生率(表1)。
该协议有一些关键注意事项和故障排除信息。尽管我们预计当前的程序将减少对高技能人员的需求并简化整个过程,但对于作员来说,精确识别穿刺部位仍然至关重要。作者应熟悉小鼠解剖结构,尤其是后颅窝和颈部区域,以确保准确定位。如果针头在插入过程中遇到骨面,则穿刺部位可能过高,应适当向下调整。为确保注射成功,我们将动物放置在 15 mL 离心管上方并固定,以完全暴露注射部位。我们还发现,31G、8 mm 胰岛素注射器在穿刺水箱 magna 方面的性能优于传统的 Hamilton 注射器。这可能是因为 Hamilton 注射器的针头在穿透较厚的组织层方面效果较差,并且在插入过程中提供的控制较少。进针的深度 (4 mm) 和角度 (45°-50°) 至关重要。深度过大可能导致脑干中的肿瘤生长,而深度不足可能导致皮下肿瘤。因此,为了尽量减少颅内压突然升高导致意外死亡的风险,注射应尽可能缓慢地进行。
但是,该协议并非没有限制。与传统方法不同,所描述的程序依赖于准确的动物定位和作员的感官反馈,这引入了一定程度的可变性。通过仔细控制注射深度和反复练习,可以实现高成功率。当前手术的另一个主要缺点是它绕过了转移级联反应的早期步骤,因此无法概括患者 LM 的整个过程。总体而言,所提出的程序在技术上简单明了,并且对于建立小鼠 LM 模型非常有效,代表了 LM 相关研究的有价值的临床前平台。
披露声明
作者声明没有利益冲突。
致谢
作者感谢 Zhang 实验室成员在整个研究过程中的宝贵讨论和帮助。W.Z. 得到了浙江省级高校基本科研业务费(2023QZJH60)、国家自然科学基金杰出青年科学基金项目(588020-X42306/041)和浙江大学生命科学研究院启动基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
参考文献
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。