Method Article
השפעות של שיטות מכניות המשמשות בטיפול פרי-אימפלנטיטיס על טיהור פני השתל וחספוס
In This Article
Summary
הפרוטוקול הנוכחי מתאר מודל ניסיוני המבוסס על צביעת דיו שניתן להשתמש בו למחקר טיהור פני השטח של שתלים במבחנה וחספוס כדי לתרום לקבלת החלטות קליניות.
Abstract
שיטות מכניות שונות הוצעו לטיהור משטחי שתלים דנטליים בהצלחה משתנה. מחקר מבחנה זה העריך את יעילות הטיהור של מערכת שחיקת אוויר (AA) עם אבקת אריתריטול, קצה קולי פוליאתר-אתר-קטון (PEEK) וקורט טיטניום (TIT) והשפעותיהם על טופוגרפיית פני השטח של השתל באמצעות מיקרוסקופ אלקטרונים סורק (SEM). בסך הכל 60 שתלים נצבעו בדיו אדום קבוע והונחו בפגמים מסוג 1A ו-Class 1B בהדפסת תלת מימד, ויצרו שש קבוצות (n=10 לקבוצה) בהתבסס על סוג הפגם ופרוטוקול הטיפול. בנוסף, נעשה שימוש בשתל שליטה חיובי אחד ואחד שלילי. אבקת אריתריטול, טיפים קוליים של PEEK וקורטות טיטניום נמרחו במשך 2 דקות בפגמים מסוג 1A ו-3 דקות בפגמים מסוג 1B. אזורי דיו אדום שנותרו כומתו באמצעות תוכנה דיגיטלית, ושינויים במשטח השתל נותחו באמצעות SEM ו-EDS. אף אחת מהשיטות לא השיגה טיהור מלא. עם זאת, אבקת אריתריטול הייתה היעילה ביותר באופן משמעותי, והשאירה שיעור דיו שיורי של 24% ±-6% (עמ' < 0.001). טיפים קוליים של PEEK הביאו ל-41% ±-4% דיו שיורי, בעוד שקורטות טיטניום השאירו 55% ±-3%. נצפו הבדלים משמעותיים בין כל השיטות. לא נמצא הבדל משמעותי ביעילות הטיהור בין פגמים מסוג 1A ו-Class 1B. ניתוח SEM הראה נזק מינימלי לפני השטח עם אבקת אריתריטול וקצות PEEK, בעוד שקורטות טיטניום גרמו לנזק בינוני עד חמור. בהתבסס על יעילות הטיהור ושימור פני השטח, אבקת אריתריטול וקצות PEEK הן אפשרויות בטוחות ויעילות לטיפול בפרי-שתל ואילו קורטות טיטניום פחות יעילות וגורמות לנזק ניכר לפני השטח. ממצאים אלה עשויים לסייע לרופאים בתכנון הטיפול בפרי-אימפלנטיטיס.
Introduction
טיפול השתלת שיניים הוא הפרוטוקול הנפוץ והמועדף ביותר להחלפת שיניים חסרות ברחבי העולם. מחקרי מעקב ארוכי טווח הראו כי השימוש בשחזורים הנתמכים על ידי שתלים בטיפול בשיניים מלאות או חלקיות מספק תוצאות צפויות ושיעורי הצלחה גבוהים מבחינת הישרדות. עם זאת, סיבוכים שונים המשפיעים על הרקמות הקשות והרכות עלולים להיווצר לאחר הנחת שתלים ושיקום כירורגי1. בשנת 2017, הסדנה העולמית לסיווג מחלות ומצבים פריודונטלים ופרי-שתלים הציגה הגדרות ואבחנות מבדלות למחלות המשפיעות על רקמות פרי-שתלים2. על פי הגדרה זו, פרי-אימפלנטיטיס היא מצב פתולוגי בלתי הפיך המאופיין בסימנים קליניים של דלקת, כולל דימום בעת גישוש ו/או סופה, עומק בדיקה מוגבר ו/או נסיגה של שולי הרירית ברירית סביב השתל, ואובדן רדיוגרפי של עצם תומכת2. האטיולוגיה של מחלות פרי-שתל היא רב-גורמית, וחלק מהאנשים רגישים יותר למצב זה מאחרים. נטיות ספציפיות של אנשים עלולות להגביר את הסיכון להתפתחות מחלה סביב השתל, מה שעלול להוביל לאובדן השתל. גורמים נוספים הממלאים תפקיד באטיולוגיה של מחלות פרי-שתל הם גורמים הקשורים למטופל (עישון, מחלות מערכתיות, היסטוריה של מחלות חניכיים, היגיינת הפה); מצב הרירית הקרטינית, כמות ואיכות העצם והרקמות הרכות באתר ההשתלה; כוחות על השתל והרקמות שמסביב; סיבוכים שנתקלו בהם במהלך הנחת השתל; והניסיון והמיומנות של הרופא המבצע טיפולים כירורגיים ותותבות2. בנוסף, לאחרונה הוצגה תפיסה חדשה להערכת סיכונים וטיפול, הכלי להערכת סיכון למחלות שתלים (IDRA)3. כלי זה פותח כדיאגרמה פונקציונלית המורכבת משמונה פרמטרים, שלכל אחד מהם קשר מתועד עם פרי-אימפלנטיטיס. הווקטורים של המתומן הם ההיסטוריה של דלקת חניכיים, אחוז השתלים ואתרי השיניים עם דימום בבדיקה (BoP), מספר השיניים/שתלים עם עומק כיס בדיקה ≥ 5 מ"מ, שיעור אובדן עצם חניכיים (צילומי רנטגן ביחס לגיל המטופל), רגישות לדלקת חניכיים, תדירות טיפול חניכיים תומך (SPT) ועיצוב התותבת.
סקירות שיטתיות אחרונות הראו כי השכיחות של פרי-אימפלנטיטיס היא 19.53% ברמת המטופל ו-12.53% ברמת השתל3. לגבי כ-5 מיליון שתלים המותקנים מדי שנה ברחבי העולם, עם גודל שוק של יותר מ-4 מיליארד דולר, פרי-אימפלנטיטיס מהווה בעיה בריאותית חמורה עבור האוכלוסייה. אם לא מטפלים, פרי-אימפלנטיטיס גורמת לאובדן השתל הפגוע והתותבת הנתמכת על ידי השתל, מה שגורם למצוקה גדולה הן לרופא השיניים והן למטופל.
ניתן לחלק את הטיפול במחלות פרי-שתל לגישות לא כירורגיות וכירורגיות. למרות שקיימת ציפייה סבירה להצלחת נקודות הקצה בטיפול בדלקת חניכיים4, עדויות דומות לטיפול בפרי-אימפלנטיטיס עדיין נדירות. לכן, הרציונל לגישה מדורגת וטיפול לא ניתוחי בפרי-אימפלנטיטיס הוא לנסות לשלוט בביופילם ובדלקת בגישות פשוטות יחסית לפני הגדלת הפולשניות של הטיפול ולבצע את השלב הכירורגי כאשר מושגת שליטה טובה יותר בביופילם וגורמי סיכון. זה כולל הוראות ומוטיבציה של OH, בקרת גורמי סיכון, בקרה על גורמים שומרי ביופילם, וניקוי/הסרה/שינוי של תותבות, כולל הערכה של רכיבי תותבת, מכשור על-שולי ותת-שולי, וטיפול חניכיים נלווה בעת הצורך. לפיכך, טיפול לא ניתוחי צריך להיות תמיד הצעד הראשון5. עבור פרי-אימפלנטיטיס מוקדמת, הפחתת גורמי סיכון וטיפול לא ניתוחי עשויים להספיק, אך הסרת ביופילם מלאה בכיסים עמוקים לאחר אובדן עצם היא לרוב מאתגרת. במהלך שלב ההערכה מחדש לאחר טיפול לא ניתוחי, עומק כיס מתמשך (≥ 6 מ"מ) ודימום בבדיקה (BoP) מצביעים על התקדמות פוטנציאלית של פרי-אימפלנטיטיס. אם קיימים סימנים אלה, מומלץ להתערב כירורגית6. הטיפול הכירורגי בפרי-אימפלנטיטיס כולל (i) הסרת דש פתוחה, (ii) ניתוח דש כריתה, (iii) ניהול פגמים בעצמות סביב השתל באמצעות גישות משחזרות, (iv) שיטות נוספות לטיהור פני השתל ו-(v) שימוש משלים באנטיביוטיקה מקומית/מערכתית7.
הגורם האטיולוגי העיקרי של פרי-אימפלנטיטיס הוא הביופילם הפתוגני המתיישב על פני השתל6. הסרת ביופילם זה היא העיקרון והמטרה העיקריים של כל פרוטוקולי הטיפול, הכוללים שיטות טיהור מכניות, כימיות ולייזר7.
פירוק מכני משתמש בקורטים מפלסטיק, פחמן וטיטניום, מכשירים קוליים עם קצות פלסטיק ומתכת, מברשות טיטניום ומערכות שוחקות אוויר (AA) עם אבקות שונות. למרות שקשה להשיג סילוק מוחלט של הביופילם, טיפולים אלה מספקים יתרונות קליניים. התערבויות קליניות שונות, כולל פרוטוקולי חיטוי מכניים עם או בלי חומרי חיטוי8, אנטיביוטיקה9, כמו גם ניתוחים כריתה והתחדשות10, שימשו בדרגות שונות של הצלחה קלינית. עם זאת, הם גם גורמים לשינויים בתכונות הכימיות והפיזיקליות של משטח השתל, מה שעלול לסבך היווצרות עצם חדשה ואוסאואינטגרציה מחדש.
מבין השיטות המכניות, הליכי AA המשתמשים בהרכבי אבקה שונים הראו את יעילות הניקוי הטובה ביותר 11,12,13. עם זאת, נוכחותם של חלקיקים שיוריים יכולה לשנות את טופוגרפיית פני השטח ולהפחית את התאימות הביולוגית14. גליצין, ואחריו נתרן ביקרבונט, הוא האבקה הנפוצה ביותר במערכות AA8. לאחרונה, חלקיקים שוחקים אוויר קטנים יותר כמו אריתריטול (14 מיקרומטר) זכו להתעניינות לטיהור יעיל עם נזק מופחת לפני השטח9. קורטות טיטניום ופלסטיק, הגורמות פחות נזק לפני השטח מאשר קצות פלדה, יעילות בטיהור ביופילם15. קצות סקלר אולטראסוניים העשויים מפולי-אתר-אתר-קטון (PEEK) מפחיתים גם את העומס החיידקי עם נזק מינימלי לפני השטח10. שיטות טיהור חייבות לקחת בחשבון את החספוס הגבוה של משטחי השתל ולשאוף להסיר ביופילם חיידקי מבלי לגרום נזק משמעותי למשטח. למרות שבוצע מחקר מקיף במבחנה, in vivo ומחקר קליני, עדיין אין קונצנזוס ופרוטוקול תקן זהב לטיפול פרי-אימפלנטיטיס עד כה. השכיחות הגוברת של מחלות פרי-שתל עקב שתלים דנטליים רבים מחייבת גישה מבוססת ראיות וצפויה לטיפול במשטחים מזוהמים. מחקר זה נועד להעריך את יעילותן של שיטות טיהור שונות - מערכות שוחקות אוויר (AA), טיפים קוליים של PEEK וטיטניום - טיהור משטח השתל ולהעריך את השפעתן על חספוס פני השתל על ידי ניתוח SEM.
Protocol
פרוטוקול המחקר אושר על ידי הוועדה האתית (TBAEK-363) של אוניברסיטת אקדניז, אנטליה, טורקיה. מחקר זה נתמך על ידי קרן המחקר של אוניברסיטת אקדניז (מספר פרויקט: TDH-2024-6676). המחקר השתמש בשתל דנטלי בצורת בורג (PrimeTaper EV Implant) במידות של 4.2 מ"מ על 11 מ"מ, הכולל עיצוב מיקרו-חוט בגודל 1.7 מ"מ על הצווארון. הכנת פני השטח עם התזת חול ותחריט חומצה עם חומצה הידרופלואורית מדוללת להשגת משטח OsseoSpeed מוגדר היטב.
1. הכנת מודלים ניסיוניים של פרי-אימפלנטיטיס
הערה: שלוש שיטות טיפול מכניות לטיהור (שוחק אוויר (AA), פוליאתרקטון (PEEK) אולטרסאונד וקורט טיטניום; טבלת חומרים) בשני סוגים שונים של פגמים בפרי-אימפלנטיטיס נותחו11 (Class 1A ו-Class 1B). לפיכך, היו שש קבוצות ניסוי (איור 1). בסך הכל נעשה שימוש ב-62 שתלים, כולל שתל בקרה חיובי אחד ואחד שלילי. תכנון מחקר מבחנה זה, שפותח בתחילה על ידי Sharhmann et al.16, שונה על ידי חוקרים שונים 12,13,14,15,16,17,18 בספרות (איור 2). בהנחה של הבדל של 10% ביעילות הסרת הביופילם בין הקבוצות, גודל המדגם נקבע כ-60 (10 לכל קבוצה) עבור שש קבוצות עם G*power, גודל אפקט של 0.50, שגיאה מסוג I של 5% ו-80% הספק.

איור 1: תרשים זרימה של קבוצות ניסוי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- הסר טוחנת ראשונה אחת ממודל הפנטום של הלסת התחתונה החינוכית. שיני הפלסטיק מקובעות לדגם הפנטום הזה בעזרת ברגים. נתק את השן הטוחנת הראשונה והסר את החוט מהשקע. מלאו את השקע על ידי יציקת חומר הסיליקון הרך כדי לכסות את השקע ליצירת רכס מכתשית שטוח.
הערה: נוצרה סימולציה של שתל המונח באזור חסר שיניים. - סרוק את הדגם המוכן בסורק מעבדה ליצירת עיצוב דיגיטלי.
- צור פגמים בעצם פרי-שתל תלת מימד Class 1A ו-Class 1B11 באופן דיגיטלי. פתח את תוכנת Exocad. העלה את קובץ הדגם הסרוק. לאחר מכן לחץ על עיצוב ובחר מצב מומחה. הסירו אזורים חריגים בעזרת האפשרות Edit Mesh. לאחר מכן לחץ לחיצה ימנית ובחר שמור סריקה כקובץ בתיקיה הקשורה במחשב.
- בחר כלים > אפשרות הוספה/הסרה של רשת , בחר סריקת שעווה> העלה קובץ ובחר את הקובץ שזה עתה נשמר בתיקיה. לאחר מכן, לחץ על מצב אשף בצד ימין.
- במודל STL החדש שנוצר, צור הדמיית פגמים בשקע השן. לשם כך, לחץ על הוספה/הסרה בצד ימין. בחר גודל מברשת צורה אליפסה. לאחר מכן, צור את הפגם בדגם באמצעות Shift ולחיצה שמאלית בו-זמנית. התאם את אורך הפגם כ-5 מ"מ ואת הרוחב כ-4.2 מ"מ (המתאים לקוטר השתל) על פני השטח הבוקאלי של השתל עבור פגמים מסוג 1A ו-5-5-5 מ"מ עבור פגמים מסוג 1B.
- כדי לצמצם את הרוחב האופקי של הפגם, בחר את התלול על ידי לחיצה על האנטומיה בצד שמאל וצמצום הרוחב הווסטיבולרי של הפגם פנימה. לאחר מכן, לחץ לחיצה ימנית ושמור את הסצנה כקובץ.
- כדי ליצור דגם סופי, הפעל מחדש את התוכנית וטען מחדש את התיקיה השמורה. לאחר מכן בחר באפשרות Wizard Mode ו-Model Alignment בצד ימין. בחר את סוג הדגם כדגם שעווה דיגיטלי משמאל. לחץ על הבא מספר פעמים עד שתגיע לקטע עיצוב הדגם משמאל. בחר באפשרות Full Model ולחץ על Next פעמיים. לאחר השלמת קובץ המודל, פתח אותו עם Explorer, והוא מוכן להדפסה.
- העבר את קבצי ה-STL של הדגם המעוצב למדפסת התלת מימד. הדפס את הדגמים הדיגיטליים שנוצרו באמצעות שרף מודל.
- שוטפים את דגמי הניסוי באתנול 96% למשך 5-10 דקות. לאחר תהליך הניקוי, הנח את הדגמים במכשיר הריפוי פולט האור ורפא באור למשך 5 דקות בהגדרת המינון בהתאם להוראות היצרן.
הערה: השתמש בדגם שרף בעל חוזק מתיחה, כיפוף ודחיסה גבוה המתאים לקידוח שתלים. נקו את הדגם המודפס בתמיסות על בסיס אלכוהול בהתאם להוראות היצרן וודאו שהוא נרפא באור כראוי.
2. מכתים של שתלים
- טבלו את שתלי הבדיקה בדיו אדום צמיג עמיד במים. ודא שכל חלקי משטח השתל מכוסים לחלוטין והומוגני בדיו למשך 15 שניות. הסר את השתלים מהמיכל הסטרילי באמצעות ידיות נהג או עמודי טביעה ללא מגע יד.
הערה: צביעה זו תדמה תחליף ביופילם גלוי אופטית לניתוח הצילום. - יבש באוויר את השתלים המוכתמים בעזרת מזרק אוויר של יחידת שיניים על מנת לקבל פיזור אחיד של הדיו. יבש את השתלים המוכתמים עוד יותר למשך 24 שעות בטמפרטורת החדר. יבש את השתלים בבידוד עם הידיות, ללא מגע ידיים.
3. מיקום שתלים מוכתמים
- התאם את ההגדרות של מתקן פיזיו דנטלי באופן הבא: 800 סל"ד, מומנט 40 N ללא השקיה במי מלח.
- צור את שקע השתל עם מקדחי השתל הכירורגיים בדגמי הניסוי כדי למקם את השתלים באורך 11 מ"מ וברוחב 4.2 מ"מ. הכן את אותו שקע שתל לדגמים עם שני סוגי הפגמים (דגמי פגמים מסוג 1A ו- 1B).
- השתמש במקדחי השתל ברצף בהתאם להוראות היצרן כדי להשיג יציבות ראשונית. נקה את שאריות הפסולת לאחר הקידוח עם מזרק אוויר-מים, ולאחר מכן הנח את השתלים. ייצב את המודלים הניסיוניים של פרי-שתל על פלטפורמת העבודה בעזרת מהדק כדי למנוע מיקרו-תנועה של השתלים וכדי למנוע מיקרו-סדקים בדגמים.
- הכנס את השתלים עם ידית מנשא לשקעים. השאירו 5 מ"מ של שטח חשוף על פני השטח הבוקאלי. ודא שהשתלים שקועים באותה רמה על פסגת העצם הלשונית של הדגם. הימנע מלגעת במשטח השתל המוכתם.
4. טיהור שתלים
- התחל לטהר את השתלים בקבוצות מבלי להסיר אותם מדגמי הפגמים הניסיוניים 1A ו-1B.
- מערכת שוחקת אוויר: הגדר את המכשיר במלוא העוצמה עם השקיה במים עם אבקת אריתריטול של 14 מיקרומטר. החזק את קצה המכשיר במרחק של 2-3 מ"מ משטח השתל ומרח את האבקה באופן שווה על הפגם החשוף בפרי-שתל . הגבל את זמן העבודה ל-2 דקות עבור פגמים של 1A ו-3 דקות עבור פגמים של 1B.
- טיפ קולי Polyetheretherketone (PEEK): הגדר את המכשיר בהספק של 8 (80%) עם השקיית מים מקסימלית. החזק את ידית ה-PEEK באופן המתאים לשימוש קולי. בצע טיהור על פני השתל בתנועות ליניאריות ומקבילות. החל את קצה ההצצה בין החוטים ככל שהעיצוב שלו מאפשר. הגבל את זמן העבודה ל-2 דקות עבור פגמים של 1A ו-3 דקות עבור פגמים של 1B.
- קורטות טיטניום: הפעל מגעים רצופים בלחץ קבוע ב-60°-90° על משטח השתל בכוח משוער של 0.75 N על משטח השתל החשוף של 5 מ"מ למשך 2 דקות עבור פגמים של 1A ו-3 דקות עבור פגמים של 1B.
- לאחר טיהור, הסר את השתל באמצעות חתיכת הנהג ללא מגע יד. אם הדגמים מתעוותים לאחר טיהור, המשך לדגמי הגיבוי. ייצב את המודלים הניסיוניים של פרי-שתל על פלטפורמת העבודה בעזרת מהדק.
הערה: כל השיטות צריכות להיות מכוילות ומיושמות על ידי חוקר יחיד.
5. הדמיה צילומית
- הסר את השתלים מהדגם בעזרת חתיכת נהג שתל תואמת. יבש את השתלים באוויר למשך 20 שניות כדי להסיר חלקיקים/שאריות משוחררים על פני השטח.
- הנח את השתלים על דגמי צילום אקריליים מעוצבים בהתאמה אישית כדי לצלם תצוגות שטוחות, תצוגות אפיקליות של 30° ותצוגות עטרה של 30° כדי להעריך את החלקים האפיקליים והעטרתיים של החוטים על משטח השתל.
- הנח את המצלמה על חצובה ותקן את הגדרות המצלמה (מרחק 15 ס"מ, ISO 160, צמצם f/16, זמן חשיפה 1/250 שניות). ודא שהחדר מואר מספיק. יש צורך לייצב את המצלמה בעזרת חצובה.
- צלם את התמונות הדיגיטליות בפורמט RAW עם פלאש. השג בסך הכל 90 תמונות בוקאליות (אחת שטוחה, אחת 30° אפיקלית ואחת 30° קורונלית עבור כל משטח שתל) עבור פגמים ב-Class1A ו-270 תמונות (שטוחות, 30° אפיקליות ו-30° קורונליות מכל משטח בוקאלי, מזיאלי ודיסטלי עבור כל שתל) עבור פגמים מסוג 1B. הפקידו את כל קובצי התמונות הדיגיטליות בדיסק קשיח להמשך ניתוח תמונה.
6. ניתוח תמונה
- בצע את כל הניתוחים בתוכנת תמונה דיגיטלית (ImageJ). לפני הניתוח, הפוך את רקע הצילומים לשחור באמצעות תוכנת פוטושופ (Photoroom) כדי להבטיח שרק השתל נראה בתמונה. פתח את היישום ולאחר מכן הוסף כל תמונה מהגלריה. הסר את הרקע מהתמונה ובחר רקע שחור מהאפשרויות.
- גרור ושחרר את התמונה ב-ImageJ. צייר ריבוע בתמונה כדי לכסות 5 מ"מ קורונלי לשתל. לאחר מכן לחץ על תמונה > חיתוך לסטנדרטיזציה. חזור על אותו תהליך עבור כל תמונה.
- המר את התמונות לפורמט 8 סיביות על ידי לחיצה על תמונה ˃ סוג ˃ 8 סיביות והתאם את הספים על ידי לחיצה על תמונה ˃ התאם ˃ סף לחישובי שטח.
- חשב את כל שטח הפנים של השתל ואת שטח שאריות הצבע האדום על ידי לחיצה על נתח ˃ מדוד ˃ שטח.
- רשום את אזור הפיקסל שהתקבל בקובץ גיליון אלקטרוני. צור קובץ גיליון אלקטרוני נפרד כדי להקליט את נתוני התמונה הגולמיים.
- על מנת להשיג את אחוז שאריות הצבע האדום, הכפל את השטח המוצג באדום ב-100 וחלקו בשטח הפנים הכולל של השתל.
7. ניתוח SEM
- אחסן את כל השתלים בקופסאות הסטריליות שלהם עד ליום הניתוח.
- לפני ניתוח SEM, בחר באופן אקראי מדגם מייצג אחד מכל קבוצת טיפול. בנוסף לדגימות שנבחרו מכל קבוצה, הוסיפו שתל סטרילי אחד, ורק השתל מכוסה לחלוטין בדיו. לפיכך, הכינו בסך הכל שמונה דגימות שתלים לניתוח SEM.
- רססו גז חנקן באמצעות אקדח גז למשך 20 שניות על מנת להסיר כל מיקרו-אבקה על פני השתל לפני ניתוח SEM.
הערה: לא הוחל ציפוי זהב נוסף בשל הטכנולוגיה המתקדמת של המכשיר. - הרכיב כל שתל על גבי דפי SEM עם דיסקים דביקים מוליכים בפחמן באופן המאפשר ניתוח של המשטח השטוח הבוקאלי ללא טיהור ידיים. סדרו אותם לפי מספרים כדי למנוע בלבול של הקבוצות.
- בחר אזור מהשתלים המונחים במכשיר וצלם תמונות בהגדלות שונות. חזור על אותו הליך עבור אזורים שונים של משטחי השתל (מזיאלי או דיסטלי). השתמש בהגדלה של 100x, 1000x ו-5000x לתמונות באמצעות התקן SEM הפועל ב-10-30 קילו וולט עם מרחק עבודה ממוצע של 12 מ"מ.
הערה: המיקרו-גדיל השני מאזור הצווארון והמקרוסטרנד השני מהגוף נבחרו עבור כל שתל כדי להבטיח סטנדרטיזציה במהלך ניתוח SEM. עבור תמונות מסוימות, מומלץ לבצע ניתוח יסודות (EDS) במהלך ההדמיה לצורך השוואה.

איור 2: תרשים זרימה של המחקר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
8. ניתוח סטטיסטי
- מבטא משתנים קטגוריים כמספרים ואחוזים ומשתנים רציפים כממוצע וסטיית תקן. אשר את נורמליות ההתפלגות עבור משתנים רציפים באמצעות מבחן שפירו-וילק.
- להשוואה של משתנים רציפים בין קבוצות פגמים, השתמש במבחן t של הסטודנט. להשוואה בין יותר משתי קבוצות, השתמש במבחן ANOVA או Kruskal Wallis חד כיווני בהתאם לשאלה אם ההשערות הסטטיסטיות התגשמו או לא.
- עבור נתונים המופצים בדרך כלל, לגבי ההומוגניות של שונות, השתמש במבחני Tukey להשוואות מרובות של קבוצות. עבור נתונים המופצים באופן לא נורמלי, השתמש במבחן Mann-Whitney U המותאם ל-Bonferroni להשוואות מרובות של קבוצות. כל הניתוחים הסטטיסטיים בוצעו באמצעות IBM SPSS 20. רמת המובהקות הסטטיסטית עבור כל המבחנים נחשבה ל-0.05.
תוצאות
פרוטוקול הניסוי המתואר כאן לניתוח טיהור משטחי השתל חשף הבדלים משמעותיים בין הליכי טיפול שונים. בנוסף, פרוטוקול ה-SEM שלאחר הטיפול הראה גם שינויים משמעותיים על משטחי השתל בדרגות שונות בקרב קבוצות המחקר.
השוואות ברמת השתל (סך כל אמצעי השתל) לאחר טיהור
השוואות ברמת השתל בוצעו על ידי השוואת הממוצעים הכלליים של כל שתל (ממוצעי המדידה של משטחי הבוקאלי בפגמים מסוג 1A וממוצעי מדידת המשטח הבוקאלי, המזיאלי והדיסטלי בפגמים מסוג 1B). בהתאם לכך, הטיהור היעיל ביותר הושג עם AA בפגמים 1A (0.19 ± 0.02) (עמ' < 0.001). אחריה AA-1B (0.29 ± 0.04), PI-1B (0.38 ± 0.04) ו-PI-1A (0.43 ±-0.03). הטיהור הנמוך ביותר זוהה בקבוצות TIT-1A (0.53 ± 0.03) ו-TIT-1B (0.56 ± 0.03). אמנם לא היה הבדל מובהק בין קבוצות הטיטניום קורט (1A-1B), אך השוואות זוגיות של כל הקבוצות האחרות מובהקות סטטיסטית (p < 0.001; טבלה 1; איור 3).

איור 3: תרשים כינור של קבוצות ניסוי וסך אמצעי השתל. קיצורים: AA = אוויר-שוחק אוויר, PI = קצה הצצה, TIT = קורט טיטניום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
השוואות בגובה פני השטח של השתל לאחר טיהור
בדומה להשוואות ברמת השתל, שוחק אוויר (AA) סיפק סטטיסטית את הטיהור היעיל ביותר על משטחי הבוקאלי של כל הדגימות (1A + 1B) בהשוואה ל-PI ו-TIT (עמ' < 0.001). בעוד שטיהור טוב יותר הושג עם PI מאשר TIT על משטחים בוקאליים (p < 0.001), לא זוהה הבדל בין קבוצות בוקאליות TIT 1A ו-1B.
הטיהור היעיל ביותר על המשטחים המזיאליים של פגמים 1B סופק על ידי AA בהשוואה ל-PI ו-TIT, וההבדל בין כל הקבוצות היה מובהק סטטיסטית (p < 0.001). נמצא כי פרוטוקולי AA ו-PI היו יעילים באופן דומה על המשטחים הדיסטליים של פגמים 1B (p ˃ 0.05), ושתי הקבוצות נצפו יעילות יותר מקבוצת TIT (p < 0.001; טבלה 1).
השוואות ברמת פרוטוקול הטיפול לאחר טיהור
ללא קשר לקבוצות הפגמים, השוואות פרוטוקול הטיפול הראו כי AA (0.24 ± 0.06) היה יעיל יותר באופן מובהק סטטיסטית בטיהור פני השתל בהשוואה ל-PI ו-TIT (עמ' < 0.001). בנוסף, מדידות PI (0.41 ± 0.04) היו טובות יותר סטטיסטית מ-TIT (0.55 ± 0.03; p < 0.001; טבלה 1).
השוואות ברמת פגמים לאחר טיהור
ללא קשר לפרוטוקולי הטיפול, השוואות סוגי הפגמים הראו שסוגי פגמים מסוג 1A ו-Class 1B הובילו ליעילות טיהור דומה (p ˃ 0.388). מצד שני, בפגמים מסוג 1B, יעילות פרוטוקולי הטיפול נצפתה כטובה יותר סטטיסטית על משטחים בוקאליים (0.34 ± 0.17) בהשוואה למשטחים דיסטליים (p ˃ 0.388; טבלה 1).
טבלה 1: השוואה בין אחוז הדיו שנותר ותוצאות הטיהור לפי קבוצות טיפול וסוגי פגמים. אנא לחץ כאן להורדת טבלה זו.
השוואה בין זוויות ניתוח צילום לאחר טיהור
כאשר הושוו המדידות של התצלומים של 90° קדמית (F-90°), 30° אפיקלית (A-30°) ו-30° עטרה (C-30°), לא ניתן היה להבחין בהבדל בין A-30° ל-C-30°. טיהור יעיל יותר נרשם בדגימות הצילום C-30° ו-F-90° של משטחים בוקאליים בקבוצת AA, בדגימות הצילום A-30° ו-C-30° בקבוצת PI, ובדגימות הצילום הבוקאליות והמזיאליות F-90° בקבוצת TIT (טבלה 2).
טבלה 2: השוואה בין אחוז הדיו הנותר ותוצאות הטיהור לפי זוויות הצילום. אנא לחץ כאן להורדת טבלה זו.
תוצאות SEM וניתוח EDS לאחר טיהור
ניתוח SEM של הדגימות המייצגות הראה כי כל שיטות הטיפול השפיעו על משטח השתל. הטיפול ב-AA גרם לשינויים זניחים הן במבנה המיקרו-חוט והן במבנה המאקרו-חוט באתרים הבוקאליים, ללא קשר לקבוצת הפגמים (איור 4, איור 5). עם זאת, באזורים המזיאליים והדיסטליים של קבוצת הפגמים 1B, נמצאו יותר שאריות דיו מתחת לחוטים בהשוואה לאזור הבוקאלי (איור 5). בנוסף, חלקיק אבקה נצפה באתר המיקרו-חוט הבוקאלי של קבוצת הפגמים 1B (איור 6). הקצה האולטראסוני PEEK מפלסטיק/פחמן גרם להשטחה קלה עד בינונית של המבנה הטופוגרפי באתר הבוקאלי בהשוואה לשיטת AA, ללא קשר לקבוצת הפגמים. יתר על כן, בקבוצת ה-PEEK נצפה מראה מטושטש ומחורר יותר, שונה מהמבנה המחוספס, במיוחד בשל שאריות דיו שנותרו בין המיקרו-חוטים (איור 4, איור 5). עם זאת, הטיפול ב-PEEK הניב תוצאות דומות ל-AA באזורים המזיאליים והדיסטליים של קבוצת הפגמים 1B בהגדלות של 1000x ו-5000x (איור 5). בנוסף, לא נמצאו חפצים זרים בקבוצת PEEK. מצד שני, קורטות טיטניום גרמו לשינויים נרחבים לפני השטח בהשוואה לשיטות אחרות. בקבוצת הפגמים 1A, לא ניתן היה להבחין במבנה המחוספס במבנה המיקרו-חוט באזור הבוקאלי עקב טיהור לקוי (איור 4). באתרים אחרים זוהו שיטוח ושריטות אורכיות/אופקיות (איור 4, איור 5). באתרים המזיאליים והדיסטליים של קבוצת הפגמים 1B, המבנה המחוספס נעלם, ומספר השריטות גדל (איור 5). בנוסף, נערך ניתוח יסודות (EDS) של שתל הייחוס הסטרילי, שחשף תכולת טיטניום של 99.2% (איור 7). ניתוח יסודות בוצע גם על המבנים הבולטים (חורים שחורים) בקבוצות אחרות ועל משטח השתל הלא מטופל המכוסה בדיו לחלוטין, והראה תוצאה דומיננטית בפחמן באזורים אלה, ככל הנראה עקב אידוי הדיו (איור 8 A-C).

איור 4: תמונות SEM של דגימות שתלים מקבוצת הפגמים Class 1A. (A) תמונות בהגדלה של 100x, 1000x, 5000x של המיקרו-חוט של הפגם הבוקאלי 1A. (B) תמונות בהגדלה של 100x, 1000x, 5000x של חוט המאקרו של הפגם הבוקאלי 1A. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: תמונות SEM של דגימות שתלים מקבוצת הפגמים Class 1B. (A) תמונות בהגדלה של 100x, 1000x, 5000x של המיקרו-חוט של הפגם הבוקאלי 1B. (ב) תמונות בהגדלה של 100x, 1000x ו-5000x של חוט המאקרו של הפגם הבוקאלי 1B. (ג) תמונות בהגדלה של 100x, 1000x, 5000x של האתר המזיאלי של הפגם 1B. (D) תמונות בהגדלה של 100x, 1000x, 5000x של האתר הדיסטלי של הפגם 1B. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: תמונת חלקיקי אבקת אריתריטול שזוהתה באתר צווארון השתל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
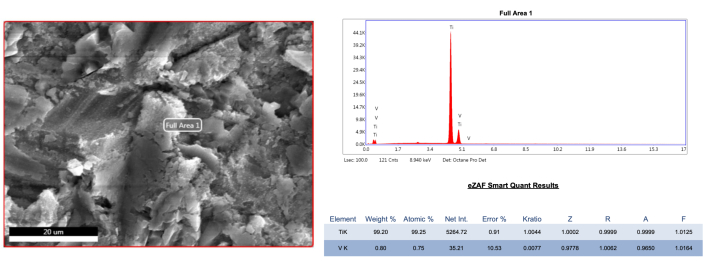
איור 7: ניתוח EDS של דגימת שתל ייחוס סטרילית ולא מטופלת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 8: ניתוח EDS. (א) ניתוח EDS של דגימת שתל לא מטופלת מצופה דיו. (B) ניתוח EDS של דגימת השתל מקבוצת PEEK (קבוצה 4). (C) ניתוח EDS של דגימת השתל מקורט הטיטניום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
המתודולוגיה של ניתוח פני שטח במבחנה של שתלים דנטליים המושפעים ממחלה סביב השתל תמיד הייתה מאתגרת בשל האופי הדלקתי והחיידקי של המנגנונים הפתוגניים המתרחשים על המשטחים המחוספסים של השתל. מספר חששות כוללים את בחירת חומר הדגימה, חיקוי ביופילם על פני השטח, בחירת סוג הפגם פרי-אימפלנטיטיס, ייצוג תנאים קליניים במהלך הליכי המבחנה, וריאציות של הליכי הטיהור ושיטות קביעת כמות הטיהור והשפעות ההליכים על חספוס משטח השתל. לכל מותג שתל יש מאפייני משטח ייחודיים כגון סוג המתכת (טיטניום, זירקוניום), מאפייני חספוס פני השטח, אנרגיה נטולת פני השטח, יכולת הרטבה, עומק חוט, רוחב ואורכים, שלכולם השפעה ישירה על היעילות של פרוטוקולי טיהור. כדי להתגבר על חשש זה, חלק מהמחקרים השתמשו בדיסקים מוכתמים או מזוהמים במקום בשתלים. עם זאת, היכולת להסיר ביופילם חיידקי ממשטח שטוח (דיסק) לעומת תכונה מסוג בורג (שתל) לא תציג את המצב הקליני בפועל16,20. למרות שיעילות הטיהור של מותגי שתלים שונים הוערכה בספרות21, נעשה שימוש בשתלים בעלי תכונות סטנדרטיות ומתקדמות במחקר הנוכחי.
מודל הדיו הקבוע ששימש במחקר זה הוא השיטה הנפוצה ביותר לחיקוי ביופילם על השתלים 13,14,15,16,17,19,22. עם זאת, שימוש בדיו עשוי לייצג הטיה מכיוון שהוא נראה בקלות למפעיל, מה שסותר את התנאים הקליניים. בנוסף, ביופילם מדומה זה אינו נדבק למשטח השתל באותו אופן כמו ביופילמים טבעיים, והוא אינו מסוייד, מה שמקל על הניתוק הפיזי מאשר במסגרות קליניות בפועל. ציפוי משטח השתל בחשבון מלאכותי23 עשוי להוות פתרון לכך, אך השגת עובי אחיד ואחיד עדיין עשויה להוות מגבלה. מספר מחקרים השתמשו בחיידקים פתוגניים פריודונטליים ישירים ב-vivo24 או בזיהום חוץ גופי25 של משטח הטיטניום. מכיוון שפרי-אימפלנטיטיס היא מחלה רב-חיידקית מורכבת, השימוש בביופילמים מונו-בקטריאליים או ביופילם רב-חיידקי על פני השטח עשוי להשפיע על תוצאות הליכי הטיהור26. יתר על כן, הזיקה של חיידקים להיצמד לחומרי משטח שונים של השתל (זירקוניה, טיטניום) עשויה להיות שונה עקב חספוס פני השטח ואנרגיה נטולת פני השטח26. בתוך מגבלות אלו, שיטת צביעת הדיו מספקת מספר יתרונות, כגון מדידה ישירה של שאריות הדיו באופן דיגיטלי ומאפשרת השוואה כמותית בין שיטות הטיהור.
דווח כי סוג סוג הפגם פרי-אימפלנטיטיס ונוכחותם של דפנות פגמים משפיעים על השפעת פרוטוקולי הניקוי המכני 15,18,27. פגמים סופרקרסטליים או היקפיים עם זוויות שונות שימשו במחקרים קודמים במבחנה15,28. הבעיה העיקרית בדגמי פגמים אלה היא שהגישה למשטח השתל במהלך המכשור זהה בכל האזורים; עם זאת, זה לא משקף את הפגמים הקליניים. במחקר הנוכחי נעשה שימוש בפגמים תוך-גרמיים מסוג 1A ו-Class1B 18, שהם הסוג הנפוץ ביותר של פגמים פרי-שרפנטיטיס. בנוסף, במחקר הנוכחי בוצעו הדמיה של הגדרות כירורגיות כפי שהומלץ על ידי הנחיות EFP5, שבו, מבחינה קלינית, מסירים את מבנה-העל התותב, ודשי ה-mucoperiosteal מוגבהים לראייה ישירה של הפגמים בפרי-אימפלנטיטיס.
ההצלחה של פרוטוקולי טיהור פני השתל תלויה ביכולתם לקבל גישה למשטחים הפנימיים המחוספסים של חוטי השתל. עד כה נחקרו מספר שיטות טיהור בדרגות שונות של הצלחה. בין אלה, מערכות שוחקות אוויר, מברשות טיטניום וקורטים דווחו כפרוטוקולי הטיפול היעילים ביותר8. עם זאת, כל הטיפולים הללו גורמים לשינויים בחספוס פני השטח של השתל, כגון שינויים במרקם ובעובי שכבת התחמוצת. לשינויים מיקרו-טופוגרפיים אלה עשויות להיות בסופו של דבר השלכות קליניות שליליות. לכן, טרם נקבעה שיטת הטיהור האופטימלית למשטחי השתל. למרות שהשוואה ישירה של התוצאות הנוכחיות עם מחקרים קודמים אינה אפשרית בשל סוג הפגם הספציפי וסימולציה של מודל הלסת, ניתן לציין קווי דמיון במרכיב התוך-עצמותי. ממצאי המחקר הנוכחי עולים בקנה אחד עם הספרות, ומצביעים על כך ש-AA יעיל יותר על משטחים בוקאליים, שם הוא מיושם בניצב בזווית של 90 מעלות למשטח השתל, בעוד שיעילותו פוחתת על משטחים מזיאלים ודיסטליים, כאשר המרכיב התוך-גרמי מחייב יישום זוויתי 14,16,17,29. בנוסף, ניתן להסביר זאת על ידי אפקט הריקושט שתואר על ידי פטרסילקה בשנת 201130, המתרחש כאשר AA, העובד על העיקרון של אבקה ומים בלחץ, מוחל על משטחים.
יעילות סוג האבקה המשמש בהליכי AA נחקרה במחקרים רבים. אמנם גליצין היא האבקה הנפוצה ביותר במחקר קליני ובמחקר חוץ גופי, אבל בין הסוגים האחרים של גליצין נתרן ביקרבונט, סידן ביקרבונט, טריקלציום פוספט וגם אריתריטול7. עם זאת, נצפה כי אבקות בעלות גדלי חלקיקים גדולים יותר, בעוד שהן מספקות טיהור יעיל יותר על פני השתל, גורמות גם לשינויים נוספים במשטח כגון שינויים מבניים מאקרו ושריטות מוגברות 13,31. מחקר מבחנה שנערך לאחרונה על ידי Pujarern et al.9 לא הראה הבדל ביעילות טיהור הביופילם בין אבקות אריתריטול ונתרן ביקרבונט על משטחי השתל. יתר על כן, דווח כי חלקיקים קטנים יותר מתמוססים ביתר קלות בתערובת האוויר-מים, מה שמפחית את הסיכון לנזק לפני השטח ומקל על חדירה לחללי חוטים צרים בהשוואה לחלקיקים גדולים יותר13. למרות היתרונות של מערכות שוחקות אוויר, כגון היותן שיטה יעילה להסרת ביופילם ממשטחי השתל, גרימת נזק מינימלי למשטח, הפחתת טראומה לרקמות רכות ותחלואה נמוכה של מטופלים לאחר הניתוח, יש לציין מגבלות מסוימות. אלה כוללים אתגרים בהסרת משקעים מסויידים או הצטברות חיידקים דבוקים היטב32, קושי בהשגת זוויות מתאימות באזורים אחוריים ולשוניים/חיכיים, והסיכון לאמפיזמה תת עורית עקב אוויר בלחץ במהלך ההליך33. לכן, נדרשות ראיות נוספות כדי לתמוך בשימוש השגרתי במערכות שוחקות אוויר5.
במצבים בהם לא ניתן להשתמש במערכות אבקה שוחקות אוויר, חלופות כגון מברשות טיטניום, קורטות מתכת או טיפים קוליים עשויות להיות עדיפות או יידרשו כטיפול משלים21. עם זאת, מכשירים מתכתיים המשמשים לטיהור מכני עשויים ליצור משטח מחוספס יותר על ידי גירוד פני הטיטניום, מה שעלול לקדם הידבקות מיקרוביאלית והצטברות פלאק. לכן, יש להשתמש בחלופות כגון טפלון, פלסטיק ומכשירים מצופים PEEK ולחקור אותן עוד יותר. במחקר הנוכחי הוערכה היעילות של קצה PEEK/פחמן קולי שפותח לאחרונה, שתוכנן במיוחד עבור משטחי שתלים. במחקרים אחרונים התואמים את המתודולוגיה שלנו, קצות פלסטיק PEEK קוליים וקוליים, כמו גם מערכות אבקה שוחקות אוויר, השיגו את התוצאות הטובות ביותר על משטחי שתלים שונים12,34. קצה ה-PI MAX המשמש במחקר הנוכחי שונה מקצה ה-PEEK הקודם של היצרן בכך שהוא מכיל 30% פחמן ובעל עיצוב דק וגמיש יותר. הנתונים המוגבלים הזמינים על עיצוב חדש זה מדגישים את החשיבות של השוואה לשתי השיטות הנחקרות ביותר (שחיקת אוויר וקורטות טיטניום) במחקר הנוכחי.
קורטות מתכתיות, הנמצאות בשימוש נרחב כיום ונחשבות לתקן הזהב לניקוי מכני בטיפולי חניכיים, נמצאות בשימוש נפוץ גם סביב השתלות שיניים. יצרנים רבים פיתחו קורטות טיטניום שתוכננו במיוחד להסרת ביופילם ושאריות אחרות מבלי לפגוע במשטח השתל35. סימולציות במבחנה הגיעו למסקנה כי מכשור מכני חוזר אינו מוביל לשינויים מצטברים בחספוס פני השתל36. עם זאת, במקרים מסוימים, קורטות טיטניום עשויות להיות בעלות יעילות מוגבלת בהסרת משקעים מוקשים או מינרליים. בנוסף, ניקוי עם קורט טיטניום ידני עשוי להיות גוזל זמן ונתון לשונות בהתאם לרמת המיומנות של המפעיל37. בהתבסס על הראיות הנוכחיות, מאתגר לתרגם את ממצאי המחקרים הללו לפרקטיקה קלינית בשל ההטרוגניות הגבוהה של עיצובים מיקרו-מקרוסקופיים של שתלים.
השכיחות הגוברת של מחלת פרי-שתל עקב המספר הגבוה של שתלים דנטליים המוצבים דורשת גישה צפויה הנתמכת על ידי נתונים מבוססי ראיות לטיפול במשטחים מזוהמים. שיטות טיהור צריכות לקחת בחשבון שמשטחי השתל הנפוצים ביותר מציגים רמה גבוהה של חספוס, מה שמקדם אוסאואינטגרציה, וכי יש לתקנן את הכימות והחיסול לאחר מכן של ביופילם חיידקי מבלי לגרום נזק משמעותי לפני השטח8. שיטות המבחנה הנפוצות ביותר המשמשות להערכת ננו-טופוגרפיה של החומרים הדנטליים והחספוס של משטחי השתל הן פרופילומטריה מכנית ותלת מימדית-אופטית (מגע וללא מגע) לניתוח כמותי ומיקרוסקופ אלקטרונים סורק (SEM) להערכה איכותית 12,38,40 . המורכבות של מדידה ומחקר של חספוס פני השטח של שתלים נובעת מנוכחותם של חללים ופגמים ללא כל דפוס גלוי מדויק41.
ממצאי ה-SEM של המחקר הנוכחי היו בהתאם לממצאים קודמים שטיפול ב-AA גרם לשינויים קלים במשטח17,31, בעוד שהשטחה משמעותית של טופוגרפיית פני השטח נצפתה עם קורטות טיטניום23. SEM מספק טווח דינמי באמצעות שדה ראייה גדול יותר עם עומק שדה גדול יותר והגדלה גדולה יותר. ניתן להעריך את פרטי פני השטח, כגון מרקם טופוגרפי וניגודיות חומרים, ברזולוציה של עד ננומטר. עם זאת, SEM אינה טכניקה כמותית בפני עצמה, וניתן להשיג נתונים אמינים יותר כאשר היא משולבת עם טכניקות כמותיות אחרות, שבהן פרופילומטריה היא השיטה הנפוצה ביותר. לאחרונה, נעשה שימוש בסטריאו-פוטוגרמטריה תלת מימדית42 ותוכנת ניתוח תמונה חדשנית מבוססת בינה מלאכותית43 למדידות כמותיות ישירות של SEM.
לסיכום, במסגרת המגבלות, הממצאים מצביעים על כך שיש לקבוע את הבחירה בשיטת הטיהור ליישומים קליניים על סמך המטרה הסופית של טיפול פרי-אימפלנטיטיס. בהתאם לכך, בעוד שמערכת אבקת אריתריטול שוחקת אוויר נראית כאופציה עדינה יותר למשטח השתל בטיפולים רגנרטיביים ומספקת נגישות וטיהור יעילים יותר, ניתן להמליץ על קורטות טיטניום, המשטיחות את פני השטח, לניקוי גרגירי רקמות רכות סביב השתל ובטיפולי כריתה שבהם משטח השתל נותר חשוף לסביבת הפה. טיפים להצצה אולטרסאונד מומלצים גם להסרת משקעים מסויידים על פסגות חוט השתל ומשטחים טרנס-ריריים חלקים. השימוש המשולב בשיטות הטיהור הזמינות, במקום השימוש בהן בנפרד, עשוי לייצג את הגישה היעילה ביותר.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
השתלים ששימשו במחקר נתמכו על ידי Dentsply Sirona.
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
References
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved