Method Article
Auswirkungen mechanischer Methoden bei der Behandlung von Periimplantitis auf die Dekontamination und Rauheit der Implantatoberfläche
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt ein experimentelles Modell auf Basis der Tintenfärbung, das für die in vitro Implantatoberflächendekontamination und Rauheitsforschung verwendet werden kann, um zur klinischen Entscheidungsfindung beizutragen.
Zusammenfassung
Es wurden verschiedene mechanische Methoden zur Dekontamination von Zahnimplantatoberflächen mit unterschiedlichem Erfolg vorgeschlagen. In dieser In-vitro-Studie wurde die Dekontaminationseffizienz eines Luftabriebsystems (AA) mit Erythritolpulver, einer Polyetheretherketon-Ultraschallspitze (PEEK) und Titanküretten (TIT) und deren Auswirkungen auf die Oberflächentopographie des Implantats mittels Rasterelektronenmikroskopie (REM) untersucht. Insgesamt wurden 60 Implantate mit permanenter roter Tinte gefärbt und in 3D-gedruckte Periimplantitis-Defekte der Klassen 1A und 1B eingesetzt, die je nach Defekttyp und Behandlungsprotokoll sechs Gruppen (n = 10 pro Gruppe) bildeten. Zusätzlich wurden ein Positiv- und ein Negativkontrollimplantat verwendet. Erythritolpulver, PEEK-Ultraschallspitzen und Titanküretten wurden 2 Minuten lang bei Defekten der Klasse 1A und 3 Minuten bei Defekten der Klasse 1B aufgetragen. Die verbleibenden roten Tintenbereiche wurden mit digitaler Software quantifiziert und die Veränderungen der Implantatoberfläche wurden mit REM und EDS analysiert. Keine der Methoden erreichte eine vollständige Dekontamination. Erythritpulver war jedoch mit einer Resttintenrate von 24 % ± 6 % (p < 0,001) deutlich am wirksamsten. PEEK-Ultraschallspitzen ergaben 41 % ± 4 % Resttinte, während Titanküretten 55 % ± 3 % übrig ließen. Bei allen Methoden wurden signifikante Unterschiede beobachtet. Es wurde kein signifikanter Unterschied in der Dekontaminationswirksamkeit zwischen Defekten der Klasse 1A und Klasse 1B festgestellt. Die REM-Analyse zeigte minimale Oberflächenschäden mit Erythritpulver und PEEK-Spitzen, während Titanküretten mittelschwere bis schwere Schäden verursachten. Sowohl aufgrund der Dekontaminationseffizienz als auch der Oberflächenkonservierung sind Erythritpulver und PEEK-Spitzen sichere und wirksame Optionen für die Behandlung von Periimplantitis, während Titanküretten weniger wirksam sind und erhebliche Oberflächenschäden verursachen. Diese Befunde können Klinikern bei der Behandlungsplanung bei Periimplantitis helfen.
Einleitung
Die Behandlung mit Zahnimplantaten ist weltweit das gebräuchlichste und bevorzugte Protokoll zum Ersatz fehlender Zähne. Langzeit-Follow-up-Studien haben gezeigt, dass der Einsatz von implantatgetragenen Restaurationen bei der Behandlung von vollständiger oder teilweiser Zahnlosigkeit vorhersehbare Ergebnisse und hohe Erfolgsraten in Bezug auf das Überleben liefert. Nach der chirurgischen Platzierung und Versorgung von Implantaten können jedoch verschiedene Komplikationen im Hart- und Weichgewebe auftreten1. Im Jahr 2017 wurden auf dem World Workshop on the Classification of Periodontal and Periimplant Diseases and Zustände Definitionen und Differentialdiagnosen für Erkrankungen eingeführt, die periimplantäres Gewebe betreffen2. Nach dieser Definition ist die Periimplantitis ein irreversibler pathologischer Zustand, der durch klinische Entzündungszeichen gekennzeichnet ist, einschließlich Blutungen bei der Sondierung und/oder Eiterung, erhöhte Sondierungstiefen und/oder Rezession des Schleimhautrandes in der periimplantären Schleimhaut und röntgenologischen Verlust des Stützknochens2. Die Ätiologie periimplantärer Erkrankungen ist multifaktoriell, und einige Personen sind anfälliger für diese Erkrankung als andere. Spezifische Veranlagungen des Einzelnen können das Risiko für die Entwicklung einer periimplantären Erkrankung erhöhen, die zum Verlust des Implantats führen kann. Weitere Faktoren, die bei der Ätiologie periimplantärer Erkrankungen eine Rolle spielen, sind patientenbezogene Faktoren (Rauchen, systemische Erkrankungen, Parodontitis in der Anamnese, Mundhygiene); den Zustand der keratinisierten Schleimhaut, die Menge und Qualität des Knochens und des Weichgewebes an der Implantatstelle; Kräfte auf das Implantat und das umgebende Gewebe; Komplikationen, die bei der Implantation auftreten; und die Erfahrung und das Können des Arztes, der chirurgische und prothetische Behandlungen durchführt2. Darüber hinaus wurde kürzlich ein neues Risikobewertungs- und Behandlungskonzept eingeführt, das Implant Disease Risk Assessment Tool (IDRA)3. Dieses Tool wurde als Funktionsdiagramm entwickelt, das aus acht Parametern besteht, die jeweils einen dokumentierten Zusammenhang mit einer Periimplantitis aufweisen. Die Vektoren des Achtecks sind die Parodontitis in der Anamnese, der Prozentsatz der Implantat- und Zahnstellen mit Blutungen bei der Sondierung (BoP), die Anzahl der Zähne/Implantate mit Sondierungstaschentiefen ≥ 5 mm, die Rate des parodontalen Knochenverlusts (Röntgenbilder in Bezug auf das Alter des Patienten), die Anfälligkeit für Parodontitis, die Häufigkeit der unterstützenden Parodontaltherapie (SPT) und das Design der Prothese.
Jüngste systematische Übersichtsarbeiten haben gezeigt, dass die Prävalenz der Periimplantitis auf Patientenebene 19,53 % und auf Implantatebene 12,53 % beträgt3. Angesichts von etwa 5 Millionen Implantaten, die jedes Jahr weltweit gesetzt werden, mit einer Marktgröße von mehr als 4 Milliarden USD, stellt die Periimplantitis ein großes Gesundheitsproblem für die Bevölkerung dar. Unbehandelt führt die Periimplantitis zum Verlust des betroffenen Implantats und der implantatgetragenen Prothese, was sowohl für den Zahnarzt als auch für den Patienten eine große Belastung darstellt.
Die Behandlung periimplantärer Erkrankungen lässt sich in nicht-chirurgische und chirurgische Ansätze unterteilen. Obwohl eine vernünftige Erwartung für den Erfolg von Endpunkten bei der Behandlung der Parodontitisbesteht 4, gibt es noch kaum vergleichbare Evidenz für die Behandlung der Periimplantitis. Daher besteht die Begründung für einen stufenweisen Ansatz und eine nicht-chirurgische Therapie der Periimplantitis darin, den Biofilm und die Entzündungskontrolle mit relativ einfachen Ansätzen zu versuchen, bevor die Invasivität der Behandlung erhöht wird, und den chirurgischen Schritt durchzuführen, wenn eine bessere Kontrolle des Biofilms und der Risikofaktoren erreicht wird. Dazu gehören OH-Anweisungen und -Motivation, Kontrolle von Risikofaktoren, Kontrolle von Biofilm-Retentionsfaktoren und Reinigung/Entfernung/Modifikation von Prothesen, einschließlich der Beurteilung von Prothesenkomponenten, supramarginaler und submarginaler Instrumente und bei Bedarf einer begleitenden Parodontalbehandlung. Daher sollte die nicht-operative Therapie immer der erste Schritt sein5. Bei einer frühen Periimplantitis kann die Reduzierung der Risikofaktoren und eine nicht-chirurgische Behandlung ausreichend sein, aber die vollständige Entfernung des Biofilms in tiefen Taschen nach Knochenverlust ist oft eine Herausforderung. Während der Reevaluationsphase nach nicht-chirurgischer Behandlung deuten persistierende Taschentiefen (≥ 6 mm) und Blutungen bei Sondierung (BoP) auf ein mögliches Fortschreiten der Periimplantitis hin. Wenn diese Anzeichen vorhanden sind, werden chirurgische Eingriffe empfohlen6. Die chirurgische Therapie der Periimplantitis umfasst (i) das offene Lappendebridement, (ii) die resektive Lappenchirurgie, (iii) die Behandlung periimplantärer ossärer Defekte mit rekonstruktiven Ansätzen, (iv) zusätzliche Methoden zur Dekontamination der Implantatoberfläche und (v) die ergänzende Anwendung von lokalen/systemischen Antibiotika7.
Der wichtigste ätiologische Faktor der Periimplantitis ist der pathogene Biofilm, der auf der Implantatoberfläche besiedeltist 6. Die Entfernung dieses Biofilms ist das Hauptprinzip und Ziel aller Behandlungsprotokolle, die mechanische, chemische und Laser-Dekontaminationsmethoden umfassen7.
Beim mechanischen Debridement werden Kunststoff-, Kohlenstoff- und Titanküretten, Ultraschallgeräte mit Kunststoff- und Metallspitzen, Titanbürsten und Luftschleifsysteme (AA) mit verschiedenen Pulvern verwendet. Obwohl eine vollständige Beseitigung des Biofilms schwer zu erreichen ist, bieten diese Therapien klinische Vorteile. Verschiedene klinische Interventionen, darunter mechanische Debridement-Protokolle mit oder ohne Antiseptika8, Antibiotika9 sowie resektive und regenerative Chirurgie10, wurden mit unterschiedlichem klinischem Erfolg eingesetzt. Sie induzieren jedoch auch Veränderungen der chemischen und physikalischen Eigenschaften der Implantatoberfläche, was möglicherweise die Knochenneubildung und die Re-Osseointegration erschwert.
Unter den mechanischen Methoden haben AA-Verfahren mit unterschiedlichen Pulverzusammensetzungen die beste Reinigungswirkung gezeigt 11,12,13. Das Vorhandensein von Restpartikeln kann jedoch die Oberflächentopographie verändern und die Biokompatibilität verringern14. Glycin, gefolgt von Natriumbicarbonat, ist das am häufigsten verwendete Pulver in AA-Systemen8. In jüngster Zeit haben kleinere luftabrasive Partikel wie Erythrit (14 μm) an Interesse gewonnen, um eine effektive Dekontamination mit reduzierter Oberflächenschädigungzu ermöglichen 9. Küretten aus Titan und Kunststoff, die weniger Oberflächenschäden verursachen als Stahlspitzen, sind bei der Biofilmdekontamination wirksam15. Ultraschall-Scalerspitzen aus Polyetheretherketon (PEEK) reduzieren zudem die Bakterienbelastung bei minimaler Oberflächenbeschädigung10. Dekontaminationsmethoden müssen die hohe Rauheit der Implantatoberflächen berücksichtigen und zielen darauf ab, den bakteriellen Biofilm zu entfernen, ohne nennenswerte Oberflächenschäden zu verursachen. Obwohl umfangreiche In-vitro-, In-vivo- und klinische Studien durchgeführt wurden, gibt es bis heute keinen Konsens und kein Goldstandardprotokoll für die Behandlung von Periimplantitis. Die zunehmende Prävalenz periimplantärer Erkrankungen aufgrund zahlreicher Zahnimplantate erfordert ein evidenzbasiertes, vorhersagbares Vorgehen bei der Behandlung kontaminierter Oberflächen. Ziel dieser Studie ist es, die Wirksamkeit verschiedener Dekontaminationsmethoden - Luftschleifsysteme (AA), PEEK-Ultraschallspitzen und Titanküretten - auf die Dekontamination der Implantatoberfläche zu bewerten und ihren Einfluss auf die Oberflächenrauheit des Implantats durch REM-Analyse zu bewerten.
Protokoll
Das Studienprotokoll wurde von der Ethikkommission (TBAEK-363) der Akdeniz Universität, Antalya, Türkei, genehmigt. Diese Studie wurde durch den Akdeniz University Research Fund (Projektnummer: TDH-2024-6676) unterstützt. In der Studie wurde ein schraubenförmiges Zahnimplantat (PrimeTaper EV Implant) mit Abmessungen von 4,2 mm x 11 mm und einem Mikrogewinde von 1,7 mm am Kragen verwendet. Oberflächenvorbereitung durch Sandstrahlen und Säureätzen mit verdünnter Flusssäure, um die gut definierte OsseoSpeed-Oberfläche zu erzielen.
1. Erstellung von experimentellen Periimplantitis-Modellen
HINWEIS: Drei mechanische Dekontaminationsbehandlungsverfahren (Luftschleifmittel (AA), Polyetheretherketon (PEEK), Ultraschall und Titanküretten; Tabelle der Materialien) bei zwei verschiedenen Periimplantitis-Defekttypenwurden 11 (Klasse 1A und Klasse 1B) analysiert. Es gab also sechs Versuchsgruppen (Abbildung 1). Insgesamt wurden 62 Implantate verwendet, darunter ein Positiv- und ein Negativkontrollimplantat. Dieses ursprünglich von Sharhmann et al.16 entwickelte In-vitro-Studiendesign wurde von verschiedenen Forschern 12,13,14,15,16,17,18 in der Literatur modifiziert (Abbildung 2). Unter der Annahme eines Unterschieds von 10 % in der Wirksamkeit der Biofilmentfernung zwischen den Gruppen wurde die Stichprobengröße für sechs Gruppen mit G*power, einer Effektstärke von 0,50, einem Typ-I-Fehler von 5 % und einer Power von 80 % auf 60 % (10 für jede Gruppe) festgelegt.

Abbildung 1: Flussdiagramm der Versuchsgruppen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Entfernen Sie einen ersten Backenzahn aus dem pädagogischen Unterkieferphantommodell. Die Kunststoffzähne werden bei diesem Phantommodell mit Schrauben befestigt. Schrauben Sie den ersten Backenzahn ab und entfernen Sie das Gewinde aus der Alveole. Füllen Sie die Alveolarkamme, indem Sie das weiche Silikonmaterial so formen, dass es die Pfanne bedeckt und einen flachen Alveolarkamm erzeugt.
HINWEIS: Es wurde eine Simulation eines Implantats erstellt, das in einem zahnlosen Bereich platziert wurde. - Scannen Sie das vorbereitete Modell in einem Laborscanner, um ein digitales Design zu erstellen.
- Erstellen Sie digitale 3D-Knochendefekte der Klassen 1A und1B 11 für Periimplantitis. Öffnen Sie das Softwareprogramm Exocad. Laden Sie die gescannte Modelldatei hoch. Klicken Sie dann auf Design und wählen Sie Expertenmodus aus. Entfernen Sie unregelmäßige Bereiche mit der Option Netz bearbeiten. Klicken Sie dann mit der rechten Maustaste und wählen Sie Scan als Datei speichern im entsprechenden Ordner auf dem Computer.
- Wählen Sie Werkzeuge > Option Netz hinzufügen/entfernen , wählen Sie Wachsscannen> Datei hochladen und wählen Sie die Datei aus, die gerade in dem Ordner gespeichert wurde. Klicken Sie danach rechts auf Wizard-Modus .
- Erstellen Sie im resultierenden neuen STL-Modell eine Defektsimulation im Zahnfach. Klicken Sie dazu auf der linken Seite auf Hinzufügen/Entfernen . Wählen Sie "Ovale Pinselgröße" aus. Erstellen Sie anschließend den Defekt auf dem Modell, indem Sie die Umschalttaste gedrückt halten und gleichzeitig mit der linken Maustaste klicken. Stellen Sie die Länge des Defekts auf 5 mm und die Breite auf 4,2 mm (entsprechend dem Durchmesser des Implantats) auf der bukkalen Oberfläche des Implantats für die Defekte der Klasse 1A und 5-5-5 mm für die Defekte der Klasse 1B ein.
- Um die horizontale Breite des Defekts zu verkleinern, wählen Sie die Höcker aus, indem Sie auf der linken Seite auf Anatomie klicken und die vestibuläre Breite des Defekts nach innen verkleinern. Klicken Sie dann mit der rechten Maustaste, und speichern Sie die Szene als Datei.
- Um ein endgültiges Modell zu erstellen, starten Sie das Programm neu und laden Sie den gespeicherten Ordner neu. Wählen Sie dann auf der rechten Seite die Optionen Assistentenmodus und Modellausrichtung aus. Wählen Sie links den Modelltyp als Digitales Waxup-Modell aus. Klicken Sie mehrmals auf Weiter, bis Sie den Abschnitt Modellkonstruktion auf der linken Seite erreichen. Wählen Sie die Option Vollständiges Modell aus, und klicken Sie zweimal auf Weiter . Sobald die Modelldatei fertig ist, öffnen Sie sie mit dem Explorer, und sie kann gedruckt werden.
- Leiten Sie die STL-Dateien des entworfenen Modells an den 3D-Drucker weiter. Drucken Sie die erstellten digitalen Modelle mit einem Modellharz aus.
- Spülen Sie die Versuchsmodelle 5-10 Minuten lang in 96%igem Ethanol. Legen Sie die Modelle nach dem Reinigungsvorgang in das lichtemittierende Härtungsgerät und härten Sie sie 5 Minuten lang mit Licht bei der Dosiseinstellung gemäß den Anweisungen des Herstellers aus.
HINWEIS: Verwenden Sie ein Harzmodell mit hoher Zug-, Biege- und Druckfestigkeit, das für das Bohren von Implantaten geeignet ist. Reinigen Sie das gedruckte Modell mit Lösungen auf Alkoholbasis gemäß den Anweisungen des Herstellers und stellen Sie sicher, dass es ausreichend lichtgehärtet ist.
2. Färben von Implantaten
- Tauchen Sie die Testimplantate in viskose, wasserfeste rote Tinte. Stellen Sie sicher, dass alle Teile der Implantatoberfläche 15 s lang vollständig und homogen mit Tinte bedeckt sind. Entnehmen Sie die Implantate mit Hilfe von Treiberhandstücken oder Abformpfosten ohne Handkontakt aus dem sterilen Behälter.
HINWEIS: Diese Färbung simuliert ein optisch sichtbares Biofilm-Surrogat für die fotografische Analyse. - Trocknen Sie die verfärbten Implantate mit einer Luftspritze der Dentaleinheit, um eine gleichmäßige Verteilung der Tinte zu erhalten. Trocknen Sie die verfärbten Implantate 24 h lang bei Raumtemperatur weiter. Trocknen Sie die Implantate isoliert mit den Handstücken, ohne Handkontakt.
3. Einsetzen von gefärbten Implantaten
- Passen Sie die Einstellungen eines zahnärztlichen Physiospenders wie folgt an: 800 U/min, 40 N Drehmoment ohne Salzspülung.
- Erstellen Sie die Implantatpfanne mit den chirurgischen Implantatbohrern an den Versuchsmodellen, um die Implantate mit einer Länge von 11 mm und einer Breite von 4,2 mm zu platzieren. Bereiten Sie den gleichen Implantatsockel für Modelle mit beiden Arten von Defekten (Defektmodelle der Klassen 1A und 1B) vor.
- Verwenden Sie die Implantatbohrer nacheinander gemäß den Anweisungen des Herstellers, um eine Primärstabilität zu erreichen. Reinigen Sie den restlichen Schmutz nach dem Bohren mit einer Luft-Wasser-Spritze und setzen Sie dann die Implantate ein. Stabilisieren Sie die experimentellen Periimplantitis-Modelle auf der Arbeitsplattform mit einer Klemme, um Mikrobewegungen der Implantate zu vermeiden und Mikrorisse an den Modellen zu verhindern.
- Setzen Sie die Implantate mit einem Trägerhandstück in die Schäfte ein. Lassen Sie 5 mm freiliegende Fläche auf der bukkalen Oberfläche. Stellen Sie sicher, dass die Implantate auf gleicher Höhe auf dem lingualen Knochenkamm des Modells eingetaucht sind. Vermeiden Sie es, die fleckige Implantatoberfläche zu berühren.
4. Dekontamination von Implantaten
- Beginnen Sie mit der Dekontamination der Implantate in Gruppen, ohne sie aus den experimentellen 1A- und 1B-Defektmodellen zu entfernen.
- Luftschleifsystem: Stellen Sie das Gerät mit Wasserbewässerung mit 14 μm Erythritpulver auf volle Leistung ein. Halten Sie die Spitze des Geräts 2-3 mm von der Implantatoberfläche entfernt und tragen Sie das Pulver gleichmäßig auf den freiliegenden Periimplantitis-Defekt auf. Begrenzen Sie die Arbeitszeit auf 2 min für 1A-Fehler und 3 min für 1B-Fehler.
- Ultraschallspitze aus Polyetheretherketon (PEEK): Stellen Sie das Gerät auf 8 Leistung (80 %) bei maximaler Wasserbewässerung ein. Halten Sie das PEEK-Handstück in einer Weise, die für den Einsatz mit Ultraschall geeignet ist. Führen Sie die Dekontamination auf der Implantatoberfläche mit linearen und parallelen Bewegungen durch. Bringen Sie die PEEK-Spitze so weit zwischen den Gewinden an, wie es das Design zulässt. Begrenzen Sie die Arbeitszeit auf 2 min für 1A-Fehler und 3 min für 1B-Fehler.
- Titanküretten: Bringen Sie aufeinanderfolgende Kontakte mit konstantem Druck bei 60°-90° auf die Implantatoberfläche mit einer Kraft von ca. 0,75 N auf die freiliegende Implantatoberfläche für 2 min für 1A-Defekte und 3 min für 1B-Defekte an.
- Entfernen Sie das Implantat nach der Dekontamination mit dem Treiberstück ohne Handkontakt. Wenn sich die Modelle nach der Dekontamination verformen, fahren Sie mit den Sicherungsmodellen fort. Stabilisieren Sie die experimentellen Periimplantitis-Modelle mit einer Klemme auf der Arbeitsplattform.
HINWEIS: Alle Methoden sollten von einem einzigen Forscher kalibriert und angewendet werden.
5. Fotografische Bildgebung
- Entfernen Sie die Implantate mit einem kompatiblen Implantattreiberstück aus dem Modell. Trocknen Sie die Implantate 20 s lang an der Luft, um gelöste Partikel/Reste auf der Oberfläche zu entfernen.
- Platzieren Sie die Implantate auf speziell angefertigten Acryl-Fotomodellen, um flache Ansichten, 30° apikale Ansichten und 30° koronale Ansichten aufzunehmen, um die apikalen und koronalen Teile der Fäden auf der Implantatoberfläche zu bewerten.
- Stellen Sie die Kamera auf ein Stativ und standardisieren Sie die Kameraeinstellungen (Abstand 15 cm, ISO 160, Blende f/16, Belichtungszeit 1/250 s). Stellen Sie sicher, dass der Raum ausreichend beleuchtet ist. Es ist notwendig, die Kamera mit einem Stativ zu stabilisieren.
- Nehmen Sie die digitalen Fotos im RAW-Format mit einem Blitz auf. Erhalten Sie insgesamt 90 bukkale Fotos (ein flaches, ein 30°-apikales und ein 30°-koronales Foto für jede Implantatoberfläche) für Klasse-1A-Defekte und 270 Fotos (flach, 30° apikal und 30°-koronal von jeder bukkalen, mesialen und distalen Oberfläche für jedes Implantat) für Defekte der Klasse 1B. Legen Sie alle digitalen Fotodateien zur weiteren Bildanalyse auf einer Festplatte ab.
6. Bildanalyse
- Führen Sie alle Analysen mit digitaler Bildsoftware (ImageJ) durch. Machen Sie vor der Analyse den Hintergrund der Fotos mit einem Photoshop-Programm (Photoroom) schwarz, um sicherzustellen, dass nur das Implantat auf dem Bild sichtbar ist. Öffnen Sie die Anwendung und fügen Sie jedes Bild aus der Galerie hinzu. Entfernen Sie den Hintergrund aus dem Bild und wählen Sie Schwarzer Hintergrund aus den Optionen.
- Ziehen Sie das Bild per Drag & Drop auf ImageJ. Zeichnen Sie ein Quadrat in das Bild, um 5 mm koronal zum Implantat abzudecken. Klicken Sie dann auf Bild > Zuschneiden zur Standardisierung. Wiederholen Sie den gleichen Vorgang für jedes Bild.
- Konvertieren Sie die Bilder in das 8-Bit-Format, indem Sie auf Bild ˃ Typ ˃ 8-Bit klicken, und passen Sie die Schwellenwerte an, indem Sie auf Bild ˃ Anpassen ˃ Schwellenwert für Flächenberechnungen klicken.
- Berechnen Sie die gesamte Implantatoberfläche und die rote Farbrückstandsfläche, indem Sie auf Analysieren ˃ Messen ˃ Fläche klicken.
- Halten Sie den erhaltenen Pixelbereich in einer Tabellenkalkulationsdatei fest. Erstellen Sie eine separate Tabellenkalkulationsdatei, um die Rohbilddaten aufzuzeichnen.
- Um den prozentualen Anteil der roten Farbreste zu erhalten, multiplizieren Sie die rot angezeigte Fläche mit 100 und dividieren Sie sie durch die gesamte Implantatoberfläche.
7. REM-Analyse
- Lagern Sie alle Implantate bis zum Tag der Analyse in ihren sterilen Boxen.
- Vor der REM-Analyse wird nach dem Zufallsprinzip eine repräsentative Stichprobe aus jeder Behandlungsgruppe ausgewählt. Zusätzlich zu den aus jeder Gruppe ausgewählten Proben fügen Sie ein steriles Implantat hinzu und nur das Implantat ist vollständig mit Tinte bedeckt. Bereiten Sie somit insgesamt acht Implantatproben für die REM-Analyse vor.
- Sprühen Sie Stickstoffgas mit einer Gaspistole für 20 s, um vor der REM-Analyse jegliches Mikropulver auf der Implantatoberfläche zu entfernen.
HINWEIS: Aufgrund der fortschrittlichen Technologie des Geräts wurde keine zusätzliche Goldbeschichtung aufgebracht. - Montieren Sie jedes Implantat auf REM-Stummel mit leitfähigen Kohlenstoffklebescheiben so, dass die Analyse der bukkalen ebenen Oberfläche ohne Dekontamination von Hand möglich ist. Ordnen Sie sie nach Nummern an, um eine Verwechslung der Gruppen zu vermeiden.
- Wählen Sie einen Bereich aus den im Instrument platzierten Implantaten aus und nehmen Sie Bilder mit unterschiedlichen Vergrößerungen auf. Wiederholen Sie den gleichen Vorgang für verschiedene Bereiche der Implantatoberflächen (mesial oder distal). Verwenden Sie eine 100-fache, 1000-fache und 5000-fache Vergrößerung für Bilder mit einem REM-Gerät, das bei 10-30 kV mit einem durchschnittlichen Arbeitsabstand von 12 mm betrieben wird.
HINWEIS: Für jedes Implantat wurden der zweite Mikrostrang aus dem Kragenbereich und der zweite Makrostrang aus dem Körper ausgewählt, um eine Standardisierung während der REM-Analyse zu gewährleisten. Für einige Bilder wird empfohlen, während der Bildgebung eine Elementaranalyse (EDS) durchzuführen, um sie zu vergleichen.

Abbildung 2: Flussdiagramm der Studie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
8. Statistische Auswertung
- Drückt kategoriale Variablen als Zahlen und Prozentsätze und stetige Variablen als Mittelwert und Standardabweichung aus. Bestätigen Sie die Normalverteilung für stetige Variablen mit dem Shapiro-Wilk-Test.
- Für den Vergleich kontinuierlicher Variablen zwischen Fehlergruppen verwenden Sie den Student's t-Test. Für den Vergleich von mehr als zwei Gruppen verwenden Sie die unidirektionale ANOVA oder den Kruskal-Wallis-Test, je nachdem, ob die statistischen Hypothesen erfüllt wurden oder nicht.
- Für normalverteilte Daten, die sich auf die Homogenität der Varianzen beziehen, verwenden Sie Tukey-Tests für Mehrfachvergleiche von Gruppen. Verwenden Sie für nicht normalverteilte Daten den Bonferroni-angepassten Mann-Whitney-U-Test für Mehrfachvergleiche von Gruppen. Alle statistischen Analysen wurden mit IBM SPSS 20 durchgeführt. Das statistische Signifikanzniveau für alle Tests wurde mit 0,05 bewertet.
Ergebnisse
Das hier beschriebene Versuchsprotokoll zur Analyse der Dekontamination von Implantatoberflächen zeigte signifikante Unterschiede zwischen den verschiedenen Behandlungsverfahren. Darüber hinaus zeigte das REM-Protokoll nach der Behandlung auch signifikante Veränderungen an den Implantatoberflächen, die in den Studiengruppen unterschiedlich stark ausgeprägt waren.
Vergleiche auf Implantatebene (Gesamtimplantatmittelwerte) nach Dekontamination
Vergleiche auf Implantatebene wurden durchgeführt, indem die allgemeinen Mittelwerte jedes Implantats verglichen wurden (die Messmittelwerte der bukkalen Oberflächen bei Defekten der Klasse 1A und die Messmittelwerte der bukkalen, mesialen und distalen Oberfläche bei Defekten der Klasse 1B). Dementsprechend wurde die effektivste Dekontamination mit AA bei 1A-Defekten (0,19 ± 0,02) erzielt (p < 0,001). Es folgten AA-1B (0,29 ± 0,04), PI-1B (0,38 ± 0,04) und PI-1A (0,43 ± 0,03). Die geringste Dekontamination wurde in den Gruppen TIT-1A (0,53 ± 0,03) und TIT-1B (0,56 ± 0,03) festgestellt. Während es keinen signifikanten Unterschied zwischen den Titankürettengruppen (1A-1B) gab, sind paarweise Vergleiche aller anderen Gruppen statistisch signifikant (p < 0,001; Tabelle 1; Abbildung 3).

Abbildung 3: Violinplot der Versuchsgruppen und der gesamten Implantatmittelwerte. Abkürzungen: AA = Air-Abrasive, PI = PEEK-Spitze, TIT = Titankürette. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Vergleiche der Implantatoberfläche nach der Dekontamination
Ähnlich wie bei Vergleichen auf Implantatebene lieferte das Luftschleifmittel (AA) statistisch gesehen die effektivste Dekontamination auf den bukkalen Oberflächen aller Proben (1A + 1B) im Vergleich zu PI und TIT (p < 0,001). Während auf bukkalen Oberflächen eine bessere Dekontamination mit PI als mit TIT erreicht wurde (p < 0,001), wurde kein Unterschied zwischen den bukkalen Gruppen TIT 1A und 1B festgestellt.
Die effektivste Dekontamination auf den mesialen Oberflächen von 1B-Defekten wurde durch AA im Vergleich zu PI und TIT erreicht, und der Unterschied zwischen allen Gruppen war statistisch signifikant (p < 0,001). Es wurde festgestellt, dass AA- und PI-Protokolle auf den distalen Oberflächen von 1B-Defekten ähnlich wirksam waren (p ˃ 0,05), und beide Gruppen erwiesen sich als wirksamer als die TIT-Gruppe (p < 0,001; Tabelle 1).
Vergleiche auf der Ebene des Behandlungsprotokolls nach der Dekontamination
Unabhängig von den Defektgruppen zeigten die Vergleiche der Behandlungsprotokolle, dass AA (0,24 ± 0,06) statistisch signifikant wirksamer bei der Dekontamination der Implantatoberfläche war als PI und TIT (p < 0,001). Darüber hinaus waren PI-Messungen (0,41 ± 0,04) statistisch besser als TIT (0,55 ± 0,03; p < 0,001; Tabelle 1).
Vergleiche der Fehlerstufen nach der Dekontamination
Unabhängig von den Behandlungsprotokollen zeigten die Defekttyp-Vergleiche, dass die Periimplantitis-Defekttypen der Klassen 1A und 1B zu einer ähnlichen Dekontaminationseffizienz führten (p ˃ 0,388). Auf der anderen Seite wurde bei Defekten der Klasse 1B beobachtet, dass die Wirksamkeit der Behandlungsprotokolle auf bukkalen Oberflächen (0,34 ± 0,17) statistisch besser war als auf distalen Oberflächen (p ˃ 0,388; Tabelle 1).
Tabelle 1: Vergleich des Restfarbanteils und der Dekontaminationsergebnisse nach Behandlungsgruppen und Fehlertypen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Vergleich der fotografischen Analysewinkel nach der Dekontamination
Beim Vergleich der Messungen der Fotografien von frontal 90° (F-90°), apikal 30° (A-30°) und koronal 30° (C-30°) konnte kein Unterschied zwischen den Gruppen zwischen A-30° und C-30° festgestellt werden. Eine effektivere Dekontamination wurde in den C-30°- und F-90°-Fotoproben von bukkalen Oberflächen in der AA-Gruppe, in den A-30°- und C-30°-Fotoproben in der PI-Gruppe und in den bukkalen und mesialen F-90°-Fotoproben in der TIT-Gruppe festgestellt (Tabelle 2).
Tabelle 2: Vergleich des Resttintenanteils und der Dekontaminationsergebnisse nach Fotowinkeln. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
REM-Ergebnisse und EDS-Analyse nach der Dekontamination
Die REM-Analyse der repräsentativen Proben zeigte, dass alle Behandlungsmodalitäten die Implantatoberfläche beeinträchtigt hatten. Die AA-Behandlung verursachte unabhängig von der Defektgruppe vernachlässigbare Veränderungen sowohl der Mikrofaden- als auch der Makrofadenstrukturen in den bukkalen Stellen (Abbildung 4, Abbildung 5). Im mesialen und distalen Bereich der 1B-Defektgruppe wurden jedoch mehr Farbreste unter den Fäden gefunden als im bukkalen Bereich (Abbildung 5). Zusätzlich wurde ein Pulverpartikel an der bukkalen Mikrofadenstelle der 1B-Defektgruppe beobachtet (Abbildung 6). Die Kunststoff/Kohlenstoff-PEEK-Ultraschallspitze verursachte im Vergleich zur AA-Methode eine leichte bis mäßige Abflachung der topographischen Struktur in der bukkalen Stelle, unabhängig von der Defektgruppe. Darüber hinaus wurde in der PEEK-Gruppe ein verschwommeneres und perforierteres Erscheinungsbild beobachtet, das sich von der groben Struktur unterscheidet, insbesondere aufgrund von Farbresten, die zwischen den Mikrofäden zurückbleiben (Abbildung 4, Abbildung 5). Die PEEK-Behandlung lieferte jedoch ähnliche Ergebnisse wie AA in den mesialen und distalen Bereichen der 1B-Defektgruppe bei 1000- und 5000-facher Vergrößerung (Abbildung 5). Darüber hinaus wurden in der PEEK-Gruppe keine Fremdkörper gefunden. Auf der anderen Seite verursachten Titanküretten im Vergleich zu anderen Verfahren umfangreiche Veränderungen an der Oberfläche. In der 1A-Defektgruppe konnte die raue Struktur in der Mikrofadenstruktur im bukkalen Bereich aufgrund einer schlechten Dekontamination nicht unterschieden werden (Abbildung 4). An anderen Stellen wurden Abflachungen und Längs-/Horizontalkratzer festgestellt (Abbildung 4, Abbildung 5). In den mesialen und distalen Stellen der 1B-Defektgruppe verschwand die raue Struktur und die Anzahl der Kratzer nahm zu (Abbildung 5). Zusätzlich wurde eine Elementaranalyse (EDS) des sterilen Referenzimplantats durchgeführt, die einen Titangehalt von 99,2 % ergab (Abbildung 7). Elementaranalysen wurden auch an den bemerkenswerten Strukturen (Schwarze Löcher) in anderen Gruppen und der vollständig mit Tinte bedeckten, unbehandelten Implantatoberfläche durchgeführt, die in diesen Bereichen ein kohlenstoffdominantes Ergebnis zeigten, vermutlich aufgrund der Verdampfung der Tinte (Abbildung 8 A-C).

Abbildung 4: REM-Bilder von Implantatproben der Defektgruppe der Klasse 1A. (A) Bilder mit 100-facher, 1000-facher, 5000-facher Vergrößerung des Mikrofadens des bukkalen 1A-Defekts. (B) Bilder mit 100-facher, 1000-facher, 5000-facher Vergrößerung des Makrogewindes des bukkalen 1A-Defekts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: REM-Aufnahmen von Implantatproben der Defektgruppe der Klasse 1B. (A) Bilder bei 100-facher, 1000-facher, 5000-facher Vergrößerung des Mikrogewindes des bukkalen Defekts 1B. (B) Bilder mit 100-facher, 1000-facher und 5000-facher Vergrößerung des Makrogewindes des bukkalen 1B-Defekts. (C) Bilder mit 100-facher, 1000-facher, 5000-facher Vergrößerung der mesialen Stelle des 1B-Defekts. (D) Bilder mit 100-facher, 1000-facher, 5000-facher Vergrößerung der distalen Stelle des 1B-Defekts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Bild des Erythritol-Pulverpartikels, das an der Stelle des Implantatkragens erkannt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
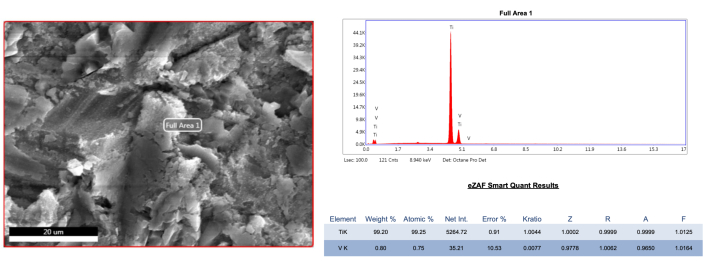
Abbildung 7: EDS-Analyse einer sterilen und unbehandelten Referenzimplantatprobe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: EDS-Analyse. (A) EDS-Analyse einer tintenbeschichteten, unbehandelten Implantatprobe. (B) EDS-Analyse der Implantatprobe aus der PEEK-Gruppe (Gruppe 4). (C) EDS-Analyse der Implantatprobe aus der Titankürette. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Methodik der In-vitro-Oberflächenanalyse von Zahnimplantaten, die von periimplantären Erkrankungen betroffen sind, war schon immer eine Herausforderung aufgrund der entzündlichen und bakteriellen Natur der pathogenen Mechanismen, die auf den rauen Oberflächen des Implantats auftreten. Zu den Bedenken gehören die Wahl des Probenmaterials, die Nachahmung des Biofilms auf der Oberfläche, die Wahl des Periimplantitis-Defekttyps, die Darstellung der klinischen Bedingungen während der In-vitro-Verfahren, Variationen der Dekontaminationsverfahren und die Methoden zur Bestimmung des Dekontaminationsumfangs und der Auswirkungen der Verfahren auf die Rauheit der Implantatoberfläche. Jede Implantatmarke hat einzigartige Oberflächeneigenschaften, wie z. B. die Metallart (Titan, Zirkonium), die Oberflächenrauheit, die freie Oberflächenenergie, die Benetzbarkeit, die Gewindetiefe, -breite und -längen, die sich alle direkt auf die Wirksamkeit von Dekontaminationsprotokollen auswirken. Um diese Bedenken auszuräumen, wurden in einigen Studien verfärbte oder kontaminierte Bandscheiben anstelle von Implantaten verwendet. Die Fähigkeit, bakteriellen Biofilm von einer flachen Oberfläche (Scheibe) im Vergleich zu einem schraubenartigen Merkmal (Implantat) zu entfernen, würde jedoch nicht die tatsächliche klinische Situation darstellen16,20. Obwohl die Dekontaminationswirksamkeit verschiedener Implantatmarken in der Literatur evaluiert wurde21, wurden in der aktuellen Studie Implantate mit Standard- und High-End-Eigenschaften verwendet.
Das in dieser Studie verwendete Modell mit permanenter Tinte ist die gebräuchlichste Methode zur Nachahmung von Biofilm auf den Implantaten 13,14,15,16,17,19,22. Die Verwendung von Tinte kann jedoch eine Verzerrung darstellen, da sie für den Bediener leicht sichtbar ist, was den klinischen Bedingungen widerspricht. Darüber hinaus haftet dieser simulierte Biofilm nicht auf die gleiche Weise wie natürliche Biofilme an der Implantatoberfläche und ist nicht verkalkt, was das physische Debridement einfacher macht als in realen klinischen Umgebungen. Die Beschichtung der Implantatoberfläche mit künstlichem Zahnstein23 kann hierfür eine Lösung sein, aber das Erreichen einer gleichmäßigen und gleichmäßigen Zahnsteindicke kann immer noch eine Einschränkung darstellen. In mehreren Studien wurde eine direkte lebensfähige parodontale pathogene Bakterien in vivo24 oder in vitro25 Kontamination der Titanoberfläche verwendet. Da es sich bei der Periimplantitis um eine komplexe multibakterielle Erkrankung handelt, kann die Verwendung von Monobakterien-Biofilmen oder Multibakterien-Biofilmen auf der Oberfläche die Ergebnisse von Dekontaminationsverfahren beeinflussen26. Darüber hinaus kann sich die Affinität von Bakterien, sich an verschiedene Implantatoberflächenmaterialien (Zirkonoxid, Titan) anzuheften, aufgrund der Oberflächenrauheit und der freien Oberflächenenergie unterscheiden26. Innerhalb dieser Grenzen bietet die Farbfärbemethode mehrere Vorteile, wie z. B. die direkte digitale Messung der Farbreste und die Möglichkeit, quantitative Vergleiche zwischen den Dekontaminationsmethoden zu ermöglichen.
Es wurde berichtet, dass die Art der Periimplantitis, der Defekttyp und das Vorhandensein von Defektwänden die Wirkung der mechanischen Debridement-Protokolle beeinflussen 15,18,27. Suprakrestale oder umlaufende Defekte mit verschiedenen Angulationen wurden in früheren in vitro Studien verwendet15,28. Das Hauptproblem bei diesen Defektmodellen besteht darin, dass der Zugang zur Implantatoberfläche während der Instrumentierung in allen Bereichen gleich ist; Dies spiegelt jedoch nicht die klinischen Mängel wider. In der aktuellen Studie wurden intraossäre Defekteder Klassen 1A und 1B 18 verwendet, die die häufigste Art von Periimplantitis-Defekten darstellen. Darüber hinaus wurden in der aktuellen Studie chirurgische Settings simuliert, wie sie von der EFP-Leitlinie5 empfohlen werden, bei denen klinisch die prothetische Suprakonstruktion entfernt und mukoperiostale Lappen angehoben werden, um die Periimplantitis-Defekte direkt sehen zu können.
Der Erfolg von Dekontaminationsprotokollen für die Implantatoberfläche hängt davon ab, ob sie Zugang zu den rauen Innenflächen der Implantatgewinde haben. Bisher wurden mehrere Dekontaminationsmethoden mit unterschiedlichem Erfolg untersucht. Unter diesen haben sich Luftschleifsysteme, Titanbürsten und Küretten als die wirksamsten Behandlungsprotokolle erwiesen8. Alle diese Behandlungen führen jedoch zu Veränderungen der Oberflächenrauheit des Implantats, wie z. B. Änderungen der Textur und der Dicke der Oxidschicht. Diese mikrotopographischen Veränderungen können schließlich negative klinische Auswirkungen haben. Daher muss die optimale Dekontaminationsmethode für Implantatoberflächen noch festgelegt werden. Obwohl ein direkter Vergleich der aktuellen Ergebnisse mit früheren Studien aufgrund der spezifischen Defekttyp- und Kiefermodellsimulation nicht möglich ist, können Ähnlichkeiten in der intraossären Komponente festgestellt werden. Die Ergebnisse der aktuellen Studie stimmen mit der Literatur überein und deuten darauf hin, dass AA auf bukkalen Oberflächen wirksamer ist, wo es senkrecht in einem 90°-Winkel zur Implantatoberfläche angewendet wird, während seine Wirksamkeit auf mesialen und distalen Oberflächen abnimmt, wo die intraossäre Komponente eine abgewinkelte Anwendung erfordert 14,16,17,29. Darüber hinaus kann dies durch den von Petersilka im Jahr 201130 beschriebenen Querpralleffekt erklärt werden, der auftritt, wenn AA, das nach dem Prinzip von unter Druck stehendem Pulver und Wasser arbeitet, auf Oberflächen aufgetragen wird.
Die Wirksamkeit des bei AA-Verfahren verwendeten Pulvertyps wurde in vielen Studien untersucht. Während Glycin bisher das am häufigsten verwendete Pulver in der klinischen und In-vitro-Forschung ist, umfassen andere Arten Natriumbicarbonat, Calciumbicarbonat, Tricalciumphosphat und Erythrit7. Es wurde jedoch beobachtet, dass Pulver mit größeren Partikelgrößen zwar eine effektivere Dekontamination auf der Implantatoberfläche bieten, aber auch mehr Oberflächenveränderungen wie makrostrukturelle Veränderungen und vermehrte Kratzer verursachen 13,31. Eine kürzlich durchgeführte In-vitro-Studie von Pujarern et al.9 zeigte keinen Unterschied in der Wirksamkeit der Biofilm-Dekontamination zwischen Erythrit und Natriumbicarbonat-Pulvern auf Implantatoberflächen. Darüber hinaus wurde berichtet, dass sich kleinere Partikel leichter im Luft-Wasser-Gemisch lösen, wodurch das Risiko einer Oberflächenbeschädigung verringert und das Eindringen in enge Fadenräume im Vergleich zu größeren Partikeln erleichtertwird 13. Trotz der Vorteile von Luftschleifsystemen, wie z. B. der effektiven Methode zur Entfernung von Biofilmen von Implantatoberflächen, die minimale Oberflächenschäden verursacht, das Weichteiltrauma reduziert und die postoperative Morbidität des Patienten gering ist, sollten bestimmte Einschränkungen beachtet werden. Dazu gehören Herausforderungen bei der Entfernung von verkalkten Ablagerungen oder gut anhaftenden Bakterienansammlungen32, Schwierigkeiten beim Erreichen geeigneter Winkel im hinteren und lingualen/palatinalen Bereich und das Risiko eines subkutanen Emphysems aufgrund von Druckluft während des Eingriffs33. Daher sind weitere Nachweise erforderlich, um den routinemäßigen Einsatz von Luftstrahlsystemenzu unterstützen 5.
In Situationen, in denen luftabrasive Pulversysteme nicht verwendet werden können, können Alternativen wie Titanbürsten, Metallküretten oder Ultraschallspitzen als Zusatzbehandlung bevorzugt oder erforderlich sein21. Metallische Instrumente, die für die mechanische Dekontamination verwendet werden, können jedoch eine rauere Oberfläche erzeugen, indem sie die Titanoberfläche zerkratzen, was möglicherweise die mikrobielle Adhäsion und die Ansammlung von Plaque fördert. Daher sollten Alternativen wie Teflon, Kunststoff und PEEK-beschichtete Instrumente verwendet und weiter untersucht werden. In der aktuellen Studie wurde die Wirksamkeit einer neu entwickelten Ultraschall-PEEK/Carbon-Spitze, die speziell für Implantatoberflächen entwickelt wurde, evaluiert. In jüngsten Studien, die mit unserer Methodik übereinstimmen, erzielten Schall- und Ultraschall-PEEK-Kunststoffspitzen sowie luftabrasive Pulversysteme die besten Ergebnisse auf verschiedenen Implantatoberflächen12,34. Die in der aktuellen Studie verwendete PI MAX-Spitze unterscheidet sich von der bisherigen PEEK-Spitze des Herstellers dadurch, dass sie 30 % Carbon enthält und ein dünneres, flexibleres Design aufweist. Die begrenzten Daten, die zu diesem neuen Design verfügbar sind, unterstreichen, wie wichtig es ist, es mit den beiden am häufigsten untersuchten Methoden (Luftabrieb und Titanküretten) in der aktuellen Studie zu vergleichen.
Metallische Küretten, die heute weit verbreitet sind und als Goldstandard für mechanisches Debridement bei Parodontalbehandlungen gelten, werden auch häufig um Zahnimplantate herum verwendet. Viele Hersteller haben Titanküretten entwickelt, die speziell entwickelt wurden, um Biofilm und andere Rückstände zu entfernen, ohne die Implantatoberfläche zu beschädigen35. In-vitro-Simulationen haben ergeben, dass wiederholte mechanische Instrumentierung nicht zu kumulativen Veränderungen der Oberflächenrauheit des Implantats führt36. In bestimmten Fällen können Titanküretten jedoch nur eine begrenzte Wirksamkeit bei der Entfernung von verhärteten oder mineralisierten Ablagerungen haben. Darüber hinaus kann die Reinigung mit manuellen Titanküretten zeitaufwändig sein und je nach Kenntnisstand des Bedieners variieren37. Basierend auf der aktuellen Evidenz ist es aufgrund der hohen Heterogenität der mikro- und makroskopischen Implantatdesigns schwierig, die Ergebnisse dieser Studien in die klinische Praxis zu übertragen.
Die zunehmende Prävalenz periimplantärer Erkrankungen aufgrund der hohen Anzahl eingesetzter Zahnimplantate erfordert einen vorhersehbaren Ansatz, der durch evidenzbasierte Daten zur Behandlung kontaminierter Oberflächen unterstützt wird. Bei Dekontaminationsmethoden sollte berücksichtigt werden, dass die am häufigsten verwendeten Implantatoberflächen einen hohen Grad an Rauheit aufweisen, der die Osseointegration fördert, und dass die Quantifizierung und anschließende Eliminierung des bakteriellen Biofilms standardisiert werden sollte, ohne dass es zu signifikanten Oberflächenschäden kommt8. Die gebräuchlichsten In-vitro-Methoden zur Bewertung der Nanotopographie der Dentalmaterialien und der Rauheit von Implantatoberflächen sind die mechanische und 3D-optische (berührende und berührungslose) Profilometrie für die quantitative Analyse und die Rasterelektronenmikroskopie (REM) für die qualitative Bewertung 12,38,40. Die Komplexität der Messung und Erforschung der Oberflächenrauheit von Implantaten ist auf das Vorhandensein von Hohlräumen und Unvollkommenheiten ohne genau sichtbares Muster zurückzuführen41.
Die REM-Befunde der aktuellen Studie stimmten mit früheren Befunden überein, dass die AA-Behandlung leichte Oberflächenveränderungen verursachte17,31, während bei Titanküretten eine signifikante Abflachung der Oberflächentopographie beobachtet wurde23. REM bietet einen Dynamikbereich mit einem größeren Sichtfeld mit größerer Schärfentiefe und größerer Vergrößerung. Die Oberflächendetails, wie topografische Textur und Materialkontrast, können bis zu einer Auflösung im Nanometerbereich ausgewertet werden. Das REM ist jedoch keine eigenständige quantitative Technik, und zuverlässigere Daten können gewonnen werden, wenn es mit anderen quantitativen Techniken kombiniert wird, von denen die Profilometrie die gebräuchlichste Methode ist. In jüngster Zeit werden die 3D-Stereophotogrammetrie42 und die innovative KI-basierte Bildanalysesoftware43 für direkte quantitative REM-Messungen eingesetzt.
Zusammenfassend lässt sich sagen, dass die Ergebnisse innerhalb der Grenzen darauf hindeuten, dass die Wahl der Dekontaminationsmethode für klinische Anwendungen auf der Grundlage des Endziels der Periimplantitis-Behandlung bestimmt werden sollte. Während das luftabrasive Erythritol-Pulversystem bei regenerativen Therapien eine schonendere Option für die Implantatoberfläche zu sein scheint und eine effektivere Zugänglichkeit und Dekontamination bietet, können Titanküretten, die die Oberfläche abflachen, für das Debridement von periimplantären Weichteilgranulationen und bei resektiven Therapien empfohlen werden, bei denen die Implantatoberfläche der oralen Umgebung ausgesetzt bleibt. Ultraschall-PEEK-Spitzen werden auch für die Entfernung von verkalkten Ablagerungen auf Implantatgewindekämmen und glatten transmukösen Oberflächen empfohlen. Die kombinierte Anwendung der verfügbaren Dekontaminationsmethoden und nicht ihre isolierte Anwendung kann den effektivsten Ansatz darstellen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die in der Studie verwendeten Implantate wurden von Dentsply Sirona unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Referenzen
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten