Method Article
种植体周围炎治疗中使用的机械方法对种植体表面去污和粗糙度的影响
摘要
本方案描述了一种基于墨水染色的实验模型,该模型可用于 体外 植入物表面净化和粗糙度研究,以促进临床决策。
摘要
已经提出了各种机械方法来净化牙科植入物表面,但成功率各不相同。这项 体外 研究使用扫描电子显微镜 (SEM) 评估了使用赤藓糖醇粉末、聚醚醚酮 (PEEK) 超声尖端和钛刮擦 (TIT) 的空气磨损 (AA) 系统的净化效率及其对植入物表面形貌的影响。总共 60 个种植体用永久性红色墨水染色,并放置在 3D 打印的 1A 类和 1B 类种植体周围炎缺损中,根据缺损类型和治疗方案形成六组 (每组 n=10)。此外,还使用了 1 例阳性和 1 例阴性对照植入物。赤藓糖醇粉末、PEEK 超声尖端和钛刮刀在 1A 类缺陷中应用 2 分钟,在 1B 类缺陷中应用 3 分钟。使用数字软件量化残留的红色墨水区域,并使用 SEM 和 EDS 分析种植体表面变化。没有一种方法能实现完全净化。然而,赤藓糖醇粉末显然是最有效的,残留墨水率为 24% ± 6% (p < 0.001)。PEEK 超声波尖端导致 41% ± 4% 的残留墨水,而钛刮匙留下 55% ± 3%。在所有方法之间观察到显著差异。在 1A 类和 1B 类缺陷之间未发现净化效果的显著差异。SEM 分析显示赤藓糖醇粉末和 PEEK 尖端的表面损伤最小,而钛刮刀会造成中度至重度损伤。基于去污效率和表面保护,赤藓糖醇粉末和 PEEK 尖端是种植体周围炎治疗的安全有效选择,而钛刮擦效果较差,会造成相当大的表面损伤。这些发现可能有助于临床医生制定种植体周围炎的治疗计划。
引言
种植牙治疗是全球最常见和首选的替换缺失牙齿的方案。长期随访研究表明,使用种植体支持的修复体治疗完全或部分无牙颌可提供可预测的结果和高生存成功率。然而,在手术放置和修复植入物1 后可能会出现影响硬组织和软组织的各种并发症。2017 年,牙周和种植体周围疾病和病症分类世界研讨会引入了影响种植体周围组织的疾病的定义和鉴别诊断2。根据这一定义,种植体周围炎是一种不可逆的病理状况,其特征是炎症的临床体征,包括探诊和/或化脓出血、探诊深度增加和/或种植体周围粘膜粘膜边缘退缩,以及支撑骨的影像学丢失2。种植体周围疾病的病因是多因素的,有些人比其他人更容易患上这种疾病。个体的特定易感性可能会增加种植体周围疾病发展的风险,这可能导致种植体损失。在种植体周围疾病病因中起作用的其他因素是患者相关因素(吸烟、全身性疾病、牙周病史、口腔卫生);角化粘膜的状况,植入部位骨骼和软组织的数量和质量;对植入物和周围组织的力;植入物植入过程中遇到的并发症;以及进行外科和修复治疗的医生的经验和技能2.此外,最近还引入了一种新的风险评估和治疗概念,即种植体疾病风险评估工具 (IDRA)3。该工具被开发为一个功能图,由八个参数组成,每个参数都与种植体周围炎有记录的关联。八边形的向量是牙周炎病史、探诊出血 (BoP) 的种植体和牙齿部位的百分比、探诊袋深度≥ 5 毫米的牙齿/种植体数量、牙周骨丢失率(与患者年龄相关的 X 光片)、牙周炎的易感性、支持性牙周治疗 (SPT) 的频率和修复体的设计。
最近的系统评价表明,患者层面种植体周围炎的患病率为 19.53%,种植体层面为 12.53%3。全球每年放置的种植体大约超过 500 万例,市场规模超过 40 亿美元,种植体周围炎是人口的主要健康问题。如果不及时治疗,种植体周围炎会导致受影响的种植体和种植体支撑的修复体丢失,给牙医和患者带来巨大的痛苦。
种植体周围疾病的治疗可分为非手术和手术两种方法。尽管对终点治疗牙周炎的成功有合理的预期4,但治疗种植体周围炎的可比证据仍然很少。因此,种植体周围炎的分期方法和非手术治疗的基本原理是在增加治疗侵袭性之前尝试用相对简单的方法控制生物膜和炎症,并在实现更好的生物膜和危险因素控制时进行手术步骤。这包括 OH 指导和动机、风险因素控制、生物膜保留因子的控制以及修复体清洁/移除/修改,包括修复体组件、边缘上和边缘下器械的评估,以及需要时伴随的牙周治疗。因此,非手术治疗应始终是第一步5.对于早期种植体周围炎,减少危险因素和非手术治疗可能就足够了,但在骨质流失后完全去除深袋中的生物膜通常具有挑战性。在非手术治疗后的重新评估阶段,持续的牙周袋深度 (≥ 6 mm) 和探诊出血 (BoP) 表明种植体周围炎的潜在进展。如果存在这些体征,建议进行手术干预6.种植体周围炎的手术治疗包括 (i) 开放皮瓣清创术,(ii) 切除皮瓣手术,(iii) 使用重建方法管理种植体周围骨缺损,(iv) 种植体表面去污的其他方法和 (v) 辅助使用局部/全身抗生素7.
种植体周围炎的主要病因是定植在种植体表面的致病性生物膜6。去除这种生物膜是所有处理方案的主要原则和目标,涉及机械、化学和激光净化方法7。
机械清创术采用塑料、碳和钛刮擦、带有塑料和金属尖端的超声波设备、钛刷和带有各种粉末的空气研磨 (AA) 系统。虽然很难完全消除生物膜,但这些疗法提供了临床益处。各种临床干预措施,包括有或没有防腐剂8 、抗生素9 以及切除和再生手术10 的机械清创方案,已经取得了不同程度的临床成功。然而,它们也会诱导植入物表面的化学和物理特性发生变化,从而可能使新骨形成和骨再结合复杂化。
在机械方法中,使用不同粉末成分的 AA 程序显示出最佳的清洁效果 11,12,13。然而,残留颗粒的存在会改变表面形貌并降低生物相容性14。甘氨酸,其次是碳酸氢钠,是 AA 系统中最常用的粉末8。最近,赤藓糖醇 (14 μm) 等较小的空气研磨颗粒因其有效净化和减少表面损伤而受到关注9。钛和塑料刮礼造成的表面损伤比钢制刮刀小,可有效去除生物膜15。由聚醚醚酮 (PEEK) 制成的超声波洁牙机针头还可以减少细菌负荷,同时将表面损伤降至最低10。去污方法必须考虑植入物表面的高粗糙度,并旨在去除细菌生物膜而不会造成明显的表面损伤。尽管已经进行了广泛的体外、体内和临床研究,但迄今为止仍未就种植体周围炎的治疗达成共识和金标准方案。由于许多种植牙导致种植体周围疾病的患病率不断增加,因此需要一种基于证据的、可预测的方法来治疗受污染的表面。本研究旨在评估不同去污方法(空气研磨 (AA) 系统、PEEK 超声尖端和钛刮刮子)对植入物表面去污的有效性,并通过 SEM 分析评估它们对植入物表面粗糙度的影响。
研究方案
该研究方案得到了土耳其安塔利亚阿克德尼兹大学伦理委员会 (TBAEK-363) 的批准。这项研究得到了阿克登尼兹大学研究基金(项目编号:TDH-2024-6676)的支持。该研究使用了尺寸为 4.2 mm x 11 mm 的螺钉形牙科植入物(PrimeTaper EV Implant),在衣领上采用 1.7 mm 的微螺纹设计。通过喷砂和稀氢氟酸进行表面处理,以获得明确的 OsseoSpeed 表面。
1. 实验性种植体周围炎模型的制备
注:三种去污机械处理方法(空气研磨剂 (AA)、聚醚醚酮 (PEEK) 超声波和钛刮刀; 材料表)在两种不同的种植体周围炎缺损类型11 (1A 类和 1B 类) 中进行了分析。因此,有六个实验组(图 1)。共使用了 62 个植入物,包括 1 个阳性和 1 个阴性对照植入物。这种 体外 研究设计最初由 Sharhmann 等人 16 开发,已在文献中被各种研究人员修改12、13、14、15、16、17、18 (图 2)。假设组间生物膜去除功效相差 10%,则样本量确定为 60(每组 10),6 组具有 G*功效,效应量为 0.50,I 型误差为 5%,功效为 80%。

图 1:实验组流程图。 请单击此处查看此图的较大版本。
- 从教育下颌体模模型中取出一颗第一磨牙。塑料齿用螺丝固定在这个虚拟模型上。拧下第一颗磨牙,从牙槽中取出螺纹。通过模制柔软的硅胶材料来填充接受腔以覆盖接受腔,以形成平坦的牙槽嵴。
注意:已创建放置在无牙颌区域的植入物的模拟。 - 在实验室扫描仪中扫描准备好的模型以创建数字设计。
- 以数字方式创建 3D 1A 类和 1B 类11 种植体周围炎骨缺损。打开 Exocad 软件程序。上传扫描的模型文件。然后单击 Design 并选择 Expert Mode。使用 Edit Mesh 选项删除不规则区域。然后右键单击并选择 将扫描另存为文件 在计算机上的相关文件夹上。
- 选择 工具 > 添加/删除网格 选项,选择 蜡扫描> 上传文件,然后选择刚刚保存在文件夹中的文件。之后,单击 向导模式 在右侧。
- 在生成的新 STL 模型中,在牙槽中创建缺陷仿真。为此,请单击 添加/删除 在左侧。选择 Oval Shape Brush Size(椭圆形画笔大小)。然后,同时使用 Shift 和 Left click 在模型上创建缺陷。对于 1A 类缺陷,将植入物颊面的缺损长度调整为 5 毫米,将宽度调整为 4.2 毫米(对应于植入物的直径),对于 1B 类缺损,调整为 5-5-5 毫米。
- 要缩小缺损的水平宽度,请单击左侧的 Anatomy(解剖)并选择 Cusp(尖点),然后向内缩小缺损的前庭宽度。然后,右键单击并将场景另存为文件。
- 要创建最终模型,请重新启动程序并重新加载保存的文件夹。然后选择右侧的 Wizard Mode and Model Alignment 选项。选择模型类型作为左侧的 Digital Waxup Model(数字蜡像模型 )。单击 Next 几次,直到到达左侧的 Model design 部分。选择 Full Model 选项,然后单击 Next 两次。模型文件完成后,使用 Explorer 打开它,然后就可以打印了。
- 将设计模型的 STL 文件转发到 3D 打印机。使用 Model Resin 打印创建的数字模型。
- 用 96% 乙醇冲洗实验模型 5-10 分钟。清洁过程结束后,将模型放入发光固化装置中,并按照制造商的说明以剂量设置用光固化 5 分钟。
注意:使用具有高拉伸、弯曲和压缩强度且适合植入物钻孔的树脂模型。根据制造商的说明,用含酒精的溶液清洁打印的模型,并确保其经过充分的光固化。
2. 植入物染色
- 将测试植入物浸入粘性防水红色墨水中。确保植入物表面的所有部分都完全均匀地被墨水覆盖 15 秒。使用驾驶员手机或印模柱从无菌容器中取出植入物,不要用手接触。
注意:这种染色将模拟用于照相分析的光学可见生物膜替代物。 - 用牙科综合治疗装置空气注射器风干染色的种植体,以便使墨水均匀分散。在室温下进一步干燥染色的植入物 24 小时。与手机隔离干燥植入物,不要用手接触。
3. 染色植入物的放置
- 按如下方式调整牙科理疗分配器的设置:800 rpm,40 N 扭矩,无盐水冲洗。
- 在实验模型上使用外科植入物钻头创建种植体接受腔,以放置 11 毫米长和 4.2 毫米宽的植入物。为具有两种类型缺陷的模型(1A 类和 1B 类缺陷模型)准备相同的种植体接受腔。
- 根据制造商的说明依次使用种植体钻头,以实现初步稳定性。用气水注射器钻孔后清洁剩余的碎屑,然后放置植入物。用夹子将实验性种植体周围炎模型稳定在工作平台上,以避免植入物的微移动并防止模型出现微裂纹。
- 将带有载体手机的植入物插入牙槽。在颊面上留出 5 毫米的暴露区域。确保植入物浸没在模型的舌骨嵴上的同一水平。避免触摸染色的种植体表面。
4. 植入物的去污
- 开始分组对植入物进行净化,而不将它们从实验性 1A 和 1B 缺陷模型中删除。
- 空气研磨系统:用 14 μm 赤藓糖醇粉末灌溉,将设备设置为全功率。将装置的尖端保持在距种植体表面 2-3 毫米的位置,并将粉末均匀地涂抹在暴露的种植体周围炎缺损上。对于 1A 缺陷,将工作时间限制为 2 分钟,对于 1B 缺陷,将工作时间限制为 3 分钟。
- 聚醚醚酮 (PEEK) 超声波尖端:将设备设置为 8 次方 (80%),并最大灌溉水。以适合超声波使用的方式握住 PEEK 手机。通过线性和平行运动对植入物表面进行去污。在其设计允许的范围内,尽可能多地将 PEEK 尖端应用于螺纹之间。对于 1A 缺陷,将工作时间限制为 2 分钟,对于 1B 缺陷,将工作时间限制为 3 分钟。
- 钛刮擦:以 60°-90° 的恒定压力将连续接触植入物表面,在 5 mm 暴露的植入物表面上施加大约 0.75 N 的力,持续 2 分钟(对于 1A 缺陷)和 3 分钟(对于 1B 缺陷)。
- 去污后,使用螺丝刀取下植入物,不要手接触。如果模型在去污后变形,请继续备份模型。用夹子将实验性种植体周围炎模型稳定在工作平台上。
注:所有方法均应由一名研究人员校准和应用。
5. 摄影成像
- 使用兼容的植入物驱动件从模型上取下植入物。将植入物风干 20 秒,以去除表面任何松动的颗粒/残留物。
- 将植入物放在定制设计的丙烯酸摄影模型上,以拍摄平面视图、30° 根尖视图和 30° 冠状视图,以评估植入物表面螺纹的根尖和冠状部分。
- 将相机放在三脚架上并标准化相机设置(距离 15 cm、ISO 160、光圈 f/16、曝光时间 1/250 秒)。确保房间光线充足。有必要用三脚架稳定相机。
- 用闪光灯拍摄 RAW 格式的数码照片。对于 1A 类缺损,总共获得 90 张颊面照片(每个种植体表面一张平面、一张 30° 顶端和一张 30° 冠状面)和 270 张照片(每个种植体的每个颊侧、近中和远中表面的平面、30° 顶端和 30° 冠状面)对于 1B 类缺损。将所有数码照片文件存放在硬盘上,以便进一步进行图像分析。
6. 图像分析
- 在数字图像软件 (ImageJ) 上执行所有分析。在分析之前,使用 Photoshop 程序 (Photoroom) 将照片的背景设置为黑色,以确保图像中只有植入物可见。打开应用程序,然后添加图库中的每张图片。从图像中删除背景并选择 黑色背景 从选项中。
- 将图像拖放到 ImageJ 上。在图像中画一个正方形,以覆盖植入物的 5 毫米冠状面。然后点击 图像>裁剪 进行标准化。对每个图像重复相同的过程。
- 单击 图像 ✜ 类型 “ 8 位 ,将图像转换为 8 位格式,然后单击 图像 “ 调整 ”阈值 进行面积计算。
- 通过单击 “分析”˃“测量””“面积”来计算整个种植体表面积和红色残留面积。
- 将获取的像素区域记录在电子表格文件中。创建单独的电子表格文件以记录原始图像数据。
- 为了获得红色残留物的百分比,请将红色显示的面积乘以 100 并除以种植体总表面积。
7. SEM 分析
- 将所有植入物存放在无菌盒中,直到分析当天。
- 在 SEM 分析之前,从每个处理组中随机选择一个代表性样品。除了从每组中选择的样品外,还添加一个无菌植入物,并且仅添加完全被墨水覆盖的植入物。因此,总共准备八个植入物样品用于 SEM 分析。
- 使用 Gas Gun 喷洒氮气 20 秒,以便在 SEM 分析之前去除植入物表面的任何微粉。
注意:由于设备的先进技术,没有应用额外的金涂层。 - 将每个植入物安装在带有导电碳胶盘的 SEM 存根上,以便无需手部消毒即可分析颊侧平面。按编号顺序排列它们,以避免组混淆。
- 从放置在器械中的植入物中选择一个区域,并以不同的放大倍率捕获图像。对种植体表面的不同区域(近中或远中)重复相同的程序。使用在 10-30 kV 下运行且平均工作距离为 12 mm 的 SEM 设备对图像使用 100 倍、1000 倍和 5000 倍放大倍率。
注:为每个植入物选择来自衣领区域的第二条微链和来自身体的第二条大链,以确保 SEM 分析过程中的标准化。对于某些图像,建议在成像过程中进行元素分析 (EDS) 以进行比较。

图 2:研究流程图。 请单击此处查看此图的较大版本。
8. 统计分析
- 将分类变量表示为数字和百分比,将连续变量表示为平均值和标准差。使用 Shapiro-Wilk 检验确认连续变量的分布正态性。
- 要比较缺陷组之间的连续变量,请使用学生 t 检验。对于两个以上组的比较,请使用单因子方差分析或 Kruskal Wallis 检验,具体取决于统计假设是否得到满足。
- 对于正态分布的数据,关于方差的同质性,请使用 Tukey 检验进行组的多重比较。对于非正态分布的数据,使用 Bonferroni 调整的 Mann-Whitney U 检验进行组的多重比较。所有统计分析均使用 IBM SPSS 20 进行。所有检验的统计显著性水平被认为为 0.05。
结果
此处描述的用于分析植入物表面去污的实验方案揭示了各种处理程序之间的显着差异。此外,治疗后 SEM 方案也显示研究组之间植入物表面发生了不同程度的显着变化。
去污后的种植体水平比较(种植体总均值)
通过比较每个植入物的一般平均值(1A 类缺损中颊面的测量平均值和 1B 类缺损中颊侧、近中和远中表面的测量平均值)进行种植体水平的比较。因此,在 1A 缺陷 (0.19 ± 0.02) 中使用 AA 获得最有效的去污 (p < 0.001)。紧随其后的是 AA-1B (0.29 ± 0.04) 、PI-1B (0.38 ± 0.04) 和 PI-1A (0.43 ± 0.03)。在 TIT-1A (0.53 ± 0.03) 和 TIT-1B (0.56 ± 0.03) 组中检测到的去污最少。虽然钛刮擦组 (1A-1B) 之间没有显着差异,但所有其他组的成对比较具有统计学意义 (p < 0.001; 表 1; 图 3)。

图 3:实验组和总植入物均值的 Violin 图。 缩写:AA = 空气研磨,PI = PEEK 尖端,TIT = 钛刮擦。 请单击此处查看此图的较大版本。
去污后的植入物表面水平比较
与植入物水平的比较类似,与 PI 和 TIT 相比,空气磨料 (AA) 在所有样品的颊面 (1A + 1B) 上提供了最有效的净化 (p < 0.001)。虽然 PI 在颊面上的去污效果优于 TIT (p < 0.001),但在 TIT 1A 和 1B 颊组之间未检测到差异。
与 PI 和 TIT 相比,AA 对 1B 缺损近中表面的净化最有效,所有组之间的差异具有统计学意义 (p < 0.001)。发现 AA 和 PI 方案对 1B 缺损的远端表面同样有效 (p ˃ 0.05),并且观察到两组都比 TIT 组更有效 (p < 0.001; 表 1)。
去污后的处理方案水平比较
无论缺陷组如何,治疗方案比较显示,与 PI 和 TIT 相比,AA (0.24 ± 0.06) 在种植体表面去污方面的有效性在统计学上显着更高 (p < 0.001)。此外,PI 测量值 (0.41 ± 0.04) 在统计学上优于 TIT (0.55 ± 0.03;p < 0.001; 表 1)。
去污后的缺陷水平比较
无论治疗方案如何,缺损类型比较表明 1A 类和 1B 类种植体周围炎缺损类型导致相似的去污效率 (p ˃ 0.388)。另一方面,在 1B 类缺损中,观察到治疗方案的有效性在颊面 (0.34 ± 0.17) 与远端表面 (p ˃ 0.388; 表 1)。
表 1: 根据处理组和缺陷类型比较剩余油墨百分比和去污结果。 请点击此处下载此表格。
去污后照片分析角度的比较
当比较额叶 90° (F-90°) 、心尖 30° (A-30°) 和冠状面 30° (C-30°) 照片的测量值时,在 A-30° 和 C-30° 之间未检测到组间差异。AA 组颊面的 C-30° 和 F-90° 光样、PI 组的 A-30° 和 C-30° 光样以及 TIT 组的颊侧和近中 F-90° 光样中记录了更有效的去污 (表2)。
表 2: 根据照片角度比较剩余墨水百分比和去污结果。 请点击此处下载此表格。
去污后的 SEM 结果和 EDS 分析
代表性样品的 SEM 分析表明,所有治疗方式都影响了种植体表面。无论缺损组如何,AA 处理对颊侧部位微线和大线结构的改变都可忽略不计(图 4、 图 5)。然而,在 1B 缺损组的近中和远中区域,与颊侧区域相比,线下发现的墨水残留更多 (图 5)。 此外,在 1B 缺损组的颊侧微线部位观察到粉末颗粒 (图 6)。 与 AA 方法相比,塑料/碳 PEEK 超声尖端导致颊侧部位的地形结构轻度至中度变平,与缺陷组无关。此外,在 PEEK 组中,观察到与粗糙结构不同的更加模糊和穿孔的外观,特别是由于微线之间残留的墨水残留物 (图 4、 图 5)。 然而,在 1000 倍和 5000 倍放大倍率下,PEEK 治疗在 1B 缺损组的近中和远中区域产生了与 AA 相似的结果 (图 5)。 此外,在 PEEK 组中未发现异物。另一方面,与其他方法相比,钛刮擦对表面造成了广泛的改变。在 1A 缺陷组中,由于去污不良,无法在颊侧区域的微螺纹结构中区分粗糙结构 (图 4)。 在其他部位,检测到压扁和纵向/水平划痕 (图 4、 图 5)。 在 1B 缺损组的近中和远中部位,粗糙的结构消失了,划痕的数量增加了 (图 5)。 此外,对无菌参考植入物进行了元素分析 (EDS),显示钛含量为 99.2%(图 7)。还对其他组中的显着结构(黑洞)和完全被墨水覆盖的未处理植入物表面进行了元素分析,显示这些区域以碳为主的结果,可能是由于墨水的蒸发 (图 8 A-C)。

图 4:1A 类缺损组植入物样品的 SEM 图像。 (A) 1A 颊侧缺损微螺纹的 100 倍、1000 倍、5000 倍放大倍率的图像。(B) 1A 颊侧缺损宏线程的 100 倍、1000 倍、5000 倍放大倍率的图像。 请单击此处查看此图的较大版本。

图 5:1B 类缺损组种植体样本的 SEM 图像。 (A) 1B 颊侧缺损微螺纹的 100 倍、1000 倍、5000 倍放大倍率的图像。(二) 1B 颊侧缺损宏线程的 100 倍、1000 倍和 5000 倍放大倍率的图像。(三) 1B 缺损近中部位的 100 倍、1000 倍、5000 倍放大倍率的图像。(D) 1B 缺损远端部位的 100 倍、1000 倍、5000 倍放大倍率的图像。 请单击此处查看此图的较大版本。

图 6:在种植体环部位识别的赤藓糖醇粉末颗粒图像。请单击此处查看此图的较大版本。
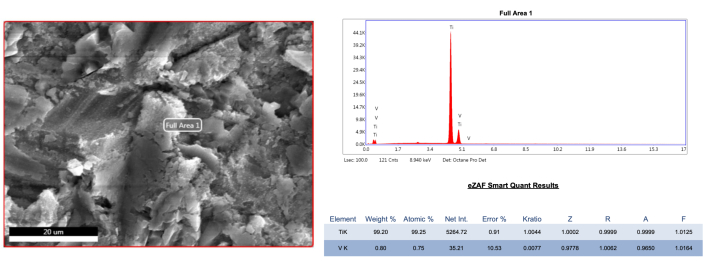
图 7:无菌和未处理的参考植入物样本的 EDS 分析。请单击此处查看此图的较大版本。

图 8:EDS 分析。 (A) 涂有墨水的未处理植入物样品的 EDS 分析。(B) PEEK 组(第 4 组)植入物样本的 EDS 分析。(C) 钛刮刀植入物样本的 EDS 分析。 请单击此处查看此图的较大版本。
讨论
由于种植体粗糙表面发生的致病机制的炎症和细菌性质,受种植体周围疾病影响的种植牙的体外表面分析方法一直具有挑战性。几个问题包括样品材料的选择、模拟表面的生物膜、选择种植体周围炎缺陷类型、代表体外手术期间的临床条件、去污程序的变化以及确定去污量的方法和程序对植入物表面粗糙度的影响。每个植入物品牌都有独特的表面特性,例如金属类型(钛、锆)、表面粗糙度特性、表面自由能、润湿性、螺纹深度、宽度和长度,所有这些都直接影响去污方案的有效性。为了克服这种担忧,一些研究使用染色或污染的椎间盘代替植入物。然而,与螺钉型特征(植入物)相比,从平面(椎间盘)去除细菌生物膜的能力不会呈现实际的临床情况16,20。尽管在文献21 中已经评估了不同植入物品牌的去污效果,但目前的研究使用了具有标准和高端特征的植入物。
本研究中使用的永久性墨水模型是模拟植入物13、14、15、16、17、19、22 上生物膜的最常用方法。然而,使用墨水可能代表偏见,因为它很容易作员看到,这与临床条件相矛盾。此外,这种模拟生物膜不会像天然生物膜那样粘附在植入物表面,也不会钙化,这使得物理清创比实际临床环境更容易。用人工结石23 涂覆植入物表面可能是一种解决方案,但实现均匀均匀的牙结石厚度可能仍然是一个限制。几项研究使用了直接活的牙周病 原菌体内24 或 体外25 污染钛表面。由于种植体周围炎是一种复杂的多细菌疾病,因此在表面使用单细菌生物膜或多细菌生物膜可能会影响净化程序的结果26。此外,由于表面粗糙度和表面自由能,细菌附着在不同植入物表面材料(氧化锆、钛)上的亲和力可能会有所不同26。在这些限制范围内,油墨染色方法具有多种优势,例如直接以数字方式测量油墨残留物,并能够在去污方法之间进行定量比较。
据报道,种植体周围炎缺损类型和缺损壁的存在会影响机械清创方案的效果 15,18,27。具有各种成角的牙槽嵴上或环状缺损已在以前的体外研究中使用15,28。这些缺陷模型的主要问题是,在器械作期间,所有区域对植入物表面的进入都是相同的;然而,这并不能反映临床缺陷。1A 类和 1B 类骨内缺损18 是最常见的种植体周围炎缺损类型,在本研究中被使用。此外,根据 EFP 指南5 的建议,在当前研究中模拟了手术设置,其中,在临床上,修复体上部结构被移除,粘骨膜瓣升高以直接观察种植体周围炎缺损。
植入物表面净化方案的成功取决于它们能够接触到植入物螺纹的粗糙内表面。迄今为止,已经研究了几种净化方法,并取得了不同程度的成功。其中,据报道,空气研磨系统、钛刷和刮擦是最有效的处理方案8。然而,所有这些处理都会引起植入物表面粗糙度的变化,例如质地和氧化层厚度的变化。这些微地形改变最终可能会产生负面的临床影响。因此,植入物表面的最佳去污方法尚待确定。尽管由于特定的缺损类型和颌骨模型模拟,无法将当前结果与以前的研究直接进行比较,但可以注意到骨内成分的相似性。当前研究的结果与文献一致,表明 AA 在颊侧表面更有效,在那里它以 90° 角垂直于植入物表面应用,而它在近中和远中表面的疗效降低,其中骨内成分需要倾斜应用14,16,17,29。此外,这可以用 Petersilka 在 201130 中描述的弹跳效应来解释,当 AA 根据加压粉末和水的原理应用于表面时,就会发生这种情况。
许多研究已经调查了 AA 手术中使用的粉末类型的有效性。虽然甘氨酸是迄今为止临床和体外研究中最常用的粉末,但其他类型包括碳酸氢钠、碳酸氢钙、磷酸三钙和赤藓糖醇7。然而,据观察,粒径较大的粉末虽然在植入物表面提供更有效的净化,但也会导致更多的表面变化,例如宏观结构改变和划痕增加 13,31。Pujarern 等人最近的一项体外研究9 显示,赤藓糖醇和碳酸氢钠粉末在植入物表面的生物膜净化功效没有差异。此外,据报道,与较大的颗粒相比,较小的颗粒更容易溶解在气-水混合物中,从而降低了表面损伤的风险,并有助于渗透到狭窄的螺纹空间中13。尽管空气研磨系统具有优点,例如是从植入物表面去除生物膜的有效方法,造成的表面损伤最小,减少软组织创伤,以及术后患者发病率低,但应注意某些局限性。这些包括清除钙化沉积物或粘附良好的细菌积累的挑战32,难以在后部和舌侧/腭区域达到适当的角度,以及手术过程中因加压空气而导致皮下肺气肿的风险33。因此,需要进一步的证据来支持空气研磨系统的常规使用5。
在无法使用空气研磨粉末系统的情况下,可能首选或需要钛刷、金属刮刀或超声波尖端等替代品作为辅助处理21。然而,用于机械去污的金属器械可能会划伤钛表面,从而产生更粗糙的表面,从而可能促进微生物粘附和牙菌斑积累。因此,应使用特氟龙、塑料和 PEEK 涂层仪器等替代品并进一步研究。在目前的研究中,评估了最近开发的专为植入物表面设计的超声波 PEEK/碳尖端的疗效。在与我们的方法一致的近期研究中,声波和超声波 PEEK 塑料尖端以及空气研磨粉末系统在不同的植入物表面上取得了最佳效果12,34。当前研究中使用的 PI MAX 针头与制造商之前的 PEEK 针头的不同之处在于,它含有 30% 的碳,并且具有更薄、更灵活的设计。这种新设计的有限可用数据凸显了将其与当前研究中研究最广泛的两种方法(空气磨损和钛刮刀)进行比较的重要性。
金属刮擦今天被广泛使用,被认为是牙周治疗中机械清创术的黄金标准,也常用于种植牙周围。许多制造商已经开发了专门设计用于去除生物膜和其他残留物而不会损坏植入物表面的钛刮刀35。 体外 模拟得出结论,重复的机械器械不会导致植入物表面粗糙度的累积变化36。然而,在某些情况下,钛刮擦在去除硬化或矿化沉积物方面的效果可能有限。此外,使用手动钛刮刀进行清洁可能很耗时,并且会有所不同,具体取决于作员的技能水平37。根据目前的证据,由于植入物微观和宏观设计的高度异质性,将这些研究的结果转化为临床实践具有挑战性。
由于放置了大量种植牙,种植体周围疾病的患病率不断增加,需要一种由循证数据支持的可预测方法来治疗受污染的表面。去污方法应考虑最常用的植入物表面表现出高度粗糙度,这促进了骨结合,并且细菌生物膜的定量和随后的消除应标准化,而不会造成明显的表面损伤8。用于评估牙科材料的纳米形貌和种植体表面粗糙度的最常见体外方法是用于定量分析的机械和 3D 光学(接触和非接触式)轮廓测量法和用于定性评估的扫描电子显微镜 (SEM) 12,38,40.测量和研究植入物表面粗糙度的复杂性是由于存在空隙和缺陷,而没有任何精确的可见图案41。
当前研究的 SEM 结果与之前的研究结果一致,即 AA 处理导致轻微的表面变化17,31,而使用钛刮刮子观察到表面形貌显着变平23。SEM 使用更大的视场、更大的景深和更大的放大倍率来提供动态范围。表面细节,如地形纹理和材料对比度,可以评估到纳米级的分辨率。然而,SEM 本身并不是一种定量技术,当它与其他定量技术结合使用时可以获得更可靠的数据,其中轮廓测量法是最常见的方法。最近,3D 立体摄影测量42 和创新的基于 AI 的图像分析软件43 已用于直接 SEM 定量测量。
总之, 在限制范围内,研究结果表明,临床应用的去污方法的选择应根据种植体周围炎治疗的最终目标来确定。因此,虽然空气研磨赤藓糖醇粉末系统似乎是再生疗法中植入物表面的更温和的选择,并提供了更有效的可及性和去污性,但可使表面变平的钛刮擦可能被推荐用于种植体周围软组织颗粒的清创和植入物表面暴露于口腔环境中的切除疗法。还建议使用超声波 PEEK 尖端去除种植体螺纹牙冠和光滑的经粘膜表面的钙化沉积物。结合使用可用的净化方法,而不是单独使用,可能是最有效的方法。
披露声明
作者没有需要披露的利益冲突。
致谢
研究中使用的植入物得到了 Dentsply Sirona 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
参考文献
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。