Method Article
Effets des méthodes mécaniques utilisées dans le traitement de la péri-implantite sur la décontamination et la rugosité de la surface de l’implant
Dans cet article
Résumé
Le présent protocole décrit un modèle expérimental basé sur la coloration à l’encre qui peut être utilisé pour la décontamination de surface d’implants in vitro et la recherche sur la rugosité afin de contribuer à la prise de décision clinique.
Résumé
Diverses méthodes mécaniques ont été proposées pour décontaminer les surfaces des implants dentaires avec plus ou moins de succès. Cette étude in vitro a évalué l’efficacité de la décontamination d’un système d’abrasion à l’air (AA) avec de la poudre d’érythritol, une pointe à ultrasons en polyéther-éther-cétone (PEEK) et des curettes en titane (TIT) et leurs effets sur la topographie de la surface de l’implant à l’aide de la microscopie électronique à balayage (MEB). Au total, 60 implants ont été colorés à l’encre rouge permanente et placés dans des défauts de péri-implantite de classe 1A et de classe 1B imprimés en 3D, formant six groupes (n = 10 par groupe) en fonction du type de défaut et du protocole de traitement. De plus, un implant de contrôle positif et un implant de contrôle négatif ont été utilisés. De la poudre d’érythritol, des pointes à ultrasons PEEK et des curettes en titane ont été appliquées pendant 2 minutes dans les défauts de classe 1A et 3 minutes dans les défauts de classe 1B. Les zones résiduelles d’encre rouge ont été quantifiées à l’aide d’un logiciel numérique, et les modifications de surface de l’implant ont été analysées à l’aide de MEB et d’EDS. Aucune des méthodes n’a permis d’obtenir une décontamination complète. Cependant, la poudre d’érythritol était significativement la plus efficace, laissant un taux d’encre résiduelle de 24 % ± 6 % (p < 0,001). Les pointes à ultrasons PEEK ont donné 41 % ± 4 % d’encre résiduelle, tandis que les curettes en titane ont laissé 55 % ± 3 %. Des différences significatives ont été observées entre toutes les méthodes. Aucune différence significative n’a été observée entre les défauts de classe 1A et de classe 1B. L’analyse MEB a montré des dommages de surface minimes avec la poudre d’érythritol et les pointes en PEEK, tandis que les curettes en titane ont causé des dommages modérés à graves. Sur la base de l’efficacité de la décontamination et de la préservation de la surface, la poudre d’érythritol et les pointes en PEEK sont des options sûres et efficaces pour le traitement de la péri-implantite, tandis que les curettes en titane sont moins efficaces et causent des dommages de surface considérables. Ces résultats peuvent aider les cliniciens dans la planification du traitement de la péri-implantite.
Introduction
Le traitement par implant dentaire est le protocole le plus courant et le plus privilégié pour remplacer les dents manquantes dans le monde. Des études de suivi à long terme ont montré que l’utilisation de restaurations implanto-portées dans le traitement de l’édentement complet ou partiel donne des résultats prévisibles et des taux de réussite élevés en termes de survie. Cependant, diverses complications affectant les tissus durs et mous peuvent survenir à la suite de la pose chirurgicale et de la restauration des implants1. En 2017, l’Atelier mondial sur la classification des maladies et affections parodontales et péri-implantaires a introduit des définitions et des diagnostics différentiels pour les maladies affectant les tissus péri-implantaires2. Selon cette définition, la péri-implantite est une affection pathologique irréversible caractérisée par des signes cliniques d’inflammation, notamment des saignements lors du sondage et/ou de la suppuration, une augmentation des profondeurs de sondage et/ou une récession de la marge muqueuse dans la muqueuse péri-implantaire et une perte radiographique de l’osde soutien 2. L’étiologie des maladies péri-implantaires est multifactorielle, et certaines personnes sont plus sensibles à cette condition que d’autres. Les prédispositions spécifiques des individus peuvent augmenter le risque de développement d’une maladie péri-implantaire, ce qui peut entraîner la perte de l’implant. D’autres facteurs qui jouent un rôle dans l’étiologie des maladies péri-implantaires sont les facteurs liés au patient (tabagisme, maladies systémiques, antécédents de maladies parodontales, hygiène buccale) ; l’état de la muqueuse kératinisée, la quantité et la qualité de l’os et des tissus mous au site d’implantation ; forces sur l’implant et les tissus environnants ; complications rencontrées lors de la pose d’implants ; et l’expérience et les compétences du médecin qui effectue des traitements chirurgicaux et prothétiques2. En outre, un nouveau concept d’évaluation des risques et de traitement a récemment été introduit, l’outil d’évaluation des risques de maladie implantaire (IDRA)3. Cet outil a été développé sous la forme d’un schéma fonctionnel composé de huit paramètres, chacun avec une association documentée avec la péri-implantite. Les vecteurs de l’octogone sont l’histoire de la parodontite, le pourcentage d’implants et de sites dentaires présentant un saignement au palpage (BoP), le nombre de dents/implants avec une profondeur de poche de sondage ≥ 5 mm, le taux de perte osseuse parodontale (radiographies par rapport à l’âge du patient), la susceptibilité à la parodontite, la fréquence du traitement parodontal de soutien (SPT) et la conception de la prothèse.
Des revues systématiques récentes ont montré que la prévalence de la péri-implantite est de 19,53 % au niveau du patient et de 12,53 % au niveaude l’implant 3. Avec environ plus de 5 millions d’implants posés chaque année dans le monde, avec une taille de marché de plus de 4 milliards USD, la péri-implantite représente un problème de santé majeur pour la population. Si elle n’est pas traitée, la péri-implantite entraîne la perte de l’implant affecté et de la prothèse sur implants, causant une grande détresse à la fois pour le dentiste et pour le patient.
Le traitement des maladies péri-implantaires peut être divisé en approches non chirurgicales et chirurgicales. Bien qu’il y ait une attente raisonnable quant au succès des critères d’évaluation dans le traitement de la parodontite4, les preuves comparables pour le traitement de la péri-implantite sont encore rares. Par conséquent, la raison d’être d’une approche par étapes et d’un traitement non chirurgical de la péri-implantite est de tenter de contrôler le biofilm et l’inflammation avec des approches relativement simples avant d’augmenter le caractère invasif du traitement et d’effectuer l’étape chirurgicale lorsqu’un meilleur contrôle du biofilm et des facteurs de risque est obtenu. Cela comprend les instructions et la motivation de la santé et de la santé, le contrôle des facteurs de risque, le contrôle des facteurs de rétention du biofilm et le nettoyage, le retrait et la modification des prothèses, y compris l’évaluation des composants de la prothèse, l’instrumentation supramarginale et submarginale et le traitement parodontal concomitant si nécessaire. Ainsi, le traitement non chirurgical doit toujours être la première étape5. Pour une péri-implantite précoce, la réduction des facteurs de risque et un traitement non chirurgical peuvent suffire, mais l’élimination complète du biofilm dans les poches profondes après une perte osseuse est souvent difficile. Au cours de la phase de réévaluation après un traitement non chirurgical, des profondeurs de poches persistantes (≥ 6 mm) et des saignements au sondage (BoP) indiquent une progression potentielle de la péri-implantite. Si ces signes sont présents, des interventions chirurgicales sont recommandées6. Le traitement chirurgical de la péri-implantite comprend (i) le débridement par lambeau ouvert, (ii) la chirurgie résécable par lambeau, (iii) la prise en charge des défauts osseux péri-implantaires à l’aide d’approches reconstructives, (iv) des méthodes supplémentaires pour la décontamination de la surface de l’implant et (v) l’utilisation d’antibiotiques locaux/systémiquesen complément 7.
Le principal facteur étiologique de la péri-implantite est le biofilm pathogène colonisé à la surface de l’implant6. L’élimination de ce biofilm est le principe fondamental et l’objectif de tous les protocoles de traitement, qui impliquent des méthodes de décontamination mécaniques, chimiques et laser7.
Le débridement mécanique utilise des curettes en plastique, en carbone et en titane, des appareils à ultrasons avec des pointes en plastique et en métal, des brosses en titane et des systèmes abrasifs à l’air (AA) avec diverses poudres. Bien que l’élimination complète du biofilm soit difficile à réaliser, ces thérapies offrent des avantages cliniques. Diverses interventions cliniques, y compris des protocoles de débridement mécanique avec ou sans antiseptiques8, des antibiotiques9, ainsi que la chirurgie réséquente et régénérative10, ont été utilisées avec divers degrés de succès clinique. Cependant, ils induisent également des modifications des propriétés chimiques et physiques de la surface de l’implant, ce qui peut compliquer la formation de nouveaux os et la réostéointégration.
Parmi les méthodes mécaniques, les procédures AA utilisant différentes compositions de poudre ont montré la meilleure efficacité de nettoyage 11,12,13. Cependant, la présence de particules résiduelles peut altérer la topographie de surface et réduire la biocompatibilité14. La glycine, suivie du bicarbonate de sodium, est la poudre la plus utilisée dans les systèmes AA8. Récemment, des particules abrasives plus petites comme l’érythritol (14 μm) ont suscité l’intérêt pour une décontamination efficace avec une réduction des dommages de surface9. Les curettes en titane et en plastique, qui causent moins de dommages de surface que les pointes en acier, sont efficaces pour la décontamination des biofilms15. Les pointes de détartreur à ultrasons en poly-éther-éther-cétone (PEEK) réduisent également la charge bactérienne avec des dommages de surface minimaux10. Les méthodes de décontamination doivent tenir compte de la grande rugosité des surfaces des implants et viser à éliminer le biofilm bactérien sans causer de dommages significatifs à la surface. Bien que des recherches cliniques approfondies in vitro, in vivo et aient été effectuées, il n’existe toujours pas de consensus et de protocole de référence pour le traitement de la péri-implantite à ce jour. La prévalence croissante des maladies péri-implantaires dues à de nombreux implants dentaires nécessite une approche prévisible et fondée sur des preuves pour traiter les surfaces contaminées. Cette étude vise à évaluer l’efficacité de différentes méthodes de décontamination - systèmes abrasifs à l’air (AA), pointes à ultrasons PEEK et curettes en titane - sur la décontamination de la surface de l’implant et à évaluer leur impact sur la rugosité de la surface de l’implant par analyse MEB.
Protocole
Le protocole de l’étude a été approuvé par le comité d’éthique (TBAEK-363) de l’Université Akdeniz, à Antalya, en Turquie. Cette étude a été soutenue par le Fonds de recherche de l’Université Akdeniz (numéro de projet : TDH-2024-6676). L’étude a utilisé un implant dentaire en forme de vis (PrimeTaper EV Implant) de dimensions 4,2 mm x 11 mm, avec une conception à micro-filetage mesurant 1,7 mm sur le collier. Préparation de surface par sablage et gravure à l’acide fluorhydrique dilué pour obtenir une surface OsseoSpeed bien définie.
1. Préparation de modèles expérimentaux de péri-implantite
REMARQUE : Trois méthodes de traitement mécanique de décontamination (abrasif à l’air (AA), polyétheréthercétone (PEEK) ultrasonique et curettes en titane ; Table des matériaux) dans deux types différents de défauts de péri-implantite,11 (classe 1A et classe 1B) ont été analysés. Il y avait donc six groupes expérimentaux (figure 1). Au total, 62 implants ont été utilisés, dont un implant de contrôle positif et un implant de contrôle négatif. Ce modèle d’étude in vitro, initialement développé par Sharhmann et al.16, a été modifié par divers chercheurs 12,13,14,15,16,17,18 dans la littérature (Figure 2). En supposant une différence de 10 % dans l’efficacité de l’élimination du biofilm entre les groupes, la taille de l’échantillon a été déterminée à 60 (10 pour chaque groupe) pour six groupes avec une puissance G*, une taille d’effet de 0,50, une erreur de type I de 5 % et une puissance de 80 %.

Figure 1 : Organigramme des groupes expérimentaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Retirez une première molaire du modèle de fantôme mandibulaire éducatif. Les dents en plastique sont fixées à ce modèle fantôme à l’aide de vis. Dévissez la première molaire et retirez le filetage de la douille. Remplissez la douille en moulant le matériau en silicone souple pour couvrir la cavité afin de créer une crête alvéolaire plate.
REMARQUE : Une simulation d’un implant placé dans une zone d’édentement a été créée. - Numérisez le modèle préparé dans un scanner de laboratoire pour créer un design numérique.
- Créez numériquement des défauts osseux péri-implantitaires 3D de classe 1A etde classe 1B 11 . Ouvrez le logiciel Exocad. Téléchargez le fichier de modèle analysé. Cliquez ensuite sur Conception et sélectionnez Mode expert. Supprimez les zones irrégulières à l’aide de l’option Modifier le maillage. Cliquez ensuite avec le bouton droit de la souris et sélectionnez Enregistrer l’analyse en tant que fichier dans le dossier associé de l’ordinateur.
- Sélectionnez Outils >option Ajouter/Supprimer un maillage , sélectionnez Numérisation à la cire> Télécharger un fichier, puis sélectionnez le fichier qui vient d’être enregistré dans le dossier. Après cela, cliquez sur Mode Assistant sur la droite.
- Dans le nouveau modèle STL qui en résulte, créez une simulation de défaut dans l’alvéole dentaire. Pour ce faire, cliquez sur Ajouter/Supprimer sur le côté gauche. Sélectionnez la taille du pinceau de forme ovale. Ensuite, créez le défaut sur le modèle en utilisant la touche Maj et le clic gauche en même temps. Ajustez la longueur du défaut à 5 mm et la largeur à 4,2 mm (correspondant au diamètre de l’implant) sur la surface buccale de l’implant pour les défauts de classe 1A et 5-5-5 mm pour les défauts de classe 1B.
- Pour réduire la largeur horizontale du défaut, sélectionnez les cuspides en cliquant sur Anatomie sur le côté gauche et en rétrécissant la largeur vestibulaire du défaut vers l’intérieur. Ensuite, faites un clic droit et enregistrez la scène en tant que fichier.
- Pour créer un modèle final, redémarrez le programme et rechargez le dossier enregistré. Sélectionnez ensuite l’option Mode Assistant et Alignement du modèle sur la droite. Sélectionnez le type de modèle Digital Waxup Model sur la gauche. Cliquez plusieurs fois sur Suivant jusqu’à ce que vous atteigniez la section de conception du modèle sur la gauche. Sélectionnez l’option Modèle complet et cliquez deux fois sur Suivant . Une fois le fichier de modèle terminé, ouvrez-le à l’aide de l’Explorateur et il est prêt à être imprimé.
- Transférez les fichiers STL du modèle conçu à l’imprimante 3D. Imprimez les modèles numériques créés à l’aide d’une résine de modèle.
- Rincez les modèles expérimentaux à l’éthanol à 96 % pendant 5 à 10 min. Après le processus de nettoyage, placez les modèles dans l’appareil de polymérisation électroluminescent et polymérisez à la lumière pendant 5 min à la dose réglée conformément aux instructions du fabricant.
REMARQUE : Utilisez un modèle en résine avec une résistance élevée à la traction, à la flexion et à la compression qui convient au forage d’implants. Nettoyez le modèle imprimé avec des solutions à base d’alcool selon les instructions du fabricant et assurez-vous qu’il est correctement photopolymérisé.
2. Coloration des implants
- Immergez les implants de test dans de l’encre rouge visqueuse et résistante à l’eau. Assurez-vous que toutes les parties de la surface de l’implant sont complètement et uniformément recouvertes d’encre pendant 15 secondes. Retirez les implants du récipient stérile à l’aide de pièces à main de pilote ou de poteaux d’empreinte sans contact avec la main.
REMARQUE : Cette coloration simulera un biofilm optiquement visible pour l’analyse photographique. - Faites sécher à l’air libre les implants tachés à l’aide d’une seringue à air dentaire afin d’avoir une dispersion uniforme de l’encre. Séchez davantage les implants colorés pendant 24 h à température ambiante. Séchez les implants de manière isolée avec les pièces à main, sans contact avec les mains.
3. Mise en place d’implants colorés
- Réglez les paramètres d’un distributeur de physiothérapie dentaire comme suit : 800 tr/min, couple de 40 N sans irrigation saline.
- Créez l’emboîture de l’implant avec les forets chirurgicaux sur les modèles expérimentaux pour placer les implants de 11 mm de longueur et 4,2 mm de largeur. Préparez la même emboîture d’implant pour les modèles présentant les deux types de défauts (modèles de défauts de classe 1A et 1B).
- Utilisez les forets implantaires de manière séquentielle selon les instructions du fabricant pour obtenir une stabilité primaire. Nettoyez les débris restants après le forage avec une seringue air-eau, puis placez les implants. Stabiliser les modèles expérimentaux de péri-implantite sur la plate-forme de travail à l’aide d’une pince pour éviter les micromouvements des implants et pour éviter les microfissures sur les modèles.
- Insérez les implants avec une pièce à main de support dans les emboîtures. Laissez 5 mm de surface exposée sur la surface buccale. Assurez-vous que les implants sont immergés au même niveau sur la crête osseuse linguale du modèle. Évitez de toucher la surface de l’implant tachée.
4. Décontamination des implants
- Commencez à décontaminer les implants en groupes sans les retirer des modèles expérimentaux de défauts 1A et 1B.
- Système abrasif à l’air : Réglez l’appareil à pleine puissance avec une irrigation à l’eau avec une poudre d’érythritol de 14 μm. Tenez l’extrémité de l’appareil à 2-3 mm de la surface de l’implant et appliquez la poudre uniformément sur le défaut de péri-implantite exposé. Limitez le temps de travail à 2 min pour les défauts 1A et 3 min pour les défauts 1B.
- Pointe à ultrasons en polyétheréthercétone (PEEK) : Réglez l’appareil à 8 puissance (80 %) avec une irrigation maximale par eau. Tenez la pièce à main PEEK d’une manière adaptée à l’utilisation par ultrasons. Effectuez la décontamination de la surface de l’implant avec des mouvements linéaires et parallèles. Appliquez l’embout PEEK entre les fils autant que sa conception le permet. Limitez le temps de travail à 2 min pour les défauts 1A et 3 min pour les défauts 1B.
- Curettes en titane : Appliquez des contacts consécutifs avec une pression constante de 60° à 90° sur la surface de l’implant avec une force d’environ 0,75 N sur la surface exposée de l’implant de 5 mm pendant 2 min pour les défauts 1A et 3 min pour les défauts 1B.
- Après la décontamination, retirez l’implant à l’aide de la pièce d’entraînement sans contact avec la main. Si les modèles se déforment après décontamination, passez aux modèles de secours. Stabilisez les modèles expérimentaux de péri-implantite sur la plate-forme de travail à l’aide d’une pince.
REMARQUE : Toutes les méthodes doivent être calibrées et appliquées par un seul chercheur.
5. Imagerie photographique
- Retirez les implants du modèle à l’aide d’un tournevis d’implant compatible. Faites sécher les implants à l’air libre pendant 20 secondes pour éliminer les particules/restes détachés à la surface.
- Placez les implants sur des modèles photographiques en acrylique conçus sur mesure pour prendre des vues plates, des vues apicales à 30° et des vues coronales à 30° pour évaluer les parties apicales et coronales des filetages sur la surface de l’implant.
- Placez l’appareil photo sur un trépied et uniformisez les paramètres de l’appareil photo (distance 15 cm, ISO 160, ouverture f/16, temps d’exposition 1/250 s). Assurez-vous que la pièce est suffisamment éclairée. Il est nécessaire de stabiliser l’appareil photo avec un trépied.
- Prenez les photos numériques au format RAW avec un flash. Obtenez un total de 90 photos buccales (une plate, une à 30° apicale et une à 30° coronale pour chaque surface d’implant) pour les défauts de classe 1A et 270 photos (plate, 30° apicale et 30° coronale de chaque surface buccale, mésiale, distale pour chaque implant) pour les défauts de classe 1B. Déposez tous les fichiers photo numériques sur un disque dur pour une analyse plus approfondie de l’image.
6. Analyse d’images
- Effectuez toutes les analyses sur un logiciel d’imagerie numérique (ImageJ). Avant l’analyse, rendez l’arrière-plan des photographies noir à l’aide d’un programme Photoshop (Photoroom) pour vous assurer que seul l’implant est visible dans l’image. Ouvrez l’application puis ajoutez chaque image de la galerie. Supprimez l’arrière-plan de l’image et sélectionnez Arrière-plan noir dans les options.
- Faites glisser et déposez l’image sur ImageJ. Dessinez un carré dans l’image pour couvrir 5 mm coronaire à l’implant. Cliquez ensuite sur Image > Recadrer pour la normalisation. Répétez le même processus pour chaque image.
- Convertissez les images au format 8 bits en cliquant sur Image ˃ Tapez ˃ 8 bits et ajustez les seuils en cliquant sur Image ˃ Ajuster ˃ Seuil pour les calculs de surface.
- Calculez toute la surface de l’implant et la zone des résidus de couleur rouge en cliquant sur Analyser ˃ Mesurer ˃ Surface.
- Enregistrez la zone de pixels obtenue dans un fichier tableur. Créez un fichier de feuille de calcul distinct pour enregistrer les données d’image brutes.
- Afin d’obtenir le pourcentage de restes de couleur rouge, multipliez la surface affichée en rouge par 100 et divisez par la surface totale de l’implant.
7. Analyse MEB
- Conservez tous les implants dans leurs boîtes stériles jusqu’au jour de l’analyse.
- Avant l’analyse MEB, sélectionnez au hasard un échantillon représentatif de chaque groupe de traitement. En plus des échantillons sélectionnés dans chaque groupe, ajoutez un implant stérile et seulement l’implant entièrement recouvert d’encre. Ainsi, préparez un total de huit échantillons d’implants pour l’analyse MEB.
- Pulvériser de l’azote gazeux à l’aide d’un pistolet à gaz pendant 20 s afin d’éliminer toute micro-poudre sur la surface de l’implant avant l’analyse MEB.
REMARQUE : Aucun revêtement d’or supplémentaire n’a été appliqué en raison de la technologie avancée de l’appareil. - Montez chaque implant sur des talons MEB avec des disques adhésifs en carbone conducteur de manière à permettre l’analyse de la surface plane buccale sans décontamination des mains. Disposez-les par ordre de nombre pour éviter la confusion des groupes.
- Sélectionnez une zone parmi les implants placés dans l’instrument et capturez des images à différents grossissements. Répétez la même procédure pour différentes régions des surfaces de l’implant (mésiale ou distale). Utilisez un grossissement de 100x, 1000x et 5000x pour les images à l’aide d’un appareil MEB fonctionnant à 10-30 kV avec une distance de travail moyenne de 12 mm.
REMARQUE : Le deuxième microbrin de la zone du collier et le deuxième macrobrin du corps ont été sélectionnés pour chaque implant afin d’assurer la standardisation lors de l’analyse MEB. Pour certaines images, il est recommandé d’effectuer une analyse élémentaire (EDS) pendant l’imagerie à des fins de comparaison.

Figure 2 : Organigramme de l’étude. Veuillez cliquer ici pour voir une version agrandie de cette figure.
8. Analyse statistique
- Exprimez les variables catégorielles sous forme de nombres et de pourcentages et les variables continues sous forme de moyenne et d’écart-type. Confirmez la normalité de la distribution pour les variables continues avec le test de Shapiro-Wilk.
- Pour comparer des variables continues entre des groupes de défauts, utilisez le test t de Student. Pour comparer plus de deux groupes, utilisez l’ANOVA à un facteur ou le test de Kruskal Wallis selon que les hypothèses statistiques se sont vérifiées ou non.
- Pour les données normalement distribuées, en ce qui concerne l’homogénéité des variances, utilisez les tests de Tukey pour des comparaisons multiples de groupes. Pour les données non distribuées de manière anormale, utilisez le test U de Mann-Whitney ajusté par Bonferroni pour des comparaisons multiples de groupes. Toutes les analyses statistiques ont été effectuées à l’aide d’IBM SPSS 20. Le niveau statistique de signification pour tous les tests a été considéré comme étant de 0,05.
Résultats
Le protocole expérimental décrit ici pour l’analyse de la décontamination des surfaces des implants a révélé des différences significatives entre les différentes procédures de traitement. De plus, le protocole SEM post-traitement a également montré des changements significatifs sur les surfaces de l’implant, à des degrés divers parmi les groupes d’étude.
Comparaisons au niveau de l’implant (moyennes totales de l’implant) après décontamination
Des comparaisons au niveau de l’implant ont été effectuées en comparant les moyennes générales de chaque implant (les moyennes de mesure des surfaces buccales dans les défauts de classe 1A et les moyennes de mesure des surfaces buccales, mésiales et distales dans les défauts de classe 1B). En conséquence, la décontamination la plus efficace a été obtenue avec l’AA dans les défauts 1A (0,19 ± 0,02) (p < 0,001). Ce groupe a été suivi par AA-1B (0,29 ± 0,04), PI-1B (0,38 ± 0,04) et PI-1A (0,43 ± 0,03). La décontamination la plus faible a été détectée dans les groupes TIT-1A (0,53 ± 0,03) et TIT-1B (0,56 ± 0,03). Bien qu’il n’y ait pas de différence significative entre les groupes de curettes en titane (1A-1B), les comparaisons par paires de tous les autres groupes sont statistiquement significatives (p < 0,001 ; Tableau 1 ; Figure 3).

Figure 3 : Graphique en violon des groupes expérimentaux et des moyennes totales de l’implant. Abréviations : AA = Abrasif à l’air, PI = Pointe PEEK, TIT = Curette en titane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Comparaisons au niveau de la surface de l’implant après décontamination
À l’instar des comparaisons au niveau de l’implant, l’abrasif à l’air (AA) a fourni statistiquement la décontamination la plus efficace sur les surfaces buccales de tous les échantillons (1A + 1B) par rapport à l’IP et au TIT (p < 0,001). Bien que la décontamination ait été meilleure avec l’IP qu’avec la TIT sur les surfaces buccales (p < 0,001), aucune différence n’a été détectée entre les groupes buccaux TIT 1A et 1B.
La décontamination la plus efficace des surfaces mésiales des défauts 1B a été fournie par l’AA par rapport à l’IP et au TIT, et la différence entre tous les groupes était statistiquement significative (p < 0,001). Il a été constaté que les protocoles AA et PI étaient également efficaces sur les surfaces distales des défauts 1B (p ˃ 0,05), et les deux groupes se sont révélés plus efficaces que le groupe TIT (p < 0,001 ; Tableau 1).
Comparaisons au niveau du protocole de traitement après décontamination
Quels que soient les groupes de défauts, les comparaisons des protocoles de traitement ont montré que l’AA (0,24 ± 0,06) était statistiquement significativement plus efficace dans la décontamination de la surface de l’implant par rapport à l’IP et au TIT (p < 0,001). De plus, les mesures de l’IP (0,41 ± 0,04) étaient statistiquement meilleures que celles de la TIT (0,55 ± 0,03 ; p < 0,001 ; Tableau 1).
Comparaison du niveau de défaut après décontamination
Quels que soient les protocoles de traitement, les comparaisons de types de défauts ont montré que les types de défauts de péri-implantite de classe 1A et de classe 1B entraînaient une efficacité de décontamination similaire (p ˃ 0,388). D’autre part, dans les défauts de classe 1B, l’efficacité des protocoles de traitement a été observée comme étant statistiquement meilleure sur les surfaces buccales (0,34 ± 0,17) par rapport aux surfaces distales (p ˃ 0,388 ; Tableau 1).
Tableau 1 : Comparaison du pourcentage d’encre restant et des résultats de décontamination en fonction des groupes de traitement et des types de défauts. Veuillez cliquer ici pour télécharger ce tableau.
Comparaison des angles d’analyse photographique après décontamination
Lorsque les mesures des photographies frontales de 90° (F-90°), apicale 30° (A-30°) et coronale 30° (C-30°) ont été comparées, aucune différence entre les groupes n’a pu être détectée entre A-30° et C-30°. Une décontamination plus efficace a été observée dans les échantillons photographiques de surfaces buccales à C-30° et F-90° du groupe AA, dans les échantillons photo A-30° et C-30° dans le groupe PI et dans les échantillons photo F-90° buccal et mésial dans le groupe TIT (tableau 2).
Tableau 2 : Comparaison du pourcentage d’encre restant et des résultats de décontamination en fonction des angles de photo. Veuillez cliquer ici pour télécharger ce tableau.
Résultats MEB et analyse EDS après décontamination
L’analyse MEB des échantillons représentatifs a montré que toutes les modalités de traitement avaient affecté la surface de l’implant. Le traitement AA a provoqué des altérations négligeables dans les structures des micro-fils et des macro-fils dans les sites buccaux, quel que soit le groupe de défauts (Figure 4, Figure 5). Cependant, dans les zones mésiales et distales du groupe de défauts 1B, on a trouvé plus de résidus d’encre sous les fils que dans la zone buccale (figure 5). De plus, une particule de poudre a été observée dans le site du micro-fil buccal du groupe de défauts 1B (Figure 6). La pointe ultrasonique en plastique/carbone PEEK a provoqué un aplatissement léger à modéré de la structure topographique du site buccal par rapport à la méthode AA, quel que soit le groupe de défauts. De plus, dans le groupe PEEK, un aspect plus flou et perforé a été observé, différent de la structure rugueuse, notamment en raison des résidus d’encre restant entre les micro-fils (Figure 4, Figure 5). Cependant, le traitement PEEK a donné des résultats similaires à ceux de l’AA dans les zones mésiales et distales du groupe de défauts 1B à des grossissements de 1000x et 5000x (Figure 5). De plus, aucun objet étranger n’a été trouvé dans le groupe PEEK. D’autre part, les curettes en titane ont provoqué d’importantes altérations de la surface par rapport aux autres méthodes. Dans le groupe de défauts 1A, la structure rugueuse n’a pas pu être distinguée de la structure à micro-filetage dans la zone buccale en raison d’une mauvaise décontamination (figure 4). Dans d’autres sites, un aplatissement et des rayures longitudinales/horizontales ont été détectés (figure 4, figure 5). Dans les sites mésial et distal du groupe de défauts 1B, la structure rugueuse a disparu et le nombre d’égratignures a augmenté (Figure 5). De plus, une analyse élémentaire (EDS) de l’implant de référence stérile a été effectuée, révélant une teneur en titane de 99,2 % (Figure 7). Une analyse élémentaire a également été effectuée sur les structures notables (trous noirs) dans d’autres groupes et sur la surface de l’implant non traitée entièrement recouverte d’encre, montrant un résultat à dominante carbone dans ces zones, probablement dû à la vaporisation de l’encre (Figure 8 A-C).

Figure 4 : Images MEB d’échantillons d’implants du groupe de défauts de classe 1A. (A) Images à un grossissement de 100x, 1000x, 5000x du microfil du défaut buccal 1A. (B) Images à un grossissement de 100x, 1000x, 5000x du macrofil du défaut buccal 1A. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Images MEB d’échantillons d’implants du groupe de défauts de classe 1B. (A) Images à un grossissement de 100x, 1000x, 5000x du microfil du défaut buccal 1B. (B) Images à un grossissement de 100x, 1000x et 5000x du macrothread de l’anomalie buccale 1B. (C) Images à un grossissement de 100x, 1000x, 5000x du site mésial du défaut 1B. (D) Images à un grossissement de 100x, 1000x, 5000x du site distal du défaut 1B. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Image de la particule de poudre d’érythritol reconnue sur le site du collier de l’implant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
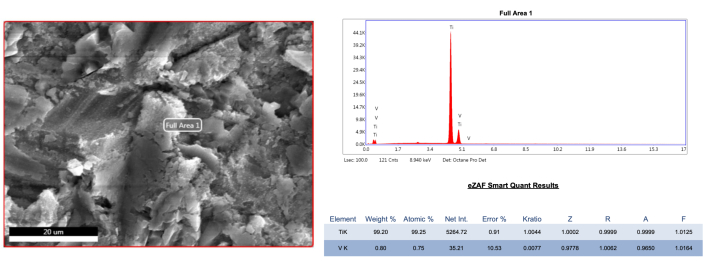
Figure 7 : Analyse EDS d’un échantillon d’implant de référence stérile et non traité. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Analyse EDS. (A) Analyse EDS d’un échantillon d’implant non traité recouvert d’encre. (B) Analyse par EDS de l’échantillon d’implant du groupe PEEK (groupe 4). (C) Analyse EDS de l’échantillon d’implant de la curette en titane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La méthodologie d’analyse de surface in vitro des implants dentaires affectés par la maladie péri-implantaire a toujours été un défi en raison de la nature inflammatoire et bactérienne des mécanismes pathogènes se produisant sur les surfaces rugueuses de l’implant. Plusieurs préoccupations incluent le choix du matériau de l’échantillon, l’imitation du biofilm à la surface, le choix du type de défaut de péri-implantite, la représentation des conditions cliniques pendant les procédures in vitro, les variations des procédures de décontamination et les méthodes de détermination de la quantité de décontamination et les effets des procédures sur la rugosité de la surface de l’implant. Chaque marque d’implant présente des caractéristiques de surface uniques telles que le type de métal (titane, zirconium), les caractéristiques de rugosité de surface, l’énergie libre de surface, la mouillabilité, la profondeur, la largeur et la longueur du fil, qui ont toutes un impact direct sur l’efficacité des protocoles de décontamination. Pour surmonter cette préoccupation, certaines études ont utilisé des disques colorés ou contaminés au lieu d’implants. Cependant, la capacité d’éliminer le biofilm bactérien d’une surface plane (disque) par rapport à une caractéristique de type vis (implant) ne présenterait pas la situation clinique réelle16,20. Bien que l’efficacité de décontamination de différentes marques d’implants ait été évaluée dans la littérature21, des implants avec des caractéristiques standard et haut de gamme ont été utilisés dans la présente étude.
Le modèle d’encre permanente utilisé dans cette étude est la méthode la plus courante pour imiter le biofilm sur les implants 13,14,15,16,17,19,22. Cependant, l’utilisation de l’encre peut représenter un biais car elle est facilement visible par l’opérateur, ce qui contredit les conditions cliniques. De plus, ce biofilm simulé n’adhère pas à la surface de l’implant de la même manière que les biofilms naturels, et il n’est pas calcifié, ce qui rend le débridement physique plus facile que dans les contextes cliniques réels. Le revêtement de la surface de l’implant avec du tartre artificiel23 peut être une solution à ce problème, mais l’obtention d’une épaisseur de tartre uniforme et uniforme peut encore représenter une limitation. Plusieurs études ont utilisé des bactéries pathogènes parodontales viables directes in vivo24 ou in vitro25 contamination de la surface du titane. La péri-implantite étant une maladie multibactérienne complexe, l’utilisation de biofilms monobactériens ou de biofilms multibactériens à la surface peut influencer les résultats des procédures de décontamination26. De plus, l’affinité des bactéries à se fixer aux différents matériaux de surface de l’implant (zircone, titane) peut différer en raison de la rugosité de la surface et de l’énergie sans surface26. Dans le cadre de ces limitations, la méthode de coloration de l’encre offre plusieurs avantages, tels que la mesure directe des restes d’encre numériquement et la possibilité de comparaisons quantitatives entre les méthodes de décontamination.
Il a été rapporté que le type de défaut de péri-implantite et la présence de parois défectueuses influencent l’effet des protocoles de débridement mécanique 15,18,27. Des anomalies supracrestales ou circonférentielles avec diverses angulations ont été utilisées dans des études in vitro antérieures15,28. Le principal problème avec ces modèles de défauts est que l’accès à la surface de l’implant pendant l’instrumentation est le même dans tous les domaines ; Cependant, cela ne reflète pas les défauts cliniques. Les défauts intra-osseux de classe 1A et de classe 1B18, qui sont le type le plus courant de défauts de péri-implantite, ont été utilisés dans la présente étude. De plus, des paramètres chirurgicaux ont été simulés dans l’étude actuelle, comme le recommandent les directives5 de l’EFP, dans lesquels, cliniquement, la superstructure prothétique est retirée et les lambeaux mucopériostés sont surélevés pour une vision directe des défauts de la péri-implantite.
Le succès des protocoles de décontamination de la surface de l’implant dépend de leur capacité à avoir accès aux surfaces intérieures rugueuses des filetages de l’implant. À ce jour, plusieurs méthodes de décontamination ont été étudiées avec plus ou moins de succès. Parmi ceux-ci, les systèmes abrasifs à l’air, les brosses en titane et les curettes sont les protocoles de traitement les plus efficaces8. Cependant, tous ces traitements induisent des modifications de la rugosité de la surface de l’implant, telles que des modifications de texture et d’épaisseur de la couche d’oxyde. Ces altérations microtopographiques peuvent éventuellement avoir des implications cliniques négatives. Par conséquent, la méthode de décontamination optimale des surfaces des implants n’a pas encore été déterminée. Bien qu’une comparaison directe des résultats actuels avec les études précédentes ne soit pas possible en raison du type de défaut spécifique et de la simulation du modèle de mâchoire, des similitudes dans la composante intraosseuse peuvent être notées. Les résultats de l’étude actuelle s’alignent sur la littérature, indiquant que l’AA est plus efficace sur les surfaces buccales, où il est appliqué perpendiculairement à un angle de 90° par rapport à la surface de l’implant, tandis que son efficacité diminue sur les surfaces mésiales et distales, où le composant intra-osseux nécessite une application inclinée 14,16,17,29. De plus, cela peut s’expliquer par l’effet de ricochet décrit par Petersilka en 201130, qui se produit lorsque l’AA, travaillant sur le principe de la poudre sous pression et de l’eau, est appliqué sur des surfaces.
L’efficacité du type de poudre utilisé dans les procédures AA a été étudiée dans de nombreuses études. Bien que la glycine soit la poudre la plus couramment utilisée dans la recherche clinique et in vitro à ce jour, d’autres types comprennent le bicarbonate de sodium, le bicarbonate de calcium, le phosphate tricalcique et l’érythritol7. Cependant, il a été observé que les poudres avec des particules de plus grande taille, tout en offrant une décontamination plus efficace sur la surface de l’implant, provoquent également plus de changements de surface tels que des modifications macrostructurelles et une augmentation des rayures 13,31. Une étude in vitro récente menée par Pujarern et al.9 n’a montré aucune différence dans l’efficacité de décontamination du biofilm entre les poudres d’érythritol et de bicarbonate de sodium sur les surfaces des implants. De plus, il a été rapporté que les particules plus petites se dissolvent plus facilement dans le mélange air-eau, ce qui réduit le risque d’endommager la surface et facilite la pénétration dans des espaces de fils étroits par rapport aux particules plus grosses13. Malgré les avantages des systèmes abrasifs à l’air, tels qu’il s’agit d’une méthode efficace pour l’élimination du biofilm des surfaces des implants, causant des dommages minimaux à la surface, réduisant les traumatismes des tissus mous et une faible morbidité postopératoire des patients, certaines limites doivent être notées. Il s’agit notamment des difficultés à éliminer les dépôts calcifiés ou les accumulations bactériennes bien adhérentes32, la difficulté à obtenir des angles appropriés dans les régions postérieure et linguale/palatine, et le risque d’emphysème sous-cutané dû à l’air comprimé pendant la procédure33. Par conséquent, des preuves supplémentaires sont nécessaires pour étayer l’utilisation régulière de systèmes abrasifs à l’air5.
Dans les situations où les systèmes de poudre abrasive à l’air ne peuvent pas être utilisés, des alternatives telles que des brosses en titane, des curettes métalliques ou des pointes à ultrasons peuvent être préférées ou requises comme traitement d’appoint21. Cependant, les instruments métalliques utilisés pour la décontamination mécanique peuvent créer une surface plus rugueuse en grattant la surface en titane, ce qui peut favoriser l’adhérence microbienne et l’accumulation de plaques. Par conséquent, des alternatives telles que le téflon, le plastique et les instruments recouverts de PEEK doivent être utilisées et étudiées plus avant. Dans l’étude actuelle, l’efficacité d’un embout ultrasonique PEEK/carbone récemment développé, spécialement conçu pour les surfaces d’implants, a été évaluée. Dans des études récentes conformes à notre méthodologie, les pointes en plastique PEEK soniques et ultrasoniques, ainsi que les systèmes de poudre abrasive à l’air, ont obtenu les meilleurs résultats sur différentes surfaces d’implants12,34. L’embout PI MAX utilisé dans la présente étude diffère de l’embout PEEK précédent du fabricant en ce qu’il contient 30 % de carbone et a une conception plus fine et plus flexible. Les données limitées disponibles sur ce nouveau design soulignent l’importance de le comparer aux deux méthodes les plus étudiées (abrasion à l’air et curettes en titane) dans l’étude actuelle.
Les curettes métalliques, largement utilisées aujourd’hui et considérées comme la référence en matière de débridement mécanique dans les traitements parodontaux, sont également couramment utilisées autour des implants dentaires. De nombreux fabricants ont développé des curettes en titane spécialement conçues pour éliminer le biofilm et autres résidus sans endommager la surface de l’implant35. Des simulations in vitro ont permis de conclure que l’instrumentation mécanique répétée n’entraîne pas de modifications cumulatives de la rugosité de la surface de l’implant36. Cependant, dans certains cas, les curettes en titane peuvent avoir une efficacité limitée pour éliminer les dépôts durcis ou minéralisés. De plus, le nettoyage avec des curettes manuelles en titane peut prendre du temps et être sujet à des variations en fonction du niveaude compétence 37 de l’opérateur. Sur la base des preuves actuelles, il est difficile de traduire les résultats de ces études en pratique clinique en raison de la grande hétérogénéité des conceptions microscopiques et macroscopiques des implants.
La prévalence croissante des maladies péri-implantaires en raison du nombre élevé d’implants dentaires posés nécessite une approche prévisible soutenue par des données probantes pour traiter les surfaces contaminées. Les méthodes de décontamination doivent tenir compte du fait que les surfaces des implants les plus couramment utilisées présentent un haut degré de rugosité, ce qui favorise l’ostéointégration, et que la quantification et l’élimination ultérieure du biofilm bactérien doivent être normalisées sans causer de dommages de surface significatifs8. Les méthodes in vitro les plus couramment utilisées pour évaluer la nanotopographie des matériaux dentaires et la rugosité des surfaces implantaires sont la profilométrie mécanique et optique 3D (avec et sans contact) pour l’analyse quantitative et la microscopie électronique à balayage (MEB) pour l’évaluation qualitative 12,38,40. La complexité de la mesure et de la recherche de la rugosité de surface des implants est due à la présence de vides et d’imperfections sans motif exact visible41.
Les résultats du MEB de la présente étude étaient conformes aux résultats précédents selon lesquels le traitement AA provoquait de légères modifications de surface17,31, tandis qu’un aplatissement significatif de la topographie de surface a été observé avec des curettes en titane23. Le MEB offre une plage dynamique en utilisant un champ de vision plus large avec une plus grande profondeur de champ et un grossissement plus important. Les détails de surface, tels que la texture topographique et le contraste des matériaux, peuvent être évalués jusqu’à une résolution nanométrique. Cependant, le MEB n’est pas une technique quantitative en soi, et des données plus fiables peuvent être obtenues lorsqu’il est combiné avec d’autres techniques quantitatives, dont la profilométrie est la méthode la plus courante. Récemment, la stéréophotogrammétrie 3D42 et un logiciel innovant d’analyse d’images basé sur l’IA43 ont été utilisés pour des mesures quantitatives MEB directes.
En conclusion, dans les limites de ces limites, les résultats suggèrent que le choix de la méthode de décontamination pour les applications cliniques devrait être déterminé en fonction de l’objectif ultime du traitement de la péri-implantite. En conséquence, alors que le système de poudre d’érythritol abrasif à l’air semble être une option plus douce pour la surface de l’implant dans les thérapies régénératives et offre une accessibilité et une décontamination plus efficaces, les curettes en titane, qui aplatissent la surface, peuvent être recommandées pour le débridement des granulations des tissus mous péri-implantaires et dans les thérapies réséquives où la surface de l’implant est laissée exposée à l’environnement buccal. Les embouts ultrasoniques PEEK sont également recommandés pour l’élimination des dépôts calcifiés sur les crêtes des filets de l’implant et les surfaces transmuqueuses lisses. L’utilisation combinée des méthodes de décontamination disponibles, plutôt que leur utilisation isolée, pourrait représenter l’approche la plus efficace.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les implants utilisés dans l’étude ont été soutenus par Dentsply Sirona.
matériels
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Références
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon