Method Article
החלפת מסתם ריאתי טרנסקטטר מקרדיום אוטולוגי עם סטנט ניטינול הניתן להרחבה עצמית במודל כבשים בוגר
In This Article
Summary
מחקר זה מדגים את ההיתכנות והבטיחות של פיתוח שסתום ריאתי אוטולוגי להשתלה בתנוחת מסתם הריאה המקומי על ידי שימוש בסטנט ניטינול הניתן להרחבה עצמית במודל כבשים בוגרות. זהו צעד לקראת פיתוח תחליף מסתם ריאתי טרנסקטטר לחולים עם תפקוד לקוי של דרכי היציאה מהחדר הימני.
Abstract
החלפת מסתם ריאתי טרנסקטטר נקבעה כגישה חלופית בת קיימא לחולים הסובלים ממערכת זרימה בחדר ימין או מתפקוד לקוי של מסתם ביו-פרוסטטי, עם תוצאות קליניות מוקדמות ומאוחרות מצוינות. עם זאת, יש לטפל באתגרים קליניים כגון הידרדרות במסתם הלב, חסימה כלילית, אנדוקרדיטיס וסיבוכים אחרים ליישום לכל החיים, במיוחד בחולי ילדים. כדי להקל על פיתוח פתרון לכל החיים לחולים, בוצעה החלפת מסתם ריאתי אוטולוגי טרנסקטטר במודל כבשים בוגר. קרום הלב האוטולוגי נקטף מהכבשים באמצעות מיני-אורקוטומיה אנטרולטרלית שמאלית בהרדמה כללית עם אוורור. קרום הלב הונח על מודל תלת-ממדי של מסתם לב לצורך חיבור צולב לא רעיל למשך יומיים ו-21 שעות. אקוקרדיוגרפיה תוך-לבבית (ICE) ואנגיוגרפיה בוצעו כדי להעריך את המיקום, המורפולוגיה, התפקוד והממדים של המסתם הריאתי המקומי (NPV). לאחר החיתוך, קרום הלב המוצלב נתפר על סטנט ניטינול הניתן להרחבה עצמית והתכווץ למערכת אספקה בעיצוב עצמי. המסתם הריאתי האוטולוגי (APV) הושתל במצב NPV באמצעות צנתור ורידים ג'וגולריים שמאליים. ICE ואנגיוגרפיה חזרו על עצמם כדי להעריך את המיקום, המורפולוגיה, הפונקציה והממדים של ה-APV. APV הושתל בהצלחה בכבשה J. במאמר זה נבחרה כבשה ג'יי כדי לקבל תוצאות מייצגות. APV 30 מ"מ עם סטנט ניטינול הושתל במדויק במצב NPV ללא כל שינוי המודינמי משמעותי. לא הייתה דליפה פראוולוולרית, לא הייתה אי-ספיקה של מסתם ריאתי חדש, או נדידת מסתם ריאתי. מחקר זה הדגים את ההיתכנות והבטיחות, במעקב ארוך שנים, של פיתוח APV להשתלה בתנוחת NPV עם סטנט ניטינול הניתן להרחבה עצמית באמצעות צנתור ורידים ג'וגולרי במודל כבשים בוגרות.
Introduction
Bonhoeffer et al.1 סימנו את תחילת החלפת מסתם הריאתי הטרנסקטטר (TPVR) בשנת 2000 כחידוש מהיר עם התקדמות משמעותית לקראת מזעור סיבוכים ומתן גישה טיפולית חלופית. מאז, השימוש ב- TPVR לטיפול במערכת זרימת החדר הימנית (RVOT) או בתפקוד לקוי של מסתם ביו-פרוסטטי עלה במהירות 2,3. עד כה, מכשירי ה- TPVR הזמינים כיום בשוק סיפקו תוצאות מספקות לטווח ארוך ולטווח הקצר עבור חולים עם תפקוד לקוי של RVOT 4,5,6. יתר על כן, סוגים שונים של מסתמי TPVR, כולל מסתמי לב נטולי תאים ומסתמי לב המונעים על ידי תאי גזע מפותחים ומוערכים, והיתכנותם הוכחה במודלים פרה-קליניים של בעלי חיים גדולים 7,8. שחזור מסתם אבי העורקים באמצעות קרום הלב האוטולוגי דווח לראשונה על ידי ד"ר דוראן, שעבורו שלוש בליטות רצופות בגדלים שונים שימשו כתבניות להנחיית עיצוב קרום הלב בהתאם לממדי האנולוס של אבי העורקים, עם שיעור הישרדות של 84.53% במעקב של 60 חודשים9. הליך אוזאקי, שנחשב להליך תיקון מסתמים ולא להליך החלפת מסתם, כולל החלפת עלוני מסתם אבי העורקים עם קרום הלב האוטולוגי שטופל בגלוטרלדהיד; עם זאת, בהשוואה להליך של ד"ר דוראן, הוא השתפר משמעותית במדידת המסתם החולה עם תבנית לחיתוך קרום הלב הקבוע10 ותוצאות משביעות רצון הושגו לא רק מהמקרים הבוגרים אלא גם ממקרי ילדים11. נכון לעכשיו, רק הליך רוס יכול לספק תחליף מסתם חי לחולה שיש לו מסתם אבי העורקים החולה עם יתרונות ברורים במונחים של הימנעות נוגדי קרישה לטווח ארוך, פוטנציאל גדילה, וסיכון נמוך של אנדוקרדיטיס12. אבל התערבויות חוזרות עשויות להידרש עבור autograft ריאתי וחדר ימין לצינור עורק ריאתי לאחר הליך כירורגי מורכב כזה.
המסתמים הביו-פרוסטטיים הנוכחיים הזמינים לשימוש קליני מתפרקים באופן בלתי נמנע עם הזמן עקב תגובות השתל לעומת המארח לרקמות החזיר או הבקר הקסנוגניות13. הסתיידות, השפלה וחוסר יכולת הקשורים למסתמים עלולים לחייב התערבויות חוזרות ונשנות לאחר מספר שנים, במיוחד בחולים צעירים שיצטרכו לעבור תחליפי מסתם ריאתי מרובים במהלך חייהם בשל היעדר גדילה של המסתמים, תכונה הטבועה בחומרים ביו-פרוסטטיים נוכחיים14. יתר על כן, לשסתומי ה-TPVR הזמינים כיום, שאינם מתחדשים במהותם, יש מגבלות עיקריות כגון סיבוכים טרומבואמבוליים ודימומים, כמו גם עמידות מוגבלת עקב שיפוץ רקמות שליליות, מה שעלול להוביל לנסיגת עלון ולתפקוד לקוי אוניברסלישל הוולבולרי 15,16.
ההשערה היא שפיתוח שסתום ריאתי אוטולוגי דמוי-יליד (APV) המורכב על סטנט ניטינול הניתן להרחבה עצמית עבור TPVR עם המאפיינים של תיקון עצמי, התחדשות ויכולת גדילה יבטיח ביצועים פיזיולוגיים ופונקציונליות ארוכת טווח. והצלבה הלא רעילה שטופלה קרום הלב האוטולוגי יכולה להתעורר מהליכי הקציר והייצור. לשם כך, ניסוי פרה-קליני זה נערך כדי להשתיל מסתם ריאתי אוטולוגי סטנט במודל כבשים בוגרות במטרה לפתח תחליפים וולולריים התערבותיים אידיאליים ומתודולוגיה פרוצדורלית בסיכון נמוך כדי לשפר את הטיפול בטרנסקטטר של תפקוד לקוי של RVOT. במאמר זה, כבשה J נבחרה כדי להמחיש את הליך ה- TPVR המקיף הכולל כריתת קרום הלב והשתלת ורידים טרנס-ג'וגולריים של מסתם לב אוטולוגי.
Protocol
מחקר פרה-קליני זה אושר על ידי הוועדה המשפטית והאתית של המשרד האזורי לבריאות ולעניינים חברתיים, ברלין (LAGeSo). כל בעלי החיים (Ovis aries) קיבלו טיפול הומאני בהתאם להנחיות האגודות האירופיות והגרמניות למדעי חיות המעבדה (FELASA, GV-SOLAS). ההליך מודגם על ידי ביצוע החלפת מסתם ריאתי אוטולוגי בנקבת כבשה J בת 3, 47 ק"ג.
1. ניהול טרום ניתוחי
- אחסנו את כל הכבשים הניסיוניות באותו חדר המכילות קש במשך שבוע מיום ההגעה ועד ליום כריתת קרום הלב כדי לשמור על חברות חברתית (איור 1A).
- לשלול מהכבשים מזון אך לא מים במשך 12 שעות לפני כריתת קרום הלב וההשתלה.
- טרום-תרופה לכבשים בזריקה תוך שרירית של מידזולם (0.4 מ"ג/ק"ג), בוטורפונול (0.4 מ"ג/ק"ג) וגליקופרולאט (0.011 מ"ג/ק"ג או 200 מק"ג) 20 דקות לפני האינטובינציה.
2. אינדוקציה של הרדמה כללית
- באופן אספטי מניחים קטטר תוך ורידי בטיחותי של 18 גרם (IV), יציאת הזרקה ויציאת T בווריד הצפלי (איור 1B).
- לגרום להרדמה על ידי הזרקה תוך ורידית של פרופופול (20 מ"ג/מ"ל, 1-2.5 מ"ג/ק"ג) ופנטניל (0.01 מ"ג/ק"ג) כדי להשפיע.
- אינדיקציות לרמה נאותה של הרגעה כוללות הרפיית לסת, אובדן בליעה ורפלקס פפילרי. לאחר ההרגעה, הכניסו את הכבשים עם צינור אנדוטרכאלי בגודל מתאים (איור 1C). לגלח את הכבשה ולאחר מכן להעביר אותה לחדר הניתוח (OR).
3. ניהול הרדמה תוך ניתוחית לכריתת קרום הלב והשתלה
- השתמש במכונת הנשמה מכנית מחזורית בלחץ כדי ליזום אוורור לחץ חיובי לסירוגין (IPPV) עם 100% חמצן ב- OR.
- חברו את הכבשים לפלטפורמת מכשיר ההרדמה ואווררו את הכבשים לאורך כל ההרדמה במצב לחץ (נפח גאות ושפל (TV) = 8-12 מ"ל/ק"ג, תדירות הנשימה (RF) = 12-14 נשימות לדקה). התאם את הטלוויזיה וה- RF כדי לשמור על הפחמן הדו-חמצני בקצה הגאות (EtCO2) בין 35-45 מ"מ כספית לבין הלחץ החלקי העורקי של CO2 (PaCO2) מתחת ל- 50 מ"מ כספית.
- שמור על הרדמה בשילוב עם איזופלורן (כדי להשפיע, ריכוז תחזוקה מוצע 1.5%-2.5%) בחמצן עם קצב זרימה של 1 ליטר לדקה (חלק בהשראת חמצן (FiO2) = 75%), בשילוב עם עירוי קצב רציף (CRI) של פנטניל (5-15 מק"ג/ק"ג/שעה) ומידזולם (0.2-0.5 מ"ג/ק"ג/שעה).
- יש למקם צנתר 18 גרם בטיחות IV בעורק האוריקולרי למדידת לחץ דם פולשני (IBP).
- חברו את הכבשים לפלטפורמת ההרדמה הרב-תפקודית לניטור המודינמי, המציגה מדידה ישירה של לחץ דם פולשני (IBP) בעורק האוריקולרי (האפס ברמת הלב), טמפרטורת הגוף עם בדיקה רקטלית, אלקטרוקרדיוגרמה של עופרת-IV, ריווי חמצן פלתיסמוגרפי (SpO2), טלוויזיה, RF, EtCO2, קצב לב (HR) ו-FiO2.
- מקם צינורית קיבה כדי לפנות עודפי גז ונוזלים מהרטיקולורומן כהכנה לכריתת קרום הלב. ציידו את צינורית הקיבה בחוט מנחה סמן כהפניה להשתלה.
- מניחים קטטר שתן פולי דרך השופכה בתוך שלפוחית השתן המחוברת לשקית שתן. הורידו את בלון הפולי עם מינימום של 5 מ"ל של תמיסת מלח (0.9% NaCl).
- בצע בדיקת קרישה מופעלת (ACT: 240-300 s) 30 דקות לפני ההשתלה כדי לאשר הפריניזציה מספקת לפני ואנטגוניזציה לאחר ההשתלה. בצע ניתוח גז דם עורקי (ABGs) כדי לנתח את הסביבה הפנימית 30 דקות לפני כריתת קרום הלב וההשתלה וכל שעה במהלך שני ההליכים.
- תן את האנטיביוטיקה הבאה, כלומר, סולבקטם / אמפיצילין (20 מ"ג / ק"ג) 30 דקות באמצעות טפטוף תוך ורידי לפני כריתת קרום הלב והשתלה. הקפידו על עירוי רציף של גבישים (5 מ"ל/ק"ג/שעה, תמיסת אלקטרוליטים מאוזנת איזוטונית) ועמילן הידרוקסיאתיל (HES, 30 מ"ל/שעה) לאורך כריתת קרום הלב וההשתלה.
4. כריתת קרום הלב
- הכנה לכריתת קרום הלב
- מניחים את הכבשה על שולחן הניתוחים בתנוחת משענת הרוחב הימנית עם גובה של 30° בצד שמאל, ואז מהדקים את גפיה ברתמות ורצועות.
- לעקר את האתר הניתוחי (כריתת קרדיקרדי: עדיף על עצם הבריח השמאלית, קדמית על עצם החזה, באופן נחות לרמה של הסרעפת, ואחורית לקו האמצע השמאלי) עם כלורהקסידין-אלכוהול לפני ביצוע המיני-אורקוטומיה. כסו את האזורים הנותרים בוילונות סטריליים (איור 2A).
- בצע חתך עור באורך 5 ס"מ בתנוחה הבין-כוכבית הרביעית באמצעות להב כירורגי מספר 10 בהרדמה כללית.
- נתחו את שריר ה-pectoralis major-pectoralis minor-anterior serratus-intercostal דרך המיני-אורקוטומיה הצדדית השמאלית (m-LLT) לחתכים באורך של 5 ס"מ ברצף ובנפרד במרחב האינטרקוסטלי השלישי והרביעי לחשיפה אידיאלית (איור 2B).
- יש לבצע את החתך לפחות 2 ס"מ היסט מעצם החזה כדי למנוע פגיעה בעורק החזה הפנימי השמאלי ובוורידים. יש להפסיק את מכונת ההנשמה למשך 10 שניות כדי למנוע פגיעה בריאה לפני פתיחת בית החזה.
- השתמשו בכמה גזוזים סטריליים כדי לדחוס את הריאה השמאלית לחשיפה טובה יותר של השדה הניתוחי לאחר הנחת מפזר צלעות (איור 2C). דמיינו את קרום הלב ואת התימוס בשדה הניתוח (איור 2D).
- מתחילים את כריתת קרום הלב בנקודת החיבור של קרום הלב והסרעפת וקוצרים את רקמת קרום הלב בין שני העצבים הפרניים, עד הוורידים המינויים, עד לסרעפת.
- דחיסת הריאה השמאלית כאמור בשלב 4.1.5 כדי לחשוף את החיבור של הצדר הסרעפתי-פריקרדיום-מדיאסטינלי. חותכים את הצדר המדיאסטינלי השמאלי בחיבור של הצדר הסרעפתי-קרום הלב-מדיאסטינלי על ידי ביצוע חתך באורך של 1 ס"מ באמצעות מספריים כירורגיים. הרחיבו את החתך כלפי מעלה לתוך הוורידים הנקובים לאורך הקו, שהם היסט של 1 ס"מ מהעצב הפרני השמאלי (איור 2E).
- חזור על ההליך עבור החלק הימני של קרום הלב על ידי הרמת הפסגה שמאלה באמצעות אצבעות. נתחו את השומן התימי והפריקרדיאלי מעצם החזה.
- פגוש את שני החתכים של קרום הלב מול אבי העורקים. לחצות את ההצטלבות של קרום הלב והתימוס משני החתכים הקרביים שלפני אבי העורקים על ידי החזקתם בחוזקה במקומם וקשירת שישה קשרים כירורגיים באופן ידני באמצעות תפר 4-0 שאינו ניתן לספיגה חוזרת.
- הימנע מפציעה של העצב הפראני והמבנים הווסקולריים הבסיסיים, בעת קצירת קרום הלב. לנתח רקמת שומן כולל התימוס מפני השטח של קרום הלב במהלך כריתת קרום הלב. השתמש בכלי צריבה (כלומר, אלקטרוטום, בובי) עבור המוסטזיס.
- מניחים את קרום הלב שנקטף על הצלחת הסטרילית עם קנה מידה של סנטימטר כדי להסיר את רקמת השומן הנוספת, ואז שוטפים אותה פעמיים ב-NaCl של 0.9% (איור 2F). בדוק שוב את כל האזורים הכירורגיים להמוסטאזיס.
- תפר את הצדר המדיאסטינלי הימני שנפתח לקצה הפריקרדיאלי הימני השיורי עם פולידיוקסנון 3-0 באופן רץ פעמיים. לנפח את הריאה הימנית לנפח הגדול ביותר באופן ידני באמצעות שקית נשימה ולהחזיק במשך 10 שניות לפני סגירת בית החזה הימני. תפר את הצדר המדיאסטינלי השמאלי שנפתח לקצה הקרבי השמאלי השיורי עם פולידיוקסנון 3-0 בצורה רצה פעמיים.
- סגור את החתכים החזיים השמאליים בארבע שכבות כמתואר להלן.
- תפר את השרירים האינטרקוסטליים ואת הסרטוס הקדמי עם 2- 0 פולידיוקסנון בצורה פשוטה של הפרעה או צלב, פקטורליס מז'ור-פקטורליס מינור עם 3-0 פולידיוקסנון בצורה רצה, הסובקוטיס עם 3-0 פולידיוקסנון בצורה צלבית, והעור עם 3-0 ניילון בצורה פשוטה ומופרעת. מניחים את כל התפרים במרווחים של 1 ס"מ.
- לנפח את הריאה השמאלית לנפח הגדול ביותר באופן ידני באמצעות בלון נשימה ולהחזיק במשך 10 שניות לפני סגירת השרירים הבין-כוכביים.
- מכסים את החתך בגאזה סטרילית ודוחסים אותה ידנית למשך 5 דקות כדי למנוע דימום לאחר הפריניזציה עבור השתלת מסתם הלב החדש. לאחר מכן לחבוש את האתר הכירורגי.
- יש להפסיק את ההרדמה התוך ורידית ואת האיזופלורן בעת ביצוע תפר העור כדי להפחית את עומק ההרגעה.
- הסר את צינורית הקיבה ואת קטטר השתן לאחר החזרת הנשימה הספונטנית. לאחר מכן מעבירים את הכבשים עם אוקסימטריית דופק לחדר ההתאוששות שעל האלונקה.
- הסר את הצינור האנדו-טרכאלי כאשר רפלקס הבליעה, הרפלקס הפפילרי והנשימה הספונטנית הרגילה מתאוששים. יש לתת 0.5 מ"ג/ק"ג מלוקסיקם תת עורי פעם ביום לפני ההשתלה.
- ברגע שההרדמה מתהפכת לחלוטין (כלומר, כאשר הכבשה מסוגלת לעמוד באופן עצמאי), ניתן לתת לכבשים גישה למזון ולמים.
5. הכנת מסתם הלב האוטולוגי התלת מימדי
- גזור את קרום הלב על-ידי הסרת רקמת השומן (איור 3A,B,C), ולאחר מכן הנח אותה על תבנית מסתם הלב המעצבת בתלת-ממד. (עקב בקשת פטנט תלויה ועומדת, לא ניתן לספק נתונים בשלב זה.)
- הכניסו את קרום הלב ואת מודל מסתם הלב לעיצוב תלת-ממדי לחממה עם קרוסלינקר לא רעיל (30 מ"ל) למשך יומיים ו-21 שעות (איור 3D; בשל בקשת הפטנט הממתינה, לא ניתן לספק בשלב זה נתונים ומידע מפורט של קרוסלינקר לא רעיל).
6. הכנת ה-APV
- שטפו את מסתם הלב המוצלב ב-0.9% NaCl פעמיים ותפרו אותו לסטנט ניטינול (בקוטר 30 מ"מ, גובה 29.4 מ"מ, 48 תאים רומביים) באופן רציף לאחר יומיים ו-21 שעות. השתמש בפוליפרופילן 5-0 כדי לתפור את מסתם הלב במקום באמצעות שישה עד שמונה קשרים כדי ליישר את נקודות החיבור בין מסתם הלב לסטנט. (עקב בקשת פטנט, לא ניתן לספק נתונים בשלב זה.)
- חתכו את שלושת הקצוות החופשיים של מסתם הריאה האוטולוגי עם להב כירורגי מס' 15 (איור 4A,B). החזיקו את מסתם הריאה עם פינצטה כירורגית, הרימו והשאירו את ה-APV ב-0.9% NaCl כדי לבדוק את הפתיחה והסגירה שלו ולהעריך אם שלושת הקומיסורים זקוקים לחיתוך נוסף כדי להשיג פתח גדול יותר של הפתח.
- דגירה של ה-APV באינקובטור למשך 30 דקות לצורך עיקור ב-47.6 מ"ל של PBS עם 0.8% אמפוטריצין B (0.4 מ"ל) ו-4.0% פניצילין/סטרפטומיצין (2 מ"ל). חתכו את מסתם הלב הסטנט לראש של מערכת אספקה (DS) באמצעות לחיצה מסחרית לבדיקה כפולה (איור 4C-D) והתאימו אותו למערכת הלידה (איור 4E).
7. השתלת מסתם ריאתי אוטולוגי טרנסקטטר דרך הווריד הג'וגולרי השמאלי
- הרדמה את הכבשים לצורך השתלת APV כפי שמודגם בשלבים 1 עד 3.
- גישה לכלי: לגלח את הכבשים ולעקר את השדה הכירורגי, הכולל עדיף על הגבול הנחות של המנדיבל, קדמית לקו החציוני הקדמי, בנחיתות מהגבול העליון של עצם הבריח השמאלית, ומאחור לקו החציוני האחורי באמצעות חומר חיטוי פובידון-יוד לפני ביצוע ההשתלה. מכסים את שאר האזורים הלא מגולחים והלא מגולחים עם וילונות סטריליים.
- סמן את הווריד הג'וגולרי השמאלי על הצוואר ובעזרת טכניקת סלדינגר מכניס את החוט המנחה לווריד הג'וגולרי השמאלי. הגדילו את נקודת הניקוב בעזרת להב מס' 10, הניחו נדן של 11 F לתוך הווריד הג'וגולרי השמאלי עבור מערכת הגשושית והמשלוחים של ICE (איור 5A,B). מניחים תפר מיתר ארנק סביב מציג הנדן עם תפר 4-0 שאינו נספג.
- אקוקרדיוגרפיה תוך לבבית (ICE)17
- בצעו ICE לפני ומיד אחרי ההשתלה באמצעות צנתר אולטרסאונד 10 Fr (איור 5C). בוחן את הפרמטרים הכוללים את הממדים והפונקציות של שסתום ה-NPV, ה-APV וה-tricuspid על ידי דו-ממד, צבע, גל פועם ודופלר רציף בציר הקצר והארוך.
- הערך את מידת הרגורגיטציה הערכית בחוזה הווריד על ידי הערכה כמותית למחצה18 באמצעות ICE (איור 6).
- אנגיוגרפיה19: בצע אנגיוגרפיה באמצעות זרוע C ניידת ומסך פונקציונלי כדי להנחות את ההשתלה על ידי מדידת הקוטרים של RVOT, NPV, נורת ריאות ועורק ריאתי על-חושי, כמו גם כדי להעריך את ה-APV לאחר ההשתלה (איור 7A-D).
- המודינמיקה20: למדוד ולרשום את לחץ העורקים בחדרים הימניים והריאות לפני ואחרי ההשתלה באמצעות צנתר צמה 5.2 F 145°. למדוד את הלחץ העורקי המערכתי דרך העורק האוריקולרי.
- השתלה
- הקמת מערכת ה-TPVR: הניחו את ה-guidewire הזוויתי בקוטר 0.035 אינץ' לעורק הריאתי הימני בהנחיית פלואורוסקופיה. לאחר מכן, מניחים צנתר צמה 5.2 Fr לתוך הווריד הג'וגולרי השמאלי ומקדמים אותו לתוך עורק הריאה הימני בהנחיית המדריך שהונח קודם לכן תחת פלואורוסקופיה.
- שלפו את ה-guidewire הזוויתי מתוך הווריד השמאלי. מניחים קטטר בלון אנגיוגרפי 5 Fr Berman לתוך הווריד הג'וגולרי השמאלי ומקדמים אותו לתוך עורק הריאה הימני באמצעות ההנחיה של המדריך.
- עצבו מראש את ה-guidewire האולטרה-נוקשה בקוטר 0.035 אינץ' לעיגול באורך של כ-8-10 ס"מ בקוטר השווה למרחק מהנקודה המרכזית של השסתום הטריקוספידי עד לנקודה המרכזית של שסתום הריאה על פי מדידת הפלואורוסקופיה, והקדמו אותו לעורק הריאתי הימני בהנחיית צנתר הבלון (איור 8A). ודא שהחוט אינו מפריע לשסתום הטריקוספידי.
- יש להרחיב את העור בלהב מס' 11 ולהרחיב את הווריד הג'וגולרי השמאלי באמצעות מרחיבים מסחריים מ-16 Fr עד 22 Fr ברצף (איור 8B). סגור את החתך עם תפר ארנק פולידיוקסנון 3-0 לאחר התרחבות (איור 8C). בצע אנגיוגרפיה כדי להבטיח את המיקום הרצוי של החלק נושא הסטנטים של ה- DS כמתואר בשנת19.
- סמן את הצומת הסינוטובולרי של המסתם הריאתי בשלבי הלב הדיאסטוליים והקצה-סיאסטוליים במהלך אנגיוגרפיה ריאתית כגבול הדיסטלי של אזור הנחיתה ואת המישור הבסיסי של מסתם הריאה כגבול הפרוקסימלי של אזור הנחיתה.
- פתח מחדש ובדוק את השסתום האוטולוגי הסטנט לאיתור נזקים הנגרמים על ידי לחיצה. צמצם מחדש את ה-APV והתאם אותו לראש ה-DS (איור 8D). קדמו את ה-DS הטעון דרך ה-guidewire המעוצב מראש דרך מערכת הזרימה החדרית הימנית (RVIT) וה-RVOT למצב NPV (איור 8E,F ואיור 9A).
- נסוגו מצינור הכיסוי של ה-DS ופרסו את ה-APV באיטיות ובאופן ישיר מעל ה-NPV באזור הנחיתה בסוף השלב הדיאסטולי בהנחיה פלואורוסקופית (איור 9A-C). יש לנקוט משנה זהירות כאשר DS טעון חוצה את הצומת בין ה-RVIT ל-RVOT על מנת למנוע פגיעה בשריר הלב ופרפור חדרים. המיקום האופטימלי עבור ה-APV הוא כאשר החלק האמצעי של הסטנט ממוקם על ה-NPV.
- נסוגו את קצה ה-DS בזהירות לתוך צינור הכיסוי לאחר הפריסה ושלפו את ה-DS מהכבשים (איור 9D). חזור על ICE (איור 6D-F), אנגיוגרפיה (איור 7C-D) ומדידות המודינמיות לאחר בדיקה של הממדים והתפקודים של ה-APV המושתל. סגור את החתך בצד שמאל של הצוואר עם תפר מיתר הארנק שהונח מראש ונדחס אותו ידנית.
8. תרופות פרי-השתלה
- לפני ההשתלה, תנו לכבשים עם הפרין במינון של 5000 יחב"ל כדי לשמור על זמן קרישה פעיל (ACT) של 240-300 שניות. השתמש בבדיקות ACT לאורך כל ההליך. חזור על בדיקות ACT כל 30 דקות לאחר תחילת ההליך כדי לאשר הן הפריניזציה מספקת לפני והן אנטגוניזציה לאחר ההשתלה.
- לפני השתלת APV, תנו 10% מגנזיום במינון של 0.02 מול/ל' ואמידרון במינון של 3-5 מ"ג/ק"ג למניעת הפרעות קצב לב.
- נהל סולבקטם/אמפיצילין (20 מ"ג/ק"ג) תוך ורידי כדי למנוע זיהום ואנדוקרדיטיס בתחילת הליך כריתת קרום הלב וההשתלה.
9. ניהול לאחר הניתוח
- בצע מעקב יומי לאחר הניתוח במשך 5 ימים, תוך בדיקת מצבה הכללי של הכבשה במונחים של קצב לב וקצב, עומק נשימה, קצב נשימה וצליל נשימה (לבדיקת דלקת ריאות לאחר הניתוח), סימני כאב וחריגות אחרות. בדוק את הפצע עבור נפיחות לאחר הניתוח, דלקת, אדמומיות, דימום, והפרשת.
- יש להמשיך בנוגדי קרישה במשך 5 ימים עם דלטאפרין 5000 יחב"ל או הפרין אחר במשקל מולקולרי נמוך הניתן באופן תת עורי פעם ביום. יש לתת 1 מ"ג/ק"ג מלוקסיקם על ידי הזרקה תת עורית לשיכוך כאבים לאחר הניתוח למשך 5 ימים.
- בצע בדיקת דם במעבדה, כולל המטולוגיה, תפקודי כבד, תפקוד כלייתי וכימיה בסרום כדי להעריך את מצבה הגופני של הכבשה.
10. מעקב
- בצע ICE, הדמיית תהודה מגנטית לבבית (cMRI), אנגיוגרפיה, ותעד המודינמיקה כל 3-6 חודשים לאחר ההשתלה במשך עד 21 חודשים. בצע ICE ואנגיוגרפיה כפי שהודגם לעיל.
- בצע cMRI כדי להעריך את שבר הרגורגיטציה (RF) בסורק MRI 3.0 T באמצעות שיטת cine-MRI סטנדרטית המגודרת באלקטרוקרדיוגרמה21. בצע טומוגרפיה ממוחשבת לבבית סופית (CT) כדי להעריך את מיקום הסטנט ואת העיוות של הלב הימני לאורך כל מחזור הלב כפי שהודגם במחקר הקודם שלנו22.
תוצאות
בכבשים J, APV (בקוטר 30 מ"מ) הושתלו בהצלחה ב"אזור הנחיתה "של ה- RVOT.
בכבשים J, ההמודינמיקה נשארה יציבה לאורך כל המיני-אורקוטומיה האנטרולטרלית השמאלית תחת הרדמה כללית עם אוורור, כמו גם במעקב MRI ו- ICE (טבלה 1, טבלה 2 וטבלה 3). קרום לב אוטולוגי בגודל 9 ס"מ על 9 ס"מ נקצר ונגזז על ידי הסרת רקמה נוספת (איור 3A-C). קרום הלב האוטולוגי הונח על תבנית העיצוב התלת-ממדית והוצלב באינקובטור עם קרוסלינקר לא רעיל למשך יומיים ו-21 שעות (איור 3D).
סטנט ניטינול הורכב על החלק החיצוני של קרום הלב המוצלב, ו-5-0 תפרים פוליפרופילן שימשו לתפירת הסטנט ומסתם הלב יחדיו באופן רציף. לאחר מכן נחתך מסתם הלב הסטנט (איור 4A-H).
ה-APV הוכנס לראשה של מערכת אספקה שתוכננה באופן עצמאי והתקדם לעמדת ה-NPV בהנחייתו של חוט הנחיה נוקשה. ה-APV נפרס בהצלחה ובאופן מלא במיקום ה-NPV הרצוי ללא כל שינוי המודינמי משמעותי (איור 8A-D).
הערכת ICE ואנגיוגרפיה מיד לאחר פריסת APV לא הראתה דליפה פראוולוולרית, שום אי-ספיקה של מסתם ריאתי חדש, או נדידת שסתומי ריאות של ה-APV (איור 6D-F).
הסטנט המושתל היה מעוגן במצב ממוקד ללא נדידה קדימה לעורק הריאה או אחורה ל-RV, על פי ה-CT הסופי. יתר על כן, זרימת הדם בעורק היורד הקדמי השמאלי (LAD) ובעורק ההיקף השמאלי (LCX) לא הושפעה מהסטנט לאורך כל מחזור הלב (איור 10).
ה-APV המושתל הדגים תפקוד חיובי והמודינמיקה במערכת הלב הימנית עם שבר רגורגיטציה של 5%-10% במעקב MRI ו-ICE (טבלה 3).
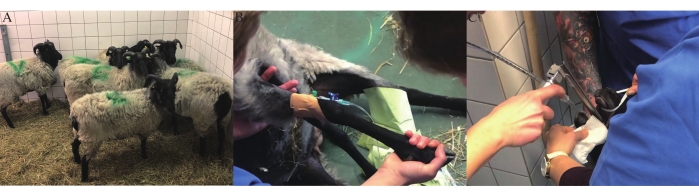
איור 1: הכנת בעלי חיים. (A) כבשים למחקר פרה-קליני. (B) מיקום צנתר IV בווריד הצפלי. (C) אינטובציה אורוטרכאלית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הליך כריתת קרום הלב. (B) סימן כירורגי במרחב האינטרקוסטלי השלישי/רביעי. (C) מיקום מגן צלעות לחשיפה. (ד) חשיפה של קרום הלב והתימוס. (E) כריתת קרום הלב. (F) קרום הלב שנקטף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
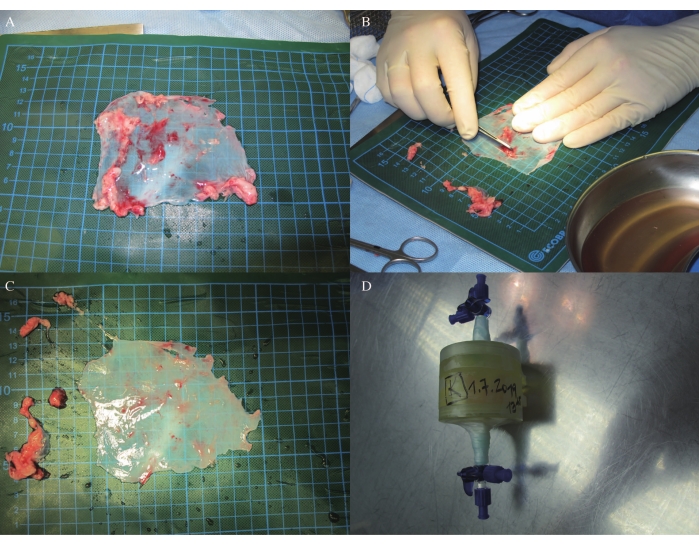
איור 3: זמירה של קרום הלב וקישורים צולבים. (D) קישור צולב פריקרדיאלי באינקובטור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
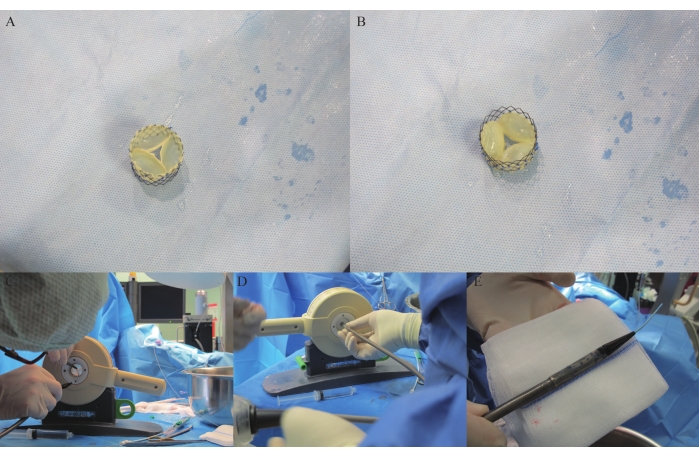
איור 4: סטנטים וטעינה של APV ב-DS. (A) APV סטנטים הנצפים מעורק הריאה. (B) APV סטנט שנצפה מה-RVOT. (ג-ד) APV סטיה נכלאת בקרמפר. (E) APV מכווץ במערכת המסירה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: הקמת גישה ל-TPVR דרך הווריד הג'וגולרי השמאלי. (A-B) מיקום נדן עבור בדיקה ומערכת אספקה של ICE דרך הווריד הג'וגולרי השמאלי. (C) הערכת ICE באמצעות וריד הג'וגולרי השמאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: הערכות ICE לפני ואחרי ההשתלה. (B) תפקוד מסתם ריאתי מקומי. (C) מהירות מסתם ריאתי מקומי, שיפוע לחץ (PG) ואינטגרל זמן מהירות (VTI). (D) גודל מסתם ריאתי אוטולוגי. (E) תפקוד מסתם ריאתי אוטולוגי. (F) מהירות מסתם ריאתי אוטולוגי, גרדיאנט לחץ (PG) ואינטגרל זמן מהירות (VTI). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 7: אנגיוגרפיה לפני ואחרי ההשתלה. (B) אנגיוגרפיה של עורק ריאתי לפני ההשתלה. (C) אנגיוגרפיה של עורק החדר והריאות בחדר הימני לאחר ההשתלה. (D) אנגיוגרפיה של עורק ריאתי לאחר ההשתלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
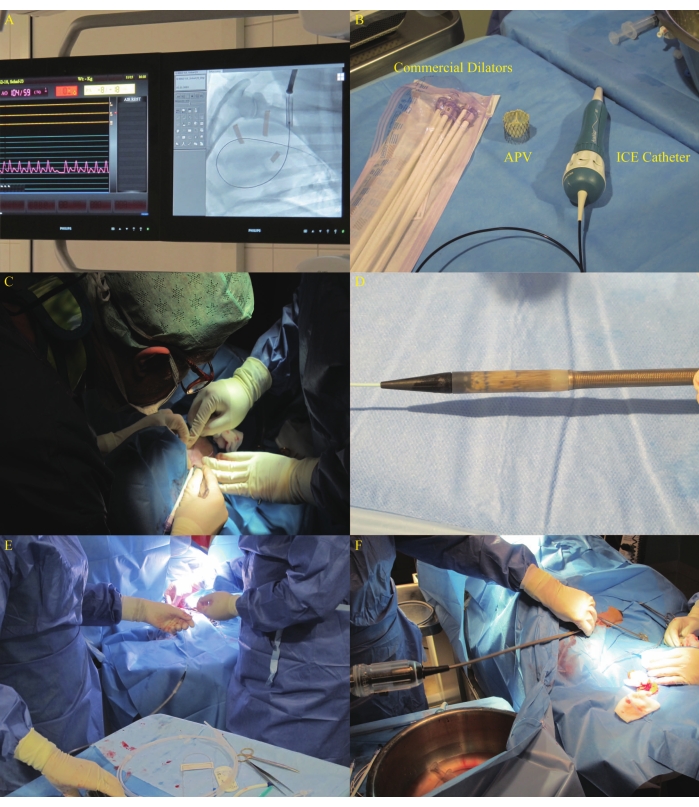
איור 8: התקדמות DS דרך הווריד הג'וגולרי השמאלי. (A) מיקום מדריך בעורק הריאתי הימני. (B) מרחיבים מסחריים המשמשים במחקר. (C) הרחבת החתך באמצעות מרחיבים בווריד הג'וגולרי השמאלי. (D) APV משוחזר שהותאם לראש ה-DS. (ה-ו-ו) קידום DS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
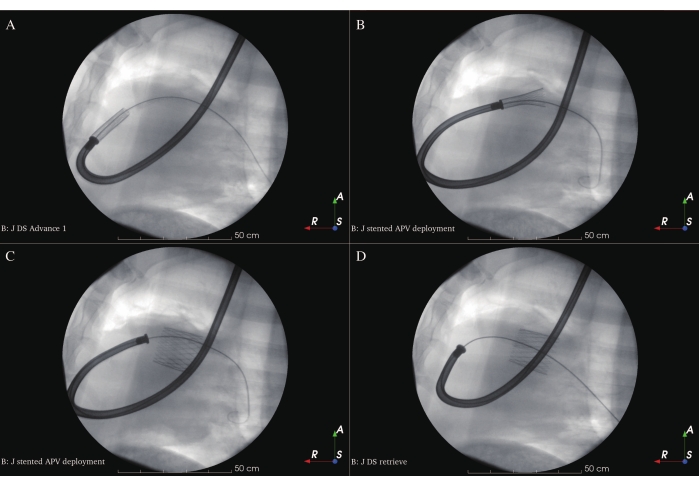
איור 9: פריסת APV סדורה. (B) פריסת APV בהתחלה. (C) פריסה כוללת של APV. (ד) שליפת DS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 10: הקשר בין עורק הריאה הסטנטי לבין העורק הכלילי השמאלי לאורך כל מחזור הלב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| ABP (mmHg) | ממוצע ABP (mmHg) | משאבי אנוש (/ דקות) | SpO2 (%) | |
| טרום השתלה | 129/104 | 115 | 98 | 98 |
| לאחר ההשתלה | 113/89 | 98 | 93 | 97 |
טבלה 1: המודינמיקה במהלך כריתת קרום הלב. הלחץ העורקי, קצב הלב וה-SpO2 של כבשה J במהלך כריתת קרום הלב נשארו יציבים.
| ABP (mmHg) | ממוצע ABP (mmHg) | RVP (mmHg) | ממוצע RVP (mmHg) | PaP (mmHg) | ממוצע PaP (mmHg) | משאבי אנוש (/ דקות) | |
| טרום השתלה | 108/61 | 74 | 11/ -7 | 0 | 13/0 | 3 | 70 |
| לאחר ההשתלה | 116/69 | 84 | 13/-9 | -3 | 10/-6 | 1 | 67 |
טבלה 2: המודינמיקה במהלך ההשתלה. הלחץ העורקי, הלחץ הריאתי, קצב הלב וה-SpO2 של Sheep J במהלך ההשתלה נשארו יציבים.
| MRI- שבר רגורגיטנטי (%) | לחץ חדר ימין (ממוצע) (mmHg) | לחץ עורק ריאתי (ממוצע) (mmHg) | לחץ ממשי שיטתי | |
| טרום השתלה | - | 11/-7 (0) | 13/0 (3) | 108/61 (74) |
| לאחר ההשתלה | - | 13/-9 (-3) | 10/-6 (1) | 116/69 (84) |
| מעקב 4 חודשים | 5 | - | - | - |
| מעקב 7 חודשים | 7 | 27/4 (11) | 23/11 (16) | - |
| מעקב 10 חודשים | 5 | - | - | - |
| מעקב 15 חודשים | 7 | 26/-2 (12) | 23/15 (18) | - |
| מעקב 18 חודשים | 10 | 26/12 (14) | 23/18 (20) | - |
| מעקב 21 חודשים | 6 | 20/-8 (16) | 19/6 (11) | - |
| קרח (PV) | PV Vmax (m/s) | PV maxPG (mmHg) | PV ממוצעPG (mmHg) | PR Vmax (m/s) | PR EROA (cm²) | נפח רגורגיטציה של יחסי ציבור (mL) |
| טרום השתלה | 0.71 | 2.01 | 1.06 | 0.76 | 0.25 | 1.7 |
| לאחר ההשתלה | 0.75 | 2.22 | 1.19 | 0.78 | 0.2 | 1 |
| מעקב 4 חודשים | - | - | - | - | - | - |
| מעקב 7 חודשים | 0.8 | 2.58 | 1.12 | 0.94 | 0.2 | 3 |
| מעקב 10 חודשים | - | - | - | - | - | - |
| מעקב 15 חודשים | 1.08 | 4.64 | 1.76 | - | 0.3 | 1 |
| מעקב 18 חודשים | 0.75 | 2.22 | 0.97 | 0.87 | 0.3 | 1 |
| מעקב 21 חודשים | 0.61 | 1.46 | 0.61 | 0.53 | 0.1 | 1 |
| PV: שסתום ריאתי | PG: שיפוע לחץ | EROA: אזור פתח רגורגיטציה יעיל | יח"צ: פולמואנרי regurgitation |
| ICE (טלוויזיה) | טלוויזיה Vmax (m/s) | טלוויזיה maxPG (mmHg) | טלוויזיה ממוצעתPG (mmHg) | TR Vmax (m/s) |
| טרום השתלה | - | - | - | - |
| לאחר ההשתלה | 0.56 | 1.27 | 0.48 | 0.83 |
| מעקב 4 חודשים | - | - | - | - |
| מעקב 7 חודשים | 0.99 | 3.92 | 1.68 | 0.84 |
| מעקב 10 חודשים | - | - | - | - |
| מעקב 15 חודשים | 0.95 | 3.6 | 1.47 | 1.04 |
| מעקב 18 חודשים | 0.95 | 3.6 | 1.47 | 1.03 |
| מעקב 21 חודשים | 0.94 | 3.56 | 1.31 | 0.95 |
| טלוויזיה: שסתום טריקוספיד |
טבלה 3: נתוני מעקב של MRI ו-ICE. נעשה מעקב של 21 חודשים עם MRI וחלק הרגורגיטציה של מסתם הריאתי האוטולוגי מכבשים J נמצא בין 5% ל -10%, מה שהראה תפקוד מסתם חיובי. האקוקרדיוגרפיה התוך-לבבית של כבשה J הראתה כי במסתם הריאתי האוטולוגי היו רק 1 מ"ל עד 3 מ"ל של נפח רגורגיטציה עם תפקוד מסתם טריקוספידי תקין.
Discussion
מחקר זה מייצג צעד חשוב קדימה בפיתוח שסתום ריאתי חי עבור TPVR. במודל של כבשה בוגרת, השיטה הצליחה להראות כי ניתן להשתיל APV שמקורו בקרום הלב של הכבשה עצמה עם סטנט ניטינול הניתן להרחבה עצמית באמצעות צנתור ורידים ג'וגולריים. בכבשה J, מסתם הריאה האוטולוגי הסטנט הוטולוגי הושתל בהצלחה בתנוחה הריאתית הנכונה באמצעות מערכת אספקה אוניברסלית שתוכננה על ידי עצמה. לאחר ההשתלה, מסתם הלב של כבשה J הראה פונקציונליות טובה עד 21 חודשים, ושימש לא רק כראיה פרה-קלינית בטוחה ויעילה לניסוי הפרה-קליני העתידי עם מסתם ריאתי אוטולוגי בכבשים לא בוגרות, אלא גם לתרגום למסגרת הקלינית.
TPVR-AVP באמצעות צנתור ורידים ג'וגולרי במודל כבשה בוגרת
בשל הדמיון האנטומי וההמודינמי עם בני אדם, כבשים בוגרות הן אחד המודלים הפופולריים והנפוצים ביותר של בעלי חיים גדולים במחקרים רבים המעריכים את הפונקציונליות והביצועים של מסתמי לב ביו-פרוסטטיים23,24. עבור צנתור והשתלה, הגישה הוורידית הטרנס-ג'וגלרית מקבלת עדיפות על פני הווריד הטרנס-פמורלי, הדורש פרופיל גדול יותר של מערכת הלידה וקשור לניהול קשה יותר במהלך ההשתלה ולאחריה. ניתן להעביר את ה-APV באמצעות חדר ימין-שסתום אטריום-טריקוספיד SVC-ימין למצב ריאתי עם מרחק קצר יותר וזווית גדולה יותר בין ה-SVC-RA בהשוואה ל-IVC-RA, מה שעשוי להקל על קידום מערכת המסירה הטעונה לתוך ה-RV.
כריתת קרום הלב
קרום הלב האוטולוגי בגודל 9 ס"מ על 9 ס"מ מכבשים J נקטף ללא פגיעה בעצב הפרני והותיר את עורק החזה הפנימי והוורידים. הכבשים לא סבלו מעוויתות סרעפתיות, אי ספיקה נשימתית או סיבוכים מדממים לאחר המיני-אורקוטומיה. בשל הרווח הצר בין הצלעות בכבשים, היה קשה להשיג את החשיפה הרצויה של קרום הלב במיניתורקוטומיה, במיוחד במהלך כריתת קרום הלב. לכן, יש לנקוט משנה זהירות במהלך כריתת רקמות כדי למנוע פגיעה בשורשי אבי העורקים והריאות, העורק הכלילי והעצב הפראני25. ההרדמה הכללית נשמרה עם איזופלורן, פנטניל ומידזולם ללא מרפי שרירים לתחייה מוקדמת ולהמודינמיקה יציבה. עם זאת, אם המטופלים עברו כריתת קרום הלב ו / או פריקרדיוטומיה במהלך ניתוחים קודמים, ישנן מגבלות לביצוע בית החזה לרכישת קרום הלב. ראשית, זה יכול להוביל לדימום בלתי נשלט בשל התפרים שהונחו במהלך הפעולות הקודמות בעת גיוס קרום הלב מול אבי העורקים העולה, גזע ריאתי, עורקים כליליים כמו גם שריר הלב. בנוסף, קרום הלב לא יכול היה להספיק לייצור מסתם לב אוטולוגי, הזקוק לגודל רקמה של לפחות 9 ס"מ על 9 ס"מ עבור מסתם לב בקוטר 30 מ"מ. יתר על כן, ייתכן שאיכות קרום הלב לא תעמוד בדרישה של מסתם הלב החדש. גם אם קרום הלב שנקטף מספיק עבור מסתם לב אוטולוגי אחד, המוסטזיס באזור הניתוח קשה מאוד לאחר הפריניזציה השיטתית לפני ה- TPVR. במצבים אלה, רקטוס פאשיה, fascia Lata ו- transversalis fascia יכולים להיות מועמדים לקצירת הרקמה האוטולוגית של מסתם הלב.
השתלה
לפני טעינת ה- APV הסטנט לתוך מערכת המסירה, יש לכווץ אותו ב- crimper מסחרי לבדיקה. הסטנט היה מתארך בעד 10% במהלך ההצמדה, מה שעלול להוביל לקרע הקשור ללחץ ברוב נקודות התפירה של העלונים והחיבורים של הקומיסורים. ב-Sheep J נבדק שסתום סטנט בקוטר 30 מ"מ והועמס לתוך מערכת אספקה של 26 Fr באמצעות קרע ללא קרע ואובדן תפר. מכשיר קטן (כולל APV סטנט) ומערכת אספקה יועילו מבחינת התאמת הווריד הג'וגולרי, במיוחד לילדים. מזעור של מכשיר ה- TPVR יאפשר בטיחות פריאופרטיבית טובה יותר בהשתלות טרנס-פמורליות עתידיות.
בהתבסס על ניסיון קודם, מטוס ה-PV נע כ-2 ס"מ בכל מחזור לב, מה שהיווה אתגר גדול בעת פריסת ה-APV במיקום הנכון. בנוסף, לכבשים הבריאות לא היו ציוני דרך ברורים כמו הסתיידות באזור הנחיתה, המתרחשת בדרך כלל במקרה של חולים אנושיים, מה שמקשה על מיקום מדויק. יתר על כן, בשל הכוח הרדיאלי, סטנט הניטינול הניתן להרחבה עצמית קפץ ממערכת הלידה או אפילו לתוך עורק הריאה כאשר כ-2/3 מהסטנט נחשף ברגע שהצינור החיצוני נסוג. יש צורך בעידונים נוספים של מערכת הסטנטים וההובלה עם ארכיטקטורות מיקום מחדש כדי לשלוט טוב יותר בפריסה במקרה של מיקום שגוי וכאשר משיכת ה-APV הסטנט לתוך הצינור. בכבשה J, ה- APV הושתל במיקום הנכון בעזרת מערכת האספקה, אשר תפקדה בצורה מצוינת ללא סטיות או קפיצות סטנט.
מעקב על ידי MRI, ICE ו- CT סופי
ה-APV המושתל הראה תפקוד מסתם חיובי עם שבר רגורגיטציה של 5%-10% ב-MRI, המודינמיקה יציבה ב-ICE, ותנוחת עיגון רצויה עם קשרי שכנות לעורק הכלילי השמאלי לאורך כל מחזור הלב במעקבים הארוכים. תוצאות מחקר זה סיפקו ראיות חזקות לביצועים המקרוסקופיים היציבים של APV סטנט, אשר יכול להביא תועלת לחולים הסובלים מ- RVOT לא מתפקד.
בניסויים גדולים בבעלי חיים, תפקוד לקוי של וולבולרי הוכח על ידי שיפוץ שסתומים שגוי, הכולל דלמינציה, עיבוי עלונים, נסיגת עלונים ואי סדרים26,27. על פי התקנים הנוכחיים של ארגון התקינה הבינלאומי (ISO) עבור תותבות מסתמי לב במחזור לחץ נמוך, regurgitation מסתם הלב של עד 20% מקובל. בהתחשב בתהליך הייצור של APV, גיאומטריית השסתומים עם עיצוב תלת מימדי היא גורם המפתח להשגת תוצאה חיובית במאמר זה. בנוסף, גיאומטריית השסתום, תכונות החומר ותנאי הטעינה ההמודינמיים יכולים לקבוע את פונקציונליות השסתום ואת שיפוץ26. ה-APV ביצע ביצועים קרובים מאוד ל-NPV, עם אי-ספיקה ערכית מינימלית שהוערך על ידי ICE מיד לאחר ההשתלה.
מסקנה
במחקר הגדול בבעלי חיים שדווח כאן, שמנו לנו למטרה ליצור ולבדוק שיטה להשתלת ורידים טרנס-ג'וגולריים של שסתום ריאתי אוטולוגי המורכב על סטנט ניטינול הניתן להרחבה עצמית. APV הושתל בהצלחה ב-Sheep J באמצעות מתודולוגיה זו ומערכת אספקה שתוכננה בעצמה. רכבי השטח עמדו בלחץ במהלך לחיצה, טעינה ופריסה והשיגו את פונקציונליות השסתומים הרצויה.
מחקר זה הדגים את ההיתכנות והבטיחות במעקב ארוך שנים של פיתוח APV להשתלה בתנוחת NPV עם סטנט ניטינול הניתן להרחבה עצמית באמצעות צנתור ורידים ג'וגולריים במודל כבשים בוגרות.
מגבלות
מחקר פרה-קליני זה הציג מגבלות רבות שלא ניתן היה לטפל בהן במלואן בשל מספר הכבשים הקטן. סטנט ניטינול ומערכת המסירה ששימשה במחקר זה חסרו ארכיטקטורות למיקום מחדש; זה יצטרך להיות מעודן לניסויים עתידיים בבעלי חיים. בנוסף, יהיה מעניין להעריך את הפונקציונליות של ה- APV מעבר לתקופת המחקר כדי לחקור עוד יותר את הביצועים והיווצרות העלונים לאחר שנה לפחות של מעקב לאחר ההשתלה. יתר על כן, יש לשפר את מערכת האספקה עם פרופיל נמוך ותכונת תנועה גמישה כדי למנוע הפרעות קצב ופציעה בשריר הלב במהלך ההשתלה. עדיין יש צורך לפתח סטנט מתכלה המאפשר צמיחת APV אצל ילדים כדי למנוע את הצורך בתחליפי מסתמי לב מרובים.
Disclosures
למחברים אין ניגודי עניינים כספיים לחשוף.
Acknowledgements
אנו מביעים את הערכתנו מקרב לב לכל מי שתרם לעבודה זו, הן בעבר והן בהווה. עבודה זו נתמכה על ידי מענקים מהמשרד הפדרלי הגרמני לענייני כלכלה ואנרגיה, EXIST - העברת מחקר (03EFIBE103). Yimeng Hao נתמך על ידי מועצת המלגות של סין (CSC: 202008450028).
Materials
| Name | Company | Catalog Number | Comments |
| 10 % Magnesium | Inresa Arzneimittel GmbH | PZN: 00091126 | 0.02 mol/ L, 10X10 ml |
| 10 Fr Ultrasound catheter | Siemens Healthcare GmbH | SKU 10043342RH | ACUSON AcuNav™ ultrasound catheter |
| 3D Slicer | Slicer | Slicer 4.13.0-2021-08-13 | Software: 3D Slicer image computing platform |
| Adobe Illustrator | Adobe | Adobe Illustrator 2021 | Software |
| Amiodarone | Sanofi-Aventis Deutschland GmbH | PZN: 4599382 | 3- 5 mg/ kg, 150 mg/ 3 ml |
| Amplatz ultra-stiff guidewire | COOK MEDICAL LLC, USA | Reference Part Number:THSF-35-145-AUS | 0.035 inch, 145 cm |
| Anesthetic device platform | Drägerwerk AG & Co. KGaA | 8621500 | Dräger Atlan A350 |
| ARROW Berman Angiographic Balloon Catheter | Teleflex Medical Europe Ltd | LOT: 16F16M0070 | 5Fr, 80cm (X) |
| Butorphanol | Richter Pharma AG | Vnr531943 | 0.4mg/kg |
| C-Arm | BV Pulsera, Philips Heathcare, Eindhoven, The Netherlands | CAN/CSA-C22.2 NO.601.1-M90 | Medical electral wquipment |
| Crimping tool | Edwards Lifesciences, Irvine, CA, USA | 9600CR | Crimper |
| CT | Siemens Healthcare GmbH | − | CT platform |
| Dilator | Edwards Lifesciences, Irvine, CA, USA | 9100DKSA | 14- 22 Fr |
| Ethicon Suture | Ethicon | LOT:MKH259 | 4- 0 smooth monophilic thread, non-resorbable |
| Ethicon Suture | Ethicon | LOT:DEE274 | 3-0, 45 cm |
| Fast cath hemostasis introducer | ST. JUDE MEDICAL Minnetonka MN | LOT Number: 3458297 | 11 Fr |
| Fentanyl | Janssen-Cilag Pharma GmbH | DE/H/1047/001-002 | 0.01mg/kg |
| Fragmin | Pfizer Pharma GmbH, Berlin, Germany | PZN: 5746520 | Dalteparin 5000 IU/ d |
| Functional screen | BV Pulsera, Philips Heathcare, Eindhoven, The Netherlands | System ID: 44350921 | Medical electral wquipment |
| Glycopyrroniumbromid | Accord Healthcare B.V | PZN11649123 | 0.011mg/kg |
| Guide Wire M | TERUMO COPORATION JAPAN | REF*GA35183M | 0.89 mm, 180 cm |
| Hemochron Celite ACT | International Technidyne Corporation, Edison, USA | NJ 08820-2419 | ACT |
| Heparin | Merckle GmbH | PZN: 3190573 | Heparin-Natrium 5.000 I.E./0,2 ml |
| Hydroxyethyl starch (Haes-steril 10 %) | Fresenius Kabi Deutschland GmbH | ATC Code: B05A | 500 ml, 30 ml/h |
| Imeron 400 MCT | Bracco Imaging | PZN00229978 | 2.0–2.5 ml/kg, Contrast agent |
| Isoflurane | CP-Pharma Handelsges. GmbH | ATCvet Code: QN01AB06 | 250 ml, MAC: 1 % |
| Jonosteril Infusionslösung | Fresenius Kabi Deutschland GmbH | PZN: 541612 | 1000 ml |
| Ketamine | Actavis Group PTC EHF | ART.-Nr. 799-762 | 2–5 mg/kg/h |
| Meloxicam | Boehringer Ingelheim Vetmedica GmbH | M21020A-09 | 20 mg/ mL, 50 ml |
| Midazolam | Hameln pharma plus GMBH | MIDAZ50100 | 0.4mg/kg |
| MRI | Philips Healthcare | − | Ingenia Elition X, 3.0T |
| Natriumchloride (NaCl) | B. Braun Melsungen AG | PZN /EAN:04499344 / 4030539077361 | 0.9 %, 500 ml |
| Pigtail catheter | Cordis, Miami Lakes, FL, USA | REF: 533-534A | 5.2 Fr 145 °, 110 cm |
| Propofol | B. Braun Melsungen AG | PZN 11164495 | 20mg/ml, 1–2.5 mg/kg |
| Propofol | B. Braun Melsungen AG | PZN 11164443 | 10mg/ml, 2.5–8.0 mg/kg/h |
| Safety IV Catheter with Injection port | B. Braun Melsungen AG | LOT: 20D03G8346 | 18 G Catheter with Injection port |
| Sulbactam- ampicillin | Pfizer Pharma GmbH, Berlin, Germany | PZN: 4843132 | 3 g, 2.000 mg/ 1.000 mg |
| Sulbactam/ ampicillin | Instituto Biochimico Italiano G Lorenzini S.p.A. – Via Fossignano 2, Aprilia (LT) – Italien | ATC Code: J01CR01 | 20 mg/kg, 2 g/1 g |
| Surgical Blade | Brinkmann Medical ein Unternehmen der Dr. Junghans Medical GmbH | PZN: 354844 | 15 # |
| Surgical Blade | Brinkmann Medical ein Unternehmen der Dr. Junghans Medical GmbH | PZN: 354844 | 11 # |
| Suture | Johnson & Johnson | Hersteller Artikel Nr. EH7284H | 5-0 polypropylene |
References
- Bonhoeffer, P., et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet. 356 (9239), 1403-1405 (2000).
- Georgiev, S., et al. Munich comparative study: Prospective long-term outcome of the transcatheter melody valve versus surgical pulmonary bioprosthesis with up to 12 years of follow-up. Circulation. Cardiovascualar Interventions. 13 (7), 008963 (2020).
- Plessis, J., et al. Edwards SAPIEN transcatheter pulmonary valve implantation: Results from a French registry. JACC. Cardiovascular Interventions. 11 (19), 1909-1916 (2018).
- Bergersen, L., et al. Harmony feasibility trial: Acute and short-term outcomes with a self-expanding transcatheter pulmonary valve. JACC. Cardiovascular Interventions. 10 (17), 1763-1773 (2017).
- Cabalka, A. K., et al. Transcatheter pulmonary valve replacement using the melody valve for treatment of dysfunctional surgical bioprostheses: A multicenter study. The Journal of Thoracic and Cardiovascular Surgery. 155 (4), 1712-1724 (2018).
- Shahanavaz, S., et al. Transcatheter pulmonary valve replacement with the sapien prosthesis. Journal of the American College of Cardiology. 76 (24), 2847-2858 (2020).
- Motta, S. E., et al. Human cell-derived tissue-engineered heart valve with integrated Valsalva sinuses: towards native-like transcatheter pulmonary valve replacements. NPJ Regenerative Medicine. 4, 14 (2019).
- Uiterwijk, M., Vis, A., de Brouwer, I., van Urk, D., Kluin, J. A systematic evaluation on reporting quality of modern studies on pulmonary heart valve implantation in large animals. Interactive Cardiovascular Thoracic Surgery. 31 (4), 437-445 (2020).
- Duran, C. M., Gallo, R., Kumar, N. Aortic valve replacement with autologous pericardium: surgical technique. Journal of Cardiac Surgery. 10 (1), 1-9 (1995).
- Sá, M., et al. Aortic valve neocuspidization with glutaraldehyde-treated autologous pericardium (Ozaki Procedure) - A promising surgical technique. Brazilian Journal of Cardiovascular Surgery. 34 (5), 610-614 (2019).
- Karamlou, T., Pettersson, G., Nigro, J. J. Commentary: A pediatric perspective on the Ozaki procedure. The Journal of Thoracic and Cardiovascular Surgery. 161 (5), 1582-1583 (2021).
- Mazine, A., et al. Ross procedure in adults for cardiologists and cardiac surgeons: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (22), 2761-2777 (2018).
- Kwak, J. G., et al. Long-term durability of bioprosthetic valves in pulmonary position: Pericardial versus porcine valves. The Journal of Thoracic and Cardiovascular Surgery. 160 (2), 476-484 (2020).
- Ou-Yang, W. B., et al. Multicenter comparison of percutaneous and surgical pulmonary valve replacement in large RVOT. The Annals of Thoracic Surgery. 110 (3), 980-987 (2020).
- Reimer, J., et al. Implantation of a tissue-engineered tubular heart valve in growing lambs. Annals of Biomedical Engineering. 45 (2), 439-451 (2017).
- Schmitt, B., et al. Percutaneous pulmonary valve replacement using completely tissue-engineered off-the-shelf heart valves: six-month in vivo functionality and matrix remodelling in sheep. EuroIntervention. 12 (1), 62-70 (2016).
- Whiteside, W., et al. The utility of intracardiac echocardiography following melody transcatheter pulmonary valve implantation. Pediatric Cardiology. 36 (8), 1754-1760 (2015).
- Lancellotti, P., et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. European Heart Journal. Cardiovascular Imaging. 14 (7), 611-644 (2013).
- Kuang, D., Lei, Y., Yang, L., Wang, Y. Preclinical study of a self-expanding pulmonary valve for the treatment of pulmonary valve disease. Regenerative Biomaterials. 7 (6), 609-618 (2020).
- Arboleda Salazar, R., et al. Anesthesia for percutaneous pulmonary valve implantation: A case series. Anesthesia and Analgesia. 127 (1), 39-45 (2018).
- Cho, S. K. S., et al. Feasibility of ventricular volumetry by cardiovascular MRI to assess cardiac function in the fetal sheep. The Journal of Physiology. 598 (13), 2557-2573 (2020).
- Sun, X., et al. Four-dimensional computed tomography-guided valve sizing for transcatheter pulmonary valve replacement. Journal of Visualized Experiments: JoVE. (179), e63367 (2022).
- Knirsch, W., et al. Establishing a pre-clinical growing animal model to test a tissue engineered valved pulmonary conduit. Journal of Thoracic Disease. 12 (3), 1070-1078 (2020).
- Zhang, X., et al. Tissue engineered transcatheter pulmonary valved stent implantation: current state and future prospect. International Journal of Molecular Sciences. 23 (2), 723 (2022).
- Al Hussein, H., et al. Challenges in perioperative animal care for orthotopic implantation of tissue-engineered pulmonary valves in the ovine model. Tissue Engineering and Regenerative Medicine. 17 (6), 847-862 (2020).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Schmidt, D., et al. Minimally-invasive implantation of living tissue engineered heart valves: . a comprehensive approach from autologous vascular cells to stem cells. Journal of the American College of Cardiology. 56 (6), 510-520 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved