Method Article
Transkatheter-Pulmonalklappenersatz aus autologem Perikard mit einem selbstexpandierenden Nitinol-Stent in einem erwachsenen Schafmodell
In diesem Artikel
Zusammenfassung
Diese Studie zeigt die Machbarkeit und Sicherheit der Entwicklung einer autologen Pulmonalklappe für die Implantation an der nativen Pulmonalklappenposition unter Verwendung eines selbstexpandierbaren Nitinol-Stents in einem erwachsenen Schafmodell. Dies ist ein Schritt zur Entwicklung eines Transkatheter-Pulmonalklappenersatzes für Patienten mit Dysfunktion des rechtsventrikulären Ausflusstraktes.
Zusammenfassung
Der Transkatheter-Pulmonalklappenersatz hat sich als praktikabler alternativer Ansatz für Patienten mit rechtsventrikulärem Ausflusstrakt oder bioprothetischer Klappenfunktionsstörung mit ausgezeichneten frühen und späten klinischen Ergebnissen etabliert. Klinische Herausforderungen wie Verschlechterung der Herzklappe mit Stented, Koronarverschluss, Endokarditis und andere Komplikationen müssen jedoch für die lebenslange Anwendung angegangen werden, insbesondere bei pädiatrischen Patienten. Um die Entwicklung einer lebenslangen Lösung für Patienten zu erleichtern, wurde der autologe Pulmonalklappenersatz des Transkatheters in einem erwachsenen Schafmodell durchgeführt. Das autologe Perikard wurde von den Schafen über die linksanterolaterale Minithorakotomie unter Vollnarkose mit Beatmung geerntet. Das Perikard wurde für 2 Tage und 21 Stunden auf ein 3D-formendes Herzklappenmodell zur ungiftigen Vernetzung gelegt. Intrakardiale Echokardiographie (ICE) und Angiographie wurden durchgeführt, um die Position, Morphologie, Funktion und Abmessungen der nativen Pulmonalklappe (NPV) zu beurteilen. Nach dem Trimmen wurde das vernetzte Perikard auf einen selbstexpandierbaren Nitinol-Stent genäht und in ein selbst entwickeltes Abgabesystem gecrimpt. Die autologe Pulmonalklappe (APV) wurde an der NPV-Position mittels Linksjugularvenenkatheterisierung implantiert. ICE und Angiographie wurden wiederholt, um die Position, Morphologie, Funktion und Abmessungen des APV zu bewerten. Ein APV wurde erfolgreich in Schaf J implantiert. In dieser Arbeit wurde Schaf J ausgewählt, um repräsentative Ergebnisse zu erzielen. Ein 30-mm-APV mit einem Nitinol-Stent wurde ohne signifikante hämodynamische Veränderung genau an der NPV-Position implantiert. Es gab kein paravalvuläres Leck, keine neue Pulmonalklappeninsuffizienz oder Stent-Pulmonalklappenmigration. Diese Studie zeigte die Machbarkeit und Sicherheit in einem langfristigen Follow-up der Entwicklung eines APV für die Implantation an der NPV-Position mit einem selbstexpandierbaren Nitinol-Stent über die Halsvenenkatheterisierung in einem erwachsenen Schafmodell.
Einleitung
Bonhoeffer et al.1 markierten den Beginn des Transkatheter-Pulmonalklappenersatzes (TPVR) im Jahr 2000 als eine schnelle Innovation mit signifikanten Fortschritten bei der Minimierung von Komplikationen und der Bereitstellung eines alternativen therapeutischen Ansatzes. Seitdem hat die Verwendung von TPVR zur Behandlung des rechtsventrikulären Ausflusstraktes (RVOT) oder der bioprothetischen Klappendysfunktion rapide zugenommen 2,3. Bis heute haben die derzeit auf dem Markt erhältlichen TPVR-Geräte zufriedenstellende Langzeit- und Kurzzeitergebnisse für Patienten mit RVOT-Dysfunktion geliefert 4,5,6. Darüber hinaus werden verschiedene Arten von TPVR-Klappen, einschließlich dezellularisierter Herzklappen und stammzellgetriebener Herzklappen, entwickelt und bewertet, und ihre Machbarkeit wurde in präklinischen Großtiermodellennachgewiesen 7,8. Die Aortenklappenrekonstruktion mit einem autologen Perikard wurde zuerst von Dr. Duran berichtet, für die drei aufeinanderfolgende Ausbuchtungen unterschiedlicher Größe als Vorlagen verwendet wurden, um die Formgebung des Perikards entsprechend den Abmessungen des Aortenrings zu steuern, mit einer Überlebensrate von 84,53% bei der Nachbeobachtung von 60 Monaten9. Das Ozaki-Verfahren, das eher als Ventilreparaturverfahren als als Ventilersatzverfahren betrachtet wird, beinhaltet das Ersetzen von Aortenklappenblättern durch das mit Glutaraldehyd behandelte autologe Perikard; Im Vergleich zu Dr. Durans Verfahren verbesserte es sich jedoch signifikant bei der Messung des erkrankten Ventils mit einer Vorlage zum Schneiden von festem Perikard10 und zufriedenstellende Ergebnisse wurden nicht nur bei den erwachsenen, sondern auch bei pädiatrischen Fällen11 erzielt. Derzeit kann nur das Ross-Verfahren einen lebenden Klappenersatz für den Patienten mit einer erkrankten Aortenklappe mit offensichtlichen Vorteilen in Bezug auf die Vermeidung einer langfristigen Antikoagulation, des Wachstumspotenzials und des geringen Risikos einer Endokarditisbieten 12. Aber Re-Interventionen können für das pulmonale Autotransplantat und den rechten Ventrikel zu Lungenarterie-Conduit nach einem so komplexen chirurgischen Eingriff erforderlich sein.
Die derzeitigen bioprothetischen Klappen, die für den klinischen Einsatz zur Verfügung stehen, werden im Laufe der Zeit aufgrund von Graft-versus-Host-Reaktionen auf das xenogene Schweine- oder Rindergewebe unweigerlich abgebaut13. Klappenbedingte Verkalkung, Abbau und Insuffizienz könnten nach mehreren Jahren wiederholte Eingriffe erforderlich machen, insbesondere bei jungen Patienten, die sich in ihrem Leben aufgrund des mangelnden Wachstums der Klappen einem multiplen Pulmonalklappenersatz unterziehen müssten, eine Eigenschaft, die den derzeitigen bioprothetischen Materialieninnewohnt 14. Darüber hinaus weisen die derzeit verfügbaren, im Wesentlichen nicht regenerativen TPVR-Ventile große Einschränkungen wie thromboembolische und blutende Komplikationen sowie eine begrenzte Haltbarkeit aufgrund eines nachteiligen Gewebeumbaus auf, der zu einer Retraktion der Packungsbeilage und einer universellen Klappenfunktionsstörung führen könnte15,16.
Es wird die Hypothese aufgestellt, dass die Entwicklung einer nativen autologen Pulmonalklappe (APV), die auf einem selbstexpandierenden Nitinol-Stent für TPVR mit den Eigenschaften Selbstreparatur, Regeneration und Wachstumskapazität montiert ist, die physiologische Leistung und langfristige Funktionalität sicherstellen würde. Und das mit dem ungiftigen Vernetzer behandelte autologe Perikard kann aus den Ernte- und Herstellungsverfahren erwachen. Zu diesem Zweck wurde diese präklinische Studie durchgeführt, um eine autologe Pulmonalklappe mit Stented in ein erwachsenes Schafmodell zu implantieren, mit dem Ziel, ideale interventionelle Klappenersatzstoffe und eine risikoarme Verfahrensmethodik zur Verbesserung der Transkathetertherapie von RVOT-Dysfunktion zu entwickeln. In dieser Arbeit wurde Schaf J ausgewählt, um das umfassende TPVR-Verfahren einschließlich Perikardiektomie und transjugulärer Venenimplantation einer autologen Herzklappe zu veranschaulichen.
Protokoll
Diese präklinische Studie wurde vom Rechts- und Ethikausschuss des Landesamtes für Gesundheit und Soziales, Berlin (LAGeSo), genehmigt. Alle Tiere (Eierstöcke) erhielten eine humane Pflege nach den Richtlinien der Europäischen und Deutschen Labortierwissenschaftlichen Gesellschaft (FELASA, GV-SOLAS). Das Verfahren wird veranschaulicht, indem ein autologer Pulmonalklappenersatz bei einem 3-jährigen, 47 kg schweren, weiblichen Schaf J durchgeführt wird.
1. Präoperative Geschäftsführung
- Unterbringe alle Versuchsschafe im selben Raum mit Stroh für 1 Woche vom Tag der Ankunft bis zum Tag der Perikardiektomie, um die soziale Kameradschaft aufrechtzuerhalten (Abbildung 1A).
- Entziehen Sie den Schafen vor der Perikardiektomie und Implantation 12 Stunden lang Nahrung, aber kein Wasser.
- Die Schafe werden 20 Minuten vor der Intubation mit einer intramuskulären Injektion von Midazolam (0,4 mg/kg), Butorphanol (0,4 mg/kg) und Glykopyrrolat (0,011 mg/kg oder 200 mcg) vorbehandelt.
2. Einleitung der Vollnarkose
- Aseptisch einen intravenösen (IV) Sicherheitskatheter, einen Injektionsport und einen T-Port in die Vena cephalica (Abbildung 1B) geben.
- Induzieren Sie die Anästhesie durch intravenöse Injektion von Propofol (20 mg / ml, 1-2,5 mg / kg) und Fentanyl (0,01 mg / kg) zu bewirken.
- Anzeichen für ein angemessenes Maß an Sedierung sind Kieferentspannung, Verlust des Schluckens und papillärer Reflex. Nach der Sedierung intubieren Sie das Schaf mit einem entsprechend großen Endotrachealtubus (Abbildung 1C). Rasieren Sie die Schafe und bringen Sie sie dann in den Operationssaal (OP).
3. Intraoperatives Anästhesiemanagement für Perikardiektomie und Implantation
- Verwenden Sie ein druckzyklisches mechanisches Beatmungsgerät, um eine intermittierende Überdruckbeatmung (IPPV) mit 100% Sauerstoff im OP einzuleiten.
- Schließen Sie das Schaf an die Plattform des Anästhesiegeräts an und belüften Sie das Schaf während der gesamten Anästhesie im Druckmodus (Tidalvolumen (TV) = 8-12 ml/kg, Atemfrequenz (RF) = 12-14 Atemzüge/min). Stellen Sie den Fernseher und die HF so ein, dass das Endgezeiten-Kohlendioxid (EtCO 2) zwischen 35-45 mmHg und der arterielle Partialdruck von CO 2 (PaCO2) unter 50 mmHg gehalten werden.
- Aufrechterhaltung der Anästhesie in Kombination mit Isofluran (zur Wirkung empfohlene Erhaltungskonzentration 1,5% -2,5%) in Sauerstoff mit einer Durchflussrate von 1 l / min (inspirierte Fraktion von Sauerstoff (FiO 2) = 75%), kombiniert mit einer kontinuierlichen Rateninfusion (CRI) von Fentanyl (5-15 mcg / kg / h) und Midazolam (0,2-0,5 mg / kg / h).
- Legen Sie einen 18 G Sicherheits-IV-Katheter in die Ohrmuschelarterie zur Messung des invasiven Blutdrucks (IBP).
- Verbinden Sie das Schaf mit der Multifunktionsanästhesieplattform für die hämodynamische Überwachung, die die direkte Messung des invasiven Blutdrucks (IBP) in der Ohrmuschelarterie (auf Höhe des Herzens nulliert), die Körpertemperatur mit einer Rektalsonde, ein Blei-IV-Elektrokardiogramm, plethysmographische Sauerstoffsättigung (SpO 2), TV, RF, EtCO 2, Herzfrequenz (HR) und FiO2 anzeigt.
- Positionieren Sie eine Magensonde, um überschüssiges Gas und Flüssigkeiten aus dem Retikulorumen in Vorbereitung auf die Perikardiektomie zu evakuieren. Statten Sie die Magensonde mit einem Markerführungsdraht als Referenz für die Implantation aus.
- Legen Sie einen Foley-Harnkatheter über die Harnröhre in die Blase, die mit einem Urinbeutel verbunden ist. Den Foley-Ballon mit mindestens 5 ml Salzlösung (0,9% NaCl) austeilen.
- Führen Sie 30 Minuten vor der Implantation einen aktivierten Gerinnungstest (ACT: 240-300 s) durch, um eine ausreichende Heparinisierung vor und Antagonisierung nach der Implantation zu bestätigen. Führen Sie eine arterielle Blutgasanalyse (ABGs) durch, um die innere Umgebung 30 Minuten vor der Perikardiektomie und Implantation und jede Stunde während der beiden Eingriffe zu analysieren.
- Verabreichen Sie die folgenden Antibiotika, nämlich Sulbactam / Ampicillin (20 mg / kg) 30 Minuten über intravenösen Tropf vor der Perikardiektomie und Implantation. Stellen Sie eine kontinuierliche Infusion von Kristalloiden (5 ml/kg/h, isotonische ausgewogene Elektrolytlösung) und Hydroxyethylstärke (HES, 30 ml/h) während der gesamten Perikardiektomie und Implantation sicher.
4. Perikardiektomie
- Vorbereitung zur Perikardiektomie
- Legen Sie das Schaf auf den Operationstisch in der rechten seitlichen Liegeposition mit 30° Höhe auf der linken Seite und sichern Sie dann ihre Gliedmaßen mit Gurten und Gurten.
- Sterilisieren Sie die Operationsstelle (Perikardiektomie: oberhalb des linken Schlüsselbeins, anterior zum Brustbein, unterlegen zum Niveau des Zwerchfells und posterior zur linken Mittelklavikellinie) mit Chlorhexidin-Alkohol, bevor Sie die Minithorakotomie durchführen. Decken Sie die verbleibenden Bereiche mit sterilen Drapierungen ab (Abbildung 2A).
- Machen Sie einen 5 cm Hautschnitt an der vierten Interkostalparasternalposition mit einer #10 chirurgischen Klinge unter Vollnarkose.
- Sezieren Sie den Musculus pectoralis major- pectoralis minor- anterior serratus-intercostalis über die linke laterale Minithorakotomie (m-LLT) in 5 cm lange Schnitte nacheinander und separat im dritten und vierten Interkostalraum für eine ideale Exposition (Abbildung 2B).
- Machen Sie den Schnitt mindestens 2 cm vom Brustbein versetzt, um eine Verletzung der linken inneren Brustarterie und der Venen zu vermeiden. Stoppen Sie das Beatmungsgerät für 10 s, um Lungenverletzungen zu vermeiden, bevor Sie den Thorax öffnen.
- Verwenden Sie mehrere sterile Gaze, um die linke Lunge zu komprimieren, um das Operationsfeld nach dem Einsetzen eines Rippenspreizers besser zu belichten (Abbildung 2C). Visualisieren Sie das Perikard und den Thymus im Operationsfeld (Abbildung 2D).
- Beginnen Sie die Perikardiektomie am Befestigungspunkt von Perikard und Zwerchfell und entnehmen Sie das Perikardgewebe zwischen den beiden Phrenicusnerven, bis zu den Nominatvenen, bis hinunter zum Zwerchfell.
- Komprimieren Sie die linke Lunge, wie in Schritt 4.1.5 erwähnt, um die Anheftung der Zwerchfell-Perikard-Mediastinalpleura freizulegen. Schneiden Sie die linke mediastinale Pleura an der Befestigung der Zwerchfell-Perikard-Mediastinalpleura auf, indem Sie mit einer chirurgischen Schere einen 1 cm langen Schnitt machen. Verlängern Sie den Schnitt nach oben in die Nominatvenen entlang der Linie, die 1 cm vom linken Nervus phrenicus versetzt ist (Abbildung 2E).
- Wiederholen Sie den Vorgang für den rechten Teil des Perikards, indem Sie die Spitze mit den Fingern nach links anheben. Sezieren Sie das Thymus- und Perikardfett aus dem Brustbein.
- Treffen Sie die beiden Einschnitte des Perikards vor der Aorta. Kreuzklemmen Sie den Schnittpunkt von Perikard und Thymus aus den beiden Perikardeinschnitten vor der Aorta, indem Sie sie fest an Ort und Stelle halten und sechs chirurgische Knoten manuell mit einer 4-0 nicht resorbierbaren Naht binden.
- Vermeiden Sie Verletzungen des Nervus phrenica und der darunter liegenden Gefäßstrukturen, wenn Sie das Perikard ernten. Sezieren Sie Fettgewebe einschließlich des Thymus von der Oberfläche des Perikards während der Perikardiektomie. Verwenden Sie ein Kauterisationswerkzeug (z. B. Elektrotom, Bovie) für die Hämostase.
- Legen Sie das geerntete Perikard mit einer Zentimeterskala auf die sterile Platte, um das zusätzliche Fettgewebe zu entfernen, und waschen Sie es dann zweimal in 0,9% NaCl (Abbildung 2F). Überprüfen Sie alle chirurgischen Bereiche auf Hämostase.
- Nähen Sie die geöffnete rechte mediastinale Pleura zweimal mit 3-0 Polydioxanon an den verbleibenden rechten Perikardrand. Blähen Sie die rechte Lunge manuell mit einem Atembeutel auf das größte Volumen auf und halten Sie sie für 10 s, bevor Sie den rechten Thorax schließen. Vernähen Sie die geöffnete linke mediastinale Pleura zweimal mit 3-0 Polydioxanon an den verbleibenden linken Perikardrand.
- Schließen Sie die linken Thoraxschnitte in vier Schichten, wie unten beschrieben.
- Vernähen Sie die Interkostalmuskulatur und den vorderen Serratus mit 2-0 Polydioxanon in einer einfachen unterbrochenen oder kreuzförmigen Weise, Pectoralis major-pectoralis minor mit 3-0 Polydioxanon in laufender Manier, die Subcutis mit 3-0 Polydioxanon in einer kreuzförmigen Art und Weise und die Haut mit 3-0 Nylon in einer einfachen unterbrochenen Weise. Legen Sie alle Nähte im Abstand von 1 cm.
- Blähen Sie die linke Lunge manuell mit einem Atemballon auf das größte Volumen auf und halten Sie sie für 10 s, bevor Sie die Interkostalmuskeln schließen.
- Decken Sie den Schnitt mit steriler Gaze ab und komprimieren Sie ihn manuell für 5 Minuten, um Blutungen nach der Heparinisierung für die neue Herzklappenimplantation zu verhindern. Verbinden Sie dann die Operationsstelle.
- Stoppen Sie die intravenösen Anästhetika und Isofluran, wenn Sie die Hautnaht durchführen, um die Tiefe der Sedierung zu reduzieren.
- Entfernen Sie die Magensonde und den Harnkatheter, nachdem die spontane Atmung zurückgekehrt ist. Dann die Schafe mit Pulsoximetrie in den Aufwachraum auf der Trage bringen.
- Entfernen Sie den Endotrachealtubus, wenn sich der Schluckreflex, der papilläre Reflex und die normale Spontanatmung erholen. 0,5 mg/kg Meloxicam einmal täglich vor der Implantation subkutan verabreichen.
- Sobald die Narkose vollständig umgekehrt ist (d.h. wenn das Schaf in der Lage ist, unabhängig zu stehen), können die Schafe Zugang zu Nahrung und Wasser erhalten.
5. Vorbereitung der dreidimensionalen autologen Herzklappe
- Schneiden Sie das Perikard ab, indem Sie das Fettgewebe entfernen (Abbildung 3A, B, C), und legen Sie es dann auf die 3D-formende Herzklappenform. (Aufgrund einer anhängigen Patentanmeldung können in diesem Schritt keine Zahlen angegeben werden.)
- Legen Sie das Perikard und das 3D-formende Herzklappenmodell für 2 Tage und 21 Stunden in einen Inkubator mit einem ungiftigen Vernetzer (30 ml) (Abbildung 3D; aufgrund der anhängigen Patentanmeldung können in diesem Schritt keine Zahlen und detaillierten Informationen zu ungiftigen Vernetzern bereitgestellt werden).
6. Vorbereitung des APV
- Waschen Sie die vernetzte Herzklappe zweimal in 0,9% NaCl und nähen Sie sie nach 2 Tagen und 21 h diskontinuierlich in einen Nitinol-Stent (30 mm Durchmesser, 29,4 mm Höhe, 48 rhombische Zellen) ein. Verwenden Sie 5-0 Polypropylen, um die Herzklappe an Ort und Stelle zu nähen, indem Sie sechs bis acht Knoten verwenden, um die Befestigungspunkte zwischen Herzklappe und Stent auszurichten. (Aufgrund einer Patentanmeldung können in diesem Schritt keine Zahlen angegeben werden.)
- Schneiden Sie die drei freien Kanten der autologen Pulmonalklappe mit einer chirurgischen Klinge Nr. 15 auf (Abbildung 4A,B). Halten Sie die gesstente Pulmonalklappe mit einer chirurgischen Pinzette, heben Sie die APV an und lassen Sie sie in 0,9% NaCl stehen, um ihre Öffnung und Schließung zu testen und zu bewerten, ob die drei Kommissare weiter geschnitten werden müssen, um eine größere Öffnung der Öffnung der Öffnung zu erreichen.
- Inkubieren Sie den APV in einem Inkubator für 30 min zur Sterilisation in 47,6 ml PBS mit 0,8% Amphotericin B (0,4 ml) und 4,0% Penicillin/Streptomycin (2 ml). Crimpen Sie die gesstente Herzklappe in den Kopf eines Abgabesystems (DS) mit einem handelsüblichen Crimper für zweifache Tests (Abbildung 4C-D) und fügen Sie sie in das Abgabesystem ein (Abbildung 4E).
7. Transkatheter-autologe Pulmonalklappenimplantation über die linke Jugularvene
- Anästhesieren Sie die Schafe für die APV-Implantation, wie in den Schritten 1 bis 3 dargestellt.
- Gefäßzugang: Rasieren Sie die Schafe und sterilisieren Sie das chirurgische Feld, das oberhalb der unteren Grenze des Unterkiefers, anterior zur vorderen Medianlinie, unterlegen zur oberen Grenze des linken Schlüsselbeins und posterior zur hinteren Medianlinie mit einem Povidon-Jod-Antiseptikum vor der Implantation gehört. Decken Sie die verbleibenden unrasierten und unsterilisierten Bereiche mit sterilen Drapierungen ab.
- Markieren Sie die linke Halsvene am Hals und setzen Sie den Führungsdraht mit der Seldinger-Technik in die linke Halsvene. Vergrößern Sie den Einstichpunkt mit einer Klinge Nr. 10, legen Sie eine 11-F-Hülle in die linke Halsvene für die ICE-Sonde und das Abgabesystem (Abbildung 5A, B). Legen Sie eine Handtuch-String-Naht um den Scheide-Introducer mit einer 4-0 nicht resorbierbaren Naht.
- Intrakardiale Echokardiographie (ICE)17
- ICE vor und unmittelbar nach der Implantation mit einem 10 Fr Ultraschallkatheter durchführen (Abbildung 5C). Bewertet die Parameter einschließlich der Abmessungen und Funktionen von NPV, APV und Trikuspidalklappe durch 2D, Farbe, gepulste Welle und kontinuierlichen Doppler in der kurzen und langen Achse.
- Bewerten Sie den Grad der Herzklappeninsuffizienz in der Vena contracta durch semi-quantitative Bewertung18über ICE (Abbildung 6).
- Angiographie19: Führen Sie eine Angiographie mit einem tragbaren C-Bogen und einem funktionellen Bildschirm durch, um die Implantation durch Messung der Durchmesser des RVOT, NPV, der Lungenzwiebel und der supravalvulären Lungenarterie zu steuern und den APV nach der Implantation zu bewerten (Abbildung 7A-D).
- Hämodynamik20: Messen und erfassen Sie den rechtsventrikulären und pulmonalen Arteriendruck vor und nach der Implantation mit einem 5,2 F 145° Pigtail-Katheter. Messen Sie den systemischen arteriellen Druck über die Ohrmuschelarterie.
- Implantat
- Einrichtung des TPVR-Trakts: Platzieren Sie einen 0,035-Zoll-Winkelführungsdraht unter der Leitung der Fluoroskopie an der rechten Lungenarterie. Legen Sie dann einen 5,2 Fr Pigtail-Katheter in die linke Halsvene und schieben Sie ihn unter Anleitung des zuvor platzierten Führungsdrahtes unter Durchleuchtung in die rechte Lungenarterie.
- Holen Sie den abgewinkelten Führungsdraht aus der linken Halsvene heraus. Legen Sie einen 5 Fr Berman angiographischen Ballonkatheter in die linke Halsvene und führen Sie ihn mit der Führung des Führungsdrahtes in die rechte Lungenarterie vor.
- Gestalten Sie den ultrasteifen 0,035-Zoll-Führungsdraht zu einem Kreis von etwa 8-10 cm Länge mit einem Durchmesser, der dem Abstand vom zentralen Punkt der Trikuspidalklappe zum zentralen Punkt der Pulmonalklappe gemäß der Durchleuchtungsmessung entspricht, vor und führen Sie ihn unter Führung des Ballonkatheters in die rechte Lungenarterie (Abbildung 8A). Stellen Sie sicher, dass der Draht die Trikuspidalklappenchordae nicht stört.
- Dilatieren Sie die Haut mit einer Klinge Nr. 11 und erweitern Sie die linke Halsvene mit kommerziellen Dilatatoren von 16 Fr bis 22 Fr sequenziell (Abbildung 8B). Schließen Sie den Schnitt nach der Dilatation mit einer 3-0 Polydioxanon-Ringfadennaht (Abbildung 8C). Führen Sie eine Angiographie durch, um die gewünschte Position des stenttragenden Teils des DS wie in19 beschrieben sicherzustellen.
- Markieren Sie den sinotubularen Übergang der Pulmonalklappe an der endsystolischen und enddiastolischen Herzphase während der pulmonalen Angiographie als distale Grenze der Landezone und die Basalebene der Pulmonalklappe als proximale Grenze der Landezone.
- Öffnen Sie das autologe Ventil mit Stented erneut und untersuchen Sie es auf crimpinduzierte Schäden. Crimpen Sie den APV neu und passen Sie ihn in den Kopf des DS an (Abbildung 8D). Führen Sie den geladenen DS über den vorgeformten Führungsdraht durch den rechtsventrikulären Zuflusstrakt (RVIT) und den RVOT in die NPV-Position (Abbildung 8E, F und Abbildung 9A).
- Ziehen Sie das Abdeckrohr des DS ein und legen Sie das APV langsam und direkt über dem NPV in der Landezone am Ende der diastolischen Phase unter fluoroskopischer Führung aus (Abbildung 9A-C). Seien Sie vorsichtig, wenn der geladene DS die Verbindung zwischen dem RVIT und dem RVOT kreuzt, um Myokardverletzungen und Kammerflimmern zu verhindern. Die optimale Position für den APV ist, wenn der mittlere Teil des Stents auf dem NPV platziert wird.
- Ziehen Sie die Spitze des DS nach dem Auslösen vorsichtig in das Abdeckrohr ein und holen Sie den DS von den Schafen zurück (Abbildung 9D). Wiederholen Sie ICE (Abbildung 6D-F), Angiographie (Abbildung 7C-D) und hämodynamische Messungen zur Nachuntersuchung der Abmessungen und Funktionen des implantierten APV. Schließen Sie den Schnitt auf der linken Seite des Halses mit der vorplatzierten Handtuchnaht und komprimieren Sie ihn manuell.
8. Periimplantationsmedikamente
- Vor der Implantation den Schafen Heparin in einer Dosis von 5000 IE verabreichen, um eine aktivierte Gerinnungszeit (ACT) von 240-300 s aufrechtzuerhalten. Verwenden Sie ACT-Tests während des gesamten Verfahrens. Wiederholen Sie die ACT-Tests alle 30 Minuten nach Beginn des Eingriffs, um sowohl eine ausreichende Heparinisierung vor als auch eine Antagonisierung nach der Implantation zu bestätigen.
- Vor der APV-Implantation 10% Magnesium in einer Dosis von 0,02 mol/l und Amiodaron in einer Dosis von 3-5 mg/kg verabreichen, um Herzrhythmusstörungen vorzubeugen.
- Sulbactam/Ampicillin (20 mg/kg) intravenös verabreichen, um Infektionen und Endokarditis zu Beginn der Perikardiektomie und Implantation zu verhindern.
9. Postoperatives Management
- Führen Sie eine tägliche postoperative Nachsorge für 5 Tage durch und überprüfen Sie den Allgemeinzustand der Schafe in Bezug auf Herzfrequenz und Rhythmus, Atemtiefe, Atemrhythmus und Atemgeräusch (zur Überprüfung der postoperativen Lungenentzündung), Anzeichen von Schmerzen und andere Anomalien. Überprüfen Sie die Wunde auf postoperative Schwellungen, Entzündungen, Rötungen, Blutungen und Sekretion.
- Setzen Sie die Antikoagulation für 5 Tage mit Dalteparin 5000 IE oder einem anderen niedermolekularen Heparin fort, das einmal täglich subkutan verabreicht wird. Verabreichen Sie 1 mg/kg Meloxicam durch subkutane Injektion zur postoperativen Analgesie für 5 Tage.
- Führen Sie einen Laborbluttest durch, einschließlich Hämatologie, Leberfunktion, Nierenfunktion und Serumchemie, um den körperlichen Zustand des Schafes zu beurteilen.
10. Nachbereitung
- Führen Sie ICE, Herzmagnetresonanztomographie (cMRT), Angiographie durch und zeichnen Sie die Hämodynamik alle 3-6 Monate nach der Implantation für bis zu 21 Monate auf. Führen Sie ICE und Angiographie wie oben dargestellt durch.
- Führen Sie eine cMRT durch, um die Regurgitationsfraktion (RF) auf einem 3,0-T-MRT-Scanner mit einer standardmäßigen Elektrokardiogramm-gesteuerten Cine-MRT-Methode21 zu bewerten. Führen Sie eine abschließende kardiale Computertomographie (CT) durch, um die Stentposition und die Verformung des rechten Herzens während des gesamten Herzzyklus zu bewerten, wie in unserer vorherigen Studie22 dargestellt.
Ergebnisse
Bei Schaf J wurden die APV (30 mm Durchmesser) erfolgreich in die "Landezone" des VVOT implantiert.
Bei Schaf J blieb die Hämodynamik während der gesamten linksanterolateralen Minithorakotomie unter Vollnarkose mit Beatmung sowie in der Nachuntersuchung und ICE stabil (Tabelle 1, Tabelle 2 und Tabelle 3). Autologes Perikard mit den Maßen 9 cm x 9 cm wurde geerntet und durch Entfernen von zusätzlichem Gewebe getrimmt (Abbildung 3A-C). Das autologe Perikard wurde auf die 3D-Formform gelegt und in einem Inkubator mit einem ungiftigen Vernetzer für 2 Tage und 21 h vernetzt (Abbildung 3D).
Ein Nitinol-Stent wurde an der Außenseite des vernetzten Perikards montiert, und 5-0 Polypropylennähte wurden verwendet, um den Stent und die Herzklappe diskontinuierlich miteinander zu nähen. Anschließend wurde die Herzklappe mit Stens aufgeschnitten (Abbildung 4A-H).
Der APV wurde in den Kopf eines selbst entworfenen Fördersystems gecrimpt und unter der Führung eines steifen Führungsdrahtes in die NPV-Position vorgeschoben. Der APV wurde erfolgreich und vollständig an der gewünschten NPV-Position ohne signifikante hämodynamische Änderung eingesetzt (Abbildung 8A-D).
Die ICE- und Angiographiebewertung unmittelbar nach dem APV-Einsatz ergab kein paravalvuläres Leck, keine neue Pulmonalklappeninsuffizienz oder eine gestaute Pulmonalklappenmigration des APV (Abbildung 6D-F).
Der implantierte Stent wurde in der Zielposition verankert, ohne Migration vorwärts zur Lungenarterie oder rückwärts zum RV, entsprechend der endgültigen CT. Darüber hinaus wurde der Blutfluss in der linken vorderen absteigenden Arterie (LAD) und der linken Zirkumflexarterie (LCX) während des gesamten Herzzyklus nicht durch den Stent beeinflusst (Abbildung 10).
Der implantierte stented APV zeigte eine günstige Funktion und Hämodynamik im richtigen Herzsystem mit einer Regurgitationsfraktion von 5% -10% in der Nachuntersuchungs-MRT und ICE (Tabelle 3).
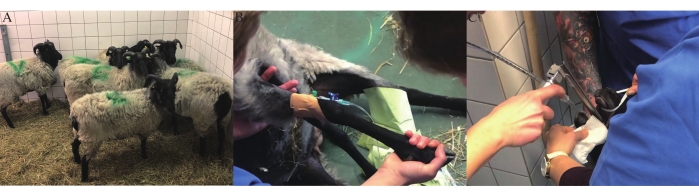
Abbildung 1: Tierpräparation . (A) Schafe für präklinische Studien. (B) IV-Katheterplatzierung in der Vena cephalica. (C) Orotracheale Intubation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Perikardiektomie-Verfahren. (A) Das chirurgische Feld. (B) Chirurgische Markierung im dritten/vierten Interkostalraum. (C) Platzierung des Rippenretraktors für die Exposition. (D) Exposition von Perikard und Thymus. (E) Perikardiektomie. (F) Geerntetes Perikard. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
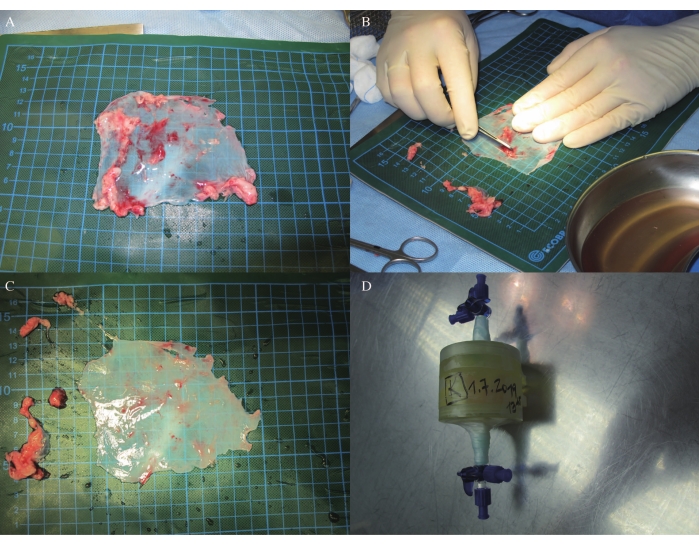
Abbildung 3: Perikardtrimmen und -vernetzen. (A-C) Perikard-Trimmung. (D) Perikardvernetzung in einem Inkubator. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
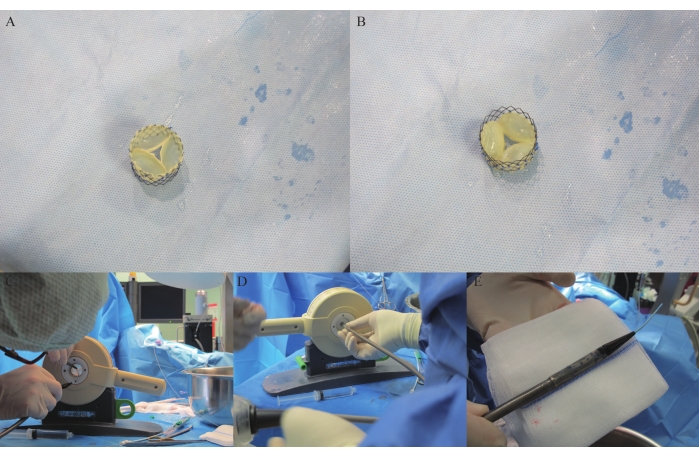
Abbildung 4: APV-Stenting und -Belastung in DS. (A) Stented APV von der Lungenarterie aus betrachtet. (B) Stented APV vom RVOT aus gesehen. (C-D) Stented APV wird im Crimper gecrimpt. (E) Crimped stented APV im Liefersystem. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: TPVR-Zugangsaufbau über die linke Halsvene. (A-B) Mantelplatzierung für ICE-Sonde und Abgabesystem über die linke Halsvene. (C) ICE-Auswertung über die linke Halsvene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: ICE-Auswertungen vor und nach der Implantation . (A) Native Pulmonalklappengröße. (B) Native Pulmonalklappenfunktion. (C) Native Pulmonalventilgeschwindigkeit, Druckgradient (PG) und Geschwindigkeitszeitintegral (VTI). (D) Automatische Skalierung der Pulmonalklappe. (E) Eigenrege Pulmonalklappenfunktion. (F) Eigenloge Pulmonalventilgeschwindigkeit, Druckgradient (PG) und Geschwindigkeitszeitintegral (VTI). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Angiographie vor und nach der Implantation . (A) Angiographie der rechtsventrikulären und pulmonalen Arterien vor der Implantation. (B) Angiographie der Lungenarterie vor der Implantation. (C) Rechtsventrikuläre und pulmonale Arterienangiographie nach der Implantation. (D) Angiographie der Lungenarterien nach der Implantation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
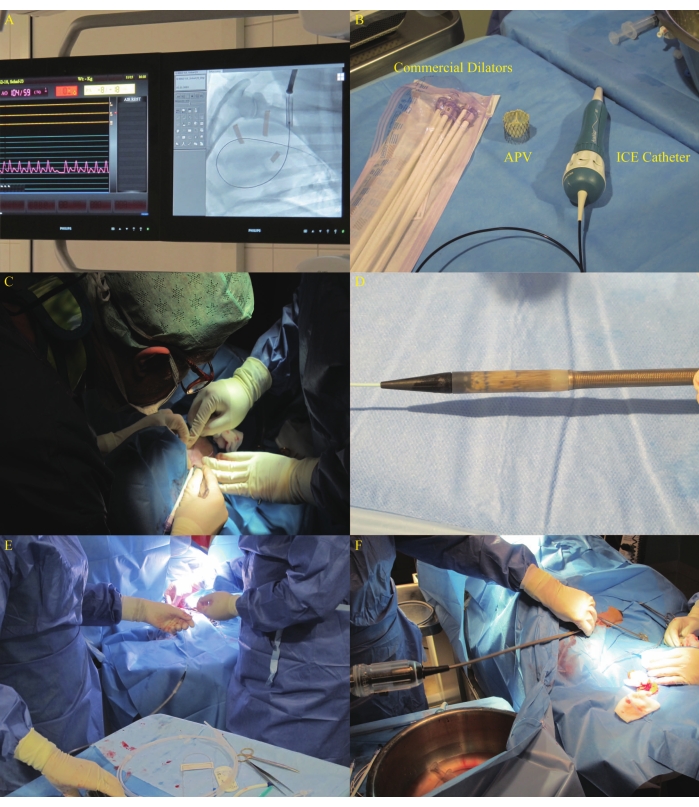
Abbildung 8: DS-Fortschreiten über die linke Halsvene. (A) Führungsdrahtplatzierung in der rechten Lungenarterie. (B) Kommerzielle Dilatatoren, die in der Studie verwendet wurden. (C) Inzisionsdilatation unter Verwendung von Dilatatoren in der linken Jugularvene. (D) Gecrimpter APV, der in den Kopf des DS eingebaut wurde. (E-F) DS-Fortschritt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
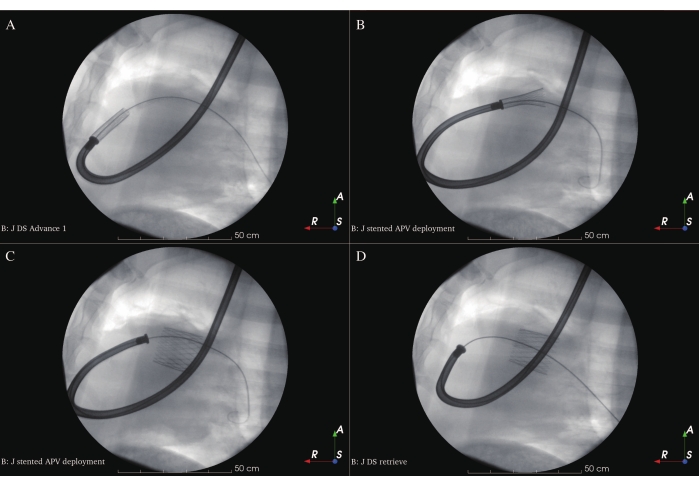
Abbildung 9: Bereitstellung von APV mit Stent . (A) Geladener DS an der Bereitstellungsposition. (B) Stented APV-Bereitstellung zu Beginn. (C) Stented APV Gesamtbereitstellung. (D) Abruf von DS. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 10: Beziehung zwischen der stentrierten Lungenarterie und der linken Koronararterie während des gesamten Herzzyklus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| ABP (mmHg) | Mittlerer ABP (mmHg) | HR (/ min) | SpO2 (%) | |
| Präimplantation | 129/104 | 115 | 98 | 98 |
| Postimplantation | 113/89 | 98 | 93 | 97 |
Tabelle 1: Hämodynamik während der Perikardiektomie. Der arterielle Druck, die Herzfrequenz und derSpO2 von Schaf J während der Perikardiektomie blieben stabil.
| ABP (mmHg) | Mittlerer ABP (mmHg) | RVP (mmHg) | Mittlerer RVP (mmHg) | PaP (mmHg) | Mittlerer PaP (mmHg) | HR (/ min) | |
| Präimplantation | 108/61 | 74 | 11/ -7 | 0 | 13/0 | 3 | 70 |
| Postimplantation | 116/69 | 84 | 13/-9 | -3 | 10/-6 | 1 | 67 |
Tabelle 2: Hämodynamik während der Implantation. Der arterielle Druck, der Lungendruck, die Herzfrequenz und derSpO2 von Schaf J während der Implantation blieben stabil.
| MRT- Regurgitativanteil (%) | Rechtsventrikulärer Druck (Mittelwert) (mmHg) | Lungenarteriendruck (Mittelwert) (mmHg) | Systematischer Flügeldruck | |
| Präimplantation | - | 11/-7 (0) | 13/0 (3) | 108/61 (74) |
| Postimplantation | - | 13/-9 (-3) | 10/-6 (1) | 116/69 (84) |
| Follow-up 4 Monate | 5 | - | - | - |
| Follow-up 7 Monate | 7 | 27/4 (11) | 23/11 (16) | - |
| Follow-up 10 Monate | 5 | - | - | - |
| Follow-up 15 Monate | 7 | 26/-2 (12) | 23/15 (18) | - |
| Follow-up 18 Monate | 10 | 26/12 (14) | 23/18 (20) | - |
| Follow-up 21 Monate | 6 | 20/-8 (16) | 19/6 (11) | - |
| ICE (PV) | PV Vmax (m/s) | PV maxPG (mmHg) | PV-MittelwertPG (mmHg) | PR Vmax (m/s) | PR EROA (cm²) | PR-Regurgitationsvolumen (mL) |
| Präimplantation | 0.71 | 2.01 | 1.06 | 0.76 | 0.25 | 1.7 |
| Postimplantation | 0.75 | 2.22 | 1.19 | 0.78 | 0.2 | 1 |
| Follow-up 4 Monate | - | - | - | - | - | - |
| Follow-up 7 Monate | 0.8 | 2.58 | 1.12 | 0.94 | 0.2 | 3 |
| Follow-up 10 Monate | - | - | - | - | - | - |
| Follow-up 15 Monate | 1.08 | 4.64 | 1.76 | - | 0.3 | 1 |
| Follow-up 18 Monate | 0.75 | 2.22 | 0.97 | 0.87 | 0.3 | 1 |
| Follow-up 21 Monate | 0.61 | 1.46 | 0.61 | 0.53 | 0.1 | 1 |
| PV: Pulmonalklappe | PG: Druckgradient | EROA: Effektiver Aufstoßensöffnungsbereich | PR: Lungeninsuffizienz |
| ICE (Fernseher) | TV Vmax (m/s) | TV maxPG (mmHg) | TV-Mittelwert PG (mmHg) | TR Vmax (m/s) |
| Präimplantation | - | - | - | - |
| Postimplantation | 0.56 | 1.27 | 0.48 | 0.83 |
| Follow-up 4 Monate | - | - | - | - |
| Follow-up 7 Monate | 0.99 | 3.92 | 1.68 | 0.84 |
| Follow-up 10 Monate | - | - | - | - |
| Follow-up 15 Monate | 0.95 | 3.6 | 1.47 | 1.04 |
| Follow-up 18 Monate | 0.95 | 3.6 | 1.47 | 1.03 |
| Follow-up 21 Monate | 0.94 | 3.56 | 1.31 | 0.95 |
| Fernseher: Trikuspidalklappe |
Tabelle 3: Folgedaten von MRT und ICE. Eine 21-monatige Nachbeobachtungszeit mit MRT wurde durchgeführt und die Regurgitationsfraktion der autologen Pulmonalklappe von Schaf J wurde mit 5% bis 10% festgestellt, was eine günstige Ventilfunktion zeigte. Die intrakardiale Echokardiographie von Schaf J zeigte, dass die autologe Pulmonalklappe nur 1 ml bis 3 ml Aufstossvolumen mit normaler Trikuspidalklappenfunktion hatte.
Diskussion
Diese Studie stellt einen wichtigen Schritt vorwärts bei der Entwicklung einer lebenden Pulmonalklappe für TPVR dar. In einem erwachsenen Schafmodell konnte die Methode zeigen, dass ein aus dem schafeigenen Perikard abgeleiteter APV mittels Jugularvenenkatheterisierung mit einem selbstexpandierbaren Nitinol-Stent implantiert werden kann. Bei Schaf J wurde die autologe Pulmonalklappe mit einem selbst entwickelten Universalabgabesystem erfolgreich in die richtige Lungenposition implantiert. Nach der Implantation zeigte die Herzklappe von Schaf J bis zu 21 Monate lang eine gute Funktionalität und diente nicht nur als sicherer und effizienter präklinischer Nachweis für die zukünftige präklinische Studie mit einer autologen Pulmonalklappe bei unreifen Schafen, sondern auch für die Translation in das klinische Setting.
TPVR-AVP über Jugularvenenkatheterisierung in einem erwachsenen Schafmodell
Aufgrund der anatomischen und hämodynamischen Ähnlichkeiten mit dem Menschen gehören erwachsene Schafe zu den beliebtesten und am weitesten verbreiteten Großtiermodellen in zahlreichen Untersuchungen zur Bewertung der Funktionalität und Leistungsfähigkeit bioprothetischer Herzklappen23,24. Für die Katheterisierung und Implantation wird der transjugular venöse Ansatz gegenüber dem transfemoralen Venus bevorzugt, was ein größeres Profil des Abgabesystems erfordert und mit einer schwierigeren Behandlung während und nach der Implantation verbunden ist. Der APV kann über den SVC-rechten Vorhof-Trikuspidalklappen-Rechtsventrikel mit einem kürzeren Abstand und einem größeren Winkel zwischen dem SVC-RA im Vergleich zum IVC-RA in die Pulmonalposition geliefert werden, was es einfacher machen könnte, das beladene Abgabesystem in das RV zu bringen.
Perikardiektomie
Autologes 9 cm x 9 cm Perikard von Schaf J wurde ohne Verletzung des Nervus phrenica geerntet und hinterließ innere Brustarterie und Venen. Die Schafe litten nach der Minithorakotomie nicht an Zwerchfellkrämpfen, Ateminsuffizienz oder Blutungskomplikationen. Aufgrund des engen Raums zwischen den Rippen bei Schafen war es schwierig, die gewünschte Exposition des Perikards in der Minithorakotomie zu erreichen, insbesondere während der Perikardiektomie. Daher ist bei der Gewebedissektion Vorsicht geboten, um Verletzungen der Aorten- und Lungenwurzeln, der Koronararterien und des Nervus phrenica25 zu vermeiden. Die Vollnarkose wurde mit Isofluran, Fentanyl und Midazolam ohne Muskelrelaxantien für eine frühe Wiederbelebung und stabile Hämodynamik aufrechterhalten. Wenn die Patienten jedoch während früherer Operationen eine Perikardiektomie und / oder Perikardiotomie hatten, gibt es Einschränkungen bei der Durchführung einer Thorakotomie zur Erfassung des Perikards. Erstens kann es zu unkontrollierbaren Blutungen aufgrund der Nähte führen, die während der vorherigen Operationen bei der Mobilisierung des Perikards vor der aufsteigenden Aorta, dem Lungenstamm, den Koronararterien sowie dem Myokard platziert wurden. Darüber hinaus könnte das Perikard nicht ausreichen, um eine autologe Herzklappe herzustellen, die für eine Herzklappe mit einem Durchmesser von 30 mm mindestens 9 cm x 9 cm Gewebegröße benötigt. Darüber hinaus entspricht die Qualität des Perikards möglicherweise nicht den Anforderungen der neuen gesstenten Herzklappe. Selbst wenn das entnommene Perikard für eine autologe Herzklappe ausreicht, ist die Hämostase im Operationsbereich nach der systematischen Heparinisierung vor dem TPVR äußerst schwierig. In diesen Situationen könnten Rectus fascia, Fascia lata und transversalis fascia Kandidaten für die Gewinnung des autologen Gewebes für die Herzklappe sein.
Implantat
Bevor der gesstente APV in das Liefersystem geladen wird, sollte er zum Testen in einem handelsüblichen Crimper gecrimpt werden. Der Stent würde sich beim Crimpen um bis zu 10% verlängern, was zu einem spannungsbedingten Bruch an den meisten Nahtstellen der Packungsbeilagen und den Aufsätzen der Beschläge führen könnte. Im Schaf J wurde ein 30-mm-Stenventil getestet und mit einem Crimper ohne Bruch und Nahtverlust in ein 26 Fr-Fördersystem geladen. Ein kleines Gerät (einschließlich des stented APV) und ein Abgabesystem wären vorteilhaft in Bezug auf die Anpassung der Halsvene, insbesondere für Kinder. Die Miniaturisierung des TPVR-Geräts würde zu einer besseren perioperativen Sicherheit bei zukünftigen transfemoralen Implantationen führen.
Basierend auf früheren Erfahrungen bewegte sich die PV-Ebene in jedem Herzzyklus um ca. 2 cm, was eine große Herausforderung darstellte, wenn das APV in der richtigen Position eingesetzt wurde. Darüber hinaus hatten die gesunden Schafe keine klaren Orientierungspunkte wie Verkalkungen in der Landezone, was bei menschlichen Patienten häufig vorkommt, was eine genaue Positionierung erschwert. Des Weiteren sprang der selbstexpandierende Nitinol-Stent aufgrund der Radialkraft aus dem Abgabesystem oder sogar in die Lungenarterie, wenn etwa 2/3 des Stents freigelegt wurde, sobald das äußere Rohr zurückgezogen wurde. Weitere Verfeinerungen des Stent- und Abgabesystems mit Repositionierungsarchitekturen sind erforderlich, um den Einsatz im Falle einer Fehlpositionierung und beim Zurückziehen des gesstenten APV in die Röhre besser steuern zu können. Bei Schaf J wurde der APV mit Hilfe des Abgabesystems in die richtige Position implantiert, das ohne Knicken oder Stentsprung hervorragend funktionierte.
Follow-up durch MRT, ICE und abschließende CT
Der implantierte gesstente APV zeigte eine günstige Klappenfunktion mit einer Regurgitationsfraktion von 5% -10% im MRT, einer stabilen Hämodynamik bei ICE und einer gewünschten Verankerungsposition mit nachbarschaftlichen Beziehungen zur linken Koronararterie während des gesamten Herzzyklus in den Langzeit-Follow-ups. Die Ergebnisse dieser Studie lieferten starke Beweise für die stabile makroskopische Leistung eines stented APV, von dem Patienten profitieren können, die an dysfunktionalem RDOT leiden.
In großen Tierversuchen wurde die Klappenfunktionsstörung durch fehlgeleitete Klappenumgestaltung nachgewiesen, die Delamination, Verdickung der Flugblätter, Zurückziehen der Flugblätter und Unregelmäßigkeiten umfasst26,27. Nach den aktuellen Normen der Internationalen Organisation für Normung (ISO) für Herzklappenprothesen im Niederdruckkreislauf ist eine Herzklappeninsuffizienz von bis zu 20% akzeptabel. In Anbetracht des Herstellungsprozesses eines APV ist die Ventilgeometrie mit 3D-Formgebung der Schlüsselfaktor für ein günstiges Ergebnis in diesem Papier. Darüber hinaus können die Ventilgeometrie, die Materialeigenschaften und die hämodynamischen Belastungsbedingungen die Ventilfunktionalität und den Umbau bestimmen26. Die APV schnitt sehr nahe an einem NPV ab, wobei die minimale Klappeninsuffizienz von ICE unmittelbar nach der Implantation beurteilt wurde.
Schlussfolgerung
In der hier berichteten Großtierstudie wollten wir eine Methode zur transjugulären Venenimplantation einer autologen Pulmonalklappe entwickeln und testen, die auf einem selbstexpandierenden Nitinol-Stent montiert ist. Ein APV wurde erfolgreich in Schaf J implantiert, wobei diese Methodik und ein selbst entwickeltes Abgabesystem verwendet wurden. Die APVs hielten den Belastungen beim Crimpen, Laden und Ausbringen stand und erreichten die gewünschte Ventilfunktionalität.
Diese Studie zeigte die Machbarkeit und Sicherheit in einem langfristigen Follow-up der Entwicklung eines APV für die Implantation an der NPV-Position mit einem selbstexpandierbaren Nitinol-Stent über Jugularvenenkatheterisierung in einem erwachsenen Schafmodell.
Begrenzungen
Diese präklinische Studie wies viele Einschränkungen auf, die aufgrund der geringen Anzahl von Schafen nicht vollständig behoben werden konnten. Dem Nitinol-Stent und dem in dieser Studie verwendeten Abgabesystem fehlten Architekturen für die Neupositionierung; Dies müsste für zukünftige Tierversuche verfeinert werden. Darüber hinaus wäre es interessant, die Funktionalität des APV über den Studienzeitraum hinaus zu bewerten, um die Leistungsfähigkeit und die Prospektbildung nach mindestens 1 Jahr Follow-up nach der Implantation weiter zu untersuchen. Darüber hinaus muss das Abgabesystem mit einer flachen und flexiblen Befahrbarkeit verbessert werden, um Arrhythmien und Myokardverletzungen während der Implantation zu verhindern. Es besteht immer noch die Notwendigkeit, einen biologisch abbaubaren Stent zu entwickeln, der das APV-Wachstum bei Kindern ermöglicht, um die Notwendigkeit eines multiplen Herzklappenersatzes zu beseitigen.
Offenlegungen
Die Autoren haben keine finanziellen Interessenkonflikte offenzulegen.
Danksagungen
Wir danken allen, die zu dieser Arbeit beigetragen haben, sowohl den ehemaligen als auch den derzeitigen Mitgliedern. Diese Arbeit wurde durch Zuschüsse des Bundesministeriums für Wirtschaft und Energie, EXIST - Transfer of Research (03EFIBE103), unterstützt. Yimeng Hao wird vom China Scholarship Council (CSC: 202008450028) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 % Magnesium | Inresa Arzneimittel GmbH | PZN: 00091126 | 0.02 mol/ L, 10X10 ml |
| 10 Fr Ultrasound catheter | Siemens Healthcare GmbH | SKU 10043342RH | ACUSON AcuNav™ ultrasound catheter |
| 3D Slicer | Slicer | Slicer 4.13.0-2021-08-13 | Software: 3D Slicer image computing platform |
| Adobe Illustrator | Adobe | Adobe Illustrator 2021 | Software |
| Amiodarone | Sanofi-Aventis Deutschland GmbH | PZN: 4599382 | 3- 5 mg/ kg, 150 mg/ 3 ml |
| Amplatz ultra-stiff guidewire | COOK MEDICAL LLC, USA | Reference Part Number:THSF-35-145-AUS | 0.035 inch, 145 cm |
| Anesthetic device platform | Drägerwerk AG & Co. KGaA | 8621500 | Dräger Atlan A350 |
| ARROW Berman Angiographic Balloon Catheter | Teleflex Medical Europe Ltd | LOT: 16F16M0070 | 5Fr, 80cm (X) |
| Butorphanol | Richter Pharma AG | Vnr531943 | 0.4mg/kg |
| C-Arm | BV Pulsera, Philips Heathcare, Eindhoven, The Netherlands | CAN/CSA-C22.2 NO.601.1-M90 | Medical electral wquipment |
| Crimping tool | Edwards Lifesciences, Irvine, CA, USA | 9600CR | Crimper |
| CT | Siemens Healthcare GmbH | − | CT platform |
| Dilator | Edwards Lifesciences, Irvine, CA, USA | 9100DKSA | 14- 22 Fr |
| Ethicon Suture | Ethicon | LOT:MKH259 | 4- 0 smooth monophilic thread, non-resorbable |
| Ethicon Suture | Ethicon | LOT:DEE274 | 3-0, 45 cm |
| Fast cath hemostasis introducer | ST. JUDE MEDICAL Minnetonka MN | LOT Number: 3458297 | 11 Fr |
| Fentanyl | Janssen-Cilag Pharma GmbH | DE/H/1047/001-002 | 0.01mg/kg |
| Fragmin | Pfizer Pharma GmbH, Berlin, Germany | PZN: 5746520 | Dalteparin 5000 IU/ d |
| Functional screen | BV Pulsera, Philips Heathcare, Eindhoven, The Netherlands | System ID: 44350921 | Medical electral wquipment |
| Glycopyrroniumbromid | Accord Healthcare B.V | PZN11649123 | 0.011mg/kg |
| Guide Wire M | TERUMO COPORATION JAPAN | REF*GA35183M | 0.89 mm, 180 cm |
| Hemochron Celite ACT | International Technidyne Corporation, Edison, USA | NJ 08820-2419 | ACT |
| Heparin | Merckle GmbH | PZN: 3190573 | Heparin-Natrium 5.000 I.E./0,2 ml |
| Hydroxyethyl starch (Haes-steril 10 %) | Fresenius Kabi Deutschland GmbH | ATC Code: B05A | 500 ml, 30 ml/h |
| Imeron 400 MCT | Bracco Imaging | PZN00229978 | 2.0–2.5 ml/kg, Contrast agent |
| Isoflurane | CP-Pharma Handelsges. GmbH | ATCvet Code: QN01AB06 | 250 ml, MAC: 1 % |
| Jonosteril Infusionslösung | Fresenius Kabi Deutschland GmbH | PZN: 541612 | 1000 ml |
| Ketamine | Actavis Group PTC EHF | ART.-Nr. 799-762 | 2–5 mg/kg/h |
| Meloxicam | Boehringer Ingelheim Vetmedica GmbH | M21020A-09 | 20 mg/ mL, 50 ml |
| Midazolam | Hameln pharma plus GMBH | MIDAZ50100 | 0.4mg/kg |
| MRI | Philips Healthcare | − | Ingenia Elition X, 3.0T |
| Natriumchloride (NaCl) | B. Braun Melsungen AG | PZN /EAN:04499344 / 4030539077361 | 0.9 %, 500 ml |
| Pigtail catheter | Cordis, Miami Lakes, FL, USA | REF: 533-534A | 5.2 Fr 145 °, 110 cm |
| Propofol | B. Braun Melsungen AG | PZN 11164495 | 20mg/ml, 1–2.5 mg/kg |
| Propofol | B. Braun Melsungen AG | PZN 11164443 | 10mg/ml, 2.5–8.0 mg/kg/h |
| Safety IV Catheter with Injection port | B. Braun Melsungen AG | LOT: 20D03G8346 | 18 G Catheter with Injection port |
| Sulbactam- ampicillin | Pfizer Pharma GmbH, Berlin, Germany | PZN: 4843132 | 3 g, 2.000 mg/ 1.000 mg |
| Sulbactam/ ampicillin | Instituto Biochimico Italiano G Lorenzini S.p.A. – Via Fossignano 2, Aprilia (LT) – Italien | ATC Code: J01CR01 | 20 mg/kg, 2 g/1 g |
| Surgical Blade | Brinkmann Medical ein Unternehmen der Dr. Junghans Medical GmbH | PZN: 354844 | 15 # |
| Surgical Blade | Brinkmann Medical ein Unternehmen der Dr. Junghans Medical GmbH | PZN: 354844 | 11 # |
| Suture | Johnson & Johnson | Hersteller Artikel Nr. EH7284H | 5-0 polypropylene |
Referenzen
- Bonhoeffer, P., et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet. 356 (9239), 1403-1405 (2000).
- Georgiev, S., et al. Munich comparative study: Prospective long-term outcome of the transcatheter melody valve versus surgical pulmonary bioprosthesis with up to 12 years of follow-up. Circulation. Cardiovascualar Interventions. 13 (7), 008963 (2020).
- Plessis, J., et al. Edwards SAPIEN transcatheter pulmonary valve implantation: Results from a French registry. JACC. Cardiovascular Interventions. 11 (19), 1909-1916 (2018).
- Bergersen, L., et al. Harmony feasibility trial: Acute and short-term outcomes with a self-expanding transcatheter pulmonary valve. JACC. Cardiovascular Interventions. 10 (17), 1763-1773 (2017).
- Cabalka, A. K., et al. Transcatheter pulmonary valve replacement using the melody valve for treatment of dysfunctional surgical bioprostheses: A multicenter study. The Journal of Thoracic and Cardiovascular Surgery. 155 (4), 1712-1724 (2018).
- Shahanavaz, S., et al. Transcatheter pulmonary valve replacement with the sapien prosthesis. Journal of the American College of Cardiology. 76 (24), 2847-2858 (2020).
- Motta, S. E., et al. Human cell-derived tissue-engineered heart valve with integrated Valsalva sinuses: towards native-like transcatheter pulmonary valve replacements. NPJ Regenerative Medicine. 4, 14 (2019).
- Uiterwijk, M., Vis, A., de Brouwer, I., van Urk, D., Kluin, J. A systematic evaluation on reporting quality of modern studies on pulmonary heart valve implantation in large animals. Interactive Cardiovascular Thoracic Surgery. 31 (4), 437-445 (2020).
- Duran, C. M., Gallo, R., Kumar, N. Aortic valve replacement with autologous pericardium: surgical technique. Journal of Cardiac Surgery. 10 (1), 1-9 (1995).
- Sá, M., et al. Aortic valve neocuspidization with glutaraldehyde-treated autologous pericardium (Ozaki Procedure) - A promising surgical technique. Brazilian Journal of Cardiovascular Surgery. 34 (5), 610-614 (2019).
- Karamlou, T., Pettersson, G., Nigro, J. J. Commentary: A pediatric perspective on the Ozaki procedure. The Journal of Thoracic and Cardiovascular Surgery. 161 (5), 1582-1583 (2021).
- Mazine, A., et al. Ross procedure in adults for cardiologists and cardiac surgeons: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (22), 2761-2777 (2018).
- Kwak, J. G., et al. Long-term durability of bioprosthetic valves in pulmonary position: Pericardial versus porcine valves. The Journal of Thoracic and Cardiovascular Surgery. 160 (2), 476-484 (2020).
- Ou-Yang, W. B., et al. Multicenter comparison of percutaneous and surgical pulmonary valve replacement in large RVOT. The Annals of Thoracic Surgery. 110 (3), 980-987 (2020).
- Reimer, J., et al. Implantation of a tissue-engineered tubular heart valve in growing lambs. Annals of Biomedical Engineering. 45 (2), 439-451 (2017).
- Schmitt, B., et al. Percutaneous pulmonary valve replacement using completely tissue-engineered off-the-shelf heart valves: six-month in vivo functionality and matrix remodelling in sheep. EuroIntervention. 12 (1), 62-70 (2016).
- Whiteside, W., et al. The utility of intracardiac echocardiography following melody transcatheter pulmonary valve implantation. Pediatric Cardiology. 36 (8), 1754-1760 (2015).
- Lancellotti, P., et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. European Heart Journal. Cardiovascular Imaging. 14 (7), 611-644 (2013).
- Kuang, D., Lei, Y., Yang, L., Wang, Y. Preclinical study of a self-expanding pulmonary valve for the treatment of pulmonary valve disease. Regenerative Biomaterials. 7 (6), 609-618 (2020).
- Arboleda Salazar, R., et al. Anesthesia for percutaneous pulmonary valve implantation: A case series. Anesthesia and Analgesia. 127 (1), 39-45 (2018).
- Cho, S. K. S., et al. Feasibility of ventricular volumetry by cardiovascular MRI to assess cardiac function in the fetal sheep. The Journal of Physiology. 598 (13), 2557-2573 (2020).
- Sun, X., et al. Four-dimensional computed tomography-guided valve sizing for transcatheter pulmonary valve replacement. Journal of Visualized Experiments: JoVE. (179), e63367 (2022).
- Knirsch, W., et al. Establishing a pre-clinical growing animal model to test a tissue engineered valved pulmonary conduit. Journal of Thoracic Disease. 12 (3), 1070-1078 (2020).
- Zhang, X., et al. Tissue engineered transcatheter pulmonary valved stent implantation: current state and future prospect. International Journal of Molecular Sciences. 23 (2), 723 (2022).
- Al Hussein, H., et al. Challenges in perioperative animal care for orthotopic implantation of tissue-engineered pulmonary valves in the ovine model. Tissue Engineering and Regenerative Medicine. 17 (6), 847-862 (2020).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Schmidt, D., et al. Minimally-invasive implantation of living tissue engineered heart valves: . a comprehensive approach from autologous vascular cells to stem cells. Journal of the American College of Cardiology. 56 (6), 510-520 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten