Method Article
Reemplazo de la válvula pulmonar transcatéter del pericardio autólogo con un stent de nitinol autoexpandible en un modelo de oveja adulta
En este artículo
Resumen
Este estudio demuestra la viabilidad y seguridad de desarrollar una válvula pulmonar autóloga para la implantación en la posición de la válvula pulmonar nativa mediante el uso de un stent de nitinol autoexpandible en un modelo de oveja adulta. Este es un paso hacia el desarrollo del reemplazo de la válvula pulmonar transcatéter para pacientes con disfunción del tracto de salida del ventrículo derecho.
Resumen
El reemplazo de la válvula pulmonar transcatéter se ha establecido como un enfoque alternativo viable para pacientes que sufren de disfunción del tracto de salida del ventrículo derecho o disfunción de la válvula bioprotésica, con excelentes resultados clínicos tempranos y tardíos. Sin embargo, los desafíos clínicos como el deterioro de la válvula cardíaca con stent, la oclusión coronaria, la endocarditis y otras complicaciones deben abordarse para la aplicación de por vida, particularmente en pacientes pediátricos. Para facilitar el desarrollo de una solución de por vida para los pacientes, se realizó un reemplazo autólogo de la válvula pulmonar transcatéter en un modelo de oveja adulta. El pericardio autólogo se cosechó de las ovejas mediante minitoracotomía anterolateral izquierda bajo anestesia general con ventilación. El pericardio se colocó en un modelo de válvula cardíaca con forma 3D para la reticulación no tóxica durante 2 días y 21 h. Se realizó ecocardiografía intracardíaca (ICE) y angiografía para evaluar la posición, morfología, función y dimensiones de la válvula pulmonar nativa (VAN). Después del recorte, el pericardio reticulado se cosió en un stent de nitinol autoexpandible y se engarzó en un sistema de administración de diseño propio. La válvula pulmonar autóloga (APV) se implantó en la posición de VAN a través de un cateterismo de la vena yugular izquierda. Se repitieron el ICE y la angiografía para evaluar la posición, morfología, función y dimensiones de la APV. Un APV fue implantado con éxito en ovejas J. En este trabajo, la oveja J fue seleccionada para obtener resultados representativos. Se implantó con precisión un APV de 30 mm con un stent de nitinol en la posición del VAN sin ningún cambio hemodinámico significativo. No hubo fuga paravalvular, ni nueva insuficiencia de la válvula pulmonar, ni migración de la válvula pulmonar con stent. Este estudio demostró la viabilidad y seguridad, en un seguimiento a largo plazo, de desarrollar una APV para la implantación en la posición de VAN con un stent de Nitinol autoexpandible a través de cateterismo de vena yugular en un modelo de oveja adulta.
Introducción
Bonhoeffer et al.1 marcaron el comienzo del reemplazo de la válvula pulmonar transcatéter (TPVR) en 2000 como una innovación rápida con un progreso significativo hacia la minimización de las complicaciones y la provisión de un enfoque terapéutico alternativo. Desde entonces, el uso de TPVR para tratar el tracto de salida del ventrículo derecho (RVOT) o la disfunción de la válvula bioprotésica ha aumentado rápidamente 2,3. Hasta la fecha, los dispositivos TPVR actualmente disponibles en el mercado han proporcionado resultados satisfactorios a largo y corto plazo para pacientes con disfunción RVOT 4,5,6. Además, se están desarrollando y evaluando varios tipos de válvulas TPVR, incluidas las válvulas cardíacas descelularizadas y las válvulas cardíacas impulsadas por células madre, y su viabilidad se ha demostrado en modelos preclínicos de animales grandes 7,8. La reconstrucción de la válvula aórtica utilizando un pericardio autólogo fue reportada por primera vez por el Dr. Durán, para lo cual se utilizaron tres protuberancias consecutivas de diferentes tamaños como plantillas para guiar la conformación del pericardio de acuerdo con las dimensiones del anillo aórtico, con una tasa de supervivencia del 84,53% en el seguimiento de 60 meses9. El procedimiento de Ozaki, que se considera un procedimiento de reparación de válvulas en lugar de un procedimiento de reemplazo de válvulas, consiste en reemplazar las valvas de la válvula aórtica con el pericardio autólogo tratado con glutaraldehído; sin embargo, en comparación con el procedimiento del Dr. Durán, mejoró significativamente en la medición de la válvula enferma con una plantilla para cortar el pericardio fijo10 y no solo se lograron resultados satisfactorios de los casos adultos sino también de los casos pediátricos11. Actualmente, solo el procedimiento de Ross puede proporcionar un sustituto de válvula viva para el paciente que tiene una válvula aórtica enferma con ventajas obvias en términos de evitar la anticoagulación a largo plazo, el potencial de crecimiento y el bajo riesgo de endocarditis12. Pero es posible que se requieran reintervenciones para el autoinjerto pulmonar y el conducto del ventrículo derecho a la arteria pulmonar después de un procedimiento quirúrgico tan complejo.
Las válvulas bioprotésicas actuales que están disponibles para uso clínico inevitablemente se degradan con el tiempo debido a las reacciones de injerto contra huésped a los tejidos xenogénicos porcinos o bovinos13. La calcificación, degradación e insuficiencia relacionadas con las válvulas podrían requerir intervenciones repetidas después de varios años, especialmente en pacientes jóvenes que necesitarían someterse a múltiples reemplazos de válvulas pulmonares en su vida debido a la falta de crecimiento de las válvulas, una propiedad inherente a los materiales bioprotésicos actuales14. Además, las válvulas TPVR actualmente disponibles, esencialmente no regenerativas, tienen limitaciones importantes como complicaciones tromboembólicas y hemorrágicas, así como una durabilidad limitada debido a la remodelación adversa de los tejidos que podría conducir a la retracción de la valva y a la disfunción valvular universal15,16.
Se plantea la hipótesis de que el desarrollo de una válvula pulmonar autóloga (APV) similar a la nativa montada en un stent de nitinol autoexpandible para TPVR con las características de autorreparación, regeneración y capacidad de crecimiento garantizaría el rendimiento fisiológico y la funcionalidad a largo plazo. Y el pericardio autólogo tratado con reticulador no tóxico puede despertar de los procedimientos de cosecha y fabricación. Con este fin, se realizó este ensayo preclínico para implantar una válvula pulmonar autóloga con stent en un modelo de oveja adulta con el objetivo de desarrollar sustitutos valvulares intervencionistas ideales y una metodología de procedimiento de bajo riesgo para mejorar la terapia transcatéter de la disfunción RVOT. En este artículo, la oveja J fue seleccionada para ilustrar el procedimiento integral de TPVR que incluye pericardiectomía e implantación de vena trans yugular de una válvula cardíaca autóloga.
Protocolo
Este estudio preclínico fue aprobado por el comité legal y ético de la Oficina Regional de Salud y Asuntos Sociales, Berlín (LAGeSo). Todos los animales (Ovis aries) recibieron atención humanitaria de conformidad con las directrices de las Sociedades Europeas y Alemanas de Ciencia de Animales de Laboratorio (FELASA, GV-SOLAS). El procedimiento se ilustra mediante la realización de un reemplazo autólogo de la válvula pulmonar en una oveja J de 3 años, 47 kg.
1. Manejo preoperatorio
- Alojar a todas las ovejas experimentales en la misma habitación que contiene paja durante 1 semana desde el día de llegada hasta el día de la pericardiectomía para mantener la compañía social (Figura 1A).
- Privar a las ovejas de comida pero no de agua durante 12 h antes de la pericardiectomía y la implantación.
- Premedicar a las ovejas con una inyección intramuscular de midazolam (0,4 mg/kg), butorfanol (0,4 mg/kg) y glicopirrolato (0,011 mg/kg o 200 mcg) 20 min antes de la intubación.
2. Inducción de anestesia general
- Coloque asépticamente un catéter intravenoso (IV) de seguridad de 18 G, un puerto de inyección y un puerto T en la vena cefálica (Figura 1B).
- Inducir anestesia mediante inyección intravenosa de propofol (20 mg/ml, 1–2,5 mg/kg) y fentanilo (0,01 mg/kg) para que surta efecto.
- Las indicaciones de un nivel adecuado de sedación incluyen relajación de la mandíbula, pérdida de la deglución y reflejo papilar. Después de la sedación, intubar a las ovejas con un tubo endotraqueal de tamaño adecuado (Figura 1C). Afeitar la oveja y luego transferirla a la sala de operaciones (OR).
3. Manejo de la anestesia intraoperatoria para la pericardiectomía y la implantación
- Use un ventilador mecánico con ciclo de presión para iniciar la ventilación intermitente con presión positiva (IPPV) con oxígeno al 100% en el quirófano.
- Conecte las ovejas a la plataforma del dispositivo anestésico y ventile a las ovejas durante toda la anestesia bajo modo de presión (volumen corriente (TV) = 8-12 ml / kg, frecuencia respiratoria (RF) = 12-14 respiraciones / min). Ajuste el televisor y la RF para mantener el dióxido de carbono de marea final (EtCO2) entre 35-45 mmHg y la presión arterial parcial de CO2 (PaCO2) por debajo de 50 mmHg.
- Mantener la anestesia combinada con isoflurano (a efecto, concentración de mantenimiento sugerida 1.5%-2.5%) en oxígeno con una tasa de flujo de 1 L/min (fracción inspirada de oxígeno (FiO2) = 75%), combinada con una infusión de velocidad continua (CRI) de fentanilo (5-15 mcg/kg/h) y midazolam (0.2-0.5 mg/kg/h).
- Coloque un catéter IV de seguridad de 18 G en la arteria auricular para la medición de la presión arterial invasiva (IBP).
- Conecte las ovejas a la plataforma de anestesia multifunción para monitoreo hemodinámico, que muestra la medición directa de la presión arterial invasiva (IBP) en la arteria auricular (puesta a cero a nivel del corazón), la temperatura corporal con una sonda rectal, un electrocardiograma de plomo IV, la saturación pletismográfica de oxígeno (SpO2), TV, RF, EtCO2, frecuencia cardíaca (HR) y FiO2.
- Coloque una sonda gástrica para evacuar el exceso de gas y líquidos del reticulorumen en preparación para la pericardiectomía. Equipar la sonda gástrica con un hilo guía marcador como referencia para la implantación.
- Coloque un catéter urinario foley a través de la uretra dentro de la vejiga conectado a una bolsa de orina. Distender el balón de foley con un mínimo de 5 ml de solución salina (NaCl al 0,9%).
- Realizar una prueba de coagulación activada (ACT: 240-300 s) 30 min antes de la implantación para confirmar suficiente heparinización antes y antagonización después de la implantación. Realizar análisis de gases en sangre arterial (ABG) para analizar el ambiente interno 30 min antes de la pericardiectomía y la implantación y cada hora durante los dos procedimientos.
- Administrar los siguientes antibióticos, a saber, sulbactam/ampicilina (20 mg/kg) 30 min por goteo intravenoso antes de la pericardiectomía y la implantación. Asegurar una infusión continua de cristaloides (5 mL/kg/h, solución isotónica equilibrada de electrolitos) e hidroxietilalmidón (HES, 30 mL/h) durante toda la pericardiectomía y la implantación.
4. Pericardiectomía
- Preparación para la pericardiectomía
- Coloque a las ovejas en la mesa de operaciones en la posición reclinada lateral derecha con una elevación de 30 ° en el lado izquierdo, y luego asegure sus extremidades con arneses y correas.
- Esterilizar el sitio quirúrgico (pericardiectomía: superiormente a la clavícula izquierda, anterior al esternón, inferior al nivel del diafragma y posteriormente a la línea mediaclavicular izquierda) con clorhexidina-alcohol antes de realizar la minitoracotomía. Cubra las áreas restantes con drapeado estéril (Figura 2A).
- Haga una incisión cutánea de 5 cm en la cuarta posición paraesternal intercostal usando una cuchilla quirúrgica # 10 bajo anestesia general.
- Diseccionar el músculo pectoral mayor-pectoral menor-serrato-intercostal anterior a través de la minitoracotomía lateral izquierda (m-LLT) en incisiones de 5 cm de longitud consecutiva y por separado en el tercer y cuarto espacio intercostal para una exposición ideal (Figura 2B).
- Haga la incisión al menos 2 cm de desplazamiento del esternón para evitar lesiones en la arteria torácica interna izquierda y las venas. Suspenda el ventilador durante 10 s para prevenir lesiones pulmonares antes de abrir el tórax.
- Use varias gasas estériles para comprimir el pulmón izquierdo para una mejor exposición del campo quirúrgico después de colocar un esparcidor de costillas (Figura 2C). Visualizar el pericardio y el timo en el campo quirúrgico (Figura 2D).
- Comience la pericardiectomía en el punto de unión del pericardio y el diafragma y recolecte el tejido pericárdico entre los dos nervios frénicos, hasta las venas innominadas, hasta el diafragma.
- Comprima el pulmón izquierdo como se menciona en el paso 4.1.5 para exponer la unión del diafragma-pericardio-pleura mediastínica. Abra la pleura mediastínica izquierda en la unión del diafragma-pericardio-pleura mediastínica haciendo una incisión de 1 cm de longitud usando una tijera quirúrgica. Extienda la incisión hacia arriba en las venas innominadas a lo largo de la línea que está a 1 cm de desplazamiento del nervio frénico izquierdo (Figura 2E).
- Repita el procedimiento para la parte derecha del pericardio elevando el ápice hacia la izquierda con los dedos. Diseccionar la grasa tímica y pericárdica del esternón.
- Conozca las dos incisiones del pericardio frente a la aorta. Pinza cruzada la intersección del pericardio y el timo de las dos incisiones pericárdicas frente a la aorta manteniéndolas firmemente en su lugar y atando seis nudos quirúrgicos manualmente utilizando una sutura no reabsorbible 4-0.
- Evite lesiones del nervio frénico y las estructuras vasculares subyacentes, al cosechar el pericardio. Diseccionar el tejido adiposo, incluido el timo, de la superficie del pericardio durante la pericardiectomía. Use una herramienta de cauterización (es decir, electrotomo, Bovie) para la hemostasia.
- Coloque el pericardio cosechado en la placa estéril con una escala de un centímetro para eliminar el tejido adiposo adicional, y luego lávelo dos veces en NaCl al 0.9% (Figura 2F). Verifique dos veces todas las áreas quirúrgicas para detectar hemostasia.
- Sutura la pleura mediastínica derecha abierta al borde pericárdico derecho residual con 3-0 polidioxanona en forma de carrera dos veces. Infle el pulmón derecho al volumen más grande manualmente usando una bolsa de respiración y manténgalo durante 10 s antes de cerrar el tórax derecho. Suturar la pleura mediastínica izquierda abierta al borde pericárdico izquierdo residual con 3-0 polidioxanona en forma de carrera dos veces.
- Cierre las incisiones torácicas izquierdas en cuatro capas como se describe a continuación.
- Suturar los músculos intercostales y el serrato anterior con 2-0 polidioxanona de manera simple interrumpida o cruciada, pectoral mayor-pectoral menor con 3-0 polidioxanona en forma corriente, el subcutis con 3-0 polidioxanona de manera cruzada y la piel con nylon 3-0 de manera simple interrumpida. Coloque todas las suturas a intervalos de 1 cm.
- Infle el pulmón izquierdo al volumen más grande manualmente usando un balón de respiración y manténgalo durante 10 s antes de cerrar los músculos intercostales.
- Cubra la incisión con una gasa estéril y comprimirla manualmente durante 5 minutos para evitar hemorragias después de la heparinización para la nueva implantación de la válvula cardíaca. Luego venda el sitio quirúrgico.
- Detenga los anestésicos intravenosos y el isoflurano al realizar la sutura de la piel para reducir la profundidad de la sedación.
- Retire la sonda gástrica y el catéter urinario después de que regrese la respiración espontánea. Luego transfiera las ovejas con oximetría de pulso a la sala de recuperación en la camilla.
- Retire el tubo endotraqueal cuando el reflejo de deglución, el reflejo papilar y la respiración espontánea normal se recuperen. Administrar 0,5 mg/kg de meloxicam por vía subcutánea una vez al día antes de la implantación.
- Una vez que la anestesia se invierte por completo (es decir, cuando las ovejas pueden pararse de forma independiente), las ovejas pueden tener acceso a alimentos y agua.
5. Preparación de la válvula cardíaca autóloga tridimensional
- Recorte el pericardio eliminando el tejido adiposo (Figura 3A, B, C) y luego colóquelo en el molde de la válvula cardíaca con forma 3D. (Debido a una solicitud de patente pendiente, no se pueden proporcionar cifras en este paso).
- Coloque el pericardio y el modelo de válvula cardíaca con modelado 3D en una incubadora con un reticulador no tóxico (30 ml) durante 2 días y 21 h (Figura 3D; debido a la solicitud de patente pendiente, no se pueden proporcionar cifras e información detallada del reticulador no tóxico en este paso).
6. Preparación del APV
- Lave la válvula cardíaca reticulada en NaCl al 0,9% dos veces y sutura en un stent de nitinol (30 mm de diámetro, 29,4 mm de altura, 48 células rómbicas) de forma discontinua después de 2 días y 21 h. Use polipropileno 5-0 para suturar la válvula cardíaca en su lugar usando de seis a ocho nudos para alinear los puntos de unión entre la válvula cardíaca y el stent. (Debido a una solicitud de patente, no se pueden proporcionar cifras en este paso).
- Corte los tres bordes libres de la válvula pulmonar autóloga abierta con una cuchilla quirúrgica no. 15 (Figura 4A, B). Sostenga la válvula pulmonar con stent con una pinza quirúrgica, levante y deje la APV en NaCl al 0,9% para probar su apertura y cierre y evaluar si las tres comisuras necesitan un corte adicional para lograr una mayor apertura del orificio.
- Incubar la APV en una incubadora durante 30 min para su esterilización en 47,6 mL de PBS con anfotericina B al 0,8% (0,4 mL) y penicilina/estreptomicina al 4,0% (2 mL). Engarce la válvula cardíaca con stent en la cabeza de un sistema de administración (DS) utilizando una crimpadora comercial para pruebas dobles (Figura 4C-D) y colóquela en el sistema de administración (Figura 4E).
7. Implantación de válvula pulmonar autóloga transcatéter a través de la vena yugular izquierda
- Anestesiar a las ovejas para la implantación de APV como se ilustra en los pasos 1 a 3.
- Acceso a los vasos: Afeitar las ovejas y esterilizar el campo quirúrgico, que incluye superiormente al borde inferior de la mandíbula, anterior a la línea mediana anterior, inferior al borde superior de la clavícula izquierda y posteriormente a la línea mediana posterior utilizando un antiséptico povidona-yodo antes de realizar la implantación. Cubra las áreas restantes sin afeitar y sin esterilizar con drapeado estéril.
- Marque la vena yugular izquierda en el cuello y, utilizando la técnica de Seldinger, coloque el alambre guía en la vena yugular izquierda. Amplíe el punto de punción con una cuchilla número 10, coloque una vaina de 11 F en la vena yugular izquierda para la sonda ICE y el sistema de administración (Figura 5A, B). Coloque una sutura de cuerda de bolso alrededor del introductor de la vaina con una sutura no absorbible 4-0.
- Ecocardiografía intracardíaca (ICE)17
- Realizar ICE antes e inmediatamente después de la implantación utilizando un catéter ecográfico de 10 Fr (Figura 5C). Evalúa los parámetros, incluidas las dimensiones y funciones del VAN, APV y válvula tricúspide mediante 2D, color, onda pulsada y Doppler continuo en el eje corto y largo.
- Evaluar el grado de regurgitación valvular en la vena contracta mediante evaluación semicuantitativa18 vía ICE (Figura 6).
- Angiografía19: Realizar angiografía utilizando un brazo C portátil y un cribado funcional para guiar la implantación midiendo los diámetros de la RVOT, npV, bulbo pulmonar y arteria pulmonar supravalvular, así como para evaluar la APV después de la implantación (Figura 7A-D).
- Hemodinámica20: Mida y registre la presión de la arteria ventricular derecha y pulmonar antes y después de la implantación utilizando un catéter de coleta de 5,2 F 145°. Medir la presión arterial sistémica a través de la arteria auricular.
- Implantación
- Establecimiento del tracto TPVR: Coloque un alambre guía en ángulo de 0.035 pulgadas a la arteria pulmonar derecha bajo la guía de fluoroscopia. Luego, coloque un catéter de coleta de 5.2 Fr en la vena yugular izquierda y avance hacia la arteria pulmonar derecha con la guía del alambre guía previamente colocado bajo fluoroscopia.
- Recupere el alambre guía en ángulo de la vena yugular izquierda. Coloque un catéter de balón angiográfico 5 Fr Berman en la vena yugular izquierda y avance hacia la arteria pulmonar derecha utilizando la guía del alambre guía.
- Pre-moldear el cable guía ultra rígido de 0.035 pulgadas en un círculo de aproximadamente 8-10 cm de longitud con un diámetro igual a la distancia desde el punto central de la válvula tricúspide hasta el punto central de la válvula pulmonar de acuerdo con la medición de fluoroscopia y avanzarlo hacia la arteria pulmonar derecha bajo la guía del catéter con balón (Figura 8A). Asegúrese de que el cable no interfiera con las cuerdas de la válvula tricúspide.
- Dilate la piel con una cuchilla nº 11 y dilata la vena yugular izquierda utilizando dilatadores comerciales de 16 Fr a 22 Fr secuencialmente (Figura 8B). Cierre la incisión con una sutura de hilo de polidioxanona 3-0 después de la dilatación (Figura 8C). Realizar angiografía para asegurar la posición deseada de la parte que lleva el stent del DS como se describe en19.
- Marque la unión sinotubular de la válvula pulmonar en las fases cardíaca sistólica final y diastólica final durante la angiografía pulmonar como el borde distal de la zona de aterrizaje y el plano basal de la válvula pulmonar como el borde proximal de la zona de aterrizaje.
- Vuelva a abrir e inspeccione la válvula autóloga con stent para detectar daños inducidos por engarzados. Vuelva a engarzar el APV y colóquelo en la cabeza del DS (Figura 8D). Avance el DS cargado a través del cable guía preformado a través del tracto de flujo ventricular derecho (RVIT) y el RVOT a la posición del VAN (Figura 8E, F y Figura 9A).
- Retraiga el tubo de cubierta del DS y despliegue el APV lenta y directamente sobre el VAN en la zona de aterrizaje al final de la fase diastólica bajo guía fluoroscópica (Figura 9A-C). Tenga cuidado cuando el DS cargado cruce la unión entre el RVIT y el RVOT para prevenir la lesión miocárdica y la fibrilación ventricular. La posición óptima para el APV es cuando la parte media del stent se coloca sobre el VAN.
- Retraiga la punta del DS con cuidado en el tubo de la cubierta después del despliegue y recupere el DS de las ovejas (Figura 9D). Repetir ICE (Figura 6D-F), angiografía (Figura 7C-D) y mediciones hemodinámicas para el postexamen de las dimensiones y funciones de la APV implantada. Cierre la incisión en el lado izquierdo del cuello con la sutura de cuerda de bolso precolocada y comprimirla manualmente.
8. Medicación periimplantacional
- Antes de la implantación, administrar a las ovejas heparina a una dosis de 5000 UI para mantener un tiempo de coagulación activado (ACT) de 240-300 s. Use pruebas ACT durante todo el procedimiento. Repita las pruebas de ACT cada 30 minutos después del inicio del procedimiento para confirmar tanto la heparinización suficiente antes como la antagonización después de la implantación.
- Antes de la implantación de APV, administrar magnesio al 10% a una dosis de 0,02 mol/L y amiodarona a una dosis de 3-5 mg/kg para prevenir arritmias cardíacas.
- Administrar sulbactam/ampicilina (20 mg/kg) por vía intravenosa para prevenir la infección y la endocarditis al inicio del procedimiento de pericardiectomía e implantación.
9. Manejo postoperatorio
- Realice un seguimiento postoperatorio diario durante 5 días, verificando el estado general de las ovejas en términos de frecuencia y ritmo cardíaco, profundidad respiratoria, ritmo respiratorio y sonido respiratorio (para verificar la neumonía postoperatoria), signos de dolor y otras anomalías. Revise la herida para detectar hinchazón postoperatoria, inflamación, enrojecimiento, sangrado y secreción.
- Continuar la anticoagulación durante 5 días con dalteparina 5000 UI u otra heparina de bajo peso molecular administrada por vía subcutánea una vez al día. Administrar 1 mg/kg de meloxicam mediante inyección subcutánea para analgesia postoperatoria durante 5 días.
- Realice un análisis de sangre de laboratorio, que incluye hematología, función hepática, función renal y química sérica para evaluar la condición física de las ovejas.
10. Seguimiento
- Realice ICE, imágenes de resonancia magnética cardíaca (cMRI), angiografía y registre la hemodinámica cada 3-6 meses después de la implantación durante un máximo de 21 meses. Realice ICE y angiografía como se ilustra arriba.
- Realice una RESONANCIA magnética funcional para evaluar la fracción de regurgitación (RF) en un escáner de resonancia magnética de 3.0 T utilizando un método estándar de cine-resonancia magnética dependiente de electrocardiograma21. Realizar tomografía computarizada (TC) cardíaca final para evaluar la posición del stent y la deformación del corazón derecho a lo largo de todo el ciclo cardíaco como se ilustra en nuestro estudio anterior22.
Resultados
En ovejas J, los APV (30 mm de diámetro) se implantaron con éxito en la "zona de aterrizaje" del RVOT.
En ovejas J, la hemodinámica se mantuvo estable a lo largo de toda la minitoracotomía anterolateral izquierda bajo anestesia general con ventilación, así como en la resonancia magnética de seguimiento y la ICE (Tabla 1, Tabla 2 y Tabla 3). El pericardio autólogo de 9 cm x 9 cm se recolectó y recortó mediante la extracción de tejido adicional (Figura 3A-C). El pericardio autólogo se colocó sobre el molde de conformación 3D y se reticuló en una incubadora con un reticulador no tóxico durante 2 días y 21 h (Figura 3D).
Se montó un stent de nitinol en el exterior del pericardio reticulado, y se utilizaron suturas de polipropileno 5-0 para coser el stent y la válvula cardíaca juntos de manera discontinua. Luego se abrió la válvula cardíaca con stent (Figura 4A-H).
El APV se engarzó en la cabeza de un sistema de entrega de diseño propio y avanzó a la posición de VAN bajo la guía de un cable guía rígido. El APV se desplegó con éxito y en su totalidad en la posición deseada del VAN sin ningún cambio hemodinámico significativo (Figura 8A-D).
La evaluación de LA ICE y la angiografía inmediatamente después del despliegue de la APV no mostraron fuga paravalvular, ni nueva insuficiencia de la válvula pulmonar, ni migración de la válvula pulmonar con stent de la APV (Figura 6D-F).
El stent implantado se ancló en la posición objetivo sin migración hacia adelante a la arteria pulmonar o hacia atrás hasta el RV, según la TC final. Además, el flujo sanguíneo en la arteria descendente anterior izquierda (LAD) y la arteria circunfleja izquierda (LCX) no se vio afectado por el stent durante todo el ciclo cardíaco (Figura 10).
La APV implantada con stent demostró una función y hemodinámica favorables en el sistema cardíaco derecho con una fracción de regurgitación del 5%-10% en la resonancia magnética de seguimiento y la ICE (Tabla 3).
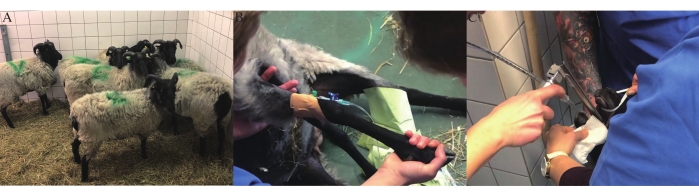
Figura 1: Preparación animal. (A) Ovejas para estudio preclínico. (B) Colocación de catéter intravenoso en la vena cefálica. C) Intubación orotraqueal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procedimiento de pericardiectomía. (A) El campo quirúrgico. (B) Marca quirúrgica en el tercer/cuarto espacio intercostal. (C) Colocación del retractor de costillas para la exposición. (D) Exposición de pericardio y timo. (E) Pericardiectomía. (F) Pericardio cosechado. Haga clic aquí para ver una versión más grande de esta figura.
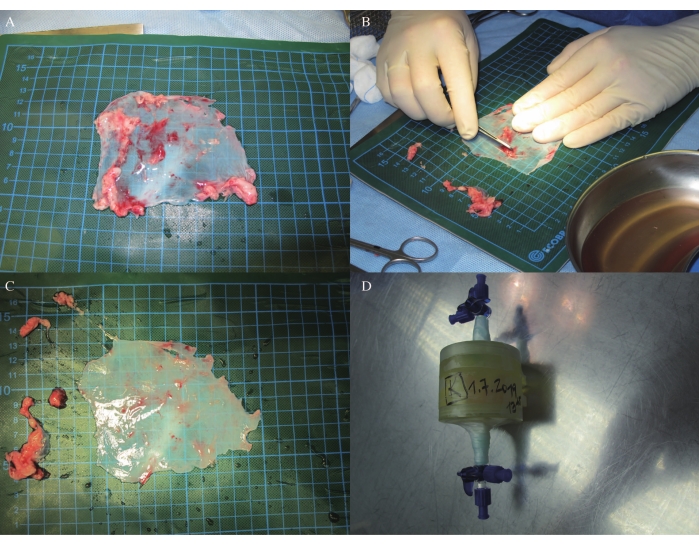
Figura 3: Recorte pericárdico y reticulación. (A-C) Recorte pericárdico. (D) Reticulación pericárdica en una incubadora. Haga clic aquí para ver una versión más grande de esta figura.
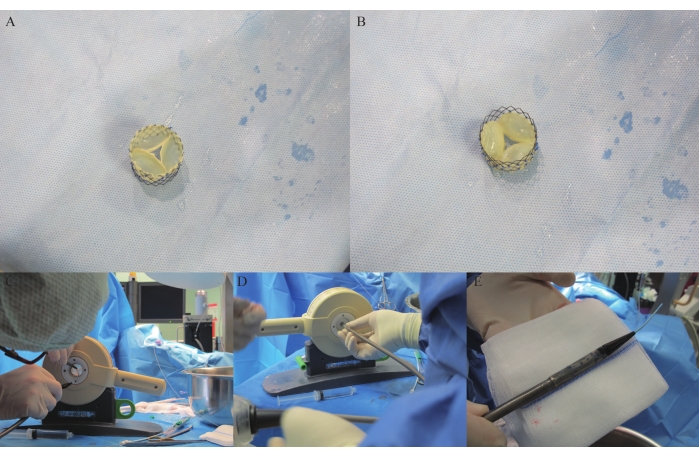
Figura 4: Colocación y carga de stents de APV en DS. (A) APV con stent visto desde la arteria pulmonar. (B) APV con stent visto desde el RVOT. (C-D) APV con stent que se engarza en la crimpadora. (E) APV engarzado con stent en el sistema de administración. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Establecimiento de acceso TPVR a través de la vena yugular izquierda. (A-B) Colocación de la vaina para la sonda ICE y el sistema de administración a través de la vena yugular izquierda. (C) Evaluación de ICE a través de la vena yugular izquierda. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Evaluaciones ICE previas y posteriores a la implantación. (A) Tamaño de la válvula pulmonar nativa. (B) Función de la válvula pulmonar nativa. (C) Velocidad de la válvula pulmonar nativa, gradiente de presión (PG) e integral de tiempo de velocidad (VTI). (D) Tamaño autólogo de la válvula pulmonar. (E) Función de la válvula pulmonar autóloga. (F) Velocidad de la válvula pulmonar autóloga, gradiente de presión (PG) e integral de tiempo de velocidad (VTI). Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Angiografía pre y postimplantación. (A) Angiografía de la arteria pulmonar y ventricular derecha antes de la implantación. (B) Angiografía de la arteria pulmonar antes de la implantación. (C) Angiografía del ventrículo derecho y de la arteria pulmonar después de la implantación. (D) Angiografía de la arteria pulmonar post-implantación. Haga clic aquí para ver una versión más grande de esta figura.
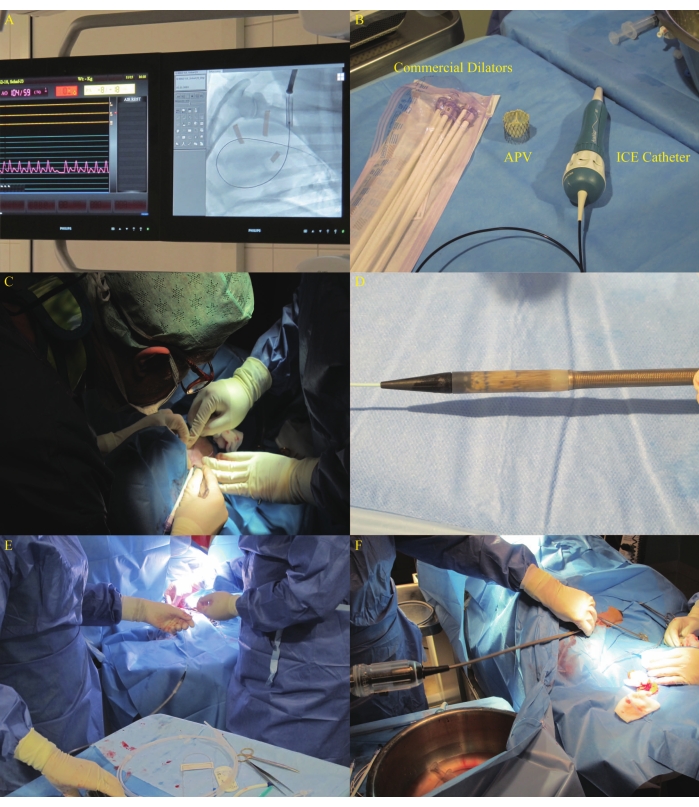
Figura 8: Avance de DS a través de la vena yugular izquierda. (A) Colocación de alambre guía en la arteria pulmonar derecha. (B) Dilatadores comerciales utilizados en el estudio. (C) Dilatación de la incisión mediante dilatadores en la vena yugular izquierda. (D) APV recrimpado que se instaló en la cabeza del DS. (E-F) Avance de DS. Haga clic aquí para ver una versión más grande de esta figura.
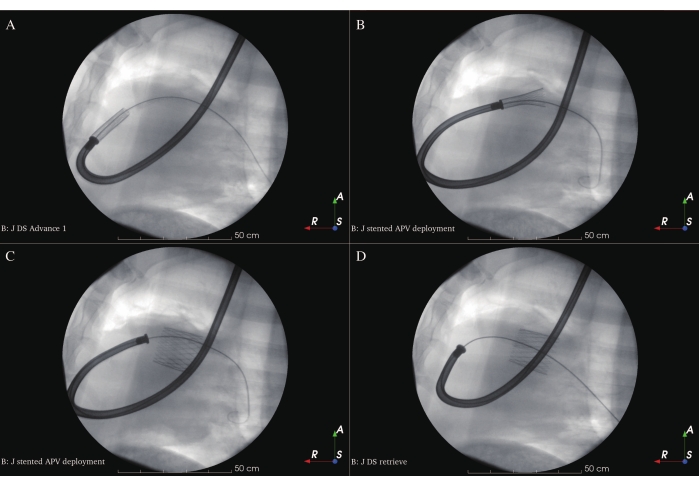
Figura 9: Implementación de APV con stent. (A) DS cargado en la posición de implementación. (B) Despliegue de APV con stent al principio. (C) Despliegue total de APV con stent. D) Recuperación de DS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Relación entre la arteria pulmonar con stent y la arteria coronaria izquierda a lo largo del ciclo cardíaco. Haga clic aquí para ver una versión más grande de esta figura.
| ABP (mmHg) | ABP media (mmHg) | HR (/ min) | SpO2 (%) | |
| Preimplantación | 129/104 | 115 | 98 | 98 |
| Post-Implantación | 113/89 | 98 | 93 | 97 |
Tabla 1: Hemodinámica durante la pericardiectomía. La presión arterial, la frecuencia cardíaca y la SpO2 de Sheep J durante la pericardiectomía se mantuvieron estables.
| ABP (mmHg) | ABP media (mmHg) | RVP (mmHg) | RVP media (mmHg) | PaP (mmHg) | PaP media (mmHg) | HR (/ min) | |
| Preimplantación | 108/61 | 74 | 11/ -7 | 0 | 13/0 | 3 | 70 |
| Post-Implantación | 116/69 | 84 | 13/-9 | -3 | 10/-6 | 1 | 67 |
Tabla 2: Hemodinámica durante la implantación. La presión arterial, la presión pulmonar, la frecuencia cardíaca y la SpO2 de Sheep J durante la implantación se mantuvieron estables.
| MRI- Fracción regurgitante (%) | Presión ventricular derecha (media) (mmHg) | Presión arterial pulmonar (media) (mmHg) | Presión atmosférica sistemática | |
| Preimplantación | - | 11/-7 (0) | 13/0 (3) | 108/61 (74) |
| Post-implantación | - | 13/-9 (-3) | 10/-6 (1) | 116/69 (84) |
| Seguimiento 4 meses | 5 | - | - | - |
| Seguimiento 7 meses | 7 | 27/4 (11) | 23/11 (16) | - |
| Seguimiento 10 meses | 5 | - | - | - |
| Seguimiento 15 meses | 7 | 26/-2 (12) | 23/15 (18) | - |
| Seguimiento 18 meses | 10 | 26/12 (14) | 23/18 (20) | - |
| Seguimiento 21 meses | 6 | 20/-8 (16) | 19/6 (11) | - |
| ICE (PV) | Vmax fotovoltaico (m/s) | PV maxPG (mmHg) | PV mediaPG (mmHg) | PR Vmax (m/s) | PR EROA (cm²) | Volumen de regurgitación PR (ml) |
| Preimplantación | 0.71 | 2.01 | 1.06 | 0.76 | 0.25 | 1.7 |
| Post-implantación | 0.75 | 2.22 | 1.19 | 0.78 | 0.2 | 1 |
| Seguimiento 4 meses | - | - | - | - | - | - |
| Seguimiento 7 meses | 0.8 | 2.58 | 1.12 | 0.94 | 0.2 | 3 |
| Seguimiento 10 meses | - | - | - | - | - | - |
| Seguimiento 15 meses | 1.08 | 4.64 | 1.76 | - | 0.3 | 1 |
| Seguimiento 18 meses | 0.75 | 2.22 | 0.97 | 0.87 | 0.3 | 1 |
| Seguimiento 21 meses | 0.61 | 1.46 | 0.61 | 0.53 | 0.1 | 1 |
| PV: Válvula pulmonar | PG: Gradiente de presión | EROA: Área de orificio de regurgitación efectiva | PR: Regurgitación de Pulmoanry |
| ICE (TV) | TV Vmax (m/s) | TV maxPG (mmHg) | TV meanPG (mmHg) | TR Vmax (m/s) |
| Preimplantación | - | - | - | - |
| Post-implantación | 0.56 | 1.27 | 0.48 | 0.83 |
| Seguimiento 4 meses | - | - | - | - |
| Seguimiento 7 meses | 0.99 | 3.92 | 1.68 | 0.84 |
| Seguimiento 10 meses | - | - | - | - |
| Seguimiento 15 meses | 0.95 | 3.6 | 1.47 | 1.04 |
| Seguimiento 18 meses | 0.95 | 3.6 | 1.47 | 1.03 |
| Seguimiento 21 meses | 0.94 | 3.56 | 1.31 | 0.95 |
| TV: Válvula tricúspide |
Tabla 3: Datos de seguimiento de RM e ICE. Se realizó un seguimiento de 21 meses con resonancia magnética y se encontró que la fracción de regurgitación de la válvula pulmonar autóloga de oveja J era del 5% al 10%, lo que mostró una función valvular favorable. La ecocardiografía intracardíaca de oveja j mostró que la válvula pulmonar autóloga solo tenía de 1 ml a 3 ml de volumen de regurgitación con función normal de la válvula tricúspide.
Discusión
Este estudio representa un importante paso adelante en el desarrollo de una válvula pulmonar viva para tpVR. En un modelo de oveja adulta, el método fue capaz de demostrar que una APV derivada del propio pericardio de la oveja se puede implantar con un stent de nitinol autoexpandible a través del cateterismo de la vena yugular. En ovejas J, la válvula pulmonar autóloga con stent se implantó con éxito en la posición pulmonar correcta utilizando un sistema de administración universal autodiseñado. Después de la implantación, la válvula cardíaca de la oveja J mostró una buena funcionalidad durante un máximo de 21 meses, sirviendo no solo como evidencia preclínica segura y eficiente para el futuro ensayo preclínico con una válvula pulmonar autóloga en ovejas inmaduras, sino también para la traducción al entorno clínico.
TPVR-AVP mediante cateterismo de la vena yugular en un modelo de oveja adulta
Debido a las similitudes anatómicas y hemodinámicas con los humanos, las ovejas adultas son uno de los modelos animales grandes más populares y ampliamente utilizados en numerosas investigaciones que evalúan la funcionalidad y el rendimiento de las válvulas cardíacas bioprotésicas23,24. Para el cateterismo y la implantación, se da preferencia al abordaje venoso transyugular sobre el venoso transfemoral, que requiere un perfil más amplio del sistema de administración y se asocia con un manejo más difícil durante y después de la implantación. El APV se puede administrar a través del ventrículo derecho de la aurícula tricúspide SVC-válvula tricúspide derecha a la posición pulmonar con una distancia más corta y un ángulo más grande entre el SVC-RA en comparación con el IVC-RA, lo que podría facilitar el avance del sistema de administración cargado en el RV.
Pericardiectomía
El pericardio autólogo de 9 cm x 9 cm de oveja J se cosechó sin lesión en el nervio frénico y la arteria torácica interna izquierda y las venas. Las ovejas no sufrieron espasmo diafragmático, insuficiencia respiratoria o complicaciones hemorrágicas después de la minitoracotomía. Debido al estrecho espacio entre las costillas en las ovejas, fue difícil lograr la exposición deseada del pericardio en la minitoracotomía, especialmente durante la pericardiectomía. Por lo tanto, se debe tener precaución durante la disección de tejidos para evitar lesiones en las raíces aórtica y pulmonar, la arteria coronaria y el nervio frénico25. La anestesia general se mantuvo con isoflurano, fentanilo y midazolam sin relajantes musculares para el renacimiento temprano y la hemodinámica estable. Sin embargo, si los pacientes se han sometido a pericardiectomía y/o pericardiotomía durante cirugías previas, existen limitaciones para realizar la toracotomía para adquirir el pericardio. En primer lugar, puede dar lugar a una hemorragia incontrolable debido a las suturas colocadas durante las operaciones anteriores al movilizar el pericardio frente a la aorta ascendente, el tronco pulmonar, las arterias coronarias y el miocardio. Además, el pericardio no podría ser suficiente para fabricar una válvula cardíaca autóloga, que necesita al menos 9 cm x 9 cm de tamaño de tejido para una válvula cardíaca de 30 mm de diámetro. Además, la calidad del pericardio podría no cumplir con el requisito de la nueva válvula cardíaca con stent. Incluso si el pericardio cosechado es suficiente para una válvula cardíaca autóloga, la hemostasia en el área quirúrgica es extremadamente difícil después de la heparinización sistemática antes de la TPVR. En estas situaciones, la fascia recto, la fascia lata y la fascia transversal podrían ser candidatos para cosechar el tejido autólogo para la válvula cardíaca.
Implantación
Antes de cargar el APV con stent en el sistema de administración, debe engarzarse en una crimpadora comercial para su prueba. El stent se alargaría hasta en un 10% durante el engarce, lo que podría provocar una ruptura relacionada con el estrés en la mayoría de los puntos de sutura de las valvas y los accesorios de las comisuras. En la oveja J, se probó una válvula con stent de 30 mm y se cargó en un sistema de administración de 26 Fr utilizando una crimpadora sin pérdida de ruptura y sutura. Un dispositivo pequeño (incluido el APV con stent) y el sistema de administración serían beneficiosos en términos de ajuste de la vena yugular, particularmente para los niños. La miniaturización del dispositivo TPVR mejoraría la seguridad perioperatoria en futuros implantes transfemorales.
Según la experiencia previa, el avión fotovoltaico se movió aproximadamente 2 cm en cada ciclo cardíaco, lo que presentó un gran desafío al desplegar el APV en la posición correcta. Además, las ovejas sanas no tenían puntos de referencia claros, como las calcificaciones en la zona de aterrizaje, lo que ocurre comúnmente en el caso de pacientes humanos, lo que dificulta el posicionamiento preciso. Además, debido a la fuerza radial, el stent de nitinol autoexpandible saltó del sistema de administración o incluso a la arteria pulmonar cuando se descubrieron aproximadamente 2/3 del stent tan pronto como se retiró el tubo externo. Se necesitan más refinamientos del stent y el sistema de administración con arquitecturas de reposicionamiento para controlar mejor el despliegue en caso de posicionamiento incorrecto y al retirar el APV con stent en el tubo. En ovejas J, el APV se implantó en la posición correcta con la ayuda del sistema de administración, que funcionó de manera excelente sin torceduras ni saltos de stent.
Seguimiento por resonancia magnética, ICE y tomografía computarizada final
La APV implantada con stent mostró una función valvular favorable con una fracción de regurgitación del 5% al 10% en la resonancia magnética, hemodinámica estable en la ICE y la posición de anclaje deseada con relaciones de vecindad a la arteria coronaria izquierda a lo largo de todo el ciclo cardíaco en los seguimientos a largo plazo. Los resultados de este estudio proporcionaron pruebas sólidas del rendimiento macroscópico estable de una APV con stent, lo que puede aportar beneficios a los pacientes que sufren de RVOT disfuncional.
En ensayos con animales grandes, la disfunción valvular se ha demostrado mediante la remodelación valvular mal referida, que incluye delaminación, engrosamiento de la valva, retracción de la valva e irregularidades26,27. De acuerdo con las normas actuales de la Organización Internacional de Normalización (ISO) para prótesis de válvulas cardíacas en una circulación de baja presión, la regurgitación de la válvula cardíaca de hasta el 20% es aceptable. Teniendo en cuenta el proceso de fabricación de un APV, la geometría de la válvula con conformación 3D es el factor clave para lograr un resultado favorable en este trabajo. Además, la geometría de la válvula, las propiedades del material y las condiciones de carga hemodinámica pueden determinar la funcionalidad y la remodelación de la válvula26. La APV se realizó muy cerca de un VAN, con una insuficiencia valvular mínima evaluada por ICE inmediatamente después de la implantación.
Conclusión
En el gran estudio en animales reportado aquí, nuestro objetivo fue crear y probar un método para la implantación de venas transyugulares de una válvula pulmonar autóloga montada en un stent de nitinol autoexpandible. Un APV se implantó con éxito en ovejas J utilizando esta metodología y un sistema de entrega autodiseñado. Los APV resistieron la tensión durante el engarzado, la carga y el despliegue y lograron la funcionalidad de válvula deseada.
Este estudio demostró la viabilidad y seguridad en un seguimiento a largo plazo del desarrollo de una APV para la implantación en la posición de NPV con un stent de nitinol autoexpandible a través del cateterismo de la vena yugular en un modelo de oveja adulta.
Limitaciones
Este estudio preclínico presentó muchas limitaciones que no pudieron abordarse completamente debido al pequeño número de ovejas. El stent de nitinol y el sistema de administración utilizado en este estudio carecían de arquitecturas para el reposicionamiento; esto tendría que ser refinado para futuros ensayos con animales. Además, sería interesante evaluar la funcionalidad de la APV más allá del período de estudio para investigar más a fondo el rendimiento y la formación de folletos después de al menos 1 año de seguimiento posterior a la implantación. Además, el sistema de administración debe mejorarse con un perfil bajo y una característica de transitabilidad flexible para prevenir la arritmia y la lesión miocárdica durante la implantación. Todavía existe la necesidad de desarrollar un stent biodegradable que permita el crecimiento de APV en los niños para eliminar la necesidad de múltiples reemplazos de válvulas cardíacas.
Divulgaciones
Los autores no tienen conflictos de intereses financieros que revelar.
Agradecimientos
Extendemos nuestro más sincero agradecimiento a todos los que contribuyeron a esta labor, tanto a los miembros pasados como a los presentes. Este trabajo fue apoyado por subvenciones del Ministerio Federal Alemán de Asuntos Económicos y Energía, EXIST - Transferencia de Investigación (03EFIBE103). Yimeng Hao cuenta con el apoyo del Consejo de Becas de China (CSC: 202008450028).
Materiales
| Name | Company | Catalog Number | Comments |
| 10 % Magnesium | Inresa Arzneimittel GmbH | PZN: 00091126 | 0.02 mol/ L, 10X10 ml |
| 10 Fr Ultrasound catheter | Siemens Healthcare GmbH | SKU 10043342RH | ACUSON AcuNav™ ultrasound catheter |
| 3D Slicer | Slicer | Slicer 4.13.0-2021-08-13 | Software: 3D Slicer image computing platform |
| Adobe Illustrator | Adobe | Adobe Illustrator 2021 | Software |
| Amiodarone | Sanofi-Aventis Deutschland GmbH | PZN: 4599382 | 3- 5 mg/ kg, 150 mg/ 3 ml |
| Amplatz ultra-stiff guidewire | COOK MEDICAL LLC, USA | Reference Part Number:THSF-35-145-AUS | 0.035 inch, 145 cm |
| Anesthetic device platform | Drägerwerk AG & Co. KGaA | 8621500 | Dräger Atlan A350 |
| ARROW Berman Angiographic Balloon Catheter | Teleflex Medical Europe Ltd | LOT: 16F16M0070 | 5Fr, 80cm (X) |
| Butorphanol | Richter Pharma AG | Vnr531943 | 0.4mg/kg |
| C-Arm | BV Pulsera, Philips Heathcare, Eindhoven, The Netherlands | CAN/CSA-C22.2 NO.601.1-M90 | Medical electral wquipment |
| Crimping tool | Edwards Lifesciences, Irvine, CA, USA | 9600CR | Crimper |
| CT | Siemens Healthcare GmbH | − | CT platform |
| Dilator | Edwards Lifesciences, Irvine, CA, USA | 9100DKSA | 14- 22 Fr |
| Ethicon Suture | Ethicon | LOT:MKH259 | 4- 0 smooth monophilic thread, non-resorbable |
| Ethicon Suture | Ethicon | LOT:DEE274 | 3-0, 45 cm |
| Fast cath hemostasis introducer | ST. JUDE MEDICAL Minnetonka MN | LOT Number: 3458297 | 11 Fr |
| Fentanyl | Janssen-Cilag Pharma GmbH | DE/H/1047/001-002 | 0.01mg/kg |
| Fragmin | Pfizer Pharma GmbH, Berlin, Germany | PZN: 5746520 | Dalteparin 5000 IU/ d |
| Functional screen | BV Pulsera, Philips Heathcare, Eindhoven, The Netherlands | System ID: 44350921 | Medical electral wquipment |
| Glycopyrroniumbromid | Accord Healthcare B.V | PZN11649123 | 0.011mg/kg |
| Guide Wire M | TERUMO COPORATION JAPAN | REF*GA35183M | 0.89 mm, 180 cm |
| Hemochron Celite ACT | International Technidyne Corporation, Edison, USA | NJ 08820-2419 | ACT |
| Heparin | Merckle GmbH | PZN: 3190573 | Heparin-Natrium 5.000 I.E./0,2 ml |
| Hydroxyethyl starch (Haes-steril 10 %) | Fresenius Kabi Deutschland GmbH | ATC Code: B05A | 500 ml, 30 ml/h |
| Imeron 400 MCT | Bracco Imaging | PZN00229978 | 2.0–2.5 ml/kg, Contrast agent |
| Isoflurane | CP-Pharma Handelsges. GmbH | ATCvet Code: QN01AB06 | 250 ml, MAC: 1 % |
| Jonosteril Infusionslösung | Fresenius Kabi Deutschland GmbH | PZN: 541612 | 1000 ml |
| Ketamine | Actavis Group PTC EHF | ART.-Nr. 799-762 | 2–5 mg/kg/h |
| Meloxicam | Boehringer Ingelheim Vetmedica GmbH | M21020A-09 | 20 mg/ mL, 50 ml |
| Midazolam | Hameln pharma plus GMBH | MIDAZ50100 | 0.4mg/kg |
| MRI | Philips Healthcare | − | Ingenia Elition X, 3.0T |
| Natriumchloride (NaCl) | B. Braun Melsungen AG | PZN /EAN:04499344 / 4030539077361 | 0.9 %, 500 ml |
| Pigtail catheter | Cordis, Miami Lakes, FL, USA | REF: 533-534A | 5.2 Fr 145 °, 110 cm |
| Propofol | B. Braun Melsungen AG | PZN 11164495 | 20mg/ml, 1–2.5 mg/kg |
| Propofol | B. Braun Melsungen AG | PZN 11164443 | 10mg/ml, 2.5–8.0 mg/kg/h |
| Safety IV Catheter with Injection port | B. Braun Melsungen AG | LOT: 20D03G8346 | 18 G Catheter with Injection port |
| Sulbactam- ampicillin | Pfizer Pharma GmbH, Berlin, Germany | PZN: 4843132 | 3 g, 2.000 mg/ 1.000 mg |
| Sulbactam/ ampicillin | Instituto Biochimico Italiano G Lorenzini S.p.A. – Via Fossignano 2, Aprilia (LT) – Italien | ATC Code: J01CR01 | 20 mg/kg, 2 g/1 g |
| Surgical Blade | Brinkmann Medical ein Unternehmen der Dr. Junghans Medical GmbH | PZN: 354844 | 15 # |
| Surgical Blade | Brinkmann Medical ein Unternehmen der Dr. Junghans Medical GmbH | PZN: 354844 | 11 # |
| Suture | Johnson & Johnson | Hersteller Artikel Nr. EH7284H | 5-0 polypropylene |
Referencias
- Bonhoeffer, P., et al. Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction. Lancet. 356 (9239), 1403-1405 (2000).
- Georgiev, S., et al. Munich comparative study: Prospective long-term outcome of the transcatheter melody valve versus surgical pulmonary bioprosthesis with up to 12 years of follow-up. Circulation. Cardiovascualar Interventions. 13 (7), 008963 (2020).
- Plessis, J., et al. Edwards SAPIEN transcatheter pulmonary valve implantation: Results from a French registry. JACC. Cardiovascular Interventions. 11 (19), 1909-1916 (2018).
- Bergersen, L., et al. Harmony feasibility trial: Acute and short-term outcomes with a self-expanding transcatheter pulmonary valve. JACC. Cardiovascular Interventions. 10 (17), 1763-1773 (2017).
- Cabalka, A. K., et al. Transcatheter pulmonary valve replacement using the melody valve for treatment of dysfunctional surgical bioprostheses: A multicenter study. The Journal of Thoracic and Cardiovascular Surgery. 155 (4), 1712-1724 (2018).
- Shahanavaz, S., et al. Transcatheter pulmonary valve replacement with the sapien prosthesis. Journal of the American College of Cardiology. 76 (24), 2847-2858 (2020).
- Motta, S. E., et al. Human cell-derived tissue-engineered heart valve with integrated Valsalva sinuses: towards native-like transcatheter pulmonary valve replacements. NPJ Regenerative Medicine. 4, 14 (2019).
- Uiterwijk, M., Vis, A., de Brouwer, I., van Urk, D., Kluin, J. A systematic evaluation on reporting quality of modern studies on pulmonary heart valve implantation in large animals. Interactive Cardiovascular Thoracic Surgery. 31 (4), 437-445 (2020).
- Duran, C. M., Gallo, R., Kumar, N. Aortic valve replacement with autologous pericardium: surgical technique. Journal of Cardiac Surgery. 10 (1), 1-9 (1995).
- Sá, M., et al. Aortic valve neocuspidization with glutaraldehyde-treated autologous pericardium (Ozaki Procedure) - A promising surgical technique. Brazilian Journal of Cardiovascular Surgery. 34 (5), 610-614 (2019).
- Karamlou, T., Pettersson, G., Nigro, J. J. Commentary: A pediatric perspective on the Ozaki procedure. The Journal of Thoracic and Cardiovascular Surgery. 161 (5), 1582-1583 (2021).
- Mazine, A., et al. Ross procedure in adults for cardiologists and cardiac surgeons: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (22), 2761-2777 (2018).
- Kwak, J. G., et al. Long-term durability of bioprosthetic valves in pulmonary position: Pericardial versus porcine valves. The Journal of Thoracic and Cardiovascular Surgery. 160 (2), 476-484 (2020).
- Ou-Yang, W. B., et al. Multicenter comparison of percutaneous and surgical pulmonary valve replacement in large RVOT. The Annals of Thoracic Surgery. 110 (3), 980-987 (2020).
- Reimer, J., et al. Implantation of a tissue-engineered tubular heart valve in growing lambs. Annals of Biomedical Engineering. 45 (2), 439-451 (2017).
- Schmitt, B., et al. Percutaneous pulmonary valve replacement using completely tissue-engineered off-the-shelf heart valves: six-month in vivo functionality and matrix remodelling in sheep. EuroIntervention. 12 (1), 62-70 (2016).
- Whiteside, W., et al. The utility of intracardiac echocardiography following melody transcatheter pulmonary valve implantation. Pediatric Cardiology. 36 (8), 1754-1760 (2015).
- Lancellotti, P., et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. European Heart Journal. Cardiovascular Imaging. 14 (7), 611-644 (2013).
- Kuang, D., Lei, Y., Yang, L., Wang, Y. Preclinical study of a self-expanding pulmonary valve for the treatment of pulmonary valve disease. Regenerative Biomaterials. 7 (6), 609-618 (2020).
- Arboleda Salazar, R., et al. Anesthesia for percutaneous pulmonary valve implantation: A case series. Anesthesia and Analgesia. 127 (1), 39-45 (2018).
- Cho, S. K. S., et al. Feasibility of ventricular volumetry by cardiovascular MRI to assess cardiac function in the fetal sheep. The Journal of Physiology. 598 (13), 2557-2573 (2020).
- Sun, X., et al. Four-dimensional computed tomography-guided valve sizing for transcatheter pulmonary valve replacement. Journal of Visualized Experiments: JoVE. (179), e63367 (2022).
- Knirsch, W., et al. Establishing a pre-clinical growing animal model to test a tissue engineered valved pulmonary conduit. Journal of Thoracic Disease. 12 (3), 1070-1078 (2020).
- Zhang, X., et al. Tissue engineered transcatheter pulmonary valved stent implantation: current state and future prospect. International Journal of Molecular Sciences. 23 (2), 723 (2022).
- Al Hussein, H., et al. Challenges in perioperative animal care for orthotopic implantation of tissue-engineered pulmonary valves in the ovine model. Tissue Engineering and Regenerative Medicine. 17 (6), 847-862 (2020).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Schmidt, D., et al. Minimally-invasive implantation of living tissue engineered heart valves: . a comprehensive approach from autologous vascular cells to stem cells. Journal of the American College of Cardiology. 56 (6), 510-520 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados