Method Article
אגרובקטריום -תווךטרנספורמציה גנטית, ייצור טרנסגנית, ויישום שלה לחקר התפתחות הרבייה הגברית באורז
* These authors contributed equally
In This Article
Summary
עבודה זו מתארת את השימוש בטכנולוגיית עריכת הגנום CRISPR-Cas9 כדי נוקאאוט גן אנדוגני OsABCG15 ואחריו Agrobacterium שונה-פרוטוקול טרנספורמציה בתיווך לייצר קו זכר סטרילי יציב באורז.
Abstract
עקירת הזכר היא תכונה אגרונומית חשובה לייצור זרעים היברידיים המאופיינת בדרך כלל על ידי פגמים פונקציונליים באיברי רבייה/גימטים גבריים. ההתפתחויות האחרונות בטכנולוגיית עריכת הגנום CRISPR-Cas9 מאפשרות יעילות עריכה גבוהה ומוטציות נוקאאוט מצילות זמן של גנים של מועמדים אנדוגניים באתרים ספציפיים. בנוסף, אגרובקטריום-מתווכים טרנספורמציה גנטית של אורז היא גם שיטת מפתח לשינוי גנים, אשר אומצה באופן נרחב על ידי מעבדות ציבוריות ופרטית רבות. במחקר זה, יישם CRISPR-Cas9 כלי עריכת הגנום ויצרנו בהצלחה שלושה קווי מוטציה סטרילי זכר על ידי עריכת גנום ממוקד של OsABCG15 ב cultivar japonica. השתמשנו בשיטת שינוי אגרובקטריום-מתווכת אורז שיכול לספק אמצעים מצוינים של סירוס גנטי לייצור זרעים היברידיים באורז. צמחים טרנסגניים ניתן להשיג בתוך 2-3 חודשים וטרנספורמטורים הומוזיגים הוקרן על ידי genotyping באמצעות ההגדלה PCR ו רצף סנגר. אפיון פנוטיפי בסיסי של קו הומוזיגוס סטרילי זכר בוצע על ידי תצפית מיקרוסקופית של איברי הרבייה זכר האורז, ניתוח קיימות אבקה על ידי יוד אשלגן יודיד (I2-KI) מכתים חצי דק חתך של anthers מתפתח.
Introduction
אורז הוא יבול המזון החשוב ביותר, במיוחד במדינות מתפתחות, ומייצג מזון בסיסי עבור יותר ממחצית מאוכלוסיית העולם. בסך הכל, הביקוש לדגן אורז גדל והוא צפוי לגדול ב-50% עד 2030 ו-100% עד 20501,,2. שיפורים עתידיים בתפוקת אורז יצטרכו לנצל משאבים מולקולריים וגנטיים מגוונים ש הופכים את האורז למודל מצוין למחקר צמחים מונוקוטלדונים. אלה כוללים מערכת טרנספורמציה יעילה, מפה מולקולרית מתקדמת, ומסד נתונים נגיש לציבור של תגי רצף מבוטאים, אשר נוצרובמשך שנים רבות 3,4. אסטרטגיה אחת לשיפור תפוקת היבול היא ייצורזרעים היברידיים 5, מרכיב מרכזי שבו היא היכולת לתמרן את הפוריות הגברית. הבנת השליטה המולקולרית של פוריות הגבר בגידולי דגנים יכולה לעזור לתרגם ידע מפתח לטכניקות מעשיות כדי לשפר את ייצור הזרעים היברידיים ולשפראת פרודוקטיביות היבול 6,7.
טרנספורמציה גנטית היא כלי מפתח למחקר בסיסי וחקלאות מסחרית שכן היא מאפשרת הכנסת גנים זרים או מניפולציה של גנים אנדוגניים בצמחי יבול, ותוצאות יצירת קווים מהונדסים גנטית. פרוטוקול טרנספורמציה מתאים יכול לעזור להאיץ מחקרים גנטיים ומולקולריים ביולוגיה להבנה בסיסית של ויסותגנים 8. בחיידקים, טרנספורמציה גנטית מתרחשת באופן טבעי; עם זאת, בצמחים, הוא מבוצע באופן מלאכותי באמצעות טכניקות ביולוגיהמולקולרית 9,10. אגרובקטריום tumefaciens הוא קרקע נישאת, חיידק גראם שלילי הגורמים למחלת מרה הכתר בצמחים על ידי העברת T-DNA, אזור של Ti plasmid שלה, לתוך תא הצמח באמצעות מערכת הפרשת סוגIV 11,12. בצמחים, A. tumefaciens-תווך טרנספורמציה נחשבת שיטה נפוצה לשינוי גנים כי זה מוביל יציב ושילוב מספר עותק נמוך של T-DNA לתוך הגנוםהמארח 13. אורז טרנסגני נוצר לראשונה באמצעות טרנספורמציהגנטית מתווכת אגרובקטריום באמצע שנות ה־90 של המאה ה־20, ב־japonica cultivar14. באמצעות פרוטוקול זה, מספר קווים טרנסגניים הושגו בתוך תקופה של 4 חודשים עם יעילות טרנספורמציה של 10%-30%. המחקר הצביע על כך שיש שני צעדים קריטיים לטרנספורמציה המוצלחת: האחד הוא אינדוקציה של תרכובת עוברית מזרעים בוגרים והשנייה היא תוספת של acetosyringone, תרכובת פנולית, לתרבות החיידקית במהלך טיפוח שותף, המאפשר יעילות טרנספורמציה גבוהה יותר בצמחים14,15. פרוטוקול זה שימש בהרחבה עם שינויים קלים japonica16,17,,18,19, כמו גם cultivars אחרים כגון indica20,21,22,,23 ו japonica טרופי,24,25. ואכן, מעל 80% מהמאמרים המתארים את טרנספורמציה אורז להשתמש אגרובקטריום-מתווכים שינוי גן ככלי13. עד כה פותחו מספר פרוטוקולי טרנספורמציה גנטית באמצעות זרעי אורז כחומר התחלתי לאינדוקציה16,,17,,18,,19. עם זאת, מעט מאוד ידוע על תפרה צעירה כמו explants לייצור יבלות. בסך הכל, חשוב להקים פרוטוקול מהיר, לשחזור ויעיל של שינוי גנים והתחדשות עבור גנומיקה תפקודית ומחקרים על שיפור היבול.
בשנים האחרונות, ההתקדמות של טכנולוגיית CRISPR-Cas9 הביאה מנגנון עריכה גנומי מדויק כדי להבין את תפקוד הגנים ולספק שיפורים חשובים אגרונומית לגידולצמחים 26,27. CRISPR מציע גם הבטחה ניכרת למניפולציה של התפתחות הרבייה הגברית וייצור היברידי. במחקר זה, השתמשנו במערכת נוקאאוט גנים באמצעות טכנולוגיית CRISPR-Cas9 והכנסנו אותה לפרוטוקול יעיל של שינוי גן אורז באמצעות תפלות צעירות כהסברים, ובכך יצרנו קווים סטריליים יציבים לחקר התפתחות הרבייה.
Protocol
1. sgRNA-CAS9 צמח ביטוי וקטור בנייה וקטורית אגרובקטריום-תיווך טרנספורמציה
- היעד גן סטרילי זכר OsABCG15 באורז על פי הספרות שפורסמה28.
- עיצוב sgRNA עבור האתר המיועד הממוקם בין 106-125 bp ב exon השני של OsABCG15 (איור 1).
- השתמש T4 פולינוקלאוטיד קינאז כדי לסנתז את האוליגוס sgRNA (sgR-OsABCG15-F: 5'TGGCAAGCACATCCTCAAGGGGAT3' ו 5 sgR-OsABCG15-R: AAACATCCCCTTGAGAGAGGTGCTT').
- השתמש אנדונוקלאז BbsI לעכל את וקטור עמוד השדרה psgR-Cas929.
- לדגדג את האוליגוס sgRNA מסונתז עם עמוד השדרה של PSGR-Cas9 ליניארי באמצעות ליגאז T4 בעקבות פרוטוקול היצרן.
- באמצעות HindIII /EcoRI, לעכל את קלטת sgRNA מ שלב 1.5 ואת subclone לתוך האתר הינדי /EcoRI של וקטור בינארי pCAMBIA1300 עבורטרנספורמציה יציבה 29.
- אשר את הפלסמיד הבנוי על ידי עיכול אנזימים ודיון. מאוחר יותר, להפוך את המבנה הבינארי לתוך tumefaciens אגרובקטריום זן EHA105 ולגדל אותם על לוחות בחירה Kan / Rif ב 28 ° C במשך 2-3 ימים.
2. טרנספורמציה גנטית אורז ותרבות רקמת הצמח
- אינדוקציה והתחדשות קוס
הערה: השתמשו בתפלות אורז צעירות טריות כחומר ההתחלתי כדי לגרום לטלוס (איור 2).- לאסוף את התפלות הצעירות מתוך שדה האורז או הבית הירוק בשלב meiosis, נקבע על ידי אורך floret של 1.6-4.8 מ"מ(איור 2A)29. ודא כי תפלת האורז מכוסה בפנס עלה. מנגבים כל תסיסה עם 70% דגימת אלכוהול ולתת לו להתייבש לפני החיתוך.
- הביאו את התסיסה לספסל סטרילי נקי. חותכים אותו לחתיכות קטנות (קטן יותר טוב) עם מספריים עיקור ולאחר מכן להעביר חתכים לצלחת פטרי המכיל NBD2 בינוני(איור 2B, טבלה 1).
- דגירה את הצלחת בחושך ב 26 ° C במשך כ 10-14 ימים כדי לגרום מנוסה (איור 3A).
הערה: השתמש בטלוס החדש שנוצר עבור חדירת אגרובקטריום (שלב 2.2.7) ישירות או recondition פעם נוספת במדיום NBD2 טרי כדי להשיג תבלות יותר. מעבירים את ההתקשרות למדיום NBD2 החדש כל 8-10 ימים.
- טרנספורמציה וטיפוח-שותף
- השתמש בחיידקים של א. tumefaciens המכילים את הפלסמיד הבינארי מ- 1.6 לטרנספורמציה. אחסן את הזנים A. tumefaciens במדיום YEB (טבלה 1) עם 50% גליטרול ב -80 °C לשימוש נוסף.
- פס A. tumefaciens מ -80 ° C גליצטרול מלאי לYEB אגר בינוני המכיל אנטיביוטיקה סלקטיבית(טבלה 1) ולגדולב 25-28 ° C עבור 48-72 שעות, כדי לאפשר למושבות להופיע.
- לחסן מושבה אחת מצלחת YEB עם אנטיביוטיקה סלקטיבית 5 מ"ל של נוזל YEB בינוני המכילאת אותה אנטיביוטיקה סלקטיבית (טבלה 1),ב 50 מ"ל צינור סטרילי חוטי. לנער על שייקר מסלולית ב 250 x g g, ב 25-28 ° C עד חיידקים לגדול OD600 של 0.5.
- להוסיף 1 מ"ל של מתלים חיידקיים 100 מ"ל של YEB בינוני (שולחן 1) עם אותו אנטיביוטיקה סלקטיבית בקבוקון חוטי 250 מ"ל ולנער על שייקר מסלולית ב 250 x גרם, ב 28 מעלות צלזיוס עבור 4 שעות.
- צנטריפוגה ב 4,000 x g עבור 10 דקות בטמפרטורת החדר כדי לאסוף חיידקים. זרוק את הסופרנטנט.
- תוסתה מחדש את הגלולה החיידקית עם AAM-AS בינוני(טבלה 1) ודללאת המתלים ל- OD600 = 0.4.
הערה: מנת ה-OD המושלמת של מתלים חיידקיים היא קריטית לשינוי יעיל. זה עוזר בחיסול עודף צמיחה חיידקים על ההתפתלויות. - לאסוף סביב 150 בריא גדל בהיר צהוב בהיר שביר קלי עוברי מ שלב 2.1.3 לתוך בקבוק סטרילי 150 מ"ל. מוסיפים 50-75 מ"ל מתלי תאים חיידקיים מ-2.2.6 לבקבוק הסטרילי, ולאחר מכן מוסיפים כ-10-25 מ"ל בינוני AAM-AS טרי כדי לטבול את הקלי במשך 10-20 דקות, רועד מדי פעם.
- לשפוך את המתלים חיידקים מהבקבוקון בזהירות לייבש את המתלים חיידקים עודף מן הקלווס באמצעות נייר סינון סטרילי #1 נייר טישו. לאחר מכן מניחים אותם על צלחת פטרי עם NBD-AS בינוני(שולחן 1)מכוסה נייר סינון סטרילי #1. דגירה ב 25-28 ° C בחושך במשך 3 ימים ולבדוק אם חיידקים overgrowth.
- בחירה עבור תלת עמידים
- לאחר 3 ימים של טיפוח-שותף, מעבירים את הקלי לצלחת פטרי סטרילית עם נייר סינון סטרילי.
- ייבש את ה-calli במשך 2 שעות על ספסל נקי. ודא שההתקשרות אינה דבקה בנייר המסנן.
- להעביר את הקלי באופן שווה באמצעות פינצטה סטרילית לבחירה העיקרית בינוני NBD2 (עם 40 מ"ג / L hygromycin ו 250 מ"ג / L טזמן)(טבלה 1). תרבות קאלי במשך 2 שבועות ב 25-28 ° C בחושך.
- לאחר 2 שבועות, להעביר calli באופן שווה לצלחת חדשה המכילה בחירה טרי בינוני NBD2 (עם 40 מ"ג / L hygromycin ו 250 מ"ג / L timentin)(טבלה 1). תרבות ה-calli לעוד שבועיים ב 25-28 מעלות צלזיוס בחושך.
- בדיל ים
- להעביר כבלים בינוני MS טרי (עם 25 מ"ג / L hygromycin ו 150 מ"ג / L טזמן)(שולחן 1). תרבות תחת האור ב 25-28 מעלות צלזיוס במשך כ 2 שבועות.
- חזור על שלב 2.4.1 פעם נוספת.
- להעביר את ניצני לירות למדיום MS החדש (עם 10 מ"ג / L hygromycin) כדי להתרבות יורה יותר.
- אינדוקציה שורש
- להעביר את הצילומים החדשים לתוך 1/2 MS מדיום(טבלה 1). תרבות תחת האור ב 25 ° C - 28 °C. הצמחים שהשתנו מייצרים שורשים בתוך שבועיים.
- לאחר שבוע, להעביר את הצמחים סירים נקיים המכסים את הצמח כדי למנוע התייבשות.
3. זיהוי גנוטיפ
- לאסוף עלים צעירים מצמחים חדשים שנוצרו עבור הפקת DNA הכולל באמצעות צטילטרימתיל אמוניום ברומיד (CTAB)שיטה 31.
- באמצעות ה-DNA הגנומי כתבנית, בחר את פריימרים (Hygromycin-F: 5' GATGTTGGCGACCTCGCGTATT 3' והיגרומיצין-R: 5' CGAAGACTCTCGTCTCTCTCA 3' הממוקם באזור Hygromycin) כדי לבצע תגובת שרשרת פולימראז (PCR) כדי לאמת את האינטגרציה הטרנסיתותדרים (איור 4). תנאי ה-PCR הבאים: 94 °C למשך 5 דקות; 36 מחזורים (94°C ל-30 שניות; 56°C ל-30 שניות; 72°C למשך דקה אחת); 72°C ל-7 דקות. תגובות PCR מוצלחות מניבות 604 bp amplicon.
- בצע PCR אחר כדי להגביר את האזור הגנומי המקיף את אתרי היעד CRISPR באמצעות פריימרים ספציפיים (OsABCG15-ID-F: 5' GTCTCTCTCTCTCAACAGTCTCTCTCTCTCTCTCTCTCTCTCTCTCTCTCTCT 3' ו- OsABCG15-ID-R: 5' TTGGTGTTTATTAACATTGCTAT 3') כדי לזהות את הגנוטיפ של הטרנספורמטורים. תנאי ה- PCR זהים לתנאים בשלב 3.2.
- השתמש בשברי PCR ממדרגה 3.3 ישירות ל-Sanger כדי לזהות מוטציות.
4. שים לב לפנוטיפ הבסיסי של המוטנט
- להכין את פתרון I2-KI: להמיס 2 גרם של KI (אשלגן יודיד) ב 10 מ"ל של מים מזוקקים ולאחר מכן להוסיף 0.2 גרם של I2 (יוד resublimed) בזה. לאחר ערבוב, להביא את הנפח הכולל 100 מ"ל עם מים מזוקקים.
- הכינו את פתרון ה-FAA (63% אתנול אנידרי, 5% חומצה אצטית קרחונית, 5% פורמלדהיד ו-27% מים) ומערבבים לפני השימוש.
- הכינו את תמיסת הכתמים הכחולה טולואידין 0.5% : להמיס 0.5 גרם של טולואידין כחול ב 100 מ"ל של מים מזוקקים.
- לבצע תצפית פנוטיפית צמחית, על ידי הדמיה צמחים שלמים עם מצלמה דיגיטלית.
- לבצע תצפית פנוטיפ רבייה, להסיר את הפלאה והלמה מן floret. צלם תמונות של אנשים שלמים תחת סטריאומיקרוק.
- שים לב לכדאיות האבקה על ידי כתמי יוד.
- לקטוף קוצים אורז בוגרים לפני אנתזה פרח, להסיר את הפלאה והלמה כדי לשחרר את anthers.
- קח 6 anthers ולמקם אותם על מגלשת זכוכית. מוסיפים טיפה אחת של מים מזוקקים, מועצים את באר האנתר עם פינצטה כדי לשחרר את גרגרי האבקה, ולאחר מכן מוסיפים 2-3טיפות של תמיסתI 2 -KI. תכסה עם כיסוי.
- שים לב תחת מיקרוסקופ הגדלה נמוכה. גרגרי אבקה צבועים בשחור להראות קתנות נמרצת יותר, אין צבע או צהוב חום צבועים מעוכב או מנוון.
- ביצוע קטע דק למחצה של את'ר אורז
- לתקן את פרחי האורז בשלבים התפתחותיים שונים לפתרון FAA. שואבים את החומרים ב-4°C (בדרך כלל 15 דקות) כדי לאפשר למתקן לחדור לרקמות עד שהחומר שוקע לתחתית בקבוק האיסוף.
- החלף בפתרון FAA חדש למחרת. ברגע שהחומר שוקע לתחתית, החלף ב-70% אתנול ואחסן ב-4°C לשימוש לטווח ארוך.
- מייבשים את החומרים עם מעברי צבע שונים של אתנול (70%, 80%, 95% בכל פעם במשך 30 דקות, 100% אתנול ל-2 שעות, 100% אתנול המכיל מעט צבע ספראנין למשך 2 שעות).
הערה: להוסיף קצת צבע Safranin לתוך השני 100% אתנול לצבוע את anthers עבור מקטע קל יותר לאחר מכן. - בצע הטבעה על-ידי ביצוע הוראת היצרן (טבלת חומרים). לאחר מכן, אופים בתנור ב-60 מעלות צלזיוס במשך 48 שעות לפני המקטע.
- מקטע את הדגימה לעובי של 2 μm באמצעות microtome. מוסיפים טיפת מים על מגלשת הזכוכית. לאחר מכן, להרים את החלקים הדקים המכילים בלוקים anther על ידי מפס ולשים אותם על פני השטח של טיפת המים על המגלשות.
- מניחים את המגלשות על אמבט המים ב-50°C כדי להפיץ את החלקים לחלוטין כדי לאפשר לה לדבוק ביציבות בשקופית.
- השתמש 0.5% טולואידין כחול פתרון להכתים את השקופיות במשך 30 דקות. לאחר מכן, לשטוף עם מים ויבש בכסה המנוע אדים. אטום עם דבק עץ נייטרלי. מניחים בעדינות כיסוי על המגלשה ומתייבשים בכיסוי האדים.
- צפה וצלם את הדגימה תחת מיקרוסקופ.
תוצאות
הוכח כאן הוא השימוש בטכנולוגיית עריכת גנים כדי ליצור קו סטרילי זכר למחקר עתידי על ידי אגרובקטריום-מתווכים טרנספורמציה גנטית באורז. כדי ליצור את הקו הסטרילי הגברי של osabcg15, CRISPR-CAS9-בתיווך mutagenesis שימש לבנייה וקטורית בינארית. SgRNA היה מונע על ידי היזם OsU3, בעוד קלטת הביטוי של hSpCas9 היה מונע על ידי מקדם 35S כפול, ואת הווקטור האמצעי הורכב pCAMBIA1300 וקטור בינארי יחיד תוכנן עבור אגרובקטריום-מתווכים טרנספורמציה יציבה של אורז. ייצוג גרפי של המבנה ששימש עבור CRISPR/Cas9-בתיווך mutagenesis של אורז מסופק באות 1A.
איור 2 ואיור 3 מייצגים את כל ההליך של ייצור טרנסג'ין אורז. התפלות הצעירות נבחרו כהסברים ( איור 2 )וגרמה ליבלותהעובריות הפריכות (FEC) בתוך 14 ימים של חיסונים במדיום NBD2(איור 3א). הקלי העוברי שימשו ישירות עבור אגרובקטריום -מתווכיםטרנספורמציה (איור 3C) או תת תרבות להתפשטות כדי להשיג יותר קאלי לזיהום נוסף (איור 3B). לאחר טיפוח במשך 48 שעות על NBD2-AS בינוני בתנאיםחשוכים (איור 3D),ה-calli הותקנו לסיבוב שני של מדיום בחירה. לאחר 10-14 ימים, קאלי שהפכה הראתה מיקרו-קלי קטן שנוצר לאחרונה בפריפריה של האם קאלי, בעוד הצבע של קאלי הלא-טרנספורמית הפך לחום ומת בסופו של דבר(איור 3E,F). מאוחר יותר, קלי בצבע בריא וקרמי הועברו למדיום ההתחדשות פעמיים. בשלב זה, קאלי השתנה בהדרגה הראה כתמים ירוקים (ניצנים לירות) (איור 3G,H). כתמים ירוקים אלה שנוצרו לאחרונה היו תרבותיים בבקבוק פלסטיק סטרילי המכיל התחדשות בינונית כדי לאפשר צמיחה לירות (איור 3I), ולאחר מכן עבר (כמו יורה טרי) 1/2 MS בינוני כדי לגרום שורשים. מאוחר יותר, צילומים בריאים ונמרצים עם שורשים מפותחים נקצרו(איור 3J).
בסך הכל הושגו 21 שתילים שהתחדשו. ההגדלה של PCR לאזור היגרומיצין הראתה כי 18 מתוך 21 יכול להגביר את הרצועה המתאימה, המציינת שקווים אלה הם טרנסגניים(איור 4), ותדירותהטרנספורמציה המתאימה היא כ-85.71%(טבלה 2). הטרנספורמטורים היו גנוטיפים כדי לזהות את המוטציות באתר היעד sgRNA(s) באמצעות פריימרים המשתרעים על אזור היעד על ידי PCR amplicon ו- Sanger רצף, בין 18 T0 צמחים טרנסגניים, שמונה קווים הטרוזיגים ושלושה קווים הומוזיגים היו CRISPR-Cas9 חיובי, עם תדרי מוטציה מתאימים של 61.11% (איור 1B, טבלה 2).
מוטציות נוקאאוט הומוזיגות אומתו על ידי תצפית איברים בסיסית רבייה גברית(איור 5). הנת'רים של osabcg15 היו קטנים ופלים יותר מאלה של הסוג הפראי (איור 5A,D),וחסר גרגרי אבקה בוגרים(איור 5ב', E). מיקרוסקופית קטעים רוחבי בוצע לחקור את הפגמים מורפולוגיים anther ב osabcg15 בהשוואה לסוג הפראי. בשלב 10, נקביים מסוג פראי הפכו עגולים בצורת וvacuoled עם exine כחול כהה מוכתם (איור 5C). לעומת זאת, osabcg15 microspores התמוטטו והשפלה, רק פסולת של microspore מנוון קיימים בlocule anther(איור 5F).

איור 1: בניית מידע עבור מערכת CRISPR/Cas9 ומוטאגנזה ממוקדת של OsABCG15. (א)sgRNA היה מונע על ידי היזם OsU3, ואילו קלטת הביטוי של hSpCas9 היה מונע על ידי מקדם 35S כפול; הווקטור האמצעי הורכב בווקטור בינארי אחד שתוכנן עבור אגרובקטריום-מתווכת טרנספורמציה יציבה של אורז. (ב)הרצף (5'-AAGCACATCCTCAAGGGGAT-3') הממוקם באקסון השני של הגן OsABCG15 נבחר כאתר היעד של sgRNA. שלושה סוגים של אירועי מוטציה הומוזיגים נוצרו על ידי CRISPR-Cas9 ברקע japonica cultivar 9522, וסנגר רצף כרומטוגרמות של אתרי מוטציה מושרה CRISPR-Cas9 מוצגים. קו 9522osabcg15-1 יש חד-נוקלאוטיד (1-nt) 'A' החדרה; קו 9522osabcg15-2 יש חד-נוקלאוטיד (1-nt) 'G' החדרה; וקו 9522osabcg15-3 יש מחיקה חד-נוקלאוטיד (1-nt) 'G'. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 2: חומרי התחלה לתחלת ת'לינג. (א)אורז צעיר מתפלה בשלב מיוזיס. (ב)תפלות צעירות נותחות גדל על NBD2 מדיום. בר = 2 ס"מ ב(A). לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
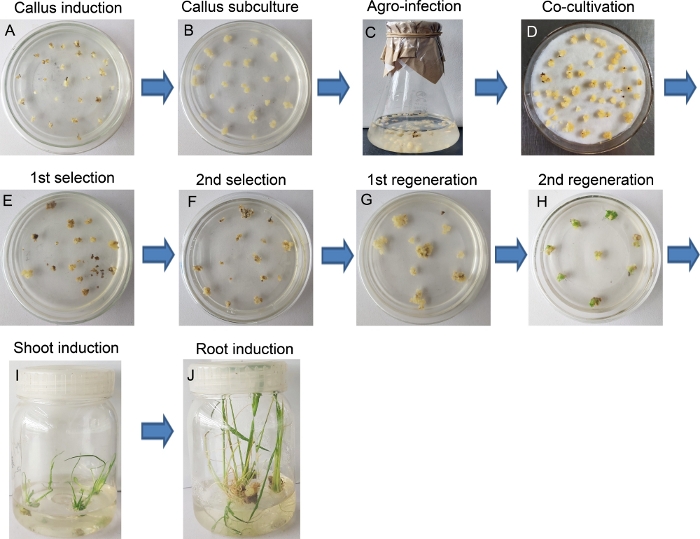
איור 3: נוהל לייצור קווים טרנסגניים על ידי אגרובקטריום-טרנספורמציה מתווכת. (א)קלי אורז שנוצרה מהתפלות הצעירות. תת-תרבותשל קאלי. (ג)דגירה של קלי עם A. tumefaciens. (D)טיפוח שותף של קאלי עם A. tumefaciens. (ה)מחזור הבחירה הראשון של קאלי השתנה בנוכחות Hygromycin (40 מ"ג / L). (F)מחזור בחירה שני של קאלי השתנה בנוכחות Hygromycin (40 מ"ג / L). התחדשותראשונה של קאלי שהשתנתה. (H)ההתחדשות השנייה של קאלי שהשתנתה, הנוצלת בנקודת הירי הירוקה בצלחת התרבות. תירהבתרבות האינדוקציה. אינדוקציהשורש. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 4: ניתוח תדרי טרנספורמציה של שתילי אורז שחדשו. מוצרי PCR מוגברים המוצגים שבר 604 bp (1-8, 10-14, 16-20) לאחר 1.5% אלקטרופורזה ג'ל agarose מצביעים על קווים חיוביים transgenic. קווים שאין להם את השבר אינם מופרכים (9, 15, 21), בדומה לפקד מסוג פראי (WT). לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 5: תצפית פנוטיפית בסיסית של סוג הפרא (9522) ומוטנט 9522osabcg15.1. (A)פרח מסוג פראי (9522) ו -(D) 9522osabcg15-1 מוטציה פרח לאחר הסרת הלמה וpala. ג'י.אל. פי, נימה; לו, לודיקול; pi, pistil; סנט, סטאמן. (ב)אני2-KI כתמימת של גרגרי אבקה בוגרים מסוג בר (9522) ו (E) 9522osabcg15-1 קו. (ג)ניתוח של התפתחות anther בסוג פראי (9522) ו (F) 9522osabcg15-1 מוטציה על ידי תצפית קטע רוחבי. DMsp, microspores מנוון; אי, אפידרמיס; אן, אנדותציום; MSP, מיקרוספר; טי, טיטום. ברים = 2 מ"מ ב (A) ו - (D), 100 μm ב (B) ו - (E), 50 μm ב (C) ו (F). לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
טבלה 1: קומפוזיציות מדיה לשינוי אורז. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: טרנספורמציה ויעילות עריכת גנים של המוטנטים של OsABCG15 שנוצרו על ידי CRISPR-Cas9 בדור T0. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
מוטנטים סטריליים גבריים מלאכותיים נוצרים באופן מסורתי על ידי מוטגנזה פיזית, כימית או ביולוגית אקראית. למרות שאותם טכניקות רבות עוצמה, טבעם האקראי לא מצליח לנצל את הכמות העצומה של ידע גנומי מודרני בעל פוטנציאל לספק שיפורים מותאמים אישית ברבייה מולקולרית32. מערכת CRISPR-Cas9 שימשה באופן נרחב בצמחים בשל האמצעים הפשוטים והמשתלמים שלה כדילתמרן ולערוך DNA 29,33; יש לו פוטנציאל לחסוך זמן בהשוואה לשיטות mutagenesis מסורתיות.
כאן, פיתחנו מערכת טרנספורמציהמתווכת אגרובקטריום נוחה באמצעות תפרים צעירים כהסברים עבור אינדוקציה יבלות. ישנם כמה שלבים בהליך transgene שניתן להשמיט כדי לחסוך זמן. שימוש בתפרים צעירים כחומר התחלתי היא בחירה טובה כדי למזער את משך הזמן הכולל של אינדוקציה יבלות לעומת שימוש בזרעים כמו explants. בנוסף, בידול התא ויכולת ההתחדשות חזקים מאוד ב-calli שהושגו מתפלות צעירות. בתהליך זה, תת תרבות של קלי אורז ניתן להימנע, אשר בסופו של דבר חוסך זמן, כמו גם מפחית את הסיכון של זיהום חיידקי ופטריות. יתר על כן, טמטין שימש כאנטיביוטיקה במקום קרבניצילין, אשר יעיל יותר בעיכוב חיידקים.
המחקר והפרוטוקול שהוצג להתבוננות פנוטיפית בסיסית של התפתחות הרבייה הגברית באורז שימושי לסטודנטים לתואר ראשון ולתואר שני המעוניינים בביולוגיה של הרבייה הצמחית. פרוטוקול נוח זה צריך להיות מהיר לתפוס ולשחזור לשימוש במחקרים הבאים.
Disclosures
ללא.
Acknowledgements
המחברים רוצים להכיר Xiaofei חן למתן תפלות אורז צעיר וסיוע בהפיכה את תרבות רקמת האורז בינוני. עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (31900611).
Materials
| Name | Company | Catalog Number | Comments |
| 1-Naphthaleneacetic acid | Sigma-Aldrich | N0640 | |
| 2, 4-Dichlorophenoxyacetic Acid | Sigma-Aldrich | D7299 | |
| 6-Benzylaminopurine (6-BA) | Sigma-Aldrich | B3408 | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Agar | Sinopharm Chemical Reagent Co., Ltd | 10000561 | |
| Ammonium sulfate | Sinopharm Chemical Reagent Co., Ltd | 10002918 | |
| Aneurine hydrochloride | Sigma-Aldrich | T4625 | |
| Anhydrous ethanol | Sinopharm Chemical Reagent Co., Ltd | 10009218 | |
| Bacteriological peptone | Sangon Biotech | A100636 | |
| Beef extract | Sangon Biotech | A600114 | |
| Boric acid | Sinopharm Chemical Reagent Co., Ltd | 10004808 | |
| Calcium chloride dihydrate | Sinopharm Chemical Reagent Co., Ltd | 20011160 | |
| Casein acid hydrolysate | Beijing XMJ Scientific Co., Ltd | C184 | |
| Cobalt(II) chloride hexahydrate | Sinopharm Chemical Reagent Co., Ltd | 10007216 | |
| Copper(II) sulfate pentahydrate | Sinopharm Chemical Reagent Co., Ltd | 10008218 | |
| D(+)-Glucose anhydrous | Sinopharm Chemical Reagent Co., Ltd | 63005518 | |
| D-sorbitol | Sinopharm Chemical Reagent Co., Ltd | 63011037 | |
| EDTA, Disodium Salt, Dihydrate | Sigma-Aldrich | E5134 | |
| EOS Digital SLR and Compact System Cameras | Canon | EOS 700D | |
| Formaldehyde | Sinopharm Chemical Reagent Co., Ltd | 10010018 | |
| Fully Automated Rotary Microtome | Leica Biosystems | Leica RM 2265 | |
| Glacial acetic acid | Sinopharm Chemical Reagent Co., Ltd | 10000208 | |
| Glycine | Sinopharm Chemical Reagent Co., Ltd | 62011516 | |
| Hygromycin | Beijing XMJ Scientific Co., Ltd | H370 | |
| Inositol | Sinopharm Chemical Reagent Co., Ltd | 63007738 | |
| Iodine | Sinopharm Chemical Reagent Co., Ltd | 10011517 | |
| Iron(II) sulfate heptahydrate | Sinopharm Chemical Reagent Co., Ltd | 10012116 | |
| Kanamycine | Beijing XMJ Scientific Co., Ltd | K378 | |
| Kinetin | Sigma-Aldrich | K0753 | |
| L-Arginine | Sinopharm Chemical Reagent Co., Ltd | 62004034 | |
| L-Aspartic acid | Sinopharm Chemical Reagent Co., Ltd | 62004736 | |
| L-Glutamine | Beijing XMJ Scientific Co., Ltd | G229 | |
| L-proline | Beijing XMJ Scientific Co., Ltd | P698 | |
| Magnesium sulfate heptahydrate | Sinopharm Chemical Reagent Co., Ltd | 10013018 | |
| Manganese sulfate monohydrate | Sinopharm Chemical Reagent Co., Ltd | 10013418 | |
| Microscopes | NIKON | Eclipse 80i | |
| MS | Phytotech | M519 | |
| Nicotinic acid | Sigma-Aldrich | N0765 | |
| Phytagel | Sigma-Aldrich | P8169 | |
| Potassium chloride | Sinopharm Chemical Reagent Co., Ltd | 10016308 | |
| Potassium dihydrogen phosphate | Sinopharm Chemical Reagent Co., Ltd | 10017608 | |
| Potassium iodide | Sinopharm Chemical Reagent Co., Ltd | 10017160 | |
| Potassium nitrate | Sinopharm Chemical Reagent Co., Ltd | 1001721933 | |
| Pyridoxine Hydrochloride (B6) | Sigma-Aldrich | 47862 | |
| Rifampicin | Beijing XMJ Scientific Co., Ltd | R501 | |
| Sodium hydroxide | Sinopharm Chemical Reagent Co., Ltd | 10019718 | |
| Sodium molybdate dihydrate | Sinopharm Chemical Reagent Co., Ltd | 10019816 | |
| Stereo microscopes | Leica Microsystems | Leica M205 A | |
| Sucrose | Sinopharm Chemical Reagent Co., Ltd | 10021418 | |
| Technovit embedding Kits 7100 | Heraeus Teknovi, Germany | 14653 | |
| Timentin | Beijing XMJ Scientific Co., Ltd | T869 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Water bath for paraffin sections | Leica Biosystems | Leica HI1210 | |
| Yeast extract | Sangon Biotech | A515245 | |
| Zinc sulfate heptahydrate | Sinopharm Chemical Reagent Co., Ltd | 10024018 |
References
- Izawa, T., Shimamoto, K. Becoming a model plant: The importance of rice to plant science. Trends in Plant Science. 1 (3), 95-99 (1996).
- Shimamoto, K., Kyozuka, J. Rice as a model for comparative genomics of plants. Annual Review of Plant Biology. 53 (1), 399-419 (2002).
- Selva, C., et al. Hybrid breeding in wheat: how shaping floral biology can offer new perspectives. Functional Plant Biology. 47 (8), 675-694 (2020).
- Lippman, Z. B., Zamir, D. Heterosis: revisiting the magic. Trends in Genetics. 23 (2), 60-66 (2007).
- Zhang, D., Liang, W. Improving food security: using male fertility for hybrid seed breeding. Science. , 45-48 (2016).
- Masters, A., et al. Agrobacterium-Mediated Immature Embryo Transformation of Recalcitrant Maize Inbred Lines Using Morphogenic Genes. Journal of Visualized Experiments. (156), e60782 (2020).
- Laurenceau, R., et al. A type IV pilus mediates DNA binding during natural transformation in Streptococcus pneumoniae. PLoS Pathogens. 9 (6), 1003473 (2013).
- Tzfira, T., Citovsky, V. Agrobacterium-mediated genetic transformation of plants: biology and biotechnology. Current Opinion in Biotechnology. 17 (2), 147-154 (2006).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiology. 150 (4), 1665-1676 (2009).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. International Journal of Developmental Biology. 57, 467-481 (2013).
- Hiei, Y., Komari, T. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed. Nature Protocols. 3 (5), 824 (2008).
- Hiei, Y., Ohta, S., Komari, T., Kumashiro, T. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. The Plant Journal. 6 (2), 271-282 (1994).
- Hiei, Y., Komari, T., Kubo, T. Transformation of rice mediated by Agrobacterium tumefaciens. Plant Molecular Biology. 35 (1-2), 205-218 (1997).
- Nishimura, A., Aichi, I., Matsuoka, M. A protocol for Agrobacterium-mediated transformation in rice. Nature Protocols. 1 (6), 2796 (2006).
- Yara, A., et al. Production of transgenic japonica rice (Oryza sativa) cultivar, Taichung 65, by the Agrobacterium-mediated method. Plant Biotechnology. 18 (4), 305-310 (2001).
- Cho, S. K., et al. Efficient transformation of Korean rice cultivars (Oryza sativa L.) mediated by Agrobacterium tumefaciens. Journal of Plant Biology. 41 (4), 262-268 (1998).
- Toki, S. Rapid and efficient Agrobacterium-mediated transformation in rice. Plant Molecular Biology Reporter. 15, 16-21 (1997).
- Zhang, J., Xu, R. j., Elliott, M. C., Chen, D. F. Agrobacterium-mediated transformation of elite indica and japonica rice cultivars. Molecular Biotechnology. 8 (3), 223-231 (1997).
- Aldemita, R. R., Hodges, T. K. Agrobacterium tumefaciens-mediated transformation of japonica and indica rice varieties. Planta. 199 (4), 612-617 (1996).
- Rashid, H., Yokoi, S., Toriyama, K., Hinata, K. Transgenic plant production mediated by Agrobacterium in indica rice. Plant Cell Reports. 15 (10), 727-730 (1996).
- Sahoo, K. K., Tripathi, A. K., Pareek, A., Sopory, S. K., Singla-Pareek, S. L. An improved protocol for efficient transformation and regeneration of diverse indica rice cultivars. Plant Methods. 7 (1), 49 (2011).
- Rachmawati, D., Hosaka, T., Inoue, E., Anzai, H. Agrobacterium-mediated transformation of Javanica rice cv. Rojolele. Bioscience, Biotechnology, and Biochemistry. 68 (6), 1193-1200 (2004).
- Dong, J., Teng, W., Buchholz, W. G., Hall, T. C. Agrobacterium-mediated transformation of Javanica rice. Molecular Breeding. 2 (3), 267-276 (1996).
- Bortesi, L., Fischer, R. The CRISPR/Cas9 system for plant genome editing and beyond. Biotechnology Advances. 33 (1), 41-52 (2015).
- Li, Q., et al. Development of japonica photo-sensitive genic male sterile rice lines by editing carbon starved anther using CRISPR/Cas9. Journal of Genetics and Genomics. 43 (6), 415 (2016).
- Qin, P., et al. ABCG15 encodes an ABC transporter protein, and is essential for Post-Meiotic anther and pollen exine development in rice. Plant and Cell Physiology. 54, (2013).
- Mao, Y., et al. Application of the CRISPR-Cas system for efficient genome engineering in plants. Molecular Plant. 6 (6), 2008-2011 (2013).
- Itoh, J. I., et al. Rice plant development: from zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Gawel, N. J., Jarret, R. L. A modified CTAB DNA extraction procedure forMusa andIpomoea. Plant Molecular Biology Reporter. 9 (3), 262-266 (1991).
- Wei, F. J., Droc, G., Guiderdoni, E., Hsing, Y. i. C. International Consortium of Rice Mutagenesis: resources and beyond. Rice. 6 (1), 39 (2013).
- Feng, Z., et al. Efficient genome editing in plants using a CRISPR/Cas system. Cell Research. 23 (10), 1229 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved