Method Article
البكتيريا الزراعية-بوساطة التحول الجيني، وإنتاج تحويل الجينات، وتطبيقها لدراسة التنمية الإنجابية للذكور في الأرز
* These authors contributed equally
In This Article
Summary
يصف هذا العمل استخدام تكنولوجيا تحرير الجينوم CRISPR-Cas9 إلى الجينات الذاتية خروج المغلوب OsABCG15 متبوعة ببروتوكول تحويل معدل بوساطة Agrobacteriumلإنتاج خط مستقر معقم للذكور في الأرز.
Abstract
عقم الذكور هو سمة زراعية هامة لإنتاج البذور الهجينة التي تتميز عادة بعيوب وظيفية في الأعضاء التناسلية للذكور / الأماشعة. التقدم الأخير في تكنولوجيا تحرير الجينوم CRISPR-Cas9 يسمح بكفاءة تحرير عالية وطفرات خروج المغلوب المنقذة للاوقات من الجينات المرشحة الذاتية في مواقع محددة. وبالإضافة إلى ذلك، فإن التحول الجيني للأرز بوساطة البكتيريا الزراعيةهو أيضاً طريقة رئيسية لتعديل الجينات، وهو ما تم تبنيه على نطاق واسع من قبل العديد من المختبرات العامة والخاصة. في هذه الدراسة، طبقنا CRISPR-Cas9 أدوات تحرير الجينوم ونجحنا في توليد ثلاثة خطوط متحولة عقيمة من الذكور عن طريق تحرير الجينوم المستهدف من OsABCG15 في أصناف japonica. استخدمنا طريقة تحويل الأرز المعدلة بوساطة أغروباكتيريومالتي يمكن أن توفر وسائل ممتازة للإحتياج الوراثي لإنتاج البذور الهجين في الأرز. يمكن الحصول على النباتات المعدلة وراثيا في غضون 2-3 أشهر، وتم فحص المحولات homozygous بواسطة genotyping باستخدام تضخيم PCR وتسلسل سانجر. تم تنفيذ توصيف الثيرنيتيبيك الأساسي لخط الهو انسجامزيجوات المعقم من قبل الملاحظة المجهرية للأعضاء التناسلية الذكورية الأرز، تحليل جدوى حبوب اللقاح بواسطة يوديد البوتاسيوم اليود (I2-KI) تلطيخ المقطع المقطع الفرعي شبه رقيقة من الأنثرس النامية.
Introduction
ويعتبر الأرز أهم المحاصيل الغذائية، لا سيما في البلدان النامية، وهو يمثل غذاء أساسيا لأكثر من نصف سكان العالم. وعموما، فإن الطلب على حبوب الأرز آخذ في الازدياد ومن المتوقع أن يزداد بنسبة 50 في المائة بحلول عام 2030 و 100 في المائة بحلول عام 20501،2. ويتعين أن تستفيد التحسينات المستقبلية في غلة الأرز من الموارد الجزيئية والجينية المتنوعة التي تجعل من الأرز نموذجاً ممتازاً لبحوث النباتات أحادية الكولدون. وتشمل هذه نظام التحول كفاءة ، والخريطة الجزيئية المتقدمة ، وقاعدة بيانات متاحة للجمهور من علامات تسلسل التعبير ، والتي تم إنشاؤها على مدى سنوات عديدة3،4. استراتيجية واحدة لتحسين غلة المحاصيل هي إنتاج البذور الهجين5، وهو عنصر مركزي منها هو القدرة على التلاعب خصوبة الذكور. يمكن أن يساعد فهم التحكم الجزيئي في خصوبة الذكور في محاصيل الحبوب على ترجمة المعرفة الرئيسية إلى تقنيات عملية لتحسين إنتاج البذور الهجينة وتعزيز إنتاجية المحاصيل6،7.
التحول الوراثي هو أداة رئيسية للبحث الأساسي والزراعة التجارية لأنه يتيح إدخال الجينات الأجنبية أو التلاعب بالجينات الذاتية في نباتات المحاصيل، ويؤدي إلى توليد خطوط معدلة وراثيا. ويمكن أن يساعد بروتوكول التحويل المناسب على تسريع الدراسات البيولوجية الوراثية والجزيئية من أجل الفهم الأساسي للتنظيم الجيني8. في البكتيريا, يحدث التحول الوراثي بشكل طبيعي; ومع ذلك، في النباتات، يتم تنفيذها اصطناعيا باستخدام تقنيات البيولوجيا الجزيئية9،10. Agrobacterium tumefaciens هي بكتيريا تحملها التربة، الغرام السلبية التي تسبب مرض المرارة التاج في النباتات عن طريق نقل T-DNA، وهي منطقة من بيلازمد تي، إلى الخلية النباتية عن طريق نظام إفراز نوع الرابع11،12. في النباتات، A. tumefaciens-يتوسط التحول يعتبر وسيلة واسعة النطاق لتعديل الجينات لأنه يؤدي إلى تكامل عدد نسخة مستقرة ومنخفضة من T-DNA في الجينوم المضيف13. تم توليد الأرز المحور وراثيا لأول مرة من خلال تحويل الجينات الزراعيةبوساطة في منتصف 1990s في جابونيكا cultivar14. باستخدام هذا البروتوكول، تم الحصول على العديد من الخطوط المعدلة وراثيا في غضون فترة 4 أشهر مع كفاءة التحول من 10٪ -30٪. وأشارت الدراسة إلى أن هناك خطوتين حاسمتين للتحول الناجح: الأولى هي تحريض الكولوس الجنيني من البذور الناضجة والأخرى هي إضافة الأسيتوسيرينجون، وهو مركب فينولي، إلى الثقافة البكتيرية أثناء الزراعة المشتركة، مما يسمح بكفاءة تحويل أعلى في النباتات14،15. وقد استخدم هذا البروتوكول على نطاق واسع مع تعديلات طفيفة في japonica16،17،18،19 ، فضلا عن أصناف أخرى مثل indica20،21،22،23 وjaponicaالاستوائية24،25. في الواقع، أكثر من 80٪ من المقالات التي تصف تحويل الأرز استخدام Agrobacterium-بوساطة تحويل الجينات كأداة13. حتى الآن، وقد تم تطوير العديد من بروتوكولات التحول الجيني باستخدام بذور الأرز كمادة البداية لالتحريض كالوس16،17،18،19. ومع ذلك ، لا يعرف سوى القليل جدا عن ازهار الشباب كما explants لإنتاج كالوس. وعموما، من المهم وضع بروتوكول سريع وفعال لتحويل الجينات وتجديدها من أجل علم الجينوم الوظيفي والدراسات المتعلقة بتحسين المحاصيل.
في السنوات الأخيرة، أدى تقدم تكنولوجيا CRISPR-Cas9 إلى آلية دقيقة لتحرير الجينوم لفهم وظيفة الجينات وتقديم تحسينات هامة زراعيا لتربية النباتات26،27. كما تقدم CRISPR وعدًا كبيرًا بالتلاعب في التنمية الإنجابية للذكور والإنتاج الهجين. في هذه الدراسة، استخدمنا نظام خروج المغلوب الجينات باستخدام تكنولوجيا CRISPR-Cas9 ويقترن ذلك ببروتوكول فعال لتحويل جينات الأرز باستخدام النضحات الصغيرة ككزروع، وبالتالي خلق خطوط عقيمة ذكورية مستقرة لدراسة التنمية الإنجابية.
Protocol
1. sgRNA-CAS9 مصنع التعبير عن بناء ناقلات Agrobacterium- بوساطة التحول
- استهداف ذكر الجينات العقيمة OsABCG15 في الأرز وفقا للأدب المنشور28.
- تصميم sgRNA للموقع المستهدف يقع بين 106-125 bp في إكسون الثاني من OsABCG15 (الشكل 1).
- استخدام T4 polynucleotide كيناز لتوليف oligos sgRNA (sgR-OsABCG15-F: 5'TGGCAAGCACCTCAGGAT3' و 5 sgR-OsABCG15-R: AAACATCCCCTTGAGGGTGCTT').
- استخدام endonuclease BBSI لهضم 29- 29 هضم29- 29.
- Ligate اغليغوس sgRNA توليفها مع الخطية psgR-Cas9 العمود الفقري باستخدام T4 ligase بعد بروتوكول الشركة المصنعة.
- باستخدام HindIII/EcoRI، هضم كاسيت sgRNA من الخطوة 1.5 و subclone في موقع HindIII/EcoRI من ناقل ثنائي pCAMBIA1300 للتحول مستقرة29.
- تأكيد البلازميد شيدت من قبل الهضم الانزيم والتسلسل. في وقت لاحق، تحويل بناء ثنائي في سلالة الجرثومة tumefaciens EHA105 وتنمو لهم على لوحات اختيار كان / الريف في 28 درجة مئوية لمدة 2-3 أيام.
2- التحول الوراثي للأرز وزراعة الأنسجة النباتية
- كالوس التعريفي وتجديد
ملاحظة: استخدام الأرز الطازجة فيلفلورسنسات كمواد البداية للحث على كالوس(الشكل 2).- جمع ازهار الشباب من حقل الأرز أو البيت الأخضر في مرحلة meiosis ، التي يحددها طول فلوريت من 1.6-4.8 ملم(الشكل 2A)29. تأكد من أن يتم تغطية الأرز فيلفلورس مع غدد ورقة. امسح كل إنفحل مع مسحة كحولية بنسبة 70% واتركها تجف قبل القطع.
- جلب النورة إلى مقاعد البدلاء العقيمة نظيفة. قطعها إلى قطع صغيرة (الأصغر كلما كان ذلك أفضل) مع مقص معقمة ثم نقل قصاصات إلى لوحة بيتري تحتوي على وسيط NBD2 (الشكل 2B، الجدول 1).
- احتضان لوحة في الظلام في 26 درجة مئوية لحوالي 10-14 يوما للحث على كالوس (الشكل 3A).
ملاحظة: استخدام callus شكلت حديثا لتسلل Agrobacterium (الخطوة 2.2.7) مباشرة أو إعادة تحديد مرة أخرى واحدة في الطازجة NBD2 المتوسطة للحصول على المزيد من callus. قم بنقل الـ callus إلى وسط NBD2 الجديد كل 8-10 أيام.
- التحول والزراعة المشتركة
- استخدام A. tumefaciens البكتيريا التي تحتوي على plasmid ثنائي من الخطوة 1.6 للتحول. تخزين سلالات A. tumefaciens في المتوسط YEB(الجدول 1)مع 50٪ الجلسرين في -80 درجة مئوية لمزيد من الاستخدام.
- Streak A. tumefaciens من مخزون الغليسيرول -80 درجة مئوية إلى YEB agar المتوسطة التي تحتوي على المضادات الحيوية الانتقائية(الجدول 1)وتنمو في 25-28 درجة مئوية لمدة 48-72 ساعة، للسماح للمستعمرات بالظهور.
- تلقيح مستعمرة واحدة من لوحة YEB مع المضادات الحيوية الانتقائية إلى 5 مل من السائل YEB المتوسطة التي تحتوي على نفس المضادات الحيوية الانتقائية(الجدول 1) ، في أنبوب اختبار مخروطي 50 مل معقم. هز على شاكر المدارية في 250 × ز,في 25-28 درجة مئوية حتى تنمو البكتيريا إلى OD600 من 0.5.
- إضافة 1 مل من تعليق البكتيرية إلى 100 مل من المتوسط YEB(الجدول 1) مع نفس المضادات الحيوية الانتقائية في قارورة مخروطية 250 مل وتهز على شاكر المداري في 250 × ز، في 28 درجة مئوية لمدة 4 ساعات.
- جهاز طرد مركزي في 4000 × ز لمدة 10 دقيقة في درجة حرارة الغرفة لجمع البكتيريا. تجاهل المُندفع.
- Resuspend بيليه بكتيرية مع AAM-AS المتوسطة(الجدول 1)وتمييع التعليق إلى OD600 = 0.4.
ملاحظة: إن نظام OD المثالي من التعليق البكتيري أمر بالغ الأهمية للتحول الفعال. يساعد في القضاء على النمو البكتيري الزائد على البكتوس. - جمع حوالي 150 صحية تنمو خفيفة صفراء خفيفة الهش كالي من الخطوة 2.1.3 في قارورة معقم 150 مل. أضف 50-75 مل تعليق الخلايا البكتيرية من الخطوة 2.2.6 في قارورة معقمة، ثم إضافة بعض 10-25 مل جديدة AAM-AS المتوسطة لتزج الكاملي لمدة 10-20 دقيقة، تهتز أحيانا.
- صب التعليق البكتيري من القارورة بعناية وتجفيف التعليق البكتيري الزائد من الوسم باستخدام ورقة فلتر عقيمة #1 أو ورق الأنسجة. ثم وضعها على طبق بيتري مع وسيط NBD-AS(الجدول 1)مغطاة بورق فلتر معقمة #1. احتضان في 25-28 درجة مئوية في الظلام لمدة 3 أيام والتحقق من فرط نمو البكتيريا.
- اختيار لـ callus المقاوم
- بعد 3 أيام من الزراعة المشتركة، نقل الكري إلى طبق بيتري معقمة مع ورقة فلتر معقمة.
- الهواء الجافة كالي لمدة 2 ساعة على مقعد نظيف. تأكد من عدم الالتزام باللّكة بورقة التصفية.
- نقل كالي بالتساوي باستخدام ملاقط عقيمة إلى الاختيار الابتدائي متوسطة NBD2 (مع 40 ملغ / لتر hygromycin و 250 ملغ / لتر timentin) (الجدول 1). ثقافة كالي لمدة 2 أسابيع في 25-28 درجة مئوية في الظلام.
- بعد 2 أسابيع، نقل كالي بالتساوي إلى لوحة جديدة تحتوي على اختيار جديد متوسطة NBD2 (مع 40 ملغم / لتر hygromycin و 250 ملغ / لتر timentin) (الجدول 1). ثقافة ال [كّ] ل آخر 2 أسابيع في 25-28 [ك] في الظلام.
- تمايز كالوس
- نقل callus إلى MS المتوسطة الطازجة (مع 25 ملغم / لتر hygromycin و 150 ملغ / لتر timentin) (الجدول 1). الثقافة تحت الضوء في 25-28 درجة مئوية لحوالي 2 أسابيع.
- كرر الخطوة 2.4.1 مرة أخرى.
- نقل براعم تبادل لاطلاق النار إلى المتوسط MS جديدة (مع 10 ملغ / لتر hygromycin) لتكاثر أكثر يطلق النار.
- تحريض الجذر
- نقل يطلق النار الجديد إلى 1/2 MS المتوسطة المتوسطة(الجدول 1). الثقافة تحت الضوء في 25 درجة مئوية - 28 درجة مئوية. النباتات المحولة تنتج جذور في غضون 2 أسابيع.
- بعد أسبوع، نقل النباتات لتنظيف الأواني التي تغطي النبات لمنع الجفاف.
3. تحديد النمط الجيني
- جمع أوراق الشباب من النباتات التي تم إنشاؤها حديثا لاستخراج الحمض النووي الكلي باستخدام بروميد الأمونيوم السيتيل (CTAB) طريقة31.
- باستخدام الحمض النووي الجينومي كقالب، اختر البهاء (Hygromycin-F: 5' GATGTTGGCGACCTCGTATT 3' وHygromycin-R: 5' CGAAGAATCTCGTGCTTTCA 3' الموجود في منطقة هيغروميسين) لإجراء تفاعل البوليميراز المتسلسل (PCR) للتحقق من تكامل وترددات الترانسوجين(الشكل 4). شروط PCR التالية: 94 درجة مئوية لمدة 5 دقائق؛ 36 دورات (94 درجة مئوية ل 30 s; 56 °C ل 30 s; 72 °C لمدة 1 دقيقة); 72 درجة مئوية لمدة 7 دقائق. ردود الفعل PCR ناجحة تسفر عن 604 بي بي امبليكون.
- تنفيذ PCR آخر لتضخيم المنطقة الجينومية المحيطة المواقع المستهدفة CRISPR باستخدام التمهيديات محددة (OsABCG15-ID-F: 5' GTCTCATTGCTCAACAGTTTCT 3' وOsABCG15-ID-R: 5' TTGGTGTTTAAAACATTGCTAT 3') لتحديد النمط الجيني للتحويلات. شروط PCR هي نفسها كما في الخطوة 3.2.
- استخدم أجزاء PCR من الخطوة 3.3 مباشرة لتسلسل Sanger لتحديد الطفرات.
4. مراقبة النمط الظاهري الأساسي للمتحول
- إعداد I2-KI الحل: حل 2 غرام من كيلو من (يوديد البوتاسيوم) في 10 مل من الماء المقطر ثم إضافة 0.2 غرام من أنا2 (إعادة طرح اليود) في ذلك. بعد خلط، وجلب حجم إجمالي إلى 100 مل مع الماء المقطر.
- إعداد حل FAA (63٪ الإيثانول اللامائية، 5٪ حمض الخليك الجليدي، 5٪ الفورمالديهايد و 27٪ ماء) ومزيج قبل استخدام.
- إعداد 0.5٪ تولويدين الأزرق تلطيخ حل: حل 0.5 غرام من الأزرق تولويدين في 100 مل من الماء المقطر.
- تنفيذ الملاحظة الظاهرية الخضرية، عن طريق تصوير النباتات كلها مع كاميرا رقمية.
- تنفيذ الملاحظة الظاهري الإنجابية، وإزالة الباليا وlemma من الزهور. التقاط صور من anthers كله تحت منظار مجسم.
- مراقبة صلاحية حبوب اللقاح من خلال تلطيخ اليود.
- اختيار المسامير الأرز ناضجة قبل أنثيس زهرة، وإزالة الباليه وlemma للافراج عن anthers.
- خذ 6 ذرات ووضعها على شريحة زجاجية. إضافة 1 قطرة من الماء المقطر، سحق بئر أنثر مع ملاقط لإطلاق حبوب اللقاح للافراج عن، ثم إضافة 2-3 قطرات من أنا2-KI الحل. تغطية مع غطاء.
- مراقبة تحت مجهر التكبير منخفضة. حبوب اللقاح السوداء المصبغة تظهر أكثر حيوية، لا لون أو أصفر بني مصبغة هي توقف أو انحطاط.
- تنفيذ مقطع شبه رقيقة من anther الأرز
- إصلاح الزهور الأرز من مراحل النمو المختلفة إلى حل FAA. فراغ المواد في 4 درجة مئوية (15 دقيقة عموما) للسماح المثبت لاختراق الأنسجة حتى المواد المصارف إلى الجزء السفلي من زجاجة جمع.
- استبدال مع حل جديد FAA في اليوم التالي. مرة واحدة في المواد المصارف إلى أسفل، استبدال مع 70٪ الإيثانول وتخزينها في 4 درجة مئوية للاستخدام على المدى الطويل.
- يجفف المواد مع تدرجات مختلفة من الإيثانول (70٪، 80٪، 95٪ في كل مرة لمدة 30 دقيقة، 100٪ الإيثانول لمدة 2 ساعة، 100٪ الإيثانول تحتوي على القليل من صبغة صفرارنين لمدة 2 ساعة).
ملاحظة: إضافة القليل من صبغة صفرانين في الإيثانول الثاني 100٪ لتلوين الثيرات لتسهيل المقاطع بعد ذلك. - تنفيذ التضمين باتباع تعليمات الشركة المصنعة (جدول المواد). ثم اخبزي في فرن عند 60 درجة مئوية لمدة 48 ساعة قبل اقطع.
- مقطع العينة إلى سمك 2 μm باستخدام microtome. إضافة قطرة من الماء على الشريحة الزجاجية. ثم، والتقاط المقاطع رقيقة تحتوي على كتل أنثر بواسطة ملقط ووضعها على سطح قطرة الماء على الشرائح.
- ضع الشرائح على حمام الماء عند 50 درجة مئوية لنشر المقاطع تمامًا للسماح لها بالتمسك بالشريحة بقوة.
- استخدام 0.5٪ حل الأزرق toluidine وصمة عار الشرائح لمدة 30 دقيقة. ثم، شطف بالماء وجاف في غطاء محرك الدخان. ختم مع الغراء شجرة محايدة. ضع غطاءً برفق على الشريحة وجففه في غطاء الدخان.
- مراقبة وتصوير العينة تحت المجهر.
النتائج
ثبت هنا هو استخدام تكنولوجيا تحرير الجينات لإنشاء خط عقيم الذكور للبحوث في المستقبل من قبل Agrobacterium- بوساطة التحول الجيني في الأرز. لإنشاء خط الذكور العقيمة من osabcg15،تم استخدام متماوجينسيس كريسبر-CAS9 بوساطة لبناء ناقلات ثنائي. وكان الدافع sgRNA من قبل المروج OsU3، في حين كان الدافع وراء الكاسيت التعبير من hSpCas9 من قبل المروج 35S مزدوجة، وتم تجميعها في ناقلات المتوسطة في ناقل ثنائي واحد pCAMBIA1300 مصممة ل Agrobacterium-بوساطة التحول مستقرة من الأرز. يتم توفير تمثيل رسومي من البناء الذي كان يستخدم ل CRISPR / Cas9-بوساطة من الأرز في الشكل 1A.
ويمثل الشكل 2 والشكل 3 الإجراء الكامل لإنتاج الأرز من إنتاج الترانسجين. تم اختيار النضيرات الصغيرة ككزنا (الشكل 2) و تسببت في تفتيت الهاس الجنيني (FEC) خلال 14 يومًا من التطعيم على وسيط NBD2 (الشكل 3A). واستخدمت كالي الجنينية مباشرة لتحويل البكتيريا الزراعية-بوساطة (الشكل 3C) أو ثقافة فرعية لانتشار للحصول على المزيد من كالي لمزيد من العدوى(الشكل 3B). بعد المشاركة في زراعة 48 ساعة على NBD2-AS المتوسطة في الظروف المظلمة(الشكل 3D)،تم نقل كالي إلى جولة ثانية من اختيار المتوسطة. بعد 10-14 أيام، تحولت كالي أظهرت بعض microcalli شكلت حديثا صغيرة على هامش كالي الأم، في حين أن لون كالي غير المترجمة تحولت إلى البني ومات في نهاية المطاف (الشكل 3E, F). في وقت لاحق، تم نقل كالي الملونة صحية ودسمة في وسط التجديد مرتين. في هذه المرحلة، تحولت كالي أظهرت تدريجيا البقع الخضراء (تبادل لاطلاق النار براعم) (الشكل 3G، H). وقد تم استزراع هذه البقع الخضراء التي تم إنشاؤها حديثا في زجاجة بلاستيكية معقمة تحتوي على تجديد المتوسطة للسماح النمو تبادل لاطلاق النار(الشكل 3I)، ثم تحولت (كما يطلق النار جديدة) في المتوسط 1 /2 MS للحث على الجذور. في وقت لاحق، تم حصاد براعم النمو صحية وقوية مع جذور متطورة(الشكل 3J).
وفي المجموع، تم الحصول على 21 شتلة مجددة. وأظهرت تضخيم PCR لمنطقة الهيغروميسين أن 18 من أصل 21 يمكن تضخيم النطاق المقابل، مشيرا إلى هذه الخطوط هي معدلة وراثيا (الشكل 4)،وتواتر التحويل المقابلة حوالي 85.71٪(الجدول 2). تم تحديد الجينوم للتحويلات لتحديد الطفرات في الموقع (sgRNA) الهدف باستخدام التمهيديات التي تغطي المنطقة المستهدفة من قبل PCR أمبيركون وسانجر التسلسل، من بين 18 T0 النباتات المعدلة وراثيا، ثمانية خطوط غير المتغايرة وثلاثة خطوط homozygous كانت CRISPR-Cas9 إيجابية، مع ترددات الطفرة المقابلة من 61.11٪(الشكل 1B، الجدول 2).
تم التحقق من صحة المسوخ المهزوخ بالضربة القاضية من قبل ملاحظة الجهاز التناسلي الذكور الأساسية(الشكل 5). كانت اثيرات osabcg15 أصغر وأكثر شحوبا من تلك من نوع البرية(الشكل 5A, D)،وتفتقر إلى الحبوب حبوب اللقاح ناضجة (الشكل 5B, E). تم إجراء مجهري المقطع العرضية للتحقيق في العيوب المورفولوجية في osabcg15 مقارنة بالنوع البري. في المرحلة 10، أصبحت الجراثيم المجهرية من النوع البري مستديرة الشكل ومشوشة مع إكسين داكنة زرقاء اللون(الشكل 5C). على النقيض من ذلك، osabcg15 الجراثيم الصغيرة انهارت وتدهورت، إلا الحطام من المجهر المنحط موجودة في ثيرول (الشكل 5F).

الشكل 1: بناء المعلومات لنظام CRISPR/Cas9 والتوليد المُستهدف للـ OsABCG15. (أ)كان الدافع sgRNA من قبل المروج OsU3، في حين كان الدافع وراء الكاسيت التعبير من hSpCas9 من قبل المروج 35S مزدوجة؛ تم تجميع المتجه الأوسط في ناقل ثنائي واحد مصمم لـ Agrobacterium-بوساطة تحول مستقر من الأرز. (ب)تم اختيار التسلسل (5'AAGCACATCCTAGGGAT-3) الموجود في الثوب الثاني من الجين OsABCG15 كموقع مستهدف من sgRNA. تم إنشاء ثلاثة أنواع من أحداث الطفرات المتجانسة بواسطة CRISPR-Cas9 في خلفية japonica cultivar 9522 ، وتظهر سلسلة سانجر الكروماتوجرامات من مواقع الطفرات المستحثة CRISPR-Cas9. خط 9522osabcg15-1 يحتوي على إدخال أحادي النيوكليوتيدات (1-nt) 'A'; خط 9522osabcg15-2 لديه نيوكليوتيد واحد (1-nt) 'G' الإدراج; وخط 9522osabcg15-3 لديه النيوكليوتيدات واحدة (1-nt) 'G' الحذف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مواد بدء لحفز الـ callus. (أ) الأرز الصغير في مرحلة الوسيس. (ب)تشريح تحلل الشباب المتنامية على المتوسط NBD2. شريط = 2 سم في (A). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
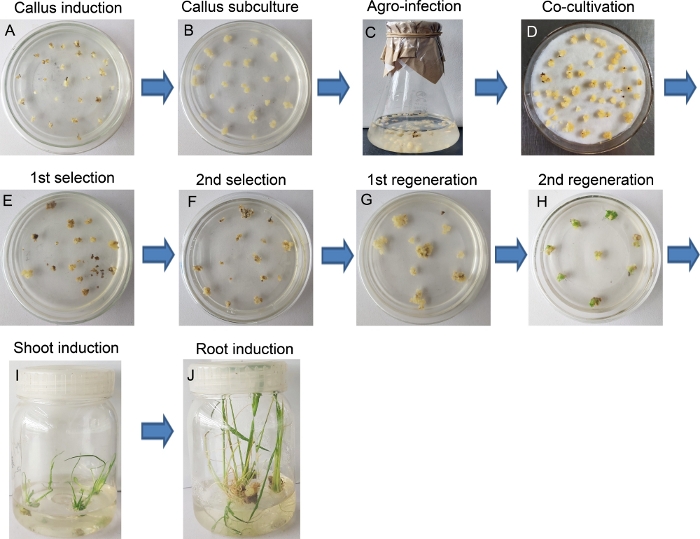
الشكل 3: إجراء لإنتاج خطوط تحويلية بواسطة تحويل البكتيريا الزراعية. (أ) الأرز كالي ولدت من ازهار الشباب. (ب) ثقافة فرعية من كالي. (C) حضانة كالي مع A. tumefaciens. (D) شارك في زراعة كالي مع A. tumefaciens. (E) دورة الاختيار الأولى من كالي تحول في وجود Hygromycin (40 ملغ / لتر). (F) دورة الاختيار الثانية من كالي تحول في وجود Hygromycin (40 ملغ / لتر). (G) التجديد الأول من كالي تحول. (H) التجديد الثاني من كالي تحويل، مشيرا إلى نقطة تبادل لاطلاق النار الأخضر في لوحة الثقافة. (I) اطلاق النار على ثقافة الحث. (J) تحريض الجذر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تحليل ترددات التحول في شتلات الأرز المجددة. منتجات PCR مضخمة تظهر جزء 604 bp (1-8، 10-14، 16-20) بعد 1.5٪ من جل agarose تشير إلى خطوط موجبة معدلة وراثيا. الخطوط التي تفتقر إلى الجزء غير مُنقلة (9، 15، 21)، مشابهة لعنصر التحكم (WT) من النوع البري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: المراقبة الأساسية للحرفين من النوع البري (9522) و 9522osabcg15-1. (أ) من النوع البري (9522) زهرة و (D) 9522osabcg15-1 زهرة متحولة بعد إزالة اليممة والباليه. gl، غلوم؛ fi, خيوط; لو ، lodicule ؛ pi, pistil; st, stamen. (B) أنا2-KI تلطيخ من الحبوب ناضجة حبوب اللقاح من نوع البرية (9522) و (E) 9522osabcg15-1 خط. (ج)تحليل من تطور آخر في البرية من نوع (9522) و (F) 9522osabcg15-1 mutant بواسطة الملاحظة المقطعية. DMsp، انحطاط الجراثيم الدقيقة؛ E, البشرة; En, endothecium; MSP، microspore؛ تي، تابتتوم. أشرطة = 2 ملم في (A) و (D) ، 100 ميكرومتر في (B) و (E)، 50 ميكرومتر في (C) و (F). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تركيبات وسائط من أجل تحويل الأرز. الرجاء النقر هنا لتحميل هذا الجدول.
الجدول 2: التحول والكفاءة تحرير الجينات من المسوخ من OsABCG15 التي تولدها CRISPR-Cas9 في الجيلT 0. الرجاء النقر هنا لتحميل هذا الجدول.
Discussion
يتم عادةً توليد المسوخ العقيمة الذكرية الاصطناعية بواسطة الطفرات الفيزيائية أو الكيميائية أو البيولوجية العشوائية. على الرغم من أن هذه هي تقنيات قوية، طبيعتها العشوائية فشل في الاستفادة من كمية هائلة من المعرفة الجينومية الحديثة التي لديها القدرة على تقديم تحسينات مصممة خصيصا في تربية الجزيئية32. وقد تم نظام CRISPR-Cas9 على نطاق واسع في النباتات بسبب وسائله بسيطة وبأسعار معقولة للتلاعب وتحرير الحمض النووي29,33; لديها القدرة على توفير الوقت مقارنة بأساليب الطفرات التقليدية.
هنا ، طورنا نظام تحويل مناسب من قبل Agrobacteriumباستخدام infloresences الشباب كاكزنج للحث callus. هناك بعض الخطوات في إجراء transgene التي يمكن حذفها لتوفير الوقت. استخدام النضور الشباب كمادة البداية هو خيار جيد لتقليل المدة الإجمالية للحث callus مقارنة باستخدام البذور كما explants. بالإضافة إلى ذلك ، فإن تمايز الخلايا والقدرة على التجديد قوية جدا في كالي التي تم الحصول عليها من ازهار الشباب. في هذه العملية، يمكن تجنب ثقافة فرعية من الأرز كالي، مما يوفر الوقت في نهاية المطاف، فضلا عن يقلل من خطر التلوث البكتيري والفطري. وعلاوة على ذلك، تم استخدام Timentin كمضاد حيوي بدلا من كاربينسيلين، وهو أكثر فعالية في تثبيط البكتيريا.
الدراسة والبروتوكول المقدم لمراقبة الظواهر الأساسية من النمو الإنجابي للذكور في الأرز مفيد لطلاب المرحلة الجامعية والدراسات العليا الذين يرغبون في البيولوجيا الإنجابية النباتية. وينبغي أن يكون هذا البروتوكول المريح سريعاً في الفهم والقابلة للتكرار للاستخدام في الدراسات البحثية اللاحقة.
Disclosures
اي.
Acknowledgements
ويود المؤلفون أن يعترفوا بـ "شياوفي تشن" لتوفيرها لفلورات الأرز الصغيرة والمساعدة في جعل زراعة أنسجة الأرز متوسطة. وقد دعم هذا العمل المؤسسة الوطنية الصينية للعلوم الطبيعية (31900611).
Materials
| Name | Company | Catalog Number | Comments |
| 1-Naphthaleneacetic acid | Sigma-Aldrich | N0640 | |
| 2, 4-Dichlorophenoxyacetic Acid | Sigma-Aldrich | D7299 | |
| 6-Benzylaminopurine (6-BA) | Sigma-Aldrich | B3408 | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Agar | Sinopharm Chemical Reagent Co., Ltd | 10000561 | |
| Ammonium sulfate | Sinopharm Chemical Reagent Co., Ltd | 10002918 | |
| Aneurine hydrochloride | Sigma-Aldrich | T4625 | |
| Anhydrous ethanol | Sinopharm Chemical Reagent Co., Ltd | 10009218 | |
| Bacteriological peptone | Sangon Biotech | A100636 | |
| Beef extract | Sangon Biotech | A600114 | |
| Boric acid | Sinopharm Chemical Reagent Co., Ltd | 10004808 | |
| Calcium chloride dihydrate | Sinopharm Chemical Reagent Co., Ltd | 20011160 | |
| Casein acid hydrolysate | Beijing XMJ Scientific Co., Ltd | C184 | |
| Cobalt(II) chloride hexahydrate | Sinopharm Chemical Reagent Co., Ltd | 10007216 | |
| Copper(II) sulfate pentahydrate | Sinopharm Chemical Reagent Co., Ltd | 10008218 | |
| D(+)-Glucose anhydrous | Sinopharm Chemical Reagent Co., Ltd | 63005518 | |
| D-sorbitol | Sinopharm Chemical Reagent Co., Ltd | 63011037 | |
| EDTA, Disodium Salt, Dihydrate | Sigma-Aldrich | E5134 | |
| EOS Digital SLR and Compact System Cameras | Canon | EOS 700D | |
| Formaldehyde | Sinopharm Chemical Reagent Co., Ltd | 10010018 | |
| Fully Automated Rotary Microtome | Leica Biosystems | Leica RM 2265 | |
| Glacial acetic acid | Sinopharm Chemical Reagent Co., Ltd | 10000208 | |
| Glycine | Sinopharm Chemical Reagent Co., Ltd | 62011516 | |
| Hygromycin | Beijing XMJ Scientific Co., Ltd | H370 | |
| Inositol | Sinopharm Chemical Reagent Co., Ltd | 63007738 | |
| Iodine | Sinopharm Chemical Reagent Co., Ltd | 10011517 | |
| Iron(II) sulfate heptahydrate | Sinopharm Chemical Reagent Co., Ltd | 10012116 | |
| Kanamycine | Beijing XMJ Scientific Co., Ltd | K378 | |
| Kinetin | Sigma-Aldrich | K0753 | |
| L-Arginine | Sinopharm Chemical Reagent Co., Ltd | 62004034 | |
| L-Aspartic acid | Sinopharm Chemical Reagent Co., Ltd | 62004736 | |
| L-Glutamine | Beijing XMJ Scientific Co., Ltd | G229 | |
| L-proline | Beijing XMJ Scientific Co., Ltd | P698 | |
| Magnesium sulfate heptahydrate | Sinopharm Chemical Reagent Co., Ltd | 10013018 | |
| Manganese sulfate monohydrate | Sinopharm Chemical Reagent Co., Ltd | 10013418 | |
| Microscopes | NIKON | Eclipse 80i | |
| MS | Phytotech | M519 | |
| Nicotinic acid | Sigma-Aldrich | N0765 | |
| Phytagel | Sigma-Aldrich | P8169 | |
| Potassium chloride | Sinopharm Chemical Reagent Co., Ltd | 10016308 | |
| Potassium dihydrogen phosphate | Sinopharm Chemical Reagent Co., Ltd | 10017608 | |
| Potassium iodide | Sinopharm Chemical Reagent Co., Ltd | 10017160 | |
| Potassium nitrate | Sinopharm Chemical Reagent Co., Ltd | 1001721933 | |
| Pyridoxine Hydrochloride (B6) | Sigma-Aldrich | 47862 | |
| Rifampicin | Beijing XMJ Scientific Co., Ltd | R501 | |
| Sodium hydroxide | Sinopharm Chemical Reagent Co., Ltd | 10019718 | |
| Sodium molybdate dihydrate | Sinopharm Chemical Reagent Co., Ltd | 10019816 | |
| Stereo microscopes | Leica Microsystems | Leica M205 A | |
| Sucrose | Sinopharm Chemical Reagent Co., Ltd | 10021418 | |
| Technovit embedding Kits 7100 | Heraeus Teknovi, Germany | 14653 | |
| Timentin | Beijing XMJ Scientific Co., Ltd | T869 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Water bath for paraffin sections | Leica Biosystems | Leica HI1210 | |
| Yeast extract | Sangon Biotech | A515245 | |
| Zinc sulfate heptahydrate | Sinopharm Chemical Reagent Co., Ltd | 10024018 |
References
- Izawa, T., Shimamoto, K. Becoming a model plant: The importance of rice to plant science. Trends in Plant Science. 1 (3), 95-99 (1996).
- Shimamoto, K., Kyozuka, J. Rice as a model for comparative genomics of plants. Annual Review of Plant Biology. 53 (1), 399-419 (2002).
- Selva, C., et al. Hybrid breeding in wheat: how shaping floral biology can offer new perspectives. Functional Plant Biology. 47 (8), 675-694 (2020).
- Lippman, Z. B., Zamir, D. Heterosis: revisiting the magic. Trends in Genetics. 23 (2), 60-66 (2007).
- Zhang, D., Liang, W. Improving food security: using male fertility for hybrid seed breeding. Science. , 45-48 (2016).
- Masters, A., et al. Agrobacterium-Mediated Immature Embryo Transformation of Recalcitrant Maize Inbred Lines Using Morphogenic Genes. Journal of Visualized Experiments. (156), e60782 (2020).
- Laurenceau, R., et al. A type IV pilus mediates DNA binding during natural transformation in Streptococcus pneumoniae. PLoS Pathogens. 9 (6), 1003473 (2013).
- Tzfira, T., Citovsky, V. Agrobacterium-mediated genetic transformation of plants: biology and biotechnology. Current Opinion in Biotechnology. 17 (2), 147-154 (2006).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiology. 150 (4), 1665-1676 (2009).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. International Journal of Developmental Biology. 57, 467-481 (2013).
- Hiei, Y., Komari, T. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed. Nature Protocols. 3 (5), 824 (2008).
- Hiei, Y., Ohta, S., Komari, T., Kumashiro, T. Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. The Plant Journal. 6 (2), 271-282 (1994).
- Hiei, Y., Komari, T., Kubo, T. Transformation of rice mediated by Agrobacterium tumefaciens. Plant Molecular Biology. 35 (1-2), 205-218 (1997).
- Nishimura, A., Aichi, I., Matsuoka, M. A protocol for Agrobacterium-mediated transformation in rice. Nature Protocols. 1 (6), 2796 (2006).
- Yara, A., et al. Production of transgenic japonica rice (Oryza sativa) cultivar, Taichung 65, by the Agrobacterium-mediated method. Plant Biotechnology. 18 (4), 305-310 (2001).
- Cho, S. K., et al. Efficient transformation of Korean rice cultivars (Oryza sativa L.) mediated by Agrobacterium tumefaciens. Journal of Plant Biology. 41 (4), 262-268 (1998).
- Toki, S. Rapid and efficient Agrobacterium-mediated transformation in rice. Plant Molecular Biology Reporter. 15, 16-21 (1997).
- Zhang, J., Xu, R. j., Elliott, M. C., Chen, D. F. Agrobacterium-mediated transformation of elite indica and japonica rice cultivars. Molecular Biotechnology. 8 (3), 223-231 (1997).
- Aldemita, R. R., Hodges, T. K. Agrobacterium tumefaciens-mediated transformation of japonica and indica rice varieties. Planta. 199 (4), 612-617 (1996).
- Rashid, H., Yokoi, S., Toriyama, K., Hinata, K. Transgenic plant production mediated by Agrobacterium in indica rice. Plant Cell Reports. 15 (10), 727-730 (1996).
- Sahoo, K. K., Tripathi, A. K., Pareek, A., Sopory, S. K., Singla-Pareek, S. L. An improved protocol for efficient transformation and regeneration of diverse indica rice cultivars. Plant Methods. 7 (1), 49 (2011).
- Rachmawati, D., Hosaka, T., Inoue, E., Anzai, H. Agrobacterium-mediated transformation of Javanica rice cv. Rojolele. Bioscience, Biotechnology, and Biochemistry. 68 (6), 1193-1200 (2004).
- Dong, J., Teng, W., Buchholz, W. G., Hall, T. C. Agrobacterium-mediated transformation of Javanica rice. Molecular Breeding. 2 (3), 267-276 (1996).
- Bortesi, L., Fischer, R. The CRISPR/Cas9 system for plant genome editing and beyond. Biotechnology Advances. 33 (1), 41-52 (2015).
- Li, Q., et al. Development of japonica photo-sensitive genic male sterile rice lines by editing carbon starved anther using CRISPR/Cas9. Journal of Genetics and Genomics. 43 (6), 415 (2016).
- Qin, P., et al. ABCG15 encodes an ABC transporter protein, and is essential for Post-Meiotic anther and pollen exine development in rice. Plant and Cell Physiology. 54, (2013).
- Mao, Y., et al. Application of the CRISPR-Cas system for efficient genome engineering in plants. Molecular Plant. 6 (6), 2008-2011 (2013).
- Itoh, J. I., et al. Rice plant development: from zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Gawel, N. J., Jarret, R. L. A modified CTAB DNA extraction procedure forMusa andIpomoea. Plant Molecular Biology Reporter. 9 (3), 262-266 (1991).
- Wei, F. J., Droc, G., Guiderdoni, E., Hsing, Y. i. C. International Consortium of Rice Mutagenesis: resources and beyond. Rice. 6 (1), 39 (2013).
- Feng, Z., et al. Efficient genome editing in plants using a CRISPR/Cas system. Cell Research. 23 (10), 1229 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved