Method Article
מידול החיסונית חזוי של גידולים מוצקים
In This Article
Summary
השימוש בגישה מבוססת RNA כדי לקבוע פרופילים חיסוניים כמותיים של רקמות הגידול מוצק ומינוף גדודים קליניים עבור גילוי החיסונית-אונקולוגיה בסמנים מתואר באמצעות פרוטוקולים מולקולריים ואינפורמטיקה.
Abstract
חיסוני להראות הבטחה בטיפול של חולי אונקולוגיה, אבל טרוגניות מורכבת של מיקרוסביבה הגידול גורם לניבוי תגובת הטיפול מאתגרת. היכולת לפתור את האוכלוסיות היחסיות של תאים חיסוניים נוכח וסביב רקמת הגידול הוכח קלינית-רלוונטי לתגובה הבנה, אבל הוא מוגבל על ידי טכניקות מסורתיות כגון הזרמת cy, ואימונוהיסטוכימיה ( IHC), בשל כמות גדולה של רקמות נדרשות, היעדר סמנים מדויקים לסוג תא, ומכשולים טכניים ולוגיסטיים רבים. שיטת אחד (למשל, החיסון ליצירת פרופיל החיסונית) מתגבר על האתגרים הללו על ידי הקלה הן כמויות קטנות של RNA ו-RNA מושפל מאוד, תכונות נפוצות של RNA שחולצו מרקמת הגידול המוצק המאוחסן בארכיון. הגישה מתבצעת באמצעות ערכה מגיב ואינפורמטיקה המבוססת על ענן צמתים המספקת פתרון ליצירת פרופיל מקצה-לקצה כמותי, בעל תפוקה גבוהה, לפלטפורמות רצף הארה. החוקרים להתחיל עם מעטים כמו שני חלקים של formalin קבוע-מוטבע הרקמה (FFPE) או 20-40 ng של RNA סה כ (בהתאם לאיכות המדגם), ואת הפרוטוקול יוצר דוח פרופיל החיסון ככמת שמונה סוגי תא החיסונית עשר החיסונית בריחה גנים, לכידת תצוגה מלאה של מיקרוסביבה הגידול. אין צורך לבצע ניתוח ביולוגי נוסף כדי להשתמש בנתונים שיתקבלו. עם הקבוצה המתאימה לדוגמה, הפרוטוקול עשוי לשמש גם כדי לזהות סמנים משמעותיים מבחינה סטטיסטית בתוך אוכלוסייה החולה של עניין.
Introduction
כימות של לימפוציטים הסתננות הגידול (TILs) ומולקולות אחרות הקשורות החיסונית ב-formalin-קבוע ו פרפין מוטבע (ffpe) גידול מוצק הגוף האנושי דגימות הוכיחה ערך במחקר קליני1,2,3. טכניקות נפוצות כגון זרימה cy, החומצה החד תא ריבונוקלאית (RNA) רצף שימושי עבור רקמה טרייה דם4, אבל הם לא מתאימים לניתוח של חומרים ffpe בשל חוסר יכולת ליצור השעית תאים קיימא. שיטות נוכחיות ששימשו לכמת תאים אלה ברקמת FFPE סובלים מאתגרים גדולים. אימונוהיסטוכימיה (IHC) וזרימות עבודה דומות אחרות של הדמיה דורשות נוגדנים ספציפיים כדי לזהות חלבונים של פני השטח, אשר יכולים להיות קשים לתקנן על פני מעבדות כדי לאפשר כימות לחות5. פלטפורמות כגון מערכת nCounter להסתמך על הביטוי של גנים בודדים כדי להגדיר תאים חיסוניים מפתח6, הגבלת רגישות וספציפיות של זיהוי. שיטות כלליות יותר לרצפי RNA, ביחד עם כלי תוכנה עצמאיים, זמינים אך דורשים אופטימיזציה ואימות משמעותיים לפני השימוש7,8,9,10,11,12. ההתפתחויות האחרונות בשילוב לכידת לייזר מיקרודיסקציה (LCM) עם רצפי RNA עבור רקמת FFPE הראו הבטחה; עם זאת, התפוקה הגבוהה יותר, פתרון סוהר הוא נדרש עבור מחקרים טרנסלtional מכוון לזיהוי סמנים חזקים13,14. שיטות ליצירת ביורים רב ממדיים, כגון מידול החיסונית חזוי, המגדירים כנופיית החולה כולל המגיבים תרפיה, סוגי סרטן, או תוצאות הישרדות עם דיוק ניבוי גבוה משמעות סטטיסטית נעשים יותר ויותר חשוב בגיל של רפואה מדויקת וחיסוני15,16.
כדי לטפל בצורך זה, שיטת הפרופיל החיסונית פותחה כדי לאפשר כימות רגיש וספציפי של תאים חיסוניים ברקמת הגידול מוצק FFPE באמצעות הריאגנטים RNA-רצפי מתוקננת ומבוססי ענן מבוסס-. בנוסף כדי לאכלס RNA מושפל מרקמת FFPE, הפרוטוקול הוא מסוגל להכיל RNA נגזר מהגבלת דגימות רקמות כגון ביופסיות מחט הליבה, המחט מורקמת, מיקרו או מאקרו לגזור רקמות. ה-RNA נתונים מכל מדגם מושווה למסד נתונים של מודלים ביטוי גנים של תאים חיסוניים, הנקרא בריאות החיסונית ביטוי מודלים, כדי לכמת את התאים החיסוניים כאחוז של תאים סה כ נוכח המדגם. בקצרה, מודלים אלה נבנו באמצעות שיטות לימוד מחשב כדי לזהות תבניות ייחודיות של ביטויים רב-מגנטיים מנתונים שלמים הנוצרים מפני אוכלוסיות תאים החיסונית מטוהרים (מבודדים באמצעות סמנים תא משטח קאנוני)17,18. ביטוי בריאות רב מימדית מודלים בבסיס הטכנולוגיה מאפשרת את האפשרות לכמת כל תא החיסון כאחוז התאים הכולל נוכח בתערובת הטרוסוגני. הדבר מאפשר לחוקר ליצור השוואות בין תאים המערכת החיסונית הפנים-לדוגמה, אשר הוכחו כבעל ערך קליני19,20. יישומים אחרים כוללים כימות התגובה החיסונית לפני ואחרי הטיפול, כפי שמתואר בתוצאות הנציג. מדווחים על תכונות מרובות של מרקם החיסון של הגידול מיקרוסביבה הגידול כולל את האחוזים המוחלט של שמונה סוגי תא החיסונית (נגזר מודלים ביטוי גנים): CD4+ t תאים, CD8+ t תאים, CD56+ טבעי הרוצח תאים, CD19+ B תאים, CD14+ מונוציטים, tregs, מקרופאגים M1, ו בנוסף, הדו מדווח על הביטוי (בתעתיקים למיליון, או TPM) של עשר גנים בריחה חיסונית: PD-1, PD-L1, CTLA4, OX40, TIM-3, BTLA, ICOS, CD47, IDO1, ו ARG1.
הערכה הכימית משמשת להכנת ספריות איכותיות מוכנות לרצף בפלטפורמת המאייר בעקבות שיטת הכנה ללכידה היברידית המבוססת על לכידה, כפי שמוצג באיור 1. אם לחוקר אין פלטפורמת הרצף של המאייר במעבדה שלהם, הם עשויים להגיש דגימות שלהם למעבדת ליבה לרצף. לאחר שנוצר, נתוני רצף מועלה לפורטל הפריזמה לניתוח אוטומטי, ופרופיל מקיף וכמותי לכל מדגם בודד, בצורת דוח המערכת (איור 2א), מוחזר למשתמש. משתמשים יכולים גם להגדיר קבוצות לדוגמה בפורטל הפריזמה כדי ליצור דוח ביוארקר (איור 2ב), הדגשת סמנים משמעותיים מבחינה סטטיסטית המבדילים בין שני גדודים החולה. חשוב מכך, הנתונים שנוצרו על-ידי הערכה הכימית הם לשימוש מחקרי בלבד ולא ניתן להשתמש בהם למטרות אבחון.

איור 1: מבט כולל על זרימת עבודה. בפרוטוקול זה, RNA מומר לראשונה ל-cDNA. מתאמי הרצף הם ליגבים, ומתאם cDNA המתאם מוגבר ומקודד על ידי ה-PCR כדי ליצור ספריית טרום לכידה. בדיקות biotinylated מהוכלא אז למטרות cDNA ספציפיים אשר נלכדו אז באמצעות חרוזי streptavidin. מאוגד, לא ממוקד cDNA מוסר על ידי שטיפת. . מוכנה לרצף * סך RNA חייב להיות מדגימות אנושיות; עלול להיות שלם או מושפל (FFPE) RNA. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הנציג דוחות החיסונית. זרימת העבודה מפיקה שני דוחות, דוח חיסוני בודד (A) עבור כל מדגם מעובד, ודוח ביוארנקר (B) עבור כנופיית מטופלים מוגדרים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הפרוטוקול דורש כ 16 h של זמן הכנה (מ-RNA סה כ לספריות מוכן לרצף); עם זאת, קיימות מספר נקודות עצירה אופציונליות, כפי שצוינו בפרוטוקול. הטיפול עושה שימוש העשיר, דינמי האופי של הטרנססקריפט לעבור מעבר מורשת חד מימדית ביטויים למודלים גנים רב ממדיים, ובכך לאפשר אפיון ביולוגי מקיף של דגימות רקמה עם סטנדרטית ריאגנטים וכלי תוכנה קלים לשימוש. זה מעצים את החוקרים לנצל טכנולוגיה עכשווית במעבדה שלהם, על ידי מינוף מחשב למידה ומסד נתונים של ביטוי בריאות מודלים לגזור מדויק יותר, פרופילי החיסון הכמותי של דגימות קליניות יקרות, ולגלות רב-ממדי RNA ביוארקרס עם אנליזה סטטיסטית מלאה.
Protocol
דגימות הרקמה האנושית הנמצאות בתוצאות הנציגים המוצגות כאן נרכשו מישות בעלת מוניטין (קבוצת טכנולוגיה של TriStar) והסכמתם על הסכמת התורמים למחקר אקדמי ומסחרי, כמו גם אישור מוסרי מוסמך וועדה.
חלק I: הכנה לפני לכידת הספרייה
1. כימות הרנ וההסמכה
- לכמת RNA באמצעות שיטת פלואורומטרי כדי לקבוע את הקלט המתאים לקביעת הסדר. להעריך את האיכות של הקלט RNA באמצעות אלקטרופורזה כדי לקבוע את מספר שלמות RNA (RIN) ואת אחוז השברים > 200 נוקלאוטידים (DV200) ערכים.
- עבור שלמות (RIN > 7) או באופן חלקי RNA מושפל (RIN = 2 עד 7) בצע את צעדי ההכנה של הספרייה עבור RNA באיכות גבוהה/שלם, החל בשלב 2.1. איכות ה-RNA חשוב לבחירת זמן הפיצול הנכון בתוכנית הציקלור התרמי #1 (טבלה משלימה 2).
- לדגימות מאוד מובנות (לדוגמה, RIN = 1 עד 2 או FFPE), בדוק את ערך ה-DV200 . דגימות אלה אינן דורשות פיצול ולאחר ההוראות עבור RNA מושפל, החל בשלב 2.2.
- להכין את הסכום המתאים של RNA סך הכל עבור כל מדגם עבור על ידי דילול 20 ng של RNA (באיכות גבוהה/שלמות RNA עם רין > 2) או 40 ng של RNA (בירידה/FFPE RNA עם DV200 > 20%) עד 5 μL במים ללא שכירות. לא מומלץ לעבד דגימות עם DV200 < 20%. עבור הבקרה הדגימות RNA שסופקו עם הערכה, לדלל 1 μL של RNA המתאים 4 μL של המים חינם nuclease. דגימות הבקרה יעברו את אותו עיבוד כפי שמתואר עבור חומרים RNA באיכות גבוהה (שלם) או מושפל (FFPE), כתווית. ראה טבלה משלימה 1 עבור כל הריאגנטים הכלולים בערכה.
2. רנ א פיצול והטרמה
- בצע את Step 2.1.1 לגבי RNA באיכות גבוהה/ללא שינוי עם רין > 2.
- עבור RNA באיכות גבוהה, להרכיב את הפיצול ואת תגובת לקרקע על הקרח בצינור PCR nuclease חינם על פי לוח 1.
- מערבבים ביסודיות על ידי מלטף למעלה ולמטה מספר פעמים. ואז, בקצרה לסובב את הדגימות בתוך מיקרוצנטריפוגה
הערה: עבור כל מהדורות צנטריפוגה בפרוטוקול, מהירות של ≥ 1,000 x g עבור לפחות 3 s מומלץ. - הניחו את הדגימות בציקלייר תרמי והשתמשו ב#1 תוכנית (טבלה משלימה 2).
- מיד להעביר את הצינורות לקרח ולהמשיך הראשון סטרנד cDNA סינתזה באיכות גבוהה RNA (שלב 3.1). עבור הכנה במקביל הן איכות גבוהה ו-RNA FFPE, להתחיל הכנת RNA FFPE (שלב 2.2) במהלך דגירה הפיצול.
- מערבבים ביסודיות על ידי מלטף למעלה ולמטה מספר פעמים. ואז, בקצרה לסובב את הדגימות בתוך מיקרוצנטריפוגה
- עבור RNA באיכות גבוהה, להרכיב את הפיצול ואת תגובת לקרקע על הקרח בצינור PCR nuclease חינם על פי לוח 1.
| פיצול ושילוב לקרקע | אמצעי אחסון (μL) |
| רנ א שלם או מושפל באופן חלקי (20 ng) | מיכל 5 |
| מאגר התגובה של הגדיל הראשון | 4 |
| צבעי יסוד אקראיים | 1 |
| סה כ נפח | 10 |
טבלה 1: פיצול ותגובה לקרקע עבור RNA באיכות גבוהה. רכיבי הפיצול ותגובת הקרקע עבור RNA באיכות גבוהה יש להרכיב מעורב על הקרח על פי אמצעי האחסון המוצג. שילוב מאסטר של הראשון סטרנד התגובה מאגר התחל אקראית אקראי ניתן להוסיף לדגימות RNA.
- בצע את שלב 2.2.1 עבור RNA שיורד/FFPE עם DV200 > 20%.
- ל-RNA המושפל ביותר (FFPE) שאינו דורש פיצול, הכנס את תגובת הקרקע כמתואר בטבלה 2. עבור RNA שלם, זכור לבצע את שלב 2.1.
- מערבבים ביסודיות על ידי מלטף למעלה ולמטה מספר פעמים. ואז, בקצרה לסובב את הדגימות בתוך מיקרוצנטריפוגה.
- הניחו את הדגימות בציקלייר תרמי והשתמשו ב#2 תוכנית (טבלה משלימה 2).
- העבר את הצינורות לקרח והמשך הראשון סטרנד cDNA סינתזה עבור מושפל מאוד (FFPE) RNA (שלב 3.2).
- ל-RNA המושפל ביותר (FFPE) שאינו דורש פיצול, הכנס את תגובת הקרקע כמתואר בטבלה 2. עבור RNA שלם, זכור לבצע את שלב 2.1.
| תגובה לקרקע | אמצעי אחסון (μL) |
| FFPE RNA (40 ng) | מיכל 5 |
| צבעי יסוד אקראיים | 1 |
| סה כ נפח | 6 |
שולחן 2: תגובת הטרמה אקראית לרנ א מושפל במיוחד. רכיבי התגובה לקרקע עבור רנ א מושפל מאוד צריך להיות מורכב על הקרח בצינור PCR nuclease חינם.
3. הראשון מגדיל cDNA סינתזה
- בצע את Step 3.1.1 לגבי RNA באיכות גבוהה/ללא שינוי עם רין > 2.
- עבור RNA שלם (באיכות גבוהה), להרכיב תגובת סטרנד הראשון התגובה על הקרח בצינור PCR nuclease חינם על פי שולחן 3.
- שמירה על התגובות קרח, מערבבים ביסודיות על ידי ליטוף למעלה ולמטה מספר פעמים. בקצרה לסובב את הדגימות בתוך מיקרוצנטריפוגה, ולהמשיך ישירות הדגירה סינתזה הראשון הגדיל (שלב 4).
- עבור RNA שלם (באיכות גבוהה), להרכיב תגובת סטרנד הראשון התגובה על הקרח בצינור PCR nuclease חינם על פי שולחן 3.
| הסטרנד הראשון סינתזה | אמצעי אחסון (μL) |
| RNA מפוצל ומוכן (שלב 2.1.3) | 10 |
| הראשון סטרנד סינתזה ספציפיות מגיב | 8 |
| הראשון מיקס סינתזה האנזים שילוב | 2 |
| סה כ נפח | 20 |
שולחן 3: התגובה של הגדיל הראשון סינתזה עבור RNA באיכות גבוהה. רכיבי הפיצול ותגובת לקרקע עבור RNA באיכות גבוהה יש להרכיב מעורב על הקרח על פי אמצעי האחסון נתון. שילוב מאסטר של הראשון סטרנד סינתזה ספציפיות מגיב הראשון סטרנד סינתזה אנזים ערבוב ניתן לעשות ולהוסיף את הדגימות RNA מפוצלים ומלא.
- בצע את שלב 3.2.1 עבור RNA שאינו מיועד לירידה/FFPE עם DV200 > 20%.
- עבור RNA מושפל מאוד (FFPE), להרכיב את תגובת סטרנד הראשון התגובה על הקרח בצינור PCR nuclease חינם על פי שולחן 4.
- שמירה על התגובות קרח, מערבבים ביסודיות על ידי ליטוף למעלה ולמטה מספר פעמים. בקצרה לסובב את הדגימות בתוך מיקרוצנטריפוגה, ולהמשיך ישירות הדגירה סינתזה הראשון הגדיל (שלב 4).
- עבור RNA מושפל מאוד (FFPE), להרכיב את תגובת סטרנד הראשון התגובה על הקרח בצינור PCR nuclease חינם על פי שולחן 4.
| הסטרנד הראשון סינתזה | אמצעי אחסון (μL) |
| RNA (שלב 2.2.3) | 6 |
| מאגר התגובה של הגדיל הראשון | 4 |
| הראשון סטרנד ספציפיות מגיב | 8 |
| הראשון מיקס סינתזה האנזים שילוב | 2 |
| סה כ נפח | 20 |
שולחן 4: התגובה של הגדיל הראשון סינתזה עבור רנ א מושפל מאוד. רכיבי הפיצול ותגובת הקרקע עבור RNA מושפל מאוד יש להרכיב מעורב על הקרח על פי אמצעי האחסון המוצג. שילוב מאסטר של הראשון סטרנד מאגר התגובה, הראשון סטרנד סינתזה מגיב, ואת הראשון גדיל סינתזה האנזים ערבוב ניתן לעשות ולהוסיף לדגימות RNA.
4. תחילה דגירה סינתזה של הגדיל
- שמירה על הצינורות על הקרח, מערבבים ביסודיות על ידי ליטוף למעלה ולמטה מספר פעמים. לקצר את הדגימות. בתוך מיקרוצנטריפוגה מודיית את הדגימות בתוך מחמם תרמי טרום מחומם בעקבות התוכנית #3 (טבלה משלימה 2).
5. שנייה מגדיל cDNA סינתזה
- הכן את התגובה השנייה לסינתזה cDNA על קרח על ידי הרכבת הרכיבים המפורטים בטבלה 5, כולל המוצר הראשון התגובה סטרנד משלב 4.1.
| תגובת סטרנד השני התגובה | אמצעי אחסון (μL) |
| מוצר ראשון הסינתזה של סטרנד (שלב 4.1) | 20 |
| מאגר התגובה לסינתזה של סטרנד | 8 |
| מיקס האנזים השני של סינתזה | 4 |
| Nuclease-מים ללא תשלום | 48 |
| סה כ נפח | 80 |
שולחן 5: תגובת סטרנד השני התגובה. מרכיבים של התגובה השנייה של מגדיל הסינתזה cDNA יש להרכיב מעורב על הקרח על פי אמצעי האחסון המוצג. שילוב מאסטר של מאגר התגובה השנייה של הסינתזה סטרנד, סינתזה סטרנד שנייה האנזים מיקס, ו Nuclease-מים חינם ניתן להוסיף והוסיף מוצר הראשון סטרנד סינתזה.
- שמירה על הצינורות על הקרח, מערבבים ביסודיות על ידי ליטוף למעלה ולמטה מספר פעמים. דגירה ב ציקלונט תרמית בעקבות התוכנית #4 (טבלה משלימה 2).
6. ניקוי cDNA באמצעות SPRI (מוצק בשלב הפיך) חרוזים
- אפשר לחרוזי SPRI להתחמם לטמפרטורת החדר לפחות 30 דקות לפני השימוש, ולאחר מכן מערבולת SPRI חרוזים עבור כ 30 s כדי להשעות מחדש.
- הוסף 144 μL של חרוזים מושעה מחדש התגובה סינתזה הגדיל השני (~ 80 μL). מערבבים היטב על ידי ליטוף למעלה ולמטה לפחות 10 פעמים ו דגירה עבור 5 דקות בטמפרטורת החדר.
- בקצרה לסובב את הצינורות במיקרוצנטריפוגה ומניחים את הצינורות על מתלה מגנטי כדי להפריד חרוזים מתוך הסופרנטאנט. לאחר הפתרון ברור, להסיר בזהירות ולמחוק את הסופרנטאנט. להיזהר לא להפריע את החרוזים, אשר מכילים דנ א.
- הוסף 180 μL של המוכן טרי 80% אתנול לצינורות בעוד על המדף המגנטי. דגירה בטמפרטורת החדר עבור 30 s, ולאחר מכן בזהירות להסיר ולמחוק את הסופרנטאנט.
- חזור על שלב 6.4 פעם אחת עבור סך של 2 שטיפת שלבים.
- . להסיר לחלוטין את האתנול השיורי השאר את הצינורות על המתלה המגנטי והאוויר מתייבש את החרוזים במשך כ -3 דקות עם המכסה פתוח, או עד שהוא יבש בעליל. אל על יבש את החרוזים, כי זה עלול לגרום להתאוששות נמוכה יותר של DNA.
- להסיר את הצינורות מן המגנט ולהוסיף 53 μL 0.1 x TE מאגר (כלול בערכה מגיב, ראה טבלה משלימה 1) על החרוזים. הפיפטה עולה ויורדת לפחות 10 פעמים כדי לערבב היטב. דגירה עבור 2 דקות בטמפרטורת החדר.
- מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט. העברת 50 μL של סופרנטאנט כדי לנקות שפופרות PCR ללא שכירות נקיות. להיזהר לא להפריע את החרוזים. זוהי נקודת עצירה אופציונלית בפרוטוקול, ניתן לאחסן דגימות cDNA ב-20 ° c.
7. תיקון סיום של ספריית cDNA
- להרכיב את תגובת התיקון הסופי על הקרח על ידי הרכבת את הרכיבים המפורטים בטבלה 6 למוצר סינתזה השני הגדיל משלב 6.8.
| תיקון סיום תגובת | אמצעי אחסון (μL) |
| מוצר סינתזה של סטרנד שניה (שלב 6.8) | 50 |
| תיקון קצה מאגר תגובת | 7 |
| סוף תיקון אנזים מיקס | 3 |
| סה כ נפח | 60 |
שולחן 6: התגובה תיקון סוף. רכיבים של תגובת התיקון הסופי צריך להיות מורכב ומעורבב על קרח לפי אמצעי האחסון המוצג. שילוב מאסטר של מאגר התגובה לתיקון סוף ותיקון בסוף לתקן אנזימים ניתן ליצור ולהוסיף את המוצר השני של הסינתזה סטרנד.
- הגדר פיפטה כדי 50 μL ולאחר מכן פיפטה את כל אמצעי האחסון למעלה ולמטה לפחות 10 פעמים כדי לערבב היטב. צנטריפוגה בקצרה כדי לאסוף את כל הנוזלים מצידי הצינורות. חשוב לערבב היטב. נוכחותו של כמות קטנה של בועות לא תפריע לביצועים.
- מודטה את הדגימות בציקלונט תרמית בעקבות התוכנית #5 (טבלה משלימה 2).
8. מתאם הארכה
- לפני הגדרת תגובת החיבור, דלל את המתאם במאגר דילול מתאם קר-קרח כמוצג בטבלה 7, הכפלה במספר הנדרש של דגימות ועוד 10% תוספת. . שמור את המתאם המדולל על הקרח
| השקיה בדילול | אמצעי אחסון (μL) |
| תאם | 0.5 |
| מאגר דילול מתאם | 2 |
| סה כ נפח | 2.5 |
שולחן 7: מתאם דילול. יש לדלל את המתאם על הקרח באמצעות מאגר דילול המתאם בהתאם לאמצעי האחסון המוצגים.
- הכנס את תגובת החיבור על הקרח על-ידי הוספת הרכיבים כמתואר בטבלה 8, לפי הסדר המפורט, למוצר תגובת ההכנה הסופית משלב 7.3. שימו לב שניתן לערבב לפני הזמן את התמהיל הראשי והשילוב הזמני. תערובת זו יציבה לפחות 8 שעות ב -4 ° c. אל תעשה מראש את התמהיל הראשי של ליטל, משפר ומתאם לפני השימוש בצעד הנוגע למתאם.
| תגובה לדישון | אמצעי אחסון (μL) |
| סוף הכין דנ א (שלב 7.3) | 60 |
| מתאם מדולל (שלב 8.1) | 2.5 |
| מעצם השקיה | 1 |
| מיקס מאסטר ליטל | 30 |
| סה כ נפח | 93.5 |
שולחן 8: תגובה לאחר הריסוס. רכיבים של תגובת המתאם יש להרכיב על הקרח בהתאם לאמצעי האחסון המוצגים לפי הסדר המוצג. שילוב מאסטר של שיפור הקשר והתמזגות מאסטר ניתן לעשות ולהוסיף ל-DNA לסיים הכין עם מתאם מדולל. אין לערבב את המתאם המדולל ואת השילוב הראשי לערבב או לקשר לפני ערבוב עם ה-DNA לסיים הכין.
- הגדר פיפטה כדי 80 μL ולאחר מכן פיפטה את כל אמצעי האחסון למעלה ולמטה לפחות 10 פעמים כדי לערבב היטב. לבצע ספין מהיר כדי לאסוף את כל הנוזלים מצידי הצינורות. . מיקס מאסטר מאוד צמיגי הקפידו לדאוג לערבוב הולם של תגובת הזמן, כאשר ערבוב לא מושלם יגרום ליעילות מופחתת. נוכחותו של כמות קטנה של בועות לא תפריע לביצועים.
- התוכנית הבאה מספר התוכניות #6 (טבלה משלימה 2), ולאחר מכן להסיר את התערובת ליטל מן הציקלונט תרמית להוסיף 3 μl של מתאם עיבוד אנזים, וכתוצאה מכך נפח כולל של 96.5 μl.
- פיפטה למעלה ולמטה מספר פעמים כדי לערבב היטב, ולאחר מכן לאחר מכן המגמה לאחר התוכנית #7 (טבלה משלימה 2) לפני שתמשיך מיד לטיהור של תגובה לאחר.
9. טיהור התגובה באמצעות SPRI Neads
- אפשר חרוזי SPRI לחמם את טמפרטורת החדר לפחות 30 דקות לפני השימוש, ולאחר מכן מערבולת SPRI חרוזים עבור כ 30 s כדי להשעות מחדש.
- הוסף 87 μL של השעיה מחדש של חרוזי SPRI ומערבבים היטב על ידי ליטוף למעלה ולמטה לפחות 10 פעמים. מודטה למשך 10 דקות בטמפרטורת החדר.
- בקצרה לסובב את הצינורות במיקרוצנטריפוגה ומניחים את הצינורות על מתלה מגנטי כדי להפריד חרוזים מתוך הסופרנטאנט. לאחר הפתרון ברור (~ 5 דקות), להסיר בזהירות ולמחוק את הסופרנטאנט. אל תמחק את החרוזים.
- הוסף 180 μL של המוכן טרי 80% אתנול לצינורות בעוד על המדף המגנטי. דגירה בטמפרטורת החדר עבור 30 s, ולאחר מכן בזהירות להסיר ולמחוק את הסופרנטאנט. חזור על שלב 9.4 פעם אחת עבור סך של 2 שטיפת שלבים.
- . להסיר לחלוטין את האתנול השיורי השאר את הצינורות על המתלה המגנטי והאוויר מתייבש את החרוזים במשך כ -3 דקות עם המכסה פתוח, או עד שהוא יבש בעליל. אל על יבש את החרוזים, כי זה עלול לגרום להתאוששות נמוכה יותר של DNA.
- להסיר את הצינורות מן המגנט ולהוסיף 17 μL של 0.1 x TE מאגר לחרוזים. הפיפטה עולה ויורדת לפחות 10 פעמים כדי לערבב היטב. דגירה עבור 2 דקות בטמפרטורת החדר, ולאחר מכן למקם את הצינורות על מדף מגנטי, המאפשר חרוזים כדי להפריד באופן מלא מן supernatant.
- העברה 15 μL של supernatant כדי לנקות nuclease-PCR ללא שפופרות. להיזהר לא להפריע את החרוזים. זוהי נקודת עצירה אופציונלית בפרוטוקול, ה-DNA ligated מתאם יכול להיות מאוחסן ב-20 ° c.
10. העשרת מתאם ה-DNA ליגנטי
- הגדר את תגובת ה-PCR כמתואר בטבלה 9. מיקס מאסטר המכיל את המיקס לפני לכידת PCR מאסטר ואת פריימר אוניברסלי ניתן להוסיף והוסיף DNA חוברים מתאם. לצורך קביעת רצף מרובב, השתמש באינדקס ייחודי ליצירת מפתח לכל תגובה והוסף לכל דוגמה בנפרד.
| העשרה באמצעות PCR | אמצעי אחסון (μL) |
| מתאם DNA ליגנטי (שלב 10.1) | 15 |
| מיקס מאסטר לפני לכידה של PCR | 25 |
| כללי הPCR | מיכל 5 |
| מדד (X) פריימר | מיכל 5 |
| סה כ נפח | 50 |
שולחן 9: העשרת ה-PCR של מתאם DNA ליגנטי. יש להרכיב ולערבב בקרח את המרכיבים של העשרת מתאם ה-PCR בהתאם לאמצעי האחסון המוצגים. שילוב מאסטר של המיקס לפני לכידת pcr מאסטר ו-pcr האוניברסלית פריימר ניתן להוסיף והוסיף DNA חוברים מתאם. לקבלת רצף מרובב, כל מדגם צריך להינתן באינדקס ייחודי.
- מערבבים היטב על ידי ליטוף בעדינות למעלה ולמטה 10 פעמים. בקצרה לסובב את הצינורות במיקרוצנטריפוגה ומקום בתוך הציקלור תרמית לבצע הגברה PCR באמצעות תוכנית #8 (טבלה משלימה 2).
11. טיהור תגובת ה-PCR באמצעות חרוזי SPRI
- אפשר חרוזי SPRI לחמם את טמפרטורת החדר לפחות 30 דקות לפני השימוש, ולאחר מכן מערבולת SPRI חרוזים עבור כ 30 s כדי להשעות מחדש.
- הוסף 45 μL של חרוזי השעיה מחדש לכל תגובת PCR (~ 50 μL). מערבבים היטב על ידי ליטוף למעלה ולמטה לפחות 10 פעמים, לפני הדגירה עבור 5 דקות בטמפרטורת החדר.
- בקצרה לסובב את הצינורות במיקרוצנטריפוגה ומניחים את הצינורות על מתלה מגנטי כדי להפריד חרוזים מתוך הסופרנטאנט. לאחר הפתרון ברור (~ 5 דקות), להסיר בזהירות ולמחוק את הסופרנטאנט. להיזהר לא להפריע את החרוזים המכילים דנ א.
- הוסף 180 μL של המוכן טרי 80% אתנול לצינורות בעוד במתלה מגנטי. דגירה בטמפרטורת החדר עבור 30 s, ולאחר מכן בזהירות להסיר ולמחוק את הסופרנטאנט. חזור על שלב 11.4 פעם אחת עבור סך של 2 שטיפת שלבים.
- . להסיר לחלוטין את האתנול השיורי השאר את הצינורות על המתלה המגנטי והאוויר מתייבש את החרוזים במשך כ -3 דקות עם המכסה פתוח, או עד שהוא יבש בעליל. אל על יבש את החרוזים, כי זה עלול לגרום להתאוששות נמוכה יותר של DNA.
- להסיר את הצינורות מן המגנט ולהוסיף 23 μL 0.1 x TE מאגר לחרוזים. הפיפטה עולה ויורדת לפחות 10 פעמים כדי לערבב היטב. דגירה עבור 2 דקות בטמפרטורת החדר.
- מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט. העברה 20 μL של סופרנטאנט כדי לנקות שפופרות PCR ללא החכירה חינם. להיזהר לא להפריע את החרוזים. זוהי נקודת עצירה אופציונלית בפרוטוקול, ניתן לאחסן ספריות קדם-לכידה ב-20 ° c.
12. ספריית קדם-לכידה של אימות וככמת
- למדוד את הריכוז של ספריית טרום לכידה באמצעות פלואורומטר ושיטת רגישות גבוהה. תשואה מינימלית של 200 ng נדרשת כדי להמשיך חלק II: היברידיזציה ולכידה.
- הפעל 1 μL של ספריה במערכת אלקטרופורזה דיגיטלית. במקרה הצורך, דלל את המדגם כדי למנוע העמסת שבב הרגישות הגבוהה, בהתאם להמלצות הפרוטוקול של היצרן.
- בדוק כי electropherogram מראה התפלגות צרה עם גודל השיא כ 250-400 bp (ראה תוצאות הנציג, איור 3 ו איור 4).
- אם שיא bp 128 (מתאם-dimer) גלוי בעקבות Bioanalyzer, ואת עוצמת האות הוא ≥ את עוצמת האות 250-400 הספרייה bp (לראות תוצאות הנציג, איור 5), ולאחר מכן להעלות את עוצמת הדגימה (משלב 11.7) כדי 50 μl עם 0.1 x TE מאגר ולחזור על הטיהור Spri חרוז (שלב 11) זוהי נקודת עצירה אופציונלית בפרוטוקול, ניתן לאחסן ספריות טרום-לכידה ב-20 ° c לפני המעבר לחלק II: היברידיזציה ולכידה.
חלק ב': היברידיזציה ולכידה
13. לשלב חוסם האוליגוס, Cot-1 דנ א, הספרייה לפני לכידת דנ א, יבש
- מערבבים את הספרייה מקודד הכין בשלב 11 וככמת בשלב 12, עם Cot-1 DNA ו חסימת Oligos בצינור PCR nuclease או 1.5 mL מיקרופופרת, כפי שמוצג בטבלה 10.
| ריאגנט | כמות/אמצעי אחסון |
| ספריה ברמקומית משלב 10.10 | 200 |
| Cot-1 דנ א | 2 μg |
| חסימת האוליגוס | 2 מיקרומטר |
שולחן 10: ליברידיזציה הכנה וייבוש למטה. מרכיבים שניתן לשלב לייבוש הספריות בהכנת היברידיזציה צריך להיות מורכב על פי הכמויות המוצגות.
- נגב את תוכן הצינורית באמצעות מרכז ואקום שהוגדר ל-30-45 ° c. זוהי נקודת עצירה אופציונלית בפרוטוקול. לאחר ייבוש, הצינורות עשויים להיות מאוחסנים לילה בטמפרטורת החדר (15-25 ° c) או למשך יותר ב-20 ° c.
14. Hybridize לכידת DNA רגשים עם הספרייה
- הפשרת 2x חרוז לשטוף מאגר היברידיזציה, מאגר היברידיזציה ומאגרי, מאגר בדיקה של 10x 1, 10x לשטוף מאגר 2, 10x לשטוף מאגר 3, ו 10x מחמירים לשטוף מאגר בטמפרטורת החדר. לפני השימוש, לבדוק את מאגר היברידיזציה על התגבשות של מלחים. אם הקריסטלים נוכחים, מחממים את הצינור ב-65 ° c, רועדים לסירוגין, עד שהמאגר יהיה מסיסות לחלוטין.
- בטמפרטורת החדר, ליצור את מיקס מאסטר היברידיזציה בצינור. הכפל אמצעי אחסון לפי מספר הדגימות והוסף 10% תוספת, לאחר הטבלה 11.
| היברידיזציה מערבבים | אמצעי אחסון (μL) |
| מאגר היברידיזציה | 8.5 |
| משפר מאגר היברידיזציה | 2.7 |
| בלוח הבקרה של אימונואופריזם | מיכל 5 |
| Nuclease-מים ללא תשלום | 0.8 |
| סה כ נפח | 17 |
שולחן 11: היברידיזציה מיקס הורים. רכיבים של מיקס מאסטר היברידיזציה צריך להיות מורכב ומעורבב בטמפרטורת החדר על פי אמצעי האחסון המוצג.
- מערבולת או פיפטה למעלה ולמטה כדי לערבב היטב. לאחר מכן, להוסיף 17 μL של מיקס מאסטר הכלאה לכל צינור המכיל DNA מיובש. חותם את הצינורות ואת הדגירה עבור 5 דקות בטמפרטורת החדר.
- מערבולת את הדגימות, להבטיח שהם מעורבים לחלוטין, ולסובב את הדגימות לזמן קצר במיקרוצנטריפוגה. אם ישים, העבר כל מדגם מ-1.5 mL מיקרופופרת לצינור PCR נטול שכירות.
- הניחו את הדגימות בציקלייר תרמי והפעל את התוכנית #9 (טבלה משלימה 2).
- במהלך הדגירה, להכין את מאגרי לשטוף (שלב 15) ו streptavidin חרוזים (שלב 16), המאפשר זמן מספיק כדי לחממים מאגרי ומשקל החרוזים streptavidin.
15. הכנת מאגרי כביסה
הערה: מאגרי הכביסה מסופקים כ-2x (מאגר שטיפת חרוזים) או 10x (כל מאגרי הכביסה האחרים) פתרונות מרוכזים.
- במהלך הדגירה היברידיזציה, לדלל את מאגר שטיפת חרוז 2x ואת מאגרי שטיפת 10x כדי ליצור 1 x פתרונות עבודה, הכפלת לפי מספר נדרש של דגימות והוספת 10% תוספת, אחרי טבלה 12. אם 10x מאגר לשטוף 1 מעונן, לחמם את הבקבוק ב 65 מעלות צלזיוס אמבט מים או בלוק חימום כדי להשעות חלקיקים מחדש. מאגרי הכביסה הקפואים של 1x צריכים להיות מעורבים לאחר הפשרה.
| מאגרי שטיפת כביסה | מאגר מרוכז (μL) | נוקיחכירה-מים ללא תשלום (μL) | סה כ (μL) |
| מאגר שטיפת חרוזים | 150 | 150 | 300 |
| שטוף מאגר 1 | 25 | 225 | 250 |
| שטוף מאגר 2 | 15 | 135 | 150 |
| שטוף מאגר 3 | 15 | 135 | 150 |
| מאגר כביסה מחמיר | 30 | 270 | 300 |
טבלה 12: לשטוף דילול המאגר. מאגרי שטיפת ריכוז צריך להיות מדולל עם nuclease-מים ללא תשלום בטמפרטורת החדר על פי אמצעי האחסון המוצג.
- להוריד את מאגרי הכביסה של 1x לצינורות ה-PCR ללא שכירות ולמקם את הטמפרטורות המתאימות כפי שמצוין בלוח 13. הקפידו לכלול מספיק עודף לליטוף. עבור מאגרים מחוממים, השתמשו בציקלייר תרמי שהוגדר כ-65 ° c עם המכסה שהוגדר ל-70 ° c.
| מאגרי שטיפת כביסה | טמפרטורת החזקה | אמצעי אחסון/שפופרת (μL) | מספר הצינוריות/לדוגמה |
| מאגר שטיפת חרוזים | RT (15-25 ° C) | 100 | 3 |
| שטוף מאגר 1 | 65 ° c | 100 | 1 |
| שטוף מאגר 1 | RT (15-25 ° C) | 150 | 1 |
| שטוף מאגר 2 | RT (15-25 ° C) | 150 | 1 |
| שטוף מאגר 3 | RT (15-25 ° C) | 150 | 1 |
| מאגר כביסה מחמיר | 65 ° c | 150 | 2 |
טבלה 13: מאגרי שטיפת מדולל. מאגרי לשטוף מדולל צריך להיות מצוטט לתוך צינורות נפרדים על פי אמצעי האחסון ומספר צינורות לכל מדגם המוצג. יש להחזיק את מאגרי הכביסה בטמפרטורה שצוינה לפני השימוש.
- הכינו את מיקס החרוזים בטמפרטורת החדר כפי שמוצג בטבלה 14, הכפלה במספר הנדרש של דגימות והוספת 10% נוספת.
| חרוז הבולם מיקס | אמצעי אחסון (μL) |
| מאגר היברידיזציה | 8.5 |
| משפר מאגר היברידיזציה | 2.7 |
| Nuclease-מים ללא תשלום | 5.8 |
| סה כ נפח | 17 |
שולחן 14: חרוז ההשעיה מיקס. רכיבי השילוב של חרוזים מיקס יש להרכיב ולערבב בטמפרטורת החדר בהתאם לאמצעי האחסון המוצגים.
16. הכן את חרוזי הStreptavidin
- חרוזים streptavidin בטמפרטורה החדר לפחות 30 דקות לפני השימוש. מערבבים את החרוזים ביסודיות על ידי vortexing עבור 15 s ו סדרת מחלקים 50 μl של חרוזים לכל לכידה לתוך שפופרת PCR ללא שכירות.
- הוסף 100 μL של מאגר שטיפת חרוזים של 1 x (מוכן בשלב 15.1) לכל צינור. פיפטה בעדינות למעלה ולמטה 10 פעמים כדי לערבב. מניחים את הצינור על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט.
- הסר והשמט את הסופרנטאנט הברור. להיזהר לא להפריע את החרוזים.
- בצע את הכביסה הבאה.
- הסר מארון תקשורת מגנטי. הוסף 100 μL של מאגר שטיפת חרוזים של 1x לכל צינור המכיל חרוזים, ולאחר מכן פיפטה למעלה ולמטה 10 פעמים כדי לערבב.
- מניחים את הצינור במתלה המגנטי, ומאפשר לחרוזים להפריד באופן מלא מהסופרנטאנט.
- הסר והשמט בזהירות את הסופרנטאנט הברור.
- חזור על שלב 16.4 פעם אחת עבור מספר כולל של שתי שטיפות.
- הסר מארון תקשורת מגנטי. הוסף 17 μL של שילוב חרוזים מחדש משלב 15.3 לכל צינור. פיפטה עולה ויורד מספר פעמים כדי לערבב ביסודיות. ודא כי חרוזים אינם תקועים לצידי הצינורות. במידת הצורך, בקצרה לסובב את הצינורות כדי לאסוף את החרוזים בתחתית.
17. אגד יעד הוכלא חרוזים Streptavidin
- לאחר 4 שעות הדגירה הכלאה הוא השלם, להסיר את הדגימות מן הציקלור התרמי ולהגדיר את הציקלונט תרמית כדי דגירה ב 65 ° c עם מכסה מחומם להגדיר 70 ° c.
- שימוש בפיפטה רב-ערוצית, העברת 17 μL של חרוזים הומוגניים במלואו לדגימות. מערבבים ביסודיות על ידי מלטף למעלה ולמטה 10 פעמים.
- אגד את ה-DNA לחרוזים על ידי הצבת את הצינורות לתוך הציקלור התרמי בעקבות התוכנית #10 (טבלה משלימה 2). במהלך הדגירה, להסיר בקצרה את צינורות הרצועה כל 10-12 דקות ומערבולת בעדינות עבור 3 s כדי להבטיח את החרוזים להישאר ההשעיה. לחלופין, תוכלו לערבב באמצעות ליטוף מספר פעמים. המשך מיד לשטיפת חרוזי Streptavidin (שלב 18).
18. לשטוף חרוזים Streptavidin כדי להסיר דנ א מאוגד
- השתמש במאגרי הכביסה של 1x משלב 15.2 ואחסן מאגרים מחוממים בציקלייר התרמי במהלך השטיפה.
- הוסף 100 μL מחמם 1x מאגר לשטוף 1 אל צינורות משלב 17.3. מערבבים ביסודיות על ידי מלטף למעלה ולמטה 10 פעמים. מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט.
- הפיפטה והשמט את הסופרנטאנט, המכיל דנ א לא מאוגד. הסר מארון תקשורת מגנטי.
- בצע את הכביסה הבאה 65 ° c.
- הוסף 150 μL של מאגר הכביסה הקפדני של 1x שחומם מראש.
- מערבבים ביסודיות על ידי ליטוף למעלה ולמטה לפחות 10 פעמים. להימנע בועות במהלך ליטוף. להיות בטוח חרוזים מושעה לחלוטין בכל הצינורות.
- מודקון בציקלונט התרמי ב 65 ° c עבור 5 דקות.
- מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט. הפיפטה והשמט את הסופרנטאנט, המכיל דנ א לא מאוגד. הסר מארון תקשורת מגנטי.
- חזור על שלב 18.4 עבור מספר כולל של שני שוטפים מחמירים.
- בצע את שטיפת טמפרטורת החדר הראשונה.
- הוסף 150 μL של טמפרטורת החדר 1x לשטוף מאגר 1.
- הפיפטה עולה ויורדת פי 10 עד 20. כדי להשהות את החרוזים לחלוטין
- חותם את הצינורות ואת הדגירה עבור 2 דקות, לסירוגין בין vortexing בעדינות עבור 30 s ומנוחה עבור 30 שניות. להיות בטוח חרוזים בכל הבארות להישאר מחדש לחלוטין בכל הצינורות במהלך הדגירה כולה.
- צנטריפוגה בקצרה את הצינורות.
- מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט. . פיפטה ותבטל את הסופרנטאנט
- סגרו את הצינורות. והצנטריפוגה בקצרה חזור לארון תקשורת מגנטית והשתמש בפיפטה 10 μl כדי להסיר מאגר כביסה שרידי.
- בצע את שטיפת הטמפרטורה בחדר השני.
- הוסף 150 μL של טמפרטורת החדר 1x לשטוף מאגר 2.
- הפיפטה עולה ויורדת פי 10 עד 20. כדי להשהות את החרוזים לחלוטין
- חותם את הצינורות ואת הדגירה עבור 2 דקות, לסירוגין בין vortexing בעדינות עבור 30 s ומנוחה עבור 30 שניות. להיות בטוח חרוזים בכל הבארות להישאר מחדש לחלוטין בכל הצינורות במהלך הדגירה כולה.
- צנטריפוגה בקצרה את הצינורות.
- להעביר את כל הנפח של חרוזים מושעה מחדש לשטוף מאגר 2 כדי לנקות את הצינורות PCR ללא החכירה נקי. חשוב: העברת החרוזים לצינורות טריים חשוב כדי למנוע זיהום מחוץ ליעד.
- מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט. . פיפטה ותבטל את הסופרנטאנט
- סגרו את הצינורות. והצנטריפוגה בקצרה חזור לארון תקשורת מגנטית והשתמש בפיפטה 10 μl כדי להסיר מאגר כביסה שרידי.
- בצע את שטיפת טמפרטורת החדר השלישי.
- הוסף 150 μL של טמפרטורת החדר 1x לשטוף מאגר 3.
- הפיפטה עולה ויורדת פי 10 עד 20. כדי להשהות את החרוזים לחלוטין
- חותם את הצינורות ואת הדגירה עבור 2 דקות, לסירוגין בין vortexing בעדינות עבור 30 s ומנוחה עבור 30 שניות. להיות בטוח חרוזים בכל הבארות להישאר מחדש לחלוטין בכל הצינורות במהלך הדגירה כולה.
- צנטריפוגה בקצרה את הצינורות.
- מניחים את הצינורות על מתלה מגנטי, המאפשר חרוזים להפריד באופן מלא מן הסופרנטאנט. . פיפטה ותבטל את הסופרנטאנט
- סגרו את הצינורות. והצנטריפוגה בקצרה חזור לארון תקשורת מגנטי והשתמש בפיפטה 10 μL כדי להסיר כל מאגר כביסה שרידי.
- להסיר מהמדף המגנטי ולהוסיף 20 μL של מים חינם של nuclease לחרוזים.
- פיפטה למעלה ולמטה 10 פעמים כדי להבטיח את כל החרוזים התקועים בצד של הצינורות הושעו מחדש.
- חשוב: אל תמחק את החרוזים. השתמש במלואו 20 μL של מחרוזות מושעה עם DNA שנתפסו בשלב 19.
19. ביצוע סופי, העשרה לאחר לכידת ה-PCR
- הכינו את המיקס הראשי של ה-PCR לאחר הלכידה בהתאם לטבלה הבאה, תוך הכפלה במספר הנדרש של דגימות והוספת 10% תוספת, לפי שולחן 15.
| רכיב מיקס מאסטר לאחר לכידת PCR | אמצעי אחסון (μL) |
| מיקס לאחר לכידת PCR | 25 |
| מיקס לאחר לכידת PCR | 1.25 |
| Nuclease-מים ללא תשלום | 3.75 |
| סה כ נפח | 30 |
טבלה 15: מיקס מאסטר לאחר לכידת PCR. רכיבי מיקס מאסטר לאחר לכידת PCR צריך להיות מורכב ומעורבב על הקרח לפי אמצעי האחסון המוצג.
- הוסף 30 μL של מיקס לאחר לכידת ה-PCR הראשי לכל מדגם עבור נפח התגובה הסופי של 50 μL. Mix ביסודיות על ידי ליטוף למעלה ולמטה 10 פעמים.
- הניחו את צינורות ה-PCR בציקלונט התרמי ובאמצעות התוכנית הבאה #11 (טבלה משלימה 2).
20. טיהור שלאחר לכידת שברי PCR
- אפשר חרוזי SPRI לחמם את טמפרטורת החדר לפחות 30 דקות לפני השימוש, ולאחר מכן מערבולת SPRI חרוזים עבור כ 30 s כדי להשעות מחדש.
- הוסף 75 μL של חרוזי השעיה מחדש לכל לכידה מועשרת ב-PCR (50 μL). מערבבים היטב על ידי ליטוף למעלה ולמטה לפחות 10 פעמים. החרוזים הstreptavidin לא יפריעו לטיהור חרוזים SPRI. דגירה של 5 דקות בטמפרטורת החדר.
- בקצרה לסובב את הצינורות במיקרוצנטריפוגה ומניחים את הצינורות על מתלה מגנטי כדי להפריד חרוזים מתוך הסופרנטאנט. לאחר הפתרון ברור, להסיר בזהירות ולמחוק את הסופרנטאנט. להיזהר לא להפריע את החרוזים, אשר מכילים דנ א.
- הוסף 180 μL של המוכן טרי 80% אתנול לצינור בזמן מתלה מגנטי. דגירה בטמפרטורת החדר עבור 30 s, ולאחר מכן בזהירות להסיר ולמחוק את הסופרנטאנט.
- חזור על שלב 20.4 פעם אחת עבור סך של 2 שטיפת שלבים.
- . להסיר לחלוטין את האתנול השיורי השאירו את השפופרת על המדף המגנטי והאוויר יבש 3 דקות עם המכסה פתוח, או עד יבש בעליל. . אל תייבש יותר מדי את החרוזים זה עלול לגרום להתאוששות נמוכה יותר של DNA.
- . תסיר את השפופרת מהמגנט Elute ה-DNA מן החרוזים על ידי הוספת 22 μL של 0.1 x TE מאגר. מערבבים היטב על ידי ליטוף למעלה ולמטה מספר פעמים. דגירה עבור 2 דקות בטמפרטורת החדר. הנח את השפופרת על המדף המגנטי עד שהפתרון יתבהר.
- הסר 20 μL של סופרנטאנט והעבר לצינור PCR נקי, שאינו מפריע להפרעה, שלא להפריע לחרוזים. זוהי נקודת עצירה אופציונלית בפרוטוקול, ייתכן שספריות יאוחסנו ב-20 ° c.
21. ספריית אימות ומכמת
- למדוד את הריכוז של הספרייה שנתפסו באמצעות פלואורומטר וערכת שיטת רגישות גבוהה.
- למדוד את אורך הקטע הממוצע של הספרייה שנתפסו באמצעות אלקטרופורזה דיגיטלית בשבב ה-DNA ולחשב את גודל הקטע הממוצע עבור כל ספריה באמצעות תוכנת המערכת. גודל הקטע הממוצע אמור להיות כ-250-400 bp (ראה תוצאות מייצגות, איור 6 ואיור 7). זוהי נקודת עצירה אופציונלית בפרוטוקול, ניתן לאחסן ספריות שהושלמו ב-20 ° c.
22. רצף על פלטפורמת רצף
- ברצף, לדלל ספריות 2 ננומטר ולעקוב אחר ההנחיות של היצרן לטעינת והפעלה ברצף. ספריות רצף לעומק מינימלי של 15,000,000 סוף בודד קריאות של לפחות 50 bp באורך.
23. ניתוח נתוני רצף כדי ליצור פרופילים חיסוניים ולגלות ביואריטים עם הפורטל הפריזמה, כלי אינפורמטיקה מבוססי ענן
- צור חשבון מנסרה על-ידי ביקור https://prism.cofactorgenomics.com/
- לאחר שהתחברת, לחץ על שלח פרוייקט חדש בסרגל הכלים העליון מכל עמוד בפריזמה כדי להעלות את קבצי הרצף של fastq שאינם מחוברים, או להעלות קבצים המאוחסנים בשטח בסיס עם החשבון של פריזמה.
- השלם את הטופס ' פרוייקט חדש ' כולל שם הפרוייקט ודוגמאות לפי קבוצה או מקבץ. הקבצה של דגימות, ואת שמות הקיבוץ המתאימים, נחוצים כדי ליצור את דוח גילוי ביוארקר. שים לב כי לפחות 3 דגימות לכל קבוצה נדרשות להפקת דוח גילוי ביוארקר. לחץ על לחצן ' הפעל יישום ' כדי לשלוח את הטופס; יופיע דף אישור אם יצליח.
- בעת הנכנסת, לחץ על ראה תוצאות בסרגל הכלים העליון או כל עמוד בפריזמה. הפריזמה מאפשרת למשתמש לראות את מעמדם של פרוייקטים שהוגשו ולהציג דוחות מדגם ובדיקת סמנים לכל פרוייקט. תהיה רשימת פרויקטים שהמשתמש יצר בפריזמה. הטבלה כוללת שלוש עמודות עבור המצב, השם ותאריך השליחה.
הערה: המצב של כל פרוייקט יכול להיות:
• "פועל", כאשר ניתוח הפרוייקט פועל כעת, או
• "הצלחה", היכן שניתוח הפרוייקט הושלם והדוחות זמינים. - אם פרוייקט סיים את הניתוח (מצוין על-ידי מצב "הצלחה"), הצג את דוחות לדוגמה בודדים ודוח גילוי ביוארקר. שים לב כי דוח גילוי ביוארקר יהיה זמין רק אם הפרוייקט כולל את המינימום הנדרש של שלוש דגימות לכל קבוצה.
- כדי לגשת לדוחות אלה, חזור לרשימת הפרוייקטים ולחץ על שם הפרוייקט. בדף פרוייקט זה, תהיה טבלה עם שורה עבור כל דוגמה בפרוייקט. לחץ על הקישור בכל שורה, תחת עמודת הדוח , כדי לגשת לדוח הפרטני של כל אחת מהדוגמאות. מיד מתחת לטבלה, לחץ על הקישור של דוח גילוי ביוארקר. אם לא מדובר בקישורים בדף זה, הפרוייקט לא השלים את הניתוח.
תוצאות
ישנם מספר מחסומים במהלך הפרוטוקול המאפשרים למשתמש להעריך את האיכות והכמות של חומרים שנוצרו. לאחר שלב 12 המתואר בפרוטוקול, מופק electropherogram כפי שמוצג באיור 3, נציג של ספריית טרום לכידה טיפוסית עבור מדגם RNA שלמים (RIN = 7.8).
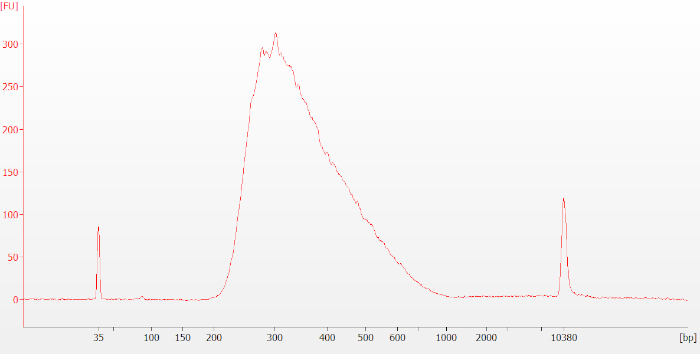
איור 3: מעקב אופייני של הספרייה טרום לכידת הספריה עבור דגימת RNA שלמה. ספריות טרום לכידה מופיעות כפסגה רחבה סביב 250-400 זוגות בסיס (bp) בגודל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הטיפול צריך להילקח כדי להימנע יתר על המידה, כפי שמצוין על ידי הפסגה השנייה סביב 1,000 bp המוצג באיור 4, הנציג electropherogram של ספריית טרום לכידה שנוצר מדגם ה-RNA ffpe (DV200 = 46). אם שיא זה קטן יחסית לפסגה הראשית (סביב 250-400 זוגות בסיס (bp), כפי שמוצג), הוא לא יפריע לצעדים או לניתוח במורד הזרם. אם הפסגה השנייה היא גדולה יחסית לשיא 250-400 bp, את הספרייה לפני הלכידה ניתן לעשות מחדש עם פחות מחזורי PCR כדי להפחית את הגברה.

איור 4: מעקב אופייני של הספרייה לפני הלכידה של הספריה עבור המדגם של ה-RNA FFPE. הפסגה השנייה סביב 1,000 bp מעיד על הגברה. אם השיא הזה קטן יחסית לשיא הראשי סביב 250-400 bp (כפי שמוצג), הוא לא יפריע לצעדים או לניתוח במורד הזרם. אם הפסגה השנייה היא גדולה יחסית לשיא 250-400 bp, את הספרייה לפני הלכידה ניתן לעשות מחדש עם פחות מחזורי PCR כדי להפחית את הגברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כפי שמתואר בשלב 12.1.3, יש להעריך את נוכחות דימרס המתאם כדי לקבוע אם יש צורך בניקוי נוסף. Electropherograms המוצגת באיור 5 הם מייצגים של לא מקובל (איור 5A, dv200 = 33) ומקובל (איור 5B, dv200 = 46) רמות של מתאם dimer, המופיעים כפסגה חדה סביב ה128 bp.
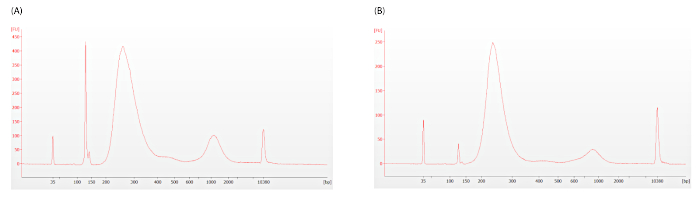
איור 5: מקדם לכידת ספריות ביולוגי עקבות. המתאם דיימר מופיע כשיא חדה סביב 128 bp. (a) דיימר מתאם מוגזם נמצאים ב electropherogram זה. (ב) רמות מתאם מקובלות של דיימר מתוארות בסימן זה. שני העקבות מראים עדויות של הגברה מתונה, אך אין להתערב בעניין השיטת הimmunoprism. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בסיום הפרוטוקול, לפני העריכה ברצף, הספריות הסופיות מוערכות שוב באמצעות אלקטרופורזה דיגיטלית. ספריות שנעשו מ-RNA FFPE נוטים להיות התפלגות קטנה יותר בגודל הממוצע מאשר ספריות שנעשו מ-RNA שלם. עבור דגימות RNA שלמות, העקבות שהתקבלו צריך להיראות דומה לאיור 6 (RIN = 9.5). עבור מושפל או FFPE RNA, העקבות המתקבלים צריך להיראות דומה לאיור 7 (DV200 = 36).
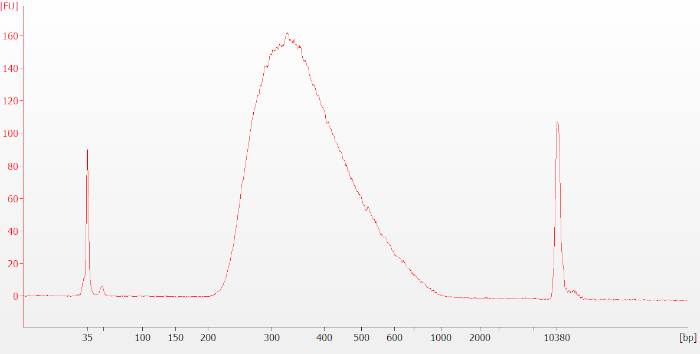
איור 6: מעקב אופייני של הספרייה הסופית ביומנתח עבור דגימת RNA שלמה. ספריות סופיות מופיעות כפסגה רחבה סביב 250-400 זוגות בסיס (bp) בגודל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
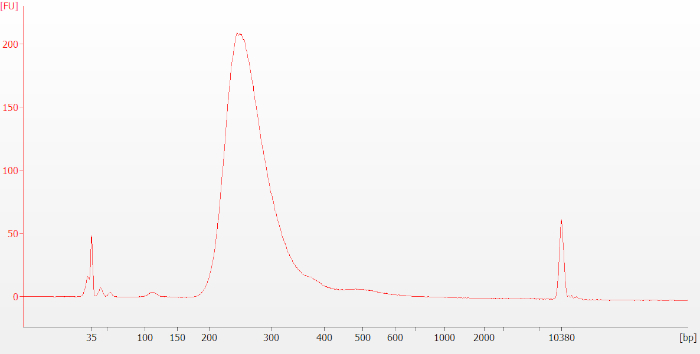
איור 7: המעקב הסופי של הספרייה הסופית בדיקת RNA של מדגם FFPE. ספריות שנעשו מ-RNA FFPE נוטים להיות התפלגות קטנה יותר בגודל הממוצע מאשר ספריות שנעשו מ-RNA שלם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כמתואר, התוצאות שנוצרו באמצעות פרוטוקול זה עשויות להיות מוחלות בשתי דרכים מרכזיות, בדומה למוצג באיור 8.

איור 8: שני מקרי שימוש בפרוטוקול. התוצאות שנוצרו על-ידי שיטת הפרופיל החיסונית מוחלות בשני יישומים מרכזיים. (א) מקרה השימוש הראשון מתחיל מרקמת הגידול האנושי מוצק (כולל ארכיון ffpe) ויוצר פרופיל החיסון היחיד עבור המדגם. (ב) שנוצר לאחר הקבוצה של דגימות אנושיות, הנתונים משולבים באמצעות הפורטל הפריזמה כדי ליצור סמנים רב ממדיים ודוח ביוארקר המקביל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי להדגים כל אחד ממקרי השימוש הללו, נתונים מייצגים ממחקר טרנסלאני קטן כלולים21. הדגימות המשמשות במחקר זה הם קבוצה של דגימות מ 7 חולים שאובחנו מטופלים עבור סרטן ריאות תאים לא קטנים (NSCLC). הדגימות הן החולה התאמה רקמות הגידול מוצק מ טרום ופוסט ביופסיות טיפול. ראשית, דגימות בודדות נותחו כדי ליצור פרופיל המערכת החיסונית, כגון דוח הדוגמה המוצג באיור 9.

איור 9: לדוגמה דוח החיסון הפרטני עבור דגימת NSCLC. קו הצינור פריזמה פורטל יוצר דוח גרפי עבור כל מדגם מעובד, עם דוח מייצג שנוצר עבור דגימת גידול מוצק NSCLC המוצג כאן. (א) הצד הקדמי של הדוח מתארבאופןגרפי את פירוק התאים החיסוניים נוכח במדגם RNA שחולצו מרקמת ffpe. (ב) הצד ההפוך של הדוח כולל טבלה של תאים חיסוניים (באחוזים מוחלטים) וביטוי הגנים הנמלטים (בתעתיקים למיליון, או TPM), כמו גם הצהרת ביצועים לצורך הקביעה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הפרופילים החיסונית טרום הטיפול ניתן להשתמש כדי להבין איך טיפול (כימותרפיה או קרינה, במחקר זה) שינה את הסביבה המיקרו הגידול. דוגמה מוצגת באיור 10, כאשר השינויים באחוזים עבור כל תא החיסון ואת התוכן החיסוני הכולל מוצגים טרום וכימותרפיה לאחר, עבור מטופל יחיד.

איור 10: תוצאות לפני ופוסט טיפול. תא החיסון בודדים ונתוני תוכן החיסון הכולל שנוצרו מראש ודגימות שלאחר הטיפול מחולה NSCLC יחיד מוצגים. בדוגמה זו, המטופל קיבל משטר כימותרפיה כטיפול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
חולים עשויים להיות מקובצים לפי קריטריונים כגון תוצאות קליניות או פנוטיפים להשוואה. לדוגמה, באיור 11, הדגימות במחקר NSCLC הושוו על פי הזמן להתקדמות המחלה בעקבות הטיפול. קבוצת משנה של המטופלים הראו הישנות המחלה ב > 18 חודשים, ועוד קבוצה התקדמה מהר יותר, ב ≤ 18 חודשים. ערך הדלתא החציוני (ההפרש בין ערכי טרום-הטיפול לאחר ולאחר הטיפולים) מושווה לכל דוגמה כדי לזהות ביואריטים של התקדמות המחלה.
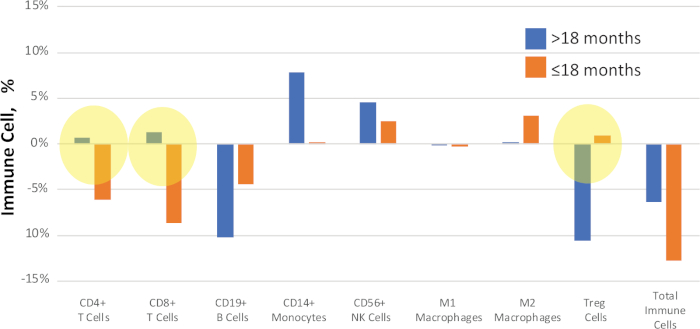
איור 11: לדוגמה תוצאות קליניות השוואה. שינויים כמותיים בין אחוזי התאים החיסוניים ב-NSCLC בהתאמה לאחר הטיפול ולאחר מכן חושבו ודווחו כערך "דלתא". אלה המסומנים בצהוב מראים שינויי אות ברורים בין מצב ההישרדות. פסים כחולים מייצגים ערכי דלתא חציון עבור > 18 חודשים עד התקדמות המחלה, פסים כתומים מייצגים ערכי דלתא חציון עבור ≤ 18 חודשים עד התקדמות המחלה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בסופו של דבר, קבוצות מדגם דומה עשוי לשמש כדי לחפש באופן ספציפי בדוגמאות טרום טיפול כדי לזהות בסמנים חזוי באמצעות הפורטל הפריזמה כדי ליצור דוח ביוארקר. המוצג באיור 12, אותו הפנוטיפ הקליני (התקדמות המחלה) כפי שמתואר לעיל מגדיר את הקיבוצים לדוגמה. בדוגמה זו, שני גנים בריחה החיסונית זוהו כחלק משמעותי מבחינה סטטיסטית של הקיבוצים לדוגמה (CD47 ו OX40, המוצג בלוח התחתון של איור 12א). בדוגמה זו, מכיוון שהסמנים הבודדים הגנים חזקים בעלי משמעות סטטיסטית ברורה, הסמנים הרב-ממדיים אינם מוסיפים ערך ניבוי משמעותי (ImmunoPrism, כפי שמסומן בתרשים הימני העליון של איור 12ב'). טבלת הנתונים המלאה, כולל תוצאות עבור כל 18 האנליטים עבור הטיפול, מסוכמת בצד ההפוך של הדוח, כולל ניתוח סטטיסטי וסיכום שיטות קצרות.
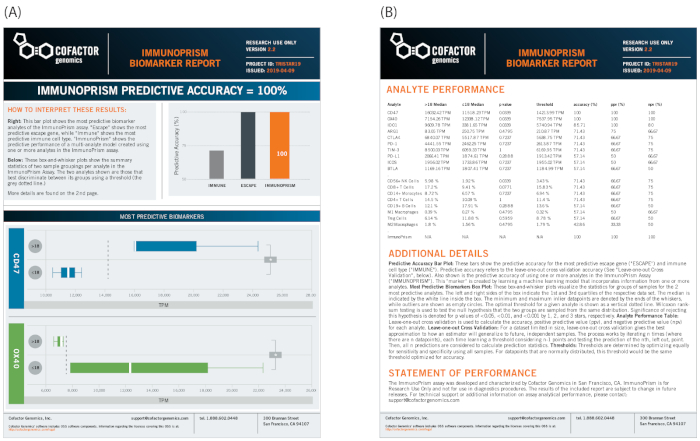
איור 12: לדוגמה דוח ביוארקר עבור דגימות NSCLC. קו ההברחה של דיסקברי ביורקר מספק דוח חזותי של סמנים בודדים, ומחשב ביואריקר רב-ממדי ללמידה, עם סטטיסטיקות מפורטות. (א) עבור מחקר זה, הצינור זיהה שני סמנים בודדים (CD47 ו OX40) מבחינה סטטיסטית-משמעותי להגדרת התקדמות המחלה עם סף של 18 חודשים. (ב) פרטים על פעולת השירות והתוצאות המלאות נכללים בצד ההפוך של הדוח. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה משלימה 1: ערכת חומרים מגיב. רשימה של חומרים המסופקים בערכת החיסונית מפורטת ברשימה, יחד עם מספרי החלקים שמפנים לפרוטוקול היצרן. כל הציוד והחומרים הנדרשים מפורטים ברשימת החומרים. בקר https://cofactorgenomics.com/product/immunoprism-kit/ עבור גליונות נתוני בטיחות (sds). אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
טבלה משלימה 2: תוכניות הציקלור תרמי. תוכניות הציקלer המומלצות שאליהן מפנה הפרוטוקול מסוכמות לנוחות התיכנות. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
טבלה משלימה 3: רצף מדריך אינדקס. האינדקס הראשי המופיע בערכה הכימית מפורטים ברשימה; פריימר ייחודי מתווסף לכל תגובה לאחר רצף deריבוב. שילובים מומלצים של מפלסים ברמה נמוכה מסופקים אף הם. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
Discussion
הפרוטוקול דורש 20 ng או 40 ng מאוד מושפל (FFPE) RNA. דוגמת ה-RNA צריכה להיות חופשית מ-DNA, מלחים (g., Mg2 +, או guanidinium מלחים), סוכני הקטיון בעלי כלים (למשל, EDTA, egta, ציטראט), או אורגניקס (למשל, פנול ו אתנול). לא מומלץ להמשיך עם דגימות RNA בעלי DV200 < 20%. השימוש ב-kit בקרת RNA מומלץ מאוד כמו אלה שולטת לספק אמצעים כדי להעריך את הביצועים ברחבי הפרוטוקול כולו, מתוך הכנת הספרייה לניתוח.
הפרוטוקול נועד להתבצע באמצעות צינורות הסטריפ 0.2 mL. אם המועדפת, ניתן לבצע את הפרוטוקול גם באמצעות הבארות בצלחת 96-PCR. פשוט להשתמש בבארות של הצלחת 96-היטב PCR במקום כל ההפניות צינורות PCR או צינורות רצועה. השתמש בלוחות PCR עם בארות ברורות בלבד, מכיוון שהוא קריטי לאישור חזותי של השעיה מלאה של חרוזים במהלך מטהר החרוזים ולשטוף את הצעדים.
במהלך הפרוטוקול, לשמור על ריאגנטים קפוא או על קרח אלא אם צוין אחרת. אין להשתמש ריאגנטים עד שהם מופשרים לחלוטין. הקפד לערבב ביסודיות את כל הריאגנטים לפני השימוש.
שמור על אנזימים ב-20 ° c עד שיהיה מוכן לשימוש וחזור ל-20 ° c מייד לאחר השימוש. השתמש במים ללא שכירות מולקולריים בלבד; לא מומלץ להשתמש במים שטופלו ב-DEPC. בעת ליטוף כדי לערבב, בעדינות מלטף ומוותר לפחות 50% של הנפח הכולל עד הפתרונות מעורבים היטב. פיפטה מערבב את כל. התערובות המכילות אנזימים שימוש במערבולת לערבב את האנזימים יכול להוביל לדנטורציה ולהתפשר על הביצועים שלהם. במהלך מטהרי חרוז, השימוש טרי עשה 80% האתנול פתרונות מאתנול כיתה מולקולרית. שימוש בפתרונות אתנול שאינם טריים עלולים לגרום לתשואות נמוכות. להימנע מייבוש את החרוזים, כמו זה יכול להפחית את יעילות הימנעות (חרוזים נראה סדוק אם מעל יבש).
כפי שמתואר בשלב 10, התחל האינדקס הייחודי מתווסף לכל תגובה. בהתאם לרצפים של מדדים אלה, עבור ריבוב ברמה נמוכה, שילובי אינדקס מסוימים הם אופטימליים. רצפי מדדים אלה נדרשים כדי לחלק את רצף הנתונים שלאחר העריכה. הרצפים ושילובי הריבוב המומלצים ניתנים בטבלה משלימה 3. באותו שלב, חשוב לציין כי מספר מחזורי ה-PCR המומלצים משתנה בהתאם לאיכות ה-RNA שבשימוש, ומיטוב מסוים עשוי להידרש כדי למנוע הגברה מרבית של ה-PCR. עבור האימונוopsm שליטה ללא שינוי RNA ואחרים RNA באיכות גבוהה, להתחיל אופטימיזציה עם 10 מחזורי PCR. עבור שליטה מרבית של rna ושאר RNA מאוד מושפל/FFPE, התחל במיטוב עם 15 מחזורי PCR. הפקת ספריית בדיקות באמצעות הנציג RNA של החומר כדי להיות מנותח על מנת לייעל מחזורי PCR מומלץ. יש להשתמש במספר המינימלי של מחזורי ה-PCR המובילים בעקביות את תשואות הספרייה לפני לכידה מספיקות (> 200 ng). שיא משני סביב 1000 bp על המעקב Bioanalyzer מעיד על הגברה מעל (איור 4). יש למזער את הגברה הרבה יותר, אך הנוכחות של שיא משני קטן לא תפריע לתוצאות התידקות.
כדי למזער את ההפסד לדוגמה ולהימנע מהחלפת צינורות, שלב 13 ניתן לבצע ב-PCR צינורות, שפופרות רצועה, או צלחת 96-היטב PCR במקום 1.5 mL מיקרו צינורות, אם מרכז ואקום שלך מאפשר. ניתן להסיר את הרוטור על ריכוז רבים. זה מאפשר את צינורות הרצועה או לוחות כדי להתאים את הוואקום. ריכוז ואקום ניתן להפעיל באמצעות הגדרת התייבשות מימית ללא צנטריפוגה. עיין במדריך עבור מרכז הואקום לקבלת הוראות. אם הדגימות מיובשות בצינורות חשפנות או בצלחת 96-באר, ניתן לבצע את שלב ההכלאה באותו כלי.
במהלך שלב 17, להיות בטוח מערבולת כל 10-12 דקות כדי להגדיל את היעילות לכידת חרוז. בזהירות להחזיק את כובעים של צינורות הרצועה חם כאשר ערבוב כדי למנוע את הפתיחה של צינורות.
שוטף המתואר בשלב 18 הם קריטיים כדי למנוע זיהום גבוה לא ספציפי ויש לעקוב מקרוב. יש להקפיד להשהות מחדש את החרוזים בכל כביסה, להסיר לחלוטין את מאגרי הכביסה, ובמהלך שטיפת מאגר הכביסה 2, העבירו את הדגימות לצינור חשפנות טרי (Step 18.6.5). ודא כי החרוזים streptavidin לחלוטין מושעה ולהישאר ההשעיה במהלך הדגירה כולה. התזת על כובעי הצינור לא תשפיע לרעה על הלכידה. במהלך שטיפת הטמפרטורה בחדר, מערבל מערבולת מיקרופלייט עשוי לשמש למערבולת הדגימות עבור כולו של תקופת דגירה של שתי דקות עבור השעיה קלה יותר. אל תתנו חרוזים streptavidin להתייבש. במידת הצורך, הרחב את incubations במאגרים כדי להימנע מייבוש החרוזים. אם באמצעות יותר מצינור רצועה אחד, לעבוד עם שפופרת רצועה אחת בכל פעם עבור כל כביסה בעוד צינורות הרצועה האחרים לשבת התרמוטרטרנר. זה יכול לעזור להימנע מייבוש החרוזים או ממהרים, וכתוצאה מכך מושהה עני או טכניקות משנה אופטימלית אחרות. עבור משתמשים בפעם הראשונה, לא מומלץ לעבד יותר מ-8 תגובות ספריה בכל פעם.
שיטות נוכחיות לפרופיל המערכת החיסונית מספקים רצף של מידע-מאלפי נקודות נתונים הדורשות פרשנות משמעותית (רצפי RNA) לנקודת נתונים אינדיווידואלית, בודדת-plex. הפרוטוקול המתואר כאן מייצג גישה שנמצאת באמצע, עם היקף ממוקד המאפשר רגישות גבוהה, אך לוכד רק תת מערכת של נתונים רלוונטיים הטרנססקריפט. בשל הטבע של חילוץ בצובר RNA, פרוטוקול זה אינו מספק מידע על היחסים המרחבית בין תאים חיסוניים לבין מיקרוסביבה הגידול, עם זאת, תוצאות עשויות להיות השלימה עם טכנולוגיות הדמיה כדי להוסיף מידע זה. ישנם מספר רב של יישומים עבור הנתונים שנוצרו על ידי פרוטוקול זה, כפי שיש הרבה ללמוד על ביולוגיה של סרטן כמחלה, ואת הטיפולים שפותחו כדי לטפל בו. כפי שמוצג בתוצאות הנציג, דו ח החיסון הפרטני שימושי להבנת האופן שבו הפרופיל החיסוני של המטופל עשוי להשתנות בתגובה לאירועים כגון התקדמות או טיפול במחלות. בעוד התוצאות המוצגות כאן לספק כמה מקרים להשתמש למשל, יישומים אחרים כולל חקירת מנגנון הפעולה של טיפול וזיהוי בסמנים ביוטיבית של תוצאות קליניות כגון התקדמות חינם הישרדות כוללת גם מעשי. בעת שימוש בפרוטוקול זה ליישומי גילוי ביוגניים, חשוב לתרגל עיצוב לימוד טוב כדי להבטיח אוכלוסיות הומוגניים, מספיק דגימות כלולות בכוח סטטיסטי, ומקורות הטיה נחשבים. בשל אופיו הממוקד והיעיל של הטיפול, ניתן לדמיין דרך לקראת אימות קליני ויישום במורד הזרם של הסמנים הללו התגלו פעם.
Disclosures
כל המחברים מועסקים על ידי קופקטור גנומיקה, Inc., החברה שפיתחה ומייצרת את הציוד המגיב הimmunoprism והכלים המשמשים במאמר זה. המלון מיועד לשימוש מחקרי בלבד, ואינו מיועד לשימוש בהליכי אבחון.
Acknowledgements
המחברים מעוניינים להכיר בקבוצת הטכנולוגיה TriStar למתן את הדגימות הביולוגי לתוצאות הנציגים, כמו גם את מולקולרית, ניתוח, מוצר, צוותי מסחרי ב קופקטור גנומיקה עבור המומחיות הטכנית שלהם תמיכה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR 8 tube strip | USA Scientific | 1402-2700 | USA Scientific 0.2 mL PCR 8-tube strip |
| 200 Proof Ethanol | MilliporeSigma | EX0276-1 | Prepare 80% by mixing with nuclease-free water on the day of the experiment |
| 96-well thermal cyclers | BioRad | 1861096 | |
| Solid-phase Reversible Immobilization (SPRI) Beads | Beckman-Coulter | A63882 | Agencourt AMPure XP – PCR Purification beads |
| Digital electrophoresis chips and kit | Agilent Technologies | 5067-4626 | Agilent High Sensitivity DNA chips and kit |
| Digital electrophoresis system | Agilent Technologies | G2939AA | Agilent 2100 Electrophoresis Bioanalyzer |
| Streptavidin Beads | ThermoFisher Scientific | 65306 | Dynabeads M-270 Streptavidin |
| ImmunoPrism Kit – 24 reaction | Cofactor Genomics | CFGK-302 | Cofactor ImmunoPrism Immune Profiling Kit – 24 reactions |
| Human Cot-1 DNA | ThermoFisher Scientific | 15279011 | Invitrogen brand |
| Magnetic separation rack | Alpaqua/Invitrogen | A001322/12331D | 96-well Magnetic Ring Stand |
| Microcentrifuge | Eppendorf | 22620701 | |
| Microcentrifuge tubes | USA Scientific | 1415-2600 | USA Scientific 1.5 mL low-adhesion microcentrifuge tube |
| NextSeq550 | Illumina | SY-415-1002 | Any Illumina sequencer may be used for this protocol |
| Nuclease-free water | ThermoFisher Scientific | AM9937 | |
| Prism Extraction Kit | Cofactor Genomics | CFGK-401 | Cofactor Prism FFPE Extraction Kit – 24 samples |
| Purified RNA | - | - | Purified from human tissue samples |
| Fluorometer | ThermoFisher Scientific | Q33226 | Qubit 4 System |
| Fluorometric Assay Tubes | Axygen | PCR-05-C | 0.5mL Thin Wall PCR Tubes with Flat Caps |
| High Sensitivity Fluorometric Reagent Kit | Life Technologies | Q32854 | Qubit dsDNA HS Assay Kit |
| Vacuum concentrator | Eppendorf | 22820001 | VacufugePlus |
| Vortex mixer | VWR | 10153-838 | |
| Water bath or heating block | VWR/USA Scientific | NA/2510-1102 | VWR water bath/USA Scientific heating block |
References
- Brambilla, E., et al. Prognostic Effect of Tumor Lymphocytic Infiltration in Resectable Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. 34 (11), 1223-1230 (2016).
- Iacono, D., et al. Tumour-infiltrating lymphocytes, programmed death ligand 1 and cyclooxygenase-2 expression in skin melanoma of elderly patients: clinicopathological correlations. Melanoma Research. 28 (6), 547-554 (2018).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nature Reviews Clinical Oncology. 14 (12), 717-734 (2017).
- Sierant, M. C., Choi, J. Single-Cell Sequencing in Cancer: Recent Applications to Immunogenomics and Multi-omics Tools. Genomics Inform. 16, (2018).
- Klauschen, F., et al. Scoring of tumor-infiltrating lymphocytes: From visual estimation to machine learning. Seminars in Cancer Biology. 52 (Pt 2), 151-157 (2018).
- Danaher, P., et al. Gene expression markers of Tumor Infiltrating Leukocytes. Journal for ImmunoTherapy of Cancer. 5, 18 (2017).
- Aran, D., Hu, Z., Butte, A. J. xCell: digitally portraying the tissue cellular heterogeneity landscape. Genome Biology. 18 (1), 220 (2017).
- Newman, A. M., et al. Robust enumeration of cell subsets from tissue expression profiles. Nature Methods. 12 (5), 453-457 (2015).
- Becht, E., et al. Estimating the population abundance of tissue-infiltrating immune and stromal cell populations using gene expression. Genome Biology. 17 (1), 218 (2016).
- Newman, A. M., Gentles, A. J., Liu, C. L., Diehn, M., Alizadeh, A. A. Data normalization considerations for digital tumor dissection. Genome Biology. 18 (1), 128 (2017).
- Chen, S. H., et al. A gene profiling deconvolution approach to estimating immune cell composition from complex tissues. BMC Bioinformatics. 19 (Suppl 4), 154 (2018).
- Yoshihara, K., et al. Inferring tumour purity and stromal and immune cell admixture from expression data. Nature Communications. 4, 2612 (2013).
- Foley, J. W., et al. Gene-expression profiling of single cells from archival tissue with laser-capture microdissection and Smart-3SEQ. Genome Research. , (2019).
- Civita, P., et al. Laser Capture Microdissection and RNA-Seq Analysis: High Sensitivity Approaches to Explain Histopathological Heterogeneity in Human Glioblastoma FFPE Archived Tissues. Front Oncol. 9, 482 (2019).
- . PD-L1 in cancer: ESMO Biomarker Factsheet | OncologyPRO Available from: https://oncologypro.esmo.org/Education-Library/Factsheets-on-Biomarkers/PD-L1-in-Cancer (2019)
- Haslam, A., Prasad, V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Network Open. 2 (5), e192535 (2019).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews Immunology. 12 (3), 191-200 (2012).
- Schillebeeckx, I., et al. Analytical Performance of an Immunoprofiling Assay Based on RNA Models. Association for Molecular Pathology 2019 Annual Meeting. Journal of Molecular Diagnostics. 21, (2019).
- Uryvaev, A., Passhak, M., Hershkovits, D., Sabo, E., Bar-Sela, G. The role of tumor-infiltrating lymphocytes (TILs) as a predictive biomarker of response to anti-PD1 therapy in patients with metastatic non-small cell lung cancer or metastatic melanoma. Medical Oncology. 35 (3), 25 (2018).
- Wang, K., Shen, T., Siegal, G. P., Wei, S. The CD4/CD8 ratio of tumor-infiltrating lymphocytes at the tumor-host interface has prognostic value in triple-negative breast cancer. Human Pathology. 69, 110-117 (2017).
- Carney, W. P., Bhagat, M., LaFranzo, N. Multidimensional gene expression models for characterizing response and metastasis in solid tumor samples [abstract]. American Association for Cancer Research Annual Meeting. Cancer Research. 79 (13 Suppl), (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved