Method Article
고형 종양의 예측 면역 모델링
요약
고형 종양 조직의 정량적 면역 프로파일을 결정하고 면역 종양학 바이오마커 발견을 위한 임상 코호트를 활용하는 RNA 기반 접근법의 사용은 분자 및 정보학 프로토콜을 통해 설명된다.
초록
면역 요법은 종양학 환자의 치료에 대한 약속을 보여주지만 종양 미세 환경의 복잡한 이질성은 치료 반응을 예측하는 데 어려움을 줍니다. 종양 조직 안팎에 존재하는 면역 세포의 상대적 집단을 해결하는 능력은 반응을 이해하는 데 임상적으로 관련이 있는 것으로 나타났지만 유세포분석 및 면역조직화학과 같은 전통적인 기술에 의해 제한된다. IHC), 필요한 많은 양의 조직, 정확한 세포 유형 마커의 부족, 및 많은 기술적 및 물류 적 장애물로 인해. 한 분석실험(예를 들어, 면역프리즘 면역 프로파일링 분석)은 임상적으로 보관된 고형 종양 조직에서 추출된 RNA의 소량RNA 및 고분해된 RNA를 모두 수용함으로써 이러한 과제를 극복한다. 이 분석법은 일루미나 시퀀싱 플랫폼을 위한 종단 간 정량적, 고처리량 면역 프로파일링 솔루션을 제공하는 시약 키트 및 클라우드 기반 정보학을 통해 액세스됩니다. 연구원은 포르말린 고정 파라핀 내장 (FFPE) 조직 또는 총 RNA의 20-40 ng (샘플 품질에 따라 다름)의 2개의 단면도로 시작하고, 프로토콜은 8개의 면역 세포 모형 및 10개의 면역 성이 있는 탈출을 정량화하는 면역 성 단 면도 보고서를 생성합니다 종양 미세 환경의 완전한 전망을 캡처합니다. 결과 데이터를 사용하기 위해 추가적인 생물정보학적 분석이 필요하지 않습니다. 적절한 샘플 코호트와 함께, 프로토콜은 또한 관심있는 환자 집단 내에서 통계적으로 유의한 바이오마커를 식별하는데 사용될 수 있다.
서문
종양-침윤 림프구(TILs) 및 포르말린-고정 및 파라핀 임베디드(FFPE) 고형 종양 인간 조직 샘플에서 다른 면역 관련 분자의 정량화는 임상 연구1,2,3에서가치를 입증하였다. 유세포 분석 및 단세포 리보핵산(RNA) 시퀀싱과 같은 일반적인 기술은 신선한 조직 및 혈액4에유용하지만, 생존 가능한 세포 현탁액을 생성할 수 없기 때문에 FFPE 물질의 분석에 적합하지 않습니다. FFPE 조직에서 이러한 세포를 정량화하는 데 사용 된 현재의 방법은 주요 도전으로 고통. 면역항암화학(IHC) 및 기타 유사한 이미징 워크플로우에는 세포 표면 단백질을 검출하기 위한 특정 항체가 필요하며, 이는 재현 가능한 정량화를 가능하게 하기 위해 실험실 전체에서 표준화하기 어려울 수 있습니다5. nCounter 시스템과 같은 플랫폼은 단일 유전자의 발현에 의존하여 주요 면역 세포6을정의하여 검출의 민감성과 특이성을 제한합니다. 독립 형 소프트웨어 도구와 결합 된 보다 일반적인 RNA 시퀀싱 방법은 사용할 수있지만7,8,9,10,11,12를사용하기 전에 상당한 최적화 및 유효성 검사가 필요합니다. FFPE 조직을 위한 RNA 시퀀싱과 레이저 포획 미세 해부 (LCM)를 결합하는 최근 발전은 약속을 보여주었습니다; 그러나, 더 높은 처리량, 턴키 솔루션은 강력한 바이오 마커를 식별하기위한 번역 연구에 필요합니다13,14. 예측 면역 모델링과 같은 다차원 바이오마커를 생성하는 방법은, 치료 응답자, 암 아류형, 또는 높은 예측 정확도 및 통계적 유의성을 갖는 생존 결과를 포함하는 환자 집단을 정의하는 정밀 의학 및 면역 요법의 시대에 점점 더 중요해지고 있다15,16.
이러한 필요성을 해결하기 위해 표준화된 RNA 시퀀싱 시약 및 클라우드 기반 정보학을 사용하여 고형 종양 FFPE 조직에서 면역 세포의 민감하고 구체적인 정량화를 가능하게 하는 면역 프로파일링 분석이 개발되었습니다. FFPE 조직에서 분해 된 RNA를 수용하는 것 외에도, 프로토콜은 코어 바늘 생검, 바늘 흡인, 및 마이크로 또는 매크로 해부 조직과 같은 조직 샘플을 제한에서 파생 된 RNA를 수용 할 수 있습니다. 각 견본에서 RNA 데이터는 면역 성이 있는 건강 발현 모형에게 불린 면역 세포의 유전자 발현 모형의 데이타베이스와 비교되고, 견본에 존재하는 총 세포의 백분율로 면역 세포를 정량화하기 위하여. 간략하게, 이들 모델은 정제된 면역 세포 집단(정식 세포 표면 마커를 사용하여 격리)으로부터 생성된 전체 전사체 데이터로부터 고유한 다원성 발현 패턴을 식별하기 위해 기계 학습 방법을 사용하여 구축되었다17,18. 이 기술의 근간이 되는 다차원 건강 발현 모델은 이종 혼합물에 존재하는 총 세포의 백분율로 각 면역 세포를 정량화하는 분석을 가능하게 합니다. 이것은 연구원이 임상 가치19,20가있기 위하여 보인 상호 샘플 면역 세포 비교를 생성하는 가능하게 합니다. 다른 응용은 대표적인 결과에 기재된 바와 같이 면역 반응 전과 후의 정량화를 포함한다. 분석 보고서는 8개의 면역 세포 유형(유전자 발현 모델에서 파생됨)의 절대 백분율을 포함하여 종양 및 종양 미세 환경의 면역 적 구성의 다중 특징에 대해 보고합니다: CD4+ T 세포, CD8+ T 세포, CD56+ 자연 킬러 세포, CD19+ B 세포, CD14+ 단핵구, Tregs, M1 대식세포 및 M2 대식세포. 또한, 분석은 PD-1, PD-L1, CTLA4, OX40, TIM-3, BTLA, ICOS, CD47, IDO1 및 ARG1: 10개의 면역 탈출 유전자의 발현(백만 체당 또는 TPM)을 보고한다.
시약 키트는 그림 1과같이 하이브리드 캡처 기반 라이브러리 준비 방법에 따라 Illumina 플랫폼에서 시퀀싱할 수 있는 고품질 라이브러리를 만드는 데 사용됩니다. 연구원이 실험실에 Illumina 시퀀싱 플랫폼이 없는 경우 시퀀싱을 위해 샘플을 핵심 실험실에 제출할 수 있습니다. 일단 생성되면, 시퀀싱 데이터는 자동화된 분석을 위해 프리즘 포털에 업로드되고, 각 개별 샘플에 대한 포괄적인 정량적 프로파일은 면역보고서(그림 2A)의형태로 사용자에게 반환된다. 사용자는 또한 프리즘 포털에서 샘플 그룹화를 정의하여 바이오마커보고서(그림 2B)를생성하여 두 환자 집단을 구별하는 통계적으로 유의한 바이오마커를 강조할 수 있다. 중요한 것은, 시약 키트에 의해 생성된 데이터는 연구용으로만 사용되며 진단 목적으로 사용될 수 없다는 것이다.

그림 1: 워크플로개요. 이 프로토콜에서 RNA는 먼저 cDNA로 변환됩니다. 시퀀싱 어댑터는 결찰되고, 어댑터-리그형 cDNA는 PCR에 의해 증폭되고 바코드화되어 사전 캡처 라이브러리를 생성합니다. 생물체화된 프로브는 그 때 스트렙타비딘 구슬을 사용하여 포획되는 특정 cDNA 표적에 혼성화됩니다. 언바운드, 비표적 cDNA는 세척에 의해 제거됩니다. 최종 PCR 보강은 시퀀싱을 위한 포스트 캡처 라이브러리를 생성합니다. *총 RNA는 인간 샘플에서 나온 것이어야 합니다. 손상되지 않거나 저하될 수 있습니다(FFPE) RNA. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 대표적인 면역 보고서. 워크플로우에서는 처리된 각 샘플에 대해 2개의 보고, 개별 면역보고서(A)및 정의된 환자 집단에 대한 바이오마커보고서(B)를생성합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 프로토콜은 약 16시간의 준비 시간이 필요합니다(총 RNA에서 시퀀싱준비가 된 라이브러리까지); 그러나 프로토콜에 설명된 대로 선택적 중지 지점이 많이 있습니다. 이 분석실험은 전사체의 풍부하고 역동적인 특성을 활용하여 기존의 단일 분석물 바이오마커를 넘어 다차원 유전자 발현 모델로 이동하여 표준화된 조직 샘플의 포괄적인 생물학적 특성화를 가능하게 합니다. 시약 및 사용하기 쉬운 소프트웨어 도구. 이를 통해 연구원들은 기계 학습과 건강 표현 모델 데이터베이스를 활용하여 귀중한 임상 샘플의 보다 정확하고 정량적인 면역 프로필을 도출하고 발견함으로써 자신의 실험실에서 현대 기술을 활용할 수 있습니다. 전체 통계 분석을 갖춘 다차원 RNA 바이오마커.
프로토콜
여기에 표시된 대표 결과에 활용 된 인간 조직 샘플은 평판 좋은 법인 (TriStar 기술 그룹)에서 구입하고 학술 및 상업 연구를 허용하는 기증자 동의뿐만 아니라 유능한 윤리의 승인을 통보했다 위원회.
파트 1: 사전 캡처 라이브러리 준비
1. RNA 정량화 및 자격
- 형광 분석법을 사용하여 RNA를 정량화하여 분석에 대한 적절한 입력을 결정합니다. 전기 영동을 사용하여 입력 RNA의 품질을 평가하여 RNA 무결성 번호(RIN) 및 단편 >200 뉴클레오티드(DV200)값의 백분율을 결정합니다.
- 손상되지 않은 경우(RIN > 7) 또는 부분적으로 분해된 RNA 샘플(RIN = 2 ~7)은 2.1단계로 시작하여 고품질/손상되지 않은 RNA에 대한 라이브러리 준비 단계를 따릅니다. RNA의 품질은 열 사이클러 프로그램 #1 올바른 단편화 시간을 선택하는 데중요합니다(보충 표 2).
- 분해가 심한 샘플(예: RIN = 1 ~ 2 또는 FFPE)의 경우 DV200 값을 결정합니다. 이 견본은 단편화를 요구하지 않으며 단계 2.2로 시작하는 분해된 RNA를 위한 명령을 따를 것입니다.
- RNA 20 ng (RIN > 2를 가진 고품질 /손상되지 않은 RNA) 또는 RNA 40 ng (DV200 > 20 %의 분해 / FFPE RNA)를 희석하여 각 샘플에 대한 적절한 양의 총 RNA를 준비하십시오. 5 μL을 뉴클레아제 없는 물에 담가. DV200 < 20%의 샘플 처리는 권장되지 않습니다. 키트와 함께 제공되는 대조군 RNA 샘플의 경우, 뉴클레아제 없는 물 4 μL에서 적절한 RNA의 1 μL을 희석한다. 대조군 샘플은 표지된 바와 같이 고품질(Intact) 또는 저하(FFPE) RNA 물질에 대해 설명된 것과 동일한 처리를 따를 것이다. 키트에 포함된 모든 시약에 대한 보충 표 1을 참조하십시오.
2. RNA 조각화 및 프라이밍
- RIN > 2를 가진 고품질/손상되지 않은 RNA를 위한 단계 2.1.1를 따르십시오.
- 고품질 RNA의 경우 표 1에따라 얼음에 대한 단편화 및 프라이밍 반응을 뉴클레아제 없는 PCR 튜브에 조립합니다.
- 위아래로 여러 번 파이펫팅하여 철저히 섞으세요. 그런 다음 미세 원심 분리기에서 샘플을 간단히 회전시
참고: 프로토콜의 모든 원심분리기 스핀의 경우 최소 3초 동안 ≥ 1,000 x g의 속도를 권장합니다. - 샘플을 열 사이클러에 놓고 프로그램 #1사용합니다(보충 표 2).
- 즉시 튜브를 얼음으로 옮기고 고품질 RNA를 위한 첫 번째 스트랜드 cDNA 합성을 진행합니다(3.1단계). 고품질 및 FFPE RNA의 동시 제제를 위해, 단편화 배양 동안 FFPE RNA(Step 2.2)의 준비를 시작한다.
- 위아래로 여러 번 파이펫팅하여 철저히 섞으세요. 그런 다음 미세 원심 분리기에서 샘플을 간단히 회전시
- 고품질 RNA의 경우 표 1에따라 얼음에 대한 단편화 및 프라이밍 반응을 뉴클레아제 없는 PCR 튜브에 조립합니다.
| 조각화 및 프라이밍 믹스 | 볼륨(μl) |
| 손상되지 않거나 부분적으로 분해된 RNA (20 ng) | 5 |
| 첫 번째 가닥 합성 반응 버퍼 | 4 |
| 랜덤 프라이머 | 1 |
| 총 볼륨 | 10 |
표 1: 고품질 RNA에 대한 단편화 및 프라이밍 반응. 고품질 RNA에 대한 단편화 및 프라이밍 반응의 성분은 도시된 부적에 따라 얼음상에서 조립 및 혼합되어야 한다. 제1 스트랜드 합성 반응 버퍼 및 랜덤 프라이머의 마스터 믹스를 만들어 RNA 샘플에 첨가할 수 있습니다.
- DV 200 >20%를 가진 저하/FFPE RNA를 위한 단계 2.2.1를 따르십시오.
- 단편화를 필요로 하지 않는 고분해(FFPE) RNA의 경우, 표 2에설명된 바와 같이 프라이밍 반응을 조립한다. 손상되지 않은 RNA의 경우 2.1 단계를 따르십시오.
- 위아래로 여러 번 파이펫팅하여 철저히 섞으세요. 그런 다음 미세 원심 분리기에서 샘플을 간단히 회전시다.
- 샘플을 열 사이클러에 놓고 프로그램 #2사용합니다(보충 표 2).
- 튜브를 얼음으로 옮기고 고분해(FFPE) RNA(Step 3.2)를 위한 첫 번째 스트랜드 cDNA 합성으로 진행합니다.
- 단편화를 필요로 하지 않는 고분해(FFPE) RNA의 경우, 표 2에설명된 바와 같이 프라이밍 반응을 조립한다. 손상되지 않은 RNA의 경우 2.1 단계를 따르십시오.
| 프라이밍 반응 | 볼륨(μl) |
| FFPE RNA (40 ng) | 5 |
| 랜덤 프라이머 | 1 |
| 총 볼륨 | 6 |
표 2: 고분해된 RNA에 대한 무작위 프라이밍 반응. 고분해된 RNA에 대한 프라이밍 반응의 성분은 뉴클레아제 없는 PCR 튜브에 얼음상에 조립되어야 한다.
3. 첫 번째 가닥 cDNA 합성
- RIN > 2를 가진 고품질/손상되지 않은 RNA를 위한 단계 3.1.1을 따르십시오.
- 그대로 RNA (고품질)의 경우 표 3에따라 뉴클레아제없는 PCR 튜브에 얼음에 대한 첫 번째 가닥 합성 반응을 조립합니다.
- 얼음에 반응을 유지, 철저하게 위아래로 여러 번 파이펫팅하여 혼합. 미세 원심 분리기에서 샘플을 간단히 스핀다운하고 첫 번째 가닥 합성 인큐베이션으로 직접 진행합니다(4단계).
- 그대로 RNA (고품질)의 경우 표 3에따라 뉴클레아제없는 PCR 튜브에 얼음에 대한 첫 번째 가닥 합성 반응을 조립합니다.
| 첫 번째 가닥 합성 | 볼륨(μl) |
| 단편화 및 프라이밍 RNA (2.1.3 단계) | 10 |
| 첫 번째 가닥 합성 특이성 시약 | 8 |
| 퍼스트 스트랜드 합성 효소 믹스 | 2 |
| 총 볼륨 | 20 |
표 3: 고품질 RNA에 대한 첫 번째 가닥 합성 반응. 고품질 RNA에 대한 단편화 및 프라이밍 반응의 성분은 주어진 부량에 따라 얼음상에서 조립 및 혼합되어야 한다. 제1 스트랜드 합성 특이성 시약 및 제1 스트랜드 합성 효소 믹스의 마스터 믹스를 조각화및 프라이밍RNA 샘플에 첨가할 수 있습니다.
- DV 200 >20%를 가진 저하/FFPE RNA를 위한 단계 3.2.1를 따르십시오.
- 고분해된 RNA(FFPE)의 경우 표 4에따라 얼음에 대한 첫 번째 가닥 합성 반응을 뉴클레아제 없는 PCR 튜브에 조립합니다.
- 얼음에 반응을 유지, 철저하게 위아래로 여러 번 파이펫팅하여 혼합. 미세 원심 분리기에서 샘플을 간단히 스핀다운하고 첫 번째 가닥 합성 인큐베이션으로 직접 진행합니다(4단계).
- 고분해된 RNA(FFPE)의 경우 표 4에따라 얼음에 대한 첫 번째 가닥 합성 반응을 뉴클레아제 없는 PCR 튜브에 조립합니다.
| 첫 번째 가닥 합성 | 볼륨(μl) |
| 프라이밍 RNA (2.2.3 단계) | 6 |
| 첫 번째 가닥 합성 반응 버퍼 | 4 |
| 첫 번째 가닥 특이성 시약 | 8 |
| 퍼스트 스트랜드 합성 효소 믹스 | 2 |
| 총 볼륨 | 20 |
표 4: 고분해된 RNA에 대한 제1 가닥 합성 반응. 고분해된 RNA에 대한 단편화 및 프라이밍 반응의 성분은 도시된 부적에 따라 얼음상에서 조립 및 혼합되어야 한다. 첫 번째 가닥 합성 반응 버퍼, 첫 번째 가닥 합성 특이성 시약 및 첫 번째 가닥 합성 효소 믹스의 마스터 믹스가 만들어지고 프라이밍 RNA 샘플에 첨가 될 수 있습니다.
4. 첫 번째 가닥 합성 배양
- 튜브를 얼음 위에 놓고, 여러 번 파이펫팅하여 철저히 섞어 줍니다. 미세 원심 분리기에서 샘플을 간단히 회전시다. 프로그램 #3(보충 표 2)에따라 예열 된 열 사이클러에서 샘플을 인큐베이션합니다.
5. 두 번째 가닥 cDNA 합성
- 제4.1단계에서 제1 가닥 반응 생성물 등 표 5에열거된 성분을 조립하여 얼음상에 제2 가닥 cDNA 합성 반응을 준비한다.
| 두 번째 가닥 합성 반응 | 볼륨(μl) |
| 첫 번째 가닥 합성 제품 (단계 4.1) | 20 |
| 두 번째 가닥 합성 반응 버퍼 | 8 |
| 두 번째 가닥 합성 효소 믹스 | 4 |
| 뉴클레아제 없는 물 | 48 |
| 총 볼륨 | 80 |
표 5: 제2 가닥 합성 반응. 두 번째 가닥 cDNA 합성 반응의 성분은 도시된 부피가에 따라 얼음 상에서 조립 및 혼합되어야 한다. 제2 스트랜드 합성 반응 버퍼, 제2 스트랜드 합성 효소 믹스 및 뉴클레아제 프리 워터의 마스터 믹스를 제1 스트랜드 합성 제품에 첨가할 수 있습니다.
- 튜브를 얼음 위에 놓고, 여러 번 파이펫팅하여 철저히 섞어 줍니다. 프로그램 #4 다음 열 사이클러에서 배양(보충 표 2).
6. SPRI를 이용한 cDNA 정리 (고체 상 뒤집을 수 있는 고정) 구슬
- SPRI 비드를 사용하기 전에 적어도 30 분 동안 실온으로 따뜻하게 한 다음 약 30 s의 소용돌이 SPRI 비드를 다시 일시 중단하십시오.
- 두 번째 가닥 합성 반응에 144 μL의 재부유 구슬을 추가합니다(~80 μL). 적어도 10 회 위아래로 파이펫팅하여 잘 섞고 실온에서 5 분 동안 배양하십시오.
- 미세 원심 분리기에서 튜브를 잠시 회전시키고 튜브를 자기 랙에 놓아 구슬을 상수에서 분리합니다. 용액이 명확한 후에는 조심스럽게 제거하고 상한액을 폐기하십시오. DNA가 들어있는 구슬을 방해하지 않도록주의하십시오.
- 마그네틱 랙에 있는 동안 튜브에 갓 준비된 80% 에탄올 180 μL을 추가합니다. 30 초 동안 실온에서 배양 한 다음 조심스럽게 제거하고 상한을 폐기하십시오.
- 총 2회 세탁단계로 6.4단계를 1회 반복합니다.
- 잔류 에탄올을 완전히 제거합니다. 튜브를 마그네틱 랙에 두고 뚜껑을 열고 약 3분 간 또는 눈에 띄게 건조될 때까지 구슬을 건조시고 있습니다. 구슬을 과도하게 건조시키지 마십시오.
- 자석에서 튜브를 제거하고 53 μL 0.1x TE 버퍼 (시약 키트에 포함 됨, 보충 표 1참조)를 구슬에 추가합니다. 파이펫을 위아래로 10회 이상 철저히 섞어 주세요. 실온에서 2 분 동안 배양하십시오.
- 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다. 뉴클레아제 프리 PCR 튜브를 세척하기 위해 상층의 50 μL을 전달합니다. 구슬을 방해하지 않도록주의하십시오. 이는 프로토콜에서 선택적 정지점이며, cDNA 샘플은 -20°C에서 저장될 수 있다.
7. cDNA 라이브러리의 끝 수리
- 제6조에서 제2 가닥 합성 생성물로 표 6에 열거된 성분을 조립하여 얼음상에서 의 최종 수리 반응을 조립한다.
| 최종 수리 반응 | 볼륨(μl) |
| 두 번째 가닥 합성 제품 (단계 6.8) | 50 |
| 최종 복구 반응 버퍼 | 7 |
| 엔드 리페어 효소 믹스 | 3 |
| 총 볼륨 | 60 |
표 6: 복구 반응을 종료합니다. 최종 수리 반응의 구성 요소는 표시된 부적에 따라 얼음에 조립및 혼합되어야 합니다. 엔드 리페어 반응 버퍼와 엔드 리페어 효소 믹스의 마스터 믹스를 만들어 두 번째 가닥 합성 제품에 추가할 수 있습니다.
- 파이펫을 50 μL로 설정한 다음 전체 볼륨을 위아래로 10회 이상 파이펫하여 완전히 혼합합니다. 튜브의 측면에서 모든 액체를 수집하기 위해 잠시 원심 분리기. 잘 혼합하는 것이 중요합니다. 소량의 거품이 있으면 성능이 저하되지 않습니다.
- 프로그램#5(보충표 2)에따라 열사이클러에서 샘플을 배양합니다.
8. 어댑터 결찰
- 결찰 반응을 설정하기 전에 표 7에표시된 것처럼 얼음-차가운 어댑터 희석 버퍼에서 어댑터를 희석하고 필요한 샘플 수와 10% 추가수를 곱합니다. 희석된 어댑터를 얼음 위에 두십시오.
| 결찰 희석 | 볼륨(μl) |
| 어댑터 | 0.5 |
| 어댑터 희석 버퍼 | 2 |
| 총 볼륨 | 2.5 |
표 7: 어댑터 희석. 어댑터는 표시된 부적에 따라 어댑터 희석 버퍼로 얼음위에 희석되어야 합니다.
- 표 8에기재된 바와 같이 구성요소를 추가하여 얼음 상에 결찰 반응을 조립하고, 열거된 순서대로, 단계 7.3으로부터 최종 준비 반응 생성물까지 조립한다. 리그 마스터 믹스 와 리그베이션 인핸서가 미리 혼합될 수 있습니다. 이러한 혼합물은 4°C에서 적어도 8시간 동안 안정하다. 어댑터 리피션 단계에서 사용하기 전에 리미션 마스터 믹스, 리그레이션 인핸서 및 어댑터를 미리 혼합하지 마십시오.
| 결찰 반응 | 볼륨(μl) |
| 끝 준비 된 DNA (단계 7.3) | 60 |
| 희석 된 어댑터 (8.1 단계) | 2.5 |
| 결찰 증강 | 1 |
| 결찰 마스터 믹스 | 30 |
| 총 볼륨 | 93.5 |
표 8: 결찰 반응. 어댑터 결찰 반응의 성분은 도시된 순서대로 도시된 부적에 따라 얼음 상에 조립되어야 한다. 리미션 인핸서와 리미션 마스터 믹스의 마스터 믹스를 만들고 희석 된 어댑터로 끝 준비 DNA에 추가 할 수 있습니다. 희석된 어댑터와 결찰 마스터 믹스 또는 결찰 증강기를 최종 준비 DNA와 혼합하기 전에 혼합하지 마십시오.
- 파이펫을 80 μL로 설정한 다음 전체 볼륨을 위아래로 10회 이상 파이펫하여 완전히 혼합합니다. 튜브의 측면에서 모든 액체를 수집하기 위해 빠른 스핀을 수행합니다. 결찰 마스터 믹스는 매우 점성이 있습니다. 불완전한 혼합은 결찰 효율을 감소시킬 것이기 때문에 결찰 반응의 적절한 혼합을 보장하기 위해주의하십시오. 소량의 거품이 있으면 성능이 저하되지 않습니다.
- 프로그램 #6(보충 표 2)에따라 인큐베이션한 다음 열 사이클러에서 결찰 혼합물을 제거하고 어댑터 처리 효소 3 μL을 추가하여 총 부피가 96.5 μL입니다.
- 파이펫을 상하로 여러 번 잘 섞은 다음, 프로그램#7(보충표 2)에따라 배양한 후 결찰 반응의 정제를 즉시 진행한다.
9. SPRI Neads를 이용한 결찰 반응의 정제
- SPRI 비드를 사용하기 전에 적어도 30 분 동안 실온으로 따뜻하게 한 다음 약 30 s의 소용돌이 SPRI 비드를 다시 일시 중단하십시오.
- 87 μL의 재매달린 SPRI 비드를 추가하고 적어도 10회 이상 위아래로 파이펫팅하여 잘 섞어보입니다. 실온에서 10 분 동안 배양하십시오.
- 미세 원심 분리기에서 튜브를 잠시 회전시키고 튜브를 자기 랙에 놓아 구슬을 상수에서 분리합니다. 용액이 명확한 후 (~ 5 분), 조심스럽게 제거하고 상한을 폐기하십시오. 구슬을 버리지 마십시오.
- 마그네틱 랙에 있는 동안 튜브에 갓 준비된 80% 에탄올 180 μL을 추가합니다. 30 초 동안 실온에서 배양 한 다음 조심스럽게 제거하고 상한을 폐기하십시오. 총 2회 세탁 단계로 9.4단계를 한 번 반복합니다.
- 잔류 에탄올을 완전히 제거합니다. 튜브를 마그네틱 랙에 두고 뚜껑을 열고 약 3분 간 또는 눈에 띄게 건조될 때까지 구슬을 건조시고 있습니다. 구슬을 과도하게 건조시키지 마십시오.
- 자석에서 튜브를 제거하고 구슬에 0.1x TE 버퍼의 17 μL을 추가합니다. 파이펫을 위아래로 10회 이상 철저히 섞어 주세요. 실온에서 2 분 동안 인큐베이션 한 다음 튜브를 자기 랙에 놓고 구슬이 상급에서 완전히 분리 될 수 있도록합니다.
- 뉴클레아제 프리 PCR 튜브를 세척하기 위해 상층의 15 μL을 전달한다. 구슬을 방해하지 않도록주의하십시오. 이는 프로토콜내의 선택적 정지점이며, 어댑터-결찰된 DNA는 -20°C에서 저장될 수 있다.
10. 어댑터 Ligated DNA의 PCR 농축
- 표 9에기재된 바와 같이 PCR 반응을 설정한다. 사전 캡처 PCR 마스터 믹스와 유니버설 프라이머를 포함하는 마스터 믹스를 만들고 어댑터 결찰 DNA에 추가 할 수 있습니다. 다중 시퀀싱의 경우 각 반응에 대해 고유한 인덱스 프라이머를 사용하고 각 샘플에 개별적으로 추가합니다.
| PCR 농축 | 볼륨(μl) |
| 어댑터 결부 DNA (10.1 단계) | 15 |
| 사전 캡처 PCR 마스터 믹스 | 25 |
| 범용 PCR 프라이머 | 5 |
| 인덱스 (X) 프라이머 | 5 |
| 총 볼륨 | 50 |
표 9: 적응기 결찰 DNA의 PCR 농축. PCR 농축의 어댑터 결찰 DNA 반응의 성분은 도시된 부적에 따라 얼음 상에 조립및 혼합되어야 한다. 프리 캡쳐 PCR 마스터 믹스와 유니버설 PCR 프라이머의 마스터 믹스를 제작하여 어댑터 리그 DNA에 추가할 수 있습니다. 다중 시퀀싱의 경우 각 샘플에 고유한 인덱스 프라이머가 주어져야 합니다.
- 위아래로 10회 부드럽게 파이펫팅하여 잘 섞으세요. 미세원심분리기에서 튜브를 간단히 돌리고 열 사이클러에 놓고 프로그램 #8 사용하여 PCR 증폭을 수행합니다(보충표 2).
11. SPRI 구슬을 사용하여 PCR 반응의 정화
- SPRI 비드를 사용하기 전에 적어도 30 분 동안 실온으로 따뜻하게 한 다음 약 30 s의 소용돌이 SPRI 비드를 다시 일시 중단하십시오.
- 각 PCR 반응에 45 μL의 재중단 구슬을 추가합니다(~50 μL). 실온에서 5분 동안 배양하기 전에 적어도 10회 위아래로 파이펫팅하여 잘 섞으세요.
- 미세 원심 분리기에서 튜브를 잠시 회전시키고 튜브를 자기 랙에 놓아 구슬을 상수에서 분리합니다. 용액이 명확한 후 (~ 5 분), 조심스럽게 제거하고 상한을 폐기하십시오. DNA가 들어있는 구슬을 방해하지 않도록주의하십시오.
- 마그네틱 랙에 있는 동안 튜브에 갓 준비된 80% 에탄올 180 μL을 추가합니다. 30 초 동안 실온에서 배양 한 다음 조심스럽게 제거하고 상한을 폐기하십시오. 총 2회 세탁단계로 11.4단계를 1회 반복합니다.
- 잔류 에탄올을 완전히 제거합니다. 튜브를 마그네틱 랙에 두고 뚜껑을 열고 약 3분 간 또는 눈에 띄게 건조될 때까지 구슬을 건조시고 있습니다. 구슬을 과도하게 건조시키지 마십시오.
- 자석에서 튜브를 제거하고 구슬에 23 μL 0.1x TE 버퍼를 추가합니다. 파이펫을 위아래로 10회 이상 철저히 섞어 주세요. 실온에서 2 분 동안 배양하십시오.
- 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다. 뉴클레아제 프리 PCR 튜브를 세척하기 위해 상층의 20 μL을 전달한다. 구슬을 방해하지 않도록주의하십시오. 이는 프로토콜의 선택적 정지 지점이며, 사전 캡처 라이브러리는 -20°C에서 저장될 수 있다.
12. 사전 캡처 라이브러리의 유효성 을 검사하고 정량화
- 형광계 및 고감도 분석 키트를 사용하여 사전 포획 라이브러리의 농도를 측정합니다. 파트 II: 하이브리드화 및 캡처로 진행하려면 최소 수율 200ng가 필요합니다.
- 디지털 전기 동공 시스템에서 라이브러리 1 μL을 실행합니다. 필요한 경우 제조업체의 프로토콜 권장 사항에 따라 고감도 칩에 과부하가 걸리지 않도록 샘플을 희석하십시오.
- 일렉트로로그램이 피크 크기가 약 250-400 bp인 좁은 분포를 나타내는지 확인합니다(대표 결과, 그림 3 및 그림 4참조).
- 128 bp 피크(어댑터-디머)가 바이오분석기 트레이스에서 보이고, 신호의 세기가 ≥250-400 bp 라이브러리 신호의 세기인 경우(대표 결과, 도 5참조), 샘플 부피(11.7단계에서 50μL까지)를 0.1x TE 버퍼로 50 μL로 끌어올려 SPRI 비드 정제(1단계)를 반복한다. 이것은 프로토콜의 선택적 정지 지점이며, 사전 캡처 라이브러리는 파트 II: 면역프리즘 혼성화 및 캡처로 이동하기 전에 -20°C에서 저장될 수 있다.
파트 II: 하이브리드화 및 캡처
13. 차단 올리고, Cot-1 DNA, 사전 캡처 라이브러리 DNA 및 드라이 결합
- 표10에 나타낸 바와 같이, 11단계에서 제조된 바코드 라이브러리를 혼합하고 12단계에서 정량화하고, Cot-1 DNA 및 차단 올리고스를 뉴클레아제 없는 PCR 튜브 또는 1.5 mL 마이크로튜브에 포함시켰다.
| 시약 | 수량/용적 |
| 10.10단계에서 바코드된 라이브러리 | 200 ng |
| 코트-1 DNA | 2 μg |
| 올리고스 차단 | 2 μL |
표 10: 혼성화 준비 및 건조. 혼성화를 준비하기 위해 라이브러리의 건조를 위해 결합되는 구성품은 도시된 수량에 따라 조립되어야 한다.
- 30-45°C로 설정된 진공 농축기를 사용하여 튜브의 내용물기를 건조시다. 프로토콜의 선택적 중지 지점입니다. 건조 후, 튜브는 실온 (15-25 °C)에서 하룻밤 또는 -20 °C에서 더 이상 보관될 수 있다.
14. 라이브러리와 DNA 캡처 프로브를 혼성화
- 해동 2x 비드 워시 버퍼 및 하이브리드화 버퍼, 하이브리드화 버퍼, 면역 프리즘 프로브 패널, 10x 워시 버퍼 1, 10x 워시 버퍼 2, 10x 워시 버퍼 3 및 실온에서 10x 엄격한 세척 버퍼. 사용하기 전에 혼성화 버퍼를 검사하여 염의 결정화를 검사하십시오. 결정이 존재하는 경우, 버퍼가 완전히 용해 될 때까지, 간헐적으로 흔들어, 65 °C에서 튜브를 가열.
- 실온에서 튜브에 하이브리드 화 마스터 믹스를 만듭니다. 표 11다음에 도피를 샘플 수에 곱하고 10% 더 추가합니다.
| 하이브리드화 마스터 믹스 | 볼륨(μl) |
| 하이브리드화 버퍼 | 8.5 |
| 하이브리드화 버퍼 인핸서 | 2.7 |
| 면역프리즘 프로브 패널 | 5 |
| 뉴클레아제 없는 물 | 0.8 |
| 총 볼륨 | 17 |
표 11: 하이브리드화 마스터 믹스. 하이브리드화 마스터 믹스의 구성 요소는 표시된 체적에 따라 실온에서 조립 및 혼합되어야 합니다.
- 소용돌이 또는 파이펫을 위아래로 잘 섞어 보도록 하십시오. 이어서, 말린 DNA를 함유하는 각 튜브에 혼성화 마스터 믹스의 17 μL을 첨가한다. 튜브를 밀봉하고 실온에서 5 분 동안 배양하십시오.
- 샘플을 소용돌이로 하여 완전히 혼합되도록 하고, 미세 원심 분리기에서 샘플을 잠시 스핀다운합니다. 적용 가능한 경우, 각 샘플을 1.5 mL 마이크로튜브에서 뉴클레아제 없는 PCR 튜브로 옮김을 전달합니다.
- 샘플을 열 사이클러에 놓고 프로그램 #9실행합니다(보충 표 2).
- 인큐베이션 동안, 세척 완충제(Step 15)와 스트렙타비딘 비드(Step 16)를 준비하고, 완충제를 예열하고 스트렙타비딘 비드를 평형화하기에 충분한 시간을 허용한다.
15. 세척 버퍼 준비
참고: 세척 버퍼는 2x(비드 워시 버퍼) 또는 10x(기타 모든 세척 버퍼) 농축 솔루션으로 제공됩니다.
- 혼성화 인큐베이션 동안 2x 비드 워시 버퍼와 10x 세척 버퍼를 희석하여 1x 작동 솔루션을 생성하고 필요한 샘플 수를 곱하고 표 12에따라 10% 추가합니다. 10x 세척 버퍼 1이 흐린 경우 병을 65°C 수조 또는 난방 블록에서 가열하여 미립자를 다시 일시 중단시려면. 냉동 1x 세척 버퍼는 해동 후 혼합해야합니다.
| 세척 버퍼 | 농축 버퍼(μL) | 뉴클레아제 없는 물 (μL) | 합계(μL) |
| 비드 워시 버퍼 | 150 | 150 | 300 |
| 워시 버퍼 1 | 25 | 225 | 250 |
| 워시 버퍼 2 | 15 | 135 | 150 |
| 워시 버퍼 3 | 15 | 135 | 150 |
| 엄격한 세척 버퍼 | 30 | 270 | 300 |
표 12: 세척 버퍼 희석. 농축 세척 버퍼는 표시된 부피에 따라 실온에서 뉴클레아제없는 물로 희석되어야합니다.
- 1x 세척 버퍼를 뉴클레아제 없는 PCR 튜브로 알리쿼트하고 표 13에나타낸 바와 같이 적절한 온도에 놓는다. 파이펫팅에 충분한 초과 시간을 포함해야 합니다. 가열 된 버퍼의 경우 뚜껑을 70 °C로 설정한 열 사이클러를 65 °C로 설정하십시오.
| 세척 버퍼 | 유지 온도 | 볼륨/튜브(μL) | 튜브 수/샘플 |
| 비드 워시 버퍼 | RT (15-25 °C) | 100 | 3 |
| 워시 버퍼 1 | 65 °C | 100 | 1 |
| 워시 버퍼 1 | RT (15-25 °C) | 150 | 1 |
| 워시 버퍼 2 | RT (15-25 °C) | 150 | 1 |
| 워시 버퍼 3 | RT (15-25 °C) | 150 | 1 |
| 엄격한 세척 버퍼 | 65 °C | 150 | 2 |
표 13: 희석세척완충제. 희석된 세척 버퍼는 표시된 샘플당 튜브의 부량 과 수에 따라 별도의 튜브로 aliquoted되어야 합니다. 세척 버퍼는 사용하기 전에 표시된 온도에서 유지되어야 합니다.
- 표 14에나타난 바와 같이 실온에서 비드 재서스펜션 믹스를 준비하고, 필요한 수의 샘플을 곱하고 10% 더 추가한다.
| 비드 리서스펜션 믹스 | 볼륨(μl) |
| 하이브리드화 버퍼 | 8.5 |
| 하이브리드화 버퍼 인핸서 | 2.7 |
| 뉴클레아제 없는 물 | 5.8 |
| 총 볼륨 | 17 |
표 14: 비드 재서스펜션 믹스. 비드 재서스펜션 믹스의 구성요소는 표시된 체적에 따라 실온에서 조립및 혼합되어야 합니다.
16. 스트렙타비딘 구슬 준비
- 사용 전에 적어도 30 분 동안 실온에서 평형 스트렙타비딘 비드. 포획당 15s 및 50 μL의 구슬을 뉴클레아제 없는 PCR 튜브에 소용돌이치면서 구슬을 철저히 혼합합니다.
- 각 튜브에 100 μL의 비드 워시 버퍼(단계 15.1에서 준비)를 추가합니다. 부드럽게 파이펫을 위아래로 10회 부드럽게 섞어주세요. 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다.
- 투명 한 상급을 제거 하 고 폐기 합니다. 구슬을 방해하지 않도록주의하십시오.
- 다음 세척을 수행합니다.
- 마그네틱 랙에서 제거합니다. 구슬이 들어있는 각 튜브에 100 μL의 1x 비드 워시 버퍼를 추가한 다음 파이펫을 위아래로 10회 섞어 주세요.
- 튜브를 마그네틱 랙에 놓고 구슬이 상급기와 완전히 분리될 수 있도록 합니다.
- 조심스럽게 제거하고 투명 한 상한을 폐기.
- 총 2번의 세차서번에 16.4단계를 한 번 반복합니다.
- 마그네틱 랙에서 제거합니다. 15.3단계에서 비드 재서스펜션 믹스 17 μL을 각 튜브에 추가합니다. 파이펫을 위아래로 여러 번 철저히 혼합합니다. 구슬이 튜브의 측면에 붙어 있지 않은지 확인하십시오. 필요한 경우 튜브를 잠시 회전하여 바닥에 있는 구슬을 수집합니다.
17. 스트렙타비딘 구슬에 하이브리드 대상 묶기
- 4시간 의 혼성화 인큐베이션이 완료된 후, 열 사이클러로부터 샘플을 제거하고 가열된 뚜껑을 70°C로 설정하여 65°C에서 배양하도록 열 사이클러를 설정합니다.
- 다중 채널 파이펫을 사용하여 완전히 균질화된 비드 17 μL을 시료로 이송합니다. 위아래로 10회 파이펫팅하여 완전히 섞으세요.
- 프로그램 #10 다음 열 사이클러에 튜브를 배치하여 비드에 DNA를 결합(보충 표 2). 배양 중에 스트립 튜브를 10-12분마다 간단히 제거하고 3s동안 부드럽게 소용돌이를 제거하여 구슬이 현탁액에 남아 있도록 합니다. 또는, 위아래로 여러 번 파이펫팅하여 혼합하십시오. 스트렙타비딘 비드 세척(18단계)으로 즉시 진행합니다.
18. 스트렙타비딘 구슬을 씻어 언바운드 DNA제거
- 15.2단계에서 1x 세척 버퍼를 사용하고 세척 중에 열 사이클러에 가열된 버퍼를 저장합니다.
- 17.3단계에서 튜브에 예열된 1x 세척 버퍼 100μl을 추가합니다. 위아래로 10회 파이펫팅하여 완전히 섞으세요. 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다.
- 피펫과 언바운드 DNA를 포함하는 상급을 폐기. 마그네틱 랙에서 제거합니다.
- 다음 65°C 세척을 수행합니다.
- 예열된 1x 엄격한 세척 버퍼 150 μL을 추가합니다.
- 위아래로 10회 이상 파이펫팅하여 완전히 섞으세요. 파이펫팅 중에 기포를 피하십시오. 구슬은 모든 튜브에 완전히 다시 매달려 있는지 확인하십시오.
- 65°C에서 5분 동안 열 사이클러에서 배양합니다.
- 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다. 피펫과 언바운드 DNA를 포함하는 상급을 폐기. 마그네틱 랙에서 제거합니다.
- 총 2개의 엄격한 세면어에 대해 18.4단계를 반복합니다.
- 첫 번째 실온 세척을 수행합니다.
- 실온 1x 세척 버퍼 1의 150 μL을 추가합니다.
- 비펫을 10~20회 위아래로 피펫하여 구슬을 완전히 재중단시부합니다.
- 튜브를 밀봉하고 2 분 동안 배양하여 30 초 동안 부드럽게 소용돌이를 하고 30 초 동안 쉬십시오. 모든 우물의 구슬은 전체 배양 기간 동안 모든 튜브에 완전히 다시 매달려 있어야합니다.
- 튜브를 잠시 원심 분리합니다.
- 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다. 피펫을 버리고 상급체를 버린다.
- 튜브를 밀봉하고 잠시 원심 분리기를. 마그네틱 랙으로 돌아가 10 μl 파이펫을 사용하여 잔류 세척 버퍼를 제거합니다.
- 두 번째 실온 세척을 수행합니다.
- 실온 1x 세척 버퍼 2의 150 μL을 추가합니다.
- 비펫을 10~20회 위아래로 피펫하여 구슬을 완전히 재중단시부합니다.
- 튜브를 밀봉하고 2 분 동안 배양하여 30 초 동안 부드럽게 소용돌이를 하고 30 초 동안 쉬십시오. 모든 우물의 구슬은 전체 배양 기간 동안 모든 튜브에 완전히 다시 매달려 있어야합니다.
- 튜브를 잠시 원심 분리합니다.
- 세척 버퍼 2에 다시 매달린 구슬의 전체 부피를 전달하여 뉴클레아제 없는 PCR 튜브를 청소합니다. 중요: 비드를 신선한 튜브로 옮기는 것은 대상 외오염을 방지하는 것이 중요합니다.
- 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다. 피펫을 버리고 상급체를 버린다.
- 튜브를 밀봉하고 잠시 원심 분리기를. 마그네틱 랙으로 돌아가 10 μl 파이펫을 사용하여 잔류 세척 버퍼를 제거합니다.
- 세 번째 실온 세척을 수행합니다.
- 실온 1x 세척 버퍼 3의 150 μL을 추가합니다.
- 비펫을 10~20회 위아래로 피펫하여 구슬을 완전히 재중단시부합니다.
- 튜브를 밀봉하고 2 분 동안 배양하여 30 초 동안 부드럽게 소용돌이를 하고 30 초 동안 쉬십시오. 모든 우물의 구슬은 전체 배양 기간 동안 모든 튜브에 완전히 다시 매달려 있어야합니다.
- 튜브를 잠시 원심 분리합니다.
- 튜브를 마그네틱 랙에 놓아 구슬이 상급과 완전히 분리될 수 있도록 합니다. 피펫을 버리고 상급체를 버린다.
- 튜브를 밀봉하고 잠시 원심 분리기를. 마그네틱 랙으로 돌아가 10 μL 파이펫을 사용하여 잔류 세척 버퍼를 제거합니다.
- 마그네틱 랙에서 제거하고 20 μL의 뉴클레아제 없는 물을 구슬에 넣습니다.
- 파이프 측면에 붙어있는 구슬이 다시 중단되었는지 확인하기 위해 10 번 위아래로 피펫을 하십시오.
- 중요: 구슬을 버리지 마십시오. 19단계에서 캡처된 DNA와 함께 재중단된 구슬의 전체 20 μL을 사용하십시오.
19. 최종 수행, 포스트 캡처 PCR 농축
- 표 15에따라 다음 표에 따라 캡처 후 PCR 마스터 믹스를 준비하고 필요한 샘플 수를 곱하고 10 % 추가를 추가합니다.
| 캡처 후 PCR 마스터 믹스 구성 요소 | 볼륨(μl) |
| 캡처 후 PCR 마스터믹스 | 25 |
| 포스트 캡처 PCR 프라이머 믹스 | 1.25 |
| 뉴클레아제 없는 물 | 3.75 |
| 총 볼륨 | 30 |
표 15: 캡처 후 PCR 마스터 믹스. 포스트 캡처 PCR 마스터 믹스의 구성 요소는 조립하고 표시된 볼륨에 따라 얼음에 혼합해야합니다.
- 포스트 캡처 PCR 마스터 믹스 30 μL을 각 샘플에 추가하여 50 μL의 최종 반응 량을 유지합니다.
- PCR 튜브를 열 사이클러에 놓고 프로그램#11(보충 표 2)에따라 배양합니다.
20. 포스트 캡처 PCR 파편 정화
- SPRI 비드를 사용하기 전에 적어도 30 분 동안 실온으로 따뜻하게 한 다음 약 30 s의 소용돌이 SPRI 비드를 다시 일시 중단하십시오.
- 각 PCR 농축 캡처(50 μL)에 75μL의 재일시 중단 구슬을 추가합니다. 위아래로 적어도 10 번 파이펫팅하여 잘 섞어. 스트렙타비딘 비드는 SPRI 비드 정제를 방해하지 않습니다. 실온에서 5 분 동안 배양하십시오.
- 미세 원심 분리기에서 튜브를 잠시 회전시키고 튜브를 자기 랙에 놓아 구슬을 상수에서 분리합니다. 용액이 명확한 후에는 조심스럽게 제거하고 상한액을 폐기하십시오. DNA가 들어있는 구슬을 방해하지 않도록주의하십시오.
- 마그네틱 랙에 있는 동안 튜브에 갓 준비된 80% 에탄올 180 μL을 추가합니다. 30 초 동안 실온에서 배양 한 다음 조심스럽게 제거하고 상한을 폐기하십시오.
- 총 2회 세탁 단계로 20.4단계를 1회 반복합니다.
- 잔류 에탄올을 완전히 제거합니다. 튜브를 마그네틱 랙에 놓고 뚜껑을 열고 3분 간 또는 눈에 띄게 건조될 때까지 공기 건조시. 구슬을 과도하게 건조시키지 마십시오. 이것은 DNA의 더 낮은 복구 귀착될 수 있습니다.
- 자석에서 튜브를 분리합니다. 0.1x TE 버퍼의 22 μL을 추가하여 구슬로부터 DNA를 용해시. 위아래로 여러 번 파이펫팅하여 잘 섞으세요. 실온에서 2 분 동안 배양하십시오. 용액이 명확해질 때까지 튜브를 마그네틱 랙에 놓습니다.
- 상층의 20 μL을 제거하고 깨끗한 뉴클레아제없는 PCR 튜브로 옮기고 구슬을 방해하지 않도록주의하십시오. 이는 프로토콜내의 선택적 정지점이며, 라이브러리는 -20°C에서 저장될 수 있다.
21. 라이브러리 의 유효성 검사 및 정량화
- 형광계 및 고감도 분석 키트를 사용하여 캡처 된 라이브러리의 농도를 측정합니다.
- 디지털 전기 영동고감도 DNA 칩을 사용하여 캡처된 라이브러리의 평균 단편 길이를 측정하고 시스템 소프트웨어를 사용하여 각 라이브러리에 대한 평균 단편 크기를 계산합니다. 평균 조각 크기는 약 250-400 bp여야 합니다(대표 결과, 그림 6 및 그림 7참조). 이는 프로토콜의 선택적 정지지점이며, 완성된 라이브러리는 -20°C에서 저장될 수 있다.
22. 시퀀싱 플랫폼에서 시퀀싱
- 시퀀싱의 경우 라이브러리를 2nM으로 희석하고 시퀀서의 로딩 및 작동에 대한 제조업체의 지침을 따릅니다. 최소 깊이 1,500만 개의 단일 엔드 판독길이가 50bp 이상인 시퀀스 라이브러리.
23. 클라우드 기반 정보학 도구인 프리즘 포털을 사용하여 면역 프로파일을 생성하고 바이오마커를 발견하기 위한 시퀀싱 데이터 분석
- https://prism.cofactorgenomics.com/ 방문하여 프리즘 계정 만들기
- 로그인한 후 프리즘의 모든 페이지에서 상단 도구 모음에 새 프로젝트 제출을 클릭하여 다중화 된 FASTQ 시퀀싱 파일을 업로드하거나 프리즘 계정으로 BaseSpace에 저장된 파일을 업로드하십시오.
- 프로젝트 이름 및 그룹 또는 코호트별 샘플을 포함하여 새 프로젝트 양식을 작성합니다. Biomarker 검색 보고서를 생성하려면 샘플 그룹화 및 해당 그룹화 이름이 필요합니다. 바이오마커 발견 보고서를 생성하려면 그룹당 최소 3개의 샘플이 필요합니다. 응용 프로그램 시작 단추를 클릭하여 양식을 제출합니다. 성공하면 확인 페이지가 나타납니다.
- 로그인하는 동안 상단 도구 모음 또는 프리즘의 모든 페이지에서 결과 보기를 클릭합니다. 프리즘은 사용자가 제출 된 프로젝트의 상태를 확인하고 프로젝트 당 샘플 및 바이오 마커 보고서를 볼 수 있습니다. 사용자가 프리즘에 만든 프로젝트의 테이블이있을 것입니다. 테이블에는 상태, 이름 및 제출 날짜에 대한 세 개의 열이 있습니다.
참고: 각 프로젝트의 상태는 다음과 같은 것입니다.
• 프로젝트 분석이 현재 실행 중인 "실행 중"이거나,
• 프로젝트 분석이 완료되고 보고서를 사용할 수 있는 "성공". - 프로젝트가 분석을 완료한 경우("성공" 상태표시), 개별 샘플 보고서 및 바이오마커 발견 보고서를 봅니다. 바이오마커 디스커버리 보고서는 프로젝트에 그룹당 최소 3개의 샘플이 포함된 경우에만 사용할 수 있습니다.
- 이러한 보고서에 액세스하려면 프로젝트 테이블로 돌아가서 프로젝트 이름을 클릭합니다. 이 프로젝트 페이지에는 프로젝트의 각 샘플에 대한 행이 있는 테이블이 있습니다. 보고서 열 아래의 각 행의 링크를 클릭하여 각 샘플의 개별 보고서에 액세스합니다. 표 바로 아래에서 바이오마커 발견 보고서의 링크를 클릭합니다. 이 페이지에 링크가 없는 경우 프로젝트가 분석을 완료하지 않은 것입니다.
결과
사용자가 생성된 재료의 품질과 양을 평가할 수 있도록 프로토콜 전체에 걸쳐 여러 체크포인트가 있습니다. 프로토콜에 기재된 12단계에 따라, 일렉트로로그램은 도 3에도시된 바와 같이 생성되며, 손상되지 않은 RNA 샘플에 대한 전형적인 사전 포획 라이브러리를 대표한다(RIN=7.8).
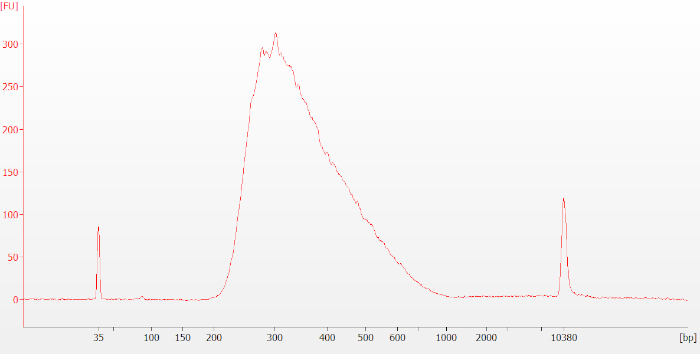
그림 3: 손상되지 않은 RNA 샘플에 대한 일반적인 사전 포획 라이브러리 바이오분석기 추적. 사전 캡처 라이브러리는 크기가 250-400개의 기본 쌍(bp) 정도의 넓은 피크로 나타납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 4에나타낸 바와 같이, FFPE RNA 샘플로부터 생성된 사전 포획 라이브러리의 대표적인 전기전보람(DV200 = 46)에 도시된 바와 같이 과다 증폭을 피하기 위해 주의를 기울여야 한다. 이 피크가 주 피크(약 250-400 염기 쌍(bp)에 비해 작으면 다운스트림 단계 또는 분석을 방해하지 않습니다. 두 번째 피크가 250-400 bp 피크에 비해 큰 경우, 사전 캡처 라이브러리는 과다 증폭을 줄이기 위해 적은 PCR 사이클로 다시 만들 수 있습니다.

그림 4: FFPE RNA 샘플에 대한 일반적인 사전 포획 라이브러리 바이오분석기 추적. 약 1,000 bp의 두 번째 피크는 과대 증폭을 나타냅니다. 이 피크가 250-400 bp(그림 참조)의 주 피크에 비해 작으면 다운스트림 단계 또는 분석을 방해하지 않습니다. 두 번째 피크가 250-400 bp 피크에 비해 큰 경우, 사전 캡처 라이브러리는 과잉 증폭을 줄이기 위해 적은 PCR 사이클로 다시 만들 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
12.1.3 단계에서 설명한 대로 어댑터 디머의 존재를 평가하여 추가 정리가 필요한지 확인해야 합니다. 도 5에 나타낸 일렉트로페로그램은 받아들일 수 없는(그림5A,DV200 = 33) 및 허용 가능한(그림5B,DV200 = 46) 수준의 어댑터 이량체를 나타내며, 약 128bp의 날카로운 피크로 나타난다.
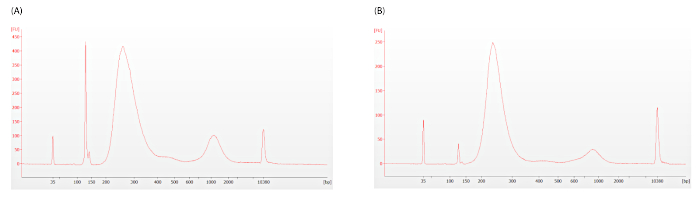
그림 5: 사전 캡처 라이브러리 바이오분석기 추적. 어댑터 디머는 128 bp.(A)이 일렉트로로그램에 존재하는 과도한 어댑터 디이머의 주위에 날카로운 피크로 나타난다. (B)허용 어댑터 디머 레벨이 이 추적에 묘사되어 있습니다. 두 흔적은 온화한 과다 증폭의 증거를 보여줍니다, 그러나 이것은 면역 프리즘 분석과 방해해서는 안됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜이 완료되면 시퀀싱 전에 최종 라이브러리가 디지털 전기 동극을 사용하여 다시 평가됩니다. FFPE RNA로 만들어진 라이브러리는 손상되지 않은 RNA로 만든 라이브러리보다 더 작은 평균 크기 분포를 가지는 경향이 있습니다. 손상되지 않은 RNA 샘플의 경우 결과 추적은 그림 6(RIN = 9.5)과 유사하게 보일 것입니다. 저하되거나 FFPE RNA의 경우 결과 추적은 그림 7(DV 200 = 36)과 유사하게 보일 것입니다.
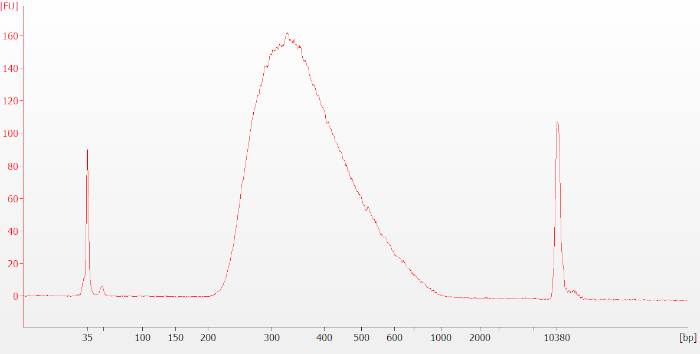
그림 6: 손상되지 않은 RNA 샘플에 대한 일반적인 최종 라이브러리 바이오분석기 추적. 최종 라이브러리는 크기가 250-400개의 기본 쌍(bp) 정도의 넓은 피크로 나타납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
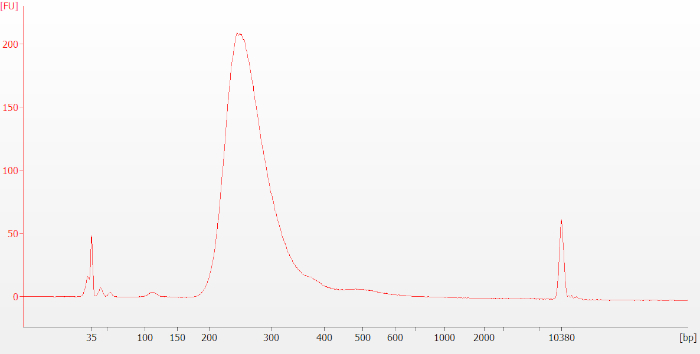
그림 7: FFPE RNA 샘플에 대한 일반적인 최종 라이브러리 바이오분석기 추적. FFPE RNA로 만들어진 라이브러리는 손상되지 않은 RNA로 만든 라이브러리보다 더 작은 평균 크기 분포를 가지는 경향이 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
설명된 바와 같이, 이 프로토콜로 생성된 결과는 도 8에나타낸 바와 같이 두 가지 주요 방법으로 적용될 수 있다.

그림 8: 프로토콜의 두 가지 사용 사례입니다. 이 면역 프로파일링 분석에 의해 생성된 결과는 두 가지 주요 번역 응용 프로그램에서 적용됩니다. (A)첫번째 사용 사례는 인간 고형 종양 조직(FFPE 아카이브 포함)에서 시작하여 샘플에 대한 개별 면역 프로필을 생성합니다. (B)일단 인간 샘플의 코호트에 대해 생성된 데이터는 프리즘 포털을 사용하여 다차원 바이오마커 및 해당 바이오마커 보고서를 생성한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이러한 각 사용 사례를 입증하기 위해 작은 번역 연구의 대표 데이터가21로포함되어 있습니다. 본 연구에서 사용된 견본은 비소세포 폐암 (NSCLC)을 위해 진단되고 취급된 7명의 환자에게서 견본의 세트입니다. 견본은 전후 처리 생검에서 환자 일치한 고형 종양 조직입니다. 먼저, 개별 샘플을 분석하여 도 9에도시된 실시예 보고서와 같은 면역 프로파일을 생성하였다.

도 9: NSCLC 샘플에 대한 개별 면역 보고서를 예로 들 수 있다. 프리즘 포털 파이프라인은 처리된 각 샘플에 대한 그래픽 보고서를 생성하며 여기에 표시된 NSCLC 고형 종양 샘플에 대해 생성된 대표 보고서가 있습니다. (A)보고서의 전면은 FFPE 조직에서 추출된 RNA 샘플에 존재하는 면역 세포의 분해를 그래픽으로 나타낸다. (B)보고서의 반대쪽은 면역 세포 (절대 백분율) 및 탈출 유전자 발현 (백만 당 성적 증명서, 또는 TPM)의 테이블뿐만 아니라 분석에 대한 성능 의 문을 포함한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
면역 프로파일 전-및 사후 치료는 어떻게 치료(화학요법 또는 방사선,이 연구에서)가 종양 미세 환경을 변형시켰는지 이해하는 데 사용될 수 있다. 예는 도 10에도시되어 있는데, 여기서 각 면역 세포에 대한 백분율의 변화와 총 면역 함량은 단일 환자에 대해 화학요법 전후로 나타난다.

그림 10: 예시 전과 후 치료 결과. 단일 NSCLC 환자로부터 치료 전 및 사후 샘플에서 생성된 개별 면역 세포 및 총 면역 함량 데이터가 도시됩니다. 이 예에서, 환자는 치료로서 화학요법 요법을 받았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
환자는 비교를 위한 임상 결과 표현형과 같은 기준에 의해 분류될 수 있습니다. 예를 들어, 도 11에서,NSCLC 연구에서 샘플은 치료 후 질병 진행에 대한 시간에 따라 비교되었다. 환자의 부분 집합은 >18 개월에서 질병 재발을 보여주었고, 또 다른 하위 집합은 ≤18 개월에서 더 빨리 진행되었습니다. 중앙값 델타 값(치료 전과 후 값 간의 차이)은 각 샘플에 대해 비교하여 질병 진행의 가처분 바이오마커를 식별합니다.
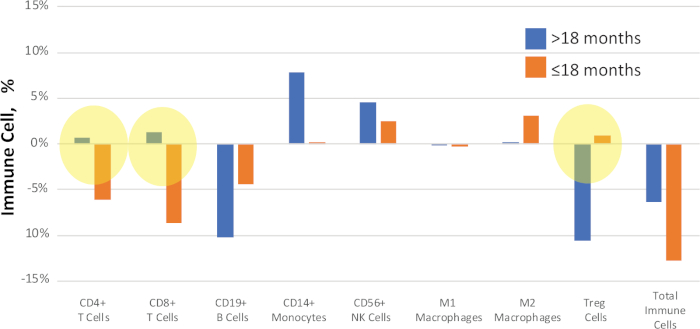
도 11: 예시 임상 결과 비교. 일치하는 전처리 전과 후 NSCLC 샘플에서 면역 세포 백분율 사이의 정량적 변화는 "델타" 값으로 계산및 보고되었다. 노란색으로 강조 표시된 사람들은 생존 상태 사이의 명확한 신호 변화를 보여줍니다. 파란색 막대는 질병이 진행될 때까지 >18개월의 중앙값 델타 값을 나타내고, 주황색 막대는 질병 진행까지 ≤18개월동안의 중앙델타 값을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
마지막으로, 유사한 샘플 그룹은 프리즘 포털을 사용하여 바이오마커 보고서를 생성함으로써 예측 바이오마커를 식별하기 위해 전처리 샘플을 구체적으로 살펴보는 데 사용될 수 있다. 도 12에도시된 바와 같이, 상술한 바와 같은 임상 표현형(disease progression)은 샘플 군칭을 정의한다. 이 예에서, 2개의 면역 이스케이프 유전자는 샘플 그룹(CD47 및 OX40, 도 12A의하부 패널에 도시된)의 통계적으로 유의한 분별체로서 확인되었다. 이 예에서, 개별 유전자 바이오마커는 명확한 통계적 유의성을 갖는 견고하기 때문에, 다차원 바이오마커는 유의한 예측 값을 추가하지 않는다(ImmunoPrism, 도 12B의오른쪽 상단 막대 차트에 표기된 대로). 분석 분석에 대한 모든 18개의 분석물 결과를 포함한 전체 데이터 테이블은 통계 분석 및 간략한 방법 요약을 포함하여 보고서의 뒷면에 요약되어 있습니다.
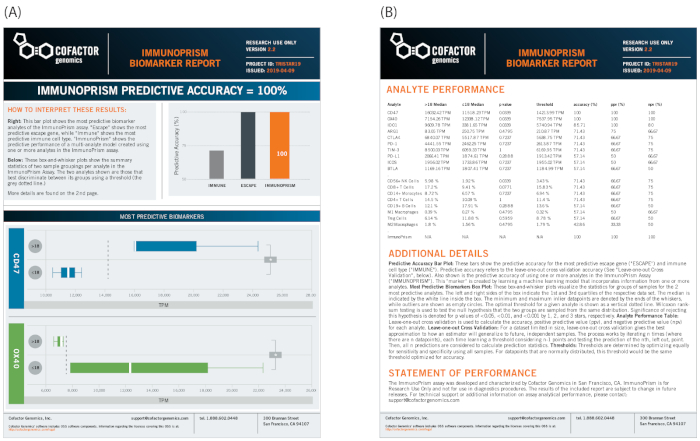
그림 12: NSCLC 샘플에 대한 바이오마커 보고서 예. 바이오마커 디스커버리 파이프라인은 개별 바이오마커의 시각적 보고서와 기계 학습 다차원 바이오마커를 상세한 통계와 함께 제공합니다. (A)본 연구에서 파이프라인은 2개의 개별 바이오마커(CD47 및 OX40)를 18개월의 임계값으로 질병 진행을 정의하는 데 통계적으로 유의한 것으로 확인하였다. (B)방법 및 전체 결과에 대한 세부 정보가 보고서의 뒷면에 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 시약 키트 재료. ImmunoPrism 키트에 제공된 재료 목록과 제조업체의 프로토콜에서 참조한 부품 번호가 나열됩니다. 필요한 기타 모든 장비 및 재료는 재료 표에 나열되어 있습니다. 안전 데이터 시트(SDS)의 https://cofactorgenomics.com/product/immunoprism-kit/ 방문하십시오. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
보충 표 2: 열 사이클러 프로그램. 프로토콜 전체에서 참조되는 권장 되는 사이클러 프로그램은 프로그래밍의 용이성을 위해 요약됩니다. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
보충 표 3: 시퀀싱 인덱스 가이드. 시약 키트에 제공된 인덱스 프라이머가 열거되어; 연속 적중을 위한 각 반응에 독특한 프라이머가 첨가된다. 권장되는 저레벨 멀티플렉싱 조합도 제공됩니다. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
토론
프로토콜은 20 ng 손상되지 않았거나 40 ng고 저하된(FFPE) RNA를 필요로 한다. RNA 샘플에는 DNA, 염(예를 들어, Mg2+또는 구니디늄 염), 분량 양이온 킬레이트화제(예를 들어, EDTA, EGTA, 구연산염), 또는 유기물(예를 들어, 페놀 및 에탄올)이 없어야 한다. DV200 <20%가 있는 RNA 샘플을 진행하는 것은 권장되지 않습니다. 이러한 제어는 라이브러리 준비에서 분석에 이르기까지 전체 프로토콜 전반에 걸쳐 성능을 평가하는 수단을 제공하기 때문에 키트 내 제어 RNA를 사용하는 것이 좋습니다.
이 프로토콜은 0.2 mL PCR 스트립 튜브를 사용하여 수행되도록 설계되었습니다. 바람직한 경우, 프로토콜은 또한 96 웰 PCR 플레이트에서 웰을 사용하여 수행될 수 있다. PCR 튜브 또는 스트립 튜브에 대한 모든 참조 대신 96웰 PCR 플레이트의 웰을 사용하기만 하면 됩니다. 구슬 정화 및 세척 단계에서 구슬의 완전한 재서스펜션을 시각적으로 확인하는 것이 중요하므로 명확한 우물만 있는 PCR 플레이트를 사용하십시오.
프로토콜 전체에 달리 명시되지 않는 한 시약을 냉동 또는 얼음 위에 보관하십시오. 완전히 해동될 때까지 시약을 사용하지 마십시오. 사용하기 전에 모든 시약을 철저히 혼합하십시오.
사용 준비가 될 때까지 효소를 -20°C에서 유지하고 사용 후 즉시 -20°C로 되돌리십시오. 분자 등급의 뉴클레아제없는 물만 사용하십시오. DEPC 처리된 물을 사용하지 않는 것이 좋습니다. 파이펫팅을 할 때는 용액이 잘 섞일 때까지 총 부피의 50% 이상을 부드럽게 흡입하고 분배합니다. 파이펫은 효소를 함유한 모든 마스터 믹스를 혼합합니다. 소용돌이를 사용하여 효소를 혼합하면 변성으로 이어질 수 있으며 성능을 손상시킬 수 있습니다. 비드 정제 중에 분자 등급 에탄올에서 갓 만든 80% 에탄올 용액을 사용하십시오. 신선하지 않은 에탄올 용액을 사용하면 수율이 낮아질 수 있습니다. 용출 효율을 감소시킬 수 있기 때문에 구슬을 과도하게 건조시키지 마십시오 (비드는 과도하게 건조되면 금이 간 것처럼 보입니다).
단계 10에 기재된 바와 같이, 고유 인덱스 프라이머는 각 반응에 첨가된다. 이러한 인덱스의 순서에 따라, 낮은 수준의 멀티플렉싱을 위해, 특정 인덱스 조합은 최적입니다. 이러한 인덱스의 시퀀스는 시퀀싱 후 데이터를 다중화하는 데 필요합니다. 서열 및 권장 멀티플렉싱 조합은 보충 표 3에제공된다. 이 와 같은 단계에서, 권장된 PCR 사이클의 수는 사용되는 RNA의 품질에 따라 달라지며, PCR 과다 증폭을 방지하기 위해 일부 최적화가 필요할 수 있다는 점에 유의해야 한다. 면역프리즘 손상되지 않은 제어 RNA 및 기타 고품질 RNA의 경우 10개의 PCR 주기로 최적화를 시작합니다. 면역프리즘 FFPE 대조군 RNA 및 기타 고분해/FFPE RNA의 경우, 15번의 PCR 주기로 최적화를 시작합니다. PCR 주기를 최적화하기 위해 분석할 물질의 RNA 대표를 사용하여 테스트 라이브러리를 제작하는 것이 좋습니다. 충분한 사전 캡처 라이브러리 수율(>200 ng)을 일관되게 생성하는 최소 PCR 사이클수를 사용해야 합니다. 바이오분석기 트레이스에서 약 1000 bp의 이차 피크는 과다 증폭을나타낸다(그림 4). 과다 증폭을 최소화해야 하지만, 작은 이차 피크의 존재는 분석 결과를 방해하지 않을 것이다.
시료 손실을 최소화하고 튜브 전환을 피하기 위해 진공 농축기가 허용하는 경우 13단계는 1.5mL 마이크로튜브 대신 PCR 튜브, 스트립 튜브 또는 96웰 PCR 플레이트에서 수행될 수 있습니다. 로터는 많은 농축기에서 제거 할 수 있습니다. 이를 통해 스트립 튜브 또는 플레이트가 진공 상태에 들어갈 수 있습니다. 그런 다음 원심분리 없이 수성 건조 설정을 사용하여 진공 농도를 실행할 수 있습니다. 진공 농축기의 지침은 설명서를 참조하십시오. 시료가 스트립 튜브 또는 96웰 플레이트에서 건조되는 경우, 혼성화 단계는 동일한 용기에서 수행될 수 있다.
17단계에서는 10-12분마다 소용돌이를 피하여 비드 포획 효율을 높여야 합니다. 튜브가 열리지 않도록 혼합 할 때 따뜻한 스트립 튜브의 뚜껑을 조심스럽게 잡으십시오.
Step 18에 설명된 세안은 높은 비특이적 오염을 피하기 위해 매우 중요하며 밀접하게 따라야 합니다. 각 세척시 구슬을 완전히 다시 중단하고 세척 버퍼 2 세척 중에 샘플을 신선한 스트립 튜브로 옮기십시오 (18.6.5 단계). 스트렙타비딘 비드가 완전히 다시 중단되고 전체 인큐베이션 동안 현탁액에 남아 있는지 확인하십시오. 튜브 캡에 튀는 것은 캡처에 부정적인 영향을 미치지 않습니다. 실온 세척 동안, 마이크로플레이트 와류 믹서가 쉽게 재서스펜션을 위해 2분 배양 기간 전체에 대한 샘플을 소용돌이에 사용할 수 있다. 스트렙타비딘 구슬이 마르지 않도록 하십시오. 필요한 경우, 구슬을 건조하지 않도록 버퍼에서 인큐베이션을 확장합니다. 하나 이상의 스트립 튜브를 사용하는 경우, 다른 스트립 튜브가 열사이클러에 앉아있는 동안 각 세척에 대해 한 번에 하나의 스트립 튜브로 작동합니다. 이렇게 하면 구슬을 과도하게 건조하거나 돌진하지 않아 재서스펜션이 불량하거나 다른 최적이 아닌 기술이 생성되지 않도록 할 수 있습니다. 처음 사용자의 경우 한 번에 8개 이상의 라이브러리 반응을 처리하지 않는 것이 좋습니다.
현재 의 면역 프로파일링 기술은 중요한 해석(RNA 시퀀싱)이 필요한 수천 개의 데이터 포인트에서 개별 데이터 포인트(단일 플렉스 IHC)에 이르기까지 정보의 연속체를 제공합니다. 여기에 설명된 프로토콜은 중도에 있는 접근 방식을 나타내며, 집중된 범위는 높은 감도를 가능하게 하지만 임상적으로 관련된 전사데이터의 하위 집합만 캡처합니다. 대량 RNA 추출의 특성으로 인해,이 프로토콜은 면역 세포와 종양 미세 환경 사이의 공간 적 관계에 대한 정보를 제공하지 않지만, 결과는이 정보를 추가하는 이미징 기술로 보완 될 수있다. 이 프로토콜에 의해 생성 된 데이터에 대 한 응용 프로그램의 무수 한있다, 질병으로 암의 생물학에 대해 배울 수 많은, 그리고 그것을 치료 하기 위해 개발 되 고 치료. 대표적인 결과에 나타난 바와 같이, 개별 면역 보고는 환자의 면역 프로필이 질병 진행 또는 치료와 같은 사건에 반응하여 어떻게 변화할 수 있는지 이해하는 데 유용하다. 여기에 제시된 결과는 몇몇 예의 사용 사례를 제공하는 동안, 치료의 작용의 기계장치를 조사하고 진행 자유로운 전반적인 생존과 같은 임상 결과의 putative biomarkers를 확인하는 것을 포함하여 그밖 응용은 또한 입니다 실용적인. 바이오마커 발견 응용을 위해 이 프로토콜을 사용하는 경우, 동종 인구를 분석하고, 통계적 힘을 위해 충분한 샘플을 포함하고, 바이어스의 근원을 고려하기 위해 좋은 연구 설계를 연습하는 것이 중요합니다. 분석법의 집중적이고 능률적인 특성으로 인해, 일단 발견된 이러한 바이오마커의 임상 검증 및 다운스트림 적용을 향한 경로를 상상하는 것이 가능합니다.
공개
모든 저자는 Cofactor 유전체학, Inc., 이 문서에 사용된 ImmunoPrism 시약 키트 및 정보학 공구를 개발하고 생성하는 회사에 의해 고용됩니다. 면역 프리즘 분석 은 연구 용 전용이며 진단 절차에 사용하지 않습니다.
감사의 말
저자는 대표적인 결과에 대한 생물학적 표본뿐만 아니라 자신의 기술 전문 지식에 대한 Cofactor 유전체학에서 전체 분자, 분석, 제품 및 상업 팀을 제공하는 TriStar 기술 그룹을 인정하고자 지원.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR 8 tube strip | USA Scientific | 1402-2700 | USA Scientific 0.2 mL PCR 8-tube strip |
| 200 Proof Ethanol | MilliporeSigma | EX0276-1 | Prepare 80% by mixing with nuclease-free water on the day of the experiment |
| 96-well thermal cyclers | BioRad | 1861096 | |
| Solid-phase Reversible Immobilization (SPRI) Beads | Beckman-Coulter | A63882 | Agencourt AMPure XP – PCR Purification beads |
| Digital electrophoresis chips and kit | Agilent Technologies | 5067-4626 | Agilent High Sensitivity DNA chips and kit |
| Digital electrophoresis system | Agilent Technologies | G2939AA | Agilent 2100 Electrophoresis Bioanalyzer |
| Streptavidin Beads | ThermoFisher Scientific | 65306 | Dynabeads M-270 Streptavidin |
| ImmunoPrism Kit – 24 reaction | Cofactor Genomics | CFGK-302 | Cofactor ImmunoPrism Immune Profiling Kit – 24 reactions |
| Human Cot-1 DNA | ThermoFisher Scientific | 15279011 | Invitrogen brand |
| Magnetic separation rack | Alpaqua/Invitrogen | A001322/12331D | 96-well Magnetic Ring Stand |
| Microcentrifuge | Eppendorf | 22620701 | |
| Microcentrifuge tubes | USA Scientific | 1415-2600 | USA Scientific 1.5 mL low-adhesion microcentrifuge tube |
| NextSeq550 | Illumina | SY-415-1002 | Any Illumina sequencer may be used for this protocol |
| Nuclease-free water | ThermoFisher Scientific | AM9937 | |
| Prism Extraction Kit | Cofactor Genomics | CFGK-401 | Cofactor Prism FFPE Extraction Kit – 24 samples |
| Purified RNA | - | - | Purified from human tissue samples |
| Fluorometer | ThermoFisher Scientific | Q33226 | Qubit 4 System |
| Fluorometric Assay Tubes | Axygen | PCR-05-C | 0.5mL Thin Wall PCR Tubes with Flat Caps |
| High Sensitivity Fluorometric Reagent Kit | Life Technologies | Q32854 | Qubit dsDNA HS Assay Kit |
| Vacuum concentrator | Eppendorf | 22820001 | VacufugePlus |
| Vortex mixer | VWR | 10153-838 | |
| Water bath or heating block | VWR/USA Scientific | NA/2510-1102 | VWR water bath/USA Scientific heating block |
참고문헌
- Brambilla, E., et al. Prognostic Effect of Tumor Lymphocytic Infiltration in Resectable Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. 34 (11), 1223-1230 (2016).
- Iacono, D., et al. Tumour-infiltrating lymphocytes, programmed death ligand 1 and cyclooxygenase-2 expression in skin melanoma of elderly patients: clinicopathological correlations. Melanoma Research. 28 (6), 547-554 (2018).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nature Reviews Clinical Oncology. 14 (12), 717-734 (2017).
- Sierant, M. C., Choi, J. Single-Cell Sequencing in Cancer: Recent Applications to Immunogenomics and Multi-omics Tools. Genomics Inform. 16, (2018).
- Klauschen, F., et al. Scoring of tumor-infiltrating lymphocytes: From visual estimation to machine learning. Seminars in Cancer Biology. 52 (Pt 2), 151-157 (2018).
- Danaher, P., et al. Gene expression markers of Tumor Infiltrating Leukocytes. Journal for ImmunoTherapy of Cancer. 5, 18 (2017).
- Aran, D., Hu, Z., Butte, A. J. xCell: digitally portraying the tissue cellular heterogeneity landscape. Genome Biology. 18 (1), 220 (2017).
- Newman, A. M., et al. Robust enumeration of cell subsets from tissue expression profiles. Nature Methods. 12 (5), 453-457 (2015).
- Becht, E., et al. Estimating the population abundance of tissue-infiltrating immune and stromal cell populations using gene expression. Genome Biology. 17 (1), 218 (2016).
- Newman, A. M., Gentles, A. J., Liu, C. L., Diehn, M., Alizadeh, A. A. Data normalization considerations for digital tumor dissection. Genome Biology. 18 (1), 128 (2017).
- Chen, S. H., et al. A gene profiling deconvolution approach to estimating immune cell composition from complex tissues. BMC Bioinformatics. 19 (Suppl 4), 154 (2018).
- Yoshihara, K., et al. Inferring tumour purity and stromal and immune cell admixture from expression data. Nature Communications. 4, 2612 (2013).
- Foley, J. W., et al. Gene-expression profiling of single cells from archival tissue with laser-capture microdissection and Smart-3SEQ. Genome Research. , (2019).
- Civita, P., et al. Laser Capture Microdissection and RNA-Seq Analysis: High Sensitivity Approaches to Explain Histopathological Heterogeneity in Human Glioblastoma FFPE Archived Tissues. Front Oncol. 9, 482 (2019).
- . PD-L1 in cancer: ESMO Biomarker Factsheet | OncologyPRO Available from: https://oncologypro.esmo.org/Education-Library/Factsheets-on-Biomarkers/PD-L1-in-Cancer (2019)
- Haslam, A., Prasad, V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Network Open. 2 (5), e192535 (2019).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews Immunology. 12 (3), 191-200 (2012).
- Schillebeeckx, I., et al. Analytical Performance of an Immunoprofiling Assay Based on RNA Models. Association for Molecular Pathology 2019 Annual Meeting. Journal of Molecular Diagnostics. 21, (2019).
- Uryvaev, A., Passhak, M., Hershkovits, D., Sabo, E., Bar-Sela, G. The role of tumor-infiltrating lymphocytes (TILs) as a predictive biomarker of response to anti-PD1 therapy in patients with metastatic non-small cell lung cancer or metastatic melanoma. Medical Oncology. 35 (3), 25 (2018).
- Wang, K., Shen, T., Siegal, G. P., Wei, S. The CD4/CD8 ratio of tumor-infiltrating lymphocytes at the tumor-host interface has prognostic value in triple-negative breast cancer. Human Pathology. 69, 110-117 (2017).
- Carney, W. P., Bhagat, M., LaFranzo, N. Multidimensional gene expression models for characterizing response and metastasis in solid tumor samples [abstract]. American Association for Cancer Research Annual Meeting. Cancer Research. 79 (13 Suppl), (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유