Method Article
固体肿瘤的预测免疫建模
摘要
通过分子和信息学协议描述使用基于RNA的方法确定固体肿瘤组织的定量免疫特征,并利用临床队列进行免疫肿瘤学生物标志物发现。
摘要
免疫疗法在肿瘤患者的治疗中显示出希望,但肿瘤微环境的复杂异质性使得预测治疗反应具有挑战性。解决肿瘤组织内和周围免疫细胞的相对群体的能力已被证明与理解反应在临床上相关,但受到流式细胞学和免疫组织化学等传统技术的限制(IHC),由于需要大量的组织,缺乏准确的细胞类型标记,以及许多技术和后勤障碍。一种测定(例如,免疫Prism免疫分析分析)通过容纳少量RNA和高降解RNA(从临床存档的固体肿瘤组织中提取的RNA的常见特征)克服了这些挑战。该测定通过试剂盒和基于云的信息学进行访问,为Illumina测序平台提供端到端定量、高通量免疫分析解决方案。研究人员从只有两个部分的形式固定石蜡嵌入(FFPE)组织或总RNA的20-40 ng(取决于样品质量),该协议生成免疫配置文件报告量化8个免疫细胞类型和10个免疫逃生基因,捕捉肿瘤微环境的完整视图。无需额外的生物信息分析即可利用所得数据。使用适当的样本队列,该协议还可用于识别患者感兴趣群体中具有统计意义的生物标志物。
引言
肿瘤渗透淋巴细胞(TILs)和其他免疫相关分子在形式固定和石蜡嵌入(FFPE)固体肿瘤人体组织样本的定量在临床研究1、2、3中已显示出价值。流动细胞学和单细胞核糖核酸(RNA)测序等常用技术对新鲜组织和血液4有用,但由于无法产生可行的细胞悬浮液,因此不适合分析FFPE材料。目前用于量化FFPE组织中这些细胞的方法面临重大挑战。免疫组织化学(IHC)和其他类似的成像工作流程需要特定的抗体来检测细胞表面蛋白,这在实验室中很难标准化,以实现可重复的定量5。诸如nCounter系统等平台依靠单一基因的表达来定义关键的免疫细胞6,限制了检测的敏感性和特异性。更通用的RNA测序方法,加上独立的软件工具,是可用的,但在使用7,8,9,10,11,12之前需要显著的优化和验证。激光捕获微分体(LCM)与FFPE组织RNA测序相结合的最新进展已显示出希望;然而,一个更高的通量,交钥匙的解决方案是需要的翻译研究,旨在识别强大的生物标志物13,14。在精密医学和免疫治疗时代,能够定义患者队列(包括治疗反应者、癌症亚型或具有高预测准确性和统计意义的生存结果)的多维生物标志物的方法变得越来越重要。
为了满足这一需求,开发了一种免疫分析测定,利用标准化的RNA测序试剂和基于云的信息学,使固体肿瘤FFPE组织中免疫细胞的敏感和特异性定量。除了容纳来自FFPE组织的降解RNA外,该协议还能够容纳从限制组织样本(如核心针头活检、针吸气和微或宏观解剖组织)衍生的RNA。将每个样本的RNA数据与免疫细胞的基因表达模型数据库进行比较,该数据库称为免疫健康表达模型,以量化免疫细胞占样本中总细胞的百分比。简单地说,这些模型是使用机器学习方法构建的,从纯化免疫细胞群(使用规范细胞表面标记分离的分离)生成全转录组数据中识别独特的多基因表达模式(使用规范细胞表面标记)17、18。该技术基础的多维健康表达模型使测定能够将每个免疫细胞量化为异质混合物中总细胞的百分比。这使得研究人员能够生成样本间和样本内免疫细胞的比较,这已被证明具有临床价值19,20。其他应用包括免疫反应治疗前和治疗后定量,如代表性结果所述。测定报告肿瘤和肿瘤微环境免疫结合的多种特征,包括八种免疫细胞类型的绝对百分比(来自基因表达模型):CD4+ T细胞、CD8+ T细胞、CD56=自然杀伤细胞、CD19+ B细胞、CD14+单核细胞、Tregs、M1巨噬细胞和M2巨噬细胞。此外,测定报告10个免疫逃逸基因的表达(以千万分之一转录或TPM计算):PD-1、PD-L1、CTLA4、OX40、TIM-3、BTLA、ICOS、CD47、IDO1和ARG1。
试剂试剂盒用于根据基于混合捕获的库制备方法,在Illumina平台上建立高质量的库,以便进行测序,如图1所示。如果研究人员在实验室中没有Illumina测序平台,他们可以将样品提交核心实验室进行测序。生成后,测序数据将上载到棱镜门户进行自动分析,并将以免疫报告(图 2A)的形式为每个样本返回一个全面的定量配置文件。用户还可以在棱镜门户中定义样本分组以生成生物标志物报告(图2B),突出显示区分两个患者群组的统计显著性生物标记。重要的是,试剂盒生成的数据仅供研究使用,不得用于诊断目的。

图 1:工作流概述。在此协议中,RNA首先转换为cDNA。测序适配器被连带,适配器连带的cDNA被PCR放大和条形码,以创建预捕获库。然后,生物素化探针杂交到特定的cDNA靶点,然后用链球菌珠捕获。未绑定、非靶向的 cDNA 通过洗涤去除。最终的 PCR 扩充产生一个后捕获库,可以进行测序。*总RNA必须来自人体样本;可能是完整或降解 (FFPE) RNA。请点击此处查看此图的较大版本。

图2:代表性免疫报告。工作流生成两个报告, 每个处理的样本的单个免疫报告 (A), 和生物标记报告 (B) 为定义的患者队列.请点击此处查看此图的较大版本。
该协议需要大约16小时的制备时间(从总RNA到准备测序的库);但是,正如协议中所述,有许多可选的停止点。该测定利用转录组学的丰富、动态特性,从传统的单分析物生物标记物转向多维基因表达模型,从而实现具有标准化的组织样本的全面生物特征试剂和易于使用的软件工具。它使研究人员能够利用机器学习和健康表达模型数据库,在自己的实验室中利用当代技术,从而获得更准确、定量的珍贵临床样本免疫配置文件,并发现具有全面统计分析的多维RNA生物标志物。
研究方案
此处所示的代表性结果中使用的人体组织样本是从信誉良好的实体(三星技术集团)购买的,并告知捐赠者同意,允许学术和商业研究,并经合格道德人批准委员会。
第一部分:预捕获库准备
1. RNA定量和资格鉴定
- 使用荧光测定对RNA进行定量,以确定测定的相应输入。使用电泳评估评估输入RNA的质量,以确定RNA完整性数(RIN)和片段百分比>200核苷酸(DV200)值。
- 对于完整 (RIN > 7) 或部分降解的 RNA 样本 (RIN = 2 到 7),请遵循从步骤 2.1 开始的高质量/完整 RNA 的库准备步骤。RNA的质量对于选择热循环程序#1正确的破碎时间非常重要(补充表2)。
- 对于高度降解的样品(例如,RIN = 1 到 2 或 FFPE),确定 DV200值。这些样品不需要碎裂,并将遵循降解RNA的指令,从步骤2.2开始。
- 通过稀释 20 ng RNA(具有 RIN > 2 的高质量/可处理 RNA)或 40 ng RNA(具有 DV200 > 20% 的降解/FFPE RNA),为每个样品制备适当的总RNA总量在无核酸酶水中至5μL。不建议使用 DV200 < 20% 处理样品。对于随试剂盒提供的对照RNA样品,在4μL无核酸酶水中稀释1μL的相应RNA。控制样品将按照与描述的高质量(完好)或降解(FFPE)RNA材料相同的处理,如标签。有关试剂盒中包含的所有试剂,请参阅补充表 1。
2. RNA碎片和起起
- 遵循步骤 2.1.1,使用 RIN > 2 的高质量/可操作 RNA。
- 对于高质量的RNA,根据表1,在无核酸酶PCR管中组装冰上破碎和充注反应。
- 通过上下多次移液彻底混合。然后,在微离心机中短暂旋转样品
注:对于协议中的所有离心机旋转,建议至少 3 s 的速度为 ± 1,000 x g。 - 将样品放入热循环仪中,使用程序#1(补充表2)。
- 立即将管转移到冰上,然后进行第一股cDNA合成,以进行高质量的RNA(步骤3.1)。为了同时制备高质量和FFPERNA,在碎片孵育期间开始制备FFPERNA(步骤2.2)。
- 通过上下多次移液彻底混合。然后,在微离心机中短暂旋转样品
- 对于高质量的RNA,根据表1,在无核酸酶PCR管中组装冰上破碎和充注反应。
| 碎片和启动混合 | 体积 (μL) |
| 完整或部分降解的RNA (20 ng) | 5 |
| 第一股合成反应缓冲液 | 4 |
| 随机引醚 | 1 |
| 总容量 | 10 |
表1:高质量RNA的破碎和启动反应。高质量RNA的破碎和充注反应的成分应根据所示体积在冰上组装和混合。可以制作第一股合成反应缓冲液和随机引物的主混合物,并将其添加到RNA样品中。
- 对于具有 DV200 > 20% 的降级/FFPE RNA,请执行步骤 2.2.1。
- 对于不需要碎片的高度降解 (FFPE) RNA,如表 2所述组装起吸反应。对于完整的RNA,请记住遵循步骤2.1。
- 通过上下多次移液彻底混合。然后,在微离心机中短暂旋转样品。
- 将样品放入热循环仪中并使用程序#2(补充表 2)。
- 将管转移到冰上,然后进行高降解(FFPE)RNA的第一股cDNA合成(步骤3.2)。
- 对于不需要碎片的高度降解 (FFPE) RNA,如表 2所述组装起吸反应。对于完整的RNA,请记住遵循步骤2.1。
| 刺激反应 | 体积 (μL) |
| FFPE RNA (40 ng) | 5 |
| 随机引醚 | 1 |
| 总容量 | 6 |
表2:高降解RNA的随机充注反应。高降解RNA的充注反应的成分应组装在无核酸酶PCR管的冰上。
3. 第一股cDNA合成
- 遵循步骤 3.1.1,使用 RIN > 2 的高质量/可操作 RNA。
- 对于完整的RNA(高质量),根据表3,在无核酸酶PCR管中组装冰上的第一股合成反应。
- 保持在冰上的反应,彻底混合通过移液向上和向下几次。在微离心机中短暂旋转样品,然后直接进入第一股合成孵育(步骤4)。
- 对于完整的RNA(高质量),根据表3,在无核酸酶PCR管中组装冰上的第一股合成反应。
| 第一股合成 | 体积 (μL) |
| 碎片和原始RNA(步骤2.1.3) | 10 |
| 第一链合成特异性试剂 | 8 |
| 第一链合成酶混合物 | 2 |
| 总容量 | 20 |
表3:优质RNA的第一股合成反应。高质量RNA的破碎和充注反应的成分应根据给出的体积在冰上组装和混合。可以制作第一股合成特异性试剂和第一链合成酶混合物的主混合物,并将其添加到碎裂和填充RNA样品中。
- 对于具有 DV200 > 20% 的降级/FFPE RNA,请执行步骤 3.2.1。
- 对于高降解RNA(FFPE),根据表4,在无核酸酶PCR管中组装冰上的第一股合成反应。
- 保持在冰上的反应,彻底混合通过移液向上和向下几次。在微离心机中短暂旋转样品,然后直接进入第一股合成孵育(步骤4)。
- 对于高降解RNA(FFPE),根据表4,在无核酸酶PCR管中组装冰上的第一股合成反应。
| 第一股合成 | 体积 (μL) |
| 引核糖核酸(步骤2.2.3) | 6 |
| 第一股合成反应缓冲液 | 4 |
| 第一股特异性试剂 | 8 |
| 第一链合成酶混合物 | 2 |
| 总容量 | 20 |
表4:高降解RNA的第一股合成反应。高降解RNA的破碎和充注反应的成分应根据所示体积在冰上组装和混合。可以制作第一股合成反应缓冲液、第一股合成特异性试剂和第一链合成酶混合物的主混合物,并将其添加到填充RNA样品中。
4. 第一股合成孵化
- 保持管子在冰上,通过上下移液多次彻底混合。在微离心机中短暂旋转样品。按照计划#3(补充表2),在预热的热循环器中孵育样品。
5. 第二股cDNA合成
- 通过组装表5所列成分,包括步骤4.1中的第一股反应产物,在冰上制备第二股cDNA合成反应。
| 第二股合成反应 | 体积 (μL) |
| 第一链合成产品(步骤 4.1) | 20 |
| 第二股合成反应缓冲液 | 8 |
| 第二股合成酶混合物 | 4 |
| 无核酸酶水 | 48 |
| 总容量 | 80 |
表5:第二股合成反应。第二股cDNA合成反应的成分应根据所示体积在冰上组装和混合。可以制作第二股合成反应缓冲液、第二股合成酶混合物和无核酸酶水的主混合物,并将其添加到第一链合成产品中。
- 保持管子在冰上,通过上下移液多次彻底混合。按照计划#4(补充表2)在热循环器中孵育。
6. 使用 SPRI(固体相位可逆固定)珠进行 cDNA 清理
- 在使用前,让 SPRI 珠加热至室温至少 30 分钟,然后涡旋 SPRI 珠约 30 秒重新悬浮。
- 将144 μL的再悬浮珠子加入第二股合成反应(±80 μL)。通过上下移液至少10次,在室温下孵育5分钟,将混合良好。
- 在微离心机中短暂旋转管,并将管放在磁性机架上,将珠子与上清液分离。溶液清除后,小心地取出并丢弃上清液。小心不要打扰含有DNA的珠子。
- 在磁性机架上将 180 μL 新鲜制备的 80% 乙醇添加到管中。在室温下孵育30s,然后小心地取出并丢弃上清液。
- 重复步骤 6.4 一次,共执行 2 个洗涤步骤。
- 完全去除残留乙醇。将管子留在磁性机架上,在盖子打开时将磁珠干燥约 3 分钟,或直到明显干燥。不要过度干燥珠子,因为这可能导致DNA的恢复性降低。
- 从磁铁中取出管子,向磁珠中加入 53 μL 0.1x TE 缓冲液(包含在试剂盒中,参见补充表 1)。上下移液至少10次,彻底混合。在室温下孵育2分钟。
- 将管子放在磁性机架上,使磁珠与上清液完全分离。转移50μL的上清液,以清洁无核酸酶PCR管。小心不要打扰珠子。这是协议中的一个可选停止点,cDNA样品可储存在-20°C。
7. cDNA库的终端修复
- 将表 6中列出的组件装配到步骤 6.8 中的第二股合成产物,从而在冰上组装端部修复反应。
| 端修复反应 | 体积 (μL) |
| 第二股合成产物(步骤 6.8) | 50 |
| 端修复反应缓冲液 | 7 |
| 端修复酶混合 | 3 |
| 总容量 | 60 |
表 6:结束修复反应。端部修复反应的部件应根据所示体积在冰上组装和混合。可以制作端部修复反应缓冲液和端部修复酶混合物的主组合,并将其添加到第二股合成产品中。
- 将移液器设置为 50 μL,然后将整个音量向上和向下移移至少 10 次,以便彻底混合。短暂离心机,从管侧收集所有液体。搞好组合很重要。存在少量气泡不会影响性能。
- 按照计划#5(补充表2),在热循环器中孵育样品。
8. 适配器连接
- 在设置结扎反应之前,在冰冷的适配器稀释液中稀释适配器,如表7所示,乘以所需数量的样品,加上10%的额外量。将稀释的适配器放在冰上。
| 结扎稀释 | 体积 (μL) |
| 适配器 | 0.5 |
| 适配器稀释缓冲器 | 2 |
| 总容量 | 2.5 |
表7:适配器稀释。适配器应在冰上稀释,并根据所示体积使用适配器稀释缓冲液。
- 将表8中所述的成分按列出的顺序添加到步骤7.3的末端制备反应产物中,从而组装冰上结扎反应。请注意,可提前混合配型主混合和配合增强剂。这种混合物在4°C下稳定至少8小时。在适配器结扎步骤中使用之前,请勿预混合结扎主混合、结扎增强剂和适配器。
| 结扎反应 | 体积 (μL) |
| 结束预置DNA(步骤 7.3) | 60 |
| 稀释适配器(步骤 8.1) | 2.5 |
| 结扎增强剂 | 1 |
| 结扎主混合 | 30 |
| 总容量 | 93.5 |
表8:结扎反应。适配器结扎反应的成分应按照所示顺序显示的体积在冰上组装。可以制作结扎增强剂和结扎主混合的主组合,并将其添加到带有稀释适配器的末端预置 DNA 中。在与末端预置DNA混合之前,请勿混合稀释的适配器和结扎主混合或结扎增强剂。
- 将移液器设置为 80 μL,然后将整个音量向上和向下移移至少 10 次,以便彻底混合。执行快速旋转,从管侧收集所有液体。结扎主混合是非常粘稠的。注意确保结扎反应的充分混合,因为不完全混合会导致连接效率降低。存在少量气泡不会影响性能。
- 按照程序#6孵育(补充表2),然后从热循环器中取出结扎混合物,加入3μL的适配器处理酶,导致总体积为96.5μL。
- 上下移液几次混合好,然后孵育遵循程序#7(补充表2),然后立即着手净化结扎反应。
9. 使用SPRI奈德净化结扎反应
- 在使用前,让 SPRI 珠加热至室温至少 30 分钟,然后涡旋 SPRI 珠约 30 秒重新悬浮。
- 加入87 μL的重新悬浮的SPRI珠,通过上下移液至少10次,混合良好。在室温下孵育10分钟。
- 在微离心机中短暂旋转管,并将管放在磁性机架上,将珠子与上清液分离。溶液清除后(±5分钟),小心地取出并丢弃上清液。不要丢弃珠子。
- 在磁性机架上将 180 μL 新鲜制备的 80% 乙醇添加到管中。在室温下孵育30s,然后小心地取出并丢弃上清液。重复步骤 9.4 一次,共执行 2 个洗涤步骤。
- 完全去除残留乙醇。将管子留在磁性机架上,在盖子打开时将磁珠干燥约 3 分钟,或直到明显干燥。不要过度干燥珠子,因为这可能导致DNA的恢复性降低。
- 从磁体中取出管,向磁珠中加入 17 μL 的 0.1x TE 缓冲液。上下移液至少10次,彻底混合。在室温下孵育2分钟,然后将管子放在磁性架上,使珠子与上清液完全分离。
- 转移15μL的上清液,以清洁无核酸酶PCR管。小心不要打扰珠子。这是协议中的一个可选停止点,适配器连结的DNA可以储存在-20°C。
10. 适应剂扩能DNA的PCR浓缩
- 如表9所述设置PCR反应。包含预捕获 PCR 主混合物和通用底漆的主组合可以制成并添加到适配器连体 DNA 中。对于多路复用测序,为每个反应使用唯一的索引引出,并分别添加到每个样本中。
| PCR 浓缩 | 体积 (μL) |
| 适配器连结DNA(步骤10.1) | 15 |
| 预捕获 PCR 主混合 | 25 |
| 通用 PCR 底漆 | 5 |
| 索引 (X) 引信 | 5 |
| 总容量 | 50 |
表9:适配器结扎DNA的PCR富集。适配器连结DNA反应的PCR富集的成分应根据所示体积在冰上组装和混合。预捕获 PCR 主混合物和通用 PCR 底漆的主组合可以制成并添加到适配器连体 DNA 中。对于多路复用排序,应为每个样本指定一个唯一的索引引信。
- 轻轻上下移液10次,搅拌均匀。在微离心机中短暂旋转管并放置在热循环器中,并使用程序#8执行 PCR 扩增(补充表 2)。
11. 使用SPRI珠净化PCR反应
- 在使用前,让 SPRI 珠加热至室温至少 30 分钟,然后涡旋 SPRI 珠约 30 秒重新悬浮。
- 在每个PCR反应中加入45μL的再悬浮珠子(±50 μL)。在室温下孵育5分钟之前,通过上下移液至少10次,将混合良好。
- 在微离心机中短暂旋转管,并将管放在磁性机架上,将珠子与上清液分离。溶液清除后(±5分钟),小心地取出并丢弃上清液。小心不要打扰含有DNA的珠子。
- 在磁性机架中向管中加入 180 μL 新鲜制备的 80% 乙醇。在室温下孵育30s,然后小心地取出并丢弃上清液。重复步骤 11.4 一次,共执行 2 个洗涤步骤。
- 完全去除残留乙醇。将管子留在磁性机架上,在盖子打开时将磁珠干燥约 3 分钟,或直到明显干燥。不要过度干燥珠子,因为这可能导致DNA的恢复性降低。
- 从磁铁上取下管子,向磁珠中加入 23 μL 0.1x TE 缓冲液。上下移液至少10次,彻底混合。在室温下孵育2分钟。
- 将管子放在磁性机架上,使磁珠与上清液完全分离。转移20μL的上清液,以清洁无核酸酶PCR管。小心不要打扰珠子。这是协议中的一个可选停止点,预捕获库可能存储在 -20°C。
12. 验证和量化预捕获库
- 使用荧光计和高灵敏度测定试剂盒测量预捕获库的浓度。进行第二部分:杂交和捕获,最低产量为 200 纳克。
- 在数字电泳系统上运行 1 μL 库。如有必要,根据制造商的协议建议,稀释样品以避免高灵敏度芯片过载。
- 检查电图显示的峰值尺寸约为 250-400 bp 的窄分布(参见代表性结果,图 3和图 4)。
- 如果生物分析仪曲线中可见 128 bp 峰值(适配器-二聚体),并且信号强度为 ± 250-400 bp 库信号强度(参见代表性结果,图 5),然后使用 0.1x TE 缓冲液将样本体积(从步骤 11.7)调高至 50 μL,并重复 SPRI 珠化纯化(步骤 11)。这是协议中的一个可选停止点,预捕获库可能存储在 -20°C,然后再进入第二部分:免疫普杂和捕获。
第二部分:杂交和捕获
13. 结合阻断奥利果斯、Cot-1 DNA、预捕获库DNA和干燥
- 将步骤 11 中准备的条形码库与无核酸酶 PCR 管或 1.5 mL 微管中的 Cot-1 DNA 和阻断 Oligos 混合,如表 10所示。
| 试剂 | 数量/数量 |
| 步骤 10.10 的条形码库 | 200 纳克 |
| 婴儿床-1 DNA | 2 μg |
| 阻止奥利戈斯 | 2 μL |
表10:杂交制备和干燥。在制备杂交时,用于干燥库的组件应根据显示的数量进行组装。
- 使用设置为 30-45 °C 的真空集中器干燥管内的物品。这是协议中的可选停止点。干燥后,管子可在室温(15-25°C)下过夜,或在-20°C下储存更长时间。
14. 将DNA捕获探针与库杂交
- 解冻 2x 珠洗液缓冲液和杂交缓冲液、杂交缓冲液增强剂、免疫循环探针面板、10x 洗涤缓冲液 1、10x 洗涤缓冲液 2、10x 洗涤缓冲液 3 和 10x 严格洗涤缓冲液室。使用前,检查混合缓冲液是否有盐的结晶。如果存在晶体,在 65°C 加热管,间歇性地晃动,直到缓冲液完全溶解。
- 在室温下,在管中创建杂交主混合物。将卷乘以样本数,并额外添加 10%,如下表 11。
| 杂交主混合 | 体积 (μL) |
| 杂交缓冲器 | 8.5 |
| 杂交缓冲器增强剂 | 2.7 |
| 免疫普瑞普学探针面板 | 5 |
| 无核酸水 | 0.8 |
| 总容量 | 17 |
表 11:混合主混合。杂交主混合组件应根据所示体积在室温下组装和混合。
- 涡旋或移液器上下混合良好。然后,将17μL的杂交主混合物加入每个含有干燥DNA的管中。密封管并在室温下孵育5分钟。
- 涡旋样品,确保它们完全混合,并在微离心机中短暂旋转样品。如果适用,将每个样品从 1.5 mL 微管转移到无核酸酶 PCR 管中。
- 将样品放入热循环仪中,并运行程序#9(补充表 2)。
- 在孵育期间,准备洗涤缓冲液(步骤15)和链球菌球珠(步骤16),留出足够的时间预热缓冲液并平衡链球菌球珠。
15. 准备洗涤缓冲器
注:洗涤缓冲液作为2x(珠洗缓冲液)或10x(所有其他洗涤缓冲液)浓缩溶液提供。
- 在杂交孵育期间,稀释2x珠洗液缓冲液和10x洗涤缓冲液,以创建1倍的工作溶液,乘以所需数量的样品,并额外增加10%,如下表12。如果 10x 洗涤缓冲液 1 为多云,则在 65°C 的水浴或加热块中加热瓶子以重新悬浮颗粒。冷冻1x洗涤缓冲液应在解冻后混合。
| 清洗缓冲器 | 浓缩缓冲液 (μL) | 无核酸酶水 (μL) | 总计 (μL) |
| 珠洗缓冲液 | 150 | 150 | 300 |
| 清洗缓冲液 1 | 25 | 225 | 250 |
| 清洗缓冲液 2 | 15 | 135 | 150 |
| 清洗缓冲液 3 | 15 | 135 | 150 |
| 严格的洗涤缓冲液 | 30 | 270 | 300 |
表12:清洗缓冲稀释。根据所示体积,在室温下,应用无核酸酶水稀释浓缩洗涤缓冲液。
- 将1x洗涤缓冲液与无核酸酶PCR管中相及,并置于表13所示的适当温度下。确保有足够的超龄移液。对于加热缓冲液,使用设置为 65°C 的热循环器,盖子设置为 70°C。
| 清洗缓冲器 | 保持温度 | 体积/管 (μL) | 管数/样本数 |
| 珠洗缓冲液 | RT (15-25 °C) | 100 | 3 |
| 清洗缓冲液 1 | 65 °C | 100 | 1 |
| 清洗缓冲液 1 | RT (15-25 °C) | 150 | 1 |
| 清洗缓冲液 2 | RT (15-25 °C) | 150 | 1 |
| 清洗缓冲液 3 | RT (15-25 °C) | 150 | 1 |
| 严格的洗涤缓冲液 | 65 °C | 150 | 2 |
表13:稀释洗涤缓冲液。稀释的洗涤缓冲液应根据显示的每个样品的体积和试管数量,将同点引入单独的管中。使用前,清洗缓冲液必须保持在指示温度。
- 如表14所示,在室温下制备珠重新悬浮混合物,乘以所需样本数,再加10%。
| 珠重新悬浮混合 | 体积 (μL) |
| 杂交缓冲器 | 8.5 |
| 杂交缓冲器增强剂 | 2.7 |
| 无核酸水 | 5.8 |
| 总容量 | 17 |
表14:珠重新悬浮混合。根据所示体积,应在室温下组装和混合珠重新悬浮混合物的部件。
16. 准备链球菌珠
- 在室温下平衡链球菌珠,在使用前至少30分钟。通过涡旋15s和等分50μL的珠子,将珠子彻底混合到无核酸酶PCR管中。
- 在每个管中加入 100 μL 的 1x 珠洗液缓冲液(步骤 15.1 中准备)。轻轻上下移液10次混合。将管子放在磁性机架上,使磁珠与上清液完全分离。
- 拆下并丢弃清除的上清液。小心不要打扰珠子。
- 执行以下洗涤。
- 从磁性机架上拆下。将100 μL的1x珠洗液缓冲液加入每个含有珠子的管中,然后上下移液10次混合。
- 将管子放在磁性机架中,使磁珠与上清液完全分离。
- 小心地取出并丢弃清除的上清液。
- 重复步骤 16.4 一次,共两次。
- 从磁性机架上拆下。从步骤 15.3 向每个管中添加 17 μL 的珠重悬浮混合物。上下移液几次彻底混合。确保珠子没有卡在管的侧面。如果需要,短暂地旋转管子以收集底部的珠子。
17. 将杂交靶与链球菌珠结合
- 完成 4 小时杂交孵育后,从热循环器中取出样品,并将热循环器设置为 65°C 孵育,加热盖设置为 70°C。
- 使用多通道移液器,将 17 μL 完全均质珠转移到样品。通过上下移液10次彻底混合。
- 将DNA与珠子结合,按照程序#10(补充表2)将管子放入热循环器中。在孵育过程中,每隔10-12分钟短暂取出带状管,轻轻涡旋3秒,以确保珠子保持悬浮状态。或者,通过上下移液多次混合。立即前往洗涤链球菌珠(步骤 18)。
18. 清洗链球菌珠去除未结合的DNA
- 使用步骤 15.2 中的 1x 洗涤缓冲液,并在洗涤过程中将加热缓冲液存放在热循环器中。
- 从步骤 17.3 向管中添加 100 μL 预热的 1x 洗涤缓冲液 1。通过上下移液10次彻底混合。将管子放在磁性机架上,使磁珠与上清液完全分离。
- 移液器并丢弃上清液,它含有未绑定的DNA。从磁性机架上拆下。
- 执行以下 65°C 洗涤。
- 加入150 μL的预热1x严格洗涤缓冲液。
- 通过上下移液至少10次彻底混合。在移液过程中避免气泡。确保所有管中都完全重新悬浮珠子。
- 在 65°C 的热循环器中孵育 5 分钟。
- 将管子放在磁性机架上,使磁珠与上清液完全分离。移液器并丢弃上清液,它含有未绑定的DNA。从磁性机架上拆下。
- 重复步骤 18.4,总共两次严格扫描。
- 执行第一次室温洗。
- 加入150 μL室温1x洗涤缓冲液1。
- 上下移移 10 到 20 次,以完全重新悬浮珠子。
- 密封管并孵育2分钟,在轻轻涡旋30秒和休息30秒之间交替。确保所有井中的珠子在整个孵育过程中在所有管中完全悬浮。
- 短暂地使管离心。
- 将管子放在磁性机架上,使磁珠与上清液完全分离。移液并丢弃上清液。
- 密封管并短暂离心。返回磁性机架并使用 10 μl 移液器去除任何残留洗涤缓冲液。
- 执行第二个室温洗。
- 加入150μL的室温1x洗涤缓冲液2。
- 上下移移 10 到 20 次,以完全重新悬浮珠子。
- 密封管并孵育2分钟,在轻轻涡旋30秒和休息30秒之间交替。确保所有井中的珠子在整个孵育过程中在所有管中完全悬浮。
- 短暂地使管离心。
- 转移在洗涤缓冲液2中重新悬浮的整个珠子体积,以清洁无核酸酶的PCR管。重要提示:将珠子转移到新鲜管中对于避免非目标污染非常重要。
- 将管子放在磁性机架上,使磁珠与上清液完全分离。移液并丢弃上清液。
- 密封管并短暂离心。返回磁性机架并使用 10 μl 移液器去除任何残留洗涤缓冲液。
- 执行第三室温洗。
- 加入150 μL室温1x洗涤缓冲液3。
- 上下移移 10 到 20 次,以完全重新悬浮珠子。
- 密封管并孵育2分钟,在轻轻涡旋30秒和休息30秒之间交替。确保所有井中的珠子在整个孵育过程中在所有管中完全悬浮。
- 短暂地使管离心。
- 将管子放在磁性机架上,使磁珠与上清液完全分离。移液并丢弃上清液。
- 密封管并短暂离心。返回磁性机架并使用 10 μL 移液器去除任何残留洗涤缓冲液。
- 从磁性机架中取出,向磁珠中加入 20 μL 无核酸酶水。
- 上下移液10次,以确保任何珠子卡在管的一侧已重新悬挂。
- 重要提示:请勿丢弃珠子。在步骤 19 中使用整个 20 μL 的重新悬浮珠子,并捕获DNA。
19. 执行最终、捕获后 PCR 浓缩
- 根据下表准备捕获后 PCR 主组合,乘以所需样本数,并额外添加 10%。
| 捕获后 PCR 主混合组件 | 体积 (μL) |
| 捕获后 PCR 主混合 | 25 |
| 捕获后 PCR 底漆组合 | 1.25 |
| 无核酸水 | 3.75 |
| 总容量 | 30 |
表 15:捕获后 PCR 主组合。捕获后 PCR 主混合组件应根据显示的体积在冰上组装和混合。
- 在每个样品中加入30μL的捕获后PCR主混合物,最终反应体积为50μL。通过上下移液10次彻底混合。
- 将 PCR 管放入热循环器中,按照计划#11进行孵育(补充表 2)。
20. 净化捕获后 PCR 碎片
- 在使用前,让 SPRI 珠加热至室温至少 30 分钟,然后涡旋 SPRI 珠约 30 秒重新悬浮。
- 在每个PCR富集捕获(50 μL)中加入75 μL的再悬浮珠子。通过上下移液至少10次,将混合良好。链球菌珠不会干扰SPRI珠的纯化。在室温下孵育5分钟。
- 在微离心机中短暂旋转管,并将管放在磁性机架上,将珠子与上清液分离。溶液清除后,小心地取出并丢弃上清液。小心不要打扰含有DNA的珠子。
- 在磁性机架中,将 180 μL 新鲜制备的 80% 乙醇添加到管中。在室温下孵育30s,然后小心地取出并丢弃上清液。
- 重复步骤 20.4 一次,共执行 2 个洗涤步骤。
- 完全去除残留乙醇。将管子放在磁性机架上,在盖子打开后晾干 3 分钟,或直到明显干燥。不要过度干燥珠子。这可能导致DNA的恢复率降低。
- 从磁铁上取下管子。通过加入22 μL的0.1x TE缓冲液,从珠子中释放DNA。通过上下多次移液,将混合良好。在室温下孵育2分钟。将管子放在磁性机架上,直到溶液清除。
- 去除20μL的上清液,并转移到一个干净的无核酸酶PCR管,小心不要干扰珠子。这是协议中的一个可选停止点,库可能存储在 -20°C。
21. 验证和量化库
- 使用荧光计和高灵敏度测定套件测量捕获的库的浓度。
- 使用数字电泳高灵敏度DNA芯片测量捕获库的平均片段长度,并使用系统软件计算每个库的平均片段大小。平均片段大小应约为 250-400 bp(参见代表性结果,图 6和图7)。这是协议中的一个可选停止点,已完成的库可以存储在 -20°C。
22. 测序平台上的测序
- 对于排序,将库稀释到 2 nM,并遵循制造商加载和操作音序器的指南。序列库到最小深度为 1500 万的单端读取至少 50 bp 的长度。
23. 使用棱镜门户(基于云的信息学工具)分析测序数据以生成免疫配置文件和发现生物标志物
- 通过访问https://prism.cofactorgenomics.com/创建棱镜帐户
- 登录后,单击 Prism 中任何页面顶部工具栏中的"提交新项目"以上载已解构的 FASTQ 排序文件,或使用棱镜帐户上载存储在 BaseSpace 上的文件。
- 填写"新项目"窗体,包括项目名称以及按组或组组进行的示例。生成生物标志物发现报告时,需要对样本的分组和相应的分组名称。请注意,每组至少需要 3 个样本才能生成生物标志物发现报告。单击"启动应用程序"按钮提交表单;如果成功,将显示一个确认页面。
- 登录时,单击顶部工具栏或棱镜的任何页面中的结果。Prism 使用户能够查看已提交项目的状态,并查看每个项目的样本和生物标志物报告。将有一个用户在棱镜上创建的项目表。该表有三列用于状态、名称和提交日期。
注: 每个项目的状态可以是:
• "运行",其中项目分析当前正在运行,或者,
• "成功",其中项目分析已完成,报告可用。 - 如果项目已完成分析(以"成功"状态表示),请查看单个示例报告和生物标志物发现报告。请注意,只有当项目包含每组所需的至少三个样本时,生物标志物发现报告才可用。
- 要访问这些报告,请返回到项目表并单击项目名称。在"项目"页上,将有一个表,其中每个示例都有一行。单击"报表"列下每一行中的链接,以访问每个示例的"单个报表"。在表格的下方,单击生物标志物发现报告的链接。如果此页面中没有链接,则项目尚未完成分析。
结果
在整个协议中有许多检查点,使用户能够评估生成的材料的质量和数量。按照协议中描述的步骤 12,生成电象图,如图3所示,代表完整RNA样本的典型预捕获库(RIN = 7.8)。
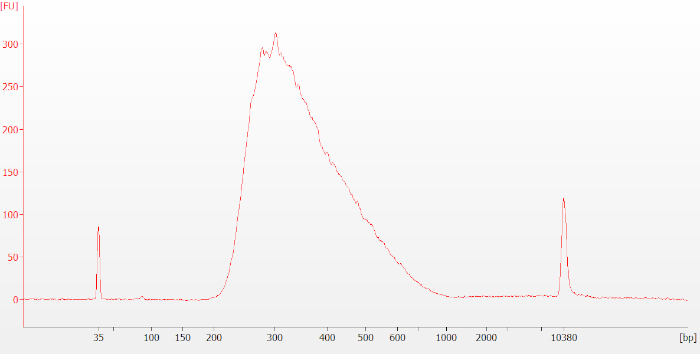
图3:完整RNA样品的典型预捕获库生物分析仪迹。预捕获库在大小约为 250-400 个碱基对 (bp) 时显示为一个宽峰值。请点击此处查看此图的较大版本。
应注意避免过度放大,如图4所示的约1,000 bp的第二个峰值所示,这是从FFPE RNA样本(DV200 = 46)生成的预捕获库的代表性电检图。如果此峰值相对于主峰值(如图所示约为 250-400 个碱基对 (bp)))较小,则不会影响下游步骤或分析。如果第二个峰值相对于 250-400 bp 峰值较大,则可以用更少的 PCR 周期重新制作预捕获库,以减少过度放大。

图4:FFPE RNA样品的典型预捕获库生物分析仪跟踪。第二个峰值在1,000 bp附近,表明过度放大。如果此峰值相对于主峰值在 250-400 bp 附近较小(如图所示),则不会影响下游步骤或分析。如果第二个峰值相对于 250-400 bp 峰值较大,则可以用更少的 PCR 周期重新制作预捕获库,以减少过度放大。请点击此处查看此图的较大版本。
如步骤 12.1.3 中所述,应评估适配器二聚器的存在,以确定是否需要进行额外的清理。图5所示的电表图代表不可接受的(图5A,DV200=33)和可接受的(图5B,DV200=46)的适配器二分器水平,显示为128 bp左右的尖峰。
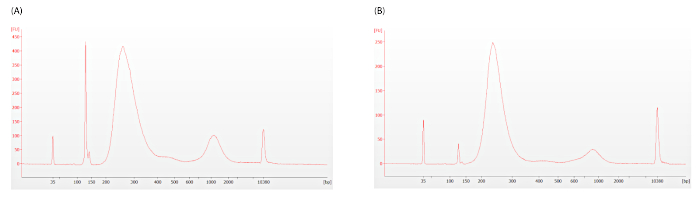
图 5:预捕获库生物分析仪跟踪。适配器二聚体以大约128 bp.(A) 的尖峰出现, 电表图中存在过多的适配器二聚体.(B) 可接受的适配器二聚位器水平在此跟踪中描述。这两种痕迹都显示出轻度过度扩增的证据,但这不应干扰免疫Prism测定。请点击此处查看此图的较大版本。
在协议完成之前,在测序之前,使用数字电泳再次评估最终库。由 FFPE RNA 制成的文库的平均大小分布往往小于由完整 RNA 制成的文库。对于完整的RNA样本,结果的跟踪应类似于图6(RIN = 9.5)。对于降解或 FFPE RNA,生成的跟踪应类似于图 7(DV 200 = 36)。
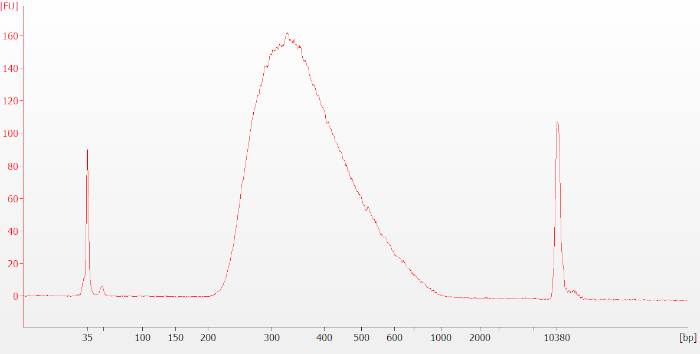
图6:完整RNA样品的典型最终库生物分析仪迹。最终库在大小约为 250-400 个碱基对 (bp) 时显示为一个宽峰值。请点击此处查看此图的较大版本。
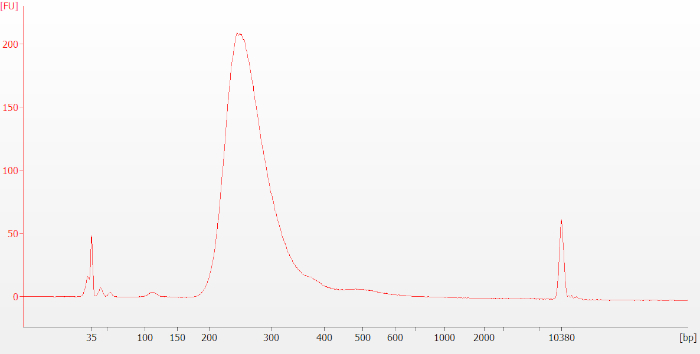
图7:FFPE RNA样品的典型最终库生物分析仪跟踪。由 FFPE RNA 制成的文库的平均大小分布往往小于由完整 RNA 制成的文库。请点击此处查看此图的较大版本。
如上所述,使用该协议生成的结果可能以两种关键方式应用,如图8所示。

图 8:协议的两个用例。此免疫分析测定产生的结果应用于两个关键的转化应用。(A) 第一个用例从人体固体肿瘤组织(包括FFPE档案)开始,为样本生成单独的免疫配置文件。(B) 一旦生成一组人类样本,数据将结合使用棱镜门户生成多维生物标记物和相应的生物标志物报告。请点击此处查看此图的较大版本。
为了演示每个用例,包含来自小型翻译研究的代表性数据21。本研究中使用的样本是7例诊断和治疗非小细胞肺癌(NSCLC)患者的样本。样本是治疗前和治疗后活检中患者匹配的固体肿瘤组织。首先,对单个样本进行分析以生成免疫配置文件,如图9所示的示例报告。

图9:NSCLC样本的个体免疫报告示例。Prism Portal 管道为每个已处理的样本生成图形报告,并在此处为 NSCLC 固体肿瘤样本生成代表性报告。(A) 报告的正面以图形方式描述了从FFPE组织中提取的RNA样本中免疫细胞的分解。(B) 报告的反面包括免疫细胞表(绝对百分比)和逃逸基因表达(以千万分之一转录本或TPM计算),以及测定的性能说明。请点击此处查看此图的较大版本。
治疗前和治疗后的免疫图谱可用于了解治疗(化疗或放疗,在这项研究中)如何改变肿瘤微环境。图10显示了一个示例,其中单个患者在化疗前和化疗后显示每个免疫细胞的百分比变化和总免疫含量的变化。

图 10:治疗前和后处理结果示例。显示单个 NSCLC 患者从治疗前和治疗后样本生成的单个免疫细胞和总免疫内容数据。在此示例中,患者接受化疗方案作为治疗。请点击此处查看此图的较大版本。
患者可以按临床结果或表型等标准进行分组进行比较。例如,在图11中,NSCLC研究中的样本根据治疗后疾病进展的时间进行了比较。一部分患者在>18个月内出现疾病复发,另一个子集在+18个月内进展得更快。比较每个样本的中位增量值(治疗前和治疗后值之间的差异),以识别疾病进展的假定生物标志物。
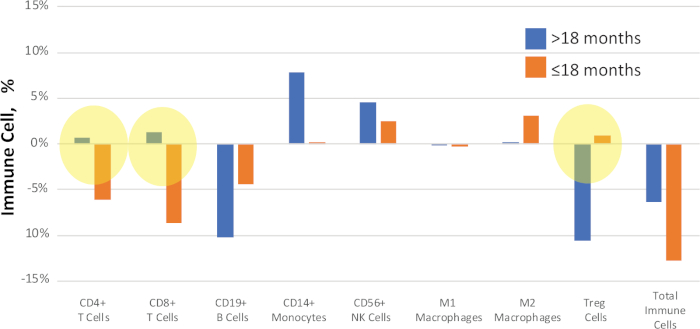
图11:临床结果比较示例。在匹配的治疗前和治疗后NSCLC样本中,免疫细胞百分比之间的定量变化被计算并报告为"delta"值。那些以黄色突出显示的表示出生存状态之间的明确信号变化。蓝色条表示 >18 个月的中值增量值,直到疾病进展,橙色条表示 ±18 个月的中值增量值,直到疾病进展。请点击此处查看此图的较大版本。
最后,类似的样本分组可用于专门查看预处理样品,通过使用棱镜门户生成生物标志物报告来识别预测性生物标志物。如图12所示,上述相同的临床表型(疾病进展)定义了样本分组。在此示例中,两个免疫逃逸基因被确定为样本分组(CD47 和 OX40,如图12A的下面板所示)的统计显著性区分。在此示例中,由于单个基因生物标志物具有强大的、具有明确的统计意义,多维生物标记物不会增加显著的预测值(如图12B的右上角条形图中标记的 ImmunoPrism)。完整的数据表,包括所有18个分析物的测定结果,在报告的反面进行汇总,包括统计分析和简要方法摘要。
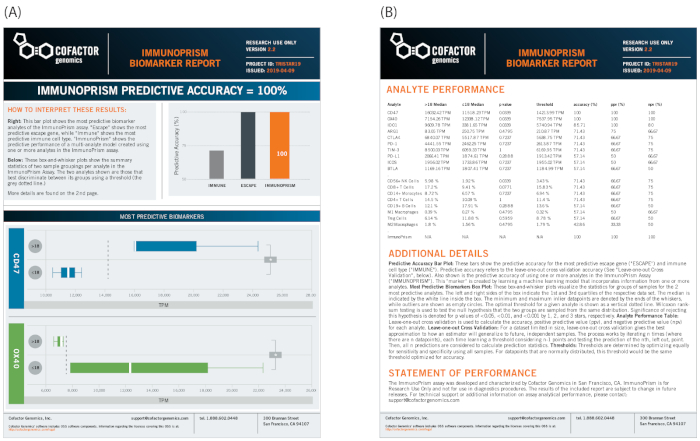
图12:NSCLC样品生物标志物报告示例。生物标志物发现管道提供单个生物标志物的可视化报告,以及机器学习多维生物标志物,并详细统计。(A) 在这项研究中,管道确定了两个单独的生物标志物(CD47和OX40),用于确定阈值为18个月的疾病进展。(B) 有关方法及全部结果的详情载于报告的反面。请点击此处查看此图的较大版本。
补充表1:试剂盒材料。列出了免疫公关套件中提供的材料列表,以及制造商协议中引用的部件号。所需所有其他设备和材料均列在"材料表"中。访问https://cofactorgenomics.com/product/immunoprism-kit/,查看安全数据表 (SDS)。请点击此处查看此文件(右键单击下载)。
补充表2:热循环器程序。为了便于编程,总结了整个协议中引用的推荐循环程序程序。请点击此处查看此文件(右键单击下载)。
补充表3:排序索引指南。列出了试剂盒中提供的索引引种;在测序后去复用的每个反应中添加独特的引解剂。还提供推荐的低级多路复用组合。请点击此处查看此文件(右键单击下载)。
讨论
该协议需要20纳克完整或40纳克高降解(FFPE)RNA。RNA样品应不含DNA、盐(如Mg2+或二元盐)、二价阳合剂(如EDTA、EGTA、锡酸盐)或有机物(如酚和乙醇)。不建议继续进行具有 DV200 <20% 的 RNA 样本。强烈建议使用试剂盒内控制RNA,因为这些控件提供了一种评估整个协议性能的方法,从库制备到分析。
该协议设计为使用 0.2 mL PCR 带管执行。如果愿意,也可以使用96孔PCR板中的井执行该协议。只需使用 96 孔 PCR 板的孔代替 PCR 管或带管的所有参考。仅使用带有透明孔的 PCR 板,因为在珠子净化和洗涤步骤期间,目视确认珠子完全重新悬浮至关重要。
在整个协议中,除非另有说明,否则将试剂冷冻或放在冰上。在试剂完全解冻之前,请勿使用试剂。使用前,请务必彻底混合所有试剂。
将酶保持在-20°C,直到准备好使用,使用后迅速返回到-20°C。仅使用分子级无核酸酶水;不建议使用DEPC处理的水。移液混合时,轻轻吸气并分配至少总体积的50%,直到溶液充分混合。移液器混合所有含有酶的主混合物。使用涡旋混合酶可能导致变性,并损害其性能。在珠子纯化过程中,使用分子级乙醇中新鲜制成的80%乙醇溶液。使用不新鲜的乙醇溶液可能会导致产量降低。避免过度干燥珠子,因为这样会降低洗脱效率(如果珠子干燥,看起来会裂开)。
如步骤 10 中所述,每个反应中都会添加唯一的索引引出。根据这些索引的顺序,对于低级多路复用,某些索引组合是最佳的。这些索引的序列是数据后排序的解数化所必需的。补充表3提供了序列和推荐的多路复用组合。在同一步骤中,必须注意,推荐的PCR周期数量因使用的RNA质量而异,并且可能需要一些优化来防止PCR过度扩增。对于免疫Prism控制RNA和其他高质量RNA,开始优化与10PCR周期。对于免疫Prism FFPE控制RNA和其他高降解/FFPERNA,开始优化与15PCR周期。建议使用要分析的材料的RNA代表生成测试库,以优化PCR周期。应使用一致产生足够预捕获库产量(>200 ng)的最小 PCR 周期数。生物分析仪追踪图上约1000 bp的二次峰值表示过度放大(图4)。应尽量减少过度放大,但小次峰的存在不会干扰检测结果。
为了尽量减少样品损失和避免开关管,步骤13可以在PCR管、带状管或96孔PCR板中执行,而不是1.5 mL微管,如果您的真空集中器允许的话。转子可以在许多集中器上拆下。这使得带材管或板能够安装在真空中。然后,可以使用无离心的水干燥设置运行真空浓度。有关您的真空集中器的说明,请参阅手册。如果样品在带状管或96孔板中干燥,杂交步骤可以在同一容器中执行。
在步骤 17 期间,确保每 10-12 分钟涡旋一次,以提高珠子捕获效率。混合时,小心地握住暖带管的盖,以防止管打开。
步骤 18 中描述的清污对于避免高非特定污染至关重要,必须密切遵循。确保每次清洗时完全重新悬浮珠子,完全去除洗涤缓冲液,在洗涤缓冲液 2 洗涤过程中,将样品转移到新鲜的带管中(步骤 18.6.5)。确保链球菌珠在整个孵育过程中完全重新悬浮并保持悬浮状态。溅到管盖上不会对捕获产生负面影响。在室温下液中,微板涡旋混合器可用于在两分钟的孵育期内涡旋样品,以便更容易再悬浮。不要让链球菌珠干涸。如果需要,在缓冲液中延长孵育,以避免珠子干燥。如果使用多个带状管,则每次清洗时使用一条管,而另一个带管则位于热循环器中。这可以帮助避免过度干燥珠子或冲,导致不良的重新悬浮或其他次优技术。对于首次用户,不建议一次处理超过 8 个库反应。
当前的免疫分析技术提供了一系列信息 - 从数千个需要重要解释(RNA测序)的数据点到单个离散数据点(单丛IHC)。此处描述的协议表示一种位于中间位置的方法,其集中范围可实现高灵敏度,但仅捕获临床相关转录组数据的子集。由于散装RNA提取的性质,该协议不提供有关免疫细胞和肿瘤微环境之间的空间关系的信息,但是,结果可以补充成像技术来添加这些信息。该协议生成的数据有无数的应用,因为关于癌症作为一种疾病的生物学和正在开发的治疗它的疗法,有许多值得学习的知识。如代表性结果所示,个人免疫报告有助于了解患者的免疫状况如何因疾病进展或治疗等事件而发生变化。虽然这里提供的结果提供了一些示例用例,但其他应用,包括调查治疗的作用机制和识别临床结果的假定生物标志物,如无进展和整体生存也实际。在生物标志物发现应用中使用该协议时,必须实践良好的研究设计,以确保分析同质种群,包括足够的样本,用于统计能力,并考虑偏置源。由于测定的集中性、流线型,因此,一旦发现这些生物标志物,就有可能实现临床验证和下游应用。
披露声明
所有作者都受雇于共同因素基因组公司,该公司开发和生产免疫普原试剂试剂盒和信息学工具在本文中使用。免疫Prism测定仅供研究使用,不用于诊断程序。
致谢
作者希望感谢三星科技集团为具有代表性的结果提供生物标本,以及共同因素基因组学的整个分子、分析、产品和商业团队,以表彰他们的技术专长和支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR 8 tube strip | USA Scientific | 1402-2700 | USA Scientific 0.2 mL PCR 8-tube strip |
| 200 Proof Ethanol | MilliporeSigma | EX0276-1 | Prepare 80% by mixing with nuclease-free water on the day of the experiment |
| 96-well thermal cyclers | BioRad | 1861096 | |
| Solid-phase Reversible Immobilization (SPRI) Beads | Beckman-Coulter | A63882 | Agencourt AMPure XP – PCR Purification beads |
| Digital electrophoresis chips and kit | Agilent Technologies | 5067-4626 | Agilent High Sensitivity DNA chips and kit |
| Digital electrophoresis system | Agilent Technologies | G2939AA | Agilent 2100 Electrophoresis Bioanalyzer |
| Streptavidin Beads | ThermoFisher Scientific | 65306 | Dynabeads M-270 Streptavidin |
| ImmunoPrism Kit – 24 reaction | Cofactor Genomics | CFGK-302 | Cofactor ImmunoPrism Immune Profiling Kit – 24 reactions |
| Human Cot-1 DNA | ThermoFisher Scientific | 15279011 | Invitrogen brand |
| Magnetic separation rack | Alpaqua/Invitrogen | A001322/12331D | 96-well Magnetic Ring Stand |
| Microcentrifuge | Eppendorf | 22620701 | |
| Microcentrifuge tubes | USA Scientific | 1415-2600 | USA Scientific 1.5 mL low-adhesion microcentrifuge tube |
| NextSeq550 | Illumina | SY-415-1002 | Any Illumina sequencer may be used for this protocol |
| Nuclease-free water | ThermoFisher Scientific | AM9937 | |
| Prism Extraction Kit | Cofactor Genomics | CFGK-401 | Cofactor Prism FFPE Extraction Kit – 24 samples |
| Purified RNA | - | - | Purified from human tissue samples |
| Fluorometer | ThermoFisher Scientific | Q33226 | Qubit 4 System |
| Fluorometric Assay Tubes | Axygen | PCR-05-C | 0.5mL Thin Wall PCR Tubes with Flat Caps |
| High Sensitivity Fluorometric Reagent Kit | Life Technologies | Q32854 | Qubit dsDNA HS Assay Kit |
| Vacuum concentrator | Eppendorf | 22820001 | VacufugePlus |
| Vortex mixer | VWR | 10153-838 | |
| Water bath or heating block | VWR/USA Scientific | NA/2510-1102 | VWR water bath/USA Scientific heating block |
参考文献
- Brambilla, E., et al. Prognostic Effect of Tumor Lymphocytic Infiltration in Resectable Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. 34 (11), 1223-1230 (2016).
- Iacono, D., et al. Tumour-infiltrating lymphocytes, programmed death ligand 1 and cyclooxygenase-2 expression in skin melanoma of elderly patients: clinicopathological correlations. Melanoma Research. 28 (6), 547-554 (2018).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nature Reviews Clinical Oncology. 14 (12), 717-734 (2017).
- Sierant, M. C., Choi, J. Single-Cell Sequencing in Cancer: Recent Applications to Immunogenomics and Multi-omics Tools. Genomics Inform. 16, (2018).
- Klauschen, F., et al. Scoring of tumor-infiltrating lymphocytes: From visual estimation to machine learning. Seminars in Cancer Biology. 52 (Pt 2), 151-157 (2018).
- Danaher, P., et al. Gene expression markers of Tumor Infiltrating Leukocytes. Journal for ImmunoTherapy of Cancer. 5, 18 (2017).
- Aran, D., Hu, Z., Butte, A. J. xCell: digitally portraying the tissue cellular heterogeneity landscape. Genome Biology. 18 (1), 220 (2017).
- Newman, A. M., et al. Robust enumeration of cell subsets from tissue expression profiles. Nature Methods. 12 (5), 453-457 (2015).
- Becht, E., et al. Estimating the population abundance of tissue-infiltrating immune and stromal cell populations using gene expression. Genome Biology. 17 (1), 218 (2016).
- Newman, A. M., Gentles, A. J., Liu, C. L., Diehn, M., Alizadeh, A. A. Data normalization considerations for digital tumor dissection. Genome Biology. 18 (1), 128 (2017).
- Chen, S. H., et al. A gene profiling deconvolution approach to estimating immune cell composition from complex tissues. BMC Bioinformatics. 19 (Suppl 4), 154 (2018).
- Yoshihara, K., et al. Inferring tumour purity and stromal and immune cell admixture from expression data. Nature Communications. 4, 2612 (2013).
- Foley, J. W., et al. Gene-expression profiling of single cells from archival tissue with laser-capture microdissection and Smart-3SEQ. Genome Research. , (2019).
- Civita, P., et al. Laser Capture Microdissection and RNA-Seq Analysis: High Sensitivity Approaches to Explain Histopathological Heterogeneity in Human Glioblastoma FFPE Archived Tissues. Front Oncol. 9, 482 (2019).
- . PD-L1 in cancer: ESMO Biomarker Factsheet | OncologyPRO Available from: https://oncologypro.esmo.org/Education-Library/Factsheets-on-Biomarkers/PD-L1-in-Cancer (2019)
- Haslam, A., Prasad, V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Network Open. 2 (5), e192535 (2019).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews Immunology. 12 (3), 191-200 (2012).
- Schillebeeckx, I., et al. Analytical Performance of an Immunoprofiling Assay Based on RNA Models. Association for Molecular Pathology 2019 Annual Meeting. Journal of Molecular Diagnostics. 21, (2019).
- Uryvaev, A., Passhak, M., Hershkovits, D., Sabo, E., Bar-Sela, G. The role of tumor-infiltrating lymphocytes (TILs) as a predictive biomarker of response to anti-PD1 therapy in patients with metastatic non-small cell lung cancer or metastatic melanoma. Medical Oncology. 35 (3), 25 (2018).
- Wang, K., Shen, T., Siegal, G. P., Wei, S. The CD4/CD8 ratio of tumor-infiltrating lymphocytes at the tumor-host interface has prognostic value in triple-negative breast cancer. Human Pathology. 69, 110-117 (2017).
- Carney, W. P., Bhagat, M., LaFranzo, N. Multidimensional gene expression models for characterizing response and metastasis in solid tumor samples [abstract]. American Association for Cancer Research Annual Meeting. Cancer Research. 79 (13 Suppl), (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。