Method Article
النمذجة المناعية التنبؤية للأورام الصلبة
In This Article
Summary
يتم وصف استخدام نهج قائم على الحمض النووي الريبي لتحديد الملامح المناعية الكمية لأنسجة الأورام الصلبة والاستفادة من الأتراب السريرية لاكتشاف العلامات الحيوية المناعية للأورام من خلال بروتوكولات الجزيئية والمعلوماتية.
Abstract
تظهر العلاجات المناعية وعدًا في علاج مرضى الأورام ، ولكن التغايرية المعقدة للبيئة الدقيقة للورم تجعل التنبؤ باستجابة العلاج أمرًا صعبًا. وقد ثبت أن القدرة على حل التجمعات النسبية للخلايا المناعية الموجودة في وحول أنسجة الورم ذات صلة سريرية بفهم الاستجابة ، ولكنها محدودة بالتقنيات التقليدية مثل قياس التدفق الخلوي والكيمياء المناعية ( المدينة العالمية للخدمات الإنسانية)، نظرا لكمية كبيرة من الأنسجة المطلوبة، وعدم وجود علامات دقيقة نوع الخلية، والعديد من العقبات التقنية واللوجستية. واحد من الاختبارات (على سبيل المثال، والمناعية المناعة التنميط الاختبارات) يتغلب على هذه التحديات من خلال استيعاب كل من كميات صغيرة من الجيش الملكي النيبالي والحمض النووي الريبي المتدهورة للغاية، والسمات المشتركة للحمض النووي الريبي المستخرجة من الأنسجة الورم الصلبة المحفوظة سريريا. يتم الوصول إلى الاختبار من خلال مجموعة عوامل الكاشف والمعلوماتية المستندة إلى السحابة التي توفر حلًا كميًا عالي الإنتاجية للتنميط المناعي لمنصات تسلسل Illumina. يبدأ الباحثون ببضعة أقسام قليلة من البارافين المثبتة المثبتة (FFPE) الأنسجة أو 20-40 نانوغرام من إجمالي الحمض النووي الريبي (اعتمادا على جودة العينة)، والبروتوكول يولد تقرير الشخصية المناعية تحديد ثمانية أنواع الخلايا المناعية والهروب المناعي عشرة الجينات ، والتقاط وجهة نظر كاملة من microenvironment الورم. ولا يلزم إجراء تحليل إضافي للمعلوماتية الحيوية للاستفادة من البيانات الناتجة. مع الأفواج عينة المناسبة، يمكن أيضا استخدام البروتوكول لتحديد المؤشرات الحيوية ذات دلالة إحصائية ضمن السكان المرضى ذات الأهمية.
Introduction
القياس الكمي للخلايا الليمفاوية المتسللة للورم (TILs) والجزيئات الأخرى ذات الصلة بالمناعة في الفورمالين الثابتة والبارافين المضمنة (FFPE) أظهرت عينات الأنسجة البشرية للورم الصلب قيمة في البحوث السريرية1،2،3. التقنيات الشائعة مثل قياس التدفق الخلوي وتسلسل الحمض الريبي النووي أحادي الخلية (RNA) مفيدة للأنسجة الطازجة والدم4، ولكنها غير مناسبة لتحليل مواد FFPE بسبب عدم القدرة على إنشاء تعليق خلية قابلة للحياة. الأساليب الحالية التي تم استخدامها لتحديد هذه الخلايا في أنسجة FFPE تعاني من تحديات كبيرة. تتطلب الكيمياء المناعية (IHC) وغيرها من مهام سير العمل التصويرية المماثلة أجسامًا مضادة محددة للكشف عن بروتينات سطح الخلية ، والتي قد يكون من الصعب توحيدها عبر المختبرات لتمكين القياس الكمي القابل للتكرار5. منصات مثل نظام nCounter تعتمد على التعبير عن جينات واحدة لتحديد الخلايا المناعية الرئيسية6، والحد من حساسية وخصوصية الكشف. أكثر عام أساليب تسلسل الجيش الملكي النيبالي، إلى جانب أدوات البرمجيات المستقلة، متوفرة ولكن تتطلب التحسين والتحقق من الصحة كبيرة قبل استخدام7،8،9،10،11،12. وقد أظهرت التطورات الأخيرة في الجمع بين الميكروديس التقاط الليزر (LCM) مع تسلسل الحمض النووي الريبي لأنسجة FFPE واعدة; ومع ذلك ، مطلوب حل تسليم المفتاح أكثر إنتاجية للدراسات الانتقالية التي تهدف إلى تحديد المؤشرات الحيوية القوية13،14. أساليب توليد المؤشرات الحيوية متعددة الأبعاد، مثل النمذجة المناعية التنبؤية، التي تحدد أفواج المرضى بما في ذلك المستجيبين العلاج، والأنواع الفرعية للسرطان، أو نتائج البقاء على قيد الحياة مع دقة تنبؤية عالية وأهمية إحصائية أصبحت ذات أهمية متزايدة في عصر الطب الدقيق والعلاج المناعي15،16.
ولتلبية هذه الحاجة، تم تطوير فحص التنميط المناعي لتمكين التحديد الكمي الحساس والمحدد للخلايا المناعية في أنسجة FFPE الورم الصلبة باستخدام الكواشف الموحدة لتسلسل الحمض النووي الريبي والمعلوماتية المستندة إلى السحابة. بالإضافة إلى استيعاب الحمض النووي الريبي المتدهور من أنسجة FFPE ، فإن البروتوكول قادر على استيعاب الحمض النووي الريبي المشتق من عينات الأنسجة الحدية مثل خزعات الإبر الأساسية ، واستنشاق الإبر ، والأنسجة المجهرية أو الكلية. تتم مقارنة بيانات الحمض النووي الريبي من كل عينة بقاعدة بيانات لنماذج التعبير الجيني للخلايا المناعية، تسمى نماذج التعبير الصحي المناعي، لتحديد الخلايا المناعية كنسبة مئوية من إجمالي الخلايا الموجودة في العينة. باختصار ، تم بناء هذه النماذج باستخدام أساليب التعلم الآلي لتحديد أنماط التعبير الفريدة متعددة الأعراق من بيانات النسخ الكامل الناتجة عن مجموعات الخلايا المناعية النقية (معزولة باستخدام علامات سطح الخلية الكنسية)17،18. نماذج التعبير الصحي متعددة الأبعاد الكامنة وراء التكنولوجيا تمكن من فحص لتحديد كل خلية مناعية في المئة من مجموع الخلايا الموجودة في خليط غير متجانس. وهذا يمكّن الباحث من إنشاء مقارنات بين الخلايا المناعية وداخل العينة ، والتي ثبت أن لها قيمة سريرية19،20. وتشمل التطبيقات الأخرى القياس الكمي للاستجابة المناعية قبل وبعد العلاج، كما هو موضح في النتائج التمثيلية. تقارير عن دراسة سمات متعددة من السياقات المناعية للورم والبيئة الدقيقة للورم بما في ذلك النسب المئوية المطلقة من ثمانية أنواع الخلايا المناعية (المستمدة من نماذج التعبير الجيني): CD4+ الخلايا T، CD8+ الخلايا التائية، CD56+ الخلايا القاتلة الطبيعية، CD19+ B الخلايا، CD14+ monocytes، Tregs، M1 الضامة، وM2 الضامة. بالإضافة إلى ذلك، تقارير النسخة المحددة التعبير (في النصوص لكل مليون، أو TPM) من عشر جينات الهروب المناعي: PD-1، PD-L1، CTLA4، OX40، TIM-3، BTLA، ICOS، CD47، IDO1، و ARG1.
يتم استخدام مجموعة الكاشف لجعل المكتبات عالية الجودة جاهزة للتسلسل على منصة Illumina باتباع طريقة إعداد مكتبة هجينة تعتمد على الالتقاط ، كما هو موضح في الشكل 1. إذا لم يكن لدى الباحث منصة تسلسل Illumina في مختبره ، فقد يقدم عيناته إلى مختبر أساسي للتسلسل. وبمجرد توليدها، يتم تحميل بيانات التسلسل إلى بوابة Prism لتحليلها آليًا، ويتم إرجاع ملف تعريف كمي شامل لكل عينة فردية، في شكل تقرير المناعة(الشكل 2A)،إلى المستخدم. يمكن للمستخدمين أيضًا تعريف مجموعات العينات في بوابة Prism لإنشاء تقرير العلامات الحيوية(الشكل 2B)، مع تسليط الضوء على المؤشرات الحيوية ذات الأهمية الإحصائية التي تميز مجموعتين من المرضى. والأهم من ذلك أن البيانات التي تم إنشاؤها بواسطة مجموعة الكاشف هي للاستخدام البحثي فقط ولا يجوز استخدامها لأغراض التشخيص.

الشكل 1: نظرة عامة على سير العمل. في هذا البروتوكول، يتم تحويل الحمض النووي الريبي أولاً إلى cDNA. يتم ربط محولات التسلسل ، ويتم تضخيم cDNA المحول - ليغاتيد وباركوديد من قبل PCR لإنشاء مكتبة ما قبل الالتقاط. ثم يتم تهجين المجسات Biotinylated إلى أهداف cDNA محددة والتي يتم التقاطها بعد ذلك باستخدام حبات ستريبتافيفيسين. تتم إزالة cDNA غير المنضمة وغير المستهدفة عن طريق الغسيل. ينتج عن تخصيب PCR النهائي مكتبة ما بعد الالتقاط جاهزة للتسلسل. * يجب أن يكون مجموع الحمض النووي الريبي من عينات بشرية؛ قد تكون سليمة أو المتدهورة (FFPE) RNA. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تقارير المناعة التمثيلية. يقوم سير العمل بإنشاء تقريرين، وتقرير مناعة فردي(A)لكل عينة تتم معالجتها، وتقرير علامة بيولوجية(B)لأفواج المرضى المحددة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
يتطلب البروتوكول حوالي 16 ساعة من وقت التحضير (من إجمالي الحمض النووي الريبي إلى المكتبات الجاهزة للتسلسل)؛ ومع ذلك، هناك عدد من نقاط التوقف الاختيارية، كما هو موضح في البروتوكول. والمواد النظرية تستخدم الطبيعة الغنية والديناميكية للنسخ للإنتقال من المؤشرات الحيوية أحادية التدليل إلى نماذج التعبير الجيني المتعدد الأبعاد، مما يتيح التوصيف البيولوجي الشامل لعينات الأنسجة مع توحيد الكواشف وأدوات البرمجيات سهلة الاستخدام. فهو يمكّن الباحثين من استخدام التكنولوجيا المعاصرة في مختبرهم الخاص، من خلال الاستفادة من التعلم الآلي وقاعدة بيانات لنماذج التعبير الصحي لاشتقاق ملامح مناعية كمية أكثر دقة للعينات السريرية الثمينة، واكتشاف المؤشرات الحيوية المتعددة الأبعاد للحمض النووي الريبي مع التحليل الإحصائي الكامل.
Protocol
تم شراء عينات الأنسجة البشرية المستخدمة في النتائج التمثيلية الموضحة هنا من كيان ذي سمعة طيبة (مجموعة تريستار للتكنولوجيا) ولديها موافقة مستنيرة من المانحين تسمح بإجراء البحوث الأكاديمية والتجارية ، وكذلك الموافقة من أخلاقي مختص اللجنه.
الجزء الأول: إعداد المكتبة قبل الالتقاط
1. الحمض النووي الريبي القياس والتأهيل
- قياس الحمض النووي الريبي باستخدام اختبار الفلورومترية لتحديد المدخلات المناسبة للكمية. تقييم جودة RNA الإدخال باستخدام electrophoresis لتحديد عدد سلامة الجيش الملكي النيبالي (RIN) والنسبة المئوية للشظايا > 200 النيوكليوتيدات (DV200)القيم.
- لعينات الحمض النووي الريبي سليمة (RIN > 7) أو تدهورجزئيا (رين = 2 إلى 7) اتبع خطوات إعداد المكتبة لحمض الرنا عالية الجودة / سليمة، بدءا من الخطوة 2.1. نوعية الجيش الملكي النيبالي مهم لاختيار الوقت الصحيح التجزئة في برنامج الدراجة الحرارية #1(الجدول التكميلي 2).
- بالنسبة للعينات المتدهورة للغاية (على سبيل المثال، RIN = 1 إلى 2 أو FFPE)، حدد قيمةDV 200. هذه العينات لا تتطلب التجزئة وسوف تتبع التعليمات لالحمض النووي الريبي المتدهورة، بدءا من الخطوة 2.2.
- إعداد المبلغ المناسب من إجمالي الحمض النووي الريبي لكل عينة عن طريق تخفيف 20 نانوغرام من الحمض النووي الريبي (عالية الجودة / سليمة RNA مع رين > 2) أو 40 نانوغرام من الحمض النووي الريبي (المتدهورة / FFPE RNA مع DV200 > 20٪) إلى 5 ميكرولتر في المياه الخالية من nuclease. لا ينصح بمعالجة العينات باستخدام DV200 < 20%. لعينات الحمض النووي الريبي السيطرة المقدمة مع عدة، تمييع 1 μL من الحمض النووي الريبي المناسب في 4 ميكرولتر من المياه خالية من nuclease. ستتبع عينات التحكم نفس المعالجة كما هو موضح إما لمواد الحمض النووي الريبي عالية الجودة (سليمة) أو المتدهورة (FFPE) ، كما تم تصنيفها. انظر الجدول التكميلي 1 لجميع الكواشف المدرجة في المجموعة.
2. تجزئة الجيش الملكي النيبالي وفتيلة
- اتبع الخطوة 2.1.1 لحمض الرنا عالي الجودة / سليمة مع رين > 2.
- لرنا عالية الجودة، وتجميع التجزئة وفتيلة رد فعل على الجليد في أنبوب PCR خالية من nuclease وفقا للجدول 1.
- تخلط جيدا عن طريق الأنابيب صعودا وهبوطا عدة مرات. ثم، تدور لفترة وجيزة أسفل العينات في جهاز طرد مركزي صغير
ملاحظة: بالنسبة لجميع دورات الطرد المركزي في البروتوكول، يوصى بسرعة ≥ 1000 × ز لمدة لا تقل عن 3 s. - ضع العينات في الدراجة الحرارية واستخدام برنامج #1(الجدول التكميلي 2).
- نقل الأنابيب فورا إلى الجليد والمضي قدما في أول ستراند cDNA التوليف لالحمض النووي الريبي عالية الجودة (الخطوة 3.1). لإعداد متزامن من كل من الجودة العالية وFFPE RNA، بدء إعداد الجيش الملكي النيبالي FFPE (الخطوة 2.2) خلال حضانة التجزئة.
- تخلط جيدا عن طريق الأنابيب صعودا وهبوطا عدة مرات. ثم، تدور لفترة وجيزة أسفل العينات في جهاز طرد مركزي صغير
- لرنا عالية الجودة، وتجميع التجزئة وفتيلة رد فعل على الجليد في أنبوب PCR خالية من nuclease وفقا للجدول 1.
| تجزئة وفتيلة ميكس | حجم (μL) |
| الحمض النووي الريبي (RNA) سليم أو متدهور جزئيًا (20 نانوغرام) | 5 |
| أول خصلة توليف التفاعل العازلة | 4 |
| التمهيديات العشوائية | 1 |
| إجمالي الحجم | 10 |
الجدول 1: التجزئة وفتيلة رد فعل لرنا عالية الجودة. وينبغي تجميع مكونات التجزئة وفتيلة رد فعل لرنا عالية الجودة ومختلطة على الجليد وفقا لأحجام المعروضة. ويمكن إجراء مزيج رئيسي من أول حبلا توليف العازلة رد فعل والتمهيديعشوائية وإضافتها إلى عينات الجيش الملكي النيبالي.
- اتبع الخطوة 2.2.1 لالحمض النووي الريبي المتدهورة / FFPE مع DV200 > 20٪.
- لتدهور شديد (FFPE) الجيش الملكي النيبالي الذي لا يتطلب التجزئة، وتجميع رد فعل فتيلة كما هو موضح في الجدول 2. للحصول على الحمض النووي الريبي سليمة، تذكر أن تتبع الخطوة 2.1.
- تخلط جيدا عن طريق الأنابيب صعودا وهبوطا عدة مرات. ثم، تدور لفترة وجيزة أسفل العينات في جهاز طرد مركزي صغير.
- ضع العينات في الدراجة الحرارية واستخدام برنامج #2(الجدول التكميلي 2).
- نقل الأنابيب إلى الجليد والمضي قدما في أول ستراند cDNA التوليف لالحمض النووي الريبي المتدهورة للغاية (FFPE) (الخطوة 3.2).
- لتدهور شديد (FFPE) الجيش الملكي النيبالي الذي لا يتطلب التجزئة، وتجميع رد فعل فتيلة كما هو موضح في الجدول 2. للحصول على الحمض النووي الريبي سليمة، تذكر أن تتبع الخطوة 2.1.
| فتيلة رد فعل | حجم (μL) |
| FFPE RNA (40 نانوغرام) | 5 |
| التمهيديات العشوائية | 1 |
| إجمالي الحجم | 6 |
الجدول 2: رد فعل فتيلة عشوائية لالحمض النووي الريبي المتدهورة للغاية. وينبغي تجميع مكونات رد الفعل فتيلة لالحمض النووي الريبي المتدهورة للغاية على الجليد في أنبوب PCR خالية من nuclease.
3. أول ستراند cDNA التوليف
- اتبع الخطوة 3.1.1 لحمض الرنا عالي الجودة / سليمة مع رين > 2.
- لالحمض النووي الريبي سليمة (ذات جودة عالية)، وتجميع أول تفاعل التوليف ستراند على الجليد في أنبوب PCR خالية من nuclease وفقا للجدول 3.
- الحفاظ على ردود الفعل على الجليد، مزيج تماما عن طريق الأنابيب صعودا وهبوطا عدة مرات. تدور لفترة وجيزة أسفل العينات في جهاز طرد مركزي صغير، والمضي قدما مباشرة إلى حضانة التوليف حبلا الأولى (الخطوة 4).
- لالحمض النووي الريبي سليمة (ذات جودة عالية)، وتجميع أول تفاعل التوليف ستراند على الجليد في أنبوب PCR خالية من nuclease وفقا للجدول 3.
| أول توليف ستراند | حجم (μL) |
| الجيش الملكي النيبالي مجزأة والتمهيدية (الخطوة 2.1.3) | 10 |
| أول تلافي التوليف خصوصية الكاشف | 8 |
| أول إنزيم إنزيم تخليق خلاب | 2 |
| إجمالي الحجم | 20 |
الجدول 3: أول تفاعل توليف ستراند لرنا عالية الجودة. وينبغي تجميع مكونات التجزئة وفتيلة رد فعل لرنا عالية الجودة ومختلطة على الجليد وفقا لأحجام معينة. يمكن إجراء مزيج رئيسي من كاشف خصوصية التوليف الأول من ستراند وأول إنزيم توليف خلاب وإضافته إلى عينات الحمض النووي الريبي مجزأة وتستعد.
- اتبع الخطوة 3.2.1 لالحمض النووي الريبي المتدهورة / FFPE مع DV200 > 20٪.
- لالحمض النووي الريبي المتدهورة للغاية (FFPE)، وتجميع أول تفاعل التوليف ستراند على الجليد في أنبوب PCR خالية من nuclease وفقا للجدول 4.
- الحفاظ على ردود الفعل على الجليد، مزيج تماما عن طريق الأنابيب صعودا وهبوطا عدة مرات. تدور لفترة وجيزة أسفل العينات في جهاز طرد مركزي صغير، والمضي قدما مباشرة إلى حضانة التوليف حبلا الأولى (الخطوة 4).
- لالحمض النووي الريبي المتدهورة للغاية (FFPE)، وتجميع أول تفاعل التوليف ستراند على الجليد في أنبوب PCR خالية من nuclease وفقا للجدول 4.
| أول توليف ستراند | حجم (μL) |
| الجيش الملكي النيبالي التمهيدي (الخطوة 2.2.3) | 6 |
| أول خصلة توليف التفاعل العازلة | 4 |
| أول كاشف خصوصية ستراند | 8 |
| أول إنزيم إنزيم تخليق خلاب | 2 |
| إجمالي الحجم | 20 |
الجدول 4: أول تفاعل توليف ستراند لالحمض النووي الريبي المتدهور ة للغاية. وينبغي تجميع مكونات التجزؤ وفتيلة رد فعل لالحمض النووي الريبي المتدهورة للغاية ومختلطة على الجليد وفقا لأحجام المعروضة. يمكن إجراء مزيج رئيسي من أول خاصية التوليف العازلة التفاعل، أول خاصية التوليف حبلا، وأول توليف انزيم مزيج حبلا وإضافتها إلى عينات الجيش الملكي النيبالي تستعد.
4. أول حضانة التوليف ستراند
- حفظ الأنابيب على الجليد، مزيج جيدا عن طريق الأنابيب صعودا وهبوطا عدة مرات. تدور لفترة وجيزة أسفل العينات في جهاز طرد مركزي صغير. احتضان العينات في الدراجة الحرارية المسخنة بعد #3 البرنامج(الجدول التكميلي 2).
5. الثاني ستراند cDNA التوليف
- إعداد التفاعل التوليف cDNA حبلا الثاني على الجليد عن طريق تجميع المكونات المدرجة في الجدول 5،بما في ذلك المنتج تفاعل حبلا الأولى من الخطوة 4.1.
| رد فعل توليف ستراند الثاني | حجم (μL) |
| أول منتج توليف ستراند (الخطوة 4.1) | 20 |
| ثاني حبلا توليف التفاعل العازلة | 8 |
| الثاني حبلا توليف مزيج انزيم | 4 |
| مياه خالية من Nuclease | 48 |
| إجمالي الحجم | 80 |
الجدول 5: رد الفعل التوليفي الثاني للخلاب. وينبغي تجميع مكونات التفاعل التوليف cDNA حبلا الثانية ومختلطة على الجليد وفقا لأحجام المعروضة. يمكن إجراء مزيج رئيسي من العازلة التفاعل التوليف ستراند الثاني، الثاني إنزيم التوليف حبلا، والمياه خالية من Nuclease وإضافتها إلى المنتج التوليف ستراند الأول.
- حفظ الأنابيب على الجليد، مزيج جيدا عن طريق الأنابيب صعودا وهبوطا عدة مرات. احتضان في الدراجة الحرارية التالية برنامج #4(الجدول التكميلي 2).
6. cDNA تنظيف باستخدام SPRI (المرحلة الصلبة قابل للإلغاء تجميد) الخرز
- السماح للحبات SPRI الحارة إلى درجة حرارة الغرفة لمدة 30 دقيقة على الأقل قبل الاستخدام، ومن ثم دوامة SPRI الخرز لمدة 30 ث تقريبا لإعادة تعليق.
- أضف 144 ميكرولتر من الخرز المعلّق إلى تفاعل توليف الخنوع الثاني (~ 80 ميكرولتر). تخلط جيدا عن طريق الأنابيب صعودا وهبوطا على الأقل 10 مرات واحتضان لمدة 5 دقيقة في درجة حرارة الغرفة.
- تدور لفترة وجيزة الأنابيب في جهاز طرد مركزي صغير ووضع الأنابيب على رف المغناطيسي لفصل الخرز من supernatant. بعد أن يكون الحل واضحًا ، قم بإزالة الـ supernatant بعناية وتخلص منه. يجب الحرص على عدم إزعاج الخرز، والتي تحتوي على الحمض النووي.
- أضف 180 ميكرولتر من الإيثانول المعد حديثاً بنسبة 80% إلى الأنابيب أثناء وجوده على الحامل المغناطيسي. احتضان في درجة حرارة الغرفة لمدة 30 ث، ومن ثم إزالة بعناية والتخلص من supernatant.
- كرر الخطوة 6.4 مرة واحدة لما مجموعه خطوتين للغسيل.
- إزالة الإيثانول تماما المتبقية. ترك الأنابيب على الرف المغناطيسي والهواء الجاف الخرز لمدة 3 دقيقة تقريبا مع غطاء مفتوح، أو حتى تجف بشكل واضح. لا أكثر من تجفيف الخرز، وهذا قد يؤدي إلى انخفاض الانتعاش من الحمض النووي.
- إزالة الأنابيب من المغناطيس وإضافة 53 ميكرولتر 0.1x TE المخزن المؤقت (المدرجة في عدة كاشف، انظر الجدول التكميلي 1)إلى الخرز. ماسيت صعودا وهبوطا على الأقل 10 مرات لخلط جيدا. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة.
- ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق. نقل 50 ميكرولتر من supernatant لتنظيف أنابيب PCR خالية من nuclease. يجب الحرص على عدم إزعاج الخرز. هذه نقطة توقف اختيارية في البروتوكول، قد يتم تخزين عينات cDNA عند -20 درجة مئوية.
7. إنهاء إصلاح مكتبة cDNA
- تجميع رد فعل إصلاح نهاية على الجليد عن طريق تجميع المكونات المدرجة في الجدول 6 إلى المنتج توليف حبلا الثاني من الخطوة 6.8.
| نهاية رد فعل إصلاح | حجم (μL) |
| المنتج الثاني لتوليف خلائل (الخطوة 6.8) | 50 |
| إنهاء إصلاح رد فعل المخزن المؤقت | 7 |
| نهاية إصلاح مزيج انزيم | 3 |
| إجمالي الحجم | 60 |
الجدول 6: رد فعل إصلاح نهاية. وينبغي تجميع مكونات رد فعل إصلاح نهاية ومختلطة على الجليد وفقا لأحجام المعروضة. يمكن إجراء مزيج رئيسي من العازلة رد فعل إصلاح نهاية ونهاية إصلاح مزيج انزيم وإضافتها إلى المنتج التوليف ستراند الثاني.
- تعيين ماصة إلى 50 ميكرولتر ومن ثم ماصة حجم كامل صعودا وهبوطا على الأقل 10 مرات لخلط جيدا. جهاز طرد مركزي لفترة وجيزة لجمع كل السائل من جانبي الأنابيب. من المهم أن تخلط جيدا. وجود كمية صغيرة من الفقاعات لن تتداخل مع الأداء.
- احتضان العينات في الدراجة الحرارية التالية #5 البرنامج(الجدول التكميلي 2).
8. ربط المحول
- قبل إعداد رد فعل الربط، تمييع المحول في مخزن تخفيف المحول الجليدي البارد كما هو موضح في الجدول 7، وضرب العدد المطلوب من العينات ، بالإضافة إلى 10٪ إضافية. الحفاظ على محول المخفف على الجليد.
| تخفيف الربط | حجم (μL) |
| محول | 0.5 |
| محول تخفيف المخزن المؤقت | 2 |
| إجمالي الحجم | 2.5 |
الجدول 7: تخفيف المحول. يجب تخفيف المحول على الجليد مع محول تخفيف المخزن المؤقت وفقا لأحجام المعروضة.
- تجميع رد فعل الربط على الجليد عن طريق إضافة المكونات كما هو موضح في الجدول 8، في الترتيب المذكور ، إلى المنتج رد فعل الإعدادية النهائية من الخطوة 7.3. لاحظ أن خلط الربط الرئيسي ومحسن الربط يمكن خلطه في وقت مسبق. هذا الخليط مستقر لمدة 8 ساعة على الأقل عند 4 درجات مئوية. لا تقم بخلط مزيج الربط الرئيسي ومحسن الربط والمحول قبل الاستخدام في خطوة ربط المحول.
| رد فعل الربط | حجم (μL) |
| إنهاء الحمض النووي الجاهز (الخطوة 7.3) | 60 |
| محول مخفف (الخطوة 8.1) | 2.5 |
| محسن الربط | 1 |
| ربط ميكس الرئيسي | 30 |
| إجمالي الحجم | 93.5 |
الجدول 8: رد فعل الربط. يجب تجميع مكونات تفاعل ربط المحول على الجليد وفقًا للمجلدات الموضحة بالترتيب المبين. يمكن إجراء مزيج رئيسي من محسن الربط وخلط ماجستير الربط وإضافتهإلى نهاية الإعداد الحمض النووي مع محول المخفف. لا تخلط محول المخفف وخلط ماجستير ربط أو محسن ربط قبل خلط مع نهاية الجاهزة الحمض النووي.
- تعيين ماصة إلى 80 ميكرولتر ومن ثم ماصة حجم كامل صعودا وهبوطا على الأقل 10 مرات لخلط جيدا. أداء تدور سريعة لجمع كل السائل من جانبي الأنابيب. خلط ماجستير الربط لزج جدا. الحرص على ضمان خلط كافية من رد فعل الربط، كما خلط غير مكتملة سيؤدي إلى انخفاض كفاءة الربط. وجود كمية صغيرة من الفقاعات لن تتداخل مع الأداء.
- احتضان #6 البرنامج التالي(الجدول التكميلي 2)، ثم قم بإزالة خليط الربط من الدراجة الحرارية وإضافة 3 ميكرولتر من إنزيم معالجة المحول ، مما يؤدي إلى حجم إجمالي قدره 96.5 ميكرولتر.
- ماسيت صعودا وهبوطا عدة مرات لخلط جيدا، ومن ثم احتضان #7 البرنامج التالي(الجدول التكميلي 2)قبل الشروع فورا في تنقية رد فعل الربط.
9. تنقية رد فعل الربط باستخدام SPRI Neads
- السماح SPRI الخرز لالحارة إلى درجة حرارة الغرفة لمدة 30 دقيقة على الأقل قبل الاستخدام، ومن ثم دوامة SPRI الخرز لمدة 30 ث تقريبا لإعادة تعليق.
- إضافة 87 ميكرولتر من الخرز SPRI إعادة تعليق وتخلط جيدا عن طريق الأنابيب صعودا وهبوطا على الأقل 10 مرات. احتضان لمدة 10 دقيقة في درجة حرارة الغرفة.
- تدور لفترة وجيزة الأنابيب في جهاز طرد مركزي صغير ووضع الأنابيب على رف المغناطيسي لفصل الخرز من supernatant. بعد أن يكون الحل واضحًا (~ 5 دقيقة) ، قم بإزالة الـ supernatant بعناية والتخلص منه. لا تتخلص من الخرز.
- أضف 180 ميكرولتر من الإيثانول المعد حديثاً بنسبة 80% إلى الأنابيب أثناء وجوده على الحامل المغناطيسي. احتضان في درجة حرارة الغرفة لمدة 30 ث، ومن ثم إزالة بعناية والتخلص من supernatant. كرر الخطوة 9.4 مرة واحدة لما مجموعه خطوتين للغسيل.
- إزالة الإيثانول تماما المتبقية. ترك الأنابيب على الرف المغناطيسي والهواء الجاف الخرز لمدة 3 دقيقة تقريبا مع غطاء مفتوح، أو حتى تجف بشكل واضح. لا أكثر من تجفيف الخرز، وهذا قد يؤدي إلى انخفاض الانتعاش من الحمض النووي.
- إزالة الأنابيب من المغناطيس وإضافة 17 ميكرولتر من 0.1x TE المخزن المؤقت إلى الخرز. ماسيت صعودا وهبوطا على الأقل 10 مرات لخلط جيدا. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة، ومن ثم وضع الأنابيب على رف المغناطيسي، مما يسمح الخرز لفصل تماما من supernatant.
- نقل 15 ميكرولتر من supernatant لتنظيف أنابيب PCR خالية من nuclease. يجب الحرص على عدم إزعاج الخرز. هذه نقطة توقف اختيارية في البروتوكول، قد يتم تخزين الحمض النووي المحول-ligated في -20 درجة مئوية.
10. تخصيب PCR من الحمض النووي محول Ligated
- إعداد رد فعل PCR كما هو موضح في الجدول 9. يمكن إجراء مزيج رئيسي يحتوي على مزيج ماجستير ماجستير ماقبل التقاط PCR والتمهيدي العالمي وإضافتها إلى الحمض النووي محول ligated. للتسلسل متعدد، استخدم التمهيديات فهرس فريدة لكل رد فعل وإضافة إلى كل عينة على حدة.
| تخصيب PCR | حجم (μL) |
| محول الدنا المنقّد (الخطوة 10.1) | 15 |
| مزيج ماجستير ما قبل التقاط PCR | 25 |
| جهاز التهيّز العالمي PCR | 5 |
| دليل (X) التمهيدي | 5 |
| إجمالي الحجم | 50 |
الجدول 9: تخصيب PCR من الحمض النووي المحول. وينبغي تجميع مكونات تخصيب PCR من تفاعل الحمض النووي المحول ومختلطة على الجليد وفقا لأحجام المعروضة. يمكن إجراء مزيج رئيسي من مزيج ماجستير ماجستير ما قبل التقاط PCR والتمهيدي PCR العالمي وإضافتها إلى الحمض النووي محول ligated. بالنسبة للتسلسل متعدد المضاعف، يجب إعطاء كل عينة دليل فهرس فريد.
- تخلط جيدا عن طريق الأنابيب بلطف صعودا وهبوطا 10 مرات. تدور لفترة وجيزة الأنابيب في جهاز طرد مركزي صغير ومكان في الدراجة الحرارية وتنفيذ تضخيم PCR باستخدام برنامج #8(الجدول التكميلي 2).
11. تنقية رد فعل PCR باستخدام الخرز SPRI
- السماح SPRI الخرز لالحارة إلى درجة حرارة الغرفة لمدة 30 دقيقة على الأقل قبل الاستخدام، ومن ثم دوامة SPRI الخرز لمدة 30 ث تقريبا لإعادة تعليق.
- أضف 45 ميكرولتر من الخرز المعلّق إلى كل تفاعل تفاعل مع PCR (~ 50 ميكرولتر). تخلط جيدا عن طريق الأنابيب صعودا وهبوطا على الأقل 10 مرات، قبل احتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- تدور لفترة وجيزة الأنابيب في جهاز طرد مركزي صغير ووضع الأنابيب على رف المغناطيسي لفصل الخرز من supernatant. بعد أن يكون الحل واضحًا (~ 5 دقيقة) ، قم بإزالة الـ supernatant بعناية والتخلص منه. يجب الحرص على عدم إزعاج الخرز التي تحتوي على الحمض النووي.
- أضف 180 ميكرولتر من الإيثانول المعد حديثاً بنسبة 80% إلى الأنابيب أثناء وجوده في الحامل المغناطيسي. احتضان في درجة حرارة الغرفة لمدة 30 ث، ومن ثم إزالة بعناية والتخلص من supernatant. كرر الخطوة 11.4 مرة واحدة لما مجموعه خطوتين للغسيل.
- إزالة الإيثانول تماما المتبقية. ترك الأنابيب على الرف المغناطيسي والهواء الجاف الخرز لمدة 3 دقيقة تقريبا مع غطاء مفتوح، أو حتى تجف بشكل واضح. لا أكثر من تجفيف الخرز، وهذا قد يؤدي إلى انخفاض الانتعاش من الحمض النووي.
- إزالة الأنابيب من المغناطيس وإضافة 23 ميكرولتر 0.1x TE المخزن المؤقت إلى الخرز. ماسيت صعودا وهبوطا على الأقل 10 مرات لخلط جيدا. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة.
- ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق. نقل 20 ميكرولتر من supernatant لتنظيف أنابيب PCR خالية من nuclease. يجب الحرص على عدم إزعاج الخرز. هذه نقطة توقف اختيارية في البروتوكول، قد يتم تخزين مكتبات ما قبل الالتقاط عند -20 درجة مئوية.
12. التحقق من صحة وتحديد مكتبة ما قبل الالتقاط
- قياس تركيز المكتبة قبل التقاط باستخدام مقياس الفلور وحساسية عالية مجموعة من الجرعات. مطلوب عائد لا يقل عن 200 نانوغرام للمضي قدما إلى الجزء الثاني: التهجين والالتقاط.
- تشغيل 1 μL من المكتبة على نظام الكهربائي الرقمية. إذا لزم الأمر، تمييع العينة لتجنب إثقال رقاقة الحساسية العالية، وفقًا لتوصيات بروتوكول الشركة المصنعة.
- تأكد من أن الرسم الكهربائي يظهر توزيعًا ضيقًا بحجم ذروة 250-400 نقطة أساس تقريبًا (انظر النتائج التمثيلية، الشكل 3 والشكل 4).
- إذا كانت ذروة 128 نقطة بريتيش بتروليوم (محول-خافت) مرئية في آثار المحلل الحيوي، وكانت شدة الإشارة ≥ شدة إشارة مكتبة 250-400 bp (انظر النتائج التمثيلية، الشكل 5)،ثم طرح حجم العينة (من الخطوة 11.7) إلى 50 ميكرولتر مع 0.1x TE Buffer وتكرار تنقية SPRI Bead (الخطوة 11). هذه نقطة توقف اختيارية في البروتوكول ، قد يتم تخزين مكتبات ما قبل الالتقاط عند -20 درجة مئوية قبل الانتقال إلى الجزء الثاني: التهجين والالتقاط المناعي.
الجزء الثاني: التهجين والالتقاط
13. الجمع بين حجب Oligos، سرير 1 الحمض النووي، قبل التقاط الحمض النووي المكتبة، والجافة
- اخلط المكتبة الشريطية التي تم إعدادها في الخطوة 11 والكمية في الخطوة 12 ، مع الحمض النووي Cot-1 وحجب Oligos في أنبوب PCR خالي من nuclease أو 1.5 مل microtube ، كما هو موضح في الجدول 10.
| كاشف | الكمية/الحجم |
| مكتبة الباركود من الخطوة 10.10 | 200 نانوغرام |
| الحمض النووي Cot-1 | 2 ميكروغرام |
| حجب أوليجوس | 2 ميكرولتر |
الجدول 10: إعداد التهجين والتجفيف. وينبغي تجميع المكونات التي يتعين دمجها لتجفيف المكتبات استعدادا للتهجين وفقا للكميات المبينة.
- تجفيف محتويات الأنبوب باستخدام تركيز فراغ تعيين إلى 30-45 درجة مئوية. هذه نقطة توقف اختيارية في البروتوكول. بعد التجفيف، يمكن تخزين الأنابيب بين عشية وضحاها في درجة حرارة الغرفة (15-25 درجة مئوية) أو لفترة أطول عند -20 درجة مئوية.
14. هجين مسابس التقاط الحمض النووي مع المكتبة
- Thaw 2x Bead Wash Buffer وBuffer التهجين ، محسن التهجين ، لوحة التحقيق ImmunoPrism ، 10x Wash Buffer 1 ، 10x Wash Buffer 2 ، 10x Wash Buffer 3 ، و 10x العازلة المشددة الصارمة في درجة حرارة الغرفة. قبل الاستخدام، تفقد المخزن المؤقت التهجين لبلورة الأملاح. إذا كانت البلورات موجودة ، قم بتسخين الأنبوب عند 65 درجة مئوية ، وتهتز بشكل متقطع ، حتى يتم تهدئة المخزن المؤقت تمامًا.
- في درجة حرارة الغرفة، قم بإنشاء مزيج التهجين الرئيسي في أنبوب. ضرب وحدات التخزين بعدد العينات وإضافة 10% إضافية، بعد الجدول 11.
| مزيج رئيسي تهجين | حجم (μL) |
| المخزن المؤقت التهجين | 8.5 |
| محسن المخزن المؤقت التهجين | 2.7 |
| لوحة مسبار ImmunoPrism | 5 |
| مياه خالية من Nuclease | 0.8 |
| إجمالي الحجم | 17 |
الجدول 11: مزيج التهجين الرئيسي. وينبغي تجميع مكونات مزيج الرئيسي التهجين ومختلطة في درجة حرارة الغرفة وفقا لأحجام المعروضة.
- دوامة أو ماصة صعودا وهبوطا لخلط جيدا. ثم أضف 17 ميكرولتر من مزيج التهجين الرئيسي إلى كل أنبوب يحتوي على الحمض النووي المجفف. ختم الأنابيب واحتضان لمدة 5 دقيقة في درجة حرارة الغرفة.
- دوامة العينات، وضمان أنها مختلطة تماما، وتدور أسفل العينات لفترة وجيزة في جهاز طرد مركزي صغير. إذا كان ذلك ممكناً، قم بنقل كل عينة من أنبوب ميكروبوبي 1.5 مل إلى أنبوب PCR خالٍ من nuclease.
- وضع العينات في الدراجة الحرارية وتشغيل برنامج #9(الجدول التكميلي 2).
- أثناء الحضانة، قم بإعداد مخازن الغسيل (الخطوة 15) وحبات ستريبتفيفيفيفيالدين (الخطوة 16)، مما يسمح بوقت كافٍ لتسخين المخازن المؤقتة ومعادلة حبات ستريبتفيفيفيسين.
15. إعداد مخازن غسل
ملاحظة: يتم توفير مخازن الغسيل كحلول مركزة بقيمة 2x (Bead Wash Buffer) أو 10x (كافة مخازن الغسيل الأخرى).
- خلال حضانة التهجين، تمييع 2x Bead غسل المخزن المؤقت و10x غسل المخازن المؤقتة لإنشاء حلول العمل 1x، وضرب من قبل العدد المطلوب من العينات وإضافة 10٪ اضافية، بعد الجدول 12. إذا كان 10x غسل المخزن المؤقت 1 غائم، تسخين الزجاجة في حمام الماء 65 درجة مئوية أو كتلة التدفئة لإعادة تعليق الجسيمات. يجب خلط مخازن الغسيل المجمدة 1x بعد الذوبان.
| غسل المخازن المؤقتة | المخزن المؤقت المركز (μL) | مياه خالية من Nuclease (μL) | المجموع (ميكرولتر) |
| العازلة غسل بزة | 150 | 150 | 300 |
| غسل المخزن المؤقت 1 | 25 | 225 | 250 |
| غسل المخزن المؤقت 2 | 15 | 135 | 150 |
| غسل المخزن المؤقت 3 | 15 | 135 | 150 |
| حاجز غسيل صارم | 30 | 270 | 300 |
الجدول 12: غسل تخفيف المخزن المؤقت. يجب تخفيف مخازن غسل التركيز بالماء الخالي من nuclease في درجة حرارة الغرفة وفقًا للأحجام المعروضة.
- Aliquot المخازن المؤقتة غسل 1x في أنابيب PCR خالية من nuclease ووضعها في درجات الحرارة المناسبة كما هو مبين في الجدول 13. تأكد من تضمين ما يكفي من التجاوز للأنابيب. بالنسبة للمخازن المؤقتة الساخنة، استخدم الدراجة الحرارية التي تم تعيينها إلى 65 درجة مئوية مع تعيين الغطاء إلى 70 درجة مئوية.
| غسل المخازن المؤقتة | عقد درجة الحرارة | حجم / أنبوب (μL) | عدد الأنابيب / العينة |
| العازلة غسل بزة | RT (15-25 درجة مئوية) | 100 | 3 |
| غسل المخزن المؤقت 1 | 65 درجة مئوية | 100 | 1 |
| غسل المخزن المؤقت 1 | RT (15-25 درجة مئوية) | 150 | 1 |
| غسل المخزن المؤقت 2 | RT (15-25 درجة مئوية) | 150 | 1 |
| غسل المخزن المؤقت 3 | RT (15-25 درجة مئوية) | 150 | 1 |
| حاجز غسيل صارم | 65 درجة مئوية | 150 | 2 |
الجدول 13: مخازن الغسيل المخففة. وينبغي أن يكون aliquoted المخازن المؤقتة غسل المخفف في أنابيب منفصلة وفقا لأحجام وعدد من الأنابيب لكل عينة هو مبين. يجب أن تعقد مخازن الغسيل في درجة الحرارة المشار لها قبل الاستخدام.
- إعداد ميكس إعادة تعليق خرز في درجة حرارة الغرفة كما هو مبين في الجدول 14،ضرب من قبل العدد المطلوب من العينات وإضافة 10٪ إضافية.
| مزيج إعادة التعليق بخرز | حجم (μL) |
| المخزن المؤقت التهجين | 8.5 |
| محسن المخزن المؤقت التهجين | 2.7 |
| مياه خالية من Nuclease | 5.8 |
| إجمالي الحجم | 17 |
الجدول 14: مزيج إعادة تعليق ببُد. وينبغي تجميع مكونات ميكس إعادة تعليق خرز ومختلطة في درجة حرارة الغرفة وفقا لأحجام المعروضة.
16. إعداد الخرز ستريبتافيفيالدين
- حبات العقدية المكافئة في درجة حرارة الغرفة لمدة 30 دقيقة على الأقل قبل الاستخدام. اخلطي الخرز جيدًا عن طريق الدوامة لمدة 15 s وaliquot 50 ميكرولتر من الخرز لكل التقاط في أنبوب PCR خالٍ من nuclease.
- أضف 100 ميكرولتر من 1x Bead Wash Buffer (تم إعداده في الخطوة 15.1) إلى كل أنبوب. ماصة بلطف صعودا وهبوطا 10 مرات لخلط. ضع الأنبوب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق.
- إزالة وتجاهل supernatant واضحة. يجب الحرص على عدم إزعاج الخرز.
- قم بإجراء الغسيل التالي.
- إزالة من رف المغناطيسي. إضافة 100 ميكرولتر من 1x حبة غسل المخزن المؤقت إلى كل أنبوب يحتوي على الخرز، ومن ثم ماصة صعودا وهبوطا 10 مرات لخلط.
- ضع الأنبوب في الحامل المغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق.
- إزالة بعناية وتجاهل supernatant واضحة.
- كرر الخطوة 16.4 مرة واحدة لما مجموعه اثنين من السهو.
- إزالة من رف المغناطيسي. أضف 17 ميكرولتر من مزيج إعادة التعليق من Bead Resuspension Mix من الخطوة 15.3 إلى كل أنبوب. ماسيت صعودا وهبوطا عدة مرات لمزيج تماما. تأكد من أن الخرز لا تمسك على جانبي الأنابيب. إذا لزم الأمر، تدور لفترة وجيزة الأنابيب لجمع الخرز في الجزء السفلي.
17. ربط الهدف الهجين إلى الخرز ستريبتفيفيالدين
- بعد اكتمال حضانة التهجين لمدة 4 ساعات ، قم بإزالة العينات من الدراجة الحرارية وتعيين الدراجة الحرارية لاحتضانها عند 65 درجة مئوية مع تعيين الغطاء الساخن إلى 70 درجة مئوية.
- باستخدام ماصة متعددة القنوات، نقل 17 ميكرولتر من الخرز المتجانس بالكامل إلى العينات. مزيج جيدا عن طريق الأنابيب صعودا وهبوطا 10 مرات.
- ربط الحمض النووي إلى الخرز عن طريق وضع الأنابيب في الدراجة الحرارية التالية #10 البرنامج(الجدول التكميلي 2). أثناء الحضانة، قم بإزالة أنابيب الشريط لفترة وجيزة كل 10-12 دقيقة ودوامة بلطف لمدة 3 s لضمان بقاء الخرز في التعليق. بدلا من ذلك، مزيج عن طريق الأنابيب صعودا وهبوطا عدة مرات. المضي قدما على الفور إلى حبات غسل ستريبتفيفيالدين (الخطوة 18).
18. غسل Streptavidin الخرز لإزالة الحمض النووي غير المنضم
- استخدم مخازن الغسيل 1x من الخطوة 15.2 وتخزين المخازن المؤقتة الساخنة في الدراجة الحرارية أثناء الغسيل.
- أضف 100 ميكرولتر مسخن ة 1x غسل المخزن المؤقت 1 إلى الأنابيب من الخطوة 17.3. مزيج جيدا عن طريق الأنابيب صعودا وهبوطا 10 مرات. ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق.
- ماسيت وتخلص من السوبرناستانت الذي يحتوي على حمض نووي غير منضم إزالة من رف المغناطيسي.
- قم بإجراء الغسيل التالي بزاوية 65 درجة مئوية.
- أضف 150 ميكرولتر من 1x مسخن غسيل صارم مسبقًا.
- مزيج جيدا عن طريق الأنابيب صعودا وهبوطا على الأقل 10 مرات. تجنب فقاعات أثناء الأنابيب. تأكد من أن الخرز يتم تعليقه بالكامل في جميع الأنابيب.
- احتضان في الدراجة الحرارية في 65 درجة مئوية لمدة 5 دقيقة.
- ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق. ماسيت وتخلص من السوبرناستانت الذي يحتوي على حمض نووي غير منضم إزالة من رف المغناطيسي.
- كرر الخطوة 18.4 لما مجموعه اثنين من السهو الصارم.
- قم بإجراء غسل درجة حرارة الغرفة الأولى.
- إضافة 150 ميكرولتر من درجة حرارة الغرفة 1x غسل المخزن المؤقت 1.
- ماسيت صعودا وهبوطا 10 إلى 20 مرة لإعادة تعليق تماما الخرز.
- ختم الأنابيب واحتضان لمدة 2 دقيقة، بالتناوب بين دوامة بلطف لمدة 30 ثانية ويستريح لمدة 30 ثانية. تأكد من أن الخرز في جميع الآبار لا تزال معلقة بالكامل في جميع الأنابيب في جميع أنحاء الحضانة بأكملها.
- طرد مركزي لفترة وجيزة الأنابيب.
- ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق. ماسيت وتجاهل supernatant.
- ختم الأنابيب والطرد المركزي لفترة وجيزة. العودة إلى رف المغناطيسي واستخدام ماصة 10 ميكرولتر لإزالة أي عازلة غسل المتبقية.
- قم بإجراء غسل درجة حرارة الغرفة الثانية.
- إضافة 150 ميكرولتر من درجة حرارة الغرفة 1x غسل المخزن المؤقت 2.
- ماسيت صعودا وهبوطا 10 إلى 20 مرة لإعادة تعليق تماما الخرز.
- ختم الأنابيب واحتضان لمدة 2 دقيقة، بالتناوب بين دوامة بلطف لمدة 30 ثانية ويستريح لمدة 30 ثانية. تأكد من أن الخرز في جميع الآبار لا تزال معلقة بالكامل في جميع الأنابيب في جميع أنحاء الحضانة بأكملها.
- طرد مركزي لفترة وجيزة الأنابيب.
- نقل كامل حجم الخرز إعادة تعليق في غسل المخزن المؤقت 2 لتنظيف أنابيب PCR خالية من nuclease. هام: نقل الخرز إلى أنابيب جديدة مهم لتجنب التلوث خارج الهدف.
- ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق. ماسيت وتجاهل supernatant.
- ختم الأنابيب والطرد المركزي لفترة وجيزة. العودة إلى رف المغناطيسي واستخدام ماصة 10 ميكرولتر لإزالة أي عازلة غسل المتبقية.
- قم بإجراء غسل درجة حرارة الغرفة الثالثة.
- إضافة 150 ميكرولتر من درجة حرارة الغرفة 1x غسل المخزن المؤقت 3.
- ماسيت صعودا وهبوطا 10 إلى 20 مرة لإعادة تعليق تماما الخرز.
- ختم الأنابيب واحتضان لمدة 2 دقيقة، بالتناوب بين دوامة بلطف لمدة 30 ثانية ويستريح لمدة 30 ثانية. تأكد من أن الخرز في جميع الآبار لا تزال معلقة بالكامل في جميع الأنابيب في جميع أنحاء الحضانة بأكملها.
- طرد مركزي لفترة وجيزة الأنابيب.
- ضع الأنابيب على رف مغناطيسي، مما يسمح للحبات بالانفصال التام عن الفوق. ماسيت وتجاهل supernatant.
- ختم الأنابيب والطرد المركزي لفترة وجيزة. العودة إلى رف المغناطيسي واستخدام ماصة 10 ميكرولتر لإزالة أي عازلة غسل المتبقية.
- إزالة من الرف المغناطيسي وإضافة 20 ميكرولتر من المياه خالية من nuclease إلى الخرز.
- ماسيت صعودا وهبوطا 10 مرات لضمان أي حبات تمسك إلى جانب الأنابيب قد تم إعادة تعليقها.
- هام: لا تتخلص من الخرز. استخدم كامل 20 ميكرولتر من الخرز المُعَلَّق مع الحمض النووي الملتقط في الخطوة 19.
19. إجراء إثراء نهائي، بعد التقاط PCR
- إعداد ما بعد التقاط PCR ميكس ماجستير وفقا للجدول التالي، وضرب من قبل العدد المطلوب من العينات وإضافة 10٪ إضافية، وفقا للجدول 15.
| مكون ميكس ماجستير ما بعد التقاط PCR | حجم (μL) |
| ما بعد التقاط PCR MasterMix | 25 |
| مزيج التمهيدي ما بعد التقاط PCR | 1.25 |
| مياه خالية من Nuclease | 3.75 |
| إجمالي الحجم | 30 |
الجدول 15: مزيج ماجستير ما بعد التقاط PCR. وينبغي تجميع مكونات ما بعد التقاط PCR ميكس الرئيسي ومختلطة على الجليد وفقا لأحجام المعروضة.
- أضف 30 ميكرولتر من مزيج ماجستير PCR بعد الالتقاط إلى كل عينة لحجم التفاعل النهائي من 50 ميكرولتر.
- ضع أنابيب PCR في الدراجة الحرارية واحتضان #11 البرنامج التالي(الجدول التكميلي 2).
20. تنقية شظايا ما بعد التقاط PCR
- السماح SPRI الخرز لالحارة إلى درجة حرارة الغرفة لمدة 30 دقيقة على الأقل قبل الاستخدام، ومن ثم دوامة SPRI الخرز لمدة 30 ث تقريبا لإعادة تعليق.
- أضف 75 ميكرولتر من الخرز المعلّق إلى كل التقاط مخصب بـ PCR (50 ميكرولتر). تخلط جيدا عن طريق الأنابيب صعودا وهبوطا على الأقل 10 مرات. وحبات ستريبتفيفيفيفيدين لا تتداخل مع تنقية حبة SPRI. احتضان لمدة 5 دقيقة في درجة حرارة الغرفة.
- تدور لفترة وجيزة الأنابيب في جهاز طرد مركزي صغير ووضع الأنابيب على رف المغناطيسي لفصل الخرز من supernatant. بعد أن يكون الحل واضحًا ، قم بإزالة الـ supernatant بعناية وتخلص منه. يجب الحرص على عدم إزعاج الخرز، والتي تحتوي على الحمض النووي.
- أضف 180 ميكرولتر من الإيثانول المعد حديثاً بنسبة 80% إلى الأنبوب أثناء وجوده في الحامل المغناطيسي. احتضان في درجة حرارة الغرفة لمدة 30 ث، ومن ثم إزالة بعناية والتخلص من supernatant.
- كرر الخطوة 20.4 مرة واحدة لما مجموعه خطوتين للغسيل.
- إزالة الإيثانول تماما المتبقية. اترك الأنبوب على الحامل المغناطيسي والهواء جافًا 3 دقيقة مع فتح الغطاء ، أو حتى يجف بشكل واضح. لا تبالغ في تجفيف الخرز. وهذا قد يؤدي إلى انخفاض استعادة الحمض النووي.
- إزالة أنبوب من المغناطيس. Elute الحمض النووي من الخرز عن طريق إضافة 22 ميكرولتر من 0.1x TE المخزن المؤقت. تخلط جيدا عن طريق الأنابيب صعودا وهبوطا عدة مرات. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة. ضع الأنبوب على الحامل المغناطيسي حتى يصبح الحل واضحًا.
- إزالة 20 ميكرولتر من supernatant ونقلها إلى أنبوب PCR نظيفة خالية من nuclease، مع الحرص على عدم إزعاج الخرز. هذه نقطة توقف اختيارية في البروتوكول، قد يتم تخزين المكتبات عند -20 درجة مئوية.
21. التحقق من صحة المكتبة وقياسها كميا
- قياس تركيز المكتبة التي تم التقاطها باستخدام مقياس الفلور وحساسية عالية كيت.
- قياس متوسط طول جزء من المكتبة الملتقطة باستخدام رقاقة الحمض النووي الكهربائية عالية الحساسية الرقمية وحساب متوسط حجم الجزء لكل مكتبة باستخدام برنامج النظام. يجب أن يكون متوسط حجم الجزء حوالي 250-400 نقطة أساس (انظر النتائج التمثيلية، الشكل 6 والشكل 7). هذه نقطة توقف اختيارية في البروتوكول، قد يتم تخزين المكتبات المكتملة عند -20 درجة مئوية.
22 - التسلسل على منصة التسلسل
- للتسلسل، تمييع المكتبات إلى 2 nM واتبع إرشادات الشركة المصنعة لتحميل وتشغيل المنظم. تسلسل المكتبات إلى عمق لا يقل عن 15 مليون نهاية واحدة يقرأ ما لا يقل عن 50 نقطة في الطول.
23. تحليل البيانات التسلسل لتوليد ملامح المناعة واكتشاف المؤشرات الحيوية مع بوابة بريزم ، وهي أداة المعلوماتية القائمة على السحابة
- إنشاء حساب Prism من خلال زيارة https://prism.cofactorgenomics.com/
- بمجرد تسجيل الدخول، انقر فوق إرسال مشروع جديد في شريط الأدوات العلوي من أي صفحة في Prism لتحميل ملفات تسلسل FASTQ المتعددة، أو تحميل الملفات المخزنة على BaseSpace باستخدام حساب Prism.
- أكمل نموذج المشروع الجديد بما في ذلك اسم المشروع والعينات حسب المجموعة أو المجموعة. تجميع العينات وأسماء التجميع المقابلة ضرورية لإنشاء تقرير اكتشاف العلامات الحيوية. لاحظ أنه يلزم وجود 3 عينات على الأقل لكل مجموعة لإنشاء تقرير اكتشاف العلامات الحيوية. انقر على زر تشغيل التطبيق لإرسال النموذج؛ ستظهر صفحة تأكيد في حالة نجاحها.
- أثناء تسجيل الدخول، انقر فوق راجع النتائج في شريط الأدوات العلوي أو أي صفحة من المنشور. المنشور تمكن المستخدم من الاطلاع على حالة المشاريع المقدمة وعرض تقارير العينات والعلامات الحيوية لكل مشروع. سيكون هناك جدول للمشاريع التي أنشأها المستخدم على Prism. يحتوي الجدول على ثلاثة أعمدة للحالة والاسم وتاريخ الإرسال.
ملاحظة: يمكن أن تكون حالة كل مشروع:
• "قيد التشغيل"، حيث يتم تشغيل تحليل المشروع حاليا، أو،
• "النجاح"، حيث اكتمل تحليل المشروع وتتوفر فيه التقارير. - إذا انتهى المشروع من التحليل (المشار إليه بحالة "نجاح")، فعرض تقارير العينات الفردية وتقرير اكتشاف العلامات الحيوية. لاحظ أن تقرير اكتشاف العلامات الحيوية لن يكون متوفراً إلا إذا كان المشروع يتضمن الحد الأدنى المطلوب من ثلاث عينات لكل مجموعة.
- للوصول إلى هذه التقارير، ارجع إلى جدول المشاريع وانقر على اسم المشروع. في صفحة المشروع هذه، سيكون هناك جدول مع صف لكل عينة في المشروع. انقر فوق الارتباط في كل صف، أسفل عمود التقرير، للوصول إلى التقرير الفردي لكل عينة. مباشرة أسفل الجدول، انقر فوق الارتباط لتقرير اكتشاف العلامات الحيوية. إذا لم تكن هناك ارتباطات في هذه الصفحة، فلن يكمل المشروع التحليل.
النتائج
هناك عدد من نقاط التفتيش في جميع أنحاء البروتوكول التي تمكن المستخدم من تقييم نوعية وكمية المواد التي تم إنشاؤها. بعد الخطوة 12 الموضحة في البروتوكول ، يتم إنشاء مخطط كهربي كما هو موضح في الشكل 3، ممثل مكتبة نموذجية قبل الالتقاط لعينة الحمض النووي الريبي سليمة (RIN = 7.8).
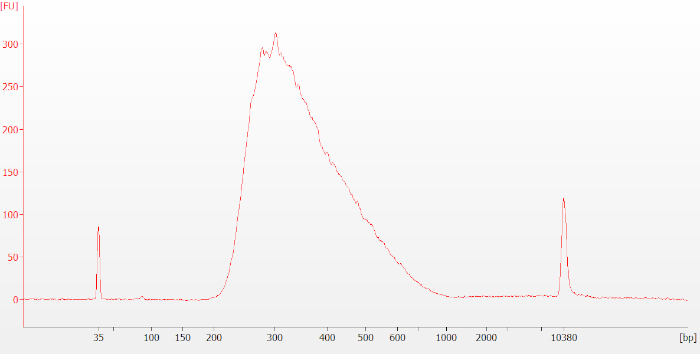
الشكل 3: نموذجي قبل التقاط مكتبة Bioanalyzer تتبع لعينة الحمض النووي الريبي سليمة. تظهر مكتبات ما قبل الالتقاط كذروة واسعة حول 250-400 زوج أساسي (bp) في الحجم. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
وينبغي توخي الحذر لتجنب الإفراط في التضخيم، كما هو مبين في الذروة الثانية حول 1000 نقطة أساس كما هو مبين في الشكل 4، وهو مخطط كهربائي تمثيلي لمكتبة ما قبل الالتقاط تم إنشاؤها من عينة FFPE RNA (DV200 = 46). إذا كانت هذه الذروة صغيرة بالنسبة للذروة الرئيسية (حوالي 250-400 زوج أساسي (bp) ، كما هو موضح ) ، فإنها لن تتداخل مع الخطوات أو التحليل المصب. إذا كانت الذروة الثانية كبيرة بالنسبة إلى ذروة 250-400 bp ، يمكن إعادة صنع مكتبة ما قبل الالتقاط مع دورات أقل من PCR من أجل تقليل التضخيم.

الشكل 4: نموذجي قبل التقاط مكتبة Bioanalyzer تتبع لعينة الجيش الملكي النيبالي FFPE. والذروة الثانية التي تبلغ حوالي 000 1 نقطة أساس تشير إلى الإفراط في التضخيم. إذا كانت هذه الذروة صغيرة بالنسبة للذروة الرئيسية حول 250-400 نقطة أساس (كما هو موضح)، فإنها لن تتداخل مع الخطوات أو التحليل المصب. إذا كانت الذروة الثانية كبيرة بالنسبة إلى ذروة 250-400 bp ، يمكن إعادة صنع مكتبة ما قبل الالتقاط مع دورات أقل من PCR من أجل تقليل التضخيم المفرط. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
كما هو موضح في الخطوة 12.1.3، يجب تقييم وجود أجهزة التميّل لتحديد ما إذا كان التنظيف الإضافي ضروريًا. المخططات الكهربائية الموضحة في الشكل 5 تمثل غير مقبول(الشكل 5A، DV200 = 33) ومقبولة(الشكل 5B، DV200 = 46) مستويات محول خافت ، تظهر كذروة حادة حول 128 نقطة أساس.
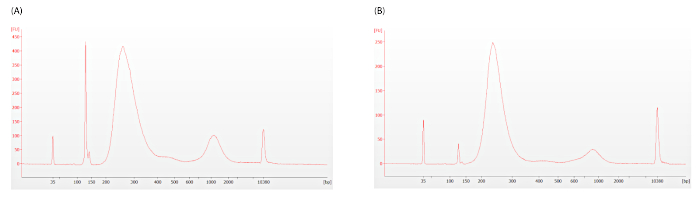
الشكل 5: قبل التقاط مكتبة آثار Bioanalyzer. يظهر الديميتر المحول كذروة حادة حول 128 bp.(A)الخافتات المحولة المفرطة موجودة في هذا الرسم الكهربائي. (ب)يتم تصوير مستويات باهتة محول مقبولة في هذا التتبع. كلا آثار تظهر أدلة على التضخيم المفرط خفيفة، ولكن هذا لا ينبغي أن تتداخل مع اختبار ImmunoPrism. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
عند الانتهاء من البروتوكول ، قبل التسلسل ، يتم تقييم المكتبات النهائية مرة أخرى باستخدام الكهربائي الرقمي. المكتبات المصنوعة من الجيش الملكي النيبالي FFPE تميل إلى أن يكون أصغر حجم التوزيع من المكتبات المصنوعة من الحمض النووي الريبي سليمة. بالنسبة لعينات الحمض النووي الريبي سليمة، يجب أن تبدو التتبع الناتج مشابهة للشكل 6 (RIN = 9.5). بالنسبة للحمض النووي الريبي المتدهور أو FFPE، يجب أن يبدو التتبع الناتج مشابهًا للرقم 7 (DV200 = 36).
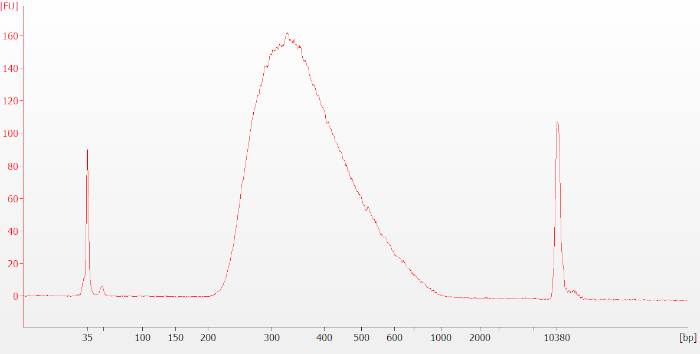
الشكل 6: نموذجي المكتبة النهائية تتبع Bioanalyzer لعينة الحمض النووي الريبي سليمة. تظهر المكتبات النهائية كذروة واسعة حول 250-400 زوج أساسي (bp) في الحجم. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
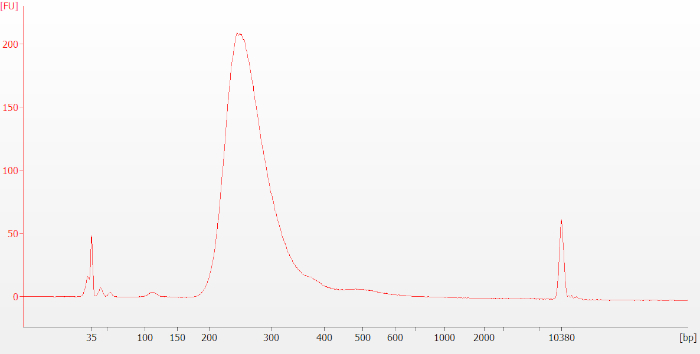
الشكل 7: نموذجي المكتبة النهائية تتبع Bioanalyzer لعينة FFPE RNA. المكتبات المصنوعة من الجيش الملكي النيبالي FFPE تميل إلى أن يكون أصغر حجم التوزيع من المكتبات المصنوعة من الحمض النووي الريبي سليمة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
كما هو موضح، يمكن تطبيق النتائج التي تم إنشاؤها باستخدام هذا البروتوكول بطريقتين رئيسيتين، كما هو موضح في الشكل 8.

الشكل 8: حالتا استخدام للبروتوكول. يتم تطبيق النتائج الناتجة عن هذا التحليل التنميط المناعي في اثنين من التطبيقات الانتقالية الرئيسية. (أ)تبدأ حالة الاستخدام الأولى من أنسجة الورم الصلبة البشرية (بما في ذلك أرشيف FFPE) وتولد صورة مناعية فردية للعينة. (ب)بمجرد توليدها لمجموعة من العينات البشرية، يتم الجمع بين البيانات باستخدام بوابة المنشور لإنشاء علامة بيولوجية متعددة الأبعاد وتقرير العلامات البيولوجية المقابلة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
ولتوضيح كل حالة من حالات الاستخدام هذه، يتم تضمين بيانات تمثيلية من دراسة تحويلية صغيرة21. العينات المستخدمة في هذه الدراسة هي مجموعة من العينات من 7 مرضى تم تشخيصهم وعلاجهم من سرطان الرئة غير صغير الخلية (NSCLC). العينات هي أنسجة الورم الصلبة المتطابقة مع المريض من خزعات ما قبل وبعد العلاج. أولاً، تم تحليل العينات الفردية لتوليد صورة مناعية، مثل تقرير المثال المبين في الشكل 9.

الشكل 9: مثال تقرير المناعة الفردية لعينة NSCLC. يقوم خط أنابيب Prism Portal بإنشاء تقرير رسومي لكل عينة تتم معالجتها ، مع تقرير تمثيلي تم إنشاؤه لعينة ورم صلب من NSCLC موضح هنا. (أ)الجانب الأمامي من التقرير يصور بيانيا انهيار الخلايا المناعية الموجودة في عينة الحمض النووي الريبي المستخرجة من أنسجة FFPE. (ب)يتضمن الجانب العكسي من التقرير جدولًا بالخلايا المناعية (بالنسب المئوية المطلقة) والتعبير الجيني للهروب (في النصوص لكل مليون، أو TPM)، بالإضافة إلى بيان أداء للتحليل. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
يمكن استخدام الملامح المناعية قبل وبعد العلاج لفهم كيف قام العلاج (العلاج الكيميائي أو الإشعاعي ، في هذه الدراسة) بتعديل البيئة الدقيقة للورم. ويرد مثال في الشكل 10، حيث تظهر التغيرات في النسبة المئوية لكل خلية مناعية والمحتوى المناعي الكلي قبل وبعد العلاج الكيميائي ، لمريض واحد.

الشكل 10: مثال نتائج ما قبل العلاج وما بعده. يتم عرض الخلايا المناعية الفردية وإجمالي بيانات المحتوى المناعي الناتجة عن عينات ما قبل وبعد العلاج من مريض واحد من NSCLC. في هذا المثال ، تلقى المريض نظام ًا كيميائيًا كعلاج. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
يمكن تجميع المرضى حسب معايير مثل النتائج السريرية أو الأنماط الظاهرية للمقارنة. على سبيل المثال ، في الشكل 11، تمت مقارنة العينات في دراسة NSCLC وفقًا للوقت لتطور المرض بعد العلاج. وأظهرت مجموعة فرعية من المرضى تكرار المرض في أكثر من 18 شهرا، وتقدمت مجموعة فرعية أخرى بشكل أسرع، في ≤ 18 شهرا. تتم مقارنة قيمة الدلتا الوسيطة (الفرق بين قيم ما قبل العلاج وما بعده) لكل عينة لتحديد المؤشرات الحيوية المفترضة لتطور المرض.
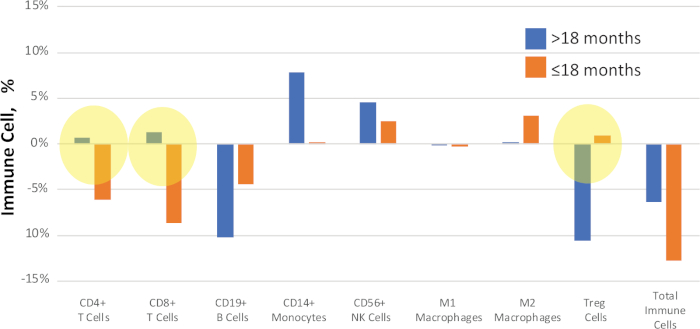
الشكل 11: مثال مقارنة النتائج السريرية. تم حساب التغيرات الكمية بين النسب المئوية للخلايا المناعية في عينات NSCLC المتطابقة قبل وبعد العلاج والإبلاغ عنها كقيمة "دلتا". تلك التي أبرزت في الأصفر تظهر تغييرات إشارة واضحة بين حالة البقاء على قيد الحياة. تمثل القضبان الزرقاء قيم دلتا متوسطة لمدة أكثر من 18 شهرًا حتى تطور المرض ، تمثل القضبان البرتقالية قيم دلتا متوسطة لمدة ≤ 18 شهرًا حتى تطور المرض. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
وأخيراً، يمكن استخدام مجموعات عينات مماثلة للنظر على وجه التحديد في عينات ما قبل المعالجة لتحديد المؤشرات الحيوية التنبؤية باستخدام بوابة المنشور لإنشاء تقرير العلامات البيولوجية. كما هو موضح في الشكل 12، فإن نفس النمط الظاهري السريري (تطور المرض) كما هو موضح أعلاه يحدد مجموعات العينة. في هذا المثال، تم تحديد اثنين من جينات الهروب المناعي كتمييزات ذات دلالة إحصائية لتجمعات العينات (CD47 و OX40، كما هو موضح في اللوحة السفلية من الشكل 12A). في هذا المثال، لأن المؤشرات الحيوية للجين الفردية قوية ذات أهمية إحصائية واضحة، فإن العلامة الحيوية متعددة الأبعاد لا تضيف قيمة تنبؤية كبيرة (ImmunoPrism، كما هو مكتوب في المخطط الشريطي الأيمن العلوي للشكل 12B). ويُلخص الجدول الكامل للبيانات، بما في ذلك النتائج المتعلقة بجميع التحليلات الـ 18 للتحاليل، في الجانب العكسي من التقرير، بما في ذلك التحليل الإحصائي وموجز موجز للأساليب.
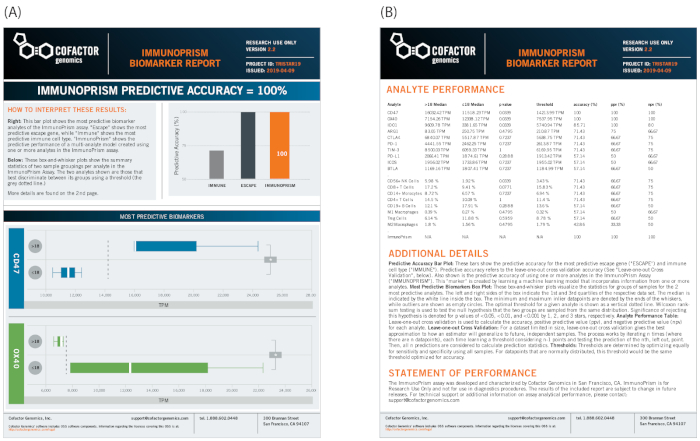
الشكل 12: مثال تقرير العلامات البيولوجية لعينات NSCLC. يقدم خط أنابيب اكتشاف العلامات الحيوية تقريرًا مرئيًا للعلامات الحيوية الفردية ، وعلامة حيوية متعددة الأبعاد للتعلم الآلي ، مع إحصاءات مفصلة. (أ)لهذه الدراسة، حدد خط الأنابيب اثنين من المؤشرات الحيوية الفردية (CD47 و OX40) كإحصائية ذات دلالة لتحديد تطور المرض مع عتبة 18 شهرا. (ب)ترد تفاصيل عن الطريقة والنتائج الكاملة على الجانب العكسي من التقرير. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: مواد مجموعة مواد الكاشف. يتم سرد قائمة من المواد الواردة في مجموعة ImmunoPrism، جنبا إلى جنب مع أرقام الجزء المشار إليها في بروتوكول الشركة المصنعة. وترد جميع المعدات والمواد الأخرى المطلوبة في جدول المواد. زيارة https://cofactorgenomics.com/product/immunoprism-kit/ لأوراق بيانات السلامة (SDS). الرجاء الضغط هنا لعرض هذا الملف (انقر على اليمين للتحميل).
الجدول التكميلي 2: برامج الدراجات الحرارية. يتم تلخيص برامج الدراجات الموصى بها المشار إليها في جميع أنحاء البروتوكول لسهولة البرمجة. الرجاء الضغط هنا لعرض هذا الملف (انقر على اليمين للتحميل).
الجدول التكميلي 3: دليل مؤشر التسلسل. يتم سرد المؤشرات التمهيدية الفهرس المقدمة في مجموعة الكاشف; يتم إضافة التمهيدي فريدة من نوعها إلى كل رد فعل لdemultiplexing ما بعد التسلسل. كما يتم توفير مجموعات متعددة المستوى الموصى بها. الرجاء الضغط هنا لعرض هذا الملف (انقر على اليمين للتحميل).
Discussion
يتطلب البروتوكول 20 نانوغرام سليمة أو 40 نانوغرام تدهورت للغاية (FFPE) RNA. يجب أن تكون عينة الحمض النووي الريبي خالية من الحمض النووي أو الأملاح (على سبيل المثال، Mg2+أو أملاح الجوانيدينيوم) أو عوامل التكالال العرافة (على سبيل المثال، EDTA، EGTA، السيترات)، أو المواد العضوية (على سبيل المثال، الفينول والإيثانول). فمن غير المستحسن المضي قدما مع عينات الجيش الملكي النيبالي التي لديها DV200 < 20٪. يوصى بشدة باستخدام الحمض النووي الريبي في مجموعة التحكم لأن هذه الضوابط توفر وسيلة لتقييم الأداء في جميع أنحاء البروتوكول بأكمله ، من إعداد المكتبة إلى التحليل.
تم تصميم البروتوكول ليتم تنفيذه باستخدام أنابيب قطاع PCR 0.2 مل. إذا كان يفضل، يمكن أيضا تنفيذ البروتوكول باستخدام الآبار في لوحة PCR 96-جيدا. ما عليك سوى استخدام آبار لوحة PCR 96-well بدلاً من جميع الإشارات إلى أنابيب PCR أو أنابيب الشريط. استخدام لوحات PCR مع آبار واضحة فقط، كما أنه من الأهمية بمكان لتأكيد بصريا إعادة التعليق الكامل للحبات أثناء تنقية الخرز وخطوات الغسيل.
طوال البروتوكول، احتفظ بالكواشف مجمدة أو على الجليد ما لم ينص على خلاف ذلك. لا تستخدم الكواشف حتى يتم إذابتها بالكامل. تأكد من خلط جميع الكواشف جيدا قبل الاستخدام.
الحفاظ على الإنزيمات عند -20 درجة مئوية حتى تصبح جاهزة للاستخدام والعودة إلى -20 درجة مئوية على الفور بعد الاستخدام. استخدام المياه الخالية من nuclease الجزيئية فقط؛ لا ينصح باستخدام المياه المعالجة بـ DEPC. عندما pipetting لخلط، يستنشق بلطف والاستغناء عن ما لا يقل عن 50٪ من الحجم الإجمالي حتى يتم خلط الحلول بشكل جيد. ماصة مزيج جميع يمزج الرئيسي التي تحتوي على الإنزيمات. استخدام دوامة لخلط الإنزيمات يمكن أن يؤدي إلى التسخ وللخطر أدائها. أثناء تنقية الخرز، استخدم حلول الإيثانول الطازجة بنسبة 80٪ من الإيثانول الجزيئي. استخدام حلول الإيثانول التي ليست طازجة قد يؤدي إلى انخفاض الغلة. تجنب أكثر من تجفيف الخرز، وهذا يمكن أن تقلل من كفاءة elution (حبات تبدو متصدع إذا أكثر من المجففة).
كما هو موضح في الخطوة 10، يتم إضافة التمهيديات فهرس فريدة من نوعها إلى كل رد فعل. استناداً إلى تسلسل هذه المؤشرات، لتعدد المستوى المنخفض، تركيبات مؤشر معينة هي الأمثل. وتسلسل هذه المؤشرات مطلوب من أجل إزالة الطابع المتعدد للبيانات بعد التسلسل. يتم توفير التسلسلات ومجموعات تعدد الإرسال الموصى بها في الجدول التكميلي 3. في هذه الخطوة نفسها، من المهم ملاحظة أن عدد دورات PCR الموصى بها يختلف اعتماداً على نوعية الحمض النووي الريبي المستخدمة، وقد تكون هناك حاجة إلى بعض التحسين لمنع PCR الإفراط في التضخيم. للحصول على جهاز ImmunoPrism Intact Control RNA وغيره من الحمض النووي الريبي عالي الجودة، ابدأ التحسين مع 10 دورات PCR. لImmunoPrism FFPE التحكم RNA وغيرها من الحمض النووي الريبي المتدهورة للغاية / FFPE ، بدء التحسين مع دورات 15 PCR. يوصى بإنتاج مكتبة اختبار باستخدام ممثل الحمض النووي الريبي للمواد التي سيتم تحليلها من أجل تحسين دورات PCR. وينبغي استخدام الحد الأدنى لعدد دورات PCR التي تسفر باستمرار عن غلة كافية من المكتبة قبل الالتقاط (أكثر من 200 نانوغرام). ذروة ثانوية حول 1000 bp على تتبع Bioanalyzer يدل على الإفراط في التضخيم(الشكل 4). يجب تقليل التضخيم المفرط ، ولكن وجود ذروة ثانوية صغيرة لن يتداخل مع نتائج الخفض.
لتقليل فقدان العينة وتجنب تبديل الأنابيب، يمكن تنفيذ الخطوة 13 في أنابيب PCR أو أنابيب الشريط أو لوحة PCR 96-well بدلاً من 1.5 مل ميكروأنابيب، إذا كان تركيز الفراغ الخاص بك يسمح. يمكن إزالة الدوار على العديد من المكثفات. وهذا يمكن أنابيب الشريط أو لوحات لتناسب في الفراغ. ويمكن بعد ذلك تشغيل تركيز الفراغ باستخدام إعداد الجفاف مائي مع عدم وجود centrifugation. راجع دليل للتركيز فراغ الخاص للحصول على تعليمات. إذا تم تجفيف العينات في أنابيب الشريط أو لوحة 96-well ، يمكن تنفيذ خطوة التهجين في نفس الوعاء.
خلال الخطوة 17، تأكد من دوامة كل 10-12 دقيقة لزيادة كفاءة التقاط البزة. عقد بعناية قبعات أنابيب الشريط الدافئ عند خلط لمنع الأنابيب من فتح.
والسُلمات الموصوفة في الخطوة 18 حاسمة لتجنب التلوث غير المحدد ويجب متابعتها عن كثب. تأكد من إعادة تعليق الخرز بالكامل في كل غسل ، وإزالة مخازن الغسيل تمامًا ، وخلال غسل العازلة 2 ، قم بنقل العينات إلى أنبوب شريط جديد (الخطوة 18.6.5). تأكد من أن حبات ستريبتفيفيفيسين يتم إعادة تعليقها بالكامل وتبقى معلقة أثناء الحضانة بأكملها. الرش على قبعات أنبوب لن يؤثر سلبا على التقاط. خلال النظافة في درجة حرارة الغرفة، يمكن استخدام خلاط دوامة ميكروبليت لدوامة العينات لكامل فترة الحضانة لمدة دقيقتين لتسهيل إعادة التعليق. لا تدع حبات ستريبتفيفيفيفيدين تجف. إذا لزم الأمر، قم بتمديد الحاضنات في المخازن المؤقتة لتجنب تجفيف الخرز. إذا كنت تستخدم أكثر من أنبوب قطاع واحد، والعمل مع أنبوب قطاع واحد في وقت واحد لكل غسل في حين أن أنابيب الشريط الأخرى الجلوس في cycler الحرارية. وهذا يمكن أن يساعد على تجنب أكثر من تجفيف الخرز أو التسرع، مما أدى إلى إعادة تعليق الفقراء أو غيرها من التقنيات دون المستوى الأمثل. للمستخدمين لأول مرة، لا ينصح بمعالجة أكثر من 8 ردود فعل المكتبة في وقت.
توفر تقنيات التنميط المناعي الحالية سلسلة متصلة من المعلومات - من آلاف نقاط البيانات التي تتطلب تفسيرًا كبيرًا (تسلسل الحمض النووي الريبي) إلى نقطة بيانات فردية ومنفصلة (IHC واحد plex). البروتوكول الموصوف هنا يمثل نهجا في مكان ما في الوسط، مع نطاق مركز ة تمكن حساسية عالية، ولكن التقاط سوى مجموعة فرعية من البيانات المحضرة ذات الصلة سريريا. نظرًا لطبيعة استخراج الحمض النووي الريبي السائب ، لا يوفر هذا البروتوكول معلومات حول العلاقات المكانية بين الخلايا المناعية والبيئة الدقيقة للورم ، ومع ذلك ، يمكن استكمال النتائج بتقنيات التصوير لإضافة هذه المعلومات. هناك عدد لا يحصى من التطبيقات للبيانات التي تم إنشاؤها بواسطة هذا البروتوكول ، حيث أن هناك الكثير مما يمكن تعلمه عن بيولوجيا السرطان كمرض ، والعلاجات التي يتم تطويرها لعلاجه. كما هو مبين في النتائج التمثيلية ، فإن تقرير المناعة الفردي مفيد لفهم كيف قد يتغير الملف المناعي للمريض استجابة لأحداث مثل تطور المرض أو العلاج. في حين أن النتائج المعروضة هنا تقدم بعض حالات الاستخدام المثال ، والتطبيقات الأخرى بما في ذلك التحقيق في آلية عمل العلاج وتحديد المؤشرات البيولوجية المفترضة للنتائج السريرية مثل التقدم مجانا والبقاء على قيد الحياة عموما هي أيضا العمليه. عند استخدام هذا البروتوكول لتطبيقات اكتشاف العلامات الحيوية ، من المهم ممارسة تصميم دراسة جيد لضمان تحليل التجمعات المتجانسة ، ويتم تضمين عينات كافية للقوة الإحصائية ، ويتم النظر في مصادر التحيز. نظرًا للطبيعة المركزة والمبسطة للدراسة ، من الممكن تخيل مسار نحو التحقق السريري والتطبيق المصب لهذه المؤشرات الحيوية بمجرد اكتشافها.
Disclosures
يتم توظيف جميع المؤلفين من قبل Cofactor Genomics, Inc. ، الشركة التي طورت وتنتج مجموعة كاشفات ImmunoPrism وأدوات المعلوماتية المستخدمة في هذه المقالة. إن اختبار ImmunoPrism هو للاستخدام البحثي فقط، وليس للاستخدام في الإجراءات التشخيصية.
Acknowledgements
يرغب المؤلفون في التنويه بمجموعة TriStar Technology Group لتوفير العينات البيولوجية للنتائج التمثيلية ، بالإضافة إلى جميع الفرق الجزيئية والتحليلية والمنتجة والتجارية في Cofactor Genomics لخبرتهم التقنية و دعم.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR 8 tube strip | USA Scientific | 1402-2700 | USA Scientific 0.2 mL PCR 8-tube strip |
| 200 Proof Ethanol | MilliporeSigma | EX0276-1 | Prepare 80% by mixing with nuclease-free water on the day of the experiment |
| 96-well thermal cyclers | BioRad | 1861096 | |
| Solid-phase Reversible Immobilization (SPRI) Beads | Beckman-Coulter | A63882 | Agencourt AMPure XP – PCR Purification beads |
| Digital electrophoresis chips and kit | Agilent Technologies | 5067-4626 | Agilent High Sensitivity DNA chips and kit |
| Digital electrophoresis system | Agilent Technologies | G2939AA | Agilent 2100 Electrophoresis Bioanalyzer |
| Streptavidin Beads | ThermoFisher Scientific | 65306 | Dynabeads M-270 Streptavidin |
| ImmunoPrism Kit – 24 reaction | Cofactor Genomics | CFGK-302 | Cofactor ImmunoPrism Immune Profiling Kit – 24 reactions |
| Human Cot-1 DNA | ThermoFisher Scientific | 15279011 | Invitrogen brand |
| Magnetic separation rack | Alpaqua/Invitrogen | A001322/12331D | 96-well Magnetic Ring Stand |
| Microcentrifuge | Eppendorf | 22620701 | |
| Microcentrifuge tubes | USA Scientific | 1415-2600 | USA Scientific 1.5 mL low-adhesion microcentrifuge tube |
| NextSeq550 | Illumina | SY-415-1002 | Any Illumina sequencer may be used for this protocol |
| Nuclease-free water | ThermoFisher Scientific | AM9937 | |
| Prism Extraction Kit | Cofactor Genomics | CFGK-401 | Cofactor Prism FFPE Extraction Kit – 24 samples |
| Purified RNA | - | - | Purified from human tissue samples |
| Fluorometer | ThermoFisher Scientific | Q33226 | Qubit 4 System |
| Fluorometric Assay Tubes | Axygen | PCR-05-C | 0.5mL Thin Wall PCR Tubes with Flat Caps |
| High Sensitivity Fluorometric Reagent Kit | Life Technologies | Q32854 | Qubit dsDNA HS Assay Kit |
| Vacuum concentrator | Eppendorf | 22820001 | VacufugePlus |
| Vortex mixer | VWR | 10153-838 | |
| Water bath or heating block | VWR/USA Scientific | NA/2510-1102 | VWR water bath/USA Scientific heating block |
References
- Brambilla, E., et al. Prognostic Effect of Tumor Lymphocytic Infiltration in Resectable Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. 34 (11), 1223-1230 (2016).
- Iacono, D., et al. Tumour-infiltrating lymphocytes, programmed death ligand 1 and cyclooxygenase-2 expression in skin melanoma of elderly patients: clinicopathological correlations. Melanoma Research. 28 (6), 547-554 (2018).
- Fridman, W. H., Zitvogel, L., Sautes-Fridman, C., Kroemer, G. The immune contexture in cancer prognosis and treatment. Nature Reviews Clinical Oncology. 14 (12), 717-734 (2017).
- Sierant, M. C., Choi, J. Single-Cell Sequencing in Cancer: Recent Applications to Immunogenomics and Multi-omics Tools. Genomics Inform. 16, (2018).
- Klauschen, F., et al. Scoring of tumor-infiltrating lymphocytes: From visual estimation to machine learning. Seminars in Cancer Biology. 52 (Pt 2), 151-157 (2018).
- Danaher, P., et al. Gene expression markers of Tumor Infiltrating Leukocytes. Journal for ImmunoTherapy of Cancer. 5, 18 (2017).
- Aran, D., Hu, Z., Butte, A. J. xCell: digitally portraying the tissue cellular heterogeneity landscape. Genome Biology. 18 (1), 220 (2017).
- Newman, A. M., et al. Robust enumeration of cell subsets from tissue expression profiles. Nature Methods. 12 (5), 453-457 (2015).
- Becht, E., et al. Estimating the population abundance of tissue-infiltrating immune and stromal cell populations using gene expression. Genome Biology. 17 (1), 218 (2016).
- Newman, A. M., Gentles, A. J., Liu, C. L., Diehn, M., Alizadeh, A. A. Data normalization considerations for digital tumor dissection. Genome Biology. 18 (1), 128 (2017).
- Chen, S. H., et al. A gene profiling deconvolution approach to estimating immune cell composition from complex tissues. BMC Bioinformatics. 19 (Suppl 4), 154 (2018).
- Yoshihara, K., et al. Inferring tumour purity and stromal and immune cell admixture from expression data. Nature Communications. 4, 2612 (2013).
- Foley, J. W., et al. Gene-expression profiling of single cells from archival tissue with laser-capture microdissection and Smart-3SEQ. Genome Research. , (2019).
- Civita, P., et al. Laser Capture Microdissection and RNA-Seq Analysis: High Sensitivity Approaches to Explain Histopathological Heterogeneity in Human Glioblastoma FFPE Archived Tissues. Front Oncol. 9, 482 (2019).
- . PD-L1 in cancer: ESMO Biomarker Factsheet | OncologyPRO Available from: https://oncologypro.esmo.org/Education-Library/Factsheets-on-Biomarkers/PD-L1-in-Cancer (2019)
- Haslam, A., Prasad, V. Estimation of the Percentage of US Patients With Cancer Who Are Eligible for and Respond to Checkpoint Inhibitor Immunotherapy Drugs. JAMA Network Open. 2 (5), e192535 (2019).
- Maecker, H. T., McCoy, J. P., Nussenblatt, R. Standardizing immunophenotyping for the Human Immunology Project. Nature Reviews Immunology. 12 (3), 191-200 (2012).
- Schillebeeckx, I., et al. Analytical Performance of an Immunoprofiling Assay Based on RNA Models. Association for Molecular Pathology 2019 Annual Meeting. Journal of Molecular Diagnostics. 21, (2019).
- Uryvaev, A., Passhak, M., Hershkovits, D., Sabo, E., Bar-Sela, G. The role of tumor-infiltrating lymphocytes (TILs) as a predictive biomarker of response to anti-PD1 therapy in patients with metastatic non-small cell lung cancer or metastatic melanoma. Medical Oncology. 35 (3), 25 (2018).
- Wang, K., Shen, T., Siegal, G. P., Wei, S. The CD4/CD8 ratio of tumor-infiltrating lymphocytes at the tumor-host interface has prognostic value in triple-negative breast cancer. Human Pathology. 69, 110-117 (2017).
- Carney, W. P., Bhagat, M., LaFranzo, N. Multidimensional gene expression models for characterizing response and metastasis in solid tumor samples [abstract]. American Association for Cancer Research Annual Meeting. Cancer Research. 79 (13 Suppl), (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved