Method Article
הדמיה של סידן דינמיקה באוכלוסיות משנה של תאים הלבלב איון של העכבר
In This Article
Summary
כאן, אנו מציגים פרוטוקול עבור דימות וכימות הדינמיקה סידן באוכלוסיות תאים הטרוגנית, כגון תאים איון הלבלב. כתבים פלורסנט מועברים לתוך שכבת היקפי של תאים בתוך איון, אשר לאחר מכן מאויית והתמונה, ועל ניתוח לתאים של הדינמיקה של עוצמת הניאון מבוצעת.
Abstract
הורמונים איון הלבלב להסדיר הומאוסטזיס דם הגלוקוז. שינויים בגלוקוז בדם לגרום לתנודות של סידן ציטומטוג בתאי איון הלבלב להפעיל הפרשה של שלושה הורמונים עיקריים: אינסולין (מ β-תאים), גלוקגון (α-תאים) ו סומטוסטטין (δ-תאים). β-תאים, אשר מהווים את רוב התאים של איון הם מצמידים חשמלית זה לזה, להגיב גירוי הגלוקוז כישות אחת בודדת. היכולת המδ של אוכלוסיות תת-משניות, α-תאים ותאי-תאים (ביצוע של כ -20% (30%) ו-4% (10%) של מכרסם הכולל1 (אדם2) מספרים תא איון, בהתאמה) הוא פחות צפוי ולכן הוא בעל עניין מיוחד.
חיישנים סידן מועברים לתוך שכבת היקפי של תאים בתוך איון מבודד. איון או קבוצה של איונים הוא לאחר מכן מקיבוע והתמונה באמצעות מיקרוסקופ פלואורסצנטית. בחירת מצב ההדמיה היא בין תפוקה גבוהה יותר (שדה רחב) ורזולוציה מרחבית טובה יותר (confocal). כרגיל, סריקת לייזר מיקרוסקופ קונפוקלית משמש לרקמת דימות, כפי שהוא מספק את ההפרדה הטובה ביותר של האות בין התאים הסמוכים. ניתן גם לעשות שימוש במערכת רחב-שדות, אם האות המזהם מהאוכלוסייה הדומיננטית של β-תאים ממוזער.
לאחר הדינמיקה סידן בתגובה גירויים ספציפיים נרשמו, הנתונים מבוטאים בצורה מספרית כמו עוצמת הקרינה לעומת זמן, מנורמל על הזריחה הראשונית מתוקן בסיסית, כדי להסיר את ההשפעות המקושרות הלבנת של . בסדר, שיהיה שינויים בתדר הדקר או באזור חלקי מתחת לעקומה (pAUC) מחושבים לעומת זמן, כדי לכמת את האפקטים הנצפים. pAUC הוא רגיש יותר וחזק למדי ואילו תדירות העלייה מספק מידע נוסף על המנגנון להגדיל את הסידן.
אוכלוסיות משניות של תאים משניים ניתן לזהות באמצעות תגובות פונקציונלי כדי לסמן תרכובות, כגון אדרנלין ghrelin, לגרום שינויים סידן ציטוסולג באוכלוסיות מסוימות של תאים איון.
Introduction
מטרת השיטה היא תמונה בזמן אמת שינויים בריכוז סידן ציטוסולג ([Ca2 +]cyt) באוכלוסיות משנה משניות של תאים איון הלבלב. זה מאפשר לחשוף את המנגנונים המסדירים הפרשת הורמונים בתאים אלה, חשיפת פרטים על הצלב בין סוגי תאים שונים, פוטנציאל, החדרת ממד poptional לתוך התמונה הגדולה של איתות איון.
איונים מורכבים ממספר סוגי תאים. מלבד ידוע יותר הפרשה אינסולין β-תאים, יש לפחות שתי אוכלוסיות משנה כי הם גם קריטיים בוויסות הגלוקוז בדם3. α-תאים (העושים סביב 17% של תאים איון) להפריש גלוקגון כאשר הגלוקוז בדם מקבל נמוך מדי, אשר אותות עבור שחרור של גלוקוז לתוך הדם מהמחסנים בכבד. רמות גלוקגון מוגזמת (היפרגלולומיה) וליקויי שליטה של גלוקגון-שחרור מלווים (ומבחינה טכנית, יכול לתרום) מצב טרום סוכרת של רגישות לקויה לאינסולין4. δ-תאים (סביב 2%) להפריש סוסטטין בתגובה העלאת גלוקוז. זה הורמון פפטיד בכל מקום צפוי להיות נוכח ריכוזים גבוהים בקרבת α-ו-β-תאים בתוך איונים, אשר יש חזק Gאני קולטן מתווך השפעה על גלוקגון והפרשת אינסולין.
α-תאים ו-δ-תאים לשתף חלק גדול של מכונות חישת גלוקוז עם קרובי משפחה קרובים שלהם השושלת, β-תאים. כל שלושת התאים מצוידים ב-ATP תלויי K+ ערוצים, חיישנים מטבוליים מורכבים5 השולטים הפוטנציאל קרום הפלזמה של תאים אלה להתרגש. במקביל, הפרשת אינסולין, סומטוסטטין וגלוקגון מוסדר באופן שונה על ידי גלוקוז. הדמיה של Ca2 + דינמיקה בשני אוכלוסיות משנה קטין של תאים איון יכול אפוא לספק תובנה על הצלב בין הגלוקוז בדם ופלט הפרשה איון.
נסיונות מוקדמים של ניטור היכולת הδ של α-ו-תאים באמצעות תיקון-מלחציים אלקטרופיזיולוגיה ואחריו בקרוב הדמיה של Ca2 + ב יחיד α-ו-δ-תאים. הזהות של תאים בניסויים אלה אומתה באמצעות כתמים פוגיורי עם נוגדנים אנטי גלוקגון או אנטי סומטוסטטין. מאמצים אלה היו לעתים קרובות הקשו על ידי מציאת תאים איון להתנהג בצורה שונה מאוד בתוך איון וכתאים בודדים. למרות β-תאים עשוי להיראות התורמים העיקריים של ההסדר איון (בשל הרוב המכריע שלהם שבתוכו צימוד חשמלי חזק שלהם), הפער העיקרי היה, למרבה ההפתעה, נמצא α-תאים. בתוך איון שלם, תאים אלה הם כל הזמן ובהתמדה מופעל על גלוקוז נמוך, אשר נכון רק עבור כ 7% של מפוזרים אחד α-תאים6. דיווח על פעילות של α-ו-δ-תאים בתוך איונים שלמים הוא ולכן האמין לייצג הערכה קרובה יותר של בתנאים vivo.
באופן כללי, ישנן שתי דרכים לדווח על Ca2 + דינמיקה במיוחד מתוך α-תא או δ-תאים משנה: (i) המבטא Ca מקודד גנטית2 + חיישן באמצעות מקדם רקמות ספציפי או (ii) באמצעות מרכיבי סמן. הגישה לשעבר אלגנטי יותר מוסיף את היתרון הניכר של הדמיה האמיתי 3D ולכן לימוד של התפלגות התא בתוך איון. זה לא יכול להיות מיושם עם כל חומר איון האנושי שלם. הדאגה הפוטנציאלית נוספת היא ' לדאוג ' של היזם, במיוחד כאשר β-/α-תא בידול או α-תא התגובה לגלוקוז גבוה נמצא במקום. ניתן להשתמש בגישה האחרונה עם רקמה מבודדת טרייה, כולל דגימות אנושיות או איונים מתורבתים. הנתונים, עם זאת, נאסף אך ורק מן השכבה ההיקפית של תאים איון, כמו אספקת מולקולה לצבוע/סמן בשכבות עמוקות יותר מבלי לשנות את האדריכלות איון הוא מאתגר. יתרון בלתי צפוי של הגישה האחרונה הוא התאימות עם מצב דימות שטח רחב, אשר מאפשר לטפס את הניסויים להדמיה סימולטני של עשרות או מאות איונים (כלומר, אלפי עד עשרות אלפי תאים).
סידן הוא התמונה ב vivo באמצעות מקודד גנטית gcamp7 (או קרום הלב8) משפחה חיישנים, אשר הם משתנים של חלבון פלורסנט מוטציה ירוקה (gcamp) התמזגו הסידן מחייב חלבון קלמודולין ואת רצף היעד שלה, M13 קטע של רירן שרשרת האור קינאז7,9. Gcamps יש יחסי אות לרעש מעולה בטווח של nanomolar Ca2 + ריכוזי ו-2-פוטון גבוהה-חתך, מה שהופך אותם בחירה אידיאלית עבור vivo עבודה10,11. ההיבט המאתגר של שימוש בחיישנים רקומביננטי הוא המסירה שלהם לתוך התאים. הביטוי הטרוולוגי דורש שימוש בווקטור וקטור ויראלי רב שעות לשעבר vivo culturing, אשר לעתים קרובות מעלה חששות לגבי בידול פוטנציאלי או הידרדרות של פונקציות התא. למרות מודלים העכבר מראש מהונדסים לבטא GCaMP בעיה זו, הם מוסיפים אתגרים חדשים על ידי הגדלת זמן החפיפה באופן משמעותי והגבלת העבודה למודל לא אנושי. רגישות גבוהה מאוד שינויים של pH תאיים הוא עוד צד שלילית של חיישנים מבוססי חלבון12, אשר, עם זאת, פחות בעיה לחישה אותות מנדנוד, כגון Ca2 +.
היתרון של צבעים הניתנים למיפוי (כגון פלורסנט ירוק Fluo4) הוא שהם יכולים להיות נטענים לתוך רקמה מבודדת טרי בתוך כשעה. באופן כצפוי, צבעים הניתנת למיפוי כוללים יחס נמוך יותר של אות לרעש ו-(הרבה) פוטויציבות נמוכה יותר מאשר עמיתיהם הרקומביננטי. אנחנו לא יכולים לאשר13 דוחות של רעילות של צבעים הניתנים למיפוי14, עם זאת, העמסת צבע היא בעיה תכופה.
Red רקומביננטי Ca2 + חיישנים המבוססים על תמורה מעגלית התפתחו במהירות מאז 201115, וההתפתחויות האחרונות להציג תחרות חזקה gcamps16 לדימות רקמות, נתון עומק גבוה יותר של חדירה של אור אדום. צבעים מסחרית זמין אדום למיפוי ניתן להשתמש מהימן עבור הדמיה בודדת תא, אבל, ברמת הרקמה, לא יכול להתחרות היטב עם אנלוגיות ירוק.
יש לכאורה מעט מאוד בחירה של טכנולוגיית הדמיה לניסויים ברקמה שבה אור מחוץ לפוקוס הופך לבעיה קריטית. המערכת קונפוקלית מספק רזולוציה מקובלת תא יחיד על ידי ביטול של אור out-of-פוקוס עם כל מטרה על NA לעיל 0.3 (עבור המקרה של GCaMP6) או 0.8 (צבע למיפוי). במובן הטכני, מיקרוסקופ קונפוקלית וקד קונבנציונאלי ניתן להשתמש עבור הדמיה בו של [Ca2 +]cyt ממאות (gcamp) או עשרות איונים (צבע למיפוי). החלופה הריאלית היחידה למצב קונפוקלית וקד במקרה של ביטוי תלת-ממד של החיישן ברקמה היא אולי מיקרוסקופ גיליון קל.
הדברים הם מעט שונה עבור המקרה כאשר החיישן מתבטא בשכבת היקפית של תאים בתוך רקמת איון. עבור חיישנים רקומביננטי בהירים כי יש דפוס ביטוי תאיים בצורה מלאת חיים, באמצעות מצב הדמיה שטח רחב עם מטרה נמוכה-NA עשוי לספק איכות מספקת תגמול החוקר עם עלייה משמעותית בשדה של שטח התצוגה ומכאן ה תפוקה. מערכת רחבה מספקת את הרזולוציה המרחבית העניים יותר, כאשר האור היוצא מהמוקד אינו מבוטל; לכן, רקמת הדמיה עם high-NA (עומק נמוך של שדה) מטרות אינפורמטיבי פחות, כמו האות תא בודד הוא מזוהם בהרבה על ידי תאים שכנים. הזיהום הוא הרבה יותר קטן עבור נמוך-NA (עומק גבוה של השדה) יעדים.
עם זאת, קיימות משימות שעבורן תפוקה גבוהה ו/או קצב דגימה יהפכו ליתרון קריטי. α-ו-δ-תאים התערוכה טרוגניות משמעותי, אשר יוצר ביקוש לגדלים גבוהים לדגום כדי לחשוף את התרומה של אוכלוסיות תת. הדמיה שטח רחב הוא מהיר ורגיש יותר, עם הדמיה של שדה גדול בקנה מידה של מערכת תצוגה מאות (gcamp) או עשרות (Fluo4) של איונים באותו יחס אות לרעש כמו ניסויים קונפוקלית וקד על 10 או איון אחד, בהתאמה. הבדל זה בתפוקה הופך את יתרון המערכת לשטח רחב עבור הדמיה בעלת רזולוציה של תא בודד, שיכולה להיות קריטית במיוחד עבור אוכלוסיות משנה קטנות כגון δ-cell 1. באופן דומה, ניסיונות לשחזר את פעילות החשמל מ-Ca2 + הטבה17 יהנה מקצב הדגימה הגבוה יותר שסופק על-ידי מצב הדמיה של שדה רחב. באותו זמן, כמה "נישה" בעיות כמו הפעילות של הלבלב α-תאים על גירוי של β-cell שולט האוכלוסייה המשנה, לדרוש שימוש במערכת קונפוקלית וקד. גורם המשפיע על ההחלטה לקראת מצב של מוקד הוא נוכחות של אות מזהם ניכר מאוכלוסיית המשנה β cell.
למרות שימוש בנוגדן ספציפי הורמון מכתים כדי לאמת את זהותו של התאים לאחר ניסויים הדמיה היא עדיין אופציה, תת האוכלוסיות התא מינורי ניתן לזהות באמצעות תרכובות סמן פונקציונלי, כגון אדרנלין גרלין שהיו הראו סלקטיבי לעורר Ca2 + דינמיקה ב α-18 ו-δ-תאים19,20, בהתאמה.
הניתוח של נתוני הדמיה בזמן שואפת לספק מידע מעבר לפרמקולוגיה טריוויאלית, כגון טרוגניות, מתאם ואינטראקציה של אותות שונים. מקובל, נתוני הדמיה מנותח כעוצמה לעומת הזמן מנורמל הזריחה הראשונית (F/F0). תיקון בסיסי נדרש לעתים קרובות, בשל הלבנת האות fluorophore או זיהום על ידי שינויים באור פלואורסצנטית או pH (בדרך כלל נגרמת על ידי רמות millimolar של גלוקוז12). Ca2 + נתונים ניתן לנתח בדרכים שונות רבות, אבל שלוש מגמות עיקריות הן למדוד שינויים בתדר ספייק, שבר הרמה, או באזור תחת העקומה, מחושב לעומת זמן. מצאנו את יתרון הגישה האחרון, במיוחד ביישום מידע ממוקד ביותר שנדגמו. היתרון של מדד pAUC הוא הרגישות שלה לשני השינויים בתדר ובשרעת האותות, בעוד שחישוב התדר מחייב מספר משמעותי של תנודות במספר21, שקשה להשיג באמצעות הדמיה קונבנציונאלית. הגורם המגביל של ניתוח pAUC הוא הרגישות הגבוהה שלה לשינויים בסיסיים.
Protocol
כל השיטות המתוארות כאן פותחו בהתאם לחוק בעלי חיים בבריטניה (הליכים מדעיים) (1986) וההנחיות האתיות של אוניברסיטת אוקספורד.
1. לבודד לבלב איים הלבלב
- הכן את מדיום התרבות ואת פתרון הבידוד.
- הפוך את מדיום התרבות: RMPI1640 (ראה טבלת חומרים), שיושלם עם 10% סרום עגל עוברי, 100 יחידות/, 100 Μg/ml סטרפטומיצין. לוותר על המדיום לתוך 2 60 מ"מ מנות פטרי מפלסטיק (לא מטופלים עם דבק), ולשמור את הכלים בחממה (37 ° c, 5% CO2, לחות מוחלטת).
- הפוך את פתרון הבידוד (50 mL/עכבר): בינונית של הנקס עם גלוקוז 5 מ"מ, 100 יחידות/מדיום סטרפטומיצין 100 μg/mL. המשיכו בקרח (4 ° c).
- הפוך את פתרון האנזים (למשל, Liberase): 0.2 mg/mL בפתרון הבידוד, 2 מ ל לכל עכבר. המשיכו בקרח (4 ° c). באופן אופציונלי, לבחון מראש את הפעילות של liberase, ולייעל את הפרמטרים הדגירה עבור כל אצווה של האנזים22.
- הכנס את פתרון האנזים לתוך צינור המרה של העכבר.
- להקריב את העכבר (12-שבוע נקבה, C57Bl/6J) באמצעות פריקה צוואר הרחם.
- תחת מיקרוסקופ לנתיחה, לחתוך את העור ואת שכבות השריר באמצעות מספריים עדינים לאתר את צינור המרה.
- ליגייט המעי משני צידי הצומת עם צינור המרה, באמצעות חוט כותנה.
- הרם את צינור המרה בעדינות עם מלקחיים של שען בסדר מעוקל ולהציג את פתרון האנזים קר קרח לתוך הצינור באמצעות מזרק 2 מ ל עם מחט 30G. יש לצפות באינפלציה של הלבלב בשלב זה.
- לאסוף את הלבלב מנופח באמצעות שילוב של מלקחיים האגודל קהה-חוטם ומלקחיים של שען משובח לתוך שפופרת 15 mL פלקון ולשמור אותו על קרח (4 ° c). הוסיפו 1 מ ל של פתרון האנזים לתוך השפופרת.
- לשחרר ולאסוף את האיים הלבלב מן הלבלב.
- הpancreata מתנפח עם פתרון אנזים עבור 16 דקות באמבט מים, ב 37 ° c. ניתן להשתמש בטלטול עדין אך לא ביקורתי, בתנאי שאינפלציה טובה.
- לעצור את העיכול על ידי הוספת פתרון הבידוד קר קרח, עד 10 מ"ל. לנער בעדינות את התקציר: זה צריך ליפול לחתיכות קטנות.
- לשטוף את התקציר שלוש פעמים ב 10 מ ל של פתרון הבידוד, לתת לעמוד 5 דקות ב 1 x g כדי משקעים האיים המשוחררים, על קרח. . עם פיפטה בגוון של 10 מ ל
- הוסף RPMI קר לתקציר (כדי להרוויח עד 10 מ"ל).
- השתמש בצלחות פטרי מפלסטיק (שלב 1.1.1) כדי לבחור את איונים. Decant מדיום RMPI את אחת ממנות פטרי, ובעדינות למזוג כמה (4-5 mL) של התקציר במקום. אספו את האיונים המשוחררים המופיעים כחלקים עגולים, חלקים ובעלי צפיפות גבוהה, עם פיפטה P10 לצלחת הפטרי השנייה.
- תרבות האיים בחממה (37 ° c, 5% CO2, לחות מוחלטת). ניתן להשהות את הניסוי בשלב זה. לעזוב את איונים עבור 1-2 שעות הוא האמין על ידי כמה כדי לעזור להתאושש מהלחץ המכני במהלך הבידוד.
2. לטעון את הצבע או לבטא את החיישן
- הכן את הצבע הניתנת למיפוי.
- לפזר את סדרת מחלקים (בדרך כלל, 50 μg) של הצבע הניתנת למיפוי (למשל, fluo-4) ב dmso לריכוז מלאי של 2 מ"מ. הוסף חומצה פלורליסטית לריכוז סופי של 1% (באמצעות מלאי של 20% ב DMSO), כדי לשפר את הפתרון של הצבע.
- מחלקים את הצבע בצינורות PCR קטנים (2 μL לכל אחד). ניתן לאחסן את הצבע קפוא (-20 ° c) במשך מספר שבועות.
- לחילופין, הכינו את החיישן הרקומביננטי.
- הפץ את החיישן (g. אדנונגיפי קידוד וקטורי GCaMP6f) לתוך 10 μL ali, ולאחסן ב-80 ° c.
- (אופציונלית) לבדוק מראש את סיכוייו של מלאי נגיפי ידי הדבקת איונים (כמו להלן) באמצעות מספר מדלל טורי, כדי לחשוף את הריכוז האופטימלי לזיהום.
הערה: חיישנים רקומביננטי המקודדים על ידי וקטורים שונים (לווירוס, באקאם, AAV) דורשים פרוטוקול זיהום שונה. הקפד לבדוק זאת עם ספק וקטורי ולמטב את יחס העבודה לצרכיך. מלאי "העבודה" של אדנווירוס יכול להיות מאוחסן ב-20 ° צ' וקפואים/מופשרים מספר פעמים. מוגזם להפשיר הקפאת אופניים מפחית את סיכוייו יעיל של הווירוס.
- הכן את פתרון ההדמיה.
- לפצות את הפתרון הדמיה, mM: 140 היום, 4.6 KCl, 2.6 CaCl2, 1.2 MgCl2, 1 נה2פו4, 5 נחקו3, 10 hepes (pH 7.4, עם naoh).
- הפוך מלאי של גלוקוז (0.5 M) ו ניטול (0.5 m) בפתרון ההדמיה. ניתן לאחסן את המניה במקרר (4 ° c) במשך מספר שבועות.
- טען את הצבע הניתנת למיפוי.
- הפוך את פתרון העבודה לצבוע על ידי המסת 2 μL של הצבע ב 600 μL של פתרון הדמיה המכיל 6 מילימטר גלוקוז. הפתרון יכול להיות מחומם או מבורך כדי לשפר את מסיסות.
- לטעון את איונים מבודדים בשלב 1 לתוך פתרון העבודה של הצבע. ניתן לבצע טעינה באמצעות צלחת מרובת היטב או צלחת פטרי. במקרה האחרון, מניחים 100 μL droplet של פתרון העבודה בחלק התחתון של צלחת פטרי שאינה מדביקה (35-או 60-mm) ו פיפטה 10-30 האיים ל-droplet.
- במקרה של קבוצות שונות של איונים (למשל פראי-סוג/לנקוש), לסדר בארות מרובות ומספר טיפות כדי שהטעינה תוכל להתבצע בו זמנית.
- מודלת את איונים בפתרון העבודה לצבוע בטמפרטורת החדר בחושך עבור 70-90 דקות. . אל תעשה מחדש את הדגירה
- בדוק את הטעינה מתחת למיקרוסקופ הזריחה; איונים צריכים לצבור זריחה קלה, עם כמה תאים להיות בהירים יותר מאשר את השאר. עיגול התאים והלוקליזציה הגרעינית של הצבע הם סימנים לעומס יתר.
- העבר את איי האיונים לפתרון הדמיה ללא צבע המכיל 6 מילימטר גלוקוז. איונים ניתן להשתמש להדמיה באופן מיידי, אך באופן אופציונלי ניתן להשאיר את הצבע כדי לבטל את השימוש בעוד 10-15 דקות. איונים ישמרו את הצבע במשך מספר שעות ולכן ניתן להשתמש בו לדימות בכמה משמרות.
- לחילופין, להדביק את איונים עם וקטור רקומביננטי.
- צלחת האיונים ב טיפות ב RPMI culturing בינונית (צעד 1.1.1) (למשל, 30 μL), כדי למזער את נפח הצורך וקטור.
- הוסף את הווקטור ביחס של כ 105 יחידות זיהומיות/איון זה צריך לגרום באופן אידיאלי ריבוי של זיהום > 2. באופן אידיאלי, יש למטב את היחס ליחס המינימלי שיספק ביטוי בשכבה ההיקפית. טרום-טיטור (שלב 2.2.3) עשוי לסייע.
- הציגו 20-50 איונים לתוך ה-droplet והתרבות במשך 8-48 שעות. (באופן אידיאלי, לילה). איונים צריכים לפתח זריחה ירוקה חלשה ברוב התאים, ללא שינויים במבנה התאים.
הערה: הצלחת הזיהום והביטוי תלויה בזמן החשיפה לפתרון הווירוסים. באופן אידיאלי, הווירוס צריך להישאר בפתרון לילה, אבל ניתן להסיר אופציונלית לאחר כמה שפחות 15 דקות. עם זאת, הנגוע, ולכן ביטוי, צפוי להיות נמוך באופן דרמטי.
3. הדמיה Ca2 + דינמיקה
- לשתק את האיים תחת (הפוך) המיקרוסקופ.
- הכנס את חדר ההדמיה למיקרוסקופיה הפוכה. מיקום שמיכות זכוכית (עובי 1 או 1.5) בתוך החדר וודא כי ממשק תא זכוכית הוא הדוק מים. בדוק כי coverslip הוא בהישג יד של מטרת המיקרוסקופ (קריטי במקרה של מטרה גבוהה-NA מגושם).
- . הכן את אביזרי השתק גזור מלבנים קטנים (20 מ"מ x 20 מ"מ) מן הרשת היפה ואת רשת גסה. הצג שני מרווח "קירות" על רשת בסדר באמצעות קלטת דביק 45-50 יקרומטר עבה. השתמש בשכבות כפולות של הרווח אם הגודל של איים להיות-להיות-התמונה משמעותית חורג 100 μm קונבנציונאלי.
- הישאב את הרשתות ואת המשקל לתוך פתרון ההדמיה באמצעות צלחת פטרי 35 מ"מ. ודא שהפלסטיק והמתכת רטובים.
- תחת מיקרוסקופ לנתיחה, סובבו את הרשת העדינה עם הקירות הפוכים, החללים הפונים כלפי מעלה. לבחור מספר איונים טעון עם הצבע הניתנת למיפוי או לבטא את החיישן רקומביננטי עם P20 הצינורות בעדינות למקם אותם על גבי רשת בסדר, בין שני מרחבי. ודא שרשת השינוי והדיסקיות אינן מכילות כמויות מוגזמות של פתרון ההדמיה עליהם.
- להרים את הרשת עם איונים, באמצעות מלקחיים של שען, ולמקם אותו הפוך בתוך חדר ההדמיה, כך את החללים הפנים כלפי מטה ולשבת ישירות על שמיכות קאמרית. ודא כי האיים לכודים בין החללים לבין הרשת, באמצע הכיסויים.
- מקמו את רשת השינוי הגסה ואת המשקל על גבי הרשת העדינה בתוך התא. הציגו את פתרון ההדמיה בתוך החדר. ודא שאיונים הם ללא תנועה ומוכנים לדימות. הימנעו מטלטול מופרז של החדר (רטבאליות קטן כמו נשיאת החדר למיקרוסקופ והחדרת לשלב מחומם מקובלים).
הערה: ניתן ליישם הסדר משתק דומה עבור מערכת זקופה.
- . הגדר את המיקרוסקופ
- בחר את מצב הדמיה ואת המטרה, למקם את התא עם איונים משלב 3.1 על השלב בקרת טמפרטורה של המיקרוסקופ.
- הגדר את בקרת הטמפרטורה (באופן אידיאלי, בין 30 ° צ' ו-36 ° c) לבין הפריזיה. עבור מערכת הפוכה, הצב את הזרימה הפנימית נמוכה יותר מהזרימה החיצונית בתוך התא, וקבע ששטף הזרימה יהיה גדול מזה של הזרימה הפנימית (שבדרך כלל מושגת באמצעות אבובים של קוטר פנימי רחב יותר על משאבה פריסטלטית).
- ודא שליצוא יש משטח מגע מינימלי עם הפתרון, כך שהוא יסיר את הפתרון בטיפות קטנות מרובות רציפים, תוך הימנעות ממרווחי זמן ארוכים של הסרת פתרונות רציפה. האחרון הוא המקור העיקרי של הפריט בהדמיה בזמן הדמיה של אותות הכתב העת כפי שהם מופיעים באופן סדיר תנודות בעוצמה תקופתית של כל פיקסל הדמיה ומפורשים לעתים קרובות "גלים איטיים".
- להפעיל את הפריפיוז עם פתרון הדמיה המכילה 3 מ"מ גלוקוז.
- לבחור את נתיב האור ומסננים עבור הדמיה של fluorophores ירוק; העירור בין 470 ו 500 ו פליטה בין 505 ו 550 יעבוד עבור כל אחד מהם.
- הפעל הדמיה חיה כדי להגדיר את פרמטרי ההדמיה. כוונן את התצוגה כדי ללכוד את איי העניין.
- מטב את היחס בין אות לרעש של התמונה. לשם כך, להתאים את עוצמת האור עירור, את זמן החשיפה ואת binning. ודא כי ההגדרות מאפשרות ויזואליזציה ברורה של כל תא בתוך איון בעוצמת אור מינימלית אפשרי וחשיפה.
- בצע רכישת תמונה. בהתאם למשימה, ניתן לקחת תמונות ב-0.1 עד 5 Hz. זה הרבה מתחת לקריטריונים של נייקוויסט עבור התנודות המהירות של Na+-מונחה ב-α-ו-δ-תאים (≫ 300 Hz), כלומר הנתונים אינם מנדגמו כברירת מחדל. עם זאת, הגדלת תדירות הרכישה כדי להתאים את הביקוש הזה הוא לא ריאלי הדמיה רב-תאיים/multi-איון עם שדה גדול של נוף. GCaMP ניתן לדימות מהר יותר, בעוד Fluo4 יהיה מלבין בלתי נמנע תחת תנאי רכישה מהירה.
הערה: בהינתן כי [Ca2 +]cyt בתאי האיון מונעים על ידי פעילות חשמלית, שימוש בקצבי רכישה נמוכים עשויים להישמע לא מועיל. במציאות, עם זאת, שיעורי הרכישה בסביבות או מעל 1 הרץ יכול להיות מספיק לפתרון התנהגות β-cell13, בעוד הסף לגילוי של התנועה המונעת בערוצי נתרן ב α-ו-δ-תאים הוא הרבה מעל 300 Hz. בין אם האוספים של α או δ-cell [Ca2 +]cyt נרכשים ב-1 hz או 0.1 hz, הם יהיו בלתי מנוצלים באופן חמור וישקפו Ca2 + טיפול בתא במקום פעילות חשמלית.- בדוק את איכות הנתונים שנרכשו: בשנת 3 מ"מ גלוקוז, α-cell פעילות צריך להיות גלוי/לזיהוי בבירור. ודא שזהו המקרה והמשך לדימות בקנה מידה מלא לפקיעה בזמן.
- בחר את מצב הדמיה ואת המטרה, למקם את התא עם איונים משלב 3.1 על השלב בקרת טמפרטורה של המיקרוסקופ.
- הדמיה של מעידה בזמן
- בצע שימוש בתרשים מקוון של דינמיקת האותות, המיושם בתוכנת הרכישה אם אפשרות זו זמינה. אם תרשים מקוון אינו מהווה אפשרות, החל את הסימון בטבלה המציגה את עוצמת האות באופן המקיף ביותר (כגון "קשת").
- החילו את הגירויים בצורה הפיכה: הקלט את החזרת האות לרמה הבזפית. התעלמו מחפצי האמנות בהתחלה ובסוף ההקלטה; האחרון עשוי להיראות כמו "להגדיל" בלתי הפיך "/" ירידה "של הזריחה החללית עקב שינויים ב-pH או מוות תאים.
- להבדיל α-תאים על ידי מנדנוד Ca2 + דינמיקה, ב גלוקוז נמוך. הצגת אדרנלין או גלוטמט לתוך הפתרון אמבטיה, הפיכה עבור 2-5 דקות. קפיצה מהירה ב [Ca2 +]cyt ואחריו איטית-down או ביטול של תנודות יהיה לעקוב.
הערה: האדרנלין הוא מתחם סמן מוכר עבור α-תאים, כי יש השפעה חיובית סלקטיבית על האוכלוסיה הזאת של תאים איון, בתיווך על ידי שחרורו של Ca2 + מן מחסני תאיים18. גלוטמט כבר הושם בתור עוד α-תאים ספציפיים אגוניסט23. - הוספה/הסרה של ghrelin, אשר דווחה לאחרונה כדי להפעיל את δ-cell באופן סלקטיבי19,20. שימו לב לעלייה הפיכה מהירה ב [Ca2 +]cyt באוכלוסיית משנה קטנה של תאים איון.
- הוספה/הסרה של גלוקוז 20 מ"מ. שימו לב לתגובת נדנוד מתואמת באוכלוסיית המשנה של התא הβ. שים לב לתגובה של תאים שהופעלו מוקדם יותר על ידי אדרנלין או גלוטמט ו-ghrelin.
- שמור את רצף התמונות. שקול להשתמש ב"שמירה אוטומטית" במהלך ההקלטה.
4. ניתוח הנתונים
- לנתח את תמונת הזמן הפקיעה.
- יבא את תמונת הזמן לתוכנת ניתוח תמונה, כגון ImageJ/פיג'י של קוד פתוח.
- אם התרחשה תנועה משמעותית/מהירה במהלך ההקלטה, מחק את הנתונים כבלתי ניתנים לתיקון. השתמש בתוספים של StackReg או TurboReg24 כדי לתקן שוליים קטנים.
- יצירת תמונת מסיכה למיפוי תאים ואזור הריבית (ROI). הדרך המועדפת להשיג זאת תהיה ליצור תמונת מחסנית באמצעות אחת מהפונקציות כגון "עוצמה ממוצעת" או "עוצמה מירבית". הפונקציה לשימוש היא זו שתספק את ההכרה הטובה ביותר של תאים בודדים.
- סף תמונת המסיכה, הסר את כל הנתונים מחוץ לאזור איון. הפונקציה פועלת במצב אוטומטי עבור תמונות 32 סיביות.
- לזהות את מקסימה בתמונת הסף. מקסימה יכול להיות מיוצג על ידי נקודות, אזורים או אפילו סקטורים, אם התמונה היא צפופה.
- להחיל את "למצוא מקסימה" הפונקציה ללא כל הגבלות גודל ולהדביק את מקסימה זוהה לתוך אזור הריבית (ROI) עורך.
- חלק/אינטרפולציה כל אחד מסוגי ROIs ממופה; יכול להיות. שה "ידרוש התרחבות סקריפט פשוט יכול להיכתב (4.1.6-4.1.8) ולרוץ מספר פעמים כדי לספק תוצאות זיהוי תאים הטוב ביותר. ייתכן שכמה ROIs חופפים אבל זה נדיר.
- לנתח את המיקום של ROIs ולהדביק את הנתונים X ו-Y המתאימים לתוך תוכנת הטבלה האלקטרונית (למשל, Microsoft Excel).
- לנתח את העוצמה האפורה לעומת הזמן עבור כל ROIs ולהדביק את הנתונים לתוך תוכנת הטבלה האלקטרונית.
- נתח את הנתונים המספריים.
- יבא את הנתונים לתוך תוכנת ניתוח הנתונים. בהתאם לבחירה של התוכנה ואת המשך/דגימה/גודל של הניסוי, זה יכול להיות פעולה פשוטה הדבקה העתקה או הליך עצמאי. ודא את הסידור והאחסון של הנתונים המספריים.
- יבא את חותמות הזמן או את הערות הזמן, אם זמינות.
- לנרמל את עוצמת הזריחה הגולמית של הנתונים ("F") לערך ההתחלתי של הזריחה ("F0"). זה לא צריך להיות הזריחה בנקודה הראשונה מאוד אבל יכול להיות ממוצע של מספר נקודות ראשונות. על הנורמליזציה להקטין את השונות של הנתונים, ובמקרה אידיאלי (ללא הבסיס הנסחף) יש תוצאה של ערכת נתונים analyzable ("F/F0").
- אם ההבדלים בין התאים לתאים של ערכת הנתונים F/F0 משמעותיים עדיין (הקלטה ארוכה, הלבנה), בצע את התיקון הבסיסי. לשם כך, להגדיר ' בקרת ' אזור, כלומר טווח הזמן שבמהלכו פתרון הבקרה (עבור לבלב איונים של העכבר, 3 מ"מ גלוקוז ללא כל אגוניסטים/אנטוניסטים) הוחל.
- אם לאזור הבקרה יש אות שאינו מנדנוד ברור, הנח כי F/F0 חזר לערך ההתחלתי (F/f0= 1) לאחר כל יישום של פתרון הפקד. תקן את נתוני פקיעה הזמן עבור כל תא על-ידי פיצול הנתונים למקטעים, המופרדות על-ידי הנקודות בעת הוספת פתרון הפקד והחלת תיקון ליניארי על כל פלח. אין להשתמש בקוד פולינומיאלי או בתיקון לא לינארית אחר כתוצאה מפריטים אלה.
- אם לטווח הבקרה יש תנודות ברורות או גורמים נוספים (כגון התאמה אוטומטית של אופנה), השתמש באלגוריתם לזיהוי דקר17. מרוץ טריוויאלי ומהיר עבור זה הוא שינוי אדוה רגיש מקסימה (איור 3א).
- לכמת את הנתונים. למרות ש-Ca2 + הוא אות דינמי במיוחד, המציג את ca2 + נתונים במונחים של ערכי f/f0 מוחלטים מקובלים בספרות ביו-רפואית. אם יש להשוות את התוצאות מניסויים מרובים, בחרו מדד.
- למדוד את התדירות של Ca2 + קוצים (איור 4A, D), ואת תגובתה לתוספת של (נמלים) אגוניסטים. לשם כך, פצל את ההקלטה למרווחי זמן שווים וחשב את הtimecourse של התדר החלקי (תדר העולה בכל אחד מהמרווחים) על-ידי ספירת קוצים בתוך המרווח ונרמול למשך המרווח.
- לחלופין, הגדר את הסף וחשב את שבר הרמה (pf) עבור כל אחד ממרווחי הזמן שהוגדרו לעיל (איור 4B, F). השבר מציין את אחוז הזמן בתוך המרווח שהתא בילה במצב "נרגש".
- לחילופין, חשב את האזור החלקי תחת העקומה (pAUC) עבור כל אחד ממרווחי הזמן שהוגדרו לעיל (איור 4ג, ג). מדד זה רגיש לשינויים בתדר ומשרעת העליה.
הערה: אזהרה אחת עבור תדר מדידה היא חוסר רגישות למשך ספייק יציבות העניים. כאשר הנתונים הם מאוד בלתי מוערך לעומת הזרם החשמלי, מספר קוצים לכל מרווח הוא קטן למדי ולכן ספייק נוסף הבלעדית יכול להשפיע באופן דרמטי את התוצאה. צוואר הבקבוק של הפאולק הוא הרגישות שלו לשינויים בתוכנית הבסיסית. למרות פחות נוטה לחפצי אמנות ורגישים יותר לשינויים ב [Ca2 +]cyt מאשר תדירות, pauc בכל זאת אינו אינפורמטיבי מאוד על הטבע של Ca2 + דינמיקה. שבר ברמה הוא הרחבה של תפיסת ההסתברות הפתוחה למערכת הסלולרית השלמה. היא חזקה פחות מאשר pAUC, בגלל התלות בערך הסף.
תוצאות
האיים לטעון היטב עם הצבעים הניתנת למיפוי (איור 1א), אלא אם הרכב השומנים של הקרום הושפע (למשל, על ידי חשיפה כרונית לחומצות שומן). האדם אדנווירוס סוג 5 (Ad5) וקטור גם מטרות כל התאים איון (איור 1B). בעיות עלולות להתעורר כאשר יותר מחיישן רקומביננטי אחד מבוטא באותו תא. יתר על כן, איונים הם בדרך כלל מאוד היטב מקיבוע באמצעות הטכנולוגיה המתוארת לעיל, אשר מספק יציבות יוצאת דופן וגישה לפתרון.
Ca2 + העולה ב α-תאים ניתן לזהות בקלות ברמות גלוקוז נמוך (איור 2). יש מתאם גבוה תא אחר תא בין הפעילות בגלוקוז נמוך ואת התגובה אדרנלין ו גלוטמט. Ghrelin מפעיל כמה האדרנלין תגובה לתאים (α-תאים?) ב גלוקוז נמוך עדיין אין לו השפעה על Ca2 + דינמיקה ברוב התאים המופעל על ידי גלוקוז נמוך (β-תאים).
כאשר מנותח במונחים של תדר חלקי (איור 4A, C), האדרנלין-או מגורה בתאי הגירוי להציג עלייה משמעותית תחת התנאים של הכל או שום דבר. כלומר, תא עם פעילות בסיס נמוכה המופעלת על-ידי אדרנלין או מראה גרלין הגידול הדרמטי במדד זה. עם זאת, השינויים הכוללים בין הבסיס הבזליים אפקט האדרנלין הם עדינים מאוד (איור 4א, ג). לעומת זאת, ה-אוק החלקי רגיש לשינויים שהוצגו על ידי אדרנלין בכל התאים, גם כאשר הפעילות הבזליים גבוהה (איור 4B, D).

איור 1: טעינת הצבע הניתנת למיפוי וביטוי של החיישן הרקומביננטי באיונים. איונים של עכבר אופייני שנטענו עם הצבע Fluo-4 (A) או ביטוי רקומביננטי חיישן GCaMP6 בשכבה ההיקפית של תאים (ב) או בשכבה עמוקה יותר (C). מעקב קוטבי sulforhodamine B (SRB, הראה לבן) כבר נוצל לחלוקה לרמות בודדים בתוך כל איון25. (ד) מייצג קינטיקה של Ca2 + בתגובה גלוקוז הקליט תאים בודדים בתוך איון באמצעות Fluo4. שים לב לטרוגניות בתוך אוכלוסיות תאים משניות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: Ca רגיל2 + תגובה של תאים איון לגירויים שונים. טיפוסי α-תא (A) ו-δ-Cell (ב) Ca2 + דינמיקה, בתגובה אדרנלין, גלוטמט, ghrelin, גלוקוז. (ג)-(ד) מפות החום של תגובת התא איון מראה אדרנלין-חיובי (C) ו ghrelin-חיובי (D) תת אוכלוסיות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
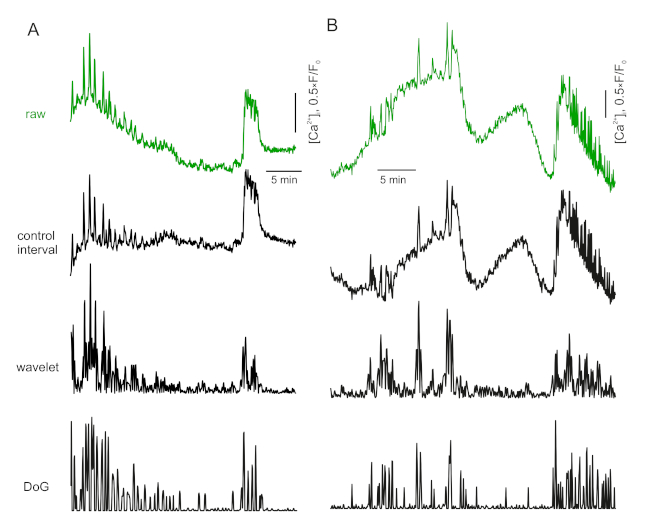
איור 3: תיקון בסיסי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
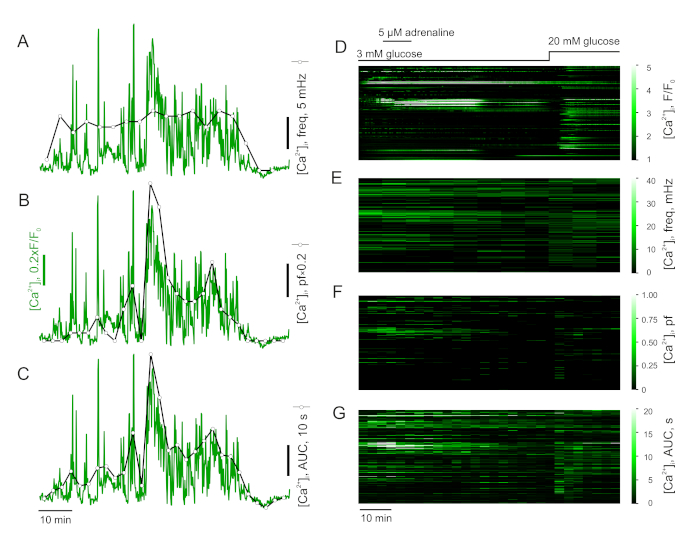
איור 4: ניתוח נתוני הפקיעה בזמן. ניתוח של Ca2 + דינמיקה ב α-תאים. תדר חלקי (A), שבר ברמה (ב) ובאזור תחת העקומה (ג) של תאים-α [Ca2 +]אני עוקב. להיות מפורסם [Ca2 +]אני נתונים מתוך עכבר הלבלב איון הביע Raw (f/f0) (D), תדר חלקי (E), שבריר רמה (F) ואזור תחת עיקול (G). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
ישנם שלושה שלבים בפרוטוקול הקריטיים להצלחה הכללית. הזרקה מוצלחת של האנזים Liberase לתוך צינור המרה קובע לא רק את ההצלחה הכמותית של הליך הבידוד, אלא גם משפיע על האיכות של איונים מבודדים. Pancreata מנופח עלול לגרום להעדר כמה תגובות מטבולית חשוב באיים מבודדים. שנית, טעינת הצבע/ביטוי החיישן מגדירה את היחס בין האות לרעש של ההקלטה בזמן הקלטה. אותות נעדרים או מנוכה באיונים עמוסים. לבסוף, מיקום מוצלח וצפוף של הרקמה בתוך חדר ההדמיה הוא רגע מגדיר עבור ניסויים משמעותיים וanalyzable. במיקום גרוע או רקמה נעה מבוזבז בזמן ניסיוני ו/או נתונים לא ברורים.
ניתן לשנות את השיטה לחשבון עבור מספר רב של אותות (באמצעות מערכת החיבור) וקבוצות מרובות של איונים (למשל, של גנוטיפ שונים). הדמיה של אותות מרובים מניח משלוח של חיישן שני לתוך כל תא של איון, באמצעות ספקטרוברית תואם את ה-Ca2 + כתב (כגון חיישן pH SNARF5f26,27). לשם כך, איונים יכול להיות שיתוף טעון/שיתוף נגועים עם Ca2 + ו-pH חיישנים, אשר לאחר מכן ברצף התמונה בתוך כל מסגרת זמן.
הדמיה של האות בקבוצות של איונים עם רזולוציה של תא יחיד מחייבת שימוש במטרה רחבה של שדה-תצוגה. המטרה עשויה להיות נמוכה יותר הגדלה ומספרית הצמצם (NA), ובכך להקטין את הרזולוציה המרחבית. בשל עומק המיקוד המוגבר של מטרת ה-low-NA, ניתן לבצע הדמיה במערכת בעלת שדה רחב. החסרונות של סידור זה הם תא תא החוצה זיהום של האות האור ויכולת מופחתת לצלם את האות תלת-ממד (למשל, עכברים המבטאים את Ca2 + חיישן תחת היזמים אינסולין). באותו הזמן, האות מבוטא תאים איון השטח יכול להיות נפתרה באופן מושלם עם רזולוציה גבוהה בזמן מקבוצות כולל עשרות מאות איים18.
למרות שזה אולי נשמע לא נעים אבל ביצוע ניתוח תמונה וניתוח נתונים מספריים בחבילות תוכנה נפרדת הוא רעיון טוב. בזמן הנוכחי, ImageJ/פיג'י שולט בניתוח תמונה מדעית. הסביבות הפופולריות ביותר עבור קידוד מדעי הם פיתון ו Matlab, אך יש גם ידוע מאמצים לנתח Ca2 + נתונים ב R28. השימושיות הטובה ביותר מסופקת על ידי חבילות נישה יותר כמו IgorPro. הבחירה שלנו היא אב טיפוס ב Matlab/פיתון ולאחר מכן ליישם את הקוד ב IgorPro לשימוש ' צינור '. התאמת חבילות של ניתוח אותות עבור מכשירי אלקטרופיזיולוגיה (g., Clampfit, נוירואקספלורר) לצרכים אנליטיים יכולים להיות שימושיים עבור הדמיה של תא בודד, אך קשה לשנות את גודלם. אפשרויות רבות שסופקו על ידי חבילות כאלה אינם ישימים עבור הדמיה איון בגלל קצב דגימה נמוך.
חשוב לזכור כי מתודולוגיה זו מוגבלת על-ידי מספר גורמים. ראשית, כפי שהוזכר לעיל, הדמיה מבוססת במידה רבה על בסיס הנתונים, כלומר לא מצביעים ולכן לא יכול להיות ישירות לעומת פעילות חשמלית של התא. שנית, הנתונים מגיע הפריפריה איון אינו משקף תהליכים צימוד חשוב כי הם, בדרך כלל, תלת מימדי. שלישית, רמת הטעינה/ביטוי משפיעה על תפיסת עוצמת החיישן. לבסוף, הפעלה של פחות היטב מחקר של תאים איון תא (g., PP תאים & ε-תאים) על ידי תרכובות סמן לא ניתן לשלול, למרות שבגלל המספרים הנמוכים של תאים אלה בתוך איון כל זיהום פוטנציאלי יהיה מינימלי.
השיטה היא "אלוף" אמיתי במונחים של אפקט חזותי, כאשר תהליכי הנדנוד מספקים רושם חזק של רקמה חיה באמת. מוחל על אוכלוסיות משנה של תאים משניים, השיטה חוקרת את הפונקציה של כל אחד מהם באופן אמין, המאפשר זיהוי של תת קבוצות והמשקף את הטרוגניות.
הדינמיקה סידן נחקרו ב הלבלב איון β-תאים במשך יותר מ 40 שנים, מונע בעיקר על ידי ההתקדמות בטכנולוגיית רכישה/זיהוי. מחקרים מוקדמים השתמשו ספקטרוסקופיית ספיגה אטומית29, אבל זה לא היה עד הגעתו של מיכל פלורסנט2 + חיישנים30 כי קינטיקה מפורטת יכול להיפתר בתאי איון בודדים, באמצעות פואפינסה31,32,33. זמן קצר לאחר מכן, המרכיב המרחבי של ca2 + קינטיקה שופרה כמו Ca2 + הדמיה34,35,36 הפך לטכנולוגיה שגרתית, תודות לאחר מכן זמין לאחרונה התקן מצמידים (CCD) גלאי. הבעיה של אור ממוקד, כי הקשה הדמיה האות מתאים בודדים בתוך הרקמה, נפתרה לאחר מכן באמצע שנות ה-90 באמצעות סריקת לייזר מיקרוסקופ קונפוקלית (lscm)37 והכולל השתקפות פנימית מיקרוסקופ קרינה (tirfm)38. שתי השיטות, השלים על ידי הגעתו של דור חדש של הפלורסנט Ca2 + חיישנים להתרגש עם לייזר nm 488, השתמשו בהצלחה לתמונה Ca2 + דינמיקה של תאים איון בקבוצות משנה39,40,41.
המאה החדשה הביאה שתי מגמות חדשות שנבעו מהתפתחויות טכנולוגיות הקשורות למוח. ראשית, חיישני פלורסנט רקומביננטי מבוסס על תמורה מעגלית של משתנים GFP מוגבר באופן משמעותי האות לרעש היחס עבור Ca2 + זיהוי, ביעילות להביא את המחקרים לרמה של אוכלוסיות תאים גדולים, שבו הדינמיקה של [Ca2 +]cyt בכל תא יכול להיפתר. שנית, השימוש של היזמים ספציפיים לרקמות מותר לכוון ביטוי חיישן לאוכלוסיות משנה קטין.
למרות שבדרך כלל חשבו לשקף את ההתפתחויות במדעי המוח, מחקרים על איון Ca2 + דינמיקה יש שני הבדלים מרכזיים. ראשית, מבחינה טכנולוגית, כל הדמיה vivo של מאותת איון מורכב יותר מאשר הדמיה במוח בשל האנטומיה בלתי צפויה של הלבלב והאיים ' מיקום42. שנית, צימוד חשמלי מעולה בין β התאים איון למעשה מעבד איונים לתוך אוכלוסיות הנייח חשמל המציגים תגובה מושלמת לכאורה הכל או שום דבר הגירוי גלוקוז גבוה. אנו מאמינים כי מחקרים של [Ca2 +]אני קינטיקה באוכלוסיות משנה של איון מינור, כגון δ-תאים, מבוסס על מיקוד ספציפי לרקמות נוטים להרחיב את הידע שלנו פרמקולוגיה/פיזיולוגיה שלהם. באותו זמן, בדיקה רגישה מאוד לאפשר הרחבת הכוח הסטטיסטי של מדידות כאלה, חשבונאות לשונות איון-אל-איון ומאפשר הדמיה של איונים מקבוצות שונות בתוך ניסוי מקביל אחד.
Disclosures
המחברים לא מצהירים על ניגודי אינטרסים.
Acknowledgements
AH היה הנמען של סוכרת בבריטניה דוקטור Studentship, EV היה נתמך על ידי תוכנית ההדרכה אמון האוקסיon ברוך הבא, AIT התקיים מועצת המחקר הביו-רפואית של אוקספורד התמחות בתר-דוקטורט.
Materials
| Name | Company | Catalog Number | Comments |
| 40x/1.3 objective | |||
| Axiovert 200 microscope | |||
| emission | |||
| Excitation | |||
| Fetal bovine serum | Sigma-Aldrich | F7524-500ML | |
| Fluo4 | Thermo Fisher (Life Technologies) | F14201 | |
| GCaMP6f, in (human type 5) adenoviral vector | Vector Biolabs | 1910 | |
| Hanks' solution | Thermo Fisher (GibCo, Life Technologies) | ||
| Liberase | Sigma-Aldrich | 5401020001 | |
| penicillin/streptomycin | Thermo Fisher (GibCo, Life Technologies) | 15140122 | |
| RPMI medium | Thermo Fisher (GibCo, Life Technologies) | 61870044 | |
| Zeiss LSM510-META confocal system | Carl Zeiss |
References
- Elayat, A. A., el-Naggar, M. M., Tahir, M. An immunocytochemical and morphometric study of the rat pancreatic islets. Journal of Anatomy. 186, 629 (1995).
- Cabrera, O., et al. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Brereton, M. F., Vergari, E., Zhang, Q., Clark, A. Alpha-, delta-and PP-cells: are they the architectural cornerstones of islet structure and co-ordination. Journal of Histochemistry & Cytochemistry. 63 (8), 575-591 (2015).
- Færch, K., et al. Insulin resistance is accompanied by increased fasting glucagon and delayed glucagon suppression in individuals with normal and impaired glucose regulation. Diabetes. 65 (11), 3473-3481 (2016).
- Dabrowski, M., Tarasov, A., Ashcroft, F. M. Mapping the architecture of the ATP-binding site of the KATP channel subunit Kir6 2. The Journal of Physiology. 557 (2), 347-354 (2004).
- Liu, Y. J., Vieira, E., Gylfe, E. A store-operated mechanism determines the activity of the electrically excitable glucagon-secreting pancreatic alpha-cell. Cell Calcium. 35 (4), 357-365 (2004).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca 2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137 (2001).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2. Proceedings of the National Academy of Sciences. 98 (6), 3197-3202 (2001).
- Broussard, G. J., Liang, R., Tian, L. Monitoring activity in neural circuits with genetically encoded indicators. Frontiers in Molecular Neuroscience. 7, 97 (2014).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42 (2), 111-129 (2017).
- Tarasov, A. I., Rutter, G. A. . Methods in enzymology. 542, 289-311 (2014).
- Tarasov, A. I., et al. Frequency-dependent mitochondrial Ca(2+) accumulation regulates ATP synthesis in pancreatic β cells. Pflugers Archiv: European Journal of Physiology. 465 (4), 543-554 (2013).
- Smith, N. A., et al. Fluorescent Ca2+ indicators directly inhibit the Na, K-ATPase and disrupt cellular functions. Science Signal. 11 (515), 2039 (2018).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888-1891 (2011).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. Elife. 5, 12727 (2016).
- Theis, L., et al. Benchmarking Spike Rate Inference in Population Calcium Imaging. Neuron. 90 (3), 471-482 (2016).
- Hamilton, A., et al. Adrenaline Stimulates Glucagon Secretion by Tpc2-Dependent Ca(2+) Mobilization From Acidic Stores in Pancreatic alpha-Cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Mourao, M., Satin, L., Schnell, S. Optimal experimental design to estimate statistically significant periods of oscillations in time course data. PloS One. 9 (4), 93826 (2014).
- Zmuda, E. J., Powell, C. A., Hai, T. A method for murine islet isolation and subcapsular kidney transplantation. Journal of Visualized Experiments. (50), (2011).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Thevenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Tarasov, A. I., et al. Monitoring real-time hormone release kinetics via high-content 3-D imaging of compensatory endocytosis. Lab on a Chip. 18 (18), 2838-2848 (2018).
- Knudsen, J. G., et al. Dysregulation of Glucagon Secretion by Hyperglycemia-Induced Sodium-Dependent Reduction of ATP Production. Cell Metabolism. , (2018).
- Adam, J., et al. Fumarate hydratase deletion in pancreatic β cells leads to progressive diabetes. Cell Reports. 20 (13), 3135-3148 (2017).
- Wills, Q. F., et al. Statistical approaches and software for clustering islet cell functional heterogeneity. Islets. 8 (2), 48-56 (2016).
- Berggren, P. O., Ostenson, C. G., Petersson, B., Hellman, B. Evidence for divergent glucose effects on calcium metabolism in pancreatic beta- and alpha 2-cells. Endocrinology. 105 (6), 1463-1468 (1979).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. The Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Longo, E. A., et al. Oscillations in cytosolic free Ca2+, oxygen consumption, and insulin secretion in glucose-stimulated rat pancreatic islets. The Journal of Biological Chemistry. 266 (14), 9314-9319 (1991).
- Johansson, H., Gylfe, E., Hellman, B. Cyclic AMP raises cytoplasmic calcium in pancreatic alpha 2-cells by mobilizing calcium incorporated in response to glucose. Cell Calcium. 10 (4), 205-211 (1989).
- Grapengiesser, E., Gylfe, E., Hellman, B. Three types of cytoplasmic Ca2+ oscillations in stimulated pancreatic β-cells. Archives of Biochemistry and Biophysics. 268 (1), 404-407 (1989).
- Okamoto, Y., et al. Role of cytosolic Ca2+ in impaired sensitivity to glucose of rat pancreatic islets exposed to high glucose in vitro. Diabetes. 41 (12), 1555-1561 (1992).
- Gilon, P., Henquin, J. C. Influence of membrane potential changes on cytoplasmic Ca2+ concentration in an electrically excitable cell, the insulin-secreting pancreatic B-cell. The Journal of Biological Chemistry. 267 (29), 20713-20720 (1992).
- Valdeolmillos, M., Nadal, A., Soria, B., Garcia-Sancho, J. Fluorescence digital image analysis of glucose-induced [Ca2+]i oscillations in mouse pancreatic islets of Langerhans. Diabetes. 42 (8), 1210-1214 (1993).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Stout, A. L., Axelrod, D. Evanescent field excitation of fluorescence by epi-illumination microscopy. Applied Optics. 28 (24), 5237-5242 (1989).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PloS One. 8 (1), 54638 (2013).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in alpha- and beta-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- van Gurp, L., et al. Sequential intravital imaging reveals in vivo dynamics of pancreatic tissue transplanted under the kidney capsule in mice. Diabetologia. 59 (11), 2387-2392 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved