Method Article
小鼠胰腺胰岛细胞亚群中的钙动力学成像
摘要
在这里,我们提出了一个协议,用于在异质细胞群(如胰腺胰岛细胞)中成像和量化钙动力学。荧光光被输送到小岛内细胞的外围层,然后固定和成像,并每细胞对荧光强度的动态进行分析。
摘要
胰腺胰岛激素调节血糖平衡。血糖的变化导致胰腺胰岛细胞中细胞钙的振荡,引发三种主要激素的分泌:胰岛素(来自β细胞)、胰高血糖素(β细胞)和体素(β细胞)。β-细胞,构成大多数小岛细胞,并相互电耦合,作为一个单一实体对葡萄糖刺激作出反应。次要亚群、β细胞和β细胞的兴奋性(约占20%(30%)4%(10%)总啮齿动物1(人类2)的岛细胞数,分别不太可预测,因此特别感兴趣。
钙传感器被输送到隔离小岛内的细胞周围层。然后,胰岛或一组胰岛被固定,并使用荧光显微镜进行成像。成像模式的选择是更高的吞吐量(广域)和更好的空间分辨率(共聚焦)。按照惯例,激光扫描共聚焦显微镜用于成像组织,因为它提供了相邻细胞之间的信号的最佳分离。如果将β-细胞的主要种群中的污染信号降至最低,也可以使用宽场系统。
一旦钙动力学对特定刺激的反应被记录下来,数据以数字形式表示为荧光强度与时间,归化为初始荧光和基线校正,以消除与漂白相关的影响。荧光。计算曲线 (pAUC) 下的尖峰频率或部分面积的变化与时间的变化,以量化观察到的效果。pAUC 更敏感、更坚固,而尖峰频率则提供了有关钙增加机制的更多信息。
小细胞亚群可以通过对标记化合物(如肾上腺素和ghrelin)的功能反应来识别,这些化合物诱导特定细胞群中细胞钙的变化。
引言
该方法的目的是在胰腺胰岛细胞的轻微亚群中实时成像细胞钙浓度([Ca2]+cyt)的实时变化。这允许揭示这些细胞中激素分泌的机制,揭示不同细胞类型之间的串扰的细节,并有可能在小岛信号的大图中引入一个总体维度。
胰岛由几种细胞类型组成。除了更知名的胰岛素分泌β细胞外,至少有两个亚群在调节血糖3方面也至关重要。β-细胞(约占胰岛细胞的17%)在血糖变得过低时分泌胰高血糖素,这表示葡萄糖从肝脏的储存库释放到血液中。过量的胰高血糖素水平(高血糖素)和糖高血糖素释放控制受损伴随(并且,技术上,可以促进)胰岛素敏感性受损的糖尿病前期状况4。• 细胞(约2%)分泌躯体他汀,以响应葡萄糖升高。这种无处不在的肽类激素很可能在胰岛内的β-和β细胞附近存在高浓度,对胰高血糖素和胰岛素分泌有很强的Gi受体介导衰减作用。
β-细胞和β-细胞与其近亲β-细胞共享大部分葡萄糖传感机械。所有三种细胞类型都配备了ATP敏感K+通道,精密的代谢传感器5,控制这些兴奋细胞的血浆膜电位。同时,胰岛素、索马他汀和胰高血糖素的分泌受到葡萄糖的不同调节。因此,在小岛细胞的两个次要亚种群中成像Ca2+动力学可以提供血糖和小岛分泌输出之间的串扰。
使用贴片夹电生理学监测β-和β-细胞兴奋性的早期尝试很快在单个β和β细胞中进行了Ca2+成像。这些实验中细胞的身份通过抗胰高血糖素或抗球瘤素抗体的后染色得到验证。这些努力经常受到发现,小岛细胞的行为非常不同,在小岛内和作为单细胞的阻碍。虽然β-细胞似乎是小岛排列的主要恩人(由于其绝大多数是它们强大的电耦合的基础),但令人惊讶的是,主要差异是在β-细胞中发现的。在完整的小岛内,这些细胞在低血糖下持续持续地被激活,这仅对大约7%的单分散β细胞6有效。因此,报告完整胰岛内β-和β细胞的活性被认为是对体内条件的接近。
通常,有两种方法可以报告专门来自β-细胞或β-细胞亚种群的Ca2+动力学:(i) 通过组织特异性启动子表达基因编码的Ca2+传感器,或(ii)使用标记化合物。更优雅的前一种方法增加了真正的3D成像的实质性优势,从而研究了小岛内的细胞分布。然而,它不能应用于完整的人类小岛材料。另一个潜在的问题是启动子的"泄漏",特别是当β-/β-细胞转位或β-细胞对高葡萄糖的反应到位时。后一种方法可用于新鲜分离的组织,包括人体样本或培养胰岛。然而,数据仅从小岛细胞的外围层收集,因为在不改变小岛结构的情况下,在更深的层中传递染料/标记分子是具有挑战性的。后一种方法的一个意外优势是与广域成像模式的兼容性,它允许将实验扩展到数十个或数百个小岛(即数千到数万个细胞)的同步成像。
钙在体内成像使用基因编码的GCaMP7(或近机8)系列传感器,这是循环渗透绿色荧光蛋白(GFP)的变体,与钙结合蛋白镇静剂及其靶序、M13片段肌苷光链激酶7、9。GCaMP在纳米摩尔Ca2+浓度范围内具有极好的信噪比,具有高2光子横截面,这使得它们成为体内工作10、11的理想选择。使用重组传感器的具有挑战性的方面是它们输送到细胞中。异质性表达需要使用病毒载体和多小时的外生培养,这经常引起人们对细胞功能可能去分化或恶化的担忧。尽管经过预先设计的鼠标模型可以表达 GCaMP 来解决这个问题,但它们通过大幅延长提前期并将工作限制在非人工模型上,增加了新的挑战。对细胞内pH值变化的极高灵敏度是基于蛋白质的传感器12的另一个不利因素,然而,对于感知振荡信号(如Ca2+)来说,问题就不那么严重了。
可捕获染料(如绿色荧光Fluo4)的优点是,它们可以在一小时内被装入新鲜分离的组织。可以预见的是,可捕获染料的信号噪比较低,光稳定性(远)低于其重组染料。我们不能证实13日关于可染色染料14毒性的报告,然而,染料超载是一个常见的问题。
基于圆形排列的红色重组 Ca2+传感器自 201115年以来发展迅速,最近的发展带来了与 GCaMPs16在组织成像方面的激烈竞争,因为红光的穿透深度较高。市售的红色可捕获染料可以可靠地用于单细胞成像,但在组织水平上,无法与绿色模拟物很好地竞争。
在失焦光成为关键问题的组织中,成像技术似乎很少选择。共聚焦系统通过取消对焦光的失焦光提供可接受的单细胞分辨率,NA 上的任何目标高于 0.3(GCaMP6)或 0.8(可染色染料)。从技术意义上讲,传统的共聚焦显微镜可用于同时成像来自数百个(GCaMP)或数十个小岛(可染色剂)的[Ca2]cyt。在组织中传感器的 3D 表达的情况下,唯一现实的共聚焦模式可能是光片显微镜。
当传感器在小岛组织内的细胞周围层中表达时,情况稍有不同。对于具有生动的细胞内表达模式的明亮重组传感器,使用具有低NA目标的广域成像模式可以提供足够的质量,并奖励研究人员在视野领域方面大幅增加,从而奖励吞吐量。广域系统提供较差的空间分辨率,因为失焦光不会被取消;因此,具有高NA(低景深)目标的成像组织信息较少,因为单细胞信号受到邻近细胞的很大污染。对于低NA(高景深)目标而言,污染要小得多。
但是,有些任务的高吞吐量和/或采样率成为其中的关键优势。β和β-细胞表现出很大的异质性,从而产生了对高样本量的需求,以揭示亚种群的贡献。广域成像快速且更灵敏,工业级大型视场系统分别以与十个或单个小岛上的共聚焦实验相同的信噪比对数百个 (GCaMP) 或数十个 (Fluo4) 小岛进行成像。这种吞吐量差异使得宽场系统有利于具有单单元分辨率的人口成像,这对于小亚种群(如 β-细胞)尤为重要。同样,尝试从 Ca2+尖峰17重建电气活动将受益于广域成像模式提供的更高采样率。同时,一些"小问题",如胰腺β-细胞在刺激主导β细胞亚群时的活动,需要使用共聚焦系统。影响对共焦点模式决策的一个因素是来自β-细胞亚群的大量污染信号。
虽然在成像实验后使用激素特异性抗体染色来验证细胞的特性仍是一种选择,但可以使用功能标记化合物(如肾上腺素和ghrelin)来识别次要细胞亚群,这些化合物分别在β-18和β细胞19、20中选择性地刺激Ca2+动力学。
时间延时成像数据分析旨在提供除琐碎的药理学之外的信息,如人口异质性、不同信号的相关性和相互作用。按照惯例,成像数据被分析为强度与时间,并归化为初始荧光(F/F0)。由于荧光信号的漂白或自荧光或pH值的变化(通常由葡萄糖12的毫摩尔水平引起)的污染,经常需要基线校正。Ca2+数据可以以许多不同的方式进行分析,但三个主要趋势是测量计算的尖峰频率、高原分数或曲线下面积的变化。我们发现后一种方法是有利的,特别是在应用严重采样不足的共聚焦数据方面。pAUC指标的优点是它对信号频率和振幅变化的灵敏度,而计算频率需要大量的振荡21,这是很难用传统的成像实现。pAUC 分析的限制因素是其对基线变化的高灵敏度。
研究方案
此处描述的所有方法都是根据《联合王国动物(科学程序)法》(1986年)和牛津大学道德准则制定的。
1. 分离小鼠胰腺胰岛
- 准备培养基和隔离解决方案。
- 组成培养基:RMPI1640(见材料表),辅以10%的胎儿小牛血清,100单位/mL青霉素,100μg/mL链霉素。将培养基放入两个60毫米塑料培养皿中(无需用任何粘合剂处理),并将培养皿保存在培养箱中(37°C,5% CO2,绝对湿度)。
- 组成分离溶液(50 mL/鼠标):汉克斯的介质,5 mM葡萄糖,100单位/mL青霉素100微克/mL链霉素。保持冰上(4°C)。
- 组成酶溶液(例如,Liberase):在分离溶液中为0.2毫克/mL,每只小鼠2 mL。保持冰上(4°C)。可有选择地对利赛酶的活性进行预测试,并优化每批酶22的孵育参数。
- 将酶溶液注射到小鼠胆管中。
- 通过宫颈脱位牺牲小鼠(12周大雌性,C57Bl/6J)。
- 在解剖显微镜下,用精细剪刀切开皮肤和肌肉层,并找到胆管。
- 使用棉线将连接两侧的肠子与胆管连接。
- 用弯曲的细制表匠钳轻轻提起胆管,并使用带 30G 针头的 2 mL 注射器将冰冷的酶溶液引入管道。在此阶段应观察胰腺的膨胀。
- 使用钝鼻拇指钳和精细制表师的钳子将膨胀的胰腺收集到 15 mL 猎鹰管中,并将其保存在冰上 (4 °C)。将1mL的酶溶液加入管中。
- 从胰腺释放和收集胰腺胰岛。
- 在37°C下,用酶溶液在水浴中孵育胰腺膨胀16分钟。温和的震动是可以使用的,但不是关键的,只要通货膨胀一直很好。
- 加入冷隔离溶液,达到10 mL,停止消化。轻轻摇动消化器:它应该掉成小块。
- 在10 mL的隔离溶液中清洗消化液三次,让站立5分钟,在1 x g处将释放的小岛沉淀在冰上。用10mL血清移液器轻轻吸进上清液。
- 将冷 RPMI 添加到摘要中(以高达 10 mL)。
- 使用塑料培养皿(步骤 1.1.1)挑选胰岛。将 RMPI 介质从其中一个培养皿中去掉,然后轻轻倒一些(4-5 mL)的消化。收集释放的小岛,显示为圆形,光滑和高密度的件,与P10移液器进入第二个培养皿。
- 培养孵化器中的胰岛(37°C,5%CO2,绝对湿度)。实验可以在此阶段暂停。一些人认为离开胰岛1-2小时有助于在隔离期间从机械应力中恢复过来。
2. 加载染料或表示传感器
- 准备可捕获的染料。
- 将可捕获染料(例如 Fluo-4)的等分(通常为50 μg)溶解至2 mM的库存浓度。将液化酸加入1%的最终浓度(使用DMSO中的20%库存),以改善染料的溶解。
- 将染料与小 PCR 管中的染料相联(每个管 2 μL)。染料可冷冻(-20°C)储存数周。
- 或者,准备重组传感器。
- 将传感器(例如编码 GCaMP6f 的腺病毒载体)分配到 10 μL 等分,并储存在 -80°C。
- (可选)通过使用多个连续稀释剂感染胰岛(如下)来预先测试病毒库存的滴度,以揭示感染的最佳浓度。
注:由不同载体(病毒、巴氏病毒、AAV)编码的重组传感器需要不同的感染协议。请务必与矢量提供程序进行检查,并根据您的需要优化工作比率。腺病毒的"工作"库存可以储存在-20°C和冷冻/解冻几次。过度的冻融循环会降低病毒的有效分量。
- 准备成像解决方案。
- 组成成像解决方案,mM:140 NaCl,4.6 KCl,2.6 CCl 2,1.2 MgCl2,1NaH2PO4,5 NaHCO3, 10 HEPES (pH 7.4,带 NaOH)。
- 在成像溶液中补充葡萄糖(0.5M)和曼尼醇(0.5M)。库存可在冰箱(4°C)中储存数周。
- 装载可捕获的染料。
- 通过在含有 6 mM 葡萄糖的成像溶液的 600 μL 中溶解 2 μL 染料,组成染料工作溶液。溶液可以加热或涡旋,以改善溶解。
- 将步骤 1 中隔离的小岛加载到染料的工作溶液中。装载可以使用多孔盘或培养皿完成。在后一种情况下,将工作溶液的 100 μL 液滴放在非粘性培养皿(35 或 60 mm)的底部,将移液器 10-30 个小岛放入液滴中。
- 对于不同的胰岛组(例如野生型/挖空),请安排多口井和多个液滴,以便可以同时进行装载。
- 在黑暗中,在黑暗中将胰岛孵育在室温下,在染料工作溶液中孵育70-90分钟。不要过度孵育。
- 检查荧光显微镜下的负载;胰岛应获得温和的荧光,有些细胞比其他细胞更亮。细胞的围捕和染料的核定位是超载的迹象。
- 将胰岛转移到含有6 mM葡萄糖的无染料成像溶液中。胰岛可用于立即成像,但可以选择染料可以离开去酯化再10-15分钟。胰岛将染料保留几个小时,因此可用于多个班次的成像。
- 或者,用重组载体感染胰岛。
- 在 RPMI 培养介质(步骤 1.1.1)(例如 30 μL)中将水滴中的胰岛板化,以尽量减少所需的矢量体积。
- 以大约 105个传染性单位/小岛的比例添加病媒,理想情况下应导致感染的多重性 >2。理想情况下,该比率应优化为在外围层中提供表达式的最小比率。预滴定(步骤 2.2.3)可能会有所帮助。
- 将20-50个小岛引入液滴和培养,为期8-48小时。(理想情况下,过夜)。胰岛应在大多数细胞中产生微弱的绿色荧光,而细胞形态没有变化。
注: 感染和表达的成功取决于接触病毒溶液的时间。理想情况下,病毒应在溶液中停留一夜,但可在 15 分钟后选择性地清除。然而,传染性,因此表达,可能会大大降低。
3. 成像 Ca2+动态
- 在(倒置)显微镜下固定胰岛。
- 组装倒置显微镜的成像室。将玻璃盖玻片(厚度 1 或 1.5)放置在造型室内,并确保玻璃室界面防水。检查盖玻片是否在显微镜目标范围内(对于笨重的高 NA 物镜至关重要)。
- 准备固定附件。从细网格和粗网格切割小矩形(20 mm x 20 mm)。使用 45-50 μm 厚的胶带在细网上引入两个垫片"墙"。如果要成像的小岛的大小大大超过常规的 100 μm,请使用垫片的双层。
- 使用 35 mm 培养皿将网和重量浸入成像解决方案中。确保塑料和金属是湿的。
- 在解剖显微镜下,将垫片"墙"倒置,垫片朝上转动细网格。挑选几个装有可染色剂的小岛,或用 P20 移液器表达重组传感器,然后轻轻地将它们放置在两个垫片之间的细网顶部。确保网格和处理器上不包含过多的成像溶液。
- 用制表师的钳子拿起网眼,将其倒置放置在成像室内,使隔板朝下,直接坐在造型室盖玻片上。确保胰岛夹在垫片和网格之间,位于盖玻片的中间。
- 将粗网格和权重放置在造型室内的细网格顶部。将成像溶液引入造型室。确保胰岛固定并准备好成像。避免腔室过度晃动(小扰动,如将腔室送入显微镜和插入加热阶段是可以接受的)。
注: 类似的固定安排可以应用于直立系统。
- 设置显微镜。
- 选择成像模式和目标,将腔室与步骤 3.1 中的胰岛定位在显微镜的温度控制阶段。
- 设置温度控制(理想情况下,在 30°C 和 36°C 之间)和围液。对于倒置系统,将流入量置于腔室内的流出小于流出量的位置,并将流出流量设置为大于流入量(这通常是通过在蠕动泵上使用更宽的内径管来实现的)。
- 确保流出与溶液的接触面最小,从而在多个顺序小液滴中去除溶液,避免连续去除溶液的长时间间隔。后者是定期信号延时成像的主要材料来源,因为它们表现为每个图像像素的周期性强度振荡,并经常被解释为"慢波"。
- 使用含有 3 mM 葡萄糖的成像溶液启动围注射。
- 选择光路径和过滤器,用于对绿色荧光道进行成像;470到500之间的激励和505到550之间的排放将适用于它们。
- 运行实时映像以设置成像参数。调整视图以捕获感兴趣的小岛。
- 优化图像的信号噪比。为此,调整激发光强度、曝光时间和分箱。确保设置允许在尽可能小的光照强度和曝光下对小岛内的每个细胞进行独特的可视化。
- 执行图像采集。根据任务的不同,图像可以以 0.1 到 5 Hz 的速度拍摄。这远低于 Nyquist 标准,该标准为 +- 和 +-单元(>300 Hz)中的快速 Na+驱动振荡,这意味着默认情况下数据采样不足。然而,在具有较大视野的多细胞/多岛位成像中,增加采集频率以匹配这一需求是不可行的。GCaMP 可以更快地成像,而 Fluo4 在快速采集条件下将不可避免地漂白。
注:鉴于[Ca2]在小岛细胞中的圆细胞振荡是由电活动驱动的,使用低采集速率听起来可能适得其反。然而,在现实中,在1赫兹左右或以上采集速率可能足以解决β-细胞的尖峰行为13,而检测β-和β细胞中钠通道驱动的振荡的阈值远高于300赫兹。无论 β- 或 + -单元 [Ca2]]的圆细胞振荡是在 1 Hz 或 0.1 Hz 时获得的,它们都会严重采样不足,并反映由电池处理 Ca2+而不是电活动。- 检查采集数据的质量:在3 mM葡萄糖时,β-细胞活性应清晰可见/可检测。确保这是事实,并继续进行全面的延时成像。
- 选择成像模式和目标,将腔室与步骤 3.1 中的胰岛定位在显微镜的温度控制阶段。
- 延时成像
- 使用信号动力学的在线图表,在采集软件中实现(如果可用)。如果联机图表不是选项,请应用以最全面的方式显示信号强度的查找表(如"彩虹")。
- 以可逆的方式应用刺激:将信号的恢复记录到基础水平。忽略记录开始和结束处的人工制品;后者可能看起来像不可逆的"增加"/"减少"的探针荧光由于pH或细胞死亡的变化。
- 在低血糖下,通过振荡Ca2+动力学区分β细胞。将肾上腺素或谷氨酸引入沐浴溶液中,可逆2-5分钟。[Ca2]的迅速跳跃,随后将缓慢或取消振荡。
注:肾上腺素是β细胞的公认标记化合物,对小岛细胞的亚群有选择性的正向作用,由细胞内储存库18的Ca2+释放介导。谷氨酸已被提出为另一种β-细胞特异性激动剂23。 - 添加/去除ghrelin,最近被报道激活β细胞选择性19,20。观察小小小小小小群中的[Ca 2]cyt的快速可逆增加。
- 添加/去除20 mM葡萄糖。观察β-细胞亚群中的协调振荡反应。注意先前被肾上腺素或谷氨酸和ghrelin激活的细胞的反应。
- 保存图像序列。请考虑在录制过程中使用"自动保存"。
4. 分析数据
- 分析延时图像。
- 将延时图像导入图像分析软件,如开源 ImageJ/FIJI。
- 如果在记录过程中发生了实质性/快速移动,则丢弃无法修复的数据。使用 StackReg 或 TurboReg 插件24来纠正轻微的漂移。
- 创建用于单元格检测和感兴趣区域 (ROI) 映射的掩膜图像。实现此目的的首选方法是使用"平均强度"或"最大强度"等函数之一创建堆栈图像。要使用的函数是提供单个细胞的最佳识别的函数。
- 阈值掩码图像,删除小岛区域外的所有数据。该功能在 32 位图像的自动模式下工作。
- 检测阈值图像中的最大值。如果图像密集,则最大值可以由点、区域甚至扇区表示。
- 应用"查找最大"函数,没有任何大小限制,并将检测到的最大值粘贴到感兴趣区域 (ROI) 编辑器中。
- 平滑/插值映射的每个 ROIs;可能,ROIs 将需要扩展。可以为 (4.1.6-4.1.8) 编写一个简单的脚本,并运行多次以提供最佳的单元检测结果。几个 ROIs 可能会重叠,但这种情况很少见。
- 分析 ROIs 的位置,并将相应的 X 和 Y 数据粘贴到电子表软件(例如 Microsoft Excel) 中。
- 分析所有 ROIs 的灰色强度与时间,并将数据粘贴到电子表软件中。
- 分析数值数据。
- 将数据导入数据分析软件。根据软件的选择和实验的持续时间/采样/大小,这可以是一个简单的复制粘贴操作或独立过程。确保数值数据的排列和存储。
- 导入时间戳或时间注释(如果可用)。
- 将原始荧光强度数据("F")标准化为荧光的初始值("F0")。这不需要是第一点的荧光,但可以是几个第一点的平均值。规范化应减少数据的可变性,并在理想情况下(无漂移基线)导致可分析的数据集("F/F0")。
- 如果 F/F0数据集的单元格到单元格的可变性仍然很大(长时间记录、漂白),则执行基线校正。为此,定义一个"控制"区域,即应用控制溶液(小鼠胰腺胰岛,3 mM葡萄糖,不含任何激动剂/拮抗剂)的时间范围。
- 如果控制区域具有清晰的非振荡信号,则假定 F/F0在每次应用控制解决方案后返回初始值 (F/F0=1)。通过将数据拆分为段,在添加控制解决方案时由点分隔,并将线性校正应用于每个段,校正每个单元格的延时数据。请勿使用多项式或其他非线性校正,因为这将导致人工制品。
- 如果控制范围具有明显的振荡或存在其他因素(如 FAD 自荧光),请使用尖峰检测算法17。一个简单和快速的运行,这是一个最大的敏感小波变换(图3A)。
- 量化数据。尽管 Ca2+是一个高度动态信号,但在生物医学文献中,以绝对 F/F0值表示 Ca2+数据是被广泛接受的。如果需要比较多个实验的结果,请选择一个指标。
- 测量 Ca2+尖峰的频率(图 4A,D)及其对添加(蚁)激动剂的响应。为此,将录制拆分为相等的时间间隔,并通过计算间隔内的尖峰并规范化为间隔持续时间来计算部分频率(每个间隔中的尖峰频率)的时间过程。
- 或者,设置阈值并计算上述每个间隔的高原分数 (pf)(图 4B,F)。分数指示单元格在"激发"状态下花费的时间间隔内的百分比。
- 或者,计算以上定义的每个间隔(图 4C,G) 曲线 (pAUC) 下的部分面积。此指标对尖峰的频率和振幅变化非常敏感。
注:测量频率的一个注意事项是,在尖峰持续时间下缺乏灵敏度,稳定性差。由于数据严重采样不足,与电尖峰,每个间隔的尖峰数相当小,因此唯一的额外峰值会显著影响结果。pAUC 的"瓶颈"是其对基线变化的敏感性。虽然较不容易受到人工处理,并且对 [Ca2]圆周的变化比频率更敏感,但 pAUC 对 Ca2+动力学的性质并不十分了解。高原分数是开放概率概念向全细胞系统的扩展。不过,由于它依赖于阈值,它不如pAUC健壮。
结果
胰岛与可捕获的染料的负荷相当好(图1A),除非膜的脂质成分受到影响(例如,长期接触脂肪酸)。人类腺病毒类型5(Ad5)载体也针对所有小岛细胞(图1B)。当在同一单元中表示多个重组传感器时,可能会出现问题。此外,使用上述技术,胰岛通常非常固定,可提供出色的稳定性和解决方案访问。
在β-细胞中,在低血糖水平下很容易检测到Ca2+尖刺(图2)。低血糖活性与肾上腺素和谷氨酸反应之间存在高逐细胞相关性。Ghrelin在低血糖时激活一些肾上腺素反应细胞(β-细胞?),但它对大多数由低葡萄糖(β细胞)激活的细胞中的Ca2+动力学没有影响。
当以部分频率(图4A,C)分析时,肾上腺素或ghrelin刺激细胞在全有或全无条件下显示大量增加。也就是说,由肾上腺素或ghrelin激活的低基础活性细胞表现出这个指标的急剧增加。然而,基底尖和肾上腺素效应之间的整体变化是非常微妙的(图4A,C)。相反,部分AUC对所有细胞中肾上腺素引起的变化很敏感,即使基础活性高(图4B,D)。

图1:在小岛中加载可捕获染料和重组传感器的表达。典型的小鼠胰岛加载了可捕获染料Fluo-4 (A) 或表示重组传感器 GCaMP6 在细胞的外围层(B) 或更深的层 (C).极地示踪剂磺胺B(SRB,显示为白色)已被用来勾勒出每个小岛25内的单个细胞。(D) Ca2+的代表性动力学,以响应使用 Fluo4 从小岛内单个细胞记录的葡萄糖。注意小细胞群中的异质性。请点击此处查看此图的较大版本。

图2:小岛细胞对各种刺激的典型Ca2+反应。典型β细胞 (A) 和 β-细胞 (B) Ca2+动力学, 响应肾上腺素, 谷氨酸, ghrelin, 葡萄糖.(C)-( D ) 显示肾上腺素阳性 (C) 和 ghrelin 阳性 (D) 亚群的小岛细胞反应的热图.请点击此处查看此图的较大版本。
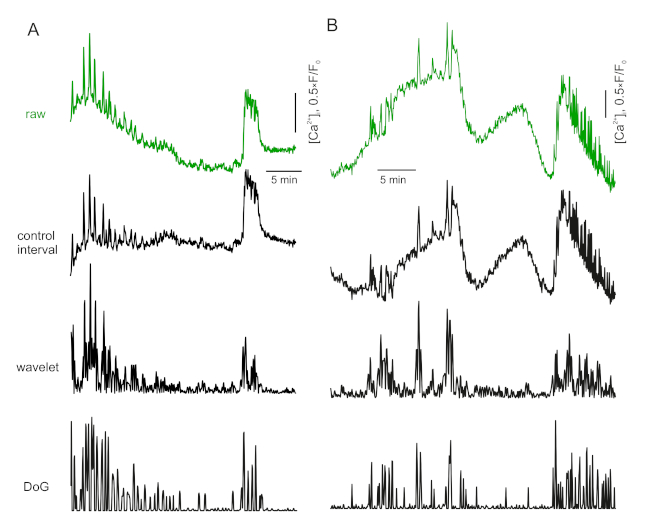
图 3:基线校正。请点击此处查看此图的较大版本。
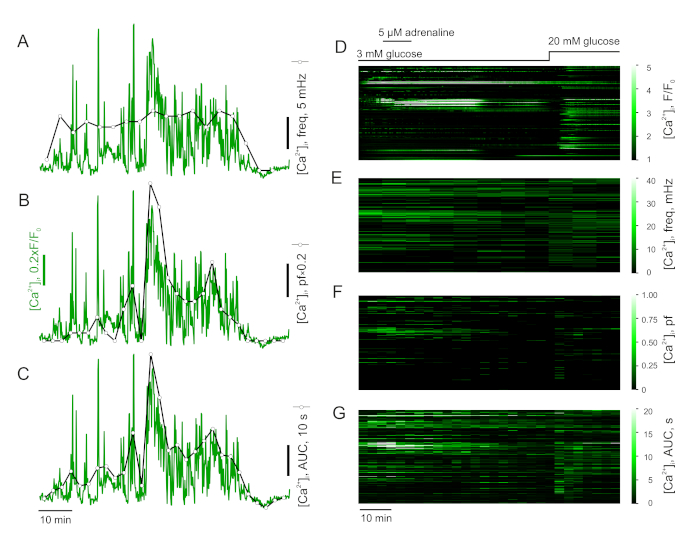
图 4:分析延时数据。分析β细胞中的Ca2+动力学。部分频率 (A), 高原分数 (B) 和曲线下的面积 (C) 的 β - 细胞 [Ca2 ]i跟踪.人口 [Ca2]i数据来自小鼠胰腺胰岛,表示为原始 (F/F0)(D)、部分频率(E)、高原分数 (F) 和曲线下的区域(G)。请点击此处查看此图的较大版本。
讨论
协议中有三个阶段对整体成功至关重要。成功将Liberase酶注入胆管,不仅决定分离程序的定量成功,而且影响分离胰岛的质量。未充气的胰腺可能导致在孤立的胰岛缺乏一些重要的代谢反应。其次,染料/传感器的表达的加载定义了延时记录的信号噪声比。在过载的小岛中,信号不存在或衰减。最后,成功和密集地定位成像室内的组织是有意义的、可分析的实验的决定性时刻。定位不当或移动的组织会导致实验时间和/或数据模糊。
可以修改该方法,以考虑多个信号(使用共聚焦系统)和多个胰岛组(例如,不同基因型)。多个信号的成像假定将第二个传感器输送到小岛的每个单元中,在光谱上与 Ca2+报告器兼容(如 pH 传感器 SNARF5f26、27)。为此,小岛可以使用 Ca2+和 pH 传感器共同加载/共同感染,然后在每个时间范围内按顺序成像。
使用单单元分辨率对胰岛组的信号进行成像需要使用宽视场目标。目标可能具有较低的放大倍率和数值光圈 (NA),从而降低空间分辨率。由于低NA目标对焦深度的增加,可以在广域系统上进行成像。这种安排的缺点是细胞-细胞交叉污染光信号和降低图像3D信号的能力(例如,在胰岛素启动子下表达Ca2+传感器的小鼠)。同时,从表面胰岛细胞表达的信号可以通过包括数十到数百个小岛18在内的高时间分辨率得到完美的解决。
虽然这听起来令人不快,但在单独的软件包中执行图像分析和数值数据分析是个好主意。目前,ImageJ/FIJI主导着科学图像分析。最常见的科学编码环境是Python和Matlab,但也有已知的努力来分析R28中的Ca2+数据。最佳可用性由更多利基包(如 IgorPro)提供。我们的选择是在 Matlab/Python 中进行原型制作,然后在 IgorPro 中实现代码以用于"管道"使用。根据分析需求调整电生理学的信号分析包(例如,Clampfit、神经探索者)可用于单细胞成像,但难以扩展。由于采样率低,此类封装提供的许多选项不适用于小岛成像。
必须记住,这种方法受到许多因素的限制。首先,如上所述,成像主要基于数据过采样,这意味着它不表示,因此不能直接与电池的电活动进行比较。其次,数据来自小岛外围,并不反映一般三维的重要耦合过程。第三,载荷/表达水平影响传感器强度的感知。最后,不能排除标记化合物激活研究不充分小的小岛细胞亚群(例如PP细胞和β-细胞),尽管由于这些细胞在小岛内的数量少,任何潜在的污染都将是最小的。
该方法在视觉效果方面是一个真正的"冠军",因为振荡过程给人一种真正活的组织的强烈印象。应用于小细胞子群,该方法可靠地探测每个子群的功能,从而能够识别子群并反映异质性。
钙动力学在胰腺胰岛β细胞中研究了40多年,主要得益于采集/检测技术的进步。早期的研究使用原子吸收光谱29,但直到荧光Ca2+传感器30的到来,详细的动力学才能在单个胰岛细胞中解析,使用光度测量31,32,33。不久之后,Ca2+动力学的空间分量得到了改进,因为 Ca2+成像 34、35、36 成为常规技术,这要归功于当时新推出的电荷耦合器件 (CCD) 探测器。失焦光问题,阻碍从组织内单个细胞成像信号的问题,随后在1990年代中期通过激光扫描共聚焦显微镜(LSCM)37和总内部反射荧光显微镜(TIRFM)38得到解决。 这两种方法,加上新一代荧光Ca2+传感器的到来,可兴奋488nm激光,已经成功地用于图像Ca2+动力学在小岛细胞亚群39,40,41。
新世纪带来了两种新趋势,它们源于神经科学相关的技术发展。首先,基于GFP变异的圆形排列的重组荧光传感器大大提高了Ca2+检测的信号噪声比,有效地将研究带到了大细胞群的水平,其中可以解决每个细胞中[Ca2]cyt的动态。其次,使用组织特异性启动子允许将传感器表达定向到次要亚种群。
虽然一般认为反映了神经科学的发展,但关于小岛Ca2+动力学的研究有两个关键区别。首先,从技术上讲,由于胰腺和胰岛位置的不可预知的解剖结构,胰岛信号的体内成像比大脑中的成像要复杂得多。其次,胰岛+细胞之间出色的电耦合实质上使胰岛进入电惰性群体,对高葡萄糖刺激表现出看似完美的全有或全无反应。我们认为,基于组织特异性靶向的[Ca2]i动力学在小小小岛亚群(如β细胞)的研究可能会拓宽我们对药理学/生理学的知识。同时,高度敏感的探头允许扩展此类测量的统计能力,将计算为胰岛到胰岛的可变性,并允许在一个并行实验中对来自不同组的胰岛进行成像。
披露声明
提交人声明没有利益冲突。
致谢
AH是英国糖尿病博士生的获得者,EV得到了OXION-威康信托培训计划的支持,AIT获得了牛津生物医学研究理事会博士后奖学金。
材料
| Name | Company | Catalog Number | Comments |
| 40x/1.3 objective | |||
| Axiovert 200 microscope | |||
| emission | |||
| Excitation | |||
| Fetal bovine serum | Sigma-Aldrich | F7524-500ML | |
| Fluo4 | Thermo Fisher (Life Technologies) | F14201 | |
| GCaMP6f, in (human type 5) adenoviral vector | Vector Biolabs | 1910 | |
| Hanks' solution | Thermo Fisher (GibCo, Life Technologies) | ||
| Liberase | Sigma-Aldrich | 5401020001 | |
| penicillin/streptomycin | Thermo Fisher (GibCo, Life Technologies) | 15140122 | |
| RPMI medium | Thermo Fisher (GibCo, Life Technologies) | 61870044 | |
| Zeiss LSM510-META confocal system | Carl Zeiss |
参考文献
- Elayat, A. A., el-Naggar, M. M., Tahir, M. An immunocytochemical and morphometric study of the rat pancreatic islets. Journal of Anatomy. 186, 629 (1995).
- Cabrera, O., et al. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Brereton, M. F., Vergari, E., Zhang, Q., Clark, A. Alpha-, delta-and PP-cells: are they the architectural cornerstones of islet structure and co-ordination. Journal of Histochemistry & Cytochemistry. 63 (8), 575-591 (2015).
- Færch, K., et al. Insulin resistance is accompanied by increased fasting glucagon and delayed glucagon suppression in individuals with normal and impaired glucose regulation. Diabetes. 65 (11), 3473-3481 (2016).
- Dabrowski, M., Tarasov, A., Ashcroft, F. M. Mapping the architecture of the ATP-binding site of the KATP channel subunit Kir6 2. The Journal of Physiology. 557 (2), 347-354 (2004).
- Liu, Y. J., Vieira, E., Gylfe, E. A store-operated mechanism determines the activity of the electrically excitable glucagon-secreting pancreatic alpha-cell. Cell Calcium. 35 (4), 357-365 (2004).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca 2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137 (2001).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2. Proceedings of the National Academy of Sciences. 98 (6), 3197-3202 (2001).
- Broussard, G. J., Liang, R., Tian, L. Monitoring activity in neural circuits with genetically encoded indicators. Frontiers in Molecular Neuroscience. 7, 97 (2014).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42 (2), 111-129 (2017).
- Tarasov, A. I., Rutter, G. A. . Methods in enzymology. 542, 289-311 (2014).
- Tarasov, A. I., et al. Frequency-dependent mitochondrial Ca(2+) accumulation regulates ATP synthesis in pancreatic β cells. Pflugers Archiv: European Journal of Physiology. 465 (4), 543-554 (2013).
- Smith, N. A., et al. Fluorescent Ca2+ indicators directly inhibit the Na, K-ATPase and disrupt cellular functions. Science Signal. 11 (515), 2039 (2018).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888-1891 (2011).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. Elife. 5, 12727 (2016).
- Theis, L., et al. Benchmarking Spike Rate Inference in Population Calcium Imaging. Neuron. 90 (3), 471-482 (2016).
- Hamilton, A., et al. Adrenaline Stimulates Glucagon Secretion by Tpc2-Dependent Ca(2+) Mobilization From Acidic Stores in Pancreatic alpha-Cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Mourao, M., Satin, L., Schnell, S. Optimal experimental design to estimate statistically significant periods of oscillations in time course data. PloS One. 9 (4), 93826 (2014).
- Zmuda, E. J., Powell, C. A., Hai, T. A method for murine islet isolation and subcapsular kidney transplantation. Journal of Visualized Experiments. (50), (2011).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Thevenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Tarasov, A. I., et al. Monitoring real-time hormone release kinetics via high-content 3-D imaging of compensatory endocytosis. Lab on a Chip. 18 (18), 2838-2848 (2018).
- Knudsen, J. G., et al. Dysregulation of Glucagon Secretion by Hyperglycemia-Induced Sodium-Dependent Reduction of ATP Production. Cell Metabolism. , (2018).
- Adam, J., et al. Fumarate hydratase deletion in pancreatic β cells leads to progressive diabetes. Cell Reports. 20 (13), 3135-3148 (2017).
- Wills, Q. F., et al. Statistical approaches and software for clustering islet cell functional heterogeneity. Islets. 8 (2), 48-56 (2016).
- Berggren, P. O., Ostenson, C. G., Petersson, B., Hellman, B. Evidence for divergent glucose effects on calcium metabolism in pancreatic beta- and alpha 2-cells. Endocrinology. 105 (6), 1463-1468 (1979).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. The Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Longo, E. A., et al. Oscillations in cytosolic free Ca2+, oxygen consumption, and insulin secretion in glucose-stimulated rat pancreatic islets. The Journal of Biological Chemistry. 266 (14), 9314-9319 (1991).
- Johansson, H., Gylfe, E., Hellman, B. Cyclic AMP raises cytoplasmic calcium in pancreatic alpha 2-cells by mobilizing calcium incorporated in response to glucose. Cell Calcium. 10 (4), 205-211 (1989).
- Grapengiesser, E., Gylfe, E., Hellman, B. Three types of cytoplasmic Ca2+ oscillations in stimulated pancreatic β-cells. Archives of Biochemistry and Biophysics. 268 (1), 404-407 (1989).
- Okamoto, Y., et al. Role of cytosolic Ca2+ in impaired sensitivity to glucose of rat pancreatic islets exposed to high glucose in vitro. Diabetes. 41 (12), 1555-1561 (1992).
- Gilon, P., Henquin, J. C. Influence of membrane potential changes on cytoplasmic Ca2+ concentration in an electrically excitable cell, the insulin-secreting pancreatic B-cell. The Journal of Biological Chemistry. 267 (29), 20713-20720 (1992).
- Valdeolmillos, M., Nadal, A., Soria, B., Garcia-Sancho, J. Fluorescence digital image analysis of glucose-induced [Ca2+]i oscillations in mouse pancreatic islets of Langerhans. Diabetes. 42 (8), 1210-1214 (1993).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Stout, A. L., Axelrod, D. Evanescent field excitation of fluorescence by epi-illumination microscopy. Applied Optics. 28 (24), 5237-5242 (1989).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PloS One. 8 (1), 54638 (2013).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in alpha- and beta-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- van Gurp, L., et al. Sequential intravital imaging reveals in vivo dynamics of pancreatic tissue transplanted under the kidney capsule in mice. Diabetologia. 59 (11), 2387-2392 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。