Method Article
Imagerie de la dynamique du calcium dans les sous-populations de cellules d'islet pancréatique de souris
Dans cet article
Résumé
Ici, nous présentons un protocole pour la formation image et la quantification de la dynamique du calcium dans les populations cellulaires hétérogènes, telles que les cellules des isfètes pancréatiques. Les reporters fluorescents sont livrés dans la couche périphérique des cellules dans l'înet, qui est alors immobilisé et image, et l'analyse par cellule de la dynamique de l'intensité de fluorescence est effectuée.
Résumé
Les hormones pancréatiques d'istique règlent l'homéostasie de glucose sanguin. Les changements dans la glycémie induisent des oscillations du calcium cytosolique dans les cellules des îcles pancréatiques qui déclenchent la sécrétion de trois hormones principales : l'insuline (à partir des cellules de l'A), le glucagon (cellules de l'A) et la somatostatine (cellules). Les cellules, qui constituent la majorité des cellules des îcaux et sont couplées électriquement les unes aux autres, répondent au stimulus de glucose en tant qu'entité unique. L'excitabilité des sous-populations mineures, des cellules et des cellules (qui représentent environ 20 % (30 %) et 4% (10%) du nombre total total de cellules d'înce de rongeur1 (humain2) est moins prévisible et est donc d'un intérêt particulier.
Les capteurs de calcium sont livrés dans la couche périphérique des cellules dans l'înisolé. L'îlots ou un groupe d'îlots est ensuite immobilisé et photographié à l'aide d'un microscope à fluorescence. Le choix du mode d'imagerie se situe entre un débit plus élevé (champ large) et une meilleure résolution spatiale (confocale). Traditionnellement, la microscopie confocale de balayage laser est employée pour le tissu d'imagerie, car elle fournit la meilleure séparation du signal entre les cellules voisines. Un système à champ large peut également être utilisé, si le signal contaminant de la population dominante de cellules de l'A est réduit au minimum.
Une fois que la dynamique calcique en réponse à des stimuli spécifiques a été enregistrée, les données sont exprimées sous forme numérique comme intensité de fluorescence par rapport au temps, normalisée à la fluorescence initiale et corrigée de base, afin d'éliminer les effets liés au blanchiment de la Fluorophore. Les changements dans la fréquence de pointe ou la zone partielle sous la courbe (pAUC) sont calculés par rapport au temps, pour quantifier les effets observés. pAUC est plus sensible et assez robuste tandis que la fréquence de pointe fournit plus d'informations sur le mécanisme de l'augmentation du calcium.
Des sous-populations cellulaires mineures peuvent être identifiées à l'aide de réponses fonctionnelles à des composés marqueurs, comme l'adrénaline et la ghréline, qui induisent des changements dans le calcium cytosolique dans une population spécifique de cellules d'éclet.
Introduction
Le but de la méthode est d'imager les changements en temps réel de la concentration cytosolique de calcium ([Ca2']cyt) dans les sous-populations mineures des cellules pancréatiques d'îcle. Cela permet de découvrir les mécanismes régissant la sécrétion hormonale dans ces cellules, révélant des détails sur le cross-talk entre les différents types de cellules et, potentiellement, l'introduction d'une dimension populationdans l'image plus large de la signalisation des îîaux.
Les îlots se composent de plusieurs types de cellules. Outre les cellules plus connues de sécrétion d'insuline, il existe au moins deux sous-populations qui sont également essentielles pour réguler la glycémie3. Les cellules (qui représentent environ 17 % des cellules des îîcres) sécrètent du glucagon lorsque la glycémie devient trop faible, ce qui indique la libération de glucose dans la circulation sanguine provenant des dépôts du foie. Les niveaux excessifs de glucagon (hyperglucagonemia) et le contrôle altéré de glucagon-libération accompagnent (et, techniquement, peuvent contribuer à) l'état prédiabétique de la sensibilité altérée d'insuline4. Cellules (environ 2%) sécrétiser la somatostatine en réponse à l'élévation du glucose. Cette hormone peptidique omniprésente est susceptible d'être présente à des concentrations élevées dans le voisinage des cellules et des cellules à l'intérieur des îlots, qui a un fort effet atténuant de récepteur Gi sur la sécrétion de glucagon et d'insuline.
Les cellules et les cellules de l'aïe partagent une grande partie de la machinerie de détection du glucose avec leurs proches parents, les cellules. Les trois types de cellules sont équipés decanaux K, sensibles à l'ATP, de capteurs métaboliques élaborés5 qui contrôlent le potentiel de membrane plasmatique de ces cellules excitables. En même temps, la sécrétion de l'insuline, de la somatostatine et du glucagon est réglée différemment par le glucose. L'imagerie de la dynamique Ca2 dans les deux sous-populations mineures de cellules d'înet peut donc fournir un aperçu de la conversation croisée entre la glycémie et la production sécrétrice d'înet.
Les premières tentatives de surveillance de l'excitabilité des cellules et des cellules à l'aide de cellules de patch-clamp ont été bientôt suivies par l'imagerie de Ca2 dans les cellules simples et les cellules. L'identité des cellules de ces expériences a été vérifiée par une coloration posteriori avec des anticorps anti-glucagon ou anti-somatostatin. Ces efforts ont souvent été entravés par la constatation que les cellules des înets se comportent très différemment dans l'în et comme cellules individuelles. Bien que les cellules de l'apo puissent sembler être les principaux bienfaiteurs de l'arrangement d'îîdre (en raison de leur majorité écrasante qui sous-tend leur fort couplage électrique), l'écart principal a été, étonnamment, trouvé dans les cellules de l'a.-. Dans l'înet intact, ces cellules sont constamment et constamment activées à faible teneur en glucose, ce qui n'est vrai que pour environ 7 % des cellules d'A disséminées6. On croit donc que la déclaration de l'activité des cellules et des cellules à l'intérieur des îlots intacts représente une approximation plus étroite des conditions in vivo.
En général, il existe deux façons de signaler la dynamique Ca2, spécifiquement à partir des sous-populations de cellules ou de cellules de cellules : (i) exprimant un capteur Ca2 codé génétiquement par l'intermédiaire d'un promoteur spécifique aux tissus ou (ii) à l'aide de composés marqueurs. L'ancienne approche plus élégante ajoute l'avantage substantiel de la véritable imagerie 3D et donc l'étude de la distribution cellulaire dans l'înt. Il ne peut toutefois pas être appliqué pour le matériel humain intact d'islet. Une autre préoccupation potentielle est la « fuite » du promoteur, en particulier lorsque la transdifférenciation des cellules de l'A-/O ou la réponse des cellules à un taux élevé de glucose est en place. Cette dernière approche peut être utilisée avec des tissus fraîchement isolés, y compris des échantillons humains ou des îlots cultivés. Les données, cependant, sont recueillies uniquement à partir de la couche périphérique des cellules des îlot, comme la livraison de la molécule de colorant / marqueur dans des couches plus profondes sans altérer l'architecture des îlot est difficile. Un avantage inattendu de cette dernière approche est la compatibilité avec le mode d'imagerie à large champ, qui permet d'étendre les expériences à l'imagerie simultanée de dizaines ou de centaines d'îlots (c'est-à-dire des milliers à des dizaines de milliers de cellules).
Le calcium est représenté in vivo à l'aide de capteurs familiaux GCaMP7 (ou péricam8)codés génétiquement, qui sont des variantes de protéines fluorescentes vertes permutées circulairement (GFP) fusionnées à la protéine liant le calcium calmodulin et à sa séquence cible, fragment M13 de la chaîne lumineuse de myosinekinase 7,9. Les GCAMP ont de superbes rapports signal-bruit dans la gamme des concentrations nanomolaires Ca2 et une coupe haute de 2 photons, ce qui en fait un choix idéal pour le travail in vivo10,11. L'aspect difficile de l'utilisation de capteurs recombinants est leur livraison dans les cellules. L'expression hétérologue nécessite l'utilisation d'un vecteur viral et de la culture ex vivo de plusieurs heures, ce qui soulève fréquemment des préoccupations concernant la dédifférenciation potentielle ou la détérioration des fonctions cellulaires. Bien que les modèles de souris préconçus pour exprimer GCaMP résoudre ce problème, ils ajoutent de nouveaux défis en augmentant le délai d'exécution de manière substantielle et en limitant le travail à un modèle non-humain. La sensibilité très élevée aux changements du pH intracellulaire est un autre côté défavorable des capteurs à base de protéines12, qui est, cependant, moins d'un problème pour la détection des signaux oscillatoires, tels que Ca2.
L'avantage des colorants trapables (tels que fluo4 fluorescent vert) est qu'ils peuvent être chargés dans des tissus fraîchement isolés en l'espace d'environ une heure. Comme on pouvait s'y attendre, les colorants trapousables ont des rapports signal-bruit plus faibles et (beaucoup) une photostabilité inférieure à celle de leurs homologues recombinants. Nous ne pouvons pas confirmer13 les rapports de toxicité des colorants trapuables14,cependant, la surcharge de colorant est un problème fréquent.
Les capteurs recombinants rouges Ca2MD basés sur la permutation circulaire ont évolué rapidement depuis 201115, et les développements les plus récents présentent une forte concurrence aux GCAMPs16 pour l'imagerie tissulaire, étant donné une plus grande profondeur de pénétration de la lumière rouge. Les colorants trapu séchables rouges disponibles dans le commerce peuvent être utilisés de façon fiable pour l'imagerie unicellulaire, mais, au niveau des tissus, ne peuvent pas rivaliser facilement avec les analogues verts.
Il y a apparemment très peu de choix de technologie d'imagerie pour des expériences dans les tissus où la lumière floue devient un problème critique. Le système confocal fournit une résolution acceptable à cellule unique par l'annulation de la lumière floue avec tout objectif sur le NA supérieur à 0,3 (pour le cas de GCaMP6) ou 0,8 (teinture trapusable). D'un point de vue technique, un microscope confocalconventionnel peut être utilisé pour l'imagerie simultanée decyt de centaines (GCaMP) ou de dizaines d'îlots (teinture trapue). La seule alternative réaliste au mode confocal en cas d'expression 3D du capteur dans le tissu est peut-être la microscopie de feuille de lumière.
Les choses sont légèrement différentes pour le cas lorsque le capteur est exprimé dans la couche périphérique des cellules dans le tissu de l'îît. Pour les capteurs recombinants lumineux qui ont un modèle d'expression intracellulaire vif, l'utilisation d'un mode d'imagerie à champ large avec un objectif de faible-NA peut fournir une qualité suffisante et récompenser le chercheur avec une augmentation substantielle dans la zone de champ de vision et donc le Débit. Un système à champ large offre une résolution spatiale plus faible, car la lumière floue n'est pas annulée; par conséquent, le tissu d'imagerie avec des objectifs de haute-NA (faible profondeur de champ) est moins instructif, car le signal unicellulaire est largement contaminé par les cellules voisines. La contamination est beaucoup plus faible pour les objectifs de faible niveau de l'AN (haute profondeur de champ).
Il y a cependant des tâches pour lesquelles un débit élevé et/ou un taux d'échantillonnage deviennent un avantage essentiel. Les cellules et les cellules de l'ue présentent une hétérogénéité importante, ce qui crée une demande de tailles d'échantillons élevées pour révéler la contribution des sous-populations. L'imagerie à large champ est rapide et plus sensible, avec un système de champ de vision à grande échelle industrielle qui imagerie des centaines (GCaMP) ou des dizaines (Fluo4) d'îlots au même rapport signal-bruit que les expériences confocales sur dix ou un seul îlots, respectivement. Cette différence de débit rend le système à champ large avantageux pour l'imagerie de la population avec une résolution à cellule unique, ce qui peut être particulièrement critique pour les petites sous-populations telles que la cellule à cellules. De même, les tentatives de reconstruction de l'activité électrique de Ca2MD spiking 17 bénéficieraient du taux d'échantillonnage plus élevé fourni par un mode d'imagerie à champ large. Dans le même temps, plusieurs problèmes de « niche » comme l'activité des cellules pancréatiques sur la stimulation de la sous-population dominante de cellules de la cellule, nécessitent l'utilisation d'un système confocal. Un facteur qui influence la décision vers le mode confocal est la présence d'un signal contaminant important provenant de la sous-population des cellules de l'A.
Bien que l'utilisation de la coloration des anticorps spécifiques aux hormones pour vérifier l'identité des cellules après les expériences d'imagerie est toujours une option, les sous-populations cellulaires mineures peuvent être identifiés à l'aide de composés marqueurs fonctionnels, tels que l'adrénaline et la ghréline qui ont été montrés pour stimuler sélectivement la dynamique Ca2 dans les cellules18 et19,20, respectivement.
L'analyse des données d'imagerie en accéléré vise à fournir des informations au-delà de la pharmacologie triviale, comme l'hétérogénéité de la population, la corrélation et l'interaction de différents signaux. Traditionnellement, les données d'imagerie sont analysées en intensité par rapport au temps et normalisées à la fluorescence initiale (F/F0). La correction de base est fréquemment nécessaire, en raison du blanchiment du signal fluorophore ou de la contamination par des changements dans l'autofluorescence ou le pH (généralement induit par des niveaux millimolaires de glucose12). Les données Ca2 peuvent être analysées de différentes façons, mais trois grandes tendances sont de mesurer les changements dans la fréquence des pointes, la fraction de plateau, ou la zone sous la courbe, calculé par rapport au temps. Nous avons trouvé cette dernière approche avantageuse, en particulier dans l'application de données confocales fortement sous-échantillonnées. L'avantage de la mesure pAUC est sa sensibilité aux changements de la fréquence et de l'amplitude du signal, alors que le calcul de la fréquence nécessite un nombre important d'oscillations21, ce qui est difficile à atteindre à l'aide de l'imagerie conventionnelle. Le facteur limitant de l'analyse pAUC est sa grande sensibilité aux changements de base.
Protocole
Toutes les méthodes décrites ici ont été élaborées conformément à la Loi de 1986 sur les animaux (procédures scientifiques) du Royaume-Uni et aux lignes directrices éthiques de l'Université d'Oxford.
1. Isoler les îlots pancréatiques de souris
- Préparer le milieu de la culture et la solution d'isolement.
- Composent le milieu de culture : RMPI1640 (voir Tableau des matériaux),complété par 10 % de sérum fœtal de veau, 100 unités/pénicilline mL, 100 og/mL de streptomycine. Distribuer le milieu dans deux plats Petri en plastique de 60 mm (non traités avec un adhésif), et conserver la vaisselle dans l'incubateur (37 oC, 5 % CO2, humidité absolue).
- Faire la solution d'isolement (50 mL/souris) : le milieu de Hanks avec 5 mM de glucose, 100 unités/mL de pénicilline 100 g/mL de streptomycine. Conserver sur la glace (4 oC).
- Faire la solution enzymatique (par exemple, Liberase): 0,2 mg/mL dans la solution d'isolement, 2 ml par souris. Conserver sur la glace (4 oC). Optionnellement, pré-testez l'activité de la liberase et optimisez les paramètres d'incubation pour chaque lot de l'enzyme22.
- Injecter la solution enzymatique dans le canal biliaire de la souris.
- Sacrifiez la souris (femelle de 12 semaines, C57Bl/6J) par la dislocation cervicale.
- Sous un microscope de dissection, couper les couches de peau et de muscle à l'aide de ciseaux fins et localiser le canal biliaire.
- Ligate l'intestin des deux côtés de la jonction avec le canal biliaire, à l'aide d'un fil de coton.
- Soulevez doucement le conduit biliaire avec des forceps d'horloger fin courbés et introduisez la solution d'enzyme séparique dans le conduit à l'aide d'une seringue de 2 ml avec une aiguille de 30 G. Une inflation du pancréas doit être observée à ce stade.
- Recueillir le pancréas gonflé à l'aide d'une combinaison de forceps du pouce au nez émoussé et de forceps de l'horloger fine dans un tube de faucon de 15 ml et le garder sur la glace (4 oC). Ajouter 1 ml de la solution enzymatique dans le tube.
- Libérez et collectez les îlots pancréatiques du pancréas.
- Incuber la pancréata gonflée à l'enzyme pendant 16 min dans un bain d'eau, à 37 oC. Des secousses douces peuvent être utilisées, mais n'est pas critique, à condition que l'inflation a été bonne.
- Arrêter la digestion par l'ajout d'une solution d'isolement glacé, jusqu'à 10 ml. Secouez doucement le digest : il doit tomber en petits morceaux.
- Laver le digest trois fois en 10 ml de la solution d'isolement, laisser reposer 5 min à 1 x g pour sédimenter les îlots libérés, sur la glace. Aspirez doucement le supernatant, avec une pipette sérologique de 10 ml.
- Ajouter le RPMI froid au digest (pour faire jusqu'à 10 ml).
- Utilisez des plats Petri en plastique (étape 1.1.1) pour cueillir les îlots. Décant le milieu RMPI hors de l'un des plats Petri, et versez doucement un peu (4-5 ml) du digest à la place. Recueillir les îlots libérés qui apparaissent comme des morceaux ronds, lisses et à haute densité, avec une pipette P10 dans le deuxième plat Petri.
- Culture des îlots de l'incubateur (37 oC, 5 % CO2, humidité absolue). L'expérience peut être interrompue à ce stade. Laissant les îlots pendant 1-2 heures est cru par certains pour aider à récupérer du stress mécanique pendant l'isolement.
2. Chargez le colorant ou exprimez le capteur
- Préparer le colorant trapable.
- Dissoudre l'aliquot (normalement, 50 g) du colorant trapuable (p. ex., Fluo-4) dans DMSO à une concentration de stock de 2 mM. Ajouter de l'acide pluronique à une concentration finale de 1% (en utilisant un stock de 20% dans DMSO), pour améliorer la solubilité du colorant.
- Aliquot le colorant dans de petits tubes PCR (2 L dans chacun). Le colorant peut être conservé congelé (-20 oC) pendant plusieurs semaines.
- Vous pouvez également préparer le capteur recombinant.
- Distribuer le capteur (p. ex. vecteur adénoviral codant gCaMP6f) dans 10 aliquots ll et stocker à -80 oC.
- (Optionnellement) pré-testez le titre du stock viral en infectant des îlots (comme ci-dessous) en utilisant plusieurs dilutions sérielles, pour révéler la concentration optimale pour l'infection.
REMARQUE : Les capteurs recombinants codés par différents vecteurs (lentivirus, BacMam, AAV) nécessitent un protocole d'infection différent. Assurez-vous de vérifier cela avec le fournisseur de vecteurs et d'optimiser le ratio de travail pour vos besoins. Le stock "en marche" de l'adénovirus peut être stocké à -20 oC et congelé/décongelé plusieurs fois. Le cycle excessif de gel-dégel réduit le titer efficace du virus.
- Préparer la solution d'imagerie.
- Maquillage de la solution d'imagerie, mM: 140 NaCl, 4.6 KCl, 2.6 CaCl2, 1.2 MgCl2, 1 NaH2PO4, 5 NaHCO3, 10 HEPES (pH 7.4, avec NaOH).
- Constituer un stock de glucose (0,5 M) et de mannitol (0,5 M) dans la solution d'imagerie. Le bouillon peut être conservé au réfrigérateur (4 oC) pendant plusieurs semaines.
- Chargez le colorant trapoutable.
- Constituez la solution de travail de colorant en dissolvant 2 ll du colorant dans 600 l de la solution d'imagerie contenant 6 mM de glucose. La solution peut être chauffée ou vortexée pour améliorer la solubilité.
- Chargez les îlots isolés à l'étape 1 dans la solution de travail du colorant. Le chargement peut être fait à l'aide d'une assiette multipuits ou d'un plat Petri. Dans ce dernier cas, placez une gouttelette de 100 llet de la solution de travail sur le fond d'un plat Petri non adhésif (35 ou 60 mm) et une pipette 10-30 îlots dans la gouttelette.
- Dans le cas de différents groupes d'îlots (p. ex. de type sauvage/knock-out), disposer plusieurs puits et gouttelettes multiples afin que le chargement puisse être effectué simultanément.
- Incuber les îlots dans la solution de travail de teinture à température ambiante dans l'obscurité pendant 70-90 minutes. Ne pas trop incuber.
- Vérifier le chargement sous le microscope à fluorescence; les îlots devraient obtenir une fluorescence légère, certaines cellules étant plus brillantes que les autres. L'arrondi des cellules et la localisation nucléaire du colorant sont des signes de surcharge.
- Transférer les îlots dans une solution d'imagerie sans colorant contenant 6 mM de glucose. Les îlots peuvent être utilisés pour l'imagerie immédiatement, mais en option, le colorant peut être laissé à désesteriser pendant encore 10-15 minutes. Les îlots conserveront le colorant pendant plusieurs heures et peuvent donc être utilisés pour l'imagerie en plusieurs quarts de travail.
- Vous pouvez également infecter les îlots avec le vecteur recombinant.
- Plaquer les îlots en gouttelettes dans le milieu de culture RPMI (étape 1.1.1) (p. ex., 30 L), afin de minimiser le volume de vecteur nécessaire.
- Ajouter le vecteur à un rapport d'environ 105 unités infectieuses / înet qui devrait idéalement entraîner une multiplicité de l'infection .2. Idéalement, le rapport devrait être optimisé au rapport minimal qui fournirait l'expression dans la couche périphérique. La pré-titration (étape 2.2.3) peut aider.
- Introduire 20-50 îlots dans la gouttelette et la culture pendant 8-48 heures. (Idéalement, du jour au lendemain). Les îlots devraient développer une légère fluorescence verte dans la plupart des cellules, sans changements dans la morphologie cellulaire.
REMARQUE : Le succès de l'infection et de l'expression dépend du moment de l'exposition à la solution virale. Idéalement, le virus devrait rester dans la solution pendant la nuit, mais peut être supprimé en option après aussi peu que 15 minutes. Cependant, l'infectiosité, et donc l'expression, est susceptible d'être considérablement plus faible.
3. Imagerie Ca2 dynamique
- Immobiliser les îlots sous le microscope (inversé).
- Assembler la chambre d'imagerie pour la microscopie inversée. Placez la glissière de verre (épaisseur 1 ou 1,5) à l'intérieur de la chambre et assurez-vous que l'interface chambre en verre est étanche à l'eau. Vérifiez que la bande de couverture est à la portée de l'objectif du microscope (critique pour le cas d'un objectif volumineux de haute-NA).
- Préparer les accessoires d'immobilisation. Couper les petits rectangles (20 mm x 20 mm) du maillage fin et de la maille grossière. Introduire deux « murs » d'espaceur sur le maillage fin à l'aide d'un ruban adhésif de 45 à 50 m d'épaisseur. Utilisez des doubles couches de l'espaceur si la taille des îlots à être représentés dépasse largement les 100 m conventionnels.
- Immerger les mailles et le poids dans la solution d'imagerie à l'aide d'un plat Petri de 35 mm. Assurez-vous que le plastique et le métal sont mouillés.
- Sous un microscope de dissection, tournez le maillage fin avec les « murs » d'espaceur à l'envers, les espaceurs faisant face vers le haut. Choisissez plusieurs îlots chargés avec le colorant trapliénable ou exprimant le capteur recombinant avec une pipette P20 et placez-les doucement sur le dessus du maillage fin, entre les deux espaceurs. Assurez-vous que le maillage et les rondelles ne contiennent pas de quantités excessives de la solution d'imagerie sur eux.
- Ramassez le maillage avec les îlots, en utilisant les forceps de l'horloger, et placez-le à l'envers à l'intérieur de la chambre d'imagerie, de sorte que les espaceurs font face vers le bas et s'asseoir directement sur le bordereau de la chambre. Assurez-vous que les îlots sont coincés entre les espaceurs et le maillage, au milieu de la couverture.
- Placez le maillage grossier et le poids sur le dessus de la maille fine dans la chambre. Introduire la solution d'imagerie dans la chambre. Assurez-vous que les îlots sont immobilisés et prêts à être photographiés. Évitez les secousses excessives de la chambre (de petites perturbations comme le transport de la chambre au microscope et l'insertion dans un stade chauffé sont acceptables).
REMARQUE : Un arrangement d'immobilisation similaire peut être appliqué pour un système droit.
- Installez le microscope.
- Choisissez le mode d'imagerie et l'objectif, placez la chambre avec les îlots à partir de l'étape 3.1 sur le stade à température contrôlée du microscope.
- Définir le contrôle de la température (idéalement, entre 30 et 36 oC) et la perifusion. Pour un système inversé, placez l'entrée plus bas que l'écoulement à l'intérieur de la chambre, et fixez le flux de sortie pour être plus grand que celui de l'afflux (qui est généralement réalisé en utilisant un tube d'un diamètre intérieur plus large sur une pompe péristétique).
- Assurez-vous que l'écoulement a une surface de contact minimale avec la solution, de sorte qu'il supprime la solution en gouttelettes séquentielles multiples, évitant de longs intervalles de suppression continue de la solution. Ce dernier est la principale source d'artefact dans l'imagerie en time-lapse des signaux périodiques car ils apparaissent comme des oscillations d'intensité périodiques régulières de chaque pixel imaged et sont fréquemment interprétés comme des « ondes lentes ».
- Initier la perifusion avec la solution de formation image contenant 3 mM de glucose.
- Choisissez le chemin de lumière et les filtres pour l'imagerie des fluorophores verts; l'excitation entre 470 et 500 et l'émission entre 505 et 550 fonctionnerait pour chacun d'eux.
- Exécuter l'imagerie en direct pour configurer les paramètres d'imagerie. Ajuster la vue pour capturer les îlots d'intérêt.
- Optimisez le rapport signal/bruit de l'image. À cette fin, ajustez l'intensité lumineuse de l'excitation, le temps d'exposition et le binning. Assurez-vous que les réglages permettent une visualisation distincte de chaque cellule à l'intérieur de l'în à l'intensité lumineuse minimale possible et l'exposition.
- Effectuer l'acquisition d'images. Selon la tâche, les images peuvent être prises à 0.1 à 5 Hz. C'est bien en dessous des critères de Nyquist pour les oscillations rapidesna-conduites dans les cellules et les cellules de 'et '', ce qui signifie que les données sont sous-échantillonnées par défaut. Cependant, l'augmentation de la fréquence d'acquisition pour répondre à cette demande n'est pas faisable dans l'imagerie multicellulaire/multi-îtte avec un grand champ de vision. GCaMP peut être photographié plus rapidement, tandis que Fluo4 sera inévitable javelblanc dans des conditions d'acquisition rapide.
REMARQUE : Étant donné que les oscillationscyt de [Ca2 ]dans les cellules d'înet sont entraînées par l'activité électrique, l'utilisation de faibles taux d'acquisition peut sembler contre-productive. En réalité, cependant, les taux d'acquisition à environ ou au-dessus de 1 Hz peuvent être suffisants pour résoudre le comportement de pieux de cellules à cellules13, tandis que le seuil pour la détection des oscillations de canal de sodium dans les cellules de 'et 'est bien au-dessus de 300 Hz. Que les oscillationscyt de la cellule de ca ou de la cellule (Ca2)soient acquises à 1 Hz ou 0,1 Hz, elles seront gravement sous-échantillonnées et refléteront la manipulation Ca2pars par la cellule plutôt que l'activité électrique.- Vérifier la qualité des données acquises : à 3 mm de glucose, l'activité des cellules de l'A doit être clairement visible/détectable. Assurez-vous que c'est le cas et passez à l'imagerie en accéléré à grande échelle.
- Choisissez le mode d'imagerie et l'objectif, placez la chambre avec les îlots à partir de l'étape 3.1 sur le stade à température contrôlée du microscope.
- Imagerie time-lapse
- Utilisez un tableau en ligne de la dynamique du signal, implémenté dans le logiciel d'acquisition si cela est disponible. Si la cartographie en ligne n'est pas une option, appliquez une table de recherche qui affiche l'intensité du signal de la manière la plus complète (comme « arc-en-ciel »).
- Appliquer les stimuli d'une manière réversible: enregistrer la récupération du signal au niveau basal. Ignorer les artefacts au tout début et à la fin de l'enregistrement; ce dernier peut ressembler à une « augmentation »/diminution irréversible de la fluorescence de la sonde en raison de changements dans le pH ou la mort cellulaire.
- Différencier les cellules de l'A par une dynamique oscillante de Ca2, à faible teneur en glucose. Introduire de l'adrénaline ou du glutamate dans la solution de bain, de façon réversible pendant 2-5 min. Un saut rapide encyt [Ca2]suivi d'un ralentissement ou d'une annulation des oscillations suivra.
REMARQUE : L'adrénaline est un composé marqueur reconnu pour les cellules de l'A, qui a un effet positif sélectif sur cette sous-population de cellules d'îîdre, médiée par la libération de Ca2 ' des dépôts intracellulaires18. Le glutamate a été présenté comme un autre agoniste spécifique à la cellule23. - Ajouter/enlever la ghréline, qui a été récemment signalée pour activer sélectivement la cellule19,20. Observez une augmentation réversible rapide ducyt [Ca2]dans une petite sous-population de cellules d'élet.
- Ajouter/enlever 20 mM de glucose. Observez une réponse oscillatoire coordonnée dans la sous-population de cellules de l'A. Notez la réponse des cellules qui ont été précédemment activées par l'adrénaline ou le glutamate et la ghréline.
- Enregistrer la séquence d'image. Envisagez d'utiliser "AutoSave" pendant l'enregistrement.
4. Analyse des données
- Analyser l'image time-lapse.
- Importer l'image time-lapse dans un logiciel d'analyse d'images, tel qu'un ImageJ/FIJI open source.
- Si des mouvements importants/rapides se sont produits pendant l'enregistrement, jetez les données comme inréparables. Utilisez les plugins StackReg ou TurboReg24 pour corriger les dérives mineures.
- Créez une image de masque pour la détection cellulaire et la cartographie de la région d'intérêt (ROI). La meilleure façon d'y parvenir serait de faire une image de pile en utilisant l'une des fonctions telles que «intensité moyenne» ou «intensité maximale». La fonction à utiliser est celle qui fournira la meilleure reconnaissance des cellules individuelles.
- Seuil l'image du masque, supprimer toutes les données en dehors de la région de l'ît. La fonction fonctionne en mode automatique pour les images 32 bits.
- Détectez les maxima dans l'image de seuil. Les maxima peuvent être représentés par des points, des régions ou même des secteurs, si l'image est dense.
- Appliquer la fonction «trouver maxima» sans aucune restriction de taille et coller les maxima détectés dans la région d'intérêt (ROI) éditeur.
- Lisser/interpoler chacun des ROC cartographiés; éventuellement, les IA nécessiteront une expansion. Un script simple peut être écrit pour (4.1.6-4.1.8) et s'exécuter plusieurs fois pour fournir les meilleurs résultats de détection cellulaire. Plusieurs ROI peuvent se chevaucher, mais c'est rare.
- Analyser la position des ROI et coller les données X et Y respectives dans le logiciel de table électronique (p. ex., Microsoft Excel).
- Analyser l'intensité grise par rapport au temps pour tous les ROI et coller les données dans le logiciel de table électronique.
- Analyser les données numériques.
- Importer les données dans le logiciel d'analyse de données. Selon le choix du logiciel et la durée/échantillonnage/taille de l'expérience, il peut s'agit d'une simple opération de copier-coller ou d'une procédure autonome. Assurer l'arrangement et le stockage des données numériques.
- Importer les horodateurs ou les notes d'heure, si disponible.
- Normaliser les données d'intensité de fluorescence brute (« F ») à la valeur initiale de la fluorescence (« F0»). Cela n'a pas besoin d'être la fluorescence dans le tout premier point, mais pourrait être la moyenne de plusieurs premiers points. La normalisation devrait réduire la variabilité des données et, dans un cas idéal (pas de ligne de base à la dérive) entraîner un ensemble de données analysables (« F/F0»).
- Si la variabilité de cellule à cellule de l'ensemble de données F/F0 est encore importante (enregistrement long, blanchiment), effectuez la correction de base. À cette fin, définissez une région de « contrôle », c'est-à-dire la plage de temps pendant laquelle la solution de contrôle (pour les îlots pancréatiques de souris, 3 mM de glucose sans agonistes/antagonistes) a été appliquée.
- Si la région de contrôle a un signal non oscillatoire clair, supposons que F/F0 revenait à la valeur initiale (F/F0'1) après chaque application de la solution de contrôle. Corriger les données time-lapse pour chaque cellule en divisant les données en segments, séparés par les points lorsque la solution de contrôle a été ajoutée, et en appliquant une correction linéaire à chaque segment. N'utilisez pas de correction polynomiale ou autre correction non linéaire, car cela donne lieu à des artefacts.
- Si la plage de contrôle présente des oscillations claires ou d'autres facteurs (comme l'autofluorescence FAD), utilisez un algorithme de détection de pointes17. Un run-around trivial et rapide pour cela est une transformation d'onde maxima-sensible (Figure 3A).
- Quantifier les données. Bien que Le Ca2 est un signal très dynamique, la présentation des données Ca2 en termes de valeurs absolues F/F0 est largement acceptable dans la littérature biomédicale. Si les résultats de plusieurs expériences doivent être comparés, choisissez une mesure.
- Mesurer la fréquence des pointes ca2 (figure 4A,D),et sa réponse à l'ajout de (ant)agonistes. À cette fin, divisez l'enregistrement en intervalles de temps égaux et calculez le cours du temps de la fréquence partielle (fréquence de pointe dans chacun des intervalles) en comptant les pointes dans l'intervalle et en normalisant à la durée d'intervalle.
- Vous pouvez également fixer le seuil et calculer la fraction de plateau (pf) pour chacun des intervalles définis ci-dessus (Figure 4B,F). La fraction indique le pourcentage de temps passé dans l'intervalle que la cellule a passé dans l'état «excité».
- Vous pouvez également calculer la zone partielle sous la courbe (pAUC) pour chacun des intervalles définis ci-dessus (figure 4C,G). Cette mesure est sensible aux changements de fréquence et d'amplitude de la pointe.
REMARQUE : Une mise en garde pour mesurer la fréquence est son manque de sensibilité pour la durée du pic et sa faible stabilité. Comme les données sont fortement sous-échantillonnées par rapport à la pointe électrique, le nombre de pointes par intervalle est assez faible et donc un seul pic supplémentaire peut affecter considérablement le résultat. Le « goulot d'étranglement » du pAUC est sa sensibilité aux changements de la ligne de base. Bien que moins sujette aux artefacts et plus sensible aux changements decyt [Ca2]que la fréquence, pAUC n'est pas très instructif sur la nature de la dynamique Ca2. La fraction de plateau est une extension du concept de probabilité ouverte au système de cellules entières. Il est moins robuste que pAUC cependant, en raison de sa dépendance à la valeur seuil.
Résultats
Les îlots se chargent assez bien avec les colorants trapoutables (figure 1A),à moins que la composition lipidique de la membrane n'ait été affectée (p. ex., par exposition chronique aux acides gras). Le vecteur humain de type 5 (Ad5) de type adénovirus (Ad5) cible également toutes les cellules des îîchers (figure 1B). Des problèmes peuvent survenir lorsque plus d'un capteur recombinant est exprimé dans la même cellule. En outre, les îlots sont généralement très bien immobilisés en utilisant la technologie décrite ci-dessus, qui offre une stabilité exceptionnelle et un accès à la solution.
Les pieux Ca2mD dans les cellules à revenu comprimé peuvent être facilement détectés à de faibles niveaux de glucose (figure 2). Il y a une corrélation cellulaire par cellule élevée entre l'activité à faible teneur en glucose et la réponse à l'adrénaline et au glutamate. Ghrelin active certaines cellules réactives à l'adrénaline (cellules de l'ae-œil?) à faible teneur en glucose, mais elle n'a aucun effet sur la dynamique Ca2 dans la plupart des cellules qui sont activées par un faible taux de glucose(cellules).
Lorsqu'il est analysé en termes de fréquence partielle (Figure 4A,C), l'adrénaline ou la ghréline stimulées cellules montrent une augmentation substantielle dans les conditions tout ou rien. C'est-à-dire, une cellule avec une faible activité basale qui est activée par l'adrénaline ou la ghréline montre une augmentation spectaculaire de cette mesure. Cependant, les changements globaux entre le pieux basal et l'effet d'adrénaline sont très subtils (Figure 4A,C). En revanche, l'AUC partielle est sensible aux changements introduits par l'adrénaline dans toutes les cellules, même lorsque l'activité basale est élevée (Figure 4B,D).

Figure 1 : Chargement du colorant trapoutable et expression du capteur recombinant dans les îlots. Îlots de souris typiques chargés avec le colorant trapu Fluo-4 (A) ou exprimant le capteur recombinant GCaMP6 dans la couche périphérique des cellules (B) ou dans la couche plus profonde (C). La sulforhodamine B (SRB, présentée en blanc) a été utilisée pour décrire les cellules individuelles dans chaque islet25. (D) Cinétique représentative de Ca2 en réponse au glucose enregistré à partir de cellules individuelles dans l'înt à l'aide de Fluo4. Notez l'hétérogénéité dans les populations cellulaires mineures. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Réponse ca2 typique des cellules des islets à divers stimuli. Typique de la dynamique des cellules de la cellule A (A) et de la cellule B (B) Ca2, en réponse à l'adrénaline, au glutamate, à la ghréline, au glucose. (C)-(D) Cartes thermiques de la réponse des cellules de l'îlots montrant des sous-populations d'adrénaline positive (C) et de ghréline positive (D). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
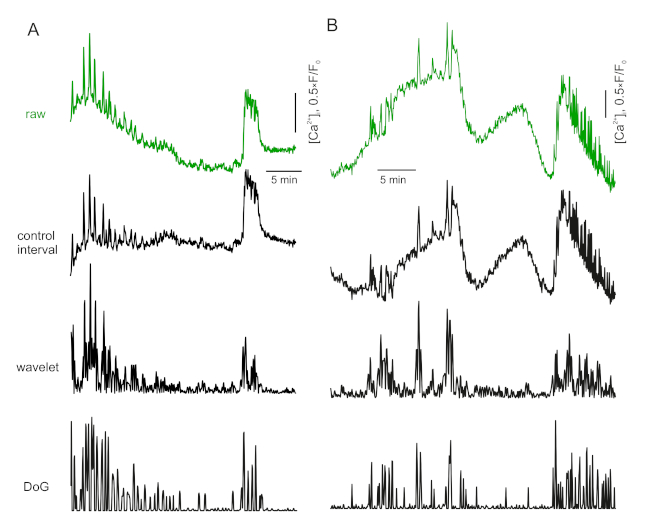
Figure 3 : Correction de base. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
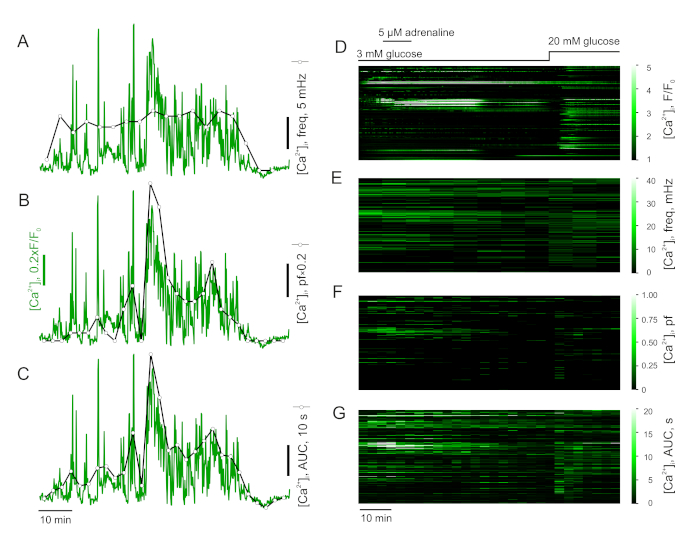
Figure 4 : Analyse des données sur le laps de temps. Analyse de la dynamique Ca2 dans les cellules de l'a.-c. Fréquence partielle (A), fraction de plateau (B) et zone sous la courbe (C) d'un '-cellules [Ca2 ']i trace. Populational [Ca2 ]i données d'un îct pancréatique de souris exprimées comme premières (F/F0) (D), fréquence partielle (E), fraction de plateau (F) et zone sous la courbe (G). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Il y a trois étapes dans le protocole qui sont essentielles au succès global. L'injection réussie de l'enzyme Liberase dans le conduit biliaire détermine non seulement le succès quantitatif de la procédure d'isolement, mais affecte également la qualité des îlots isolés. Pancreata non gonflé peut avoir comme conséquence l'absence de quelques réponses métaboliques importantes dans les îlots isolés. Deuxièmement, le chargement du colorant/l'expression du capteur définit le rapport signal-bruit de l'enregistrement time-lapse. Les signaux sont absents ou atténués dans les îlots surchargés. Enfin, le positionnement réussi et dense du tissu à l'intérieur de la chambre d'imagerie est un moment déterminant pour des expériences significatives et analysables. Les tissus mal positionnés ou mal placés entraînent une perte de temps expérimental et/ou des données peu claires.
La méthode peut être modifiée pour tenir compte de plusieurs signaux (à l'aide du système confocal) et de plusieurs groupes d'îlots (p. ex., de différents génotypes). L'imagerie de signaux multiples suppose la livraison d'un deuxième capteur dans chaque cellule de l'înet, spectralement compatible avec le journaliste Ca2 (comme un capteur de pH SNARF5f26,27). À cette fin, les îlots peuvent être co-chargés/co-infectés avec des capteurs Ca2 et pH, qui sont ensuite images séquentiellement dans chaque laps de temps.
L'imagerie du signal en groupes d'îlots avec résolution d'une seule cellule nécessite l'utilisation d'un large champ de vision objectif. L'objectif est susceptible d'avoir un grossissement et une ouverture numérique (NA) plus faibles, réduisant ainsi la résolution spatiale. En raison de la profondeur de mise au point accrue de l'objectif de faible niveau DNA, l'imagerie peut être réalisée sur un système à champ large. Les inconvénients de cet arrangement sont la contamination croisée cellulaire du signal lumineux et la capacité réduite d'imager le signal 3D (p. ex., les souris exprimant le capteur Ca2MD sous les promoteurs d'insuline). Dans le même temps, le signal exprimé à partir des cellules des îlots de surface peut être parfaitement résolu avec une résolution temporelle élevée de groupes comprenant des dizaines à des centaines d'îlots18.
Bien qu'il puisse sembler désagréable, mais l'exécution de l'analyse d'image et l'analyse des données numériques dans des logiciels distincts est une bonne idée. À l'heure actuelle, ImageJ/FIJI domine l'analyse d'images scientifiques. Les environnements les plus populaires pour le codage scientifique sont Python et Matlab, mais il ya aussi des efforts connus pour analyser les données Ca2 dans R28. La meilleure facilité d'utilisation est fournie par plus de paquets de niche comme IgorPro. Notre choix est de prototyper dans Matlab/Python, puis d'implémenter le code dans IgorPro pour l'utilisation de 'pipeline'. L'adaptation des paquets d'analyse de signal pour l'électrophysiologie (p. ex. Clampfit, Neuroexplorer) aux besoins analytiques peut être utile pour l'imagerie unicellulaire, mais il est difficile de l'étendre. De nombreuses options offertes par ces forfaits ne s'appliquent pas à l'imagerie des islets en raison du faible taux d'échantillonnage.
Il est important de se rappeler que cette méthodologie est limitée par un certain nombre de facteurs. Tout d'abord, comme mentionné ci-dessus, l'imagerie est largement basée sur le sous-échantillonnage des données, ce qui signifie qu'elle n'indique pas et ne peut donc pas être directement comparée à l'activité électrique de la cellule. Deuxièmement, les données proviennent de la périphérie de l'îît et ne reflètent pas d'importants processus de couplage qui sont, de façon générale, tridimensionnels. Troisièmement, le niveau de chargement/expression affecte la perception de l'intensité du capteur. Enfin, l'activation de sous-populations de cellules d'îts moins recherchées (p. ex., cellules PP et cellules) par les composés marqueurs ne peut être exclue, bien qu'en raison du faible nombre de ces cellules dans l'în, toute contamination potentielle soit minime.
La méthode est un véritable «champion» en termes d'effet visuel, que les processus oscillatoires offrent une forte impression d'un tissu véritablement vivant. Appliquée aux sous-populations cellulaires mineures, la méthode sonde la fonction de chacun de façon fiable, permettant l'identification des sous-groupes et reflétant l'hétérogénéité.
La dynamique du calcium a été étudiée dans les cellules des îcles pancréatiques depuis plus de 40 ans, principalement grâce aux progrès de la technologie d'acquisition/détection. Les premières études ont utilisé la spectroscopie d'absorption atomique29, mais ce n'est qu'à l'arrivée des capteurs fluorescents Ca2 30 que la cinétique détaillée a pu être résolue dans les cellules des îcles individuels, en utilisant la photométrie31,32,33. Peu de temps après, la composante spatiale de la cinétique Ca2 a été améliorée à mesure que l'imagerie Ca2 34 ,35,36 est devenue une technologie de routine, grâce aux détecteurs d'appareils couplés de charge (CCD) alors nouvellement disponibles. Le problème de la lumière hors foyer, qui a entravé l'imagerie du signal des cellules individuelles dans le tissu, a alors été résolu dans le milieu des années 90 par le biais de la microscopie confocale de balayage laser (LSCM)37 et de la microscopie interne totale de fluorescence de réflexion (TIRFM)38. Les deux méthodes, complétées par l'arrivée d'une nouvelle génération de capteurs fluorescents Ca2 avec un laser de 488 nm, ont été utilisées avec succès pour l'image de la dynamique Ca2 dans les sous-populations de cellules d'înet39,40,41.
Le nouveau siècle a mis en avant deux nouvelles tendances qui ont découlé des développements technologiques liés aux neurosciences. Tout d'abord, les capteurs fluorescents recombinants basés sur la permutation circulaire des variantes de GFP ont considérablement augmenté le rapport signal-bruit pour la détection Ca2, amenant efficacement les études au niveau des grandes populations cellulaires, dans lesquelles la dynamique ducyt [Ca2]dans chaque cellule pourrait être résolue. Deuxièmement, l'utilisation de promoteurs spécifiques aux tissus a permis de cibler l'expression du capteur aux sous-populations mineures.
Bien que généralement pensé pour refléter les développements en neurosciences, les études sur l'îc Ca2 dynamique ont deux différences clés. Tout d'abord, technologiquement, toute imagerie in vivo de la signalisation des îlots est plus complexe que l'imagerie dans le cerveau en raison de l'anatomie imprévisible du pancréas et l'emplacement des îlots42. Deuxièmement, un excellent couplage électrique entre les cellules de l'îlots Eta, rend essentiellement les îlots en populations électriquement inertes affichant une réponse apparemment parfaite tout ou rien au stimulus élevé de glucose. Nous croyons que les études de [Ca2']i cinétique dans les sous-populations mineures d'islet, telles que les cellules de ', basées sur le ciblage tissulaire-spécifique sont susceptibles d'élargir nos connaissances de leur pharmacologie/physiologie. Dans le même temps, des sondes très sensibles permettent d'étendre la puissance statistique de ces mesures, en tenant compte de la variabilité de l'îlots à l'îlots et en permettant l'imagerie d'îlots de différents groupes au sein d'une expérience parallèle.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts.
Remerciements
AH a reçu un doctorat sur le diabète au Royaume-Uni, EV a été soutenu par le programme de formation OXION-Wellcome Trust, AIT a tenu une bourse postdoctorale Oxford Biomedical Research Council.
matériels
| Name | Company | Catalog Number | Comments |
| 40x/1.3 objective | |||
| Axiovert 200 microscope | |||
| emission | |||
| Excitation | |||
| Fetal bovine serum | Sigma-Aldrich | F7524-500ML | |
| Fluo4 | Thermo Fisher (Life Technologies) | F14201 | |
| GCaMP6f, in (human type 5) adenoviral vector | Vector Biolabs | 1910 | |
| Hanks' solution | Thermo Fisher (GibCo, Life Technologies) | ||
| Liberase | Sigma-Aldrich | 5401020001 | |
| penicillin/streptomycin | Thermo Fisher (GibCo, Life Technologies) | 15140122 | |
| RPMI medium | Thermo Fisher (GibCo, Life Technologies) | 61870044 | |
| Zeiss LSM510-META confocal system | Carl Zeiss |
Références
- Elayat, A. A., el-Naggar, M. M., Tahir, M. An immunocytochemical and morphometric study of the rat pancreatic islets. Journal of Anatomy. 186, Pt 3 629(1995).
- Cabrera, O., et al. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Brereton, M. F., Vergari, E., Zhang, Q., Clark, A. Alpha-, delta-and PP-cells: are they the architectural cornerstones of islet structure and co-ordination. Journal of Histochemistry & Cytochemistry. 63 (8), 575-591 (2015).
- Færch, K., et al. Insulin resistance is accompanied by increased fasting glucagon and delayed glucagon suppression in individuals with normal and impaired glucose regulation. Diabetes. 65 (11), 3473-3481 (2016).
- Dabrowski, M., Tarasov, A., Ashcroft, F. M. Mapping the architecture of the ATP-binding site of the KATP channel subunit Kir6 2. The Journal of Physiology. 557 (2), 347-354 (2004).
- Liu, Y. J., Vieira, E., Gylfe, E. A store-operated mechanism determines the activity of the electrically excitable glucagon-secreting pancreatic alpha-cell. Cell Calcium. 35 (4), 357-365 (2004).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca 2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137(2001).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2. Proceedings of the National Academy of Sciences. 98 (6), 3197-3202 (2001).
- Broussard, G. J., Liang, R., Tian, L. Monitoring activity in neural circuits with genetically encoded indicators. Frontiers in Molecular Neuroscience. 7, 97(2014).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42 (2), 111-129 (2017).
- Tarasov, A. I., Rutter, G. A. Methods in enzymology. 542, Elsevier. 289-311 (2014).
- Tarasov, A. I., et al. Frequency-dependent mitochondrial Ca(2+) accumulation regulates ATP synthesis in pancreatic β cells. Pflugers Archiv: European Journal of Physiology. 465 (4), 543-554 (2013).
- Smith, N. A., et al. Fluorescent Ca2+ indicators directly inhibit the Na, K-ATPase and disrupt cellular functions. Science Signal. 11 (515), 2039(2018).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888-1891 (2011).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. Elife. 5, 12727(2016).
- Theis, L., et al. Benchmarking Spike Rate Inference in Population Calcium Imaging. Neuron. 90 (3), 471-482 (2016).
- Hamilton, A., et al. Adrenaline Stimulates Glucagon Secretion by Tpc2-Dependent Ca(2+) Mobilization From Acidic Stores in Pancreatic alpha-Cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Mourao, M., Satin, L., Schnell, S. Optimal experimental design to estimate statistically significant periods of oscillations in time course data. PloS One. 9 (4), 93826(2014).
- Zmuda, E. J., Powell, C. A., Hai, T. A method for murine islet isolation and subcapsular kidney transplantation. Journal of Visualized Experiments. (50), (2011).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Thevenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Tarasov, A. I., et al. Monitoring real-time hormone release kinetics via high-content 3-D imaging of compensatory endocytosis. Lab on a Chip. 18 (18), 2838-2848 (2018).
- Knudsen, J. G., et al. Dysregulation of Glucagon Secretion by Hyperglycemia-Induced Sodium-Dependent Reduction of ATP Production. Cell Metabolism. , (2018).
- Adam, J., et al. Fumarate hydratase deletion in pancreatic β cells leads to progressive diabetes. Cell Reports. 20 (13), 3135-3148 (2017).
- Wills, Q. F., et al. Statistical approaches and software for clustering islet cell functional heterogeneity. Islets. 8 (2), 48-56 (2016).
- Berggren, P. O., Ostenson, C. G., Petersson, B., Hellman, B. Evidence for divergent glucose effects on calcium metabolism in pancreatic beta- and alpha 2-cells. Endocrinology. 105 (6), 1463-1468 (1979).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. The Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Longo, E. A., et al. Oscillations in cytosolic free Ca2+, oxygen consumption, and insulin secretion in glucose-stimulated rat pancreatic islets. The Journal of Biological Chemistry. 266 (14), 9314-9319 (1991).
- Johansson, H., Gylfe, E., Hellman, B. Cyclic AMP raises cytoplasmic calcium in pancreatic alpha 2-cells by mobilizing calcium incorporated in response to glucose. Cell Calcium. 10 (4), 205-211 (1989).
- Grapengiesser, E., Gylfe, E., Hellman, B. Three types of cytoplasmic Ca2+ oscillations in stimulated pancreatic β-cells. Archives of Biochemistry and Biophysics. 268 (1), 404-407 (1989).
- Okamoto, Y., et al. Role of cytosolic Ca2+ in impaired sensitivity to glucose of rat pancreatic islets exposed to high glucose in vitro. Diabetes. 41 (12), 1555-1561 (1992).
- Gilon, P., Henquin, J. C. Influence of membrane potential changes on cytoplasmic Ca2+ concentration in an electrically excitable cell, the insulin-secreting pancreatic B-cell. The Journal of Biological Chemistry. 267 (29), 20713-20720 (1992).
- Valdeolmillos, M., Nadal, A., Soria, B., Garcia-Sancho, J. Fluorescence digital image analysis of glucose-induced [Ca2+]i oscillations in mouse pancreatic islets of Langerhans. Diabetes. 42 (8), 1210-1214 (1993).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Stout, A. L., Axelrod, D. Evanescent field excitation of fluorescence by epi-illumination microscopy. Applied Optics. 28 (24), 5237-5242 (1989).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PloS One. 8 (1), 54638(2013).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in alpha- and beta-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- van Gurp, L., et al. Sequential intravital imaging reveals in vivo dynamics of pancreatic tissue transplanted under the kidney capsule in mice. Diabetologia. 59 (11), 2387-2392 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon