Method Article
Bildgebende Calciumdynamik in Subpopulationen von Maus-Pankreas-Islet-Zellen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur Abbildung und Quantifizierung der Calciumdynamik in heterogenen Zellpopulationen wie Pankreas-Isletzellen vor. Fluoreszierende Reporter werden in die periphere Zellschicht innerhalb der Islet geliefert, die dann immobilisiert und abgebildet wird, und es wird eine pro-Zell-Analyse der Dynamik der Fluoreszenzintensität durchgeführt.
Zusammenfassung
Pankreas-Islet-Hormone regulieren die Blutzucker-Homöostase. Veränderungen des Blutzuckerspiegels induzieren Schwingungen von zytosolischem Kalzium in Pankreas-Isletzellen, die die Sekretion von drei Haupthormonen auslösen: Insulin (aus den Zellen), Glucagon (Zellen) und Somatostatin (Zellen). Die Zellen, die die Mehrheit der Ischenzellen ausmachen und elektrisch miteinander gekoppelt sind, reagieren auf den Glukosereiz als eine Einheit. Die Erregbarkeit der kleineren Subpopulationen, der Zellen und der Zellen (die etwa 20 % (30 %) ausmachen und 4% (10%) der gesamten Nagetier1 (Mensch2) Islet Zellzahlen, bzw.) ist weniger vorhersehbar und ist daher von besonderem Interesse.
Calciumsensoren werden in die periphere Zellschicht innerhalb der isolierten Islet abgegeben. Die Insel oder eine Gruppe von Inselchen wird dann immobilisiert und mit einem Fluoreszenzmikroskop abgebildet. Die Wahl des Bildgebungsmodus liegt zwischen höherem Durchsatz (Weitfeld) und besserer räumlicher Auflösung (konfokale). Konventionell wird die konfokale Laserscanning-Mikroskopie für die Abbildung von Gewebe verwendet, da sie die beste Trennung des Signals zwischen den benachbarten Zellen bietet. Ein Weitfeldsystem kann auch genutzt werden, wenn das kontaminierende Signal der dominierenden Population der Zellen minimiert wird.
Sobald die Kalziumdynamik als Reaktion auf spezifische Reize aufgezeichnet wurde, werden die Daten in numerischer Form als Fluoreszenzintensität vs. Zeit ausgedrückt, normalisiert auf die anfängliche Fluoreszenz und Baseline-korrigiert, um die Mitwirkungen der Bleiche der Fluorophor. Änderungen der Spitzenfrequenz oder des Teilbereichs unter der Kurve (pAUC) werden im Vergleich zur Zeit berechnet, um die beobachteten Effekte zu quantifizieren. pAUC ist empfindlicher und recht robuster, während die Spiking-Frequenz mehr Informationen über den Mechanismus der Kalziumerhöhung liefert.
Kleinere Zellsubpopulationen können mit funktionellen Reaktionen auf Markerverbindungen wie Adrenalin und Ghrelin identifiziert werden, die Veränderungen des zytosolischen Kalziums in einer bestimmten Population von Ischenzellen induzieren.
Einleitung
Der Zweck der Methode besteht darin, Echtzeitveränderungen in der zytosolischen Kalziumkonzentration ([Ca2+]cyt) in kleineren Subpopulationen von Pankreas-Isletzellen abzubilden. Dies ermöglicht die Aufdeckung der Mechanismen für die Hormonsekretion in diesen Zellen, die Offenlegung von Details über das Cross-Talk zwischen verschiedenen Zelltypen und möglicherweise die Einführung einer Populationsdimension in das gesamte Bild der Islet-Signalisierung.
Inselchen bestehen aus mehreren Zelltypen. Neben den bekannteren Insulin-Sekret-Zellen gibt es mindestens zwei Subpopulationen, die auch bei der Regulierung des Blutzuckers3von entscheidender Bedeutung sind. Zellen (die etwa 17% der Ischenzellen ausmachen) sezernieren Glucagon, wenn der Blutzuckerzufluss zu niedrig wird, was auf die Freisetzung von Glukose aus den Depots in der Leber signalisiert. Übermäßige Glucagon-Spiegel (Hyperglucagonemie) und beeinträchtigte Kontrolle der Glucagon-Freisetzung begleiten (und, technisch gesehen, kann dazu beitragen), den prädiabetischen Zustand der beeinträchtigten Insulinempfindlichkeit4. •-Zellen (ca. 2%) Somatostatin als Reaktion auf die Glukoseerhöhung. Dieses allgegenwärtige Peptidhormon ist wahrscheinlich in hohen Konzentrationen in der Nähe von -- und -Zellen innerhalb von Inselchen vorhanden, was eine starke G i-Rezeptor-vermittelte Dämpfungswirkung sowohl auf Glucagon als auch auf Insulinsekretion hat.
Die Zellen und Zellen teilen sich einen großen Teil der Glukose-Sensing-Maschinerie mit ihren nahen Linienverwandten, den Zellen. Alle drei Zelltypen sind mit ATP-empfindlichen K+-Kanälen ausgestattet, aufwendigen Stoffwechselsensoren5, die das Plasmamembranpotenzial dieser erregbaren Zellen steuern. Gleichzeitig wird die Sekretion von Insulin, Somatostatin und Glucagon durch Glukose unterschiedlich reguliert. Die Abbildung der Ca2+-Dynamik in den beiden kleineren Subpopulationen von Isletzellen kann somit einen Einblick in den Quertalk zwischen Blutzucker und islet sekretoziellen Output geben.
Frühe Versuche, die Erregbarkeit von Zellen mit Patch-Clamp-Elektrophysiologie zu überwachen, folgten bald der Bildgebung von Ca2+ in einzelnen Zellen. Die Identität der Zellen in diesen Experimenten wurde durch eine posteriori Färbung mit Anti-Glucagon oder Anti-Somatostatin-Antikörpern überprüft. Diese Bemühungen wurden häufig durch die Feststellung behindert, dass sich Die zellissenzellen innerhalb der Islet und als einzelne Zellen sehr unterschiedlich verhalten. Obwohl die Zellen die Hauptwohltäter der Ischenanordnung zu sein scheinen (aufgrund ihrer überwältigenden Mehrheit, die ihrer starken elektrischen Kopplung zugrunde liegt), wurde die Hauptabweichung überraschenderweise in den Zellen gefunden. Innerhalb der intakten Islet werden diese Zellen ständig und dauerhaft bei niedriger Glukose aktiviert, was nur für etwa 7% der einzelnen dispergierten Zellen6gilt. Es wird daher angenommen, dass die Berichterstattung über die Aktivität von Zellen innerhalb intakter Inselchen eine nähere Annäherung der In-vivo-Bedingungen darstellt.
Im Allgemeinen gibt es zwei Möglichkeiten, ca2+-Dynamik speziell aus den Subpopulationen von '-Zell oder -Zell zu melden: (i) Ausdrücke eines genetisch codierten Ca2+-Sensors über einen gewebespezifischen Promotor oder (ii) unter Verwendung von Markerverbindungen. Der elegantere frühere Ansatz fügt den wesentlichen Vorteil der echten 3D-Bildgebung und damit das Studium der Zellverteilung innerhalb der Islet hinzu. Es kann jedoch nicht für intaktes menschliches Isletmaterial angewendet werden. Ein weiteres potenzielles Problem ist die "Leakiness" des Promotors, insbesondere wenn die Transdifferenzierung oder die Reaktion der Zelle auf hohe Glukose vorhanden ist. Der letztgenannte Ansatz kann mit frisch isoliertem Gewebe einschließlich menschlicher Proben oder kultivierter Inselchen verwendet werden. Die Daten werden jedoch ausschließlich aus der peripheren Schicht von Ischenzellen gewonnen, da die Bereitstellung des Farbstoffs/Markermoleküls in tieferen Schichten, ohne die Isletarchitektur zu verändern, eine Herausforderung darstellt. Ein unerwarteter Vorteil des letztgenannten Ansatzes ist die Kompatibilität mit dem Wide-Field-Imaging-Modus, der es ermöglicht, die Experimente auf die gleichzeitige Abbildung von Dutzenden oder Hunderten von Inselchen (d. h. Tausende bis Zehntausende von Zellen) zu skalieren.
Calcium wird in vivo mit genetisch kodierten GCaMP7 (oder pericam8) Familiensensoren abgebildet, die Varianten von kreisförmig permutiertem grünem Fluoreszenzprotein (GFP) sind, die mit dem Calcium-bindenden Protein-Calmodulin und seiner Zielsequenz, dem M13-Fragment der Myosin-Lichtkettenkinase7,9, verschmolzen werden. GCaMPs haben hervorragende Signal-Rausch-Verhältnisse im Bereich der nanomolaren Ca2+ Konzentrationen und einen hohen 2-Photon-Querschnitt, was sie zu einer idealen Wahl für in vivo Arbeitenmacht 10,11. Der schwierige Aspekt des Einsatzes rekombinanter Sensoren ist ihre Abgabe in die Zellen. Die heterologe Expression erfordert die Verwendung eines viralen Vektors und eine mehrstündige Ex-vivo-Kultivierung, was häufig Bedenken hinsichtlich einer möglichen Entdifferenzierung oder Verschlechterung der Zellfunktionen aufwirft. Obwohl Mausmodelle, die bereits entwickelt wurden, um GCaMP auszudrücken, dieses Problem lösen, fügen sie neue Herausforderungen hinzu, indem sie die Vorlaufzeit erheblich erhöhen und die Arbeit auf ein nicht-menschliches Modell beschränken. Eine sehr hohe Empfindlichkeit gegenüber Veränderungen des intrazellulären pH-Werts ist eine weitere nachteilige Seite der proteinbasierten Sensoren12, was jedoch weniger ein Problem für die Erfassung oszillatorischer Signale wie Ca2+darstellt.
Der Vorteil von trappablen Farbstoffen (wie z.B. grüne fluoreszierende Fluo4) ist, dass sie innerhalb von etwa einer Stunde in frisch isoliertes Gewebe geladen werden können. Wie vorherzusehen ist, haben abfangbare Farbstoffe ein geringeres Signal-Rausch-Verhältnis und (viel) geringere Photostabilität als ihre rekombinanten Pendants. Wir können13 Berichte über die Toxizität der abfangbaren Farbstoffe14nicht bestätigen, jedoch ist eine Farbüberlastung ein häufiges Problem.
Rote rekombinante Ca2+-Sensoren auf Basis kreisförmiger Permutation haben sich seit 201115rasant weiterentwickelt, und die jüngsten Entwicklungen stellen einen starken Wettbewerb zu GCaMPs16 für die Gewebebildgebung dar, da das rote Licht stärker in die Tiefe eindringt. Kommerziell erhältliche rote, abfangbare Farbstoffe können zuverlässig für die einzellige Bildgebung verwendet werden, können aber auf Gewebeebene nicht gut mit den grünen Analoga konkurrieren.
Es gibt scheinbar kaum eine Auswahl an Bildgebungstechnologie für Experimente im Gewebe, bei denen unkonzentriertes Licht zu einem kritischen Problem wird. Das konfokale System bietet eine akzeptable einzelzellige Auflösung durch Annullierung des nicht fokussierten Lichts mit einem beliebigen Objektiv auf der NA über 0,3 (für den Fall von GCaMP6) oder 0,8 (trappabler Farbstoff). Im technischen Sinne kann ein herkömmliches konfokales Mikroskop zur gleichzeitigen Abbildung von [Ca2+]Cyt aus Hunderten (GCaMP) oder Dutzenden von Inselchen (trappabler Farbstoff) verwendet werden. Die einzige realistische Alternative zum konfokalen Modus bei 3D-Expression des Sensors im Gewebe ist vielleicht die Lichtbogenmikroskopie.
Etwas anders sieht es bei dem Fall aus, wenn der Sensor in der peripheren Zellschicht innerhalb des Ischengewebes ausgedrückt wird. Für helle rekombinante Sensoren, die ein lebendiges intrazelluläres Expressionsmuster aufweisen, kann die Verwendung eines Breitfeld-Bildgebungsmodus mit einem Low-NA-Objektiv eine ausreichende Qualität bieten und den Forscher mit einer erheblichen Zunahme des Sichtbereichs und damit der Durchsatz. Ein Weitfeldsystem bietet eine schlechtere räumliche Auflösung, da das nicht fokussierte Licht nicht aufgehoben wird. Daher ist bildgebendes Gewebe mit hohen NA-Zielen (niedrige Schärfentiefe) weniger informativ, da das einzellige Signal durch benachbarte Zellen stark kontaminiert ist. Die Kontamination ist bei Zielen mit niedriger NA (hohe Schärfentiefe) viel kleiner.
Es gibt jedoch Aufgaben, bei denen ein hoher Durchsatz und/oder eine hohe Abtastrate zu einem entscheidenden Vorteil werden. Die Zellen weisen eine erhebliche Heterogenität auf, was eine Nachfrage nach hohen Stichprobengrößen erzeugt, um den Beitrag der Subpopulationen zu offenbaren. Die Großfeld-Bildgebung ist schnell und empfindlicher, wobei ein industrielles Großfeldsystem Hunderte (GCaMP) oder Dutzende (Fluo4) von Inselchen mit dem gleichen Signal-Rausch-Verhältnis wie die konfokalen Experimente an zehn bzw. einer einzelnen Insel abzeichnet. Dieser Unterschied im Durchsatz macht das Weitfeldsystem vorteilhaft für die populationsbildende Bildgebung mit einer Einzelzellauflösung, die besonders kritisch für kleine Subpopulationen wie die --Zell-Eins sein kann. Ebenso würden Versuche, die elektrische Aktivität von Ca2+ spiking17 zu rekonstruieren, von der höheren Abtastrate profitieren, die von einem Großfeld-Bildgebungsmodus bereitgestellt wird. Zur gleichen Zeit erfordern mehrere "Nischen"-Probleme wie die Aktivität von Bauchspeicheldrüsenzellen bei der Stimulation der dominierenden Subpopulation der Zelle die Verwendung eines konfokalen Systems. Ein Faktor, der die Entscheidung zum konfokalen Modus beeinflusst, ist das Vorhandensein eines erheblichen kontaminierenden Signals aus der Subpopulation der Zelle.
Obwohl die Verwendung von hormonspezifischer Antikörperfärbung zur Überprüfung der Identität der Zellen nach den bildgebenden Experimenten immer noch eine Option ist, können kleinere Zellsubpopulationen mit funktionellen Markerverbindungen wie Adrenalin und Ghrelin identifiziert werden, die nachweislich dieCa2+-Dynamik in den Zellen19,20bzw. selektiv stimulieren.
Die Analyse von Zeitraffer-Bildgebungsdaten zielt darauf ab, Informationen über die triviale Pharmakologie hinaus bereitzustellen, wie z. B. Populationsheterogenität, Korrelation und Interaktion verschiedener Signale. Üblicherweise werden bildgebende Daten als Intensität vs. Zeit analysiert und auf die anfängliche Fluoreszenz normalisiert (F/F0). Aufgrund des Bleichens des Fluorophorsignals oder der Kontamination durch Veränderungen der Autofluoreszenz oder des pH-Wertes (typischerweise induziert durch Millimolar-Glukosespiegel12) ist häufig eine Basiskorrektur erforderlich. Ca2+ Daten können auf viele verschiedene Arten analysiert werden, aber drei Haupttrends sind, Veränderungen in der Spitzenfrequenz, der Plateaufraktion oder dem Bereich unter der Kurve zu messen, berechnet vs. Zeit. Letzterer Ansatz war von Vorteil, insbesondere bei der Anwendung von stark untersampelten konfokalen Daten. Der Vorteil der pAUC-Metrik ist ihre Empfindlichkeit gegenüber Veränderungen der Signalfrequenz und Amplitude, während die Berechnung der Frequenz eine beträchtliche Anzahl von Schwingungen21erfordert, was mit konventioneller Bildgebung schwer zu erreichen ist. Der begrenzende Faktor der pAUC-Analyse ist seine hohe Empfindlichkeit gegenüber Basisänderungen.
Protokoll
Alle hier beschriebenen Methoden wurden in Übereinstimmung mit dem United Kingdom Animals (Scientific Procedures) Act (1986) und den ethischen Richtlinien der Universität Oxford entwickelt.
1. Isolieren Sie Die Pankreasinseln der Maus
- Bereiten Sie das Kulturmedium und die Isolationslösung vor.
- Bilden Sie das Kulturmedium: RMPI1640 (siehe Materialtabelle), ergänzt durch 10% fetales Kalbsserum, 100 Einheiten/ml Penicillin, 100 g/ml Streptomycin. Geben Sie das Medium in zwei 60 mm Kunststoff Petri Schalen (nicht mit Klebstoff behandelt), und halten Sie die Gerichte im Inkubator (37 °C, 5%CO2, absolute Luftfeuchtigkeit).
- Bilden Sie die Isolationslösung (50 ml/Maus): Hanks' Medium mit 5 mM Glukose, 100 Einheiten/ml Penicillin 100 g/ml Streptomycin. Auf Eis (4 °C).
- Die Enzymlösung (z.B. Liberase): 0,2 mg/ml in der Isolationslösung, 2 ml pro Maus. Auf Eis (4 °C). Optional, vorab testen, die Aktivität von Liberase, und optimieren Sie die Inkubationsparameter für jede Charge desEnzyms 22.
- Injizieren Sie die Enzymlösung in den Gallengang der Maus.
- Opfern Sie die Maus (12 Wochen altes Weibchen, C57Bl/6J) durch Zervixverrenkung.
- Unter einem Seziermikroskop die Haut- und Muskelschichten mit einer feinen Schere aufschneiden und den Gallengang lokalisieren.
- Ligate den Darm auf beiden Seiten der Kreuzung mit dem Gallengang, mit einem Baumwollfaden.
- Heben Sie den Gallengang vorsichtig mit gebogenen feinen Uhrmacherzangen an und führen Sie die eiskalte Enzymlösung mit einer 2 ml Spritze mit einer 30G-Nadel in den Kanal ein. Eine Inflation der Bauchspeicheldrüse sollte in diesem Stadium beobachtet werden.
- Sammeln Sie die aufgeblasene Bauchspeicheldrüse mit einer Kombination aus stumpfnasigen Daumenzangen und feinen Uhrmacherzangen in ein 15 ml Falkenrohr und halten Sie sie auf Eis (4 °C). 1 ml der Enzymlösung in die Röhre geben.
- Befreien und sammeln Sie die Pankreas-Inseln aus der Bauchspeicheldrüse.
- Die Pankreata mit der Enzymlösung 16 min in einem Wasserbad bei 37 °C aufblasen. Sanftes Schütteln kann verwendet werden, ist aber nicht kritisch, vorausgesetzt, die Inflation war gut.
- Stoppen Sie die Verdauung durch Zugabe von eiskalter Isolationslösung, bis zu 10 ml. Den Digest sanft schütteln: Er sollte in kleine Stücke fallen.
- Den Digest dreimal in 10 ml der Isolationslösung waschen, 5 min bei 1 x g stehen lassen, um die befreiten Inselchen auf Eis zu sedimentieren. Den Überstand sanft mit einer 10 ml serologischen Pipette ansaugen.
- Fügen Sie kaltes RPMI in den Digest (um bis zu 10 ml zu machen).
- Verwenden Sie Kunststoff Petri-Gerichte (Schritt 1.1.1), um die Inselchen zu pflücken. Dekantieren Sie das RMPI-Medium von einer der Petri-Schalen, und gießen Sie stattdessen vorsichtig einige (4-5 ml) des Digests. Sammeln Sie die befreiten Inselchen, die als runde, glatte und hochdichte Stücke erscheinen, mit einer P10 Pipette in die zweite Petrischale.
- Kultur die Inseln im Inkubator (37 °C, 5%CO2, absolute Luftfeuchtigkeit). Das Experiment kann in diesem Stadium angehalten werden. Das Verlassen der Inselchen für 1-2 Stunden wird von einigen geglaubt, um zu helfen, von der mechanischen Belastung während der Isolierung zu erholen.
2. Laden Sie den Farbstoff oder drücken Sie den Sensor aus
- Bereiten Sie den abfangbaren Farbstoff vor.
- Lösen Sie den Aliquot (normalerweise 50 g) des abfangbaren Farbstoffs (z. B. Fluo-4) in DMSO auf eine Lagerkonzentration von 2 mM auf. Pluronsäure zu einer Endkonzentration von 1% hinzufügen (mit einem 20% Vorrat an DMSO), um die Löslichkeit des Farbstoffs zu verbessern.
- Aliquot den Farbstoff in kleinen PCR-Röhren (jeweils 2 l). Der Farbstoff kann mehrere Wochen gefroren (-20 °C) gelagert werden.
- Alternativ können Sie den rekombinanten Sensor vorbereiten.
- Verteilen Sie den Sensor (z. B. adenovirale Vektorcodierung GCaMP6f) in 10 L Aliquots und lagern Sie bei -80 °C.
- (Optional) den Titer des Virusbestands vortesten, indem Inselchen (wie unten) mit mehreren seriellen Verdünnungen infiziert werden, um die optimale Konzentration für infektionsmittelzuzeigen.
HINWEIS: Rekombinante Sensoren, die von verschiedenen Vektoren (Lentivirus, BacMam, AAV) kodiert sind, erfordern ein anderes Infektionsprotokoll. Achten Sie darauf, dies mit dem Vektoranbieter zu überprüfen und das Arbeitsverhältnis für Ihre Bedürfnisse zu optimieren. Der "Arbeitsbestand" des Adenovirus kann bei -20 °C gelagert und mehrmals eingefroren/aufgetaut werden. Übermäßiges Frost-Tau-Zyklus reduziert den effektiven Titer des Virus.
- Bereiten Sie die Bildverarbeitungslösung vor.
- Make up the imaging solution, mM: 140 NaCl, 4.6 KCl, 2.6 CaCl2, 1.2 MgCl2, 1 NaH2PO4, 5 NaHCO3, 10 HEPES (pH 7.4, with NaOH).
- Machen Sie einen Vorrat an Glukose (0,5 M) und Mannitol (0,5 M) in der bildgebenden Lösung. Der Vorrat kann mehrere Wochen im Kühlschrank (4 °C) gelagert werden.
- Laden Sie den abfangbaren Farbstoff.
- Bilden Sie die Farbstoffarbeitslösung, indem Sie 2 l des Farbstoffs in 600 l der bildgebenden Lösung auflösen, die 6 mM Glukose enthält. Die Lösung kann erhitzt oder gewirbelt werden, um die Löslichkeit zu verbessern.
- Die in Schritt 1 isolierten Inselchen in die Arbeitslösung des Farbstoffs eintragen. Die Beladung kann mit einer Multiwell-Platte oder einer Petrischale erfolgen. Im letzteren Fall legen Sie ein 100-L-Tröpfchen der Arbeitslösung auf den Boden einer nicht klebenden Petrischale (35- oder 60-mm) und Pipette 10-30-Inseln in das Tröpfchen.
- Bei verschiedenen Inselgruppen (z.B. Wildtyp/Knock-out) können mehrere Brunnen und mehrere Tröpfchen angeordnet werden, damit die Beladung gleichzeitig erfolgen kann.
- Die Inselchen in der Farbstofflösung bei Raumtemperatur in der Dunkelheit 70-90 Minuten betätigen. Nicht überbrütieren.
- Überprüfen Sie die Belastung unter dem Fluoreszenzmikroskop; Die Inseln sollten eine milde Fluoreszenz erhalten, wobei einige Zellen heller sind als der Rest. Die Aufrundung von Zellen und die kerntechnische Lokalisierung des Farbstoffs sind Anzeichen einer Überlastung.
- Übertragen Sie die Inselchen in eine farbfreie Bildgebungslösung mit 6 mM Glukose. Die Inselchen können sofort für die Bildgebung verwendet werden, aber optional kann der Farbstoff für weitere 10-15 Minuten entestert werden. Inselchen behalten den Farbstoff für mehrere Stunden und können daher in mehreren Schichten für die Bildgebung verwendet werden.
- Alternativ können Sie die Inselchen mit dem rekombinanten Vektor infizieren.
- Die Inselchen in Tröpfchen im RPMI-Kultivierungsmedium (Schritt 1.1.1) (z. B. 30 l) anlegen, um das benötigte Vektorvolumen zu minimieren.
- Fügen Sie den Vektor mit einem Verhältnis von etwa 105 infektiösen Einheiten/Islet hinzu, die idealerweise zu einer Vielzahl von Infektionen führen sollten >2. Idealerweise sollte das Verhältnis auf das minimale Verhältnis optimiert werden, das Ausdruck in der peripheren Ebene liefern würde. Die Vortitration (Schritt 2.2.3) kann helfen.
- Führen Sie 20-50 Inselchen in das Tröpfchen und Kultur für 8-48 Stunden. (Idealerweise über Nacht). Inselchen sollten in den meisten Zellen eine schwache grüne Fluoreszenz entwickeln, ohne Veränderungen in der Zellmorphologie.
HINWEIS: Der Erfolg der Infektion und Expression hängt vom Zeitpunkt der Exposition gegenüber der Viruslösung ab. Idealerweise sollte das Virus über Nacht in der Lösung bleiben, kann aber optional nach nur 15 Minuten entfernt werden. Jedoch, Infektiosität, und damit Ausdruck, ist wahrscheinlich dramatisch niedriger sein.
3. Imaging Ca2+ Dynamik
- Immobilisieren Sie die Inselchen unter dem (invertierten) Mikroskop.
- Montieren Sie die Bildgebungskammer für die invertierte Mikroskopie. Positionieren Sie den Glasdeckel (Dicke 1 oder 1,5) innerhalb der Kammer und stellen Sie sicher, dass die Glaskammerschnittstelle wasserdicht ist. Prüfen Sie, ob sich der Deckschein in Reichweite des Mikroskopobjektivs befindet (kritisch für den Fall eines sperrigen High-NA-Objektivs).
- Bereiten Sie das Immobilisierungszubehör vor. Schneiden Sie kleine Rechtecke (20 mm x 20 mm) aus dem feinen Netz und dem groben Netz. Führen Sie zwei Abstandswände auf das feine Netz mit einem 45-50 m dicken Klebeband ein. Verwenden Sie doppelte Schichten des Abstandsraums, wenn die Größe der zu bebildenden Inselchen die herkömmlichen 100 m erheblich übersteigt.
- Tauchen Sie die Maschen und das Gewicht mit einer 35 mm Petrischale in die Bildlösung ein. Stellen Sie sicher, dass der Kunststoff und das Metall nass sind.
- Drehen Sie unter einem Seziermikroskop das feine Netz mit den Abstandswänden auf den Kopf, die Abstandshalter nach oben zeigen. Wählen Sie mehrere Inselchen, die mit dem abfangbaren Farbstoff beladen sind, oder drücken Sie den rekombinanten Sensor mit einer P20-Pipette aus und positionieren Sie sie vorsichtig auf dem feinen Netz zwischen den beiden Abstandshaltern. Stellen Sie sicher, dass das Netz und die Unterlegscheiben keine übermäßigen Mengen der Bildverarbeitungslösung enthalten.
- Nehmen Sie das Netz mit den Inseln mit der Zange des Uhrmachers auf und positionieren Sie es kopfüber in der Bildkammer, so dass die Abstandshalter nach unten zeigen und direkt auf dem Kammerdeckel sitzen. Stellen Sie sicher, dass die Inselchen zwischen den Abstandshaltern und dem Netz in der Mitte des Deckslips gefangen sind.
- Positionieren Sie das grobe Netz und das Gewicht auf dem feinen Netz innerhalb der Kammer. Führen Sie die Bildgebungslösung in die Kammer ein. Stellen Sie sicher, dass die Inselchen immobilisiert sind und bildbereit sind. Vermeiden Sie übermäßiges Schütteln der Kammer (kleine Störungen wie das Tragen der Kammer zum Mikroskop und einsetzen in eine beheizte Stufe sind akzeptabel).
HINWEIS: Eine ähnliche Immobilisierungsanordnung kann für ein aufrechtes System angewendet werden.
- Richten Sie das Mikroskop ein.
- Wählen Sie den Bildgebungsmodus und das Objektiv, positionieren Sie die Kammer mit den Inselchen aus Schritt 3.1 auf der temperaturgeregelten Stufe des Mikroskops.
- Stellen Sie die Temperaturregelung (idealerweise zwischen 30 °C und 36 °C) und die Perifusion ein. Positionieren Sie bei einem invertierten System den Zufluss niedriger als der Abfluss innerhalb der Kammer, und stellen Sie den Abflussstrom so fest wie der des Zuflusses (der typischerweise durch die Verwendung eines Schlauches mit einem breiteren Innendurchmesser auf einer peristaltischen Pumpe erreicht wird).
- Stellen Sie sicher, dass der Abfluss über eine minimale Kontaktfläche mit der Lösung verfügt, sodass die Lösung in mehreren sequenziellen kleinen Tröpfchen entfernt wird, wodurch lange Intervalle der kontinuierlichen Lösungsentfernung vermieden werden. Letzteres ist die Hauptquelle für Artefakte in der Zeitraffer-Bildgebung der periodischen Signale, da sie als regelmäßige periodische Intensitätsschwingungen jedes abgebildeten Pixels erscheinen und häufig als "langsame Wellen" interpretiert werden.
- Initiieren Sie die Perifusion mit der bildgebenden Lösung, die 3 mM Glukose enthält.
- Wählen Sie den Lichtpfad und Filter für die Abbildung der grünen Fluorophore; Die Anregung zwischen 470 und 500 und die Emissionen zwischen 505 und 550 würden für jeden von ihnen wirken.
- Führen Sie die Live-Bildgebung aus, um die Bildgebungsparameter einzurichten. Passen Sie die Ansicht an, um die interessierten Inselchen zu erfassen.
- Optimieren Sie das Signal-Rausch-Verhältnis des Bildes. Passen Sie zu diesem Zweck die Anregungslichtintensität, die Belichtungszeit und das Binning an. Stellen Sie sicher, dass die Einstellungen eine eindeutige Visualisierung jeder Zelle innerhalb der Islet bei minimaler Lichtintensität und Belichtung ermöglichen.
- Führen Sie die Bildaufnahme durch. Je nach Aufgabe können Bilder mit 0,1 bis 5 Hz aufgenommen werden. Dies liegt deutlich unter den Nyquist-Kriterien für die schnellen Na + --gesteuerten Schwingungen in den Zellen von Na+und 300 Hz), was bedeutet, dass die Daten standardmäßig untersampelt werden. Eine Erhöhung der Erfassungshäufigkeit, um dieser Nachfrage gerecht zu werden, ist jedoch in der multizellulären/Multi-Islet-Bildgebung mit einem großen Sichtfeld nicht möglich. GCaMP kann schneller abgebildet werden, während Fluo4 unter schnellen Erfassungsbedingungen unvermeidlich Bleichen wird.
HINWEIS: Da [Ca2+]Zytoszillationen in den Ischenzellen durch elektrische Aktivität angetrieben werden, kann die Verwendung niedriger Erfassungsraten kontraproduktiv klingen. In Wirklichkeit können jedoch die Erfassungsraten bei etwa oder über 1 Hz ausreichen, um das S-Zell-Spiking-Verhalten13zu lösen, während der Schwellenwert für den Nachweis von Natriumkanal-gesteuerten Schwingungen in den Zellen von 1 und 300 Hz deutlich über 300 Hz liegt. Unabhängig davon, ob dieCyt-Oszillationen von 1 Hz oder 0,1 Hz erfasst werden, werden sie stark untersampelt und reflektieren die Ca2+-Handhabung durch die Zelle und nicht die elektrische Aktivität.- Überprüfen Sie die Qualität der erfassten Daten: Bei 3 mM Glukose sollte die Aktivität der Zelle deutlich sichtbar/nachweisbar sein. Stellen Sie sicher, dass dies der Fall ist, und fahren Sie mit der umfassenden Zeitraffer-Bildgebung fort.
- Wählen Sie den Bildgebungsmodus und das Objektiv, positionieren Sie die Kammer mit den Inselchen aus Schritt 3.1 auf der temperaturgeregelten Stufe des Mikroskops.
- Zeitraffer-Bildgebung
- Nutzen Sie ein Online-Diagramm der Signaldynamik, das in der Erfassungssoftware implementiert ist, sofern diese verfügbar ist. Wenn Online-Diagramme keine Option sind, wenden Sie eine Nachschlagenstabelle an, in der die Signalintensität auf die umfassendste Weise angezeigt wird (z. B. "Regenbogen").
- Wenden Sie die Reize reversibel an: Notieren Sie die Wiederherstellung des Signals auf die Basalebene. Ignorieren Sie die Artefakte ganz am Anfang und am Ende der Aufnahme; Letzteres kann wie eine irreversible "Erhöhung"/"Abnahme" der Sondenfluoreszenz aufgrund von Veränderungen des pH-Werts oder des Zelltodes aussehen.
- Differenzieren Sie die Zellen nach oszillatoriger Ca2+-Dynamik bei geringer Glukose. Adrenalin oder Glutamat in die Badlösung einführen, reversibel für 2-5 min. Ein schneller Sprung in [Ca2+]cyt gefolgt von einer Verlangsamung oder Absagen der Schwingungen wird folgen.
ANMERKUNG: Adrenalin ist eine anerkannte Markerverbindung für die Zellen von '-Zellen, die eine selektive positive Wirkung auf diese Subpopulation von Ischenzellen hat, vermittelt durch die Freisetzung von Ca2+ aus intrazellulären Depots18. Glutamat wurde als ein weiterer zellspezifischer Agonist23hervorgebracht. - Fügen/entfernen Sie Ghrelin, das vor kurzem berichtet wurde, um die Zelle selektiv zu aktivieren19,20. Beobachten Sie einen schnellen reversiblen Anstieg von [Ca2+]Cyt in einer kleinen Teilpopulation von Ischenzellen.
- Fügen Sie 20 mM Glukose hinzu/entfernen Sie sie. Beobachten Sie eine koordinierte Oszillationsreaktion in der Subpopulation der Zelle. Beachten Sie die Reaktion von Zellen, die zuvor durch Adrenalin oder Glutamat und Ghrelin aktiviert wurden.
- Speichern Sie die Bildsequenz. Erwägen Sie die Verwendung von "AutoSave" während der Aufnahme.
4. Analysieren der Daten
- Analysieren Sie das Zeitrafferbild.
- Importieren Sie das Zeitrafferbild in eine Bildanalysesoftware, z. B. ein Open-Source-ImageJ/FIJI.
- Wenn während der Aufzeichnung eine wesentliche/schnelle Bewegung aufgetreten ist, verwerfen Sie die Daten als nicht reparierbar. Verwenden Sie StackReg oder TurboReg Plugins24, um kleinere Drifts zu korrigieren.
- Erstellen Sie ein Maskenbild für die Zellerkennung und die ROI-Zuordnung (Region of Interest). Der bevorzugte Weg, dies zu erreichen, wäre, ein Stapelbild mit einer der Funktionen wie "durchschnittliche Intensität" oder "maximale Intensität" zu erstellen. Die zu verwendende Funktion ist diejenige, die die beste Erkennung einzelner Zellen bietet.
- Schwellen Sie das Maskenbild, entfernen Sie alle Daten außerhalb des Islet-Bereichs. Die Funktion funktioniert im Automatikmodus für 32-Bit-Bilder.
- Erkennen Sie Maxima im Schwellenwertbild. Die Maxima kann durch Punkte, Regionen oder sogar Sektoren dargestellt werden, wenn das Bild dicht ist.
- Wenden Sie die Funktion "find maxima" ohne Größenbeschränkungen an und fügen Sie die erkannte Maxima in den ROI-Editor (Region of Interest) ein.
- Glätten/interpolieren Sie jede der zugeordneten ROIs; möglicherweise müssen die ROIs erweitert werden. Ein einfaches Skript kann für (4.1.6-4.1.8) geschrieben und mehrmals ausgeführt werden, um die besten Ergebnisse bei der Zellerkennung zu erzielen. Mehrere ROIs können sich überlappen, aber dies ist selten.
- Analysieren Sie die Position der ROIs und fügen Sie die entsprechenden X- und Y-Daten in die elektronische Tabellensoftware (z.B. Microsoft Excel) ein.
- Analysieren Sie die Grauintensität im Vergleich zur Zeit für alle ROIs und fügen Sie die Daten in die elektronische Tischsoftware ein.
- Analysieren Sie die numerischen Daten.
- Importieren Sie die Daten in die Datenanalysesoftware. Abhängig von der Wahl der Software und der Dauer/Sampling/Größe des Experiments kann dies eine einfache Copy-Paste-Operation oder eine eigenständige Prozedur sein. Stellen Sie die Anordnung und Speicherung der numerischen Daten sicher.
- Importieren Sie die Zeitstempel oder die Zeitnotizen, sofern verfügbar.
- Normalisieren Sie die Rohfluoreszenzintensitätsdaten ("F") auf den Anfangswert der Fluoreszenz ("F0"). Dies muss nicht die Fluoreszenz im allerersten Punkt sein, sondern könnte der Durchschnitt mehrerer erster Punkte sein. Die Normalisierung sollte die Variabilität der Daten verringern und im Idealfall (keine Drift-Baseline) zu einem analyzierbaren Datensatz führen ("F/F0").
- Wenn die Zell-zu-Zelle-Variabilität des F/F 0-Datasets noch erheblich ist (lange Aufzeichnung, Bleichen), führen Sie die Baseline-Korrektur durch. Zu diesem Zweck definieren Sie einen "Kontrollbereich", d. h. den Zeitraum, in dem die Steuerlösung (für Mauspankreasinseln, 3 mM Glukose ohne Agonisten/Antagonisten) angewendet wurde.
- Wenn der Kontrollbereich ein klares nicht oszillatores Signal hat, gehen Sie davon aus, dass F/F0 nach jeder Anwendung der Steuerungslösung zum Anfangswert (F/F0=1) zurückkehrt. Korrigieren Sie die Zeitrafferdaten für jede Zelle, indem Sie die Daten in Segmente aufteilen, durch die Punkte getrennt, an denen die Steuerungslösung hinzugefügt wurde, und lineare Korrektur auf jedes Segment anwenden. Verwenden Sie keine polynomiade oder andere nichtlineare Korrektur, da dies zu Artefakten führt.
- Wenn der Regelbereich klare Schwingungen hat oder zusätzliche Faktoren (z. B. FAD-Autofluoreszenz) vorhanden sind, verwenden Sie einen Spike-Erkennungsalgorithmus17. Ein trivialer und schneller Runaround dafür ist eine maximasensitive Wellenwirbeltransformation (Abbildung 3A).
- Quantifizieren Sie die Daten. Obwohl Ca2+ ein hochdynamisches Signal ist, ist die Darstellung der Ca2+-Daten in Bezug auf absolute F/F0-Werte in der biomedizinischen Literatur weithin akzeptabel. Wenn die Ergebnisse mehrerer Experimente verglichen werden müssen, wählen Sie eine Metrik aus.
- Messen Sie die Häufigkeit von Ca2+-Spitzen (Abbildung 4A,D) und ihre Reaktion auf die Zugabe von (Ameis-)Agonisten. Teilen Sie zu diesem Zweck die Aufzeichnung in gleiche Zeitintervalle auf und berechnen Sie den Zeitverlauf der Teilfrequenz (Spiking-Frequenz in jedem der Intervalle), indem Sie Spitzen innerhalb des Intervalls zählen und sich auf die Intervalldauer normalisieren.
- Alternativ können Sie den Schwellenwert festlegen und den Plateauanteil (pf) für jedes der oben definierten Intervalle berechnen (Abbildung 4B,F). Der Anteil gibt den Prozentsatz der Zeit innerhalb des Intervalls an, das die Zelle im Status "aufgeregt" verbracht hat.
- Alternativ können Sie die Teilfläche unter der Kurve (pAUC) für jedes der oben definierten Intervalle berechnen (Abbildung 4C,G). Diese Metrik ist empfindlich auf Änderungen der Häufigkeit und Amplitude des Spiking.
HINWEIS: Eine Einschränkung für die Messung der Frequenz ist seine mangelnde Empfindlichkeit für die Spike-Dauer und schlechte Stabilität. Da die Daten im Vergleich zum elektrischen Spike stark untersampelt werden, ist die Anzahl der Spitzen pro Intervall recht gering und daher kann eine einzige zusätzliche Spitze das Ergebnis dramatisch beeinflussen. Der "Flaschenhals" der pAUC ist ihre Empfindlichkeit gegenüber Änderungen in der Basislinie. Obwohl sie weniger anfällig für Artefakte und empfindlicher gegenüber Veränderungen in [Ca2+]cyt als Frequency ist, ist pAUC dennoch nicht sehr informativ über die Art der Ca2+ Dynamik. Plateaufraktion ist eine Erweiterung des offenen Wahrscheinlichkeitskonzepts auf das Ganzzellsystem. Sie ist jedoch aufgrund ihrer Abhängigkeit vom Schwellenwert weniger robust als die pAUC.
Ergebnisse
Inselchen laden ziemlich gut mit den abfangbaren Farbstoffen (Abbildung 1A), es sei denn, die Lipidzusammensetzung der Membran wurde beeinflusst (z. B. durch chronische Exposition gegenüber Fettsäuren). Der menschliche Adenovirus Typ 5 (Ad5) Vektor zielt auch auf alle Isletzellen ab (Abbildung 1B). Probleme können auftreten, wenn mehr als ein rekombinanter Sensor in derselben Zelle ausgedrückt wird. Darüber hinaus sind Inselchen in der Regel sehr gut immobilisiert mit der oben beschriebenen Technologie, die außergewöhnliche Stabilität und Lösungszugang bietet.
Ca2+ Spiking in den Zellen von É-Zellen kann leicht bei niedrigen Glukosespiegeln nachgewiesen werden (Abbildung 2). Es besteht eine hohe Zell-für-Zell-Korrelation zwischen der Aktivität bei niedriger Glukose und der Reaktion auf Adrenalin und Glutamat. Ghrelin aktiviert einige adrenalinempfindliche Zellen (-Zellen?) bei niedriger Glukose, aber es hat keinen Einfluss auf Ca2+ Dynamik in den meisten Zellen, die durch niedrige Glukose aktiviert werden .- Zellen.
Bei der Analyse in Teilfrequenz (Abbildung 4A,C) zeigen adrenalin- oder ghrelinstimulierte Zellen unter den Alles-oder-Nichts-Bedingungen einen erheblichen Anstieg. Das heißt, eine Zelle mit geringer Basalaktivität, die durch Adrenalin oder Ghrelin aktiviert wird, weist eine dramatische Zunahme dieser Metrik auf. Die Gesamtveränderungen zwischen Basal-Spiking und dem Adrenalineffekt sind jedoch sehr subtil (Abbildung 4A,C). Im Gegensatz dazu ist die partielle AUC empfindlich gegenüber den Veränderungen, die durch Adrenalin in allen Zellen eingeführt werden, selbst wenn die Basalaktivität hoch ist (Abbildung 4B,D).

Abbildung 1: Beladen des abfangbaren Farbstoffs und Expression des rekombinanten Sensors in Inselchen. Typische Mausinseln, die mit dem abfangbaren Farbstoff Fluo-4 (A) oder dem rekombinanten Sensor GCaMP6 in der peripheren Zellschicht (B) oder in der tieferen Schicht (C) belastet sind. Polartracer Sulforhodamin B (SRB, weiß dargestellt) wurde verwendet, um einzelne Zellen innerhalb jeder Islet25zu skizzieren. (D) Repräsentative Kinetik von Ca2+ als Reaktion auf Glukose, die von einzelnen Zellen innerhalb der Islet mit Fluo4 aufgezeichnet wurde. Beachten Sie die Heterogenität innerhalb kleinerer Zellpopulationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Typische Ca2+-Antwort von Ischenzellen auf verschiedene Reize. Typische Dynamik von A-und B-Ca2+ als Reaktion auf Adrenalin, Glutamat, Ghrelin, Glukose. (C)-(D) Wärmekarten der Isletzellantwort zeigen adrenalinpositive (C) und ghrelin-positive (D) Subpopulationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
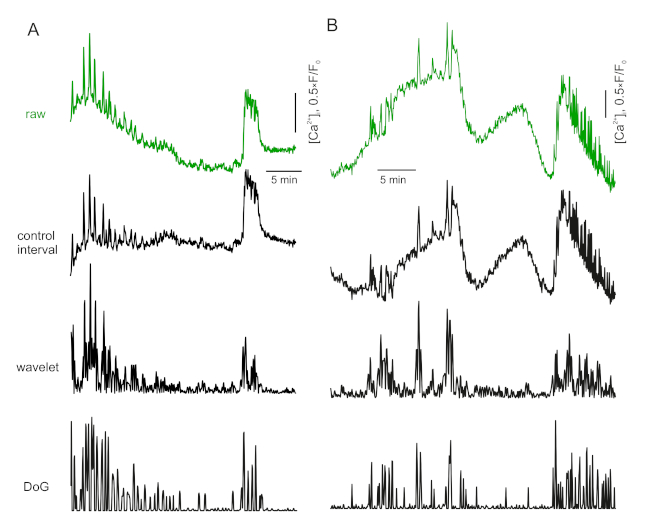
Abbildung 3: Baseline-Korrektur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
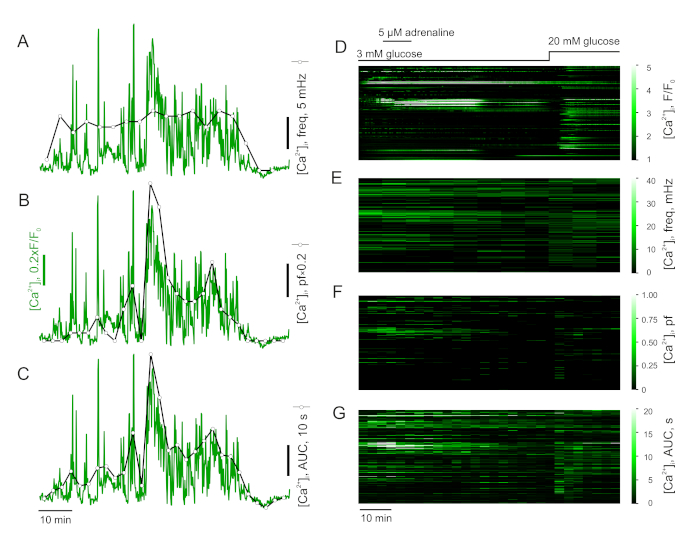
Abbildung 4: Analyse der Zeitrafferdaten. Analyse der Ca2+-Dynamik in den Zellen. Teilfrequenz (A), Plateaufraktion (B) und Fläche unter der Kurve (C) einer '-Zellen [Ca2+] i-Ablaufverfolgung. Populationsdaten [Ca2+]i Daten einer Maus-Pankreasinsel, ausgedrückt als roh (F/F0) (D), Teilfrequenz (E), Plateaufraktion (F) und Fläche unter der Kurve (G). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das Protokoll besteht aus drei Phasen, die für den Gesamterfolg entscheidend sind. Die erfolgreiche Injektion des Enzyms Liberase in den Gallengang bestimmt nicht nur den quantitativen Erfolg des Isolationsverfahrens, sondern beeinflusst auch die Qualität der isolierten Inselchen. Ungeblähte Pankreata kann dazu führen, dass einige wichtige metabolische Reaktionen in den isolierten Inseln fehlen. Zweitens definiert die Belastung des Farbstoffs/der Expression des Sensors das Signal-Rausch-Verhältnis der Zeitrafferaufzeichnung. Signale fehlen oder werden in überladenen Inselchen abgeschwächt. Schließlich ist eine erfolgreiche und dichte Positionierung des Gewebes in der Bildkammer ein entscheidender Moment für sinnvolle und analyzierbare Experimente. Schlecht positioniertes oder sich bewegendes Gewebe führt zu verschwendeter experimenteller Zeit und/oder unklaren Daten.
Die Methode kann geändert werden, um mehrere Signale (mit dem konfokalen System) und mehrere Gruppen von Inselchen (z. B. verschiedener Genotypen) zu berücksichtigen. Die Abbildung mehrerer Signale setzt die Lieferung eines zweiten Sensors in jede Zelle der Ischen voraus, spektral kompatibel mit dem Ca2+ Reporter (z. B. pH-Sensor SNARF5f26,27). Zu diesem Zweck können Inselchen mit Ca2+ und pH-Sensoren ko-infiziert/koinfiziert werden, die dann sequenziell innerhalb jedes Zeitrahmens abgebildet werden.
Die Abbildung des Signals in Inselgruppen mit einzelliger Auflösung erfordert die Verwendung eines weiten Sichtfeldziels. Das Ziel wird wahrscheinlich eine niedrigere Vergrößerung und numerische Blende (NA) haben, wodurch die räumliche Auflösung reduziert wird. Durch die erhöhte Schärfentiefe des Low-NA-Objektivs kann die Bildgebung auf einem Weitfeldsystem durchgeführt werden. Die Nachteile dieser Anordnung sind zellzellübergreifende Kontamination des Lichtsignals und verminderte Bildfähigkeit des 3D-Signals (z. B. Mäuse, die den Ca2+-Sensor unter den Insulinpromotoren exzieren). Gleichzeitig kann das Signal, das aus den Oberflächeninselzellen ausgedrückt wird, mit hoher zeitlicher Auflösung von Gruppen, einschließlich Dutzenden bis Hunderten von Inselchen18,perfekt aufgelöst werden.
Obwohl es unangenehm klingen mag, ist die Durchführung von Bildanalyse und numerischer Datenanalyse in separaten Softwarepaketen eine gute Idee. Derzeit dominiert ImageJ/FIJI die wissenschaftliche Bildanalyse. Die beliebtesten Umgebungen für die wissenschaftliche Codierung sind Python und Matlab, aber es gibt auch bekannte Bemühungen, die Ca2+ Daten in R28zu analysieren. Beste Benutzerfreundlichkeit wird durch mehr Nischenpakete wie IgorPro bereitgestellt. Wir haben die Wahl, einen Prototyp in Matlab/Python zu erstellen und dann den Code in IgorPro für die "Pipeline"-Verwendung zu implementieren. Die Anpassung von Signalanalysepaketen für die Elektrophysiologie (z.B. Clampfit, Neuroexplorer) für analytische Bedürfnisse kann für die einzellige Bildgebung nützlich sein, ist jedoch schwer zu skalieren. Viele Optionen, die von solchen Paketen zur Verfügung gestellt werden, sind wegen der geringen Abtastrate nicht für die Bildgebung von Isleten anwendbar.
Es ist wichtig, sich daran zu erinnern, dass diese Methode durch eine Reihe von Faktoren begrenzt wird. Erstens basiert die Bildgebung, wie oben erwähnt, weitgehend auf einer Unterstichprobe der Daten, was bedeutet, dass sie nicht auf die elektrische Aktivität der Zelle hinweist und daher nicht direkt mit der elektrischen Aktivität der Zelle verglichen werden kann. Zweitens stammen die Daten aus der Islet-Peripherie und spiegeln keine wichtigen Kopplungsprozesse wider, die im Allgemeinen dreidimensional sind. Drittens wirkt sich die Belastungs-/Ausdrucksebene auf die Wahrnehmung der Sensorintensität aus. Schließlich kann die Aktivierung weniger gut erforschter Isletzellsubpopulationen (z. B. PP-Zellen & -Zellen) durch die Markerverbindungen nicht ausgeschlossen werden, obwohl aufgrund der geringen Anzahl dieser Zellen innerhalb der Islet jede mögliche Kontamination minimal sein wird.
Die Methode ist ein echter "Champion" in Bezug auf die visuelle Wirkung, da die oszillierenden Prozesse einen starken Eindruck von einem wirklich lebenden Gewebe liefern. Die Methode, die auf kleinere Zellsubpopulationen angewendet wird, untersucht zuverlässig die Funktion jeder einzelnen, ermöglicht die Identifizierung von Untergruppen und spiegelt die Heterogenität wider.
Die Calciumdynamik wird seit über 40 Jahren in pankreatischen Ischen-Zellen untersucht, hauptsächlich getrieben durch den Fortschritt in der Erfassungs-/Detektionstechnologie. Frühe Studien verwendeten Atomabsorptionsspektroskopie29, aber erst mit der Ankunft der fluoreszierenden Ca2+ Sensoren30 konnte die detaillierte Kinetik in einzelnen Ischenzellen mit Hilfe der Photometrie31,32,33aufgelöst werden. Bald darauf wurde die räumliche Komponente der Ca2+ Kinetik verbessert, da Ca2+ Imaging34,35,36 dank der damals neu verfügbaren Lade-Gekoppelt-Gerätedetektoren (CCD) zur Routinetechnologie wurde. Das Problem des außerfokussierten Lichts, das die Bildgebung des Signals einzelner Zellen im Gewebe behinderte, wurde dann Mitte der 1990er Jahre durch Laserscanning Konfokalmikroskopie (LSCM)37 und totale interne Reflexionsfluoreszenzmikroskopie (TIRFM)38gelöst. Beide Methoden, ergänzt durch die Einführung einer neuen Generation von fluoreszierenden Ca2+ Sensoren, die mit einem 488 nm Laser erregbar sind, wurden erfolgreich eingesetzt, um Ca2+ Dynamik in den Isletzellsubpopulationen39,40,41abzubilden.
Das neue Jahrhundert brachte zwei neue Trends hervor, die auf neurowissenschaftlichen technologischen Entwicklungen beruhten. Erstens erhöhten rekombinante Fluoreszenzsensoren, die auf einer kreisförmigen Permutation von GFP-Varianten basieren, das Signal-Rausch-Verhältnis für die Ca2+-Erkennung erheblich, wodurch die Studien effektiv auf das Niveau großer Zellpopulationen gebracht wurden, in denen die Dynamik von [Ca2+]Zyt in jeder Zelle aufgelöst werden konnte. Zweitens ermöglichte die Verwendung von gewebespezifischen Promotoren die gezielte Sensorexpression auf kleinere Subpopulationen.
Obwohl allgemein gedacht, um die Entwicklungen in der Neurowissenschaft zu reflektieren, haben Studien über die Islet Ca2+ Dynamik zwei Hauptunterschiede. Erstens ist jede In-vivo-Bildgebung der Inselsignalisierung aufgrund der unvorhersehbaren Anatomie der Bauchspeicheldrüse und der Lage der Inselchen42komplexer als die Bildgebung im Gehirn. Zweitens, ausgezeichnete elektrische Kopplung zwischen den Inselzellen - Zellen im Wesentlichen macht Inselchen in elektrisch inerten Populationen, die eine scheinbar perfekte Alles-oder-Nichts-Antwort auf den hohen Glukosereiz. Wir glauben, dass Studien von [Ca2+]i Kinetik in kleineren Islet-Subpopulationen, wie z. B. zellen, die auf gewebespezifischem Targeting basieren, wahrscheinlich unser Wissen über ihre Pharmakologie/Physiologie erweitern. Gleichzeitig ermöglichen hochempfindliche Sonden die Erweiterung der statistischen Leistungsfähigkeit solcher Messungen, die Bilanzierung auf Insel-zu-Insel-Variabilität und die Abbildung von Inselchen aus verschiedenen Gruppen innerhalb eines parallelen Experiments.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
AH erhielt eine Diabetes UK PhD Studentship, EV wurde vom OXION-Wellcome Trust Training Programme unterstützt, AIT hielt ein Postdoktorandenstipendium des Oxford Biomedical Research Council.
Materialien
| Name | Company | Catalog Number | Comments |
| 40x/1.3 objective | |||
| Axiovert 200 microscope | |||
| emission | |||
| Excitation | |||
| Fetal bovine serum | Sigma-Aldrich | F7524-500ML | |
| Fluo4 | Thermo Fisher (Life Technologies) | F14201 | |
| GCaMP6f, in (human type 5) adenoviral vector | Vector Biolabs | 1910 | |
| Hanks' solution | Thermo Fisher (GibCo, Life Technologies) | ||
| Liberase | Sigma-Aldrich | 5401020001 | |
| penicillin/streptomycin | Thermo Fisher (GibCo, Life Technologies) | 15140122 | |
| RPMI medium | Thermo Fisher (GibCo, Life Technologies) | 61870044 | |
| Zeiss LSM510-META confocal system | Carl Zeiss |
Referenzen
- Elayat, A. A., el-Naggar, M. M., Tahir, M. An immunocytochemical and morphometric study of the rat pancreatic islets. Journal of Anatomy. 186, Pt 3 629(1995).
- Cabrera, O., et al. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Brereton, M. F., Vergari, E., Zhang, Q., Clark, A. Alpha-, delta-and PP-cells: are they the architectural cornerstones of islet structure and co-ordination. Journal of Histochemistry & Cytochemistry. 63 (8), 575-591 (2015).
- Færch, K., et al. Insulin resistance is accompanied by increased fasting glucagon and delayed glucagon suppression in individuals with normal and impaired glucose regulation. Diabetes. 65 (11), 3473-3481 (2016).
- Dabrowski, M., Tarasov, A., Ashcroft, F. M. Mapping the architecture of the ATP-binding site of the KATP channel subunit Kir6 2. The Journal of Physiology. 557 (2), 347-354 (2004).
- Liu, Y. J., Vieira, E., Gylfe, E. A store-operated mechanism determines the activity of the electrically excitable glucagon-secreting pancreatic alpha-cell. Cell Calcium. 35 (4), 357-365 (2004).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca 2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137(2001).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2. Proceedings of the National Academy of Sciences. 98 (6), 3197-3202 (2001).
- Broussard, G. J., Liang, R., Tian, L. Monitoring activity in neural circuits with genetically encoded indicators. Frontiers in Molecular Neuroscience. 7, 97(2014).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Rodriguez, E. A., et al. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends in Biochemical Sciences. 42 (2), 111-129 (2017).
- Tarasov, A. I., Rutter, G. A. Methods in enzymology. 542, Elsevier. 289-311 (2014).
- Tarasov, A. I., et al. Frequency-dependent mitochondrial Ca(2+) accumulation regulates ATP synthesis in pancreatic β cells. Pflugers Archiv: European Journal of Physiology. 465 (4), 543-554 (2013).
- Smith, N. A., et al. Fluorescent Ca2+ indicators directly inhibit the Na, K-ATPase and disrupt cellular functions. Science Signal. 11 (515), 2039(2018).
- Zhao, Y., et al. An expanded palette of genetically encoded Ca2+ indicators. Science. 333 (6051), 1888-1891 (2011).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. Elife. 5, 12727(2016).
- Theis, L., et al. Benchmarking Spike Rate Inference in Population Calcium Imaging. Neuron. 90 (3), 471-482 (2016).
- Hamilton, A., et al. Adrenaline Stimulates Glucagon Secretion by Tpc2-Dependent Ca(2+) Mobilization From Acidic Stores in Pancreatic alpha-Cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Mourao, M., Satin, L., Schnell, S. Optimal experimental design to estimate statistically significant periods of oscillations in time course data. PloS One. 9 (4), 93826(2014).
- Zmuda, E. J., Powell, C. A., Hai, T. A method for murine islet isolation and subcapsular kidney transplantation. Journal of Visualized Experiments. (50), (2011).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Thevenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Tarasov, A. I., et al. Monitoring real-time hormone release kinetics via high-content 3-D imaging of compensatory endocytosis. Lab on a Chip. 18 (18), 2838-2848 (2018).
- Knudsen, J. G., et al. Dysregulation of Glucagon Secretion by Hyperglycemia-Induced Sodium-Dependent Reduction of ATP Production. Cell Metabolism. , (2018).
- Adam, J., et al. Fumarate hydratase deletion in pancreatic β cells leads to progressive diabetes. Cell Reports. 20 (13), 3135-3148 (2017).
- Wills, Q. F., et al. Statistical approaches and software for clustering islet cell functional heterogeneity. Islets. 8 (2), 48-56 (2016).
- Berggren, P. O., Ostenson, C. G., Petersson, B., Hellman, B. Evidence for divergent glucose effects on calcium metabolism in pancreatic beta- and alpha 2-cells. Endocrinology. 105 (6), 1463-1468 (1979).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. The Journal of Biological Chemistry. 260 (6), 3440-3450 (1985).
- Longo, E. A., et al. Oscillations in cytosolic free Ca2+, oxygen consumption, and insulin secretion in glucose-stimulated rat pancreatic islets. The Journal of Biological Chemistry. 266 (14), 9314-9319 (1991).
- Johansson, H., Gylfe, E., Hellman, B. Cyclic AMP raises cytoplasmic calcium in pancreatic alpha 2-cells by mobilizing calcium incorporated in response to glucose. Cell Calcium. 10 (4), 205-211 (1989).
- Grapengiesser, E., Gylfe, E., Hellman, B. Three types of cytoplasmic Ca2+ oscillations in stimulated pancreatic β-cells. Archives of Biochemistry and Biophysics. 268 (1), 404-407 (1989).
- Okamoto, Y., et al. Role of cytosolic Ca2+ in impaired sensitivity to glucose of rat pancreatic islets exposed to high glucose in vitro. Diabetes. 41 (12), 1555-1561 (1992).
- Gilon, P., Henquin, J. C. Influence of membrane potential changes on cytoplasmic Ca2+ concentration in an electrically excitable cell, the insulin-secreting pancreatic B-cell. The Journal of Biological Chemistry. 267 (29), 20713-20720 (1992).
- Valdeolmillos, M., Nadal, A., Soria, B., Garcia-Sancho, J. Fluorescence digital image analysis of glucose-induced [Ca2+]i oscillations in mouse pancreatic islets of Langerhans. Diabetes. 42 (8), 1210-1214 (1993).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Stout, A. L., Axelrod, D. Evanescent field excitation of fluorescence by epi-illumination microscopy. Applied Optics. 28 (24), 5237-5242 (1989).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PloS One. 8 (1), 54638(2013).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in alpha- and beta-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- van Gurp, L., et al. Sequential intravital imaging reveals in vivo dynamics of pancreatic tissue transplanted under the kidney capsule in mice. Diabetologia. 59 (11), 2387-2392 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten