Method Article
שיטה אוטומטית לביצוע השימוש בשיטת ההדמיה באמצעות הדמיה רב ספקטקטרלית באמצעות זרימה
In This Article
Summary
הבחנה בשיטת החוץ הגופית היא שיטה מבוססת היטב להערכת הרעילות והרעלת הציטוזה, אך הבקיע את השימוש במיקרוסקופיה ידנית, הוא מפרך וסובל מהבדלים בין השונות לבין השערים. מאמר זה מתאר את הפרוטוקול שפותח כדי לבצע גרסה אוטומטית לחלוטין של השיטה באמצעות זרימת הדמיה רב ספקטנטרי.
Abstract
בעזרת מערכת החוץ הגופית (MN) משתמשים לעתים קרובות כדי להעריך את הרעלת הרעלים והרעילות, אבל הבקיע את הבדיקה באמצעות מיקרוסקופ ידני הוא מפרך ומציג חוסר ודאות בתוצאות עקב השתנות בין השמאים. כדי לתקן את זה, מיקרוסקופ אוטומטי סריקת שקופיות, כמו גם שיטות הזרם הקונבנציונאלי cy, הוכנסו בניסיון להסיר הטיה השערים ולשפר את התפוקה. עם זאת, שיטות אלה יש מגבלות הטבועה שלהם כגון חוסר יכולת להמחיש את הציטופלסמה של התא ואת חוסר אימות MN ויזואלי או אחסון נתונים התמונה עם הזרימה ציטופלסמה try. הדמיה מרובת ספקטרלית זרימה Cy, יש פוטנציאל להתגבר על מגבלות אלה. MIFC משלבת את הדימוי הפלורסנט ברזולוציה גבוהה של מיקרוסקופ עם החוסן הסטטיסטי ואת המהירות של הזרימה הקונבנציונלית cy, לנסות. בנוסף, כל הדימויים שנאספו ניתן לאחסן קבצים ספציפיים למינון. מאמר זה מתאר את הפרוטוקול שפותח כדי לבצע גירסה אוטומטית לחלוטין של שיטת MN ב-MIFC. התאים האנושיים lymphoblastoid TK6 הורחבו באמצעות פתרון יפוטוניק (75 mM kcl), קבוע עם 4% פורמאלין ואת התוכן הגרעיני היה מוכתם עם hoechst 33342. כל הדגימות התרחשו בהשעיה ב-MIFC, ומאפשר רכישת תמונות ברזולוציה גבוהה של כל האירועים הנדרשים לצורך שיטת הניהול (למשל, תאים בינקליום עם וללא MN, כמו גם תאים מונונוקלאובטים ופולינוקליבטים). תמונות זוהו באופן אוטומטי, מסווגים וממוספרים בתוכנת ניתוח נתונים MIFC, המאפשר הבקיע אוטומטי של שתי הרעילות ורעילות. תוצאות להפגין כי באמצעות mifc לבצע את הבחינה מחוץ לגופית mn מאפשר עליות משמעותיות סטטיסטית בתדר MN להיות מזוהה ברמות שונות של רעילות ציטומה לעומת שולטת ממס לאחר החשיפה של TK6 תאים כדי ל מיטומיצין C ו קולכיצין, ושאין עליות משמעותיות בתדר MN נצפו בעקבות החשיפה למאננייול.
Introduction
הבדיקה של מערכת החוץ הגופית (MN) היא בדיקה נפוצה להערכת רעילות ורעילות כמו כלי ההקרנה בתחומים שונים של מחקר כגון פיתוח כימי ותרופות, כמו גם בדיקת האדם בקרב אנשים חשופים שונים , גורמים סביבתיים, בעיסוק או בסגנון חיים1,2,3. MN מורכב משברי כרומוזום או כרומוזומים שלמים שנוצרו במהלך חלוקת התא שאינם משולבים באחת משתי הגרעינים המרכזיים של הבת. בעקבות המאמר, חומר כרומוזום זה מתאים לגוף יחיד, מעוגל בתוך הציטופלסמה הנפרדת מאחד הגרעינים העיקריים2. לכן, MN הם נציג של נזק לדנ א ושימשו במשך שנים רבות כנקודת קצה בבדיקת הגנומות4. השיטה המתאימה ביותר למדידת MN היא הציטוקינזה-בלוק של מיקרורוקלינוס (CBMN). באמצעות השימוש בשיטת CBMN, התדירות של MN בתאים בינקליבטים (BNCs) ניתן להבקיע על ידי שילוב ציטוצ'סין B (Cyt-B) לתוך המדגם. Cyt-B מאפשר חלוקה גרעינית, אך מונע החטיבה התאית ולכן, מגביל את התוצאה של MN כדי BNCs כי יש לחלק רק פעם5.
פרוטוקולים באמצעות מיקרוסקופ וזרימה cy, מיקרוסקופיה פותחו ואומתו ומשמשים באופן שגרתי כדי לבצע את השימוש בשיטת חוץ גופית6,7,8,9,10, .11,12,13,14 מיקרוסקופיה נהנית מיכולת לאשר באופן חזותי כי MN הם לגיטימיים אבל הוא זמן רב ונוטה להשתנות בין קולעים15. כדי לענות על כך, שיטות מיקרוסקופית אוטומטיות פותחו כדי לסרוק שקופיות וללכוד תמונות של גרעינים, ו16,17,18,19, אבל ציטופלסמה לא יכול להיות דמיינו, מה שהופך אותו קשה לקבוע אם MN משויך למעשה לתא מסוים. יתר על כן, שיטות אלה יש קשיים בזיהוי תאים פולינוקלינטי (כולל תאים tri ו quadranucleated) אשר נדרשים לחישוב של רעילות ציטוזה בעת שימוש Cyt-B9. הזרימה cy, שיטות שפותחו כדי לבצע את מימוש האתר מעסיק את הקרינה הפלואורסצנטית, כמו גם קדימה ולצד בעוצמות פיזור כדי לזהות אוכלוסיות של גרעיני שני ו-MN כי שוחררו מתא אחרי הליזה20,21 ,22. זה מאפשר לרכוש נתונים מכמה אלפי תאים בתוך כמה דקות ומאפשר ניתוח אוטומטי23; עם זאת, חוסר יכולת להמחיש את התאים לא מאפשר לאשר כי האירועים הבקיע הם אמיתיים. בנוסף, לישיר את קרום התא מעכב את השימוש Cyt-B, כמו גם יצירת השעיה המכיל פסולת אחרים כגון אגרגטים כרומוזום או האפוטוטיים גופים ואין דרך להבדיל אלה מ-MN24.
לאור המגבלות האלה, הדמיה רב ספקטקטרלית זרימה Cy, מערכת אידיאלית כדי לבצע את שיטת MN מאחר שהיא משלבת את הדימוי הפלורסנט ברזולוציה גבוהה של מיקרוסקופ עם החוסן הסטטיסטי ואת המהירות של הזרימה המקובלת cy, לנסות. ב-mifc, כל התאים מוצגים לתוך מערכת פלואידיקה ולאחר מכן הם התמקדו באופן דינמי במרכז של תא זרימה קובט. התאורה האורתוגונלית של כל התאים מושגת באמצעות השימוש בשדה ברייטקל (BF) דיודות פולטות אור (LED), לייזר לפיזור בצד (לפחות) אחד לייזר פלורסנט. פוטונים פלורסנט נלכדים על ידי אחד מתוך שלושה (20x, 40x או 60x) מספריים באיכות גבוהה עדשות היעד ולאחר מכן לעבור דרך אלמנט הפירוק ספקטרלי. פוטונים הם לאחר מכן מתמקדים המכשיר חיוב מצמידים (CCD) מצלמה כדי לקבל תמונות ברזולוציה גבוהה של כל התאים העוברים דרך תא הזרימה. כדי למנוע טשטוש או מעקב, ה-CCD פועלת במצב שילוב של עיכוב בזמן (TDI) העוקב אחר אובייקטים על ידי העברת תוכן פיקסל מהשורה לשורה למטה CCD ב סנכרון עם מהירות התא בזרימה. מידע פיקסלים נאסף לאחר מכן משורת הפיקסלים האחרונה. הדמיה TDI בשילוב עם ריקבון ספקטרלי מאפשר עד 12 תמונות (2 BF, 10 פלורסנט) להילכד בו זמנית מכל התאים העוברים דרך תא הזרימה. כל הדימויים שנלכדו מאוחסנים בקבצי נתונים ספציפיים לדוגמה, המתיר ניתוח שיבוצע בכל עת באמצעות תוכנת ניתוח נתונים MIFC. לבסוף, קבצי נתונים שומרים על הקשר בין תמונות סלולריות ונקודות על כל החלקות של bivariate. משמעות הדבר היא כי כל נקודה על העלילה bivariate מסורתית יכול להיות מודגש ו-BF המקביל שלה ואת התמונות הפלורסנט יוצגו25.
לאחרונה, mifc מבוססי שיטות פותחו כדי לבצע את הטיפול MN עבור שני קרינה מיון biodosimetry26,27,28,29,30,31 , ו גנטית טוקסיקולוגיה32,33 בדיקות. עבודה זו הוכיחה כי תמונות הסלולר של גרעינים הראשי, MN ואת הציטופלסמה יכול להיות התמונה עם תפוקה גבוהה יותר מאשר שיטות אחרות26. כל סוגי התאים הדרושים לניתוח, כולל תאי מונו, BNCs (עם או בלי MN), ותאי פולי, יכולים להיות מזוהים באופן אוטומטי בתוכנת ניתוח הנתונים MIFC, ויישום הקריטריונים של הניקוד שפותחו על ידי Fenech et al. מושגת באמצעות השימוש באלגוריתמים מתמטיים שונים6,34. תוצאות מ biodosimetry הראו כי מינון התגובה עקומות כיול היו דומים בסדר גודל לאלה שהתקבלו משיטות אוטומטיות אחרות בספרות כאשר לכמת את שיעור של MN לכל BNC29. בנוסף, העבודה האחרונה בטוקסיקולוגיה הוכיחה כי תמונות של תאים מונו, BNCs (עם או בלי MN) ו-פולי תאים ניתן ללכוד באופן אוטומטי, מזוהה, מסווג וממוספרים באמצעות MIFC. הפרוטוקול וניתוח הנתונים איפשר את החישוב של רעילות ציטורעלים ו-גנוזה לאחר חשיפת תאים TK6 למספר clastogens ו aneugens32.
הפרוטוקול המוצג במאמר זה מתאר שיטה לביצוע השימוש בשיטת החוץ-גופית באמצעות MIFC. טכניקת העיבוד לדוגמה המשמשת בעבודה זו דורשת פחות מ-2 שעות כדי לעבד מדגם אחד והיא קלה יחסית לביצוע בהשוואה לשיטות אחרות. ניתוח הנתונים בתוכנת הניתוח MIFC הוא מורכב, אך היצירה של תבנית הניתוח יכולה להתבצע בתוך מספר שעות בעקבות השלבים המתוארים בנייר זה. יתר על כן, לאחר יצירת התבנית, ניתן להחילו באופן אוטומטי על כל הנתונים שנאספו ללא כל עבודה נוספת. הפרוטוקול מתאר את כל הצעדים הדרושים כדי לחשוף את TK6 תאים ל clastogens ו-aneugens, מתאר כיצד להתרבות, לעבד ולהכתים את התאים, ומדגים כיצד לרכוש דימויים ברזולוציה גבוהה באמצעות MIFC. יתר על כן, נייר זה ממחיש את שיטות העבודה הטובות ביותר לניתוח נתונים בתוכנה MIFC כדי לזהות באופן אוטומטי וציון תאים מונו, BNCs, ו פולי תאים למטרות חישוב שני ציטורעילות ו-גנוזיס.
Protocol
1. הכנת התרבות הבינונית והTK6 של תאים
הערה: חלק מהכימיקלים המשמשים בפרוטוקול זה רעילים. שאיפת, בליעה או פנייה לעור עם ציטוצ'סין B יכול להיות קטלני. לבשו ציוד הגנה אישי מתאים כולל חלוק מעבדה ושני זוגות של כפפות ניטריל. רוחצים את הידיים ביסודיות לאחר הטיפול. Formalin/פורמלדהיד הוא רעיל אם שאפה או בלע; מרגיזה את העיניים, מערכת הנשימה והעור; ועלולים לגרום לרגישות באינהלציה או במגע העור. יש סיכון של נזק חמור לעיניים. זהו גורם מסרטן פוטנציאלי.
- הכינו 565 mL של מדיום התרבות 1x RPMI. הוסף 5 מ ל של חומצות אמינו לא חיוניות (100x), 5 מ ל של נתרן פירובט (100 מ"מ), 5 מ ל פניצילין-סטרפטומיצין-גלוטמין (100x), ו 50 mL של סרום העוברי (FBS) לבקבוקון 500 mL של 1x RPMI 1640 בינונית. הכן את המדיום בארון ביולוגי ואחסן ב2-8 ° c. מחממים את המדיום עד 37 ° צ' לפני הוספתו לתאי הTK6 (ראו טבלת חומרים).
- הפשרת 1 מ ל של TK6 תאים (מאוחסנים ב-80 ° c ב DMSO) ב 10 מ ל של בינוני. צנטריפוגה את התאים ב 200 x g עבור 8 דקות ומכה את הסופרנטאנט. העבר את התאים כדי 50 mL של מדיה ו-דגירה ב 37 ° c, 5% CO2. זמן ההכפלה של תאים TK6 משתנה מ-~ 12-18 h וכמה (3 או 4) מעברים יידרשו עבור התאים כדי להגיע לקצב ההפצה המקסימלי שלהם (ראה טבלת חומרים).
- תרבות 100 mL של תאים לריכוז של ~ 7-8 x 105 תאים/mL.
2. הכנת קלסטוגנים ו/או אניוגנים וציטוצ'אסין B
- הכינו את ריכוזי המניות המתאימים של הקלייגנים הרצויים והאניוגנים. לדוגמה, עבור מיטומיצין C, לפזר בקבוק מלא 2 מ ג ב 10 מ ל של מים סטרילי כדי להשיג ריכוז מלאי הסופי של 200 μg/mL. מיטומיצין C ניתן לאחסן ב -4 ° c במשך שלושה חודשים (ראה לוח חומרים).
- ביום הניסוי, להכין דילול של כימיקלים הרצוי כי הם או 10-קיפול או 100-מתקפל גבוה יותר מאשר ריכוזי החשיפה הרצויה אם דילול במים סטרילי או DMSO, בהתאמה.
- עבור מיטומיצין C, להכין 3 לדלל mL במים סטרילית של 0.5, 1.0, 2.0, 3.0, 4.0, ו-5.0 μg/mL. עבור קולכיצין, להכין 3 מדלל mL במים סטרילית של 0.05, 0.1, 0.2, 0.3, 0.4, ו-0.5 μg/mL. לבסוף, עבור Mannitol, להכין 3 מדלל mL במים סטרילית של 5, 10, 20, 30, 40, ו 50 mg/mL.
- הכן 200 μg/mL ריכוז מניות של ציטוצ'לסין B על ידי המסת בקבוק 5 מ ג ל 25 מ ל של DMSO. ציטוצ'סין B ניתן לאחסן ב-20 ° c במשך מספר חודשים.
3. חשיפת תאים לקלסטוגנים ו/או אניוגנים
- הוסף 1 מ ל של הכימיקל הרצוי (g. מיטומיצין C) עד 9 מ ל של תאים ב ~ 7-8x105 תאים/mL בבקבוקון T25. לדגימות הבקרה, הוסיפו 1 מ ל של מים סטריליים. מניחים את מבחנות ב 37 ° c, 5% בחממה2 עבור 3 שעות.
הערה: אם כימיקלים מדוללים ב DMSO, להוסיף רק 100 μL של הכימיקל לכל בקבוקון ולהוסיף 100 μL של DMSO כדי פקדים. כל בקבוקון צריך להכיל 9.900 מ ל של תאים. - לאחר 3 שעות, להסיר מבחנות מתוך החממה ולהעביר את התאים 15 מ"ל צינורות פוליפרופילן. צנטריפוגה ב 200 x g עבור 8 דקות, מתיף את supernatant ואת התאים להעביר T25 מבחנות חדש המכיל סך של 10 מ ל של מדיום התרבות הטרייה. הוסף 150 μL של ריכוז המניה (200 μg/mL) של ציטוחלסין B כדי להשיג ריכוז סופי של 3 μg/mL.
- החזר את מבחנות אל 37 ° צ', 5%2 חממה עבור זמן התאוששות שווה 1.5-2.0 זמני הכפל, כפי שמומלץ על ידי ה-OECD הנחיות9. עבור התאים הTK6 ששימשו בעבודה זו, זמן ההחלמה היה 24 שעות.
הערה: זמן ההכפלה של התאים הTK6 שבשימוש כאן היה 15 שעות וזמן החלמה של 24 שעות (1.6 פעמים ההכפלה) שימש. זמני התאוששות פחות מ 1.5 פעמים ההכפלה תפחית את התפשטות דגימות חשוף למינונים גבוהים יותר להשפיע על מספר BNCs. לעומת זאת, זמני התאוששות של יותר מ-2.0 יפיקו מספר בלתי פרופורציונלי של תאים פולינופולימרים בדגימות שליטה, הטיית חישובי הרעלים הציטובית.
4. הכנת מאגרים לקיבוע ותיוג של תוכן DNA (ראו לוח חומרים)
- הכינו 75 מ"מ של אשלגן כלוריד (KCl) על ידי הוספת 2.79 g ל 500 mL של מים באולטרטהורים. מערבבים את הפתרון עבור 5 דקות באמצעות מערבב מגנטי ומסנן סטרילי דרך מסנן יקרומטר 200. הפתרון 75 מ"מ KCl יכול להיות מאוחסן ב -4 ° c במשך מספר חודשים.
- הכינו כמות מספקת של 4% פורמלין עבור הניסוי, מצפה כי סך של 2.1 mL יש להוסיף לכל מדגם. לדוגמה, כדי להכין 10 מ ל של 4% פורמלין, להוסיף 4 מ ל של 10% פורמלין מלאי 6 מ ל של מלוחים באגירה של 1x של המלח של דולבאגור במאגר ללא Ca2 + או Mg2 + (PBS). ניתן לאחסן את המלון בטמפרטורת החדר במשך מספר שבועות.
- להכין 510 mL של מאגר לשטוף (2% FBS ב 1X PBS) על ידי הוספת 10 מ ל FBS ל 500 mL בקבוק של 1X PBS.
- הכן 10 מ ל של 100 μg/mL ריכוז של Hoechst 33342 על ידי הוספת 100 μL של ריכוז המניה (1 מ"ג/mL) כדי 9,900 μL של 1X PBS. ניתן לאחסן את התמיסה ה33342 ב -4 ° c במשך מספר חודשים.
5. עיבוד לדוגמה: נפיחות בהיפוטוניק, קיבוע, ספירת תאים ותיוג תוכן DNA
- בסוף תקופת ההחלמה, להסיר את כל מבחנות מן החממה ולהעביר את כל הדגימות כדי 15 מ"ל צינורות פוליפרופילן. צנטריפוגה את כל הדגימות ב 200 x g עבור 8 דקות.
- לאחר מכן, השהה מחדש את התאים והוסף 5 מ מ של 75 mM KCl. מערבבים בעדינות על ידי היפוך שלוש פעמים ו דגירה ב 4 ° c עבור 7 דקות.
- הוסף 2 מ"ל של 4% פורמלין לכל מדגם, לערבב בעדינות על ידי היפוך שלוש פעמים ו דגירה ב 4 ° c עבור 10 דקות. שלב זה פועל כ"קיבעון רך".
- צנטריפוגה את כל הדגימות ב 200 x g עבור 8 דקות. ולאחר מכן להשהות את הסופרנטאנט בתוך 100 μl של 4% פורמלין עבור 20 דקות. שלב זה פועל כ"קיבעון קשה".
- הוסף 5 מ ל של מאגר לשטוף צנטריפוגה ב 200 x g עבור 8 דקות. מרוב הסופר ומחדש ב 100 μl של מאגר לשטוף.
- העבר את כל הדגימות כדי 1.5 mL מיקרוצנטריפוגה צינורות.
- בצע ספירת תאים בכל דוגמה כדי לקבוע את מספר התאים לכל מדגם. דגימות יהיה מרוכז מאוד כך 1:100 דילול 1x PBS (10 μL של מדגם ב 990 μL של PBS) סביר להניח שיידרש כדי לקבל ספירה מדויקת.
הערה: בשלב זה, מומלץ לבצע ספירת תאים באמצעות היפוך. הוספת KCl מעניקה לציטופלסמה מראה שקוף, מה שמקשה על מוני תאים אוטומטיים לזהות אותם. כמו כן, המונים האוטומטיים מתקשים להבקיע תאים פוליפונים בשל גודלם. - אם לא להפעיל את הדגימות על MIFC מיידית, הם יכולים להיות מאוחסנים ב 4 ° c במשך כמה ימים. כאשר מוכן להפעיל דגימות, להוסיף 5 μL של 100 μg/mL לכל 1x106 תאים/ml לכל מדגם. גם להוסיף 10 μL של 500 μg/mL של RNase לכל 100 μL של מדגם עבור ריכוז סופי של 50 μg/mL. מודטה את הדגימות ב 37 ° c, 5% CO2 עבור 30 דקות.
- מיקרו צנטריפוגה את כל הדגימות ב 200 x g עבור 8 דקות ולהשתמש בפיפטה כדי להסיר את ה-סופרנטאנט עוזב ~ 30 μl. השתמש בפיפטה כדי להשעות מחדש את כל הדגימות לפני ההפעלה על MIFC להבטיח כי אין בועות בצינור. אל תעשה מערבולת.
6. מתחיל ומכייל את MIFC
- ודא את הנדן, כיול המערכת מגיב, באגים, מכולות ניקוי ועיקור מלאים ומיכל הפסולת ריק. מתח את המערכת ולחץ פעמיים על סמל התוכנה MIFC. לחץ על לחצן הפעלה וודא שתיבת הסימון הפעל את כל הכיול והבדיקות מסומנת. זה יהיה לשטוף את המערכת, לטעון נדן וכיול מערכת ריאגנטים, ולכייל את המערכת (ראה טבלת חומרים).
7. הרצת דגימות על מועדון הכדורגל של MIFC
הערה: סעיף זה מניח את השימוש ב-MIFC 2 מצלמה. אם משתמשים במצלמה 1 MIFC, אנא ראה מוסף 1-פרוטוקול מלא, סעיף 7 ליצירת מגרשים במהלך הרכישה
- הפעל את תוכנת רכישת הנתונים MIFC (ראה טבלת חומרים). איור 1 מציג את הגדרות המכשיר. הפעל את הלייזר 405 ננומטר והגדר את כוח הלייזר ל-10 mW (A). הפוך את כל לייזרים אחרים (כולל מתחת להאס. סי) והגדר את BF לערוצים 1 ו -9 (ב). ודא שמחוון ההגדלה מוגדר כ-60x (C), במצב של רגישות גבוהה נבחר (D), וכי רק ערוצים 1, 7 ו-9 מוצגים בגלריית התמונות.
- לחצו על הסמל ' התוויה מגרש '. בחר את כל האוכלוסיה ובחר באזור M01 בציר ה-X וביחס גובה-רוחב M01 בציר ה-Y. לחץ על סמל אזור מרובע וצייר אזור מסביב לתאים היחידים. ציין את שם האזור ' תאים בודדים'. לחץ לחיצה ימנית על העלילה ולבחור אזורים. האר את אזור התאים היחידים ושנה את הקואורדינטות x ל-100 ו-900 ושנה את קואורדינטות ה-y ל-0.75 ו-1 (איור 1I).
- לחצו על הסמל ' התוויה מגרש '. בחר באפשרות ' תאים בודדים ' כאוכלוסיית האב, בחר ב- rms M01 בציר ה-X וM07 Rms על ציר ה-Y. לחצו על הסמל ' אזור מרובע ' וציירו אזור סביב רוב התאים. ציין את שם האזור ' תאים ממוקדים'. לחץ לחיצה ימנית על העלילה ולבחור אזורים. האר את אזור התאים המתמקדים ושנה את ה-x-קואורדינטות ל-55 ו-75 ושנה את קואורדינטות ה-y ל-9.5 ו-20 (איור 1J).
- לחצו על סמל ההיסטוגרמה. בחר את אוכלוסיית התאים המתמקדים ובחר בעוצמה M07 כתכונה. לחצו על סמל האזור הליניארי וציירו אזור לאורך הפסגה הראשית בהיסטוגרמה. . שם האזור הזה DNA-חיובי לחץ לחיצה ימנית על העלילה ולבחור אזורים. האר את אזור ה-DNA-חיוביים ושנה את הקואורדינטות ל-2 x 105 ו-2 x 106. ייתכן שיש לכוונן את הטווח בהתאם לעוצמת השיא בהיסטוגרמה (איור 1K).
- הגדר את פרמטרי הרכישה (איור 1E). ציין את שם הקובץ ואת תיקיית היעד, שנה את מספר האירועים ל-20,000 ובחר את האוכלוסיה החיובית של ה-DNA .
- לחץ על ' טען ' (איור 1F) והציבו את דגימת הבקרה ב-mifc. לחץ על לחצן הרכישה כדי לאסוף את הנתונים (איור 1G). לאחר השלמת הרכישה, לחץ על לחצן החזרה כדי להחזיר את המדגם (איור 1H). הסר את השפופרת לדוגמה מכלי הנגינה. חזור על תהליך זה עבור כל הדגימות הנותרות בניסוי.
8. פתיחת קובץ נתונים ברעיונות
- הפעל את חבילת תוכנת ניתוח MIFC (עיין ברשימת החומרים). לחץ על התחל ניתוח כדי להפעיל את ' אשף הקבצים הפתוחים'. בחר קובץ נתונים על-ידי דפדוף בקובץ התמונה הגולמי הרצוי (. רי). לחץ על לחצן פתח ולחץ על הבא.
- מאחר שזהו שיטת צבע בודדת, אין צורך בפיצוי, ולכן לחץ על הבא כדי לעקוף את שלב הפיצוי. בשלב זה לא קיימת תבנית ניתוח להחלה, לכן לחץ שוב על הבא . אם תבנית הניתוח הורדה מהחומר המשלים, בחר אותה כעת. תבניות אלה לעבוד רק עם 2 מצלמה MIFC עם BF להגדיר לערוצים 1 ו -9 ואת הדימויים הגרעיניים בערוץ 7 במהלך הרכישה.
- כברירת מחדל, שמות הקבצים. cif ו-. דאף נוצרים באופן אוטומטי כדי להתאים ל-... לא מומלץ לשנות את שמותיהם של. cif ו-. דאף. לחץ על הבא. הגדר את מאפייני תצוגת התמונה על-ידי בחירה ב- 01 ו- 07. לחץ על הבא. לא קיים אשף עבור יישום זה, לכן לחץ על סיום. חשוב מאוד לשמור את קובץ ניתוח הנתונים (. דאף) ואת תבנית הניתוח (. ast) לעתים קרובות במהלך סעיפים 9 – 14 כדי למנוע אובדן התקדמות.
9. יצירת מסיכות ותכונות לזיהוי BNCs
- לחץ על הסמל ' מאפייני גלריית תמונות ' (סמל כחול/לבן). בכרטיסיה מאפייני תצוגה , לחץ על קבע טווח לנתוני פיקסלים ולאחר מכן שנה את הצבע לצהוב. לחץ על אישור. כעת קל יותר לצפות בתמונות הופסט כנגד הרקע השחור.
- צור את ההתוויה של תאים שאינם אפוטוטיים.
- לחץ על הכרטיסייה ניתוח ולאחר מכן לחץ על מסיכות. לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה בחר סף, תחת מסיכה בחר M07 והגדר את אחוז העוצמה ל-50. לחץ על אישור אז בסדר שוב. לחץ על סגור.
- לחץ על הכרטיסיה ניתוח , לחץ על תכונותולאחר מכן לחץ על חדש. עבור אזורבחירת סוג תכונה . עבור מסכה בחר את הסף (M07, Ch07, 50). לחץ על קבע שם ברירת מחדל ולחץ על אישור. לחץ על ' סגור ' כדי להתחיל לחשב את ערכי התכונות.
- לחץ על הסמל נקודה מגרש . בחר את כל האוכלוסיה. עבור התכונה ציר X בחר את התכונה Contrast_M01_Ch01 ועבור התכונה ציר Y בחר באפשרות Area_Threshold (M07, Ch07, 50). לחץ על אישור.
- לחץ על לחצן אזור מרובע וצייר אזור מסביב לרוב התאים. התקשרו לאזור זה ללא האפוטוטית. לחץ לחיצה ימנית על העלילה ולחץ על אזורים. סמן את האזור שאינו האפוטוטית . הגדר את קואורדינטות ה-x ל -0 ו-15 והגדר את קואורדינטות y ל- 50 ו-300. לחץ על סגור.
- צור את מסיכת BNC (שלבים 9.3.1-9.3.5) כדי לזהות תאים המכילים שני גרעינים בלבד.
- אתר BNC בגלריית התמונות ולחץ עליו. זה כדי להמחיש את יצירת המסכה בערוץ הואכסט.
- לחץ על הכרטיסייה ניתוח ולאחר מכן לחץ על מסיכות. לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה בחר levelset, תחת מסכה בחר M07, בחר את לחצן האפשרויות ' מסיכת רמה אמצעית ' והגדר את קנה המידה של מתאר הפירוט ל-3.00. לחץ על אישור אז בסדר שוב.
- לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה, בחר באפשרות ' ההתרחב ' ותחת מסיכה בחר Levelset (M07, Ch07, אמצע, 3). הגדר את התמונה כך שתוצג ל- Ch07והגדר את מספר הפיקסלים ל-2. לחץ על אישור אז בסדר שוב.
- לחץ על חדש לאחר מכן לחץ על פונקציה. תחת הפונקציה בחר בפרשת השניים, ותחת מסכה בחר בהתרחב (M07, Ch07, באמצע, 3) 2). הגדר את התמונה כך שתוצג ל- Ch07והגדר את עובי הקו ל-1. לחץ על אישור אז בסדר שוב.
- לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה בחר טווח, תחת מסכה בחר פרשת השניים (להתרחב (M07, Ch07, באמצע, 3) 2)). הגדר את התמונה כך שתוצג ל- Ch07. הגדר את ערכי האזור המינימלי והמקסימלי ל-115 ו-5000, בהתאמה. הגדר את ערכי יחס הגובה-רוחב המינימלי והמקסימלי ל-0.4 ו-1, בהתאמה. לחץ על אישור. בשדה השם שנה את הטקסט לקריאה BNC לאחר מכן לחץ על אישור.
- צור את התכונות והמגרשים כדי להשיג את אוכלוסיית BNC הסופית
- התכונה ספירת ספוט BNC: לחץ על הכרטיסיה ניתוח , ולאחר מכן תכונות, לאחר מכן חדש. עבור סוג התכונה בחר ספירת ספוט. למסיכה, בחרו במסיכת הBNC הסופית שנוצרה ב9.3.5. הגדר את החיבור לארבע ושנה את השם לספוט ספירה BNC. לחץ על אישור לאחר מכן התקרב לחישוב ערכי התכונות.
- היסטוגרמה של ספירת ספוט BNC. לחץ על סמל ההיסטוגרמה. בחר באפשרות ' לא האפוטוטית ' כאוכלוסיית האב. עבור התכונה ' ציר X ' בחר בתכונה ' ספירת ספוט BNC '. לחץ על אישור. לחצו על הסמל ' אזור ליניארי '. צייר אזור על פני bin 2. . קרא לאזור 2N
הערה: עיין בסעיף 9 בתוספת 1-פרוטוקול מלא כדי ליצור את המסכות, התכונות והמגרשים הנותרים כדי לזהות את אוכלוסיית BNC הסופית
10. יצירת מסיכות ותכונות לזיהוי MN בתוך אוכלוסיית BNC
- צור את מסיכת MN. אתר BNC המכיל MN בגלריית התמונות ולחץ עליו. זה כדי להמחיש את היצירה של מסכת MN בערוץ הואכסט. לחץ על הכרטיסייה ניתוח ולאחר מכן לחץ על מסיכות.
- צור מסיכת זיהוי ספוט 1:
- לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה בחר באפשרות ספוט וודא שבחרת בלחצן האפשרויות הבהיר. תחת מסכה בחר M07, הגדר את הנקודה ליחס הרקע של התא ל- 2.00. הגדר את הרדיוס המינימלי ל- 2 ואת הרדיוס המקסימלי ל- 6. לחץ על אישור אז בסדר שוב.
- לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה בחר טווח, ותחת מסכה בחר Levelset (M07, Ch07, אמצע, 3). הגדר את התמונה כך שתוצג ל- Ch07. הגדר את האזור המינימלי והמקסימלי ל-80 ו-5000, בהתאמה. הגדר את יחס הגובה-רוחב המינימלי והמקסימלי ל-0 ו-1, בהתאמה. לחץ על אישור אז בסדר שוב.
- לחץ על חדש לאחר מכן לחץ על פונקציה. תחת פונקציה בחר להתרחב, תחת מסכה בחר טווח (Levelset (M07, Ch07, אמצע, 3), 80-5000, 0-1). הגדר את התמונה כך שתוצג ל- Ch07. הגדר את מספר הפיקסלים ל- 2. לחץ על אישור אז בסדר שוב.
- לחץ על חדש. לחצו פעמיים על המסיכה ספוט (M07, Ch07, בהיר, 2, 6, 2) כדי להוסיפו להגדרת המסיכה. לחץ על האופרטור ולאחר מכן על האופרטור לא . לחץ פעמיים על המסיכה (טווח (M07, Ch07, אמצע, 3), 80-5000, 0-1), 2) כדי להוסיפו להגדרת המסיכה. לחץ על אישור.
- לחץ על חדשולאחר מכן הפונקציה. תחת פונקציה בחר טווח ותחת מסיכה בחר את המסיכה שנוצרה ב-10.1.1.4:
- בחר ספוט (M07, Ch07, בהיר, 2, 6, 2) ולא מתרחבים (טווח (M07, Ch07, אמצע, 3), 80-5000, 0-1), 2).
- הגדר את התמונה להצגה ל- Ch07. הגדר את האזור המינימלי והמקסימלי ל-10 ו-80, בהתאמה. הגדר את יחס הרוחב-גובה המינימלי והמקסימלי ל-0.4 ו -1, בהתאמה. לחץ על אישור אז בסדר שוב. מסיכת זיהוי ספוט 1 הושלמה.
הערה: עיין בסעיף 10 בתוספת 1-פרוטוקול מלא כדי ליצור מסיכות, תכונות ומגרשים כדי לזהות את אוכלוסיית MN הסופית
- צור מסיכת זיהוי ספוט 1:
11. יצירת מסיכות, תכונות ומגרשים כדי לזהות את האוכלוסיות של מונונומונטס ופולינוצינטי
- צור את מסיכת ה-פולי. לחץ על ניתוח, לאחר מכן מסיכות ולאחר מכן הפונקציה החדשה. תחת פונקציה בחר טווח, תחת מסכה בחר פרשת השניים (הרחב (M07, Ch07, אמצע, 3), 2)). הגדר את התמונה כך שתוצג ל- Ch07. הגדר את ערכי האזור המינימלי והמקסימלי ל-135 ו-5000, בהתאמה. הגדר את ערכי יחס הגובה-רוחב המינימלי והמקסימלי ל-0.4 ו -1, בהתאמה. לחץ על אישור. בשדה שם , שנה את הטקסט לקריאה בפולי ולאחר מכן לחץ על אישור לאחר מכן סגור. מסיכת התאים הפוליציבנטי הושלמה.
- צור את המסיכות של רכיבי ה-פולי.
- מסיכת פולי רכיב 1: לחץ על הכרטיסיה ניתוח , ולאחר מכן מסיכות, ואז חדש, לאחר מכן הפונקציה. תחת הפונקציה בחר רכיב, ותחת מסיכה בחר את פולי המסיכה. עבור אזורהבחירה של תכונת הדירוג ועבור סדר המיון לחץ על לחצן האפשרויות היורד. הגדר דרגה ל- 1. לחץ על אישור אז בסדר שוב.
- מסיכות פולי רכיבים 2, 3 ו-4: חזור על כל השלבים ב-11.2.1 למעט הגדרת דירוג 2, 3 ו- 4 כדי ליצור את מסיכות הרכיבים הבודדות.
- ספירת ספוט המשתמשת במסיכת פולי.
- לחץ על הכרטיסיה ניתוח , לאחר מכן תכונות, לאחר מכן חדש. באפשרות ' סוג תכונה', בחרו ' ספירת ספוט'. למסיכה בחרו במסיכת הזכוכית וקבעו את החיבור ההדדי ב- 4. לחץ על קבע שם ברירת מחדל ולחץ על אישור לאחר מכן סגור כדי לחשב את ערכי התכונות.
- לחצו על הסמל ' היסטוגרמה '. בחר באוכלוסיה שאינה אפוטוטית . עבור התכונה ציר ה-X בחר בתכונה ספוט Count_POLY_4 .
- אזור ספירת הספוט של מונו. לחצו על הסמל ' אזור ליניארי '. צייר אזור על-פני bin 1 בהיסטוגרמה שנוצרה ב-11.3.2. . קרא לאזור הזה 1 n
- אזור ספירת ספוט תלת-ממדי. לחצו על הסמל ' אזור ליניארי '. צייר אזור על פני bin 3 בהיסטוגרמה שנוצרה ב-11.3.2. . קרא לאזור הזה 3 n
- אזור ספירת הספוט של מונו (QUAD). לחצו על הסמל ' אזור ליניארי '. ציירו אזור על פני bin 4 בהיסטוגרמה שנוצרה ב-11.3.2. . קרא לאזור 4N
- זהה את אוכלוסיית ה-מונו.
- צור את התכונה ' יחס גובה-רוחב של מונו '. לחץ על הכרטיסיה ניתוח , לאחר מכן תכונות, לאחר מכן חדש. תחת סוג תכונה, בחר בתכונה יחס גובה -רוחב ותחת מסיכה בחר רכיב (1, אזור, פולי, יורד). לחץ על קבע שם ברירת מחדל ולאחר מכן לחץ על אישור.
- צור את התכונה ' מעגליות מונו '. כאשר חלון מנהל התכונה עדיין פתוח, לחץ על חדש. תחת סוג תכונה, בחר בתכונה מעגליות ותחת מסיכה בחר רכיב (1, אזור, פולי, יורד). לחץ על קבע שם ברירת מחדל ולאחר מכן לחץ על אישור לאחר מכן לחץ על סגור כדי לחשב את ערכי התכונות.
- עבור העלילה מעגלית מונו תאים נקודה, לחץ על סמל נקודה מגרש . בחר באפשרות 1N כאוכלוסיית האב. עבור התכונה ציר X בחר Circularity_Component (1, אזור, פולי, בסדר יורד) ועבור התכונה ציר Y בחר היבט Ratio_Component (1, אזור, פולי, יורד). לחץ על אישור. לחץ על לחצן אזור מרובע וצייר אזור מסביב לאוכלוסיית התאים כלפי החלק הימני העליון של ההתוויה. שם אזור זה Circular_1N. לחץ לחיצה ימנית על העלילה ולחץ על אזורים. האר את אזור Circular_1N . שנה את קואורדינטות ה-X ל-20 ו-55 ושנה את קואורדינטות Y ל-0.85 ו-1.0. לחץ על סגור.
- צור את התכונה אזור פולי/Area_M07. לחץ על הכרטיסיה ניתוח , לאחר מכן תכונות, לאחר מכן חדש. תחת סוג תכונה, בחר בתכונה אזור ותחת מסיכה בחר רכיב (1, אזור, פולי, סדר יורד). לחץ על קבע שם ברירת מחדל ולאחר מכן לחץ על אישור.
- כאשר חלון מנהל התכונה עדיין פתוח, לחץ על חדש לאחר מכן תחת סוג תכונה לחץ על לחצן האפשרויות המשולב. מתוך רשימת התכונות, סמן את Area_Component (1, אזור, פולי, בסדר יורד) ולחץ על החץ למטה כדי להוסיף אותו להגדרת תכונה. לחץ על סמל החילוק (/). בחר את התכונה Area_M07 ולחץ על החץ למטה כדי להוסיפו להגדרת התכונה. לחץ על קבע שם ברירת מחדל ולחץ על אישור. לחץ על ' סגור ' כדי להתחיל לחשב את ערכי התכונות.
- עבור העלילה הסופית של נקודות האוכלוסיה של מונו, לחץ על סמל העלילה נקודה . בחר Circular_1N כאוכלוסיית האב. עבור התכונה ציר X בחר היבט Ratio_M07 ועבור התכונה ציר Y בחר Area_Component (1, אזור, פולי, בסדר יורד)/Area_M07. לחץ על אישור. לחץ על לחצן אזור מרובע וצייר אזור מסביב לרוב התאים. ציין את שם האזור המונונולי. לחץ לחיצה ימנית על העלילה ולחץ על אזורים. הדגש את האזור המונונולי. שנה את קואורדינטות X ל 0.85 ו 1.0 ולשנות את קואורדינטות Y ל 0.55 ו 1.0. לחץ על סגור.
הערה: עיין בסעיף 11 בנספח 1-הפרוטוקול המלא כדי ליצור את המסכות, התכונות והחלקות כדי לזהות את האוכלוסיות הסופיות של הטריאוקליקות והרב.
12. צור תצוגה מותאמת אישית כדי לבחון את מסיכות BNC ו-MN
- לחץ על לחצן מאפייני גלריית תמונות ולאחר מכן לחץ על הכרטיסיה תצוגה . לחץ על הכרטיסיה מרוכבים ולאחר מכן לחץ על חדש. תחת שם סוג Ch01/Ch07. לחץ על הוסף תמונה. תחת התמונה בחר Ch01 והגדר את האחוז ל 100. לחץ שוב על הוספת תמונה , תחת התמונה בחר Ch07 והגדר את האחוז ל-100.
- לחץ על חדש ותחת סוג שם BNC ומסיכות MN
- לחץ על הוסף עמודה. תחת סוג תמונה בחר Ch01 ומתחת למסיכה בחר ללא
- לחץ על הוסף עמודה. תחת סוג תמונה בחר Ch07 ומתחת למסיכה בחר ללא
- לחץ על הוסף עמודה. תחת סוג תמונה בחר Ch07 ותחת מסכה בחר BNC
- לחץ על הוסף עמודה. תחת סוג תמונה בחר Ch07 ותחת מסיכה בחר מסכת MN
- לחץ על הוסף עמודה. תחת סוג תמונה לחץ על לחצן האפשרויות המשולב. יש להוסיף באופן אוטומטי את התמונה Ch01/Ch07 composite לתצוגה. לחץ על ' אישור ' כדי לסגור את חלון המאפיינים של גלריית התמונות.
13. צור תצוגה מותאמת אישית כדי לבחון את המסכה הפולי
- עיין בסעיף 13 בנספח 1-פרוטוקול מלא כדי ליצור תצוגה מותאמת אישית כדי לבחון את מסיכת ה-פולי
14. צור טבלת סטטיסטיקה לספירת אירועי מפתח
- לחץ על הכרטיסייה דוחות ולאחר מכן לחץ על הגדרת דוח סטטיסטיקה. בחלון החדש, לחץ על הוסף עמודות.
- הוסף את סטטיסטיקת ספירת ה-BNC. תחת ספירת סטטיסטיקה בחירה ותחת אוכלוסיה נבחרת בחר באוכלוסיה BNCs . לחץ על הוסף סטטיסטיקה כדי להוסיף את הסטטיסטיקה לרשימה.
- חזור על שלב 14.2 כדי ליצור עמודות נפרדות עבור האוכלוסיות MN BNCs, מונו, TRI ו- פולי . לחץ על סגור ולאחר מכן לחץ על אישור.
- תבנית ניתוח הנתונים מלאה (איור 2). שמור את התבנית (קובץ, שמור כתבנית). ניתן למצוא את רשימת המסיכה המלאה ברשימת 2 מסיכות.
15. התנסות בתהליך אצווה באמצעות תבנית ניתוח הנתונים
- תחת תפריט כלים לחץ על קבצי נתונים של אצווה ולאחר מכן לחץ על הוסף אצווה בחלון החדש.
- בחלון החדש לחץ על הוסף קבצים כדי לבחור את קבצי הניסוי (. רי) כדי להוסיף לאצווה. תחת האפשרות בחר תבנית או קובץ ניתוח נתונים (. ast,. דאף) , לחץ על סמל התיקיה הפתוחה כדי לדפדף אל ולפתוח את תבנית ניתוח הנתונים (קובץ. ast) שנשמרה בשלב 14.4.
- לחץ על לחצן התצוגה המקדימה דוח סטטיסטיקה כדי להציג בתצוגה מקדימה את טבלת הסטטיסטיקה. לא יוצגו ערכים כאן כיוון שלא חושבו עדיין. עם זאת, שלב זה משמש כבדיקה כדי לוודא שתבנית הניתוח המתאימה נבחרה לפני הפעלת האצווה.
- לחץ על אישור כדי לסגור את החלון הנוכחי. לאחר מכן לחץ על ' שלח אצוות ' כדי להתחיל את עיבוד האצווה של כל הקבצים.
- כאשר עיבוד האצווה הושלם, קובץ. txt יהיה זמין בתיקיה המכילה את כל קבצי ה-... השתמש בנתונים סטטיסטיים אלה כדי לחשב רעילות והרעלת ציטוזה.
16. חישוב ערכי הרעילות והרעילות לציטורעלים
- חישוב הרעלת הגנוזה: כדי לחשב הרעלת רעילות, השתמש בטבלת הסטטיסטיקה שנוצרה ב-15.5. חלק את מספר התאים באוכלוסיית MN BNCs במספר התאים באוכלוסייה BNCs ולאחר מכן הכפל על-ידי 100:

- חישוב רעילות ציטוזה: קבע את המספר הכולל של תאי ה-פולי על-ידי סיכום מספר התאים TRI ו-QUAD.
- חשב את אינדקס ההפצה ציטוקינזה-Block (CBPI) באמצעות מספר התאים ב-מונו, BNCs ו-פולי באופן הבא:
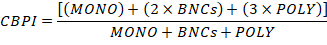
- לבסוף, לחשב את הרעילות של כל תרבות על ידי שימוש בערכי CBPI מתרבויות הבקרה (C) ותרבות חשופה כימית (T) כדלקמן:

- חשב את אינדקס ההפצה ציטוקינזה-Block (CBPI) באמצעות מספר התאים ב-מונו, BNCs ו-פולי באופן הבא:
תוצאות
שיטת הניתוח המתואר בנייר זה מאפשרת זיהוי אוטומטי והבקיע של BNCs, עם ובלי MN, כדי לחשב רעילות. בנוסף, מונו ו-פולי תאים מזוהים גם באופן אוטומטי הבקיע כדי לחשב רעילות ציטובית. קריטריונים של הבקיע שפורסמו6,34 שיש לכלול כאשר הבקיע אירועים אלה מיושמים בתוכנת ניתוח נתונים mifc. התוצאות המוצגות כאן לציין כי עליות משמעותיות מבחינה סטטיסטית בתדר MN עם רעילות הגוברת ניתן להבחין בעקבות חשיפת התאים האנושיים lymphoblastoid TK6 כדי ידוע מוכר MN כימיקלים (מיטומיצין C ו קולכינין). תוצאות דומות עבור כימיקלים נוספים נבדק הוכחו בפרסום נפרד32. בנוסף, תוצאות השימוש של Mannitol להראות כי שאינם MN הגורם כימיקלים יכול להיות גם מזוהה כראוי באמצעות שיטת MIFC המפורטים כאן. הפרמטרים המתוארים בפרוטוקול ליצירת כל המסכות, התכונות וגבולות האזור עשויים להיות מותאמים אם סוגי תאים שונים (לדוגמה, תאי אוגר סיניים) משמשים לביצוע התיקרות.
איור 3 מראה ארבעה פאנלים נבחרים כדי לזהות BNCs (איור 3A-3d). המוצג כאן הוא היסטוגרמה המאפשרת בחירת תאים עם שני גרעינים (איור 3a) ומגרשים bivariate המאפשרים את הבחירה של BNCs עם מעגליות דומה (איור 3ב), אזורים דומים ועוצמות (איור 3ג ) ו BNCs שיש להם הפרדה היטב, גרעיני לא חופפים (איור 3ד) לפי הניקוד ביקורת6,34. איור 3 E מציג את התמונות BF ו-Hoechst, כמו גם את מסכות BNC ו-MN המציינות כי BNCs עם יחיד או מספר מרובות ניתן לזהות ולספור. זה מאפשר הרעילות להיות מחושב על ידי קביעת שיעור הBNCs של micronucleated באוכלוסייה BNC הסופי. איור 4 מציג את היישום של התכונה ' ספירת ספוט ' באמצעות מסיכת ה-פולי לזיהוי תאים מונו, TRI ו-QUAD. לאחר מכן ניתן לסכם את מספר התאים TRI ו-QUAD כדי לקבל את המספר הסופי של התאים הפולי (טבלה 1). פעולה זו מאפשרת לחשב את רעילות הציטוזה באמצעות הנוסחה המוצגת בפרוטוקול. לכן, כל נקודת מינון בניסוי יכולה להיות מוערכת על ידי הפרמטרים הגנומטרים והרעילות ציטוזה.
איור 5 מראה ערכי הגנורעלים והרעלת ציטופין עבור אנאויגן קולכיצין, clastogen מיטומיצין C ועבור שליטה שלילית, Mannitol. עבור קולכיצין (איור 5A) 0.02 באמצעות 0.05 μg/mL מינונים הפיק עליות משמעותיות סטטיסטית בתדר MN, החל 1.28% כדי 2.44% בהתאמה על בקרת הממס (שולחן 1). במקרה של מיטומיצין C (איור 5B) שתי מינונים העליון של 0.4 ו 0.5 μg/ML המיוצר תדרים MN משמעותיים מבחינה סטטיסטית בהשוואה לפקדים ממס. אלה תדרי MN היו 0.93% ב 0.4 μg/mL ו 1.02% ב 0.5 μg/mL (טבלה 2). לבסוף, עבור mannitol (איור 5ג), לא נבדק מינונים לגרום לרעילות ציטובית מעל 30%, וגם לא הפיק עליות משמעותיות בתדר MN בהשוואה לבקרת ממס, כצפוי (שולחן3).

איור 1 : הגדרות מכשיר Mifc. צילום מסך של הגדרות MIFC כמתואר בסעיף שלב 7 של הפרוטוקול. (א) הגדרת כוח הלייזר 405 ננומטר ל -10 mW. (ב) הגדרת ערוצי BF 1 ו -9. (ג) בחירת העדשה האובייקטיבית של ההגדלה 60x. (ד) בחירת מהירות הזרימה האיטית ביותר היוצרת דימויים עם הרזולוציה הגבוהה ביותר. (ה) המציין את מספר האירועים שיש לאסוף ל-20,000. (ו) לחיצה על לחצן הטעינה כדי להתחיל בתהליך הטעינה לדוגמה. (G) לחיצה על כפתור לרכוש כדי להתחיל לרכוש דימויים. (ח) לחיצה על לחצן החזרה כדי להחזיר את כל המדגם שאינו בשימוש. (I) מגרש של יחס גובה-רוחב של bf לעומת אזור BF עבור בחירת תאים בודדים. (J) מגרש של Rms מעבר הדרגתי לעומת Rms מעבר ל-BF עבור הבחירה של תאים ממוקדים. (K) היסטוגרמה של חוזק הופסט לבחירת תאי דנ א חיוביים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2 : ניתוח תוכנות מחקר אסטרטגיה. צילום מסך של אסטרטגיית הסיכום שתוארה בסעיף 9 לפרוטוקול. אזורים מוצגים בסדר רציף לזיהוי תאים binucleated (תיבה אדומה), מיקרורוקליאני (תיבה צהובה), ותאים מונו-ופולינופולימרים (קופסה כחולה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
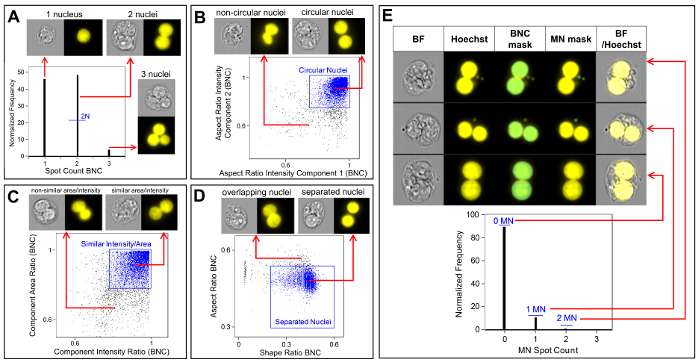
איור 3 : זיהוי והבקיע של BNCs עם ובלי MN. (A) בחירת תאים בעלי שני גרעינים שונים. (ב) זיהוי של תאים בינקלתיים (BNCs) הכוללים שני גרעינים מעוגלים מאוד באמצעות השימוש בתכונה ' עוצמת יחס גובה-רוחב '. (ג) בחירת BNCs שיש להם גרעינים עם אזורים דומים ועוצמות. זה מושגת על ידי חישוב היחס של האזור של שני הגרעינים ואת היחס של יחס גובה-רוחב של שני גרעינים. (ד) שימוש בתכונות יחס הצורה ויחס גובה-רוחב כדי לזהות BNCs בעלי שני גרעינים מופרדים היטב. (ה) התכונה ספירת הספוט באמצעות מסיכת מיקרו-משתמשים (mn) הממחיש שBNCs עם MN יחיד או מספר מרובים ניתנת לזיהוי ולספירה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
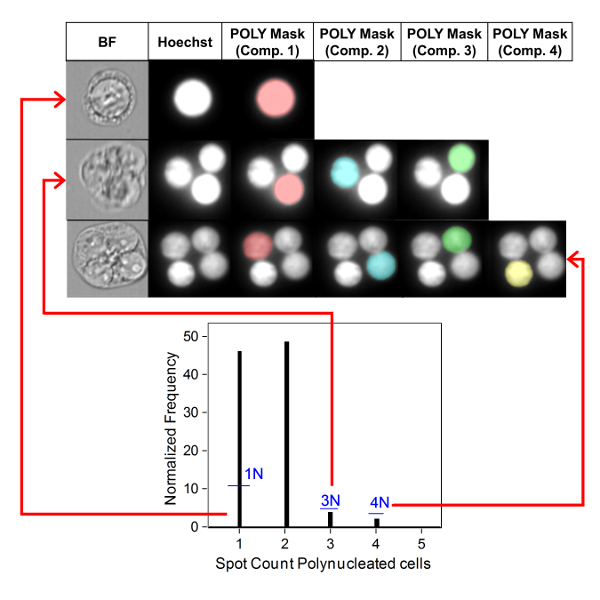
איור 4 : זיהוי והבקיע של תאים מונו ו פולי. השתמש בתכונה ספירת הספוט כדי לזהות ולספור תאים מונו, תלת-ממדי ומרובע. מסיכת רכיב 1 מאפשרת זיהוי של תאים מונונומונו (התמונה העליונה). מסיכות רכיב 1 עד 3 מאפשר זיהוי של תאים trinucleated (התמונה האמצעית). מסיכות רכיב 1 עד 4 מאפשר זיהוי של תאים מקוואדראוקלסים (התמונה התחתונה). דמות זו השתנתה מ-רודריגז 201832. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
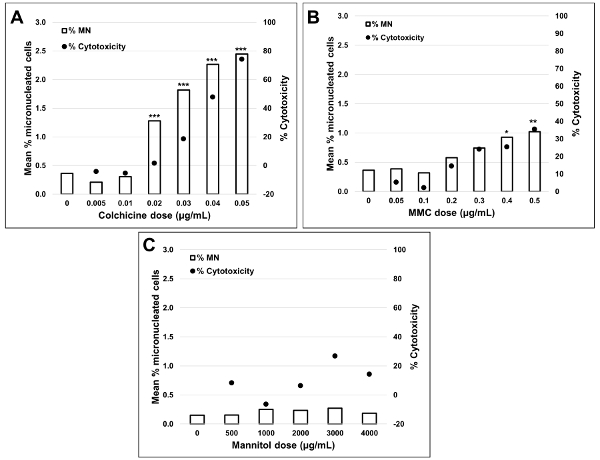
איור 5 : קוונפיקציה של הרעלת ציטוזה. רעילות ציטוזה מכמת באמצעות המדד התפשטות ציטוקינזה block (עיגולים שחורים) ו-רעילות כימות באמצעות אחוז של MN (ברים ברורים) בעקבות חשיפה 3 h ו 24 התאוששות h עבור (א) קולכיצין, (ב) מיטומיצין C ו ( ג) mannitol. עליות משמעותיות מבחינה סטטיסטית בתדר MN בהשוואה לפקדים מצוינים על ידי כוכבים (מבחן צ'י-בריבוע; *p < 0.05, * *p < 0.01, * * *p < 0.001). כל הכמויות הן הממוצע של שני משכפל בכל נקודת מינון. דמות זו השתנתה מ-רודריגז 201832. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
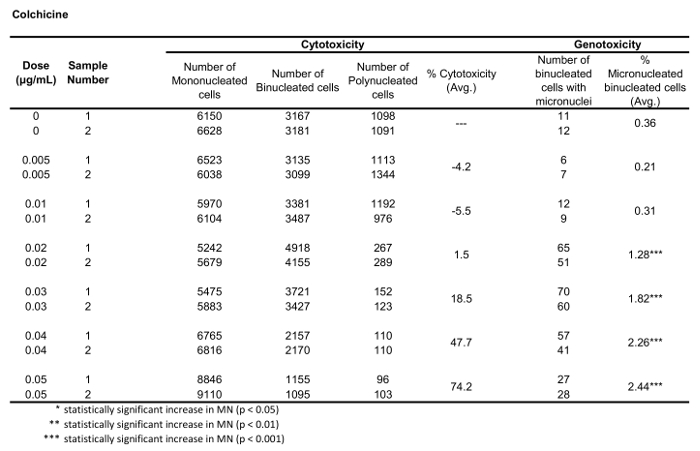
טבלה 1: הפרמטרים הדרושים כדי לחשב רעילות ציטומות (מספר מונו-, bi-ו-polynucleated תאים) ו-רעילות (המספר והאחוזים של תאים binucleated מיקרו) עבור קולכיצין. כל הכמויות המחושבות הן הממוצע של שני משכפל בכל נקודת מינון.
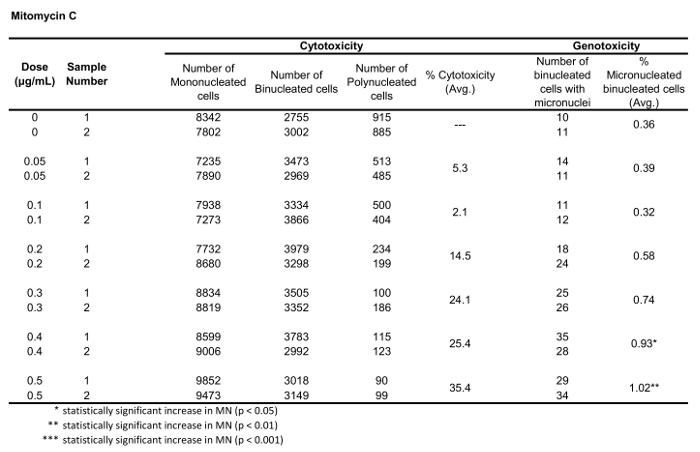
טבלה 2: הוא הפרמטרים הנדרשים כדי לחשב רעילות ציטומות (מספר מונו-, bi-ו-polynucleated תאים) ו-רעילות (המספר והאחוזים של תאים binucleated מיקרו) עבור מיטומיצין C. כל הכמויות המחושבות הן הממוצע של שני משכפל בכל נקודת מינון.
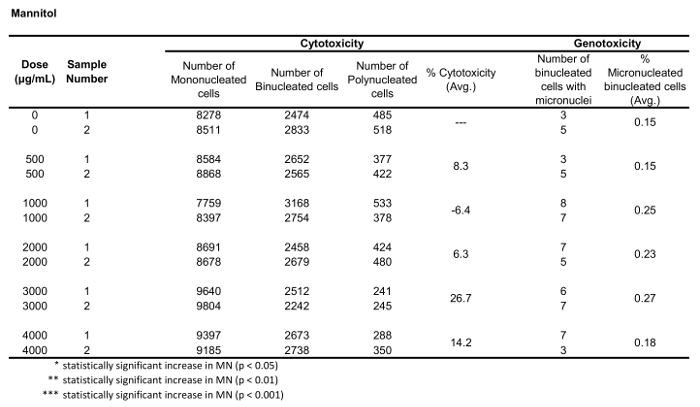
שולחן 3: הפרמטרים הנדרשים כדי לחשב רעילות ציטומות (מספר מונו-, bi-ו-polynucleated תאים) ו רעילות (המספר והאחוזים של תאים binucleated מיקרו) עבור Mannitol. כל הכמויות המחושבות הן הממוצע של שני משכפל בכל נקודת מינון.
מוסף 1: פרוטוקול מלא. אנא לחץ כאן כדי להוריד קובץ זה.
מוסף 2: רשימת מסיכות. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בפרסום שנערך לאחרונה Verma et al. הבקיע את החשיבות של פיתוח מערכת המשלבת את היתרון של תפוקה גבוהה של הזרימה cy, לנסות את הנתונים ואת התמונה היתרונות אחסון של ניתוח תמונה35. ה-MIFC בשיטת החוץ הגופית שתוארה במאמר זה עונה על הצעת המחיר הזאת ויש לו את הפוטנציאל להתגבר על רבים מהאתגרים הנ ל במיקרוסקופיה ושיטות הזרימה של הציטוטונסה. הפרוטוקול המתואר כאן ממחיש כי ניתן להעריך גם את הרעלת הציטורעלים ו-גנוזה באמצעות MIFC. הכנה לדוגמה, כתמים סלולריים ואיסוף נתונים הם פשוטים אך ישנם כמה צעדים קריטיים בפרוטוקול שצריך תמיד להיות מיושם. תוספת של אשלגן כלוריד (KCl) לתאים הוא קריטי כדי להתנפח את התאים, יצירת הפרדה בין הגרעין הראשי. הדבר מבטיח שאלגוריתם המסיכה יוכל לזהות את כל הגרעינים הבודדים בתאי BNCs ו-פולי (תאי פולי) הנחוצים לספירה שלהם. בנוסף, KCL מספק הפרדה בין גרעינים ו-MN, החיונית לצורך מיסוך וכימות מדויקים של MN. יתר על כן, השימוש Formalin בעקבות תוספת של KCl מונע התאים מלייסינג במהלך צנטריפוגה. התוספת של ציטוצ'לסין B גורם TK6 תאים שעברו יותר מאשר מחלקה גרעינית אחת להיות גדולה למדי. כתוצאה מכך, ציטופלסמה הופך שברירי יכול lyse אם צנטריפוגה מבוצעת מיד לאחר התוספת של KCl. כמו-כן, חשוב מאוד להחדיר הואכסט למדגם על פי מספר התאים במדגם ולא על פי ריכוז סופי. לדוגמה, ריכוז סופי של 10 μg/mL של Hoechst יהיה בצורה אחידה כתם מדגם של 1 x 106 תאים אבל לא יכול להיות כתם מספיק מדגם המכיל 5 x 106 תאים והוא יכול לגרום לתאים רבים עם גרעינים מוכתם במעומעם, עושה ניתוח קשה. חשוב גם לציין כי Hoechst יכול להיות מוחלף עם צבע DNA אחר כגון DAPI אם MIFC מצויד עם 405 לייזר עירור DRAQ5 ננומטר או אם מיFC מצויד עם 488 ננומטר ו/או 642nm לייזר. אם שינוי הכתם הגרעיני, חיוני להפעיל את הכתם כדי למצוא את הריכוז המתאים לכוח הלייזר הנדרש/רצוי.
בעת איסוף נתונים ב-MIFC חשוב לקבוע את גבולות האזור האופטימליים עבור התכונות של מעבר הצבע של RMS. הגבולות המוצגים בפרוטוקול זה עשויים לדרוש התאמה עקב כמה וריאציות קלות בין כלי MIFC. היישום של תכונה זו במהלך איסוף הנתונים חיוני כדי להבטיח את הדימויים ממוקדת מאוד נתפס. אם קבצי נתונים מכילים הרבה תמונות מטושטש או ממוקד, סביר לשכן את האלגוריתמים המסיכה בתוכנה הניתוח יהיה להדגיש באופן שגוי ממצאים באזורים מטושטשים, המוביל למספר גבוה של ממצאים חיוביים שווא הבקיע כמו MN. למרות הטכניקות עיבוד תמונה שתוארו כאן יכול להיות קשה, פעם אחת תבנית ניתוח פותחה בתוכנה MIFC, עיבוד אצווה מאפשר קבצים נתונים לניתוח אוטומטי, ביטול התערבות המשתמש ולכן, השערים טיה. כמו כן, אם קו תא שאינו TK6 תאים משמשים לביצוע הצורך, יהיה צורך לשנות את גבולות המסיכות והאזור כמאפיינים מורפולוגיים (לדוגמה, גודל) של תאים שונים מאלה של תאים TK6.
התוצאות המוצגות כאן (איור 5) מציגות עליות משמעותיות מבחינה סטטיסטית באינדוקציה MN בעת חשיפת תאים TK6 למינונים שונים של מיטומיצין C ו קולכיצין. עליות משמעותיות מבחינה סטטיסטית בתדירות של MN לעומת שולטת ממס נצפו עבור מנות מספר בשני הכימיקלים. בנוסף, אין מינון של Mannitol התוצאה של רעילות ציטובית מעל 30%, ולא עלייה משמעותית מבחינה סטטיסטית בתדירות של MN בהשוואה לבקרת ממס, כצפוי. הפרוטוקול המתואר במאמר זה באמצעות MIFC לבצע את שיטת החוץ הגופית מעניקה תוצאות צפויות מכימיקלים שליטה חיוביים ושליליים. חשוב מאוד לבצע מספר ניסויים באמצעות שליטה ממיסים וכימיקלים בקרה שלילית כדי לפתח ערכים בסיסיים הן בתדירות של MN והן באינדקס ההפצה ציטוקינזה Block (CBPI). עבור רעילות, עליות משמעותיות מבחינה סטטיסטית בתדר MN נקבעות באמצעות השוואה לתדרי MN בסיסית אשר חייב להיות מוכר עבור סוג התא בשימוש. בנוסף כל חישובים ציטורעילות מבוססים על CBPI של דגימות בקרה ולכן, שיעורי בסיס של מונו, BNCs ו-פולי תאים חייב להיות כימות היטב בפקדים.
מספר מגבלות ויתרונות של שימוש mifc בהקשר של שיטת MN תוארה בעבודה הקודמת29,32. המגבלות העיקריות נוגעות לתדרי MN נמוכים יותר בהשוואה למיקרוסקופיה, שכנראה נובעת הן מחוסר הגמישות כאשר מיישמים את קריטריוני הניקוד בתוכנת הניתוח, כמו גם את העומק המוגבל של השדה של MIFC. מסכות מתאר היטב ניתן ליצור כדי לזהות במדויק את הגרעין הראשי אבל MN כי הם נוגעים (או קרוב מאוד) הגרעין הראשי עשוי להילכד בתוך מסכת BNC. בנוסף, מאוד קטן MN כי יכול להיות בקלות הבקיע באמצעות מיקרוסקופ הם כנראה החמיץ באופן שגוי בעת שימוש MIFC בשל המגבלה התחתונה על הפרמטר אזור של מסכת MN כדי למנוע הבקיע חפצים קטנים. בנוסף לקשיים המצויים בניתוח נתונים מבוסס תמונה, בשל עיצובו, MIFC מקבל שתי תמונות הקרנה ממדיות של אובייקטים סלולריים תלת מימדיים. זה כנראה גורם מסוימים MN להילכד בעומק שונה של מיקוד כי שני MN הראשי, מה שהופך אותם מופיעים עמום מאוד ולא-scorable באמצעות מיסוך. יתר על כן, חלק קטן של MN יכול לשכון מאחורי אחד משני הגרעינים העיקריים, מה שהופך אותם בלתי אפשרי להמחיש ולהבקיע. לכן, בהתחשב בקשיים אלה, יש להשתמש בזהירות בעת פענוח עליות משמעותיות בתדר MN במינון נמוך.
למרות החסרונות הללו, השיטה MIFC המתוארת כאן מציעה מספר יתרונות על פני טכניקות אחרות. באמצעות הקריטריונים וההנחיות המוצעים שיש לשקול בעת פיתוח מערכות אוטומטיות ומתודולוגיות עבור MN בחני36. אלה כוללים, אך אינם מוגבלים, הדמיה ישירה של הגרעינים העיקריים וציטופלסמה, קביעת תדירות של MN ממינונים שונים של הכימיקל או הסוכן נבדק את היכולת לכמת את המבנה ולקבוע את המיקום של כל גרעינים ו-MN כדי לוודא שהם בתוך הציטופלסמה. מאמר זה מראה כי השיטה MIFC פיתחה לבצע את הדרישות מחוץ לכאן באופן מתורבת (או בעל פוטנציאל לספק) קריטריונים אלה. במיוחד, תמונות של גרעינים ו-MN יכול להילכד על ידי לייזרים פלורסנט בעוד הדימויים cytoplasmic ניתן להשיג באמצעות הנורית BF. הדמיה של תאים עם מורפולוגיה גרעינית נורמלית ניתן לבדיל באופן אוטומטי מתאים אלה עם מורפולוגיה סדיר באמצעות שילוב של מסכות מתקדמות ותכונות. התוצאות המוצגות עבור Colchicine ו מיטומיצין C (איור 5) מראים כי הן גנורעילות ו ציטורעילות יכול להיות מוערך במינונים שונים בהשוואה לפקדים ממס ומבחינה סטטיסטית משמעותי תדרים MN הם נצפו היכן צפוי. יתר על כן, בדיקת ה-OECD מנחה 487 ממליצה על הבקיע 2,000 BNCs לכל מבחן ריכוז להעריך את הנוכחות של MN כדי לקבוע את הרעילות יחד עם לפחות 500 תאים לכל מבחן ריכוז כדי לקבוע רעילות ציטובית9; זה יכול לקחת מעל 1 h באמצעות מיקרוסקופ ידני. הפרוטוקול ואת התוצאות במאמר זה מראים כי ממוצע של כ 6,000 BNCs, 16,000 תאים מונו, ו 800 התאים פולי נתפסו הבקיע לכל ריכוז במבחן בערך 20 דקות. הקצב המהיר של רכישת הנתונים והמספרים הגבוהים של התאים המועמדים הבקיע בזמן קצר כזה להדגיש עוד יתרון חשוב של העסקת MIFC לבצע את שיטת החוץ הגופית MN.
בעוד התוצאות המוצגות במאמר זה מעודדות, הן מייצגות שיטת הוכחת הרעיון המוקדמת. עבודה זו צריכה להיות בעקבות חקירה יסודית יותר של מערכת כימית גדולה יותר, מגוונת יותר המכסה מספר מחלקות ומנגנונים של רעילות ורעילות ציטובית כגון אלה המוצעים על ידי קירקלנד ואח '.37 ביצוע מחקרים כאלה הם זמן רב ועבודה אינטנסיבית, וליפול מחוץ לטווח של נייר זה אולם, מחקרים גדולים יותר בקנה מידה יספק תובנה יקר ליכולת של השיטה לזהות באופן אמין סוכנים גנוטיים חלש. המתודולוגיה המוצגת כאן עדיין לא היתה מיניאטורי לפורמט למיקרוגל, אשר יאפשר הקרנה מהירה ויעילה יותר על פני מגוון גדול יותר של מינון. ככזה, בצורתו הנוכחית, מבוסס MIFC בתוך שיטת הבדיקה החוץ-גופית המוצגת כאן עשויה להיות מתאימה ביותר ללימודי מעקב ומחקר בתחום העבודה במעבדה טובה. עם זאת, השיטה תמשיך להיות ממוטבת ומאומתת, והיא מחזיקה בפוטנציאל לאפשר גמישות מוגברת בזיהוי אירועים כימיים הקשורים למבנה מורפולוגיה, כגון חשיפה של מרבית התאים עם גרעיני לא מעגלי כי הם עדיין scorable38. בסופו של דבר, שיטת MIFC מציגה הזדמנות להחדיר סמנים נוספים לתוך שיטת MN (כגון כתמים קינטוכורה) כדי לספק תצוגה מקיפה יותר של המנגנון האינדוקציה MN.
Disclosures
המחבר מועסק על ידי חברת לומיקס, יצרנית של הדמיה של זרם ה-ImageStream רב-ספקטרלי ששימש בעבודה זו.
Acknowledgements
המחבר תודה כריסטין פרובסט (תאגיד לומיקס) על מאמציה בפיתוח צורות קודמות של התבנית ניתוח נתונים, כמו גם ד ר היילי Pugsley (לומיקס Corporation) ו ד ר פיל מוריסי (תאגיד לומיקס) לסקירת ועריכה של כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Falcon | 352096 | |
| Cleanser - Coulter Clenz | Beckman Coulter | 8546931 | Fill container with 200 mL of Cleanser. https://www.beckmancoulter.com/wsrportal/page/itemDetails?itemNumber=8546931#2/10//0/25/1/0/asc/2/8546931///0/1//0/ |
| Colchicine | MilliporeSigma | 64-86-8 | |
| Corning bottle-top vacuum filter | MilliporeSigma | CLS430769 | 0.22 um filter, 500 mL bottle |
| Cytochalasin B | MilliporeSigma | 14930-96-2 | 5 mg bottle |
| Debubbler - 70% Isopropanol | EMD Millipore | 1.3704 | Fill container with 200 mL of Debubbler. http://www.emdmillipore.com/US/en/product/2-Propanol-70%25-%28V%2FV%29-0.1-%C2%B5m-filtred,MDA_CHEM-137040?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Dimethyl Sulfoxide (DMSO) | MilliporeSigma | 67-68-5 | |
| Dulbecco's Phosphate Buffered Saline 1X | EMD Millipore | BSS-1006-B | PBS Ca++MG++ Free |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Polysciences, Inc. | 04018 | This is what is used for the 4% and 1% Formalin. CAUTION: Formalin/Formaldehyde toxic by inhalation and if swallowed. Irritating to the eyes, respiratory systems and skin. May cause sensitization by inhalation or skin contact. Risk of serious damage to eyes. Potential cancer hazard. http://www.polysciences.com/default/catalog-products/life-sciences/histology-microscopy/fixatives/formaldehydes/formaldehyde-10-methanol-free-pure/ |
| Hoechst 33342 | Thermo Fisher | H3570 | 10 mg/mL solution |
| Mannitol | MilliporeSigma | 69-65-8 | |
| MEM Non-Essential Amino Acids 100X | HyClone | SH30238.01 | |
| MIFC - ImageStreamX Mark II | EMD Millipore | 100220 | A 2 camera ImageStreamX Mark II eqiped with the 405nm, 488nm, and 642nm lasers was used. http://www.emdmillipore.com/US/en/life-science-research/cell-analysis/amnis-imaging-flow-cytometers/imagestreamx-Mark-ii-imaging-flow-cytometer/VaSb.qB.QokAAAFLzRop.zHe,nav?cid=BI-XX-BDS-P-GOOG-FLOW-B325-0006 |
| MIFC analysis software - IDEAS | EMD Millipore | 100220 | The companion software to the MIFC (ImageStreamX MKII) |
| MIFC software - INSPIRE | EMD Millipore | 100220 | This is the software that runs the MIFC (ImageStreamX MKII) |
| Mitomycin C | MilliporeSigma | 50-07-7 | |
| NEAA Mixture 100X | Lonza BioWhittaker | 13-114E | |
| Penicllin/Streptomycin/Glutamine solution 100X | Gibco | 15070063 | |
| Potassium Chloride (KCl) | MilliporeSigma | P9541 | |
| Rinse - Ultrapure water or deionized water | NA | NA | You can use any ultrapure water or deionized water. Fill container with 900 mL of Rinse. |
| RNase | MilliporeSigma | 9001-99-4 | |
| RPMI-1640 Medium 1X | HyClone | SH30027.01 | |
| Sheath - PBS | EMD Millipore | BSS-1006-B | This is the same as Dulbecco's Phosphate Buffered Saline 1X Ca++MG++ free. Fill container with 900mL of Sheath. |
| Sterile water | HyClone | SH30529.01 | |
| Sterilizer - 0.4-0.7% Hypochlorite | VWR | JT9416-1 | This is assentually 10% Clorox bleach that can be made by deluting Clorox bleach with water. Fill container with 200 mL of Sterilzer. |
| System Calibration Reagent - SpeedBead | EMD Millipore | 400041 | Each tube holds ~10 mL. https://www.emdmillipore.com/US/en/life-science-research/cell-analysis/amnis-imaging-flow-cytometers/support-training/XDqb.qB.wQMAAAFLBDUp.zHu,nav |
| T25 flask | Falcon | 353109 | |
| T75 flask | Falcon | 353136 | |
| TK6 cells | MilliporeSigma | 95111735 |
References
- Bonassi, S., et al. An increased micronucleus frequency in peripheral blood lymphocytes predicts the risk of cancer in humans. Carcinogenesis. 28 (3), 625-631 (2007).
- Fenech, M. The in vitro micronucleus technique. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 455 (1-2), 81-95 (2000).
- Fenech, M. The Lymphocyte Cytokinesis-Block Micronucleus Cytome Assay and its Application in Radiation Biodosimetry. Health Physics. 98 (2), 234-243 (2010).
- Hintzsche, H., et al. Fate of micronuclei and micronucleated cells. Mutation Research - Reviews in Mutation Research. 771, 85-98 (2017).
- Fenech, M. The advantages and disadvantages of the cytokinesis-block micronucleus method. Mutation Research. 392 (1-2), 11-18 (1997).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Fenech, M., Holland, N., Chang, W. P., Zeiger, E., Bonassi, S. The HUman MicroNucleus Project - An international collaborative study on the use of the micronucleus technique for measuring DNA damage in humans. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 428 (1-2), 271-283 (1999).
- Kirsch-Volders, M., et al. Report from the in vitro micronucleus assay working group. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 540 (2), 153-163 (2003).
- OECD Library. Test No. 487: In vitro Mammalian Cell Micronucleus Test. OECD Guidelines for the Testing of Chemicals, Section 4. , (2016).
- Aardema, M. J., et al. SFTG international collaborative study on in vitro micronucleus test. III. Using CHO cells. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 61-87 (2006).
- Clare, M. G., et al. SFTG international collaborative study on in vitro micronucleus test. II. Using human lymphocytes. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 37-60 (2006).
- Lorge, E., et al. SFTG international collaborative study on in vitro micronucleus test. I. General conditions and overall conclusions of the study. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 13-36 (2006).
- Oliver, J., et al. SFTG international collaborative study on in vitro micronucleus test. V. Using L5178Y cells. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 125-152 (2006).
- Wakata, A., et al. SFTG international collaborative study on in vitro micronucleus test. IV. Using CHL cells. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 88-124 (2006).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: Results of an international slide-scoring exercise by the HUMN project. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 534 (1-2), 45-64 (2003).
- Decordier, I., et al. Automated image analysis of cytokinesis-blocked micronuclei: an adapted protocol and a validated scoring procedure for biomonitoring. Mutagenesis. 24 (1), 85-93 (2009).
- Decordier, I., et al. Automated image analysis of micronuclei by IMSTAR for biomonitoring. Mutagenesis. 26 (1), 163-168 (2011).
- Schunck, C., Johannes, T., Varga, D., Lorch, T., Plesch, A. New developments in automated cytogenetic imaging: unattended scoring of dicentric chromosomes, micronuclei, single cell gel electrophoresis, and fluorescence signals. Cytogenetic and Genome Research. 104 (1-4), 383-389 (2004).
- Rossnerova, A., Spatova, M., Schunck, C., Sram, R. J. Automated scoring of lymphocyte micronuclei by the MetaSystems Metafer image cytometry system and its application in studies of human mutagen sensitivity and biodosimetry of genotoxin exposure. Mutagenesis. 26 (1), 169-175 (2011).
- Nüsse, M., Marx, K. Flow cytometric analysis of micronuclei in cell cultures and human lymphocytes: Advantages and disadvantages. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 392 (1-2), 109-115 (1997).
- Avlasevich, S. L., Bryce, S. M., Cairns, S. E., Dertinger, S. D. In vitro micronucleus scoring by flow cytometry: Differential staining of micronuclei versus apoptotic and necrotic chromatin enhances assay reliability. Environmental and Molecular Mutagenesis. 47 (1), 56-66 (2006).
- Bryce, S. M., Bemis, J. C., Avlasevich, S. L., Dertinger, S. D. In vitro micronucleus assay scored by flow cytometry provides a comprehensive evaluation of cytogenetic damage and cytotoxicity. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 630 (1-2), 78-91 (2007).
- Bryce, S. M., et al. Flow cytometric 96-well microplate-based in vitro micronucleus assay with human TK6 cells: Protocol optimization and transferability assessment. Environmental and Molecular Mutagenesis. 54 (3), 180-194 (2013).
- Fenech, M. Commentary on the SFTG international collaborative study on the in vitro micronucleus test: to Cyt-B or not to Cyt-B. Mutation Research. 607 (1), 9-12 (2006).
- Basiji, D. A. . Methods in Molecular Biology. 1389, 13-21 (2016).
- Rodrigues, M. A., Beaton-Green, L. A., Kutzner, B. C., Wilkins, R. C. Automated analysis of the cytokinesis-block micronucleus assay for radiation biodosimetry using imaging flow cytometry. Radiation and Environmental Biophysics. 53 (2), 273-282 (2014).
- Rodrigues, M. A., Beaton-Green, L. A., Kutzner, B. C., Wilkins, R. C. Multi-parameter dose estimations in radiation biodosimetry using the automated cytokinesis-block micronucleus assay with imaging flow cytometry. Cytometry Part A. 85 (10), 883-893 (2014).
- Rodrigues, M. A., Beaton-Green, L. A., Wilkins, R. C. Validation of the cytokinesis-block micronucleus assay using imaging flow cytometry for high throughput radiation biodosimetry. Health Physics. 110 (1), 29-36 (2016).
- Rodrigues, M. A., Probst, C. E., Beaton-Green, L. A., Wilkins, R. C. Optimized automated data analysis for the cytokinesis-block micronucleus assay using imaging flow cytometry for high throughput radiation biodosimetry. Cytometry Part A. 89 (7), 653-662 (2016).
- Rodrigues, M. A., Probst, C. E., Beaton-Green, L. A., Wilkins, R. C. The effect of an optimized imaging flow cytometry analysis template on sample throughput in the reduced culture cytokinesis-block micronucleus assay. Radiation Protection Dosimetry. 172 (1-3), 223-229 (2016).
- Wang, Q., et al. Automated Triage Radiation Biodosimetry: Integrating Imaging Flow Cytometry with High-Throughput Robotics to Perform the Cytokinesis-Block Micronucleus Assay. Radiation Research. 191 (4), 342-351 (2019).
- Rodrigues, M. A. Automation Of The In vitro Micronucleus Assay Using The ImageStream® Imaging Flow Cytometer. Cytometry Part A. 93, 706-726 (2018).
- Rodrigues, M. A., Beaton-Green, L. A., Wilkins, R. C., Fenech, M. F. The potential for complete automated scoring of the cytokinesis block micronucleus cytome assay using imaging flow cytometry. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 836, 53-64 (2018).
- Fenech, M., et al. HUMN project: Detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 534 (1-2), 65-75 (2003).
- Verma, J. R., et al. Evaluation of the automated MicroFlow® and Metafer™ platforms for high-throughput micronucleus scoring and dose response analysis in human lymphoblastoid TK6 cells. Archives of Toxicology. 91 (7), 2689-2698 (2017).
- Fenech, M., et al. HUMN project initiative and review of validation, quality control and prospects for further development of automated micronucleus assays using image cytometry systems. International Journal of Hygiene and Environmental Health. 216 (5), 541-552 (2013).
- Kirkland, D., et al. Updated recommended lists of genotoxic and non-genotoxic chemicals for assessment of the performance of new or improved genotoxicity tests. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 795, 7-30 (2016).
- Verma, J. R., et al. Investigating FlowSight® imaging flow cytometry as a platform to assess chemically induced micronuclei using human lymphoblastoid cells in vitro. Mutagenesis. 33 (4), 283-289 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved