Method Article
מדידה רגיש של Mitophagy מאת Flow Cytometry באמצעות תלויי-pH הכתב פלורסנט mt-Keima
In This Article
Summary
Mitophagy, השפלה סלקטיבי של המיטוכונדריה, היה מעורב הומאוסטזיס מיטוכונדריאלי, הוא deregulated למחלות אנושיות שונות. עם זאת, שיטות נסיוניות נוח למדידת פעילות mitophagy מוגבלים מאוד. כאן, אנו מספקים וזמינותו רגיש למדידת פעילות mitophagy באמצעות cytometry זרימה.
Abstract
Mitophagy הוא תהליך של הסרת סלקטיבי של המיטוכונדריה פגום או לא נחוץ שימוש autophagy מכונות. נמצאו קשרים הדוקים בין mitophagy פגומים מחלות אנושיות שונות, כולל מחלות ניווניות, סרטן ומחלות מטבוליות. בנוסף, מחקרים שנעשו לאחרונה הראו ש-mitophagy הזה מעורב בתהליכי סלולרית רגילה, כמו התמיינות והתפתחות. עם זאת, התפקיד המדויק של המנגנונים המולקולריים שבבסיס mitophagy דורשים לימוד נוסף. לכן, חיוני לפתח שיטה חזקה ונוחה למדידת השינויים בפעילות mitophagy. כאן, אנו מתארים את פרוטוקול מפורטת להערכת באופן כמותי mitophagy פעילות דרך cytometry זרימה באמצעות החלבון הניאון, ממוקדות המיטוכונדריה Keima (mt-Keima). זה וזמינותו cytometry זרימה ניתן לנתח פעילות mitophagy יותר במהירות וברגישות מאשר קונבנציונאלי מיקרוסקופ או immunoblotting מבוססת על שיטות. פרוטוקול זה ניתן להחיל כדי לנתח פעילות mitophagy סוגי תאים שונים.
Introduction
המיטוכונדריה הם organelles כי הם חיוניים עבור התפשטות תאים ופיזיולוגיה. המיטוכונדריה הם אחראי על יצירת יותר מ 80% מאספקת ATP באמצעות זרחון חמצוני, הם גם מספקים ביניים מטבוליים שונים עבור ביוסינטזה ואת חילוף החומרים1,2. בנוסף לתפקידים שלהם אספקת אנרגיה, מטבוליזם, המיטוכונדריה ממלאים תפקידים מרכזי בתהליכים רבים אחרים חשובים, כולל דור (ROS) מינים חמצן תגובתי, ברגולציה של מוות של תאים, Ca תאיים2 + דינמיקה3 . שינויים בתפקוד מיטוכונדריאלי קושרו עם מחלות אנושיות, לרבות סרטן, סוכרת,4,מחלות ניווניות שונות5. תפקוד מיטוכונדריאלי מוגברת, מוטציות דנ א מיטוכונדריאלי נחשבים גם לתרום הזדקנות נורמלית תהליכים6,7,8. לכן, בקרת איכות הוא עניין מכריע בתוך המיטוכונדריה. המיטוכונדריה הם organelles דינמי מאוד ללא הרף שיכולים לשנות את צורתם בין רשתות מוארך טופס קצר, מפוצלים. המיטוכונדריה dynamics ממלא תפקיד חשוב בשמירה על הפונקציה של המיטוכונדריה, כמו גם שפלותם עד mitophagy9.
Mitophagy הוא מנגנון זה כרוך השפלה סלקטיבי של המיטוכונדריה שלם באמצעות המנגנון autophagy. Mitophagy הוא עקרון המנגנון הבסיסי מחזור מיטוכונדריאלי והסרה של המיטוכונדריה פגום או לא מתפקדת. בתהליך זה, המיטוכונדריה קודם מוקף קרום, וכתוצאה מכך להיווצרות של autophagosomes, אשר אז נתיך עם lysosomes השפלה hydrolytic9. מחקרים גנטיים הקודם בדרוזופילה הראו ששני גנים הקשורים מחלת פרקינסון, הנוצרות על-ידי PTEN בשם קינאז 1 (PINK1) (PARK6) פרקין (PARK2), לתפקד באותו מסלול10,11. תת-סדרה מחקרים הראו כי מסלול PINK1-פרקין האחראית לסילוק המיטוכונדריה פגום מפגמים תוצאה זו מסלול ב mitophagy לא מתפקדת, עשוי לתרום מחלות אנושיות12,13. פגמים בתהליכים mitophagy לאחרונה התגלו מחלות אנושיות שונות, כולל סרטן, מחלות לב, מחלות כבד, מחלות ניווניות 14. בנוסף, מחקרים שנעשו לאחרונה גם הראו שכי mitophagy הינה קריטית תהליכים פיזיולוגיים רבים, כגון בידול, התפתחות התגובה החיסונית15,16,17,18 ,19, רומז mitophagy זה עשוי לשחק תפקיד פעיל יותר פונקציות תא השליטה.
למרות אישור האחרונות כי mitophagy ממלא תפקיד חשוב בבקרת איכות שני בתוך המיטוכונדריה, מחלות אנושיות, המנגנונים המולקולריים שבבסיס mitophagy נשארים לקוי הבין. למרות מנגנונים הקשורים mitophagy נחקרו באופן שיטתי של שמרים, מחקרים שמטרתם לחקור מנגנונים הקשורים mitophagy בתאים בתרבית של התמקדו בעיקר המעבר PINK1-פרקין. מחקרים קודמים הקימו המעבר PINK1-פרקין אחראי בעיקר על הסרת סלקטיבי של המיטוכונדריה פגום באמצעות mitophagy12,20,21. עם זאת, מחקרים שנעשו לאחרונה דיווחו כי כמה דגמים, mitophagy יכול להיות מופעל גם בהיעדר פונקציונלי PINK122,23,24. תוצאות אלו מעידות על כך בנוסף מסלול PINK1-פרקין, שם מסלול לא מזוהה נוספים לבצע הפעלה mitophagy
העדר של שיטה נוחה כדי להעריך mitophagy פעילות זו היא מכשול גדול כדי לחקור את המסלולים המסדירים mitophagy ותפקידו באירועים הקשורים pathophysiological. מיקרוסקופ אלקטרונים הוא כלי רב עוצמה ישירות להמחיש המיטוכונדריה שפוקדת autophagosome. עם זאת, מיקרוסקופ אלקטרונים יש מגבלות לכימות mitophagy פעילות. למרות אסטרטגיות המשתמשות הקשורים microtubule חלבון-1 אור שרשרת 3 (LC3)-הגששים פלורסנט מצומדת, כגון ה-GFP-LC3, הם כיום גישות הנפוצה ביותר25, הארעיות של האות מבוסס-LC3 ועבור הקצב גבוה של חיובי-false אותות להגביל את הרגישות שלה לגילוי mitophagy תאים26. שילוב של סופג המערבי כדי למדוד את רמת חלבון מיטוכונדריאלי, כימות של דנ א מיטוכונדריאלי, וניתוח פלורסצנטיות מיקרוסקופ כדי colocalize המיטוכונדריה עם autophagosomes או lysosomes תהיה גישה טובה להערכת mitophagy. עם זאת, מגבלות כימות וחוסר הנוחות של מתודולוגיות קיימות להזעיק גישות חדשות. המבוא של חלבון פלואורסצנטי חדש תלויי-pH, המטרה מיטוכונדריאלי Keima (mt-Keima), לשפר באופן משמעותי את היכולת לזהות mitophagy27. על ידי מיזוג הרצף מיטוכונדריאלי פילוח של ציטוכרום c אוקסידאז מיתרים יחידה משנית השמיני (קוקס השמיני) לתוך Keima, mt-Keima מכוונת אל המטריקס מיטוכונדריאלי. משמרת גדול בשיא עירור של Keima מ- 440 ננומטר עד 586 nm (תואם ל- pH 7 ו- pH 4, בהתאמה) יכול להיות מנוצל כדי להעריך mitophagy עם הטוב ברגישות גם במבחנה וגם ויוו ניסויים28,29 . חשוב מכך, ההתנגדות של mt-Keima כדי השפלה lysosomal גורמת השילוב של האות mt-Keima lysosomes, המאפשר למדידה כמותית קל של פעילות mitophagy. השינוי פלורסצנטיות המתרחשת ב- mt-Keima ניתן לנתח באמצעות גם מיקרוסקופיה קונפוקלית או לזרום cytometry28,29. עם זאת, שיטה המבוססת על cytometry זרימה למדידת פעילות mitophagy באמצעות mt-Keima לא סופק בפירוט עד כה.
כאן, אנו מתארים את פרוטוקול מפורט עבור טכניקה המבוססת על cytometry זרימה למדידת פעילות mitophagy בתאים באמצעות mt-Keima. למרות שהראתי כאן כי ניתוח cytometry זרימה זוהה בהצלחה mitophagy CCCP-induced בתאים הלה לבטא פרקין, ניתן ליישם טכניקה זו מגוון רחב של סוגי תאים.
Protocol
1. דור של תאים הלה לבטא mito-Keima (mt-Keima)
-
הכנת mt-Keima lentivirus
- מעיל לצלחת תרבות 100-מ מ על-ידי הוספת 2 מ ל תמיסת 0.001% פולי-L-ליזין/פוספט-buffered (PBS), לאפשר לו לעמוד במשך 5 דקות בטמפרטורת החדר.
- הסר את הפתרון פולי-L-ליזין באמצעות פיפטה מזכוכית מחובר ואקום, כדי לבשל תרבות על-ידי הוספת 2 מ של 1 x PBS.
- צלחת 1.5 x 10 תאים6 HEK293T על תרבות מצופה צלחת עם 10 מ"ל של DMEM המכיל 10% FBS ו 1% פניצילין/סטרפטומיצין, התרבות התאים ב- 37 מעלות צלזיוס חממה תרביות רקמה של2 CO ליום אחד.
- Transfect µg 2 mt-Keima פלסמיד lentiviral29 ה-DNA יחד עם אריזה DNAs (psPAX 2 µg ו µg pVSVG 0.25) באמצעות תגובה כימית תקנים עבור 8 שעות בהתאם להוראות היצרן.
- מסיר את המדיה תרביות תאים ולהוסיף 8 מ של מדיה חדשה.
- לאסוף את המדיה המכילה חלקיקים נגיפיים 48 שעות מאוחר יותר. הסרת לכלוך הסלולר מהתקשורת שנאספו על ידי צנטריפוגה ב 500 g x עבור 5 דקות ולסנן אותם עם מסנן מזרק 0.45-מיקרומטר.
הערה: לשימוש ארוך טווח, להפוך aliquots של חלקיקים lentiviral ולאחסן את הדגימות ב-80 מעלות צלזיוס. הימנע העמדת הדגימות ויראלית כדי להקפיא-הפשרה מחזורי עבור זיהום ויראלי יעיל.
-
מדביק הלה-פרקין תאים עם mt-Keima lentivirus
- צלחת 5 x 104 הלה תאים המבטאים פרקין (הלה-פרקין) בצלחת תרבות 60 מ מ עם 4 מיליליטר DMEM המכיל 10% FBS ו 1% פניצילין/סטרפטומיצין ב 37 ° C יום אחד לפני הקטיף של lentivirus mt-Keima.
הערה: בהעדר פרקין אנדוגני, ביטוי תאים הלה30, התאים הלה-פרקין נהגו כאן יותר בבירור הצג CCCP-induced mitophagy. הליך זה ניתן גם ליישם שורות תאים ראשי או מונצחים אחרים. - להסיר את מדיום הגידול למחרת ולהוסיף 1 מ"ל של מדיה lentiviral mt-Keima. הוסף אוטם 2 נוספים של מדיום הגידול המכיל 3 µL של polybrene מניות פתרון (8 מ ג/מ ל מים מזוקקים). תקופת דגירה של יום אחד בחממה תרביות רקמה2 CO.
- להסיר את התערובת lentiviral mt-Keima למחרת ולשטוף את התאים פעמיים עם 1 x PBS. להוסיף 4 מיליליטר מדיום הגידול ולטפל בתאים עם 2 puromycin µg/mL במשך יומיים.
- לאחר יומיים של puromycin בחירה, להסיר את מדיום הגידול, לשטוף את התאים פעמיים עם 1 x PBS. הוסף את מדיום הגידול, התרבות התאים חממה2 CO עד השימוש.
הערה: בשיטה זו ניתן להחיל כדי ליצור תאים המבטאים stably mt-Keima, כולל שורות תאים ותאים יסוד אחרים.
- צלחת 5 x 104 הלה תאים המבטאים פרקין (הלה-פרקין) בצלחת תרבות 60 מ מ עם 4 מיליליטר DMEM המכיל 10% FBS ו 1% פניצילין/סטרפטומיצין ב 37 ° C יום אחד לפני הקטיף של lentivirus mt-Keima.
2. גרימת mitophagy באמצעות טיפול CCCP והכנת דוגמאות FACS
- צלחת 5 x 104 הלה-פרקין התאים לבטא mt-Keima בתרבות 60 מ מ צלחת עם 4 מיליליטר DMEM המכיל 10% FBS ו 1% פניצילין/סטרפטומיצין, תרבות עליהם ליום אחד ב- 37 מעלות צלזיוס חממה תרביות רקמה של2 CO.
- להסיר את מדיום הגידול למחרת ולהוסיף 4 מיליליטר DMEM טריים המכילים 10 מיקרומטר קרבוניל ציאניד m-chlorophenylhydrazone (CCCP). דגירה הלה-פרקין-mt-Keima בתאים חממה רקמות של2 CO במשך 6 שעות.
- להסיר את מדיום הגידול 6 שעות לאחר מכן, לשטוף את התאים עם 2 מ ל 1 x PBS. לנתק את התאים אם תתייחס אליהם עם פתרון טריפסין/EDTA, בטל את טריפסין על-ידי הוספת מדיום הגידול המכיל 10% FBS. העבר את התאים לתוך צינור חרוטי 15-mL.
- Centrifuge התאים ב 500 g x במשך 5 דקות.
- בזהירות להסיר את מדיום הגידול על ידי השאיפה, resuspend את התאים עם 1 מ"ל של PBS קר 1 x.
- העברת תאים לתוך הצינור FACS המתאימה ומניחים אותו על קרח.
הערה: להכין תאים הלה נגוע כפקד שלילי.
הערה: התאים קיימא על קרח למשך מספר שעות, mt-Keima קרינה פלואורסצנטית אותות גם נשארים בעינם.
3. FACS ניתוח של mitophagy
הערה: במחקר זה, תאים נותחו עם cytometer זרימה מצויד עם לייזר 405 ננומטר, 561-nm. התאים היו נרגשים עם לייזר סגול (405 ננומטר) עם פליטה זוהה ליד 610 nm ± 10 גלאי BV605, עם לייזר צהוב וירוק (561 ננומטר) עם פליטה שזיהה-610 nm ± 10 גלאי PE-CF594 בו זמנית (איור 1).
-
Gating תאים חיים
- הפעל את הזרימה cytometer ואת המחשב ולהיכנס לתוך התוכנה ניתוח.
- ליצור התנסות חדשה או לשכפל ניסוי הקיים. כדי לעורר תאים עם הסגול (405 ננומטר) צהוב וירוק (561 ננומטר) לייזרים, לזהות פליטה-610 ± 10 ננומטר גלאי, בחר BV605 ו- PE-CF594 בנוסף פיזור קדמי (FSC) ואת הצד פיזור (האס) בחלון פרמטר ככל הנדרש fluorophores.
הערה: כל fluorophores צריכים להתווסף במצב לינארי. - מערבולת אגרגטים כל מדגם תא בקצרה כדי לפזר את התא.
- מקם את שפופרת המכילה את דגימת תאים שליטה הלה-פרקין זה לא נגוע lentivirus mt-Keima ביציאה הזרקה מדגם, ליחצו על כפתור "להריץ" cytometer.
- העלילה נקודה של FSC נגד האס, התאם את המתח FSC ואת האס למקום תאים במרכז העלילה נקודה.
- לצייר שער P1 שימוש בסמל מצולע בערך תאים חיים, לסלק תאים מתים ופסולת תאים (איור 2 א).
-
להתאים את המתחים לייזר סגול וירוק
- מקם את הצינור המכיל תאים הלה-פרקין נגועים lentivirus mt-Keima על הזריקה מדגם פורט, ליחצו על כפתור "להריץ" cytometer.
- העלילה נקודה של BV605 (405 ננומטר) לעומת האס, להתאים את המתח BV605 כך הלה-פרקין תאים המבטאים mt-Keima הם בבירור מכובד מתאי שליטה המבטאים לא mt-Keima (איור 2B).
- העלילה נקודה של PE-CF594 (561 ננומטר) לעומת האס, להתאים את המתח PE-CF594 כך הלה-פרקין תאים המבטאים mt-Keima הם בבירור מכובד מתאי שליטה (איור 2B).
-
להעריך את אחוז תאים mitophagy
- רוכשים את BV605 לעומת PE-CF594 נקודה מגרש באמצעות סרגל ליניארי. לצייר שער באמצעות הסמל מצולע סביב התאים לבטא mt-Keima, ולחסל התאים מבטאים mt-Keima (איור 3 א). האוכלוסייה זריחה-חיוביות תא mt-Keima נחשבת השער "mt-Keima".
- ליצור עוד נקודה מזימה של BV605 לעומת PE-CF594 מציג רק "הר-Keima"-מגודרת תאים. בעלילה זו נקודה ', צייר שער סביב התאים mt-Keima-חיובית ללא טיפול. הפעילות mitophagy הבסיס של שליטה הלה תאים הוא נמוך, היחס של פליטת-PE-CF594/BV605 הוא פחות מ- 1. לכן, שער זה מכונה השער "נמוך".
- צייר שער אחר המכיל אזור לעיל של השער "נמוך". שער זה מכונה השער 'גבוהה' מאחר שהוא מכיל תאים עם פעילות mitophagy גבוה, כלומר, תאים עם יחס גבוה של פליטת-PE-CF594/BV605 (איור 3B).
- כדי לחשב את אחוז תאים בשער 'גבוהה', בחר בתפריט "להראות היררכיה האוכלוסייה". הערך "אחוז של אב" (% האב) מייצג את אחוז תאים בשער 'גבוהה' בקרב האוכלוסייה mt-Keima-חיוביות.
- הגדר אירועים לפחות 10,000 להקליט בשער "mt-Keima" לעצור ולהפעיל כל דגימה.
תוצאות
דוגמה של ניתוח cytometry זרימה של CCCP-induced mitophagy בתאים הלה-פרקין מוצג באיור4. באמצעות שיטת הניתוח cytometry זרימה שתוארו לעיל, אנו יכולים להבחין עלייה דרמטית בתאים mitophagic בשער 'גבוהה'. אחוז תאים בשער 'גבוהה' היה גדל יותר 10-fold לעומת תאים שליטה ללא טיפול (איור 4A). זו עלייה בפעילות mitophagy בוטלה לחלוטין על ידי טיפול משותף עם bafilomycin A (BFA) (איור 4A , 4B).

איור 1 . ייצוג סכמטי של השיטה למדידת mitophagy עם cytometry זרימה. התכנית מתווה את השלבים העיקריים הנחוצים לכמת תאים שעברו mitophagy על ידי cytometry זרימה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 . הגדרת הזרימה פרמטרים cytometer. (א) Gating של תאים חיים. אזור של תאים חיים נקבע על FSC נגד האס מגרש כדי לא לכלול תאים מתים ופסולת תאים. (B) כוונון לייזרים 405 ננומטר, 531-nm שימוש בפקד הלה תאים, הלה תאים לביטוי mt-Keima. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3 . חישוב היחס של תאים mitophagic על ידי cytometry זרימה. (א) תאים Gating הלה לבטא mt-Keima. (B) Gating תאים mitophagic, חישוב שיעור השימוש בכלי הסטטיסטיקה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
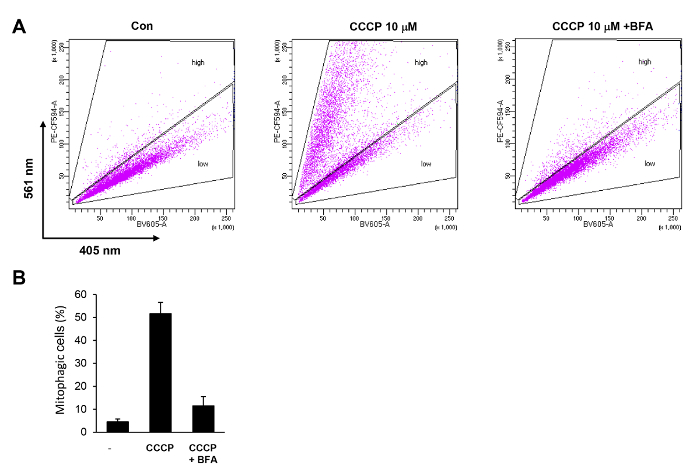
איור 4 . כימות של CCCP-induced mitophagy בתאים הלה מאת cytometry זרימה. (א) תאים הלה-פרקין לבטא mt-Keima שטופלו 10 מיקרומטר CCCP במשך 6 שעות עם או בלי nM 100 bafilomycin A (BFA). תאים נותחו על ידי FACS באמצעות גלאי BV605 ו- PE-CF594. תאים (B) עם יחס גבוה של PE-CF594/BV605 נבחרו ("גבוהה"), פרופורציה שלהם חושבה. התוצאות של 3 ניסויים חוזרים ונשנים מותוות עם סטיות תקן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כאן, אנו מציגים שיטה מהירה ורגיש באמצעות מיכשור למדידת פעילות הסלולר mitophagy בתאים המבטאים mt-Keima. תאים שעברו רמה גבוהה של mitophagy שהפגינו יחס מוגבר של PE-CF594 (561 ננומטר) / BV605 (405 ננומטר) עירור. לפיכך, ניתן לבטא פעילות mitophagy אחוז תאים מפגין יחס 561/405 גבוה. לנו לחשב את אחוז תאים באזור שער 'גבוהה' על מגרש נקודה של PE-CF594 (561 ננומטר) לעומת BV605 (405 ננומטר), התוצאות הראו כי טיפול עם CCCP המושרה עלייה mitophagy בתאים הלה-פרקין. אנחנו בעבר הראו כי ביטוי בתיווך lentivirus של mt-Keima עצמה משפיעה על תפקוד מיטוכונדריאלי או פיסיולוגיה תאית31. למרות הראינו בכתב היד שלנו הניתוח cytometry זרימה בהצלחה לזהות CCCP-induced mitophagy של הלה תאים המבטאים פרקין, טכניקה זו ניתן להחיל על כל סוג של תא לאחר החדרת mt-Keima. בעבר הראנו שאת mitophagy הנוצרות על-ידי היפוקסיה יכול להתגלות בתאים הלה מבלי פרקין חוץ רחמי ביטוי29. בנוסף, מחקרים קודמים, כולל שלנו ואלו של קבוצות אחרות, הראתה כי ניתוח פלורסצנטיות mt-Keima יכול לזהות mitophagy בתאים הראשי כגון העכבר מתחלקים fibroblasts (MEFs), מונצחים תאים כגון תאים הלה, HEK293 ו- SH-SY5Y 28 , 29 , 32.
לעומת מבחני מבוסס מיקרוסקופיה מבוססי immunoblotting או mitophagy אחרים, מבחני cytometry זרימה יש יתרונות בכך שהם מאפשרים ניתוח מהיר, לשחזור של מספר גדול של תאים31. לפיכך, ואילו מבוסס מיקרוסקופיה בניתוח, חוקר הטיה יכולה לעוות את תוצאות, הנטיה הזו אינה מהווה בעיה כאשר באמצעות מבחני cytometry זרימה.
פחות מ 1 x 106 תאים נדרשים לניתוח cytometry זרימה. בנוסף, כי הניתוח של מדגם לוקח רק 1-2 דקות, עד עשרות דוגמאות ניתן לנתח תוך 1-2 שעות. יתר על כן, מבחני cytometry זרימה יכול לזהות מגביר בתאים mitophagic עם רגישות טובה. בניתוח cytometry זרימה שלנו, הבחנו בגידול תאים mitophagic 10-fold אחרי 6 שעות של טיפול עם CCCP.
השלב הקריטי עבור ניתוח mitophagy באמצעות cytometry זרימה הוא להגדיר את השערים "גבוהה" ו "נמוך" כראוי כדי להבחין בין תאים שעברו רמה גבוהה של mitophagy. מכיוון mitophagy הבזליים רמות עשויים להיות שונים בהתאם לסוג התא, קביעת השער גבוהה"ו-"נמוך"עלול להיות קשה כמה שורות תאים. במקרה כזה, מומלץ לכלול קו תא שליטה בפעילות mitophagy הבסיס נמוך כגון תאים הלה. בנוסף, עבור תאים שטופלו מעכב lysosomal כגון כלורוקין, bafilomycin A ניתן לכלול כפקד mitophagy נמוך כדי להגדיר gating הנכון. למרות lentiviruses משמשים בדרך כלל עבור הביטוי חוץ רחמי של חלבונים מעניין, כמה שורות תאים יכולים להיות פגיעים לזיהום וירוס. אם זיהום lentivirus עצמו תוצאות השינויים צמיחת תאים או בפונקציה המיטוכונדריה, שיטה נוספת להתייחס לביטוי mt-Keima. רמת ביטוי של mt-Keima יכול להשתנות גם בהתאם לסוג התא. אם האות פלורסצנטיות mt-Keima הוא חלש מדי או יותר מדי הטרוגנית, רק התאים עם קליטה פלורסצנטיות חזקה mt-Keima ניתן לאסוף באמצעות של סדרן התא או התאים mt-Keima מטופלים שוב עם ריכוז גבוה יותר של אנטיביוטיקה puromycin במשך כמה ימים . האות mt-Keima של התאים מנותקת יציבים ככל התאים קיימא, אך אנו ממליצים ניתוח הדגימות מאת cytometry זרימה מהר ככל האפשר.
שלנו assay cytometry זרימה היא שיטה חזקה ונוחה לניתוח mitophagy, אך ישנן כמה מגבלות. קודם כל, כי התאים להפרידם כמו רמה תא בודד עבור cytometry זרימה, שיטה זו היא קשה להחיל לניתוח את mitophagy של הרקמות או האיברים מבלי לשנות את הפיזיולוגיה. בנוסף, זריחה mt-Keima מאבד את מאפייניה תלויי-pH לאחר קיבוע, לפיכך, כל הדגימות צריך להיות מנותח כמו תאים חיים. התוצאה היא המגבלה של אחסון מדגם שהוזכרו לעיל, הגבלה נוספת בשעת החלת על הכתם immunofluorescence נוספים. טכניקה זו ניתן למדוד פעילות mitophagy באופן כמותי, אבל זה לא ניתן לעקוב אחר שינויים מורפולוגיה מיטוכונדריאלי או דינמיקה, אשר ידועים תפקיד חשוב בתהליך mitophagy9. חוקרים יש לזכור את המורכבות ואת לא נקבע היבטים של mitophagy. לכן, כדי למנוע משפח אפשרי, תהליך mitophagy צריך להיות עוד יותר מאושרות על ידי התוצאות המשולבות של שיטות ניתוח נפוצות אחרות mitophagy, כולל מיקרוסקופ אלקטרונים, חלבון מיטוכונדריאלי מחזור, צמצום דנ א מיטוכונדריאלי, מיקרוסקופיה פלורסצנטיות מדידה את colocalization של המיטוכונדריה עם lysosomes או autophagosomes כפי שתואר לעיל34,33,35. כל נצפתה עלייה של mitophagy אפשר גם עוד יותר לבחון דרך מיקרוסקופיה קונפוקלית של תאים המבטאים mt-Keima. בתאים mitophagic, mt-Keima מתבטא דפוס punctate בהיר עם יחס 586/440 גבוה זה יכול להיות שנצפו תחת מיקרוסקופיה קונפוקלית28,29.
בהתחשב ביכולת לאתר במהירות וברגישות mitophagy, זו assay cytometry זרימה מספקת הערכה הראשונה-צעד זה יהיה ערך למגוון רחב של מחקרים. מאת פשוט להדביק תאים עם lentivirus mt-Keima, שינויים בפעילות mitophagy ניתן בקלות למדוד בכל סוג התא הרצוי. בשילוב עם הפונקציה סדרן התא, תאים עם רמה מסוימת של פעילות mitophagy יכול להיות במיוחד מבודד ומשמשת ללמוד את התפקידים של מנגנוני הרגולציה שבבסיס mitophagy.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק הלאומי מחקר קרן של קוריאה (2016R1D1A1B03931949) (י א), ועל ידי קרן המחקר הלאומי של קוריאה (NRF) גרנט במימון government(MSIT) קוריאה (2016R1A2B2008887 מס, מס 2016R1A5A2007009) (כדי J.Y .)
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| poly-L-lysine | Sigma-Aldrich | P2636 | |
| FBS | GIBCO | 16000-044 | |
| penicillin/streptomycin | wellgene | LS202-02 | |
| PBS | Hyclone | SH30013.02 | |
| HEK293T | ATCC | CRL-3216 | |
| DMEM | GIBCO | 12800-082 | |
| OPTI-MEM | GIBCO | 31985-070 | |
| Turbofect | Thermos scientific | R0531 | |
| 0.45 μm syringe filter | sartorius | 16555 | |
| HeLa | ATCC | CCL-2 | |
| polybrene | Sigma-Aldrich | H9268 | 8 mg/ml |
| puromycin | Sigma-Aldrich | P8833 | 2 mg/ml |
| Carbonyl cyanide m-chlorophenyl hydrazine (CCCP) | Sigma-Aldrich | C2759 | 10 mM |
| trypsin-EDTA | wellgene | LS015-01 | |
| EQUIPMENTS | |||
| BD LSRFortessa | BD Bioscience | LSRFortessa | |
| FACSDIVA | BD Bioscience | FACSDIVA (v8.0.1) |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), R551-R560 (2006).
- Zorov, D. B., Krasnikov, B. F., Kuzminova, A. E., Vysokikh, M., Zorova, L. D. Mitochondria revisited. Alternative functions of mitochondria. Bioscience Reports. Bioscience Reports. 17 (6), 507-520 (1997).
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nature Reviews Genetics. 6 (5), 389-402 (2005).
- Galluzzi, L., Kepp, O., Trojel-Hansen, C., Kroemer, G. Mitochondrial control of cellular life, stress, and death. Circulation Research. 111 (9), 1198-1207 (2012).
- Kang, D., Hamasaki, N. Alterations of mitochondrial DNA in common diseases and disease states: aging, neurodegeneration, heart failure, diabetes, and cancer. Current Medicinal Chemistry. 12 (4), 429-441 (2005).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Wallace, D. C., Brown, M. D., Melov, S., Graham, B., Lott, M. Mitochondrial biology, degenerative diseases and aging. BioFactors. 7 (3), 187-190 (1998).
- Yun, J., Finkel, T. Mitohormesis. Cell Metabolism. 19 (5), 757-766 (2014).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20 (1), 31-42 (2013).
- Clark, I. E., et al. Drosophila pink1 is required for mitochondrial function and interacts genetically with parkin. Nature. 441 (7097), 1162-1166 (2006).
- Park, J., et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin. Nature. 441 (7097), 1157-1161 (2006).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. The Journal of Cell Biology. 183 (5), 795-803 (2008).
- Zhu, J., Wang, K. Z., Chu, C. T. After the banquet: Mitochondrial biogenesis, mitophagy, and cell survival. Autophagy. 9 (11), 1663-1676 (2013).
- Um, J. H., Yun, J. Emerging role of mitophagy in human diseases and physiology. BMB Reports. 50 (6), 299-307 (2017).
- Al Rawi, S., et al. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 334 (6059), 1144-1147 (2011).
- Kim, M. J., et al. SESN2/sestrin2 suppresses sepsis by inducing mitophagy and inhibiting NLRP3 activation in macrophages. Autophagy. 12 (8), 1272-1291 (2016).
- Kim, M. J., Yoon, J. H., Ryu, J. H. Mitophagy: A balance regulator of NLRP3 inflammasome activation. BMB Reports. 49 (10), 529-535 (2016).
- Sandoval, H., et al. Essential role for Nix in autophagic maturation of erythroid cells. Nature. 454 (7201), 232-235 (2008).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Geisler, S., et al. PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1. Nature Cell Biology. 12 (2), 119-131 (2010).
- Matsuda, N., et al. PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy. The Journal of Cell Biology. 189 (2), 211-221 (2010).
- Allen, G. F., Toth, R., James, J., Ganley, I. G. Loss of iron triggers PINK1/Parkin-independent mitophagy. EMBO Reports. 14 (12), 1127-1135 (2013).
- Chu, C. T., et al. Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nature Cell Biology. 15 (10), 1197-1205 (2013).
- Kubli, D. A., et al. PINK1 Is dispensable for mitochondrial recruitment of Parkin and activation of mitophagy in cardiac myocytes. PloS One. 10 (6), e0130707(2015).
- Dolman, N. J., Chambers, K. M., Mandavilli, B., Batchelor, R. H., Janes, M. S. Tools and techniques to measure mitophagy using fluorescence microscopy. Autophagy. 9 (11), 1653-1662 (2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chemistry & Biology. 18 (8), 1042-1052 (2011).
- Lee, I. H., Yun, J., Finkel, T. The emerging links between sirtuins and autophagy. Methods in Molecular Biology. 1077, 259-271 (2013).
- Sun, N., et al. Measuring In vivo Mitophagy. Molecular Cell. 60 (4), 685-696 (2015).
- Denison, S. R., et al. Alterations in the common fragile site gene Parkin in ovarian and other cancers. Oncogene. 22 (51), 8370-8378 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: Basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Bingol, B., et al. The mitochondrial deubiquitinase USP30 opposes parkin-mediated mitophagy. Nature. 510 (7505), 370-375 (2014).
- Burbulla, L. F., Kruger, R. The use of primary human fibroblasts for monitoring mitochondrial phenotypes in the field of Parkinson's disease. Journal of Visualized Experiments. 68, e4228(2012).
- Di Sante, G., Casimiro, M. C., Pestell, T. G., Pestell, R. G. Time-lapse video microscopy for assessment of EYFP-Parkin aggregation as a marker for cellular mitophagy. Journal of Visualized Experiments. 111, e53657(2016).
- Fang, E. F., et al. In vitro and in vivo detection of mitophagy in human cells, C. Elegans, and mice. Journal of Visualized Experiments. 129, e56301(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved