Method Article
قياس ميتوفاجي الحساسة بالتدفق الخلوي استخدام تعتمد على درجة الحموضة "مراسل الفلورسنت" طن متري-كيما
In This Article
Summary
قد تورط في التوازن المتقدرية ميتوفاجي، تدهور انتقائية من الميتوكوندريا، وهو رفع الضوابط التنظيمية في مختلف الأمراض التي تصيب الإنسان. ومع ذلك، ملاءمة الأساليب التجريبية لقياس النشاط ميتوفاجي محدودة للغاية. هنا، نحن نقدم مقايسة حساسة لقياس نشاط ميتوفاجي باستخدام التدفق الخلوي.
Abstract
ميتوفاجي عملية إزالة انتقائية من الميتوكوندريا معطوب أو غير الضرورية باستخدام جهاز أوتوفاجي. وجدت روابط وثيقة بين ميتوفاجي المعيبة والأمراض البشرية المختلفة، بما في ذلك أمراض الأعصاب والسرطان والأمراض الأيضية. وبالإضافة إلى ذلك، أظهرت دراسات أجريت مؤخرا أن ميتوفاجي وتشارك في العمليات الخلوية العادية، مثل التمايز والتنمية. ومع ذلك، بدور محدد والآليات الجزيئية الكامنة وراء ميتوفاجي تتطلب مزيدا من الدراسة. ولذلك، من المهم لتطوير طريقة قوية وملائمة لقياس التغيرات في النشاط ميتوفاجي. هنا، يمكننا وصف بروتوكول مفصلة لتقييم كمي النشاط ميتوفاجي من خلال التدفق الخلوي استخدام البروتين الفلورسنت الميتوكوندريا التي تستهدف كيما (طن متري-كيما). ويمكن تحليل هذا الفحص الخلوي تدفق النشاط ميتوفاجي أكثر سرعة وحساسية من الأساليب التقليدية القائمة على الميكروسكوب أو إيمونوبلوتينج. يمكن تطبيق هذا البروتوكول لتحليل النشاط ميتوفاجي في مختلف أنواع الخلايا.
Introduction
الميتوكوندريا هي العضيات التي تعتبر ضرورية لتكاثر الخلايا وعلم وظائف الأعضاء. الميتوكوندريا المسؤولة عن توليد أكثر من 80 في المائة إمدادات ATP عن طريق الفسفرة، وكما أنها توفر مختلف المواد الوسيطة الأيضية للتركيب الحيوي والاستقلاب1،2. بالإضافة إلى أدوارها في إمدادات الطاقة والايض، الميتوكوندريا تلعب أدواراً مركزية في العديد من العمليات الهامة الأخرى، بما في ذلك توليد الأنواع (روس) الأكسجين التفاعلية، وتنظيم موت الخلية وداخل الخلية Ca2 + ديناميات3 . وكانت التعديلات في الوظيفة المتقدرية المرتبطة بالأمراض التي تصيب الإنسان، بما في ذلك السرطان والسكري وأمراض الأعصاب المختلفة4،5. كما يعتقد أن تسهم في الشيخوخة العادية العمليات6،،من78زيادة خلل mitochondrial وطفرات الحمض النووي mitochondrial. ولذلك، مراقبة الجودة مسألة حاسمة في الميتوكوندريا. الميتوكوندريا هي العضيات شديد الحيوية التي يمكن بشكل مستمر تغيير شكلها بين شبكات ممدود والنموذج القصير، مجزأة. ديناميات الميتوكوندريا دوراً هاما في الحفاظ على وظيفة الميتوكوندريا، فضلا عن التدهور من خلال ميتوفاجي9.
ميتوفاجي هو إليه التي تنطوي على تدهور انتقائية الميتوكوندريا كاملة باستخدام جهاز أوتوفاجي. ميتوفاجي هو إليه المبدأ الأساسي معدل دوران mitochondrial وإزالة الميتوكوندريا التالفة أو مختلة. في هذه العملية، الميتوكوندريا أولاً يحيط بها غشاء، أسفر عن تشكيل أوتوفاجوسوميس، الذي ثم تلتحم مع lysosomes لتدهور هيدروليكي9. اقترحت الدراسات الوراثية السابقة في المورفولوجية أن اثنين الجينات المتعلقة بمرض باركنسون، والناجمة عن فتن كيناز المفترضة 1 (PINK1) (PARK6) وباركين (PARK2)، يعمل في نفس المسار10،11. وقد أظهرت الدراسات استأثر أن المسار باركين PINK1 هي المسؤولة عن القضاء على الميتوكوندريا التالفة والعيوب في هذه النتيجة الطريق في ميتوفاجي المختلة وظيفيا وقد تساهم في الأمراض البشرية12،13. مؤخرا وجدت عيوب في العمليات ميتوفاجي في الأمراض البشرية المختلفة، بما في ذلك السرطان وأمراض القلب، وأمراض الكبد و أمراض الأعصاب 14. وبالإضافة إلى ذلك، أظهرت الدراسات الحديثة أيضا أن ميتوفاجي أمر بالغ الأهمية للعديد من العمليات الفسيولوجية، مثل التمايز، والتنمية، والاستجابة المناعية15،،من1617،18 ،19، مما يوحي بأن ميتوفاجي قد تلعب دوراً أكثر نشاطا في السيطرة على وظائف الخلية.
وعلى الرغم من تأكيد الأخيرة أن ميتوفاجي دوراً هاما في مراقبة الجودة على حد سواء في الميتوكوندريا والأمراض البشرية، الآليات الجزيئية الكامنة وراء ميتوفاجي تظل ضعيفة مفهومة. على الرغم من أن الآليات ذات الصلة ميتوفاجي وقد درست بشكل منهجي في الخميرة، ركزت دراسات تهدف إلى استكشاف الآليات ذات الصلة ميتوفاجي في خلايا الثدييات أساسا على المسار PINK1 باركين. وقد أنشأت الدراسات السابقة أن المسار باركين PINK1 مسؤولة في المقام الأول لإزالة انتقائية من الميتوكوندريا التالفة عن طريق ميتوفاجي12،،من2021. ومع ذلك، أفادت الدراسات الأخيرة أن في بعض النماذج، يمكن تنشيط ميتوفاجي حتى في غياب الوظيفية PINK122،،من2324. هذه النتائج تشير إلى أنه بالإضافة إلى المسار PINK1 باركين، هناك طريقا مجهولة إضافية يمكن تنشيط ميتوفاجي.
عدم وجود طريقة ملائمة لتقييم نشاط ميتوفاجي هو عقبة رئيسية أمام استكشاف المسارات التي تنظم ميتوفاجي ودورها في الأحداث الفيزيولوجية المرضية. المجهر الإلكتروني أداة قوية لتصور مباشرة اجتاحت أوتوفاجوسومي الميتوكوندريا. ومع ذلك، الميكروسكوب الإلكتروني على القيود في التحديد الكمي لنشاط ميتوفاجي. على الرغم من أن السلسلة 3 (LC3) الضوء على الاستراتيجيات التي تستخدم المرتبطة microtubule البروتين-1-مترافق المسابير الفلورية، مثل التجارة والنقل-LC3، حاليا25النهج الأكثر استخداماً، وطبيعة عابرة للإشارة على أساس LC3 وبه نسبة عالية من إشارات إيجابية كاذبة الحد من حساسية للكشف عن ميتوفاجي في خلايا26. مزيج من النشاف الغربية لقياس مستوى البروتين المتقدرية، التحديد الكمي للحمض النووي، والتحليل المجهري الأسفار كولوكاليزي الميتوكوندريا مع أوتوفاجوسوميس أو ليسوسوميس سيكون أسلوباً جيدا لتقييم ميتوفاجي. مع ذلك، استدعاء القيود الكمي وعدم الملاءمة للمنهجيات القائمة للنهج الجديد. الأخذ بروتين فلوري جديدة تعتمد على درجة الحموضة، الهدف المتقدرية كيما (طن متري-كيما)، تحسنت القدرة على الكشف عن ميتوفاجي27. بالصمامات تسلسل المتقدرية استهداف الفسفرة التأكسدية فرعية الثامن (كوكس الثامن) في كيما، توجه كيما طن متري للمصفوفة المتقدرية. التحول الكبير في ذروة الإثارة من كيما من 440 نانومتر إلى 586 نانومتر (المقابلة للرقم الهيدروجيني 7 والرقم الهيدروجيني 4، على التوالي) يمكن أن تستخدم لتقييم ميتوفاجي مع حسن حس مرهف في على حد سواء في المختبر و في فيفو تجارب28،29 . الأهم من ذلك، يسبب مقاومة كيما طن متري إلى تدهور الليزوزومية دمج الإشارات كيما طن متري في lysosomes، مما يسمح للقياس الكمي سهل النشاط ميتوفاجي. الأسفار والتغيير الذي يحدث في النقل المتعدد الوسائط-كيما يمكن تحليلها باستخدام أما مجهرية [كنفوكل] أو التدفق الخلوي28،29. ومع ذلك، قدمت لا تدفق الخلوي طريقة لقياس نشاط ميتوفاجي باستخدام النقل المتعدد الوسائط-كيما بالتفصيل لتاريخ.
هنا، يمكننا وصف بروتوكول مفصل لتقنية تستند إلى قياس تدفق لقياس النشاط ميتوفاجي في الخلايا باستخدام النقل المتعدد الوسائط-كيما. على الرغم من أننا أظهرنا هنا أن التدفق الخلوي التحليل بنجاح الكشف عن ميتوفاجي ااحد المستحثة في خلايا هيلا معربا عن باركين، يمكن تطبيق هذا الأسلوب على مجموعة متنوعة واسعة من أنواع الخلايا.
Protocol
1-توليد خلايا هيلا معربا عن ميتو-كيما (طن متري-كيما)
-
إعداد lentivirus طن متري-كيما
- معطف صحن ثقافة 100 ملم بإضافة 2 مل من 0.001 ٪ بولي-L-يسين/الفوسفات-مخزنة المالحة (PBS) والسماح لها بالوقوف لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة الحل بولي-L-يسين باستخدام ماصة زجاجية متصل بفراغ وغسل الطبق الثقافة بإضافة 2 مل من 1 x PBS.
- لوحة 1.5 × 106 HEK293T الخلايا في ثقافة المغلفة طبق مع 10 مل دميم التي تحتوي على 10% FBS و 1% البنسلين/ستربتوميسين، والثقافة الخلايا عند 37 درجة مئوية في حاضنة استنبات الأنسجة2 CO لمدة يوم واحد.
- ترانسفيكت ميكروغرام 2 طن متري-كيما بلازميد لينتيفيرال29 الحمض النووي جنبا إلى جنب مع التغليف السلطات الوطنية المعينة (بسب 2 ميكروغرام وبفسفج 0.25 ميكروغرام) استخدام كاشف تعداء لح 8 وفقا لإرشادات الشركة المصنعة.
- قم بإزالة الوسائط تعداء وإضافة 8 مل وسائط جديدة.
- جمع الوسائط التي تحتوي على الجسيمات الفيروسية بعد 48 ساعة. إزالة الحطام الخلوية من الوسائط التي تم جمعها باستخدام الطرد المركزي في ز x 500 لمدة 5 دقائق وتصفية لهم مع عامل تصفية حقنه 0.45 ميكرومتر.
ملاحظة: للاستخدام على المدى الطويل، جعل مختبرين للجسيمات لينتيفيرال وتخزين العينات في-80 درجة مئوية. تجنب تعريض العينات الفيروسية لتجميد أذاب دورات للعدوى الفيروسية بكفاءة.
-
إصابة خلايا هيلا باركين مع لينتيفيروس طن متري-كيما
- لوحة 5 × 104 خلايا هيلا معربا عن Parkin (الحلة-باركين) في صحن ثقافة 60 ملم مع 4 مل دميم التي تحتوي على 10% FBS و 1% البنسلين/ستربتوميسين في 37 درجة مئوية يوم واحد قبل الحصاد lentivirus طن متري-كيما.
ملاحظة: بسبب غياب التعبير باركين الذاتية في هيلا الخلايا30، هيلا باركين الخلايا المستخدمة هنا بأكثر وضوح إظهار المستحثة ااحد ميتوفاجي. يمكن أيضا تطبيق هذا الإجراء إلى أخرى خطوط الخلايا الأولية أو مخلدة. - إزالة متوسط النمو في اليوم التالي وإضافة 1 مل وسائط النقل المتعدد الوسائط-كيما لينتيفيرال. إضافة 2 مل إضافية للنمو المتوسطة التي تحتوي على 3 ميليلتر لحل بوليبريني الأسهم (8 ملغ/مل بالماء المقطر). احتضان لمدة يوم واحد في حاضنة استنبات الأنسجة2 CO.
- إزالة الخليط لينتيفيرال كيما طن متري في اليوم التالي وتغسل الخلايا مرتين مع برنامج تلفزيوني 1 x. إضافة 4 مل متوسط النمو وعلاج الخلايا مع 2 ميكروغرام/مل بوروميسين لمدة يومين.
- بعد يومين اختيار بوروميسين، إزالة المتوسطة النمو، وتغسل الخلايا مرتين مع 1 x PBS. إضافة المتوسطة النمو، والثقافة الخلايا في حاضنة2 CO حتى الاستخدام.
ملاحظة: يمكن تطبيق هذا الأسلوب توليد خلايا ستابلي تعبر عن كيما طن متري، بما في ذلك خطوط الخلايا والخلايا الأولية الأخرى.
- لوحة 5 × 104 خلايا هيلا معربا عن Parkin (الحلة-باركين) في صحن ثقافة 60 ملم مع 4 مل دميم التي تحتوي على 10% FBS و 1% البنسلين/ستربتوميسين في 37 درجة مئوية يوم واحد قبل الحصاد lentivirus طن متري-كيما.
2-حمل ميتوفاجي استخدام العلاج ااحد وإعداد عينات نظام مراقبة الأصول الميدانية
- لوحة 5 × 104 هيلا باركين الخلايا معربا عن كيما طن متري في ثقافة 60 ملم طبق مع 4 مل دميم التي تحتوي على 10% FBS و 1% البنسلين/ستربتوميسين والثقافة منهم لمدة يوم واحد في 37 درجة مئوية في حاضنة استنبات الأنسجة2 CO.
- إزالة متوسط النمو في اليوم التالي وإضافة 4 مل دميم الطازجة التي تحتوي على 10 ميكرومتر الكربونيل السيانيد m-تشلوروفينيلهيدرازوني (CCCP). احتضان خلايا هيلا-باركين-mt-كيما في حاضنة أنسجة2 CO ح 6.
- إزالة متوسط نمو ح 6 في وقت لاحق وغسل الخلايا مع 2 مل من س 1 برنامج تلفزيوني. فصل الخلايا بمعاملتها بمحلول التربسين/يدتا وإلغاء تنشيط التربسين عن طريق إضافة متوسط النمو الذي يحتوي على 10% FBS. نقل الخلايا في أنبوب مخروطي 15 مل.
- الطرد المركزي الخلايا في ز x 500 لمدة 5 دقائق.
- بعناية إزالة المتوسطة النمو بالطموح وريسوسبيند الخلايا مع 1 مل من برنامج تلفزيوني الباردة x 1.
- نقل الخلايا في أنبوب نظام مراقبة الأصول الميدانية المناسبة ووضعه على الجليد.
ملاحظة: إعداد مصابة هيلا الخلايا كعنصر سلبي.
ملاحظة: خلايا قابلة للتطبيق على الجليد لعدة ساعات، وأيضا إشارات fluorescence طن متري-كيما لا تزال مستقرة.
3-نظام مراقبة الأصول الميدانية التحليل من ميتوفاجي
ملاحظة: في هذه الدراسة، تم تحليل الخلايا مع سيتوميتير تدفق مزودة بليزر 405-شمال البحر الأبيض المتوسط، وشمال البحر الأبيض المتوسط-561. الخلايا كان متحمس مع ليزر بنفسجي (405 نانومتر) مع الانبعاثات التي اكتشفت في 610 ± 10 نانومتر مع جهاز كشف BV605 وليزر الأخضر الأصفر (561 nm) مع الانبعاثات التي اكتشفت في 610 ± 10 نانومتر بجهاز كشف PE-CF594 في وقت واحد (الشكل 1).
-
الخلايا الحية النابضة
- بدوره على تدفق سيتوميتير وجهاز الكمبيوتر وتسجيل الدخول إلى برنامج التحليل.
- إنشاء تجربة جديدة أو تكرار تجربة الحالية. إثارة الخلايا التي تحتوي الأشعة فوق البنفسجية (405 نانومتر) والأصفر والأخضر (561 nm) ليزر والكشف عن الانبعاثات في شمال البحر الأبيض المتوسط ± 10 610 للكشف عن، حدد BV605 و PE-CF594 بالإضافة إلى الأمام مبعثر (FSC) والجانب مبعثر (SSC) في إطار المعلمة ك fluorophores المطلوبة.
ملاحظة: ينبغي إضافة جميع فلوروفوريس بطريقة خطية. - دوامة كل عينة خلية بإيجاز لتفريق خلية المجاميع.
- ضع الأنبوبة المحتوية على عينة خلية مراقبة باركين هيلا مصاب لا لينتيفيروس طن متري-كيما على المنفذ حقن العينة واضغط على زر "تشغيل" على سيتوميتير.
- في المؤامرة دوت من منتدى التعاون الأمني مقابل التعاون بين بلدان الجنوب، وضبط الجهد منتدى التعاون الأمني، والتعاون بين بلدان الجنوب لوضع الخلايا في مركز الأرض نقطة.
- رسم بوابة P1 استخدام رمز المضلع حول الخلايا الحية والقضاء على الخلايا الميتة والخلية الحطام (الشكل 2A).
-
ضبط الفولتية لليزر البنفسجي والأخضر
- ضع الأنبوبة التي تحتوي على خلايا هيلا باركين المصابين لينتيفيروس طن متري-كيما على حقن عينة الميناء، واضغط على زر "تشغيل" على سيتوميتير.
- في مؤامرة نقطة من BV605 (405 nm) مقابل التعاون بين بلدان الجنوب، ضبط الجهد BV605 حيث أن خلايا هيلا باركين معربا عن النقل المتعدد الوسائط-كيما يتم التمييز بوضوح بين من مراقبة الخلايا التي لا تعبر عن النقل المتعدد الوسائط-كيما (الشكل 2).
- في مؤامرة دوت من PE-CF594 (561 nm) مقابل التعاون بين بلدان الجنوب، ضبط الجهد PE-CF594 حيث أن خلايا هيلا باركين معربا عن النقل المتعدد الوسائط-كيما يتم التمييز بوضوح بين من مراقبة الخلايا (الشكل 2).
-
تقدير النسبة المئوية للخلايا في ميتوفاجي
- الحصول على BV605 مقابل الأرض دوت PE CF594 استخدام مقياس خطي. رسم بوابة استخدام رمز المضلع حول الخلايا معربا عن كيما طن متري، والقضاء على الخلايا التي لم تعرب عن طن متري-كيما (الشكل 3A). السكان خلية مصابات بالأسفار طن متري-كيما يشار إلى بوابة "mt-كيما".
- إنشاء آخر نقطة الأرض من BV605 مقابل PE-CF594 عرض فقط "mt-كيما"-بوابات الخلايا. في هذه المؤامرة دوت، رسم بوابة حول غير المعالجة طن متري-كيما-إيجابية الخلايا. النشاط القاعدي ميتوفاجي لمراقبة هيلا الخلايا منخفض، وأن نسبة الانبعاثات في PE-CF594/BV605 هي أقل من 1. وهكذا، يشار إلى هذه البوابة كبوابة "منخفضة".
- رسم آخر بوابة تحتوي على المنطقة المذكورة أعلاه من بوابة "منخفضة". هذه البوابة يشار إلى بوابة "عالية" لأنه يحتوي على خلايا بنشاط ميتوفاجي عالية، وهي الخلايا التي تحتوي على نسبة عالية من الانبعاثات في PE-CF594/BV605 (الشكل 3B).
- لحساب النسبة المئوية للخلايا في بوابة "عالية"، حدد من القائمة "إظهار التسلسل الهرمي السكان". تمثل القيمة "% من الأصل" (% الأصل) النسبة المئوية للخلايا في بوابة "عالية" بين السكان طن متري-كيما-إيجابية.
- تعيين الأحداث 10,000 على الأقل سجل في بوابة "mt-كيما" إيقاف وتشغيل كل عينة.
النتائج
ويرد مثال على تحليل التدفق الخلوي ميتوفاجي ااحد المستحثة في خلايا هيلا باركين في الشكل 4. استخدام أسلوب التحليل الخلوي التدفق الوارد وصفها أعلاه، يمكننا الكشف عن زيادة هائلة في الخلايا ميتوفاجيك في بوابة "عالية". النسبة المئوية للخلايا في بوابة "عالية" زاد أكثر من 10 إضعاف بالمقارنة مع الخلايا التحكم غير المعالجة (الشكل 4 أ). هذه الزيادة في النشاط ميتوفاجي ألغى تماما بالعلاج المشترك مع بافيلوميسين A (واو) (الشكل 4A و 4B).

الشكل 1 . التمثيل التخطيطي للطريقة المستخدمة لقياس ميتوفاجي مع التدفق الخلوي- المخطط يبين الخطوات الرئيسية اللازمة لتحديد الخلايا التي تمر ميتوفاجي بالتدفق الخلوي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 . إعداد تدفق المعلمات سيتوميتير. (أ) Gating الخلايا الحية. تم تحديد منطقة للخلايا الحية في منتدى التعاون الأمني مقابل الأرض SSC لاستبعاد الخلايا الميتة والخلية من الحطام. (ب) ضبط الليزر 405-شمال البحر الأبيض المتوسط، وشمال البحر الأبيض المتوسط-531 استخدام التحكم هيلا هيلا وخلايا الخلايا كيما طن متري وإذ تعرب عن. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3 . حساب نسبة الخلايا ميتوفاجيك بالتدفق الخلوي. (أ) خلايا هيلا Gating معربا عن كيما طن متري. (ب) النابضة الخلايا ميتوفاجيك وحساب نسبة استخدام الأداة الإحصائية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
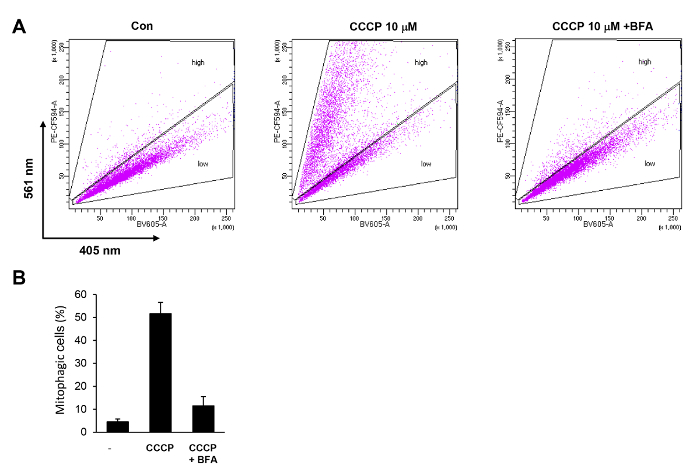
الشكل 4 . التحديد الكمي ميتوفاجي ااحد المستحثة في خلايا هيلا بالتدفق الخلوي. (أ) خلايا هيلا باركين معربا عن النقل المتعدد الوسائط-كيما تعامل مع 10 ميكرون ااحد ح 6 مع أو بدون بافيلوميسين شمال البحر الأبيض المتوسط 100 ألف (واو). تم تحليل الخلايا باستخدام BV605 و PE CF594 للكشف عن نظام مراقبة الأصول الميدانية. تم تحديد خلايا (ب) مع ارتفاع نسبة PE-CF594/BV605 ("عالي")، وتم حساب النسبة. يتم رسم نتائج ثلاث تجارب متكررة مع الانحرافات المعيارية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
نقدم هنا، طريقة سريعة وحساسة لاستخدام التدفق الخلوي لقياس النشاط ميتوفاجي الخلوية في الخلايا معربا عن كيما طن متري. يحمل الخلايا تمر بمستوى عال من ميتوفاجي زيادة نسبة PE-CF594 (561 nm)/BV605 (405 nm) الإثارة. وهكذا، يمكن التعبير عن نشاط ميتوفاجي بالنسبة المئوية للخلايا العارضة ارتفاع نسبة 561/405. قمنا بحساب النسبة المئوية للخلايا في منطقة بوابة "عالية" في مؤامرة دوت من PE-CF594 (561 nm) مقابل BV605 (405 نانومتر)، وأظهرت النتائج أن المعاملة مع ااحد الناجم عن زيادة في ميتوفاجي في خلايا هيلا باركين. أظهرنا سابقا أن overexpression lentivirus بوساطة من طن متري-كيما لا نفسها تؤثر على الوظيفة المتقدرية أو الفيزيولوجيا الخلوية31. على الرغم من أننا أظهرنا في مخطوطة لدينا أن التدفق الخلوي التحليل يمكن بنجاح الكشف عن الخلايا المستحثة ااحد ميتوفاجي في الحلة معربا عن باركين، هذه التقنية يمكن تطبيقها على أي نوع من الخلايا بعد إدخال كيما طن متري. واظهرنا سابقا يمكن أن يتم الكشف عن أن ميتوفاجي الناجمة عن نقص في خلايا هيلا دون حمل خارج الرحم باركين التعبير29. وبالإضافة إلى ذلك، أظهرت أن تحليل fluorescence طن متري-كيما يمكن الكشف عن ميتوفاجي في الخلايا الأولية مثل الخلايا الليفية الجنينية الماوس (MEFs) الدراسات السابقة، بما في ذلك بلدنا، والفئات الأخرى، وخلد الخلايا مثل خلايا هيلا، HEK293، و SY5Y ش 28 , 29 , 32.
بالمقارنة مع فحوصات ميتوفاجي إيمونوبلوتينج المستندة إلى الفحص المجهري أو غيرها، التدفق الخلوي معبراً بمزايا في ذلك أنها تسمح للتحليلات السريعة واستنساخه بعدد كبير من الخلايا31. ومن ثم، في حين يمكن أن تشوه تحيز الباحث في التحليلات المستندة إلى الفحص المجهري، النتائج، هذا التحيز ليس مسألة عند استخدام التدفق الخلوي فحوصات.
أقل من 1 × 106 خلايا مطلوبة من أجل تحليل التدفق الخلوي. وبالإضافة إلى ذلك، نظراً لأن تحليل عينة تستغرق دقائق واحد إلى اثنين فقط، يمكن تحليل تصل إلى العشرات من عينات داخل من ساعة إلى ساعتين. وعلاوة على ذلك، يمكن كشف التدفق الخلوي فحوصات زيادات في الخلايا ميتوفاجيك مع حساسية جيدة. في تحليلنا قياس التدفق، اكتشفنا بزيادة الوقت في الخلايا ميتوفاجيك بعد ح 6 المعاملة مع ااحد.
أن الخطوة الحاسمة لتحليل ميتوفاجي استخدام التدفق الخلوي تعيين غيتس "عال" و "منخفضة" بشكل صحيح التمييز بين الخلايا تمر بمستوى عال من ميتوفاجي. نظراً للمستويات القاعدية ميتوفاجي يمكن أن تختلف تبعاً لنوع الخلية، قد يكون صعباً في بعض خطوط الخلايا إعداد بوابة "عال" و "منخفضة". في هذه حالة، يكون من المفيد تضمين خط خلية تحكم بنشاط منخفض ميتوفاجي القاعدية مثل خلايا هيلا. وبالإضافة إلى ذلك، بافيلوميسين أ للخلايا تعامل مع مثبط الليزوزومية مثل الكلوروكين، يمكن إدراجها كعنصر تحكم ميتوفاجي منخفضة لإعداد النابضة الصحيح. على الرغم من أن لينتيفيروسيس تستخدم عادة للتعبير حمل خارج الرحم من البروتينات مثيرة للاهتمام، بعض خطوط الخلايا يمكن أن تكون عرضه للإصابة بالفيروس. إذا كانت العدوى lentivirus نفسها ينتج عن التغيرات في نمو الخلايا أو وظيفة الميتوكوندريا، ينبغي النظر في أسلوب آخر للتعبير كيما طن متري. مستوى التعبير طن متري-كيما يمكن أيضا أن تختلف تبعاً لنوع الخلية. إذا كانت إشارة fluorescence طن متري-كيما ضعيفة للغاية أو غير متجانسة جداً، يمكن جمعها فقط الخلايا مع إشارة قوية طن متري-كيما fluorescence استخدام أرز خلية أو الخلايا طن متري-كيما تعامل مرة أخرى بتركيز أعلى من المضادات الحيوية بوروميسين لعدة أيام . إشارة كيما طن متري من الخلايا المنفصلة مستقرة ما دام قابلة للخلايا، ولكن نوصي بتحليل العينات من التدفق الخلوي، في أسرع وقت ممكن.
لدينا التدفق الخلوي والرزن وسيلة قوية ومريحة للتحليل ميتوفاجي، ولكن هناك بعض القيود. أولاً، لأنه ينبغي فصل الخلايا كمستوى خلية مفردة للتدفق الخلوي، هذا الأسلوب من الصعب تطبيقه لتحليل ميتوفاجي للأنسجة أو الأجهزة دون تغيير الفسيولوجيا. وباﻹضافة إلى ذلك، الأسفار طن متري-كيما يفقد خصائصه تعتمد على درجة الحموضة بعد التثبيت، وهكذا، يجب أن يتم تحليل جميع العينات كخلايا حية. هذه النتائج في الحد تخزين العينات المذكورة أعلاه وقيد آخر عند تطبيق وصمة عار الفلورة إضافية. هذا الأسلوب يمكن قياس النشاط ميتوفاجي كمياً، إلا أنها غير قادر على رصد التغيرات في مورفولوجيا المتقدرية أو الديناميات، التي من المعروف أن تلعب أدواراً هامة في عملية ميتوفاجي9. الباحثين ينبغي أن نأخذ في الاعتبار تعقيد وجوانب غير محددة من ميتوفاجي. ولذلك، تفاديا لسوء التقدير ممكن، عملية ميتوفاجي ينبغي زيادة تأكيد بالجمع بين نتائج أخرى أساليب التحليل ميتوفاجي المشتركة، بما في ذلك المجهر الإلكتروني، ودوران البروتين المتقدرية، انخفاضا في الحمض النووي، والفحص المجهري fluorescence قياس كولوكاليزيشن الميتوكوندريا مع lysosomes أو أوتوفاجوسوميس كالموصوفة سابقا33،،من3435. يمكن أيضا دراسة أي الزيادة الملحوظة من ميتوفاجي عن طريق الفحص المجهري [كنفوكل] خلايا معربا عن النقل المتعدد الوسائط-كيما كذلك. في الخلايا ميتوفاجيك، يعبر عن النقل المتعدد الوسائط-كيما في نمط الشروريه مشرقة مع ارتفاع نسبة 586/440 التي يمكن ملاحظتها تحت المجهر [كنفوكل]28،29.
نظراً لقدرتها على اكتشاف بسرعة وحس مرهف ميتوفاجي، يوفر هذا الفحص الخلوي تدفق تقريب الخطوة الأولى التي ستكون ذات قيمة لمجموعة متنوعة من الدراسات. بمجرد إصابة الخلايا مع لينتيفيروس طن متري-كيما، يمكن التغيرات في نشاط ميتوفاجي بسهولة من التدبير في أي نوع من أنواع الخلايا المطلوب. بالاقتران مع الدالة cell فارز، يمكن على وجه التحديد عزل الخلايا التي تحتوي على مستوى معين من النشاط ميتوفاجي والمستخدمة لدراسة أدوار والآليات التنظيمية التي تقوم عليها ميتوفاجي.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل بمنحه من "مؤسسة أبحاث كوريا الوطنية" (2016R1D1A1B03931949) (لشين ياء)، ومؤسسة "البحوث الوطنية" في كوريا (جبهة الخلاص الوطني) منحة ممولة من government(MSIT) كوريا (رقم 2016R1A2B2008887 ورقم 2016R1A5A2007009) (إلى J.Y .)
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| poly-L-lysine | Sigma-Aldrich | P2636 | |
| FBS | GIBCO | 16000-044 | |
| penicillin/streptomycin | wellgene | LS202-02 | |
| PBS | Hyclone | SH30013.02 | |
| HEK293T | ATCC | CRL-3216 | |
| DMEM | GIBCO | 12800-082 | |
| OPTI-MEM | GIBCO | 31985-070 | |
| Turbofect | Thermos scientific | R0531 | |
| 0.45 μm syringe filter | sartorius | 16555 | |
| HeLa | ATCC | CCL-2 | |
| polybrene | Sigma-Aldrich | H9268 | 8 mg/ml |
| puromycin | Sigma-Aldrich | P8833 | 2 mg/ml |
| Carbonyl cyanide m-chlorophenyl hydrazine (CCCP) | Sigma-Aldrich | C2759 | 10 mM |
| trypsin-EDTA | wellgene | LS015-01 | |
| EQUIPMENTS | |||
| BD LSRFortessa | BD Bioscience | LSRFortessa | |
| FACSDIVA | BD Bioscience | FACSDIVA (v8.0.1) |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), R551-R560 (2006).
- Zorov, D. B., Krasnikov, B. F., Kuzminova, A. E., Vysokikh, M., Zorova, L. D. Mitochondria revisited. Alternative functions of mitochondria. Bioscience Reports. Bioscience Reports. 17 (6), 507-520 (1997).
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nature Reviews Genetics. 6 (5), 389-402 (2005).
- Galluzzi, L., Kepp, O., Trojel-Hansen, C., Kroemer, G. Mitochondrial control of cellular life, stress, and death. Circulation Research. 111 (9), 1198-1207 (2012).
- Kang, D., Hamasaki, N. Alterations of mitochondrial DNA in common diseases and disease states: aging, neurodegeneration, heart failure, diabetes, and cancer. Current Medicinal Chemistry. 12 (4), 429-441 (2005).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Wallace, D. C., Brown, M. D., Melov, S., Graham, B., Lott, M. Mitochondrial biology, degenerative diseases and aging. BioFactors. 7 (3), 187-190 (1998).
- Yun, J., Finkel, T. Mitohormesis. Cell Metabolism. 19 (5), 757-766 (2014).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20 (1), 31-42 (2013).
- Clark, I. E., et al. Drosophila pink1 is required for mitochondrial function and interacts genetically with parkin. Nature. 441 (7097), 1162-1166 (2006).
- Park, J., et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin. Nature. 441 (7097), 1157-1161 (2006).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. The Journal of Cell Biology. 183 (5), 795-803 (2008).
- Zhu, J., Wang, K. Z., Chu, C. T. After the banquet: Mitochondrial biogenesis, mitophagy, and cell survival. Autophagy. 9 (11), 1663-1676 (2013).
- Um, J. H., Yun, J. Emerging role of mitophagy in human diseases and physiology. BMB Reports. 50 (6), 299-307 (2017).
- Al Rawi, S., et al. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 334 (6059), 1144-1147 (2011).
- Kim, M. J., et al. SESN2/sestrin2 suppresses sepsis by inducing mitophagy and inhibiting NLRP3 activation in macrophages. Autophagy. 12 (8), 1272-1291 (2016).
- Kim, M. J., Yoon, J. H., Ryu, J. H. Mitophagy: A balance regulator of NLRP3 inflammasome activation. BMB Reports. 49 (10), 529-535 (2016).
- Sandoval, H., et al. Essential role for Nix in autophagic maturation of erythroid cells. Nature. 454 (7201), 232-235 (2008).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Geisler, S., et al. PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1. Nature Cell Biology. 12 (2), 119-131 (2010).
- Matsuda, N., et al. PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy. The Journal of Cell Biology. 189 (2), 211-221 (2010).
- Allen, G. F., Toth, R., James, J., Ganley, I. G. Loss of iron triggers PINK1/Parkin-independent mitophagy. EMBO Reports. 14 (12), 1127-1135 (2013).
- Chu, C. T., et al. Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nature Cell Biology. 15 (10), 1197-1205 (2013).
- Kubli, D. A., et al. PINK1 Is dispensable for mitochondrial recruitment of Parkin and activation of mitophagy in cardiac myocytes. PloS One. 10 (6), e0130707(2015).
- Dolman, N. J., Chambers, K. M., Mandavilli, B., Batchelor, R. H., Janes, M. S. Tools and techniques to measure mitophagy using fluorescence microscopy. Autophagy. 9 (11), 1653-1662 (2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chemistry & Biology. 18 (8), 1042-1052 (2011).
- Lee, I. H., Yun, J., Finkel, T. The emerging links between sirtuins and autophagy. Methods in Molecular Biology. 1077, 259-271 (2013).
- Sun, N., et al. Measuring In vivo Mitophagy. Molecular Cell. 60 (4), 685-696 (2015).
- Denison, S. R., et al. Alterations in the common fragile site gene Parkin in ovarian and other cancers. Oncogene. 22 (51), 8370-8378 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: Basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Bingol, B., et al. The mitochondrial deubiquitinase USP30 opposes parkin-mediated mitophagy. Nature. 510 (7505), 370-375 (2014).
- Burbulla, L. F., Kruger, R. The use of primary human fibroblasts for monitoring mitochondrial phenotypes in the field of Parkinson's disease. Journal of Visualized Experiments. 68, e4228(2012).
- Di Sante, G., Casimiro, M. C., Pestell, T. G., Pestell, R. G. Time-lapse video microscopy for assessment of EYFP-Parkin aggregation as a marker for cellular mitophagy. Journal of Visualized Experiments. 111, e53657(2016).
- Fang, E. F., et al. In vitro and in vivo detection of mitophagy in human cells, C. Elegans, and mice. Journal of Visualized Experiments. 129, e56301(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved