Method Article
Mesure sensible des Mitophagy par Flow Cytometry à l’aide de la fonction du pH Fluorescent journaliste mt-Keima
Dans cet article
Résumé
Mitophagy, la dégradation sélective des mitochondries, a été impliquée dans l’homéostasie mitochondriale et est déréglementé dans diverses maladies humaines. Cependant, les méthodes expérimentales commodes pour mesurer l’activité de mitophagy sont très limitées. Ici, nous fournissons une analyse sensible pour mesurer l’activité mitophagy à l’aide de cytométrie en flux.
Résumé
Mitophagy est un processus d’élimination sélective des mitochondries endommagés ou inutiles à l’aide de machines de l’autophagie. Des liens étroits ont été trouvés entre mitophagy défectueux et diverses maladies humaines, y compris les maladies neurodégénératives, le cancer et les maladies métaboliques. En outre, des études récentes ont montré que mitophagy est impliqué dans les processus cellulaires normaux, tels que la différenciation et le développement. Cependant, le rôle précis des et des mécanismes moléculaires qui sous-tendent les mitophagy nécessitent une étude plus approfondie. Par conséquent, il est essentiel d’élaborer une méthode robuste et pratique pour mesurer les changements dans l’activité mitophagy. Nous décrivons ici un protocole détaillé pour évaluer quantitativement l’activité mitophagy par cytométrie de flux à l’aide de la protéine fluorescente axés sur les mitochondries Keima (mt-Keima). Ce dosage de cytométrie de flux peut analyser l’activité de mitophagy plus rapidement et plus sensible que les méthodes conventionnelles microscopie ou immunoblotting dotés. Ce protocole peut être appliqué pour analyser l’activité mitophagy dans divers types de cellules.
Introduction
Les mitochondries sont des organites qui sont essentiels pour la physiologie et la prolifération cellulaire. Les mitochondries sont chargés de générer plus de 80 % de l’approvisionnement en ATP par phosphorylation oxydative, et elles offrent aussi des intermédiaires métaboliques divers biosynthèse et métabolisme1,2. En plus de leur rôle dans l’approvisionnement énergétique et le métabolisme, les mitochondries jouent un rôle central dans de nombreux autres processus importants, y compris génération de réactives de l’oxygène (DRO), la régulation de la mort cellulaire et intracellulaire Ca2 + dynamique3 . Altérations de la fonction mitochondriale ont été associées à des maladies humaines, y compris le cancer, le diabète sucré et divers neurodégénératives maladies4,5. Une augmentation dysfonctionnement mitochondrial et les mutations de l’ADN mitochondriales semblent également contribuer au processus de vieillissement normal6,7,8. Par conséquent, le contrôle de la qualité est un enjeu crucial dans les mitochondries. Les mitochondries sont des organites très dynamiques qui peuvent changer en permanence de leur forme entre réseaux allongées et forme courte et fragmentée. Dynamique des mitochondries joue un rôle important dans le maintien de la fonction des mitochondries ainsi que leur dégradation par l’intermédiaire de mitophagy9.
Mitophagy est un mécanisme qui implique la dégradation sélective des mitochondries entières en utilisant le mécanisme de l’autophagie. Mitophagy est le principe mécanisme sous-jacent mitochondrial chiffre d’affaires et de l’élimination des mitochondries endommagés ou dysfonctionnels. Dans ce processus, les mitochondries sont tout d’abord enveloppés d’une membrane, entraînant la formation des autophagosomes, qui puis fusionnent avec les lysosomes pour dégradation hydrolytique9. Des études génétiques antérieures chez la drosophile ont suggéré que deux gènes liés à la maladie de Parkinson, induite par le gène PTEN putatif kinase 1 (PINK1) (PARK6) et Parkin (PARK2), fonctionne sur la même voie10,11. Sous-suite ont démontré que la voie PINK1-Parkin est responsable de l’élimination des mitochondries endommagés et défauts de ce résultat de voie en mitophagy dysfonctionnel et peut-être contribuer à des maladies humaines12,13. Défauts dans les processus de mitophagy ont été récemment trouvés dans diverses maladies humaines, y compris le cancer, maladies cardiaques, maladies du foie et de maladies neurodégénératives 14. En outre, des études récentes ont également montré que mitophagy est essentiel pour de nombreux processus physiologiques, tels que la différenciation, le développement et la réponse immunitaire15,16,17,18 ,19, ce qui laisse supposer que mitophagy peut jouer un rôle plus actif dans le contrôle des fonctions cellulaires.
Malgré la confirmation récente que mitophagy joue un rôle important dans les deux contrôle de la qualité dans les mitochondries et les maladies humaines, les mécanismes moléculaires qui sous-tendent les mitophagy restent mal compris. Bien que les mécanismes axés sur les mitophagy ont été systématiquement étudiés chez les levures, études qui visent à explorer les mécanismes axés sur les mitophagy dans les cellules de mammifères portent principalement sur la voie de PINK1-Parkin. Des études antérieures ont démontré que la voie PINK1-Parkin est principalement responsable de l’élimination sélective des mitochondries endommagés via mitophagy12,20,21. Cependant, des études récentes ont rapporté que dans certains modèles, mitophagy peut être activé même en l’absence de fonctionnelle PINK122,23,24. Ces résultats suggèrent que, outre la voie PINK1-Parkin, là une voie non identifiée supplémentaire qui permet d’activer mitophagy.
L’absence d’une méthode pratique pour évaluer l’activité mitophagy est un obstacle majeur à explorer les voies qui régulent le mitophagy et son rôle dans les manifestations physiopathologiques. Microscopie électronique est un outil puissant pour visualiser directement les mitochondries autophagosome-englouti. Toutefois, la microscopie électronique a ses limites dans la quantification de l’activité mitophagy. Bien que les stratégies qui utilisent le microtubule-associated protein-1 chaîne 3 (LC3) légère-conjugués des sondes fluorescentes, comme GFP-LC3, sont actuellement les approches les plus largement utilisées25, la nature transitoire du signal basé sur LC3 et son taux élevé de signaux de faux-positifs limitent sa sensibilité pour la détection des mitophagy dans les cellules26. Une combinaison de western blot permettant de mesurer le niveau de protéines mitochondriales, la quantification de l’ADN mitochondrial et analyse de la microscopie de fluorescence sont colocalisées mitochondries avec autophagosomes ou lysosomes serait une bonne approche pour l’évaluation mitophagy. Toutefois, les limites de quantification et le manque de commodité des méthodologies existantes appellent de nouvelles approches. L’introduction d’une nouvelle protéine fluorescente dépend du pH, la cible mitochondriale Keima (mt-Keima), a grandement amélioré la capacité de détecter mitophagy27. En fusionnant la séquence de ciblage mitochondrial de sous-unité du cytochrome c oxydase (COX VIII), VIII, dans Keima, mt-Keima est dirigée vers la matrice mitochondriale. Le grand changement dans le pic de Keima de l’excitation de 440 nm à 586 nm (correspondant au pH de 7 et 4, respectivement) peut servir à évaluer les mitophagy avec un bon avec sensibilité à la fois in vitro et in vivo expériences28,29 . Plus important encore, la résistance du mt-Keima à la dégradation lysosomiale entraîne l’intégration du signal mt-Keima dans les lysosomes, permettant une simple mesure quantitative de l’activité mitophagy. Le changement de fluorescence qui survient chez mt-Keima peut être analysé en utilisant soit la microscopie confocale ou écoulement cytometry28,29. Toutefois, une méthode axée sur la cytométrie de flux pour mesurer l’activité mitophagy à l’aide de mt-Keima n’a pas été fournie avec précision jusqu'à présent.
Nous décrivons ici un protocole détaillé pour une technique axée sur la cytométrie de flux pour mesurer l’activité mitophagy dans les cellules à l’aide de mt-Keima. Bien que nous avons montré ici, que les analyse en cytométrie en flux détecté avec succès mitophagy induite par le CCCP dans les cellules HeLa exprimant Parkin, cette technique peut être appliquée à une grande variété de types de cellules.
Protocole
1. génération de cellules HeLa exprimant mito-Keima (mt-Keima)
-
Préparation des lentivirus mt-Keima
- Recouvrir une boîte de Petri de 100 mm en ajoutant 2 mL de solution saline à 0,001 % poly-L-lysine/tamponnée au phosphate (PBS) et laisser reposer pendant 5 min à température ambiante.
- Enlever la solution de la poly-L-lysine à l’aide d’une pipette en verre reliée à un aspirateur et lavez la boîte de Petri en ajoutant 2 mL de solution 1 PBS x.
- Plaque de 1,5 x 106 HEK293T cellules sur la culture revêtue plat avec 10 mL de DMEM contenant 10 % de SVF et 1 % la pénicilline/streptomycine et culture les cellules à 37 ° C dans une étuve de vitroplants CO2 pendant une journée.
- Transfecter 2 µg de mt-Keima lentiviral plasmide29 ADN avec emballage DNAs (psPAX 2 µg et pVSVG 0,25 µg) en utilisant un réactif de transfection pendant 8 h selon les instructions du fabricant.
- Retirez le support de transfection et ajoutez 8 mL de supports neufs.
- Recueillir les médias contenant des particules virales 48 h plus tard. Enlever les débris cellulaires des médias collectés par centrifugation à 500 g pendant 5 min et filtrez-les avec un seringue-filtre de 0,45 µm.
Remarque : Pour une utilisation à long terme, faire des parties aliquotes de Particules Lentivirales et stocker les échantillons à-80 ° C. Éviter de soumettre les échantillons virus pour cycles pour infection virale efficace de gel-dégel.
-
Infecter les cellules HeLa-Parkin avec mt-Keima lentivirus
- Plaque 5 x 104 les cellules HeLa exprimant Parkin (HeLa-Parkin) dans une boîte de Petri de 60 mm avec 4 mL de DMEM contenant 10 % SVF et 1 % la pénicilline/streptomycine à 37 ° C, un jour avant la récolte le lentivirus mt-Keima.
Remarque : En raison de l’absence d’expression endogène de Parkin HeLa cellules30, les cellules HeLa-Parkin, utilisés ici pour plus clairement voir l’induite par le CCCP mitophagy. Cette procédure peut également être appliquée à d’autres lignées cellulaires primaires ou immortalisées. - Enlever le milieu de croissance le lendemain et ajouter 1 mL de médias des gènes mt-Keima. Ajouter 2 mL de milieu de culture contenant 3 µL de solution mère de polybrene (8 mg/mL dans l’eau distillée) supplémentaire. Incuber pendant une journée dans un incubateur à CO2 culture de tissus.
- Retirez le mélange des gènes mt-Keima le lendemain et laver les cellules deux fois avec du PBS 1 x. Ajouter 4 mL de milieu de croissance et de traiter les cellules avec la puromycine 2 µg/mL pendant deux jours.
- Après deux jours de sélection de la puromycine, enlevez le milieu de croissance et laver les cellules deux fois avec la solution 1 PBS x. Ajouter le milieu de croissance et la culture des cellules dans un incubateur à CO2 jusqu'à utilisation.
Remarque : Cette méthode peut être appliquée pour générer des cellules exprimant stablement mt-Keima, y compris les autres lignées cellulaires et les cellules primaires.
- Plaque 5 x 104 les cellules HeLa exprimant Parkin (HeLa-Parkin) dans une boîte de Petri de 60 mm avec 4 mL de DMEM contenant 10 % SVF et 1 % la pénicilline/streptomycine à 37 ° C, un jour avant la récolte le lentivirus mt-Keima.
2. inciter les mitophagy à l’aide de traitement CCCP et préparation des échantillons de FACS
- Plaque 5 x 104 HeLa-Parkin cellules exprimant mt-Keima dans une culture de 60 mm plat avec 4 mL de DMEM contenant 10 % de SVF et 1 % la pénicilline/streptomycine et leur culture pendant une journée à 37 ° C dans une étuve vitroplants de CO2 .
- Enlever le milieu de croissance le lendemain et ajouter 4 mL de frais DMEM contenant 10 µM carbonyl cyanide m-chlorophénylhydrazone (CCCP). Incuber les cellules HeLa-Parkin-mt-Keima dans une étuve de tissu de CO2 pendant 6 h.
- Enlever le milieu de croissance 6 h plus tard et laver les cellules avec 2 mL de PBS 1 x. Détacher les cellules en les traitant avec une solution de trypsine/EDTA et inactiver la trypsine en ajoutant le milieu de culture contenant 10 % FBS. Transférer les cellules dans un tube conique de 15 mL.
- Centrifuger les cellules à 500 g pendant 5 min.
- Avec précaution, retirer le milieu de culture par aspiration et remettre en suspension les cellules avec 1 mL de PBS 1 x contre le rhume.
- Cellules de transfert dans le tube de FACS approprié et placez-le sur la glace.
Remarque : Préparer les cellules HeLa infectées comme témoin négatif.
Remarque : Les cellules sont viables sur la glace pendant plusieurs heures, et signaux fluorescents mt-Keima restent également stables.
3. analyse FACS de mitophagy
Remarque : Dans cette étude, les cellules ont été analysées avec un cytomètre en flux équipé d’un laser à 405 nm et 561 nm. Cellules étaient excitées avec un laser violet (405 nm) avec des émissions détectées à 610 nm ± 10 avec un détecteur de BV605 et avec un laser jaune-vert (561 nm) avec des émissions détectées à 610 nm ± 10 par un détecteur de PE-CF594 simultanément (Figure 1).
-
Blocage des cellules vivantes
- Allumez le cytomètre en flux et l’ordinateur et ouvrez une session dans le logiciel d’analyse.
- Générer une nouvelle expérience ou dupliquer une expérience existante. Pour exciter des cellules avec le violet (405 nm) et jaune-vert (561 nm) lasers et détecter des émissions au détecteur de nm ± 10 610, sélectionnez BV605 et PE-CF594 outre forward scatter (FSC) et diffusion latérale (SSC) dans la fenêtre de paramètre comme fluorophores requis.
Remarque : Fluorochromes doivent être ajoutés en mode linéaire. - Agrégats de chaque échantillon cellulaire brièvement pour disperser les cellules Vortex.
- Placer le tube contenant un échantillon de cellules contrôle HeLa-Parkin qui n’est pas infecté par le lentivirus mt-Keima sur le port d’injection de l’échantillon et appuyez sur le bouton « exécuter » le cytomètre.
- Dans l’intrigue de la dot de FSC versus SSC, régler la tension de FSC et SSC pour placer les cellules dans le centre de l’intrigue de la dot.
- Dessiner une porte de P1 à l’aide de l’icône de polygone autour des cellules vivantes et éliminer les cellules mortes et les débris cellulaires (Figure 2 a).
-
Régler les tensions pour laser violet et vert
- Placer le tube contenant des cellules HeLa-Parkin infectés par le lentivirus mt-Keima sur l’injection de l’échantillon de port et appuyez sur le bouton « run » sur le cytomètre.
- Dans l’intrigue de la dot de BV605 (405 nm) versus SSC, régler la tension de la BV605, afin que les cellules HeLa-Parkin exprimant mt-Keima sont clairement distingués des cellules de contrôle qui n’expriment pas mt-Keima (Figure 2 b).
- Dans l’intrigue de la dot de PE-CF594 (561 nm) versus SSC, régler la tension de PE-CF594, afin que les cellules HeLa-Parkin exprimant mt-Keima sont clairement distingués des hématies (Figure 2 b).
-
Évaluer le pourcentage de cellules en mitophagy
- Acquérir la BV605 contre le complot de dot de PE-CF594 à l’aide d’une échelle linéaire. Dessiner une porte à l’aide de l’icône de polygone autour de cellules exprimant mt-Keima et éliminer les cellules n’exprimant ne pas mt-Keima (Figure 3 a). La population de fluorescence positive cellule mt-Keima est dénommée le portail « mt-Keima ».
- Créer une autre parcelle de point de BV605 par rapport aux PE-CF594 montrant seulement « mt-Keima »-dépendants des cellules. Dans ce complot de dot, dessiner une porte autour des cellules mt-Keima positives non traitées. L’activité basale mitophagy du contrôle HeLa cellules est faible et le taux d’émission à PE-CF594/BV605 est inférieur à 1. Ainsi, cette porte est dénommée la porte « basse ».
- Dessinez un autre portail contenant la région ci-dessus de la porte « basse ». Cette porte est dénommée la « haute » porte car il contient des cellules avec mitophagy de haute activité, c'est-à-dire les cellules avec un ratio élevé d’émission à PE-CF594/BV605 (Figure 3 b).
- Pour calculer le pourcentage de cellules dans le portail « haut », sélectionner le menu de « Hiérarchie de voir la Population ». La valeur « % du Parent » (Parent %) représente le pourcentage de cellules dans la « haute » porte parmi la population de mt-Keima positive.
- Définissez au moins 10 000 événements à enregistrer dans la barrière d’arrêt « mt-Keima » et exécutez chaque échantillon.
Résultats
Un exemple de l’analyse de cytométrie de flux de mitophagy induite par le CCCP dans les cellules HeLa-Parkin est illustré à la Figure 4. À l’aide de la méthode d’analyse de cytométrie en flux décrite ci-dessus, nous pouvons détecter une augmentation spectaculaire dans les cellules de mitophagic dans la porte « élevée ». Le pourcentage de cellules dans la « haute » porte a augmenté de plus de 10 fois par rapport aux cellules témoins non traitées (Figure 4 a). Cette augmentation de l’activité mitophagy est complètement abolie par cotraitement avec bafilomycines A (BFA) (Figure 4 a et 4 b).

Figure 1 . Représentation schématique de la méthode utilisée pour mesurer la mitophagy avec écoulement cytometry. Le schéma décrit les principales étapes nécessaires pour quantifier les cellules subissant mitophagy par cytométrie en flux. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 . Paramétrage des flux cytomètre. Gating (A) des cellules vivantes. Une région pour les cellules vivantes a été déterminée sur le FSC versus SSC complot visant à exclure les cellules mortes et les débris cellulaires. (B) régler les lasers 405 nm et 531 nm à l’aide de la commande HeLa cellules et HeLa cellules exprimant mt-Keima. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 . Calcul de la proportion de cellules mitophagic par cytométrie en flux. (A) les cellules HeLa Gating exprimant mt-Keima. (B) de blocage mitophagic cellules et calcul de la proportion à l’aide de l’outil de statistiques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
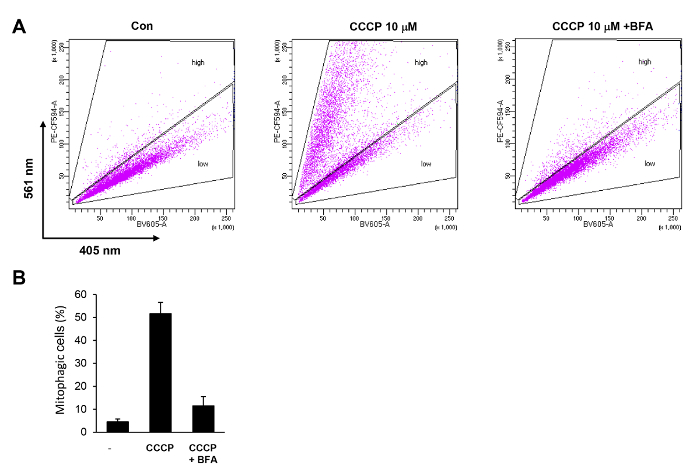
Figure 4 . Quantification de le mitophagy induite par le CCCP dans les cellules HeLa par cytométrie en flux. (A) les cellules HeLa-Parkin exprimant mt-Keima ont été traitées avec 10 µM CCCP pendant 6 h avec ou sans 100 nM bafilomycines A (BFA). Les cellules ont été analysées par FACS en utilisant des détecteurs BV605 et PE-CF594. (B) les cellules avec un ratio élevé de PE-CF594/BV605 ont été sélectionnés (« high »), et leur proportion a été calculée. Les résultats de trois expériences répétées sont tracés avec des écarts-types. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous présentons ici une méthode rapide et sensible pour cytométrie pour mesurer l’activité de la mitophagy cellulaire dans les cellules exprimant mt-Keima. Les cellules subissant un niveau élevé de mitophagy montrent une augmentation du rapport du PE-CF594 (561 nm) / BV605 (405 nm) excitation. Ainsi, mitophagy activité peut être exprimée comme le pourcentage de cellules présentant un taux élevé de 561/405. Nous avons calculé le pourcentage de cellules dans la région de la « haute » porte sur un terrain de dot de PE-CF594 (561 nm) versus BV605 (405 nm), et les résultats ont montré que le traitement avec le CCCP induit une augmentation de mitophagy dans les cellules HeLa-Parkin. Nous avons démontré précédemment que la surexpression induite par le lentivirus de mt-Keima lui-même naffecte pas la fonction mitochondriale ou physiologie cellulaire31. Bien que nous l’avons montré dans notre manuscrit cette analyse en cytométrie en flux peut détecter avec succès mitophagy induite par le CCCP dans HeLa cellules exprimant Parkin, cette technique peut être appliquée à n’importe quel type de cellule après l’introduction de mt-Keima. Nous avons montré précédemment que mitophagy induite par l’hypoxie peut être détecté dans les cellules HeLa sans ectopique Parkin expression29. En outre, des études antérieures, y compris les nôtres et celles des autres groupes, a montré que mt-Keima analyse de fluorescence peut détecter des mitophagy dans les cellules primaires comme les fibroblastes embryonnaires de souris (MEFs) et immortalisé les cellules comme les cellules HeLa, HEK293 et SH-SY5Y 28 , 29 , 32.
Par rapport aux autres épreuves mitophagy microscopie-base ou immunoblotting, écoulement cytometry essais présentent des avantages en ce qu’elles permettent des analyses rapides et reproductibles d’un grand nombre de cellules31. Par conséquent, alors que dans les analyses axées sur la microscopie, partialité chercheur peut perturber les résultats, ce biais n’est pas un problème lors de l’utilisation des dosages de cytométrie en flux.
Moins de 1 x 106 cellules sont nécessaires pour l’analyse en cytométrie en flux. En outre, parce que l’analyse d’un échantillon prend seulement une ou deux minutes, jusqu'à des dizaines d’échantillons peut être analysé dans une ou deux heures. En outre, écoulement cytometry dosages peuvent détecter des augmentations dans les cellules mitophagic avec une bonne sensibilité. Dans notre analyse en cytométrie en flux, nous avons détecté une multiplication par 10 dans les cellules mitophagic après 6 h de traitement avec le CCCP.
L’étape critique pour analyser les mitophagy à l’aide de cytométrie en flux est correctement réglé les portes « hautes » et « bas » pour distinguer les cellules subissant un niveau élevé de mitophagy. Parce que les niveaux mitophagy basale peuvent être différentes selon le type de cellule, définissant la porte « élevée » et « faible » peut être difficile dans certaines lignées cellulaires. Dans un tel cas, il est utile d’inclure une lignée de cellules de contrôle avec mitophagy basal faible activité telles que les cellules HeLa. En outre, pour les cellules traitées par un inhibiteur lysosomal tels que la chloroquine, bafilomycines A peuvent être inclus comme un contrôle faible mitophagy de mettre en place le blocage correct. Bien que les lentivirus sont couramment utilisés pour l’expression ectopique de protéines intéressantes, certaines lignées cellulaires peuvent être sensibles à l’infection par le virus. Si infection lentivirus elle-même entraîne des changements dans la croissance cellulaire ou la fonction des mitochondries, une autre méthode doit envisager pour mt-Keima expression. Le niveau d’expression du mt-Keima peut également varier selon le type de cellule. Si le signal de fluorescence mt-Keima est trop faible ou trop hétérogène, seules les cellules avec un signal de fluorescence forte mt-Keima peuvent être collectées à l’aide d’un trieur de cellules ou cellules mt-Keima traitées à nouveau avec une concentration plus élevée d’antibiotiques puromycine pendant plusieurs jours . Le signal de mt-Keima des cellules individuelles sont stables, aussi longtemps que les cellules sont viables, mais il est recommandé d’analyser les échantillons par cytométrie en flux aussi rapidement que possible.
Notre essai de cytométrie en flux est une méthode robuste et pratique pour l’analyse de mitophagy, mais il existe certaines limitations. Tout d’abord, parce que les cellules doivent être séparés comme niveau unicellulaire pour cytométrie en flux, cette méthode est difficile à appliquer pour l’analyse de la mitophagy de tissus ou d’organes sans altérer la physiologie. En outre, mt-Keima fluorescence perd ses caractéristiques dépend du pH après fixation, et ainsi, tous les échantillons doivent être analysés comme des cellules vivantes. Cela se traduit par la limitation de la conservation des échantillons mentionnée ci-dessus et une autre limitation lorsque vous appliquez une tache supplémentaire par immunofluorescence. Cette technique permet de mesurer quantitativement l’activité mitophagy, mais il est incapable de suivre les changements dans la morphologie mitochondriale ou dynamiques, qui sont connus pour jouer un rôle important dans le processus de mitophagy9. Les chercheurs devraient garder à l’esprit la complexité et les aspects indéterminés de mitophagy. Donc, afin d’éviter l’erreur de jugement possible, le processus de mitophagy devrait être confirmé par les résultats combinés des autres méthodes d’analyse de mitophagy commune, y compris la microscopie électronique, le renouvellement des protéines mitochondriales, une réduction l’ADN mitochondrial et la microscopie de fluorescence mesurant la co-localisation des mitochondries avec les lysosomes ou autophagosomes comme décrivent précédemment33,34,35. Toute augmentation observée du mitophagy peut également être examinée par l’intermédiaire de la microscopie confocale des cellules exprimant mt-Keima. Dans les cellules mitophagic, mt-Keima est exprimée dans un modèle ponctué lumineux avec un ratio élevé de 586/440 que l'on peut observer en microscopie confocale28,29.
Compte tenu de sa capacité à détecter rapidement et avec sensibilité les mitophagy, cet essai de cytométrie de flux fournit une approximation de la première étape qui pourrait se révéler utile pour une variété d’études. En simplement infectant les cellules avec le mt-Keima lentivirus, changements de l’activité de la mitophagy peuvent être facilement mesure dans n’importe quel type de cellule désirée. En combinaison avec la fonction de trieur de cellules, cellules avec un niveau spécifique de l’activité de la mitophagy peuvent être spécifiquement isolés et utilisés pour étudier les rôles d’et les mécanismes de régulation qui sous-tendent les mitophagy.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par une subvention de la Fondation de la recherche nationale de Corée (2016R1D1A1B03931949) (à J. U.) et par la Fondation de recherche National de Corée (NRF) subvention financée par le government(MSIT) de Corée (no 2016R1A2B2008887, no 2016R1A5A2007009) (à Jean-Yves .)
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| poly-L-lysine | Sigma-Aldrich | P2636 | |
| FBS | GIBCO | 16000-044 | |
| penicillin/streptomycin | wellgene | LS202-02 | |
| PBS | Hyclone | SH30013.02 | |
| HEK293T | ATCC | CRL-3216 | |
| DMEM | GIBCO | 12800-082 | |
| OPTI-MEM | GIBCO | 31985-070 | |
| Turbofect | Thermos scientific | R0531 | |
| 0.45 μm syringe filter | sartorius | 16555 | |
| HeLa | ATCC | CCL-2 | |
| polybrene | Sigma-Aldrich | H9268 | 8 mg/ml |
| puromycin | Sigma-Aldrich | P8833 | 2 mg/ml |
| Carbonyl cyanide m-chlorophenyl hydrazine (CCCP) | Sigma-Aldrich | C2759 | 10 mM |
| trypsin-EDTA | wellgene | LS015-01 | |
| EQUIPMENTS | |||
| BD LSRFortessa | BD Bioscience | LSRFortessa | |
| FACSDIVA | BD Bioscience | FACSDIVA (v8.0.1) |
Références
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), R551-R560 (2006).
- Zorov, D. B., Krasnikov, B. F., Kuzminova, A. E., Vysokikh, M., Zorova, L. D. Mitochondria revisited. Alternative functions of mitochondria. Bioscience Reports. Bioscience Reports. 17 (6), 507-520 (1997).
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nature Reviews Genetics. 6 (5), 389-402 (2005).
- Galluzzi, L., Kepp, O., Trojel-Hansen, C., Kroemer, G. Mitochondrial control of cellular life, stress, and death. Circulation Research. 111 (9), 1198-1207 (2012).
- Kang, D., Hamasaki, N. Alterations of mitochondrial DNA in common diseases and disease states: aging, neurodegeneration, heart failure, diabetes, and cancer. Current Medicinal Chemistry. 12 (4), 429-441 (2005).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Wallace, D. C., Brown, M. D., Melov, S., Graham, B., Lott, M. Mitochondrial biology, degenerative diseases and aging. BioFactors. 7 (3), 187-190 (1998).
- Yun, J., Finkel, T. Mitohormesis. Cell Metabolism. 19 (5), 757-766 (2014).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20 (1), 31-42 (2013).
- Clark, I. E., et al. Drosophila pink1 is required for mitochondrial function and interacts genetically with parkin. Nature. 441 (7097), 1162-1166 (2006).
- Park, J., et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin. Nature. 441 (7097), 1157-1161 (2006).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. The Journal of Cell Biology. 183 (5), 795-803 (2008).
- Zhu, J., Wang, K. Z., Chu, C. T. After the banquet: Mitochondrial biogenesis, mitophagy, and cell survival. Autophagy. 9 (11), 1663-1676 (2013).
- Um, J. H., Yun, J. Emerging role of mitophagy in human diseases and physiology. BMB Reports. 50 (6), 299-307 (2017).
- Al Rawi, S., et al. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 334 (6059), 1144-1147 (2011).
- Kim, M. J., et al. SESN2/sestrin2 suppresses sepsis by inducing mitophagy and inhibiting NLRP3 activation in macrophages. Autophagy. 12 (8), 1272-1291 (2016).
- Kim, M. J., Yoon, J. H., Ryu, J. H. Mitophagy: A balance regulator of NLRP3 inflammasome activation. BMB Reports. 49 (10), 529-535 (2016).
- Sandoval, H., et al. Essential role for Nix in autophagic maturation of erythroid cells. Nature. 454 (7201), 232-235 (2008).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Geisler, S., et al. PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1. Nature Cell Biology. 12 (2), 119-131 (2010).
- Matsuda, N., et al. PINK1 stabilized by mitochondrial depolarization recruits Parkin to damaged mitochondria and activates latent Parkin for mitophagy. The Journal of Cell Biology. 189 (2), 211-221 (2010).
- Allen, G. F., Toth, R., James, J., Ganley, I. G. Loss of iron triggers PINK1/Parkin-independent mitophagy. EMBO Reports. 14 (12), 1127-1135 (2013).
- Chu, C. T., et al. Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells. Nature Cell Biology. 15 (10), 1197-1205 (2013).
- Kubli, D. A., et al. PINK1 Is dispensable for mitochondrial recruitment of Parkin and activation of mitophagy in cardiac myocytes. PloS One. 10 (6), e0130707(2015).
- Dolman, N. J., Chambers, K. M., Mandavilli, B., Batchelor, R. H., Janes, M. S. Tools and techniques to measure mitophagy using fluorescence microscopy. Autophagy. 9 (11), 1653-1662 (2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chemistry & Biology. 18 (8), 1042-1052 (2011).
- Lee, I. H., Yun, J., Finkel, T. The emerging links between sirtuins and autophagy. Methods in Molecular Biology. 1077, 259-271 (2013).
- Sun, N., et al. Measuring In vivo Mitophagy. Molecular Cell. 60 (4), 685-696 (2015).
- Denison, S. R., et al. Alterations in the common fragile site gene Parkin in ovarian and other cancers. Oncogene. 22 (51), 8370-8378 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: Basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Bingol, B., et al. The mitochondrial deubiquitinase USP30 opposes parkin-mediated mitophagy. Nature. 510 (7505), 370-375 (2014).
- Burbulla, L. F., Kruger, R. The use of primary human fibroblasts for monitoring mitochondrial phenotypes in the field of Parkinson's disease. Journal of Visualized Experiments. 68, e4228(2012).
- Di Sante, G., Casimiro, M. C., Pestell, T. G., Pestell, R. G. Time-lapse video microscopy for assessment of EYFP-Parkin aggregation as a marker for cellular mitophagy. Journal of Visualized Experiments. 111, e53657(2016).
- Fang, E. F., et al. In vitro and in vivo detection of mitophagy in human cells, C. Elegans, and mice. Journal of Visualized Experiments. 129, e56301(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon