Method Article
שיטת שבב exo: זיהוי אינטראקציות חלבון-דנ"א עם Precision סמוך לבסיס זוג
In This Article
Summary
Here, we present a protocol to achieve near base pair resolution of protein-DNA interactions. This is obtained by exonuclease treatment of DNA fragments selectively enriched by chromatin immunoprecipitation (ChIP-exo) followed by high throughput sequencing.
Abstract
הכרומטין immunoprecipitation (שבב) הוא כלי הכרחי בתחומי אפיגנטיקה ויסות הגנים המבודדת אינטראקציות חלבון-דנ"א ספציפי. שבב מצמידים את רצף תפוקה גבוהה (שבב ואילך) משמש בדרך כלל כדי לקבוע את המיקום הגנומי של חלבונים אינטראקציה עם הכרומטין. עם זאת, שבב seq הקשה על ידי ברזולוצית מיפוי נמוכה היחסי של כמה מאה זוגות בסיסים ו אות רקע גבוהה. שיטת השבב exo היא גרסה מעודנת של שבב seq המשפר באופן משמעותי את שני ברזולוציה ורעש. ההבחנה המפתח של המתודולוגיה שבב exo הוא שילוב של עיכול exonuclease למבדה בתהליך העבודה הכנת הספרייה כדי טביעת רגל שמאל ביעילות וימין 5 גבולות DNA של האתר crosslink חלבון-דנ"א. הספריות-exo שבב חשופים מכן רצף קצב העברת נתונים גבוה. כתוצאת הנתונים ניתן למנף לספק תובנה ברזולוציה ייחודיות ועל עליון לתוך o הארגון הפונקציונליf הגנום. כאן אנו מתארים את שיטת השבב exo כי לנו אופטימיזציה וייעלו למערכות יונקות הדור הבא רצף-ידי-סינתזת פלטפורמה.
Introduction
הכרומטין immunoprecipitation (שבב) היא שיטה רבת עוצמה כדי לחקור מנגנונים של ויסות הגנים על ידי העשרת סלקטיבי עבור שברי דנ"א אינטראקציה עם חלבון נתון בתאים חיים. שיטות איתור של קטעי DNA מועשר שבב התפתחו ככל שהטכנולוגיה משתפרת, מן הגילוי של מוקד יחיד (תקן שבב qPCR) הכלאה על microarrays oligonucleotide (שבב שבב) כדי רצף תפוקה גבוהה (שבב ואילך) 1. למרות-seq השבב רואה יישום נרחב, ההטרוגניות הכרומטין אינטראקציות DNA ספציפיות יש הכבד איכות נתונים המוביל תוצאות חיוביות שגויות ומיפוי מדויק. כדי לעקוף מגבלות אלו, ד"ר פרנק Pugh פיתח את שיטת שבב exo 2. התכונה הבולטת של-exo השבב היא שזה משלב 5 'ל 3' exonuclease, footprinting ביעילות גורם שעתוק מחייבים מקומות. כתוצאה מכך, המתודולוגיה השבב exo משיגה רזולוציה גבוהה יותר, טווח דינמי גדול יותר של detection, ורעש רקע תחתון.
למרות שבב exo הוא יותר מאתגר מבחינה טכנית כדי להתמחות מ שבב seq, בחודשים האחרונים הוא לאימוץ נרחב כמו מחקרים שואפים לקבל תובנה ברזולוציה גבוהה אולטרה ייחודיות באמצעות מערכות ביולוגיות מגוונות 3-8. ואכן,-exo השבב יושם בהצלחה חיידקים, שמרים, עכבר, חולדה, ומערכות תאים אנושיות. כהוכחה עקרונית,-exo השבב שמש במקור כדי לזהות את מוטיב המחייב המדויק בעבור חופן שעתוק שמרים גורם 2. הטכניקה שימש גם בשמרים ללמוד את הארגון של המתחם מראש ייזום שעתוק, וכדי לפענח מבנה subnucleosomal של היסטונים שונים 9,10. לאחרונה, אנו ממונפים-exo השבב לפתור TFIIB הסמוך Pol II מחייב אירועי יזמים אנושיים, והראינו כי שעתוק מסתעף נרחב נובע ייזום ברור קומפלקסי 11.
זרימת העבודה המוצגת כאן היא מותאמת ו- streamlined עבור שבב exo היונק (איור 1). ראשית, התרבות תאים ראשוניים או רקמות חיות מטופלות עם פורמלדהיד לשמר באינטראקציות חלבון-דנ"א vivo באמצעות crosslink קוולנטיים. התאים lysed ו הכרומטין טעון ~ 100 - 500 שברי גודל בסיס זוג. שבב אז מעשיר באופן סלקטיבי עבור קטעי DNA crosslinked לחלבון של עניין. בשלב זה, ספריות-seq שבב ערוכים בדרך כלל, אשר מטבעו מגביל את הרזולוציה זיהוי לגודל שבר הממוצע של כמה מאות זוגות בסיסים. עם זאת, שבב exo מתגבר על מגבלה זו על ידי זמירה משמאל ומימין 5 גבולות DNA של האתר crosslink חלבון-דנ"א עם exonuclease למבדה. ספריות רצף בנויות אז מ- DNA מתעכל exonuclease כמפורט להלן. הגבולות המקוננים 5 'וכתוצאה מכך מייצגים טביעת in vivo של אינטראקצית החלבון-דנ"א (איור 1, שלב 14), והם מזוהים על ידי רצף קצב העברת נתונים גבוה. Altיו המתודולוגיה שבב exo הוא מעורב יותר מאשר שבב seq, מעברים בין רוב השלבים דורש כביסה חרוז פשוט, אשר ממזערת אובדן מדגם ולהבדלים ניסיוני. יודגש, כי בגלל-exo השבב היא גרסה מעודנת של-seq שבב, כל מדגם כי הוא מוצלח עם-seq שבב צריכה גם להצליח עם-exo שבב.
תפקידו של המוסד vivo footprinting של אינטראקציות חלבון-דנ"א עם תוצאות שבב exo במבנה נתונים ברורים במהותו מן-seq שבב. למרות המתקשר שבב seq משותף ניתן להחיל נתוני שבב exo, כדי לקבל את שיחות שיא המדויקות ביותר אנו ממליצים כלי ביואינפורמטיקה שתוכננו במיוחד עם המבנה הייחודי של נתוני שבב exo בראש. אלה כוללים Genetrack, GEM, MACE, Peakzilla, ו ExoProfiler 12-15.
Protocol
הערה: H הזוגי המזוקק 2 O או שוות ערך כיתה מולקולרי מומלצת לכל המאגרים ותערובות תגובות.
יום 0: הכנת חומר קציר נייד
1. הצפת הכנה
- כן תמוגה חוצצי 1 - 3 (לוחות 1 - 3) ולהוסיף 100 μl מניות מעכבים פרוטאז שלמים (CPI) 50 מיליליטר של כל חיץ רק לפני השימוש. הכן המניה למדד ידי המסת טבליה אחת ב 1 מ"ל כיתה מולקולרית H 2 O.
- כן חוצץ שבב (לוחות 4 - 7). הוספת 100 μl המניה למדד ל -50 מ"ל של חסימה מאגרים Ripa. אל תוסיף למדד מאגרי טריס וצ'יפ Elution.
חישול 2. Oligonucleotides מתאם
הערה: רצפי oligonucleotide ספציפיים ניתן למצוא את הפרטים הנוספים.
- הכן תערובות חישול מתאם (לוחות 8 - 9). וורטקס לערבב בקצרהספין צינורות לאסוף תוכן. Aliquot 100 μl של כל ערבוב לתוך צינורות 0.5 מ"ל.
- להכליא oligonucleotides ידי הפעלת התכנית (לוח 10) ב thermocycler.
חנות annealed oligonucleotides ב -80 מעלות צלזיוס.
3. Vivo הכרומטין Crosslinking עם פורמלדהיד
הערה: לצורך ניסוי שבב טיפוסי, חומר המוצא אמור להכיל כ -50 מיליון תאים.
- הוסף פתרון המניות פורמלדהיד 37% ללא מתנול טרי פוספט בופר (PBS) שטף תרבית תאים לריכוז סופי של 1% (v / v), ומערבבים היטב, ולתת לשבת בטמפרטורת החדר למשך 10 דקות.
הערה: לדוגמה, אנו נוהגים להוסיף 1.4 מ"ל של 37% ללא מתנול פורמלדהיד לתאים 50 מ"ל של בטמפרטורת החדר PBS. כמו כן, להימנע פורמלדהיד crosslinking בתקשורת מאז חלבונים בתקשורת יהיה להרוות חלק פורמלדהיד. - להרוות crosslinking תגובה על ידי הוספת 2.5 M glycinדואר ריכוז סופי של 125 מ"מ. מערבבים היטב.
- עבר תאים 50 מ"ל צינור על קרח. ספין התאים למשך 5 דקות XG ב 1000 ב 4 מעלות צלזיוס. supernatant למזוג.
- הוסף 1 מ"ל קר כקרח 1x PBS לתא גלולה ו resuspend ידי pipetting. מעבירים צינור 1.5 מ"ל.
- ספין תאים במשך 3 דקות XG ב 2000 ב 4 מעלות צלזיוס. לשאוב supernatant.
- מיד פלאש להקפיא כדורי תא צינורות 1.5 מ"ל עם חנקן נוזלי. חנות ב -80 מעלות צלזיוס. תאים Crosslinked יציבים ללא הגבלת זמן ב -80 מעלות צלזיוס.
יום 1: תא תמוגה, Sonication, וצ'יפ
4. תא תמוגה
הערה: במהלך כל חלקי תמוגה התא, הדגימות חייבות להישמר על קרח או על 4 מעלות צלזיוס כדי למזער היפוך crosslink.
- בקצרה להפשיר תא גלול crosslinked. ביסודיות resuspend כל גלולה ב 0.5 מ"ל תמוגה הצפת 1 ולשלב עם 4.5 מ"ל תמוגה הצפת 1 בתוך שפופרת פוליסטירן 15 מ"ל.
- צינורות רוק עבור 10 דקות ב 4 ° Cעבור על פלטפורמת נדנדה. ספין למשך 4 דקות XG ב 2000 ב 4 מעלות צלזיוס. supernatant למזוג.
- ביסודיות resuspend כל גלולה ב 0.5 מ"ל הצפת תמוגה 2 ולהוסיף 4.5 מ"ל הצפת תמוגה 2 פעם resuspended.
- רוק במשך 5 דקות ב 4 ° C על פלטפורמת נדנדה. ספין במשך 5 דקות XG ב 2000 ב 4 מעלות צלזיוס. למזוג supernatant והקש עודף בעדינות על מגבת נייר.
- ביסודיות resuspend כל גלולה ב 0.5 מ"ל הצפת תמוגה 3 ולהוסיף 1 מ"ל הצפת תמוגה 3 פעם resuspended. שמור lysates גרעיני על קרח מיד להמשיך sonication.
5. Sonication של גרעיני Lysates
הערה: במהלך כל חלקי sonication, הדגימות חייבות להישמר על קרח כדי למזער היפוך crosslink. הדגם הספציפי של sonicator משמש בשיתוף עם פרוטוקול להלן ניתן למצוא טבלה של חומרים. פרטים על שימוש sonicator ספציפי והנחיות עבור מכשירים אחרים ניתן למצוא את הפרטים הנוספים.
- Plמתאמי תהודת אס 15 מיליליטר צינורות קלקר המכילים תמציות גרעיניות (הבר המתכתי לא צריך לגעת הקיר של הצינור).
- lysates גרעיני Sonicate באמבט מים קרים קרח במשך 2 x 15 מפגשים דקות עם 30 שניות ON / OFF 30 שניות בהספק בינוני. רק sonicate שני 15 מ"ל צינורות בכל פעם. הגדרות אלה לעבוד על מגוון רחב של שורות תאים סוגי תאים ראשוניים, אבל ייתכן שיהיה צורך אופטימיזציה נוספת אם הגז הכרומטין אינו שלם.
- כדי לבדוק תוצאות sonication, העברת 2 x 10 דגימות μl מן lysate לתוך צינורות 1.5 מ"ל.
- להיפוך crosslinks, לשלב את aliquot הראשונה 10 μl עם 10 μl TE-RNase A ו- 0.2 μl של proteinase ק לדגור על 37 מעלות צלזיוס למשך 30 דקות. הוסף 4 μl לצבוע DNA קסילן 6x.
- כדי לשמר crosslinks, לשלב את aliquot השני 10 μl עם 2 μl לצבוע DNA קסילן 6x.
- להפעיל את שתי דוגמאות על ג'ל 1.5% agarose ב 140 V עבור כ 30 - 45 דקות עד לצבוע bromophenol ב הסולם i¾ s של הדרך למטה הג'ל.
- אם sonication היה מוצלח (רוב שברי DNA טעון 100 - 500 נ"ב), העברת sonicated lysates 2 מ"ל צינורות המכיל 150 μl של 10% Triton X-100. וורטקס לערבב.
- כדי גלולת הכרומטין ופסולת מסיסים, ספין sonicated lysate הגרעיני במשך 10 דקות ב 20,000 XG ב 4 מעלות צלזיוס.
- העברת supernatant אל צינור 2 מ"ל חדש. פנה מיד דגימות שבב או בחנות ב -80 ° C ללא הגבלת זמן. תמציות sonicated לא צריך להיות קפוא מופשר יותר מפעם אחת.
6. נוגדן צימוד חרוזים
הערה: לעולם אל מערבולת או להקפיא / להפשיר חרוזים מגנטיים מאז הם ינפצו ולהגדיל אות רקע.
- לאחר ערבוב המניות ביסודיות, aliquot Y μl slurry חרוז לתוך 1.5 מ"ל צינור, היכן Y = 1.1 x 2.5 x μl (מספר דגימות שבב). כריכת יכולת slurry חרוז 2.5 μl היא עד 13 מיקרוגרם IgG. לשטוף חרוזים ונקווה 3x עם 1 מ"ל חסימתבַּלָם.
- לקבלת aliquotting העקבית יותר של חרוזים לאחר שטיפות, חרוזי resuspend ב 10x נפח slurry מקורי (25 μl / שבב) עם חסימת הצפה. Aliquot 25 μl לדגימה שבב לתוך צינורות 1.5 מ"ל.
- להוסיף 5 - 10 מיקרוגרם של נוגדנים מתאימים aliquot חרוזים גלולים. תביא נפח סופי עד 250 μl עם חיץ חסימה. דגירה דגימות במשך 4 שעות (לחילופין, לילה במשך 16 שעות) על במה מסתובבת ב 4 ° C.
- לשאוב supernatant. כדי להסיר נוגדן מאוגד או עודף, לשטוף חרוזים פעם עם 1 מ"ל חסימת חיץ.
- לאחר aspirating לשטוף האחרון, ומיד להוסיף 50 מיליון ושווי התא של תמציות sonicated (~ 1.6 מ"ל) כדי נוגדן: conjugates חרוז. אם תמציות sonicated אינן מוכנות, חרוזי resuspend ב 100 μl חסימת הצפה עד שהם מוכנים. זה קריטי לא לתת את החרוזים יבשים.
7. הכרומטין immunoprecipitation (שבב)
- עבור כל דגימה שבב, לשלב 1.5 מ"ל של sonicateתמציות ד עם נוגדן: conjugates חרוז ב 1.5 מ"ל או 2 צינורות מ"ל.
- דגירת צינורות על כתף מיני צינור הלילה (כ 16 שעות) בשעת הגדרת מהירות של 9 ב 4 ג. בדוק אחרי כמה דקות על מנת להבטיח דגימות אינן דולפות והם ערבוב כראוי.
יום 2: השבב רוחץ ו- On-שרף תגובות אנזימטיות
8. רוחצת שבב
הערה: כדי למזער זיהום צולב, ספין צינורות בקצרה בין כל שטיפה. לקבלת השאיפה הראשונה, לשנות טיפים בין כל דגימה. במהלך שוטפים עוקב באותו הקצה יכול לשמש עוד כפי שהוא לא נגע חרוזים. ראה סעיף מידע נוסף עבור כיוונים על כביסת שבב נכונה.
- בקצרה מאוד ספין צינורות באמצעות microcentrifuge (~ 3 שניות ב 500 XG) לאסוף נוזלי כמוסות ומניחים על המדף מגנטי 1 דקות. אמנם עדיין על המדף המגנטי, תמצית לשאוב.
- להוסיף 0.75 מ"ל Ripa הצפת על צינור אחד. הסר צינורות מ מתלה מגנטיו להפוך מספר פעמים כדי לערבב. חלף צינורות על מתלה מגנטית supernatant לשאוב. חזור 7x.
- להוסיף 0.75 מ"ל 10 מ"מ טריס HCl (pH 7.5) על צינור אחד. הסר צינורות מ מתלה מגנטי ו להפוך מספר פעמים כדי לערבב. חלף צינורות על מתלה מגנטית supernatant לשאוב. חזור 2x.
- לאחר aspirating לשטוף האחרון, המשך צחצוח.
הערה: לאחר כל תגובת דגירה בסעיפים 9.3, 10.3, 11.3, 12.3, 13.3, 14.3, ו -15.3, בקצרה צינורות ספין ומקום נגד מתלת מגנטי 1 דקות ו supernatant לשאוב. 2x לשטוף עם 0.75 מ"ל Ripa הצפת 2x עם 0.75 מ"ל טריס HCl (pH 7.5).
תגובת צחצוח 9.
- מלא את פוליש חישובי תערובת אמן (לוח 11). הפוך פוליש תמהיל 1.5 מ"ל צינור על הקרח. Pipet לערבב.
- מייד לאחר כביסת השבב האחרונה היא aspirated, להוסיף 50 μl של פוליש תערובת לכל שרף מדגם ועדיין על המדף המגנטי. דגירה דגימות עבור 30 דקות ב 3 XG30 צלזיוס thermomixer.
- לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך A-עוקב.
10. A-עוקב תגובה
- מלא את חישובי תערובת אמן עוקב-A (לוח 12). הפוך-עוקב לערבב בתוך צינור 1.5 מ"ל על הקרח. Pipet לערבב.
- מייד לאחר פוליש סעיף, להוסיף 50 μl של A-עוקב תערובת לכל שרף מדגם ועדיין על המדף המגנטי. דגירה דגימות עבור 30 דקות ב 3 XG ב 37 צלזיוס thermomixer.
- לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך קשירת מתאם P7.
11. תגובת קשירת מתאם P7
- מלא את חישובי תערובת אמן קשירה (לוח 13). הפוך קשירת לערבב צינור 1.5 מ"ל על הקרח. פיפטה לערבב.
- מייד לאחר-עוקבים סעיף, להוסיף 48 μl תערובת אמן P7 קשירה ו -2 μl של t אינדקס מתאם שונהo כל שרף מדגם ועדיין על המדף המגנטי. דגירה דגימות עבור שעה 2 ב 3 XG ב 25 צלזיוס thermomixer.
הערה: שימוש אינדקסים שונים עבור כל דגימה יאפשר יותר דגימות להיות רצף בתוך תא זרימה חד. - לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך תיקון Φ-29 ניק.
12. Phi-29 תגובת תיקון ניק
- מלא את Φ-29 חישובי מיקס מאסטר (לוח 14). צור לקט Φ-29 ב 1.5 מ"ל צינור על הקרח. Pipet לערבב.
- מיד לאחר סעיף קשירת P7, להוסיף 50 μl של תמהיל Φ-29 לכל שרף מדגם ועדיין על המדף מגנטי. דגירה דגימות עבור 20 דקות ב 3 XG ב 30 צלזיוס thermomixer.
- לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך התגובה קינאז.
תגובה קינאז 13.
- מלא את חישובי תערובת אמן קינאז ( לוח 15). הפוך קינאז לערבב ב 1.5 מ"ל צינור על הקרח. Pipet לערבב.
- מיד לאחר סעיף Φ-29, להוסיף 50 μl של קינאז לערבב לכל שרף מדגם ועדיין על המדף מגנטי. דגירה דגימות עבור 20 דקות ב 3 XG ב 37 צלזיוס thermomixer.
- לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך התגובה exonuclease למבדה.
תגובת 14. למבדה exonuclease
- מלאו את חישובי תערובת אמן Lambda exonuclease (לוח 16). הפוך Lambda exonuclease לערבב ב 1.5 מ"ל צינור על הקרח. Pipet לערבב.
- מיד לאחר סעיף קינאז, להוסיף 50 μl של למבדה exonuclease לערבב לכל שרף מדגם ועדיין על המדף מגנטי. דגירה דגימות עבור 30 דקות ב 3 XG ב 37 צלזיוס thermomixer.
- לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך התגובה f RecJ.
15. RecJ fתגובת nuclease
- מלא את חישובי תמהיל RecJ f מאסטר (לוח 17). הפוך f תמהיל RecJ ב 1.5 מ"ל צינור על הקרח. Pipet לערבב.
- מיד לאחר סעיף exonuclease למבדה, להוסיף 50 μl של תמהיל RecJ f לכל שרף מדגם ועדיין על המדף מגנטי. דגירה דגימות עבור 30 דקות ב 3 XG ב 37 צלזיוס thermomixer.
- לאחר aspirating לשטוף האחרון כמתואר בביאור לאחר סעיף 8.4, המשך שבב Elution.
16. Elution ואת היפוך Crosslink
- הכינו תערובת אמן: מספר דגימות x 1.1 x (200 μl שבב הצפת elution + 1 μl 20 מ"ג / מ"ל proteinase K) ב 1.5 מ"ל צינור. הוסף 200 μl שבב הצפת elution + proteinase K מיקס מאסטר לכל שרף המדגם.
- דגירה דגימות לילה (כ 16 שעות) בשעה 3 XG ב 65 צלזיוס thermomixer עם מכסה מחומם כדי למנוע התעבות.
יום 3: DNA חלץיון קשירת מתאם
17. Elution ואת היפוך Crosslink (המשך)
- לאחר דגירה לילה בשעה 65 C, בקצרה ספין דגימות כדי לאסוף העיבוי. מקום דגימות על מתלה מגנטי 1 דקות.
- העברת 200 μl supernatant אל צינור חדש 1.5 מ"ל המכיל 200 μl TE הצפת (pH 7.5).
הפקת 18. אלכוהול Isoamyl כלורופורם פנול (PCIAA)
- להוסיף 400 כלורופורם פנול μl isoamyl אלכוהול מדגם זה. וורטקס לערבב במשך 20 שניות.
- צנטריפוגות במשך 10 דקות ב 20,000 XG בטמפרטורת החדר (RT). בזהירות להעביר 325 μl של השכבה המימית העליונה לצינור טרי.
הערה: יש להיזהר שלא להעביר כל אחד (השכבה התחתונה) האורגנית לתוך הצינור החדש. - להוסיף 1/10 נפח של 3 M NaOAc (pH 5.5) ו 1 μl 20 מ"ג / מ"ל גליקוגן מדגם זה. לקבלת דוגמיות מרובות, להכין תערובת אב.
- הוסף 3 כרכים של אתנול 100% קר קרח מדגם זה. מְעַרבּוֹלֶתלערבב. דגירה במשך 15 דקות ב -80 C.
- צנטריפוגה במשך 15 דקות ב 20,000 XG ב 4 ג. בזהירות למזוג supernatant, מוודא שלא להפריע את הכדור.
- בעדינות להוסיף 500 μl טריים אתנול קר כקרח 70%, מוודא שלא להפריע את הכדור. צנטריפוגה במשך 5 דקות ב 20,000 XG ב 4 ג. בזהירות למזוג supernatant.
- גלולה יבשה למשך כ 20 דקות (או עד יבש) בחלל ריק מהירות 45 ג.
הערה: זוהי נקודת הפסקה בפרוטוקול. ניתן לאחסן כדורי ה- DNA היבשים ב -20 C. - כדורי Resuspend ב 10 μl DDH 2 O. Pipet שוב ושוב מעל האזור שבו pelleted DNA, למרות הגלולה היבשה לא ניתן לראות.
- העבר 10 μl של כל דגימה על 0.3 מ"ל PCR צינור או 8-מתלה טריים, תלוי במספר דגימות.
19. תגובת ההארכה תחל P7
- מלאו את חישובי תערובת אמן P7 פריימר רחבים (לוח 18). הפוך רחבים לערבב ב 1.5 מיליליטר צינור על קרח. Pipet לערבב.
- הוסף 10 μl של תערובת הרחבה (פולימראז Φ-29 מינוס) לדגום כל 10 μl. Pipet לערבב.
- דגימות לרוץ thermocycler באמצעות תוכנית (לוח 19) כדי פריימר לחשל את התבנית עד 30 ג "להחזיק" צעד.
- הוסף 1 μl Φ-29 פולימראז במהלך 30 C "להחזיק" צעד בתוכנית. Pipet לערבב. קורות חיים עד סוף התוכנית (לוח 19).
20. A-עוקב תגובה
- מלא את חישובי תערובת אמן עוקב-A (לוח 20). הפוך-עוקב לערבב בתוך צינור 1.5 מ"ל על הקרח. Pipet לערבב.
- הוסף 10 μl של A-עוקב תמהיל מדגם זה. Pipet לערבב.
- ב thermocycler, דגירה דגימות עבור 30 דקות ב 37 ג, ולאחר מכן לחמם להשבית למשך 20 דקות ב 75 ג.
21. תגובת קשירת מתאם P5
- fill החוצה תמהיל חישובים מאסטר P5 מתאם קשירה (לוח 21). הפוך קשירת לערבב צינור 1.5 מ"ל על הקרח. Pipet לערבב.
- הוסף 20 μl של קשירת P5 לערבב מדגם זה. Pipet לערבב.
- ב thermocycler, דגירה דגימות עבור שעה 2 ב 25 ג.
22. חרוז נקי-אפ
הערה: אנא ראה סעיף חומרים לפרטי יצרן על חרוז לנקות.
- העברת כל מדגם 50 μl כדי צינור 1.5 מ"ל חדש.
- Resuspend לנקות חרוזים על כתף מיני-צינור ב הגדרת מהירות של 15 במשך 15 דקות ב RT. אל תתנו החרוזים להתיישב לפני pipetting.
- הוסף 60 μl לנקות חרוזים לדגום (1.2: 1 לנקות חרוזים לדגום היחס הוא קריטי כדי להסיר DNA המכיל פחות מ 200 זוגות בסיסים). Pipet לערבב במשך 20 שניות.
- Resuspend לנקות חרוזים על כתף מיני-צינור ב הגדרת מהירות של 15 דקות 3 ב RT. בקצרה ספין צינורות.
- מניח צינורות על המדף המגנטי 1 דקות.Pipet וישאירו supernatant.
הערה: אין להשתמש שאיפה ואקום בסעיף זה כי זה יהיה להתחנף החרוזים לנקות. - להוסיף 400 μl של טריות RT 70% אתנול מדגם זה בזמן שהם על מתלה מגנטית. אל תערבב. לשאוב supernatant. חזור 2x.
- לייבש את החרוזים לנקות במשך 10 דקות ב RT. הצבע של החרוזים יהפוך כהה הסדקים חומים בהירים מאוד קטנים יהיה גלוי הגלול השרף כאשר חרוזים יבשים.
- כדי elute DNA, להוסיף 40 μl 10mm טריס (pH 7.5). ביסודיות pipet לערבב במשך 20 שניות.
- מניח את הדגימות על המדף המגנטי 1 דקות. לאט pipet ולהעביר 36 μl eluate ישירות 0.3 מ"ל צינורות PCR.
- להמשיך ישירות eluates תגובה או חנות PCR ב -20 C.
יום 4: ניתוח PCR ו ג'ל
23. PCR
- מלא את חישובי תערובת אמן PCR (לוח 22). הפוך לערבב PCR. Pipet בעדינות מאוד לערבב כדי למנועבועות.
- להוסיף 14 μl של ה- PCR לערבב כל דגימת DNA 36 μl. Pipet לערבב. שמור על דגימות קרח עד מוכן לשים thermocycler.
- על בקרת PCR החיובית, כולל ספרייה שהוכנה קודם לכן. על הבקרה PCR שלילי, כולל מים. דגימות לרוץ thermocycler באמצעות תוכנית ה- PCR (לוח 23).
הכנת ג'ל 24., כריתת DNA, ויזואליזציה
- לנקות ביסודיות ולשטוף תיבת ג'ל בגודל מתאימה עם מים ללא יונים. הכן ג'ל agarose 1.5% (המכיל 0.5 מ"ג / מ"ל ethidium ברומיד) עם עבה, מסרק רחב היטב שיכול להכיל 60 μl.
הערה: ברומיד Ethidium (EtBr) הוא קרצינוגן ויש לטפל בו בזהירות. - ספין למטה דוגמיות PCR בקצרה לאסוף עיבוי.
- להוסיף 1/5 היקף לצבוע DNA קסילן 6x כדי מדגם משולב. אין להשתמש כחול bromophenol ב לצבוע DNA שכן הוא נודד באותו מקום כמו ה- DNA במדגם.
- טען int המדגםo כל טוב, רצוי עם בארות ריקות בין דגימות.
הערה: ספריות עם אינדקסים אותו ואסור לרוץ באותה ג'ל. - טען 7 μl 100 סולם נ"ב משני צדי דגימות. הפעל ג'ל ב -140 V עבור כ 30-45 דקות עד צבע bromophenol ב הסולם הוא ¾ הדרך למטה הג'ל.
- תמונה ולדמיין הג'ל על transilluminator בכל הגדרה UV נמוכה. ובלו קטעי agarose המכיל קטעי דנ"א 200 - 500 נ"ב. להיות מאוד זהיר, כדי למנוע חיתוך להקת דימר המתאם שיוצאת ב -125 נ"ב.
- מניחים כל פרוסה ג'ל נכרת לתוך צינור 15 מ"ל. משקל נטו שיא של כל פרוסת ג'ל. כתוב המשקל הזה ישירות על צינור.
- תמונה, שמורה, ותסמן ג'ל נכרת לאשר שנבחר טווח גודל נכון.
25. ג'ל טיהור
- לטהר DNA מן פרוסת ג'ל נכרתה על פי הוראות היצרן, בשינויים הבאים.
- ממיסים את הפרוסה ג'ל ידי נדנדהב RT על נדנדת פלטפורמה. זה ייקח כ 20 דקות כדי לפזר.
- כדי להשיג DNA נקי במיוחד, לשטוף עמודות עם 0.5 מיליליטר הצפת QG לאחר מומס ג'ל עבר דרך עמודה.
- לאחר לשטוף PE ההצפה, בואו עמודות לשבת ב RT במשך 2 - 5 דקות. ספין דקות 1 ב 13,000 XG ב RT.
- כדי לאפשר מקום תערובת אמן תגובת PCR, דגימות elute עם 40 μl EB הציפה לתוך צינור 1.5 מיליליטר טרי.
26. DNA כימות
- הכינו דגימות על פי הוראות היצרן (לוח 24). דגימות למדוד למכשיר שנבחר עם צינורות אופטיים.
- לאחר ספריות-exo שבב הם לכמת, להגיש עבור סידור על מערכת הפעלה שמשתמשת רצף-ידי-סינתזה כימיה 16 התואמת מתאמי ה- DNA בפרוטוקול זה.
הערה: בדרך כלל, 2 μl של המדגם הוא מספיק כימות, אבל יותר עשוי להיות נחוץ אם ריכוז מדגם נמוך. DNA מניב טיפוסימגוון ly בין 50 ל 200 ng. - לאחר כימות, דגימות חנות ב -20 C.
תוצאות
התמונות הבאות ממחישות תוצאות נציג מן פרוטוקול השבב exo שהוצג כאן. בניגוד מתודולוגיות שבב seq מסורתיים עם כמה צעדים אנזימטית, שבב exo דורש עשר תגובות אנזימטיות תלויות ברצף (איור 1). לפיכך, יש לנקוט זהירות בכל שלב על מנת להבטיח כי כל רכיב תגובה מתווסף תערובת מאסטר התגובה שלו בהתאמה. אנו ממליצים ליצור גיליון אלקטרוני נוסחה המבוססת על שולחנות התגובה לבצע את החישובים תמהיל מאסטר התגובה באופן אוטומטי, הדפסת לוחות וכתוצאה מכך, ולאחר מכן בודקים כל פריט לאחר הוספתה מיקס מאסטר.
אנו מפעילים מספר של אמצעי בקרת איכות לאורך כל הפרוטוקול כדי להבטיח תוצאות רצף באיכות גבוהה (איור 2). התגובה של כל שבב מכיל שלושה רכיבים בסיסיים: 1) sonicated תמצית הכרומטין מתאי של interest, 2) נוגדן המכוון נגד החלבון של עניין, ו -3) ProteinG (או ProteinA) שרף כדי לשתק את המתחמים חיסוניים זרזו. קבלת תמציות הכרומטין גבוהה sonicated איכות (איור 2 א) יכולה להיות מאתגרת למדי שכן תנאי sonication חייבים להיות מותאמים לכל סוג תא מכשיר sonication. זה שווה לבזבז זמן כדי לייעל שלב זה משום הספריות באיכות הגבוהות ביותר להתחיל עם מכך sonication מניב שבר DNA בין 100 - 500 נ"ב (איור 2 א, "+" שביל). מאז crosslinks פורמלדהיד הם יציב פורמלדהיד עצמה יש חיי מדף מוגבלים, אנו משתמשים assay משמרת ניידות electrophoretic (איור 2 א, "-" נתיב) על מנת לוודא כי תמציות sonicated מכילים crosslinks חלבון-דנ"א שלם, ברור כמו סופר-משמרת של שברי DNA. כדי להעריך אות הרקע אנו שגרתי לבצע "מדומה" שבב כי משמיט נוגדן מן התגובה שבב. שבב-לשעבר באיכות גבוההכנת ספריית o תהיה מעט מאוד, אם בכלל, אות רקע בשבב "המדומה" ( "-") ביחס נוגדן השבב הספציפי, במקרה זה מכוון נגד Pol II. כפי שניתן לראות באיור 2B, ספריות שבב seq מסורתיות יש משמעותי יותר אות רקע מ-exo שבב. לבסוף, לפני הרצף, שבב exo איכות ספרייה נבחן על bioanalyzer (איור 2 ג - ד). ניתוח מדויק מודד חלוקת גודל הספרייה ומזהה הדימרים מתאם זיהום (מסומן בחץ) שמופעלים על 125 נ"ב. אם הדימרים מתאם נוכחים, הם יוכלו להפחית את רוחב פס הרצף. לכן, אנו ממליצים על ניקוי חרוז נוסף כי יסיר ביעילות DNA שבר פחות מ -200 נ"ב.
שבב exo היא טכניקת גנומית תפקודית עצמה כי היא השיטה היחידה מסוגלת לפתור מסתעף מרחבית, הייזום, עצר, האריך RNA פולימראז II oנה מידת הגנום כולו (איור 3) 11. מאז אירועים מחייבים סמוכים קיימות עשרות זוגות בסיסים בנפרד, שבב seq אינו מסוגל להבחין בין אירועים המחייבים אלה בפתרון הכח של כמה מאה זוגות בסיסים.

איור 1: שבב Exo סכמטי. לאחר שבב, מתאם P7 הוא ligated לגבולות sonication. exonuclease למבדה אז עיטורי DNA 5 'ל 3' עד לנקודה crosslink, ובכך footprinting האינטראקציה חלבון-דנ"א. לאחר היפוך elution ו crosslink, הארכה יחל מסנתז DNA דופלקס. לבסוף, קשירת מתאם P5 מסמן את גבולות שמאלה וימינה exonuclease והספרייה וכתוצאה מכך הוא נתון רצף תפוקה גבוהה. מיפוי הקצוות "5 של תגי רצף הגנום התייחסות מתחמת המכשול exonuclease ובכך את מיקומה המדויק של ה- DNA חלבוןcrosslinking. איור שונה מן רי ואת פיו 17. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
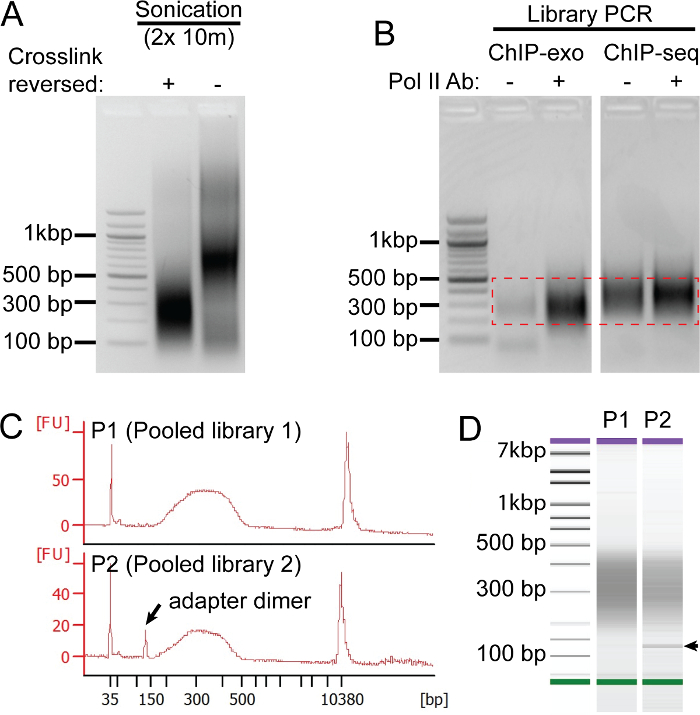
איור 2: בקרת איכות שבב exo. לוחות AC להראות תוצאות נציגים מניסויים קשורים. (א) איכות לחלץ הכרומטין sonicated (מקו תאים אנושיים HCC1806 סרטן השד) נבחנת על ידי ג'ל אלקטרופורזה agarose על תמציות עם (+) ובלי (-) את crosslinks התהפכה. crosslinks השלם יגרום קומפלקסי חלבונים-DNA להעביר איטי. לפיכך, פועל לחלץ ללא crosslinks הפוך (-) מאפשרת איכות crosslinks פורמלדהיד תוערך, אשר הם קריטיים עבור שבב מוצלח. (ב) השוואה בין IP מדומה (-) אnd Pol II (+) שבב exo והכנות ספרייה-seq שבב לאחר 21 מחזורים של הגברת PCR. לאחר PCR, קטעי דנ"א 200-500 נ"ב הם נכרתו (כונו על ידי תיבת מקוצר אדומה) מטוהרים באמצעות ערכת חילוץ ג'ל. (CD) ב C פנל, העקבות העליונות מייצגת עקבות אידיאליים ספרייה תיקווה (P1), ואת העקבות התחתונות מציגות ספרייה תיקווה (P2) המכיל הדימרים מתאם. לוח ד מציג את עלילת DNA הצפיפות מתאימת עקבות ספריית P1-2 המלוח C (חץ מציין להקת דימר מתאם). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
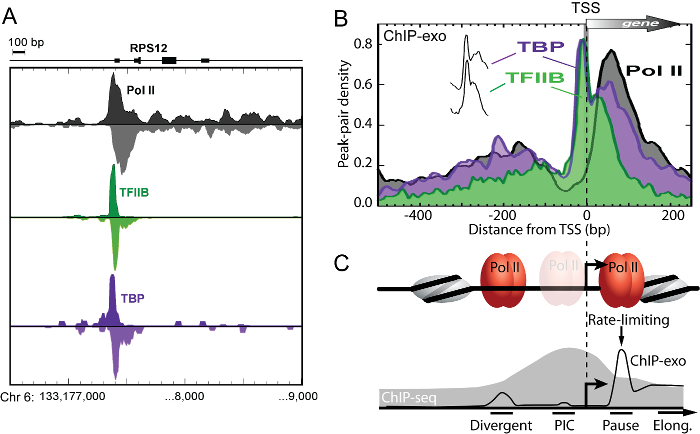
איור 3: שבב exo מרחבית פותר כיוונית ברור תמלול ייזום מכלולים. (א) חלוקת מוחלק של גדיל בהסרהed שבב exo תג 5 'מסתיים עבור Pol II, TFIIB, ו TBP ב גן RPS12 האדם מתרבה K562 תאים. (ב) בממוצע דפוסי שבב exo ברחבי RefSeq הקרוב TSS. תגי Peak-זוג היו מיושרים הגן-ידי-גן TSS, זרקו לפח במרווחי 10bp שאינו חופף ביחס TSS, ולאחר מכן ערך צפיפות שיא-זוג הממוצע בכל TFIIB כבושות (n = 6511) גנים היה זמם כמו אחוז מכלל תושבי העיר. את "הקוצים" של TBP ו TFIIB סמויים (לקזז אנכי הבלעה). (C) דגם המבוסס על לוח B נתונים, הממחישות מתחמי ייזום שעתוק ברורים נפתרו על ידי שבב exo (זכר שחור). Pol השנייה כבשה בשני מקומות פתירים נפרדים שעלו בקנה אחד עם אתרי חניכת שעתוק מסתעף ( "מסתעף") ואתרים "השהה". פרדה מרחבית ברורה זו של שניית מתחמי Pol עולה כי תמלילים מסתעפים לנבוע מתחמי ייזום ברורים. פוליטיקאי הרוב המכריע השני abo crosslinked ut 50 נ"ב במורד הזרם של TSS באתר "השהה", שבה הוא צפוי להשהות לאחר התחלת שעתוק. Pol II היה מדולדל ביותר 20 - 60 נ"ב במעלה הזרם של TSS שם המתחם מראש ייזום ( "PIC") צורות, המציין כי בממוצע זה מבלה סביר פחות זמן שם מאשר באתרי מושהות. הדבר מצביע על כך ברוב (אך לא בהכרח בכולם), פעם Pol II מגויסת, זה במהירות מנקה האמרגן ומניח המדינה- עצר כ 30 - 50 נ"ב במורד הזרם של TSS, עולה בקנה אחד עם תצפית כי שחרור Pol II הפסקה הוא צעד שער הגבלה בתעתיק. מתחמי ייזום סמוכים אלה פתירים ידי-seq שבב (מאויר על ידי עקבות מילוי אפורות) מאז בהחלטתה מוגבלת לכמה מאה זוגות בסיסים. איור שונה מן Pugh ו Venters 11. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 1 M HEPES-KOH (pH 7.5) | 50 | 50 מ"מ |
| 5 M NaCl | 28 | 140 מ"מ |
| 0.5 M EDTA | 2 | 1 מ"מ |
| 100% גליצרול | 100 | 10% |
| 10% NP40 | 50 | 0.50% |
| 10% טריטון X100 | 25 | 0.25% |
| DDH 2 O | מלאו עד 1 L |
מתכון 1. טבלת הצפת תמוגה 1. מסנן באמצעות 0.22 מיקרומטר הסינון. חנות ב 50 מ"ל צינורות ב 4 ג. הוספת 100 μl המניה למדד ל -50 מ"ל של חיץ רק לפני השימוש.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 1 M טריס- HCl (pH 8) | 10 | 10 מ"מ |
| 5 M NaCl | 40 | 200 מ"מ |
| 0.5 M EDTA | 2 | 1 מ"מ |
| 0.5 M EGTA | 1 | 0.5 מ"מ |
| DDH2 O | מלאו עד 1 L |
מתכון טבלה 2. עבור הצפת תמוגה 2. סינון באמצעות 0.22 מיקרומטר הסינון. חנות ב 50 מ"ל צינורות ב 4 ג. הוספת 100 μl המניה למדד ל -50 מ"ל של חיץ רק לפני השימוש.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 1 M טריס- HCl (pH 8) | 10 | 10 מ"מ |
| 5 M NaCl | 20 | 100 מ"מ |
| 0.5 M EDTA | 2 | 1 מ"מ |
| 0.5 M EGTA | 1 | 0.5 מ"מ |
| 10% Deoxycholate | 10 | 0.10% |
| N-lauroylsarcosine | 5 גרם | 0.5% (w / v) |
| DDH 2 O | מלאו עד 1 L |
מתכון טבלה 3. הצפת תמוגה 3. מסנן באמצעות 0.22 מיקרומטר הסינון. חנות ב 50 מ"ל צינורות ב 4 ג. הוספת 100 μl המניה למדד ל -50 מ"ל של חיץ רק לפני השימוש.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 10x PBS | 50 | 1x |
| שור סרום אלבומין | 2.5 גרם | 0.50% |
| DDH 2 O | מלאו 500 |
מתכון טבלה 4. עבור חסימה בַּלָם. סנן באמצעות 0.22 מיקרומטר הסינון. חנות ב 50 מ"ל צינורות ב 4 ג. הוספת 100 μl המניה למדד ל -50 מ"ל של חיץ רק לפני השימוש.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 1 M HEPES (pH 7.5) | 25 | 50 מ"מ |
| 0.5 M EDTA (pH 8) | 1 | 1 מ"מ |
| 10% נתרן Deoxycholate | 35 | 0.70% |
| 10% NP40 | 50 | 1% |
| 1 M LiCl | 250 | 500 מ"מ |
| DDH 2 O | מלאו 500 |
מתכון טבלה 5. עבור הצפת ריפה. סנן באמצעות 0.22 מיקרומטר הסינון. חנות ב 50 מ"ל צינורות ב 4 ג. הוספת 100 μl המניה למדד ל -50 מ"ל של חיץ רק לפני השימוש.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 1 M טריס-Cl (pH 7.5) | 2.5 | 50 מ"מ |
| 0.5 M EDTA | 1 | 10 מ"מ |
| 20% SDS | 2.5 | 1% |
| DDH 2 O | מלאו 50 |
מתכון טבלה 6. עבור שבב הצפת elution. סנן באמצעות 0.22 מיקרומטר הסינון. חנות ב RT.
| מֵגִיב | נפח (מ"ל) | [סופי] |
| 1 M טריס-Cl (pH 7.5) | 0.5 | 10 מ"מ |
| DDH 2 O | מלאו 50 |
מתכון טבלת 7. עבור TE הצפה. סנן באמצעות 0.22 מיקרומטר הסינון. חנות ב 4 ג.
| נפח (μl) | [סופי] | |
| 100 מיקרומטר ExA2-iX | 75 | 15 מיקרומטר |
| 100 מיקרומטר ExA2-33 | 75 | 15 מיקרומטר |
| 1 M טריס (pH 7.5) | 50 | 100 מ"מ |
| 5 M NaCl | 5 | 50 מ"מ |
| DDH 2 O | 295 | - |
| נפח כולל | 500 |
לוח 8: חישול מתאם P7 לערבב.
| נפח (μl) | [סופי] | |
| 100 מיקרומטר ExA1-58 | 75 | 15 מיקרומטר |
| 100 מיקרומטר ExA1-13 | 75 | 15 מיקרומטר |
| 1 M טריס (pH 7.5) | 50 | 100 מ"מ |
| 5 M NaCl | 5 | 50 מ"מ |
| DDH 2 O | 295 | - |
| נפח כולל | 500 |
לוח 9: חישול מתאם P5 לערבב.
| Temp (C) | זְמַן |
| 95 | 5 דקות |
| 72 | 5 דקות |
| 65 כדי 60 כבש ירידה | 5 דקות |
| 55 כדי 50 כבש ירידה | 3 דקות |
| 45 כדי 40 כבש ירידה | 3 דקות |
| 30 | 3 דקות |
| 20 | 3 דקות |
| 10 | 3 דקות |
| 4 | לָנֶצַח |
טבלה 10. תוכנית חישול מתאם.
| 1x (μl) | [סופי] | |
| DDH 2 O | 39.8 | |
| מאגר התגובה 10x 2 | 5 | 1x |
| 100 מיקרומטר ATP | 0.5 | 1 מ"מ |
| 3 מ"מ dNTPs | 1.7 | 100 מיקרומטר |
| 3 U / פולימראז T4 μl | 1 | 3 U |
| 5 U / μl Klenow | 1 | 5 U |
| 10 U / μl T4 Polynucleotide קינאז | 1 | 10 U |
| עוצמת התגובה סה"כ | 50 |
שילוב הורים צחצוח טבלה 11..
| 1x (μl) | [סופי] | |
| DDH 2 O | 42.3 | |
| מאגר התגובה 10x 2 | 5 | 1x |
| 3 מ"מ dATP | 1.7 | 100 מיקרומטר |
| 5 U / μl Klenow מינוס exo '3'-5 | 1 | 5 U |
| עוצמת התגובה סה"כ | 50 |
טבלת 12. A-עוקבים תערובת מאסטר.
| 1x (μl) | [סופי] | |
| DDH 2 O | 41 | |
| 100 מ"מ ATP | 0.5 | 1 מ"מ |
| מאגר התגובה 10x 2 | 5 | 1x |
| 400 U / μl T4 DNA LigASE | 1.5 | 600 U |
| עוצמת התגובה תערובת | 48 | |
| מתאם 15 מ"מ אינדקס | 2 | 30 picomoles |
| עוצמת התגובה סה"כ | 50 |
טבלה 13. P7 מתאם קשירת תערובת מאסטר.
| 1x (μl) | [סופי] | |
| DDH 2 O | 41 | |
| 10x Φ-29 הצפה | 5 | 1x |
| 3 מ"מ dNTPs | 2.5 | 150 מיקרומטר |
| פולימראז 10 U / μl Φ-29 | 1.5 | 15 U |
| עוצמת התגובה סה"כ | 50 |
טבלה 14. Φ-29 ניק תיקון תערובת מאסטר.
| 1x (μl) | [סופי] | |
| DDH 2 O | 43.5 | |
| 100 מ"מ ATP | 0.5 | 1 מ"מ |
| מאגר התגובה 10x 2 | 5 | 1x |
| 10 U / μl T4 Polynucleotide קינאז | 1 | 10 U |
| עוצמת התגובה סה"כ | 50 |
שילוב הורי טבלה 15. קינאז תגובה.
| 1x (&# 956; l) | [סופי] | |
| DDH 2 O | 43 | |
| 10x Lambda הצפה | 5 | 1x |
| 5 U / μl exonuclease למבדה | 2 | 10 U |
| עוצמת התגובה סה"כ | 50 |
טבלה 16. למבדה exonuclease תמהיל מאסטר התגובה.
| 1x (μl) | [סופי] | |
| DDH 2 O | 44 | |
| מאגר התגובה 10x 2 | 5 | 1x |
| 30 U / μl RecJ exonuclease f | 1 | 30 U |
| נ התגובה סה"כolume | 50 |
לוח 17. RecJ f Nuclease התגובה תערובת מאסטר.
| 1x (μl) | [סופי] | |
| DDH 2 O | 6.45 | |
| 10x Φ-29 הצפה | 2 | 1x |
| 3 מ"מ dNTP | 1.3 | 200 מיקרומטר |
| 20 מיקרומטר P7 פריימר | 0.25 | 0.25 מיקרומטר |
| עוצמת התגובה תערובת | 10 | |
| מדגם EtOH זירז | 10 | |
| עוצמת התגובה סה"כ | 20 |
P7 טבלה 18.תמהיל מאסטר תגובה הרחבה פריימר.
| Temp (C) | זְמַן |
| 95 | 5 דקות |
| 65 | 5 דקות |
| 30 | 2 דקות |
| 30 | חזק עד Φ-29 מתווספים |
| 30 | 20 דק ' |
| 65 | 10 דק ' |
| 4 | לָנֶצַח |
טבלה 19. תוכנית הרחבה P7 פריימר.
| 1x (μl) | [סופי] | |
| DDH 2 O | 5 | |
| 10x תגובת הצפה 2 | 3 | 1x |
| 3 מ"מ dATP | 1 | 0.1 מ"מ |
| 5 U / μl Klenow 3 'ל 5' מינוס exo | 1 | 5 U |
| עוצמת התגובה תערובת | 10 | |
| מדגם פריימר המורחבת | 20 | |
| עוצמת התגובה סה"כ | 30 |
טבלת 20. A-עוקבים תערובת מאסטר.
| 1x (μl) | [סופי] | |
| DDH 2 O | 11.5 | |
| 10x T4 אנזים הצפה | 5 | 1x |
| 15 מיקרומטר ExA1-58 /13 מתאם | 2 | 30 picomoles |
| 400 U / μl האנזים T4 DNA | 1.5 | 600 U |
| עוצמת התגובה תערובת | 20 | |
| A-זנב מדגם | 30 | |
| עוצמת התגובה סה"כ | 50 |
טבלה 21. P5 מתאם קשירת תערובת מאסטר.
| 1x (μl) | [סופי] | |
| 5x PCR הצפה | 10 | 1x (2 מ"מ MgCl 2) |
| 10 מ"מ של כל dNTP | 1 | 200 מיקרומטר אחד |
| 20 מיקרומטר P1.3 פריימר | 1.25 | 0.5 מיקרומטר |
| 20 מיקרומטר P2.1 פריימר | 1.25 | 0.5 מיקרומטר |
| 2 U / פולימראז חם התחל μl | 0.5 | 1 U |
| עוצמת התגובה תערובת | 14 | |
| חרוז eluted מדגם | 36 | |
| עוצמת התגובה סה"כ | 50 |
טבלה 22. PCR.
| Temp (C) | זְמַן | מחזורים |
| 98 | 30 שניות | 1 |
| 98 | 10 שניות | 15-21 (תלוי יעיל שבב) |
| 52 | 30 שניות | |
| 72 | 20 שניות | |
| 72 | 2 דקות | 1 |
| 4 | לָנֶצַח | לְהַחזִיק |
טבלה 23. תוכנית ה- PCR.
| לפי DNA רגיל (μl) | לדגימה (μl) | |
| 1: 200 תערובת חיץ / לצבוע מדולל | 190 | 198 |
| תקני ה- DNA | 10 | |
| ספריית שבב exo | 2 | |
| נפח כולל | 200 | 200 |
טבלה 24. כימות.
Discussion
אנו מציגים פרוטוקול גנומית תפקודי כדי לקבוע את המיקום המחייב המדויק עבור הכרומטין אינטראקצית חלבוני משוא פנים, רחב-הגנום ברזולוצית זוג הבסיס קרובה. השלב הקריטי ביותר להשיג ברזולוצית מיפוי זוג ליד הבסיס הוא טיפול exonuclease של ה- DNA השבב מועשר בעוד immunoprecipitate נשאר על השרף המגנטי. לכאורה, קומפלקסי חלבונים עלולים לחסום in vivo footprinting של כל תת-יחידה מסוימת (למשל, מתחמי שיפוץ הכרומטין או חלקיק הליבה הנוקלאוזום). עם זאת, כפי שדווח בעבר 10, מאז פורמלדהיד הוא crosslinker יעיל, הוא הופך להיות סביר יותר ויותר כי יחידות משנה מרובים של קומפלקס היה crosslink ל- DNA ואת כל האחרים באותו תא באותו הלוקוס. לפיכך, footprinting vivo של יחידות משנת פרט של קומפלקס חלבון, כגון יחידות משנת היסטון פרט של הנוקלאוזום, אפשרי עם-exo שבב.
t "> היתרונות הבולטים של-exo השבב הם ברזולוצית זוג הבסיס ליד שלה ורקע נמוך. ההחלטה הגבוהה במיוחד מאפשר תובנות מבניים מרחבית מפורט להתבצע בסולם הגנום כולו שאינם כיום אפשריים עם כל שיטה אחרת . מצד שני, המגבלה העיקרית של שבב exo היא שזה מתודולוגיה ביולוגיה מולקולרית מאתגרת מבחינה טכנית כדי להתמחות. בנוסף, המגבלות הכלליות של צעד השבב חלות גם על-exo שבב (למשל, זמינות נוגדנים מסחריות וספציפי נגישות, epitope, ומספר גדול יחסית של תאי חובה). כשל נפוץ כולל מיצויי sonicated באיכות ירודות, באמצעות נוגדן כיתה שאינו שבב, ולא שמירה על דגימות קרח ככל האפשר. לכן, תנאי sonication חייבים להיות מותאמים בקפידה כל נוגדן תוקף כפי שתואר לעיל 18, כדי למנוע את השפעות מזיקות פרמטרים אלה יכולים להיות על התוצאה הניסיונית.כל עודעומק רצף עבור מטרה גורם שעתוק, אנחנו בדרך כלל לשאוף כ -20 מיליון ייחודיים מיושר קוראים. מאז Pol השנייה ושינויים היסטון מופצים באופן נרחב יותר, אנו שואפים במשך 30 עד 50 מיליון קורא. חשוב לציין, שמאז-exo שבב יש רקע פחות משמעותי-seq שבב, פחות קורא נדרשים להשיג עומק רצף דומה.
טכנולוגית השבב exo בימים אלה לאימוץ נרחב למרות האתגרים הטכניים שלה, כמו וריאציות חזקות על הפרוטוקול המקורי תוספנה להתפרסם 17,19,20. בפרט, וריאציה אחד אשר עשוי להיות לעזר עבור קשה חלבוני שבב נקראת שבב קשר, אשר משתמש צעד קשירה אחת כדי להגדיל את יעילות תכשיר הספרייה 20. לסיכום,-exo שבב הוא מועסק יותר ויותר וחזק מתודולוגיה למיפוי רזולוציה גבוהה במיוחד של חלבונים אינטראקציה הכרומטין בקנה מידה עולמי. כמו הרשימה של נמלת שבב כיתה זמינה מסחריibodies ממשיך לגדול, יישומים עתידיים של המתודולוגיה השבב exo יופנו כלפי רשתות רגולטוריות גן מיפוי נודע להבין את המעגלים המולקולריים של תא רזולוציה גבוהה במיוחד. בנוסף, שבב exo יהיה מעודן יותר סביר ומותאם טביעת in vivo אינטראקציות החלבון-RNA ברזולוצית זוג הבסיס קרובה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank the Venters Lab and members of the Molecular Physiology and Biophysics Department for helpful discussions. Special thanks to Frank Pugh for his guidance, mentoring, and many insightful discussions on the nuances of ChIP-exo while I was a post-doctoral fellow in his laboratory.
Materials
| Name | Company | Catalog Number | Comments |
| 37% formaldehyde, methanol free, 10x10ml ampules | ThermoFisher Scientific | 28908 | Section 3 |
| Complete Protease Inhibitor cocktail (CPI) | Roche Life Science | 11873580001 | Sections 4, 8 |
| Bioruptor sonicator | Diagenode | UCD200 | Section 5 |
| 15 ml polystyrene tubes | BD Falcon | 352095 | Section 5 |
| MagSepharose Protein G Xtra beads | GE Healthcare | 28-9670-66 | Section 6 |
| DynaMag-1.5ml Side Magnetic Rack | Invitrogen | 12321D | Sections 6-17, 22 |
| Mini-Tube Rotator | Fisher Scientific | 05-450-127 | Sections 7, 22 |
| T4 DNA Polymerase | New England BioLabs | M0203 | Section 9 |
| DNA Polymerase I, Klenow | New England BioLabs | M0210 | Section 9 |
| 10x NEBuffer 2 (10x Reaction Buffer 2) | New England BioLabs | B7002 | Sections 9-11, 13, 15, 20 |
| Thermomixer C | Eppendorf | 5382 | Sections 9-16 |
| ATP | Roche Life Science | 010419979001 | Sections 9, 11, 13 |
| dNTPs | New England BioLabs | N0447 | Sections 9, 12, 19, 23 |
| T4 Polynucleotide Kinase | New England BioLabs | M0201 | Sections 9, 13 |
| dATP | New England BioLabs | N0440 | Sections 10, 20 |
| Klenow 3'-5' Exo Minus | New England BioLabs | M0212 | Sections 10, 20 |
| T4 DNA ligase | New England BioLabs | M0202 | Sections 11, 21 |
| Φ-29 DNA Polymerase | New England BioLabs | M0269 | Sections 12, 19 |
| 10x Φ-29 Buffer | New England BioLabs | B0269 | Sections 12, 19 |
| Lambda Exonuclease | New England BioLabs | M0262 | Section 14 |
| 10x Lambda Buffer | New England BioLabs | B0262 | Section 14 |
| RecJf Exonuclease | New England BioLabs | M0264 | Section 15 |
| Proteinase K | Roche Life Science | 03115828001 | Section 16 |
| Glycogen | Roche Life Science | 010901393001 | Section 18 |
| 10x T4 Ligase Buffer | New England BioLabs | B0202 | Section 21 |
| AMPure XP (clean up) beads | Beckman Coulter | A63881 | Section 22 |
| Q5 Hot Start DNA Polymerase | New England BioLabs | M0493 | Section 23 |
| 5x Q5 Buffer (5x PCR Buffer) | New England BioLabs | B9027 | Section 23 |
| Qubit Fluorometer | Invitrogen | Q33216 | Section 25 |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | Section 25 |
| Optical Clear Qubit tubes | Invitrogen | Q32856 | Section 26 |
| Qubit dsDNA High Sensitivity Assay kit | Invitrogen | Q32851 | Section 26 |
References
- Venters, B. J., Pugh, B. F. How eukaryotic genes are transcribed. Crit Rev Biochem Mol Biol. 44, 117-141 (2009).
- Rhee, H. S., Pugh, B. F. Comprehensive genome-wide protein-DNA interactions detected at single-nucleotide resolution. Cell. 147, 1408-1419 (2011).
- Chen, J., et al. Single-molecule dynamics of enhanceosome assembly in embryonic stem cells. Cell. 156, 1274-1285 (2014).
- Wales, S., Hashemi, S., Blais, A., McDermott, J. C. Global MEF2 target gene analysis in cardiac and skeletal muscle reveals novel regulation of DUSP6 by p38MAPK-MEF2 signaling. Nucleic acids research. 42, 11349-11362 (2014).
- Cho, S., et al. The architecture of ArgR-DNA complexes at the genome-scale in Escherichia coli. Nucleic Acids Res. 43, 3079-3088 (2015).
- Katainen, R., et al. CTCF/cohesin-binding sites are frequently mutated in cancer. Nat Genet. 47, 818-821 (2015).
- Murphy, M. W., et al. An ancient protein-DNA interaction underlying metazoan sex determination. Nat Struct Mol Biol. 22, 442-451 (2015).
- Zere, T. R., et al. Genomic Targets and Features of BarA-UvrY (-SirA) Signal Transduction Systems. PLoS One. 10, e0145035 (2015).
- Rhee, H. S., Pugh, B. F. Genome-wide structure and organization of eukaryotic pre-initiation complexes. Nature. 483, 295-301 (2012).
- Rhee, H. S., Bataille, A. R., Zhang, L., Pugh, B. F. Subnucleosomal structures and nucleosome asymmetry across a genome. Cell. , 1377-1388 (2014).
- Pugh, B. F., Venters, B. J. Genomic Organization of Human Transcription Initiation Complexes. PLoS One. 11, e0149339 (2016).
- Albert, I., Wachi, S., Jiang, C., Pugh, B. F. GeneTrack--a genomic data processing and visualization framework. Bioinformatics. 24, 1305-1306 (2008).
- Guo, Y., Mahony, S., Gifford, D. K. High resolution genome wide binding event finding and motif discovery reveals transcription factor spatial binding constraints. PLoS computational biology. 8, e1002638 (2012).
- Bardet, A. F., et al. Identification of transcription factor binding sites from ChIP-seq data at high resolution. Bioinformatics. 29, 2705-2713 (2013).
- Wang, L., et al. MACE: model based analysis of ChIP-exo. Nucleic Acids Res. 42, e156 (2014).
- Bentley, D. R., et al. Accurate whole human genome sequencing using reversible terminator chemistry. Nature. 456, 53-59 (2008).
- Rhee, H. S., Pugh, B. F. ChIP-exo method for identifying genomic location of DNA-binding proteins with near-single-nucleotide accuracy. Curr Protoc Mol Biol. Chapter 21, Unit 21.24 (2012).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Res. 22, 1813-1831 (2012).
- Serandour, A. A., Brown, G. D., Cohen, J. D., Carroll, J. S. Development of an Illumina-based ChIP-exonuclease method provides insight into FoxA1-DNA binding properties. Genome Biol. 14, R147 (2013).
- He, Q., Johnston, J., Zeitlinger, J. ChIP-nexus enables improved detection of in vivo transcription factor binding footprints. Nat Biotechnol. 33, 395-401 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved