Method Article
הערכת Hypermutation תאים סומטיים ב ראמוס B לאחר Overexpression או מציאה של גנים ספציפיים
In This Article
Summary
אנו מתארים כיצד לבצע זיהומים retroviral או lentiviral של overexpression או shRNA המכילים בונה את קו האדם ראמוס תא B וכיצד למדוד hypermutation סומטיים בתאים אלה.
Abstract
בתאי B להתחיל את החיים שלהם עם נוגדנים זיקה נמוך שנוצר על ידי רקומבינציה V J (ד '). עם זאת, על גילוי פתוגן, (V) את המשתנה באזור של גן אימונוגלובולינים (איג) עובר מוטציה כ -100,000 פי יותר משאר הגנום באמצעות hypermutation סומטי (SHM), וכתוצאה מכך 1,2 זיקה נוגדנים גבוהה. בנוסף, מתג בכיתה רקומבינציה (CSR) מייצר נוגדנים עם מפעיל פונקציות שונות בהתאם לסוג התגובה החיסונית הדרוש פתוגן מסוים. שני CSR ו SHM הם שיזמו דאמינז ההפעלה הנגרמת cytidine (AID), אשר deaminates שאריות ציטוסין ב-DNA כדי לייצר uracils. Uracils אלה מטופלות על ידי צורות מועדת לטעויות של מסלולי תיקון, המוביל בסופו של דבר מוטציות רקומבינציה 1-3.
ההבנה הנוכחית שלנו את הפרטים המולקולריים של SHM ו CSR לבוא משילוב של מחקרים בעכברים, תאים ראשוניים, שורות תאים, ותא-fרי ניסויים. מודלים עכבר להישאר תקן הזהב עם knockouts הגנטי מראה תפקידים קריטיים עבור גורמים רבים לתקן (למשל אונג, Msh2, MSH6, Exo1 ו פולימראז η) 40-10. עם זאת, לא כל הגנים הנוחות ללימודי בנוקאאוט. לדוגמה, knockouts של כמה גדיל פעמיים חלבונים לתקן לשבור הם קטלניים embryonically או לפגום B-cell פיתוח 11-14. יתר על כן, לפעמים הפונקציה ספציפי של חלבון ב SHM או אחריות חברתית עשויה להיות רעולי פנים על ידי פגמים הגלובלי הנגרם על ידי יותר בנוקאאוט. בנוסף, מאז ניסויים בעכברים יכול להיות ארוך, לשנות את הביטוי של גנים בודדים שורות תאים הפך יותר ויותר פופולרי הצעד הראשון לזיהוי ואפיון גנים מועמדים 15-18.
ראמוס - תא לימפומה Burkitt קו constitutively עובר SHM - כבר מודל פופולרי תא שורת ללמוד SHM 18-24. אחד היתרונות של תאים ראמוס הוא שיש להם מובנית למחצה נוחמדד כמותי-SHM. תאים מסוג Wild להביע IgM, וכפי שהם להרים מוטציות, כמה מוטציות לדפוק את הביטוי IgM. לכן, assaying הפסד IgM ידי סריקת הקרינה המופעל תאים (FACS) מספק מהיר לקריאה החוצה ברמה של SHM. מדידה כמותית של SHM יותר ניתן להשיג על ידי ישירות רצף הגנים נוגדנים.
מכיוון שתאי ראמוס קשה transfect, אנחנו מייצרים נגזרים יציב הגדילו או הוריד הביטוי של גן יחיד על ידי הדבקה של תאים עם בונה retroviral או lentiviral המכילות קלטת overexpression או סיכת ראש רנ"א קצרות (shRNA), בהתאמה. כאן, אנו מתארים כיצד אנו להדביק תאים ראמוס ולאחר מכן להשתמש בתאים אלה כדי לחקור את תפקידה של גנים ספציפיים על SHM (איור 1).
Protocol
1. הכנת דגימות תאים
- בצעו הכנה בקנה מידה בינוני של ה-DNA (midiprep) של overexpression או shRNA המכילים בונה וקטור retroviral אריזה pKat2 או וקטורים אריזה lentiviral pVSV-G, pMDLg / pRRE, pRSV ו-Rev 25. השתמש ב-DNA 6 מיקרוגרם לבנות עבור כל אחד 4 מיקרוגרם של pKat2 (לטיפול בדלקות retroviral) או הדנ"א 1.5 מיקרוגרם עבור כל אחד pVSV-g, pMDLg / pRRE, pRSV ו-Rev וקטורים אריזה (לטיפול בדלקות lentiviral).
- הכן בוסק 23 התקשורת. עבור transfection, להשתמש בשני בינוני unamended שונה Dulbecco של הנשר (DMEM) וכן DMEM להשלים. כדי להפוך את DMEM להשלים, להוסיף 1% HEPES חיץ, 1% פניצילין, סטרפטומיצין, גלוטמין (PGS), ו -10% נסיוב עגל בן יומו (NCS) אל בקבוק DMEM.
- הכן ראמוס התקשורת. עבור השלב זיהום, לעשות להשלים RPMI-1640 בינוני (RPMI) על ידי הוספת HEPES 1%, PGS 1%, ו -10% בסרום שור עוברית (FBS) אל בקבוק RPMI. עבור השלב זריעת תא יחיד, מ 'האייק "מותנית" על ידי התקשורת גדל תאים ראמוס ב RPMI המלא ל 2 ימים, ספינינג את התאים למטה אל X 400 גרם במשך 4 דקות וסינון supernatant עם 0.2 מיקרומטר לסנן לתוך בקבוק סטרילי. כמו התקשורת להשלים אחרות, התקשורת מותנה מאוחסן 4 ° C עד הצורך.
- פיצול 3 x 10 6 בוסק 23 תאים לתוך צלחת 100 מ"מ ב 10 מ"ל DMEM להשלים את יום לפני transfection כך התאים יהיו% 50-60 יום confluency של transfection. הפוך את צלחת אחת של תאים עבור כל וקטור אתם מתכננים transfecting. חשוב כי התאים לא נשמרו בתרבות יותר מדי זמן, להשתמש במספר נמוך מעבר תאים או תאים מופשרים לאחרונה transfection והן צעדים כדי להבטיח זיהום זיהום טוב.
- כלול שולטת עבור הניסויים שלך. עבור transfections וזיהומים, ליצור שליטה שלילי (תאים untransfected או נגוע) וכן בקרת חיובי (וירוס המבטא GFP ו-puromycin התנגדות גן). עבור exper לדפוק למטה shRNAiments, להדביק היטב עם חביתה או שליטה shRNA רלוונטי.
2. Transfecting בוסק 23 תאים
- לחמם את בקבוקי DMEM unamended ו DMEM להשלים ב 37 ° C.
- הסר מן התקשורת 23 תאים בוסק ולהחליף עם 5 מ"ל של DMEM להשלים. מחזירים את התאים 37 ° C עד החממה להשתמש בשלב 2.6.
- לחמם את בקבוק FuGENE 6 בטמפרטורת החדר במשך 5 דקות ואז מערבולת בקצרה (<1 שנייה).
- Aliquot 600 DMEM unamended μL לתוך צינור microcentrifuge 1.5 מ"ל.
- מדולל 30 FuGENE μL 6 לתוך 600 DMEM unamended μL, בקצרה מערבולת (<1 שנייה) ולאחר מכן לדגור בטמפרטורת החדר במשך חמש דקות. הקפד טפטפת ישירות לתוך התקשורת. אל תתנו 6 FuGENE לגעת צידי הצינור.
- הוסף 6 לבנות ו מיקרוגרם או 4 מיקרוגרם pKat2 (זיהומים retroviral) או 1.5 מיקרוגרם אחד pVSV-G, pMDLg / pRRE, pRSV ו-Rev (זיהומים lentiviral) כדי לערבב את 6 DMEM / FuGENE, מערבולת BRI אפי (<1 שנייה) ולאחר מכן לדגור בטמפרטורת החדר למשך 25 דקות.
- מוסיפים את ה-DNA / DMEM / 6 FuGENE תערובת של 23 תאים בוסק ולחזור 37 מעלות באינקובטור למשך 24 שעות.
- לאחר 24 שעות, מוסיפים 5 מ"ל DMEM להשלים את התאים transfected ולחזור 37 ° C חממה עוד 24 שעות.
3. מסיק חלקיקים נגיפיים
- קציר 10 מ"ל של מדיה מן transfected בוסק 23 תאים עם מזרק 10 מ"ל.
- צרף 0.45 מיקרומטר מסנן עד סוף המזרק ולסנן את התקשורת לתוך צינור נקי מ"ל 15 פוליפרופילן.
- השתמש בתקשורת ויראלי מיד או להקפיא כמו 1 aliquots מ"ל 2 בקבוקוני קריוגני מ"ל ב -80 ° C.
- לאחר קצירת התקשורת ויראלי, לאשר transfection יעיל התרחשה בתאי בקרה חיובית על ידי FACS. זה יכול להעשות גם עבור כל הדגימות אם לבנות מכיל גם (GFP למשל) או פלורסנט סמן על פני קרום התא (לדוגמא Thy1).
- 2 זרעים מ"ל של 2 x 10 5 תאים / מ"ל תאים ראמוס ב RPMI להשלים לתוך צלחת 6-באר 24 שעות לפני ההדבקה. שוב, הקפד להשתמש במספר נמוך מעבר תאים או תאים מופשרים לאחרונה כדי להבטיח הדבקה טובה.
- אם אתה משתמש aliquots קפוא של הנגיף, להפשיר את התקשורת ויראלי במהירות 37 ° C.
- מערבבים 1 מ"ל התקשורת ויראלי עם μL 3 של polybrene מ"ג / מ"ל 10. הריכוז הסופי של polybrene יש 10 מיקרוגרם / מ"ל בנפח כולל של 3 מ"ל.
- מוסיפים את תערובת וירוס / polybrene לתאי ומערבבים היטב על ידי pipetting. כפי שהוזכר קודם לכן, אחד טוב צריך לשמש מלאה נגוע, מוסיפים 1 מ"ל RPMI להשלים 3 polybrene μL לנגיף 1 זה גם במקום מ"ל. הקפד להדביק אחד מוכר היטב עם שליטה שלילי בהתאמה. אנחנו גם להדביק באר אחת עם וקטור-GFP המכיל, על מנת לקבוע יעילות זיהום על ידי FACS.
- צנטריפוגה את הצלחת היטב 6-3000-X גרם במשך 90 דקות בטמפרטורת החדר.
- מחזירים את הצלחת37 ° C החממה למשך 48 שעות.
- לאחר 48 שעות, ספין את התאים הנגועים בתוך שפופרת 15 מ"ל פוליפרופילן ב 400 X גרם במשך 4 דקות בטמפרטורת החדר. הסר את התקשורת על ידי שאיפה, להיות בטוח לא להפריע תא גלולה. Resuspend התאים RPMI טריים.
- אשר את היעילות של זיהום במדגם בקרה חיובית על ידי FACS. כמו בעבר, אתה יכול לעשות את זה עבור כל דגימות שלך אם לבנות מכיל גם (GFP למשל) או פלורסנט סמן על פני קרום התא (לדוגמא Thy1).
- התחל בחירת התאים (אם רלוונטי). בונה shRNA המכילים שלנו מכילים כל קלטת התנגדות puromycin. אנו בוחרים shRNA תאים הנגועים ראמוס עם 0.25 מיקרוגרם / מ"ל puromycin. אנו מוצאים כי נגזרות של תאים ראמוס לפעמים להראות שינוי הרגישות puromycin, ולכן אנו מבצעים להרוג עקומות כדי לייעל את הריכוז של puromycin עבור כל נגזרת. בנוסף לטיפול בתאי השליטה נגוע עם puromycin לאשר כי הבחירה היא יעילה.
זריעת יחיד יכול להתבצע באחת משתי דרכים: על ידי FACS מיון או באופן ידני.
- FACS: השתמש סדרן FACS עם מתאם צלחת לתא זרע 1 / היטב בצלחת 96-היטב מראש מלא μL 100 של 40% RPMI/40% מותנה media/20% FBS. שיטה זו נותנת הרבה שיבוטים תא בודד יותר לכל צלחת.
- ידנית: ספירת התאים. מדולל aliquot של תאים עד 10 תאים / מ"ל ב 40% RPMI/40% מותנה media/20% FBS. השתמש ב 10 מ"ל של תאים מדוללת עבור כל צלחת seeded. שיבוטים שונים יציגו התאוששות משתנה בשלב זה ולכן כדאי להגדיר כמה צלחות בריכוזים שונים (הנעים בין 3-20 תאים / מ"ל). שימוש כזה בצמחים מייצר פחות להימנע שיבוטים הנובעות מספר תאים). השתמש פיפטה רב לזרע 96-גם צלחות עם μL 100 של תאים בדילול מלא.
- הנח את צלחת בתוך 37 ° C חממה 2 שבועות.
- בדוק הפרט בארות under מיקרוסקופ כדי לאשר את נוכחותם של תאים יום לאחר זריעה. תאים יחיד יכול להיות מסובך למצוא בשל הצורך להתמקד בעומק הנכון. התמקדות המספרים היטב המוטבע בתחתית הצלחת 96-גם אמור לעזור. תאים הם יותר קל למצוא כאשר שנזרעו על ידי סדרן FACS שכן רוב בארות יש תא.
- לאחר 2 שבועות, מושבות הגוברת ניתן לראות בקושי מסתכל על צלחות מלמטה על ידי בעין בלתי מזוינת. הם הרבה יותר קל לראות מתחת למיקרוסקופ. מושבות נוטים לגדול בשולי היטב ובדרך כלל מושבות ביותר צלחת גדלים בשולי אותו בבארות שונים. סמן בארות עם צמיחת תאים חזקים ולהעביר את התאים גם 24 צלחות 1 מ"ל RPMI ולחזור 37 ° C חממה.
- שמרו על תאים 1 x 05-01 אוקטובר x 10 6 תאים / מ"ל. שנה את התקשורת על ידי ספינינג התאים ב 400 X גרם במשך 4 דקות בטמפרטורת החדר הסרת התקשורת כנדרש. החלף RPMI מ"ל 1 טרי.
- לאחר מספר דays של צמיחה, העברת תאים לצלחת 6-באר ולהמשיך הגוברת 37 ° C חממה.
- לאחר 3 שבועות, לנתח את שיבוטים על אובדן IgM (כמתואר להלן).
- המשיכו לגדל את התאים יותר עבור 2 שבועות ולאחר מכן לנתח את שיבוטים שוב בנקודת זמן 5 בשבוע.
6. ניתוח: הפסד IgM (3 שבועות 5 שבועות)
- Aliquot 5 x 10 5 תאים היטב לתוך כל צינור microcentrifuge 1.5 מ"ל ו - ספין התאים לעבר X 400 גרם במשך 4 דקות בטמפרטורת החדר. שימוש בתאים מכל אחד לשלוט ו-shRNA לדפוק למטה בארות, וכן דגימה אחת של פקד בלא כתם.
- שוטפים את התאים מ"ל 1 של PBS ולאחר מכן שוב ספין X 400 גרם במשך 4 דקות בטמפרטורת החדר.
- Resuspend ב 50 μL של PBS (שליטה בלא כתם) או PBS + 01:20 דילול של נוגדן הנקרא PE-α-IgM האדם. לדגור על קרח במשך שעה 1.
- ספין התאים לעבר X 400 גרם במשך 4 דקות בטמפרטורת החדר.
- שטפו את גאמות פעמיים עם 1 מ"ל של PBS ו - ספין של 400 גרם X עבור 4 דקות בכל פעם בטמפרטורת החדר.
- הסר את supernatant ו resuspend ב 100 μL של PBS. העברת התאים מוכתם resuspended לצינור FACS.
- נתח את התאים באמצעות מכונה FACS.
- השווה את אחוז IgM - תאים שולט מול shRNA דפק למטה תאים. כפי שצוין קודם לכן, אובדן IgM, כפי שהיא נמדדת על ידי FACS הוא מדד אמין חצי כמותית של SHM בתאים ראמוס.
7. ניתוח: אשר עקום על ידי RT-PCR כמותי (5 שבועות)
- Aliquot 3 x 10 6 תאים מבאר כל ספין למטה אל X 400 גרם במשך 4 דקות בטמפרטורת החדר.
- הכן aliquot RNA מן התאים. אנו משתמשים TRIzol בהתאם להמלצות היצרן.
- הכנת cDNA מן הכנה RNA. אנו משתמשים 2 מיקרוגרם RNA ו-II כתב עילי על פי המלצות היצרן.
- ביצוע PCR כמותי באמצעות cDNA כדי confirמ 'עקום למטה. אנו משתמשים GAPDH כביקורת נורמליזציה, ערכת qPCR FAST SYBR בנפח תגובה μL 10 בסך הכל.
8. ניתוח: רצף הגנום (5 שבועות)
- 5 Aliquot x 10 6 תאים מבאר כל ספין למטה אל X 400 גרם במשך 4 דקות בטמפרטורת החדר.
- בודד את הדנ"א הגנומי של תאים אלה. אנו משתמשים SV-DNA הגנומי אשף ערכת טיהור בהתאם להמלצות היצרן.
- PCR להגביר את הדנ"א הגנומי של הגנים V איג 19 (טבלה 1) וכל גנים אחרים בעלי עניין באמצעות פולימראז KAPA HiFi DNA. אנו משתמשים פולימראז בגלל הנמוכה שגיאות שיעור, אבל כל פולימראז באיכות גבוהה PCR צריך להיות מקובל.
- ג'ל לטהר את מוצרי ה-PCR על 1% agarose ג'ל באמצעות ערכת חילוץ QIAquick ג'ל.
- Polymerases יש להוסיף שאריות יחיד deoxyadenosine (א) עד הקצוות "3 של מוצרי ה-PCR, בעוד שאחרים לא. אלה 3 "זנבות נחוצים ת"א Topoצעד שיבוט. פולימראז HiFi KAPA לא משאיר 3 "זנבות. זנב המוצרים PCR ידי דוגרים 25 מוצר μL ג'ל מטוהרים PCR עם 3 חיץ μL תקי 10x התגובה, 1 μL dNTPs 10 מ"מ, ו 1 תקי פולימראז יחידה ב 72 מעלות צלזיוס במשך 30 דקות.
- Clone ג'ל מטוהרים מוצרי PCR באמצעות ערכת ת"א Topo שיבוט. הפוך את המוצרים מן התגובה Topo לתוך ה בתנאי coli DH5α-T1 R תאים המוסמכת על צלחת LB / צלחות אגר המכיל 100 מיקרוגרם / מ"ל אמפיצילין שיושלם עם 1.6 מ"ג של X-gal בהתאם להמלצות היצרן.
- שלח מושבות בודדים עבור סידור.
- ביצוע ניתוח רצף לקבוע סוגים ומיקומים של מוטציות.
9. נציג תוצאות:
כפי שצוין קודם לכן, אנו משתמשים וקטור ויראלי בקרה חיובית המבטאת הן ה-GFP, כמו גם גן puromycin התנגדות. אנו בדרך כלל רואים 50-75% GFP בתאים + יומייםלאחר transfection. בשנת זיהומים שלנו, אנו בדרך כלל רואים תאים 50-70% הם GFP + יומיים לאחר ההדבקה, אך לפני הבחירה. לאחר הבחירה היא מוחלטת,> 95% של תאים + GFP.
כמו ניסויים נציג, אנו מראים את ההשפעות של סיוע overexpressing או דריסה גורם לתקן בתאים ראמוס. באופן ספציפי, אנחנו transfected וקטור overexpression retroviral עבור AID מקושר דרך אתר IRES כדי Thy1.1 יחד עם וקטור retroviral אריזה pKat2 לתוך בוסק 23 תאים. וירוס המכילים התקשורת היה מסונן ולאחר מכן השתמשו כדי להדביק תאים ראמוס. סוג שני בר (WT) ו AID overexpressing (AID היי) היו תאים תא בודד seeded גדל במשך 3 שבועות, ובשלב זה הם נותחו על ביטוי גנים על ידי qRT-PCR (איור 2) וכן על אובדן IgM ידי FACS (איור 3 ). עבור מכתים את FACS, התאים הודגרו עם 1:20 הן בדילול PE-שכותרתו α-האדם נוגדנים IgM וכן 1:400 בדילול FITC שכותרתו α-עכברוש CD90/mouseCD90.1 (Thy1.1) נוגדן. בניסוי נפרד, lentiviruses המכיל גם shRNA רלוונטי (שליטה) או shRNA נגד גורם ה-DNA באיכות גבוהה לתיקון צפוי להגן מפני SHM נעשו בוסק 23 תאים, ולאחר מכן נגוע לתוך שיבוט של תאים AID היי ראמוס. שוב, ביטוי גנים (איור 4) ואובדן IgM (איור 5) נותחו שיבוטים תא בודד לאחר 3 שבועות. מאז הגורם לתיקון הוא חשב לספק הגנה מפני מוטציות במהלך SHM, אנו רואים עלייה אובדן IgM ו SHM בהעדר גורם. אם היינו דפק למטה גורם מעורב ביצירת SHM הקשורים מוטציות, היינו רואים ירידה הפסד IgM במקום.
כצפוי, תוצאות qRT-PCR שלנו להראות עלייה ניכרת הבעה AID בעקבות זיהום של תאים עם וקטור AID overexpression (איור 2), ואילו רמות של ירידה לתקן גורם DNA בנוכחות shRNA ממוקד נגד גורם (איור 4 ). מכיוון clon הפרטes עשויים להשתנות, אתה עשוי לראות כמה וריאציה רמות ביטוי הגנים. בגלל ביטוי גנים יכול להשתנות, יש צורך לאשר את הביטוי שיבוט כל אתם מתכננים ניתוח נוסף. ShRNAs שונים כנגד אותו הגן עשויות להיות השפעות שונות על ביטוי גנים, כמו גם, אז אתה צריך מסך shRNAs מספר כדי לקבוע שיש לו את ההשפעה הגדולה ביותר. מציאה יכול להיות גם אישר ברמת החלבון על ידי immunoblotting. כמו כן, שיבוטים הפרט עשוי להשתנות במידה רבה ברמות של אובדן IgM. שיבוטים מסוימים עשויים להפגין "הקופה" אפקט, שבו התרחשה המוטציה IgM באחד חלוקות תא המוקדם - לדוגמה, תוכלו לראות> הפסד IgM 50% פשוט כי באחד התאים הפך IgM - בשלב שני התא. ההשפעה של שיבוטים אלה ממוזער על ידי חישוב הממוצע עבור מספר שיבוטים תא בודד.

באיור 1. Schematic עבור טרנס, fection זיהום וניתוח של אובדן IgM. ראו טקסט לקבלת פרטים.

2. איור AID overexpression בתאים ראמוס. WT ו AID היי תאים ראמוס היו משובטים תא בודד גדל במשך 3 שבועות, בו AID נקודה ביטוי שיבוטים אדם נמדד על ידי qRT-PCR. הביטוי GAPDH שימש נורמליזציה. WT נקבע ל -1. הערך החציוני הוא הצביע. * מציין הערך של ap <0.01, כפי שחושב מבחן t-סטודנט אחד זנב.

באיור 3. מוגברת אובדן IgM בתאים היי AID לעומת תאים WT. IgM Surface נמדדה על ידי FACS בנקודת 3 פעם בשבוע, שיעור אובדן IgM חושבה עבור WT והיי בתאי זרע. (א) נציג FACS העלילה של שיבוט WT ו שיבוט AID היי. Overexpression AID vEctor יש סיוע צמוד Thy1.1 דרך אתר IRES, כך Thy1.1 הביטוי משמש כתחליף לביטוי AID. (ב) quantitation של אובדן IgM ב WT מספר AID שיבוטים היי. הערך החציוני הוא הצביע. * מציין הערך של ap <0.01, כפי שחושב מבחן t-סטודנט אחד זנב.

איור 4. מציאה של גורם לתקן בתאים היי AID. תאים היו נגועים או לשלוט shRNA רלוונטי (שליטה) או shRNA שלנו עניין (shRNA), ואת תא זרע בודד. לאחר 3 שבועות, ביטוי גנים שיבוטים הפרט נמדד על ידי qRT-PCR. הביטוי GAPDH שימש נורמליזציה. WT נקבע ל -1. הערך החציוני הוא הצביע. * מציין הערך של ap <0.01, כפי שחושב מבחן t-סטודנט אחד זנב.
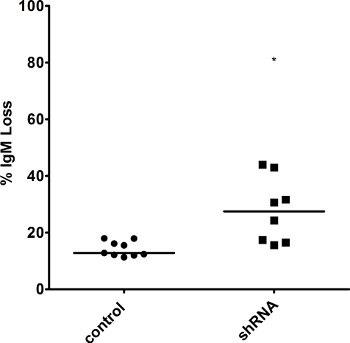
איור 5. הפסד IgM מוגברבהיי תאים AID עם רמות דפק למטה של גורם תיקון. IgM פני השטח שיבוטים כמה נמדדה על ידי FACS בנקודת 3 פעם בשבוע, שיעור אובדן IgM חושבה סיוע תאים overexpressing עדיין. הערך החציוני הוא הצביע. * מציין הערך של ap <0.01, כפי שחושב מבחן t-סטודנט אחד זנב.

. טבלה 1 פריימר רצפים של גנים איג 19: Cμ באזור קבוע, שרשרת כבדה V האזור (V H), ואת שרשרת האור V האזור (V L).
Discussion
כפי שנאמר קודם לכן, שורת תאים מודלים גיוון נוגדן הפכו נקודת המוצא הפופולרית לזהות חלבונים חדשים המשפיעים על שלבים שונים במהלך פיזור נוגדנים. אנו מציגים כאן שיטה באמצעות זיהום ויראלי חלבונים או לדפוק למטה או overexpress בקו ראמוס B-cell ולאחר מכן לבחון את ההשפעה על SHM.
עבור מחקרים אלה, אנו מנצלים גם ראמוס WT ו AID היי תאים ראמוס. תאים WT יכול לשמש כדי לחקור גורמים המעורבים מיקוד או ביטוי של תרומת זרע, כמו גם תיקון של AID שנוצר נגעים, בעוד ההיי תאים AID לכלול הגורמים המשפיעים על ביטוי AID.
ראוי גם לציין כי, SHM נמדדת כאן על ידי assaying אובדן IgM מתוך אוכלוסייה של תאים אשר בתחילה + IgM. לחלופין, אפשר להתחיל עם IgM -. תאים לחפש רווח של תאים assay IgM + ב 23 חזרה
באמצעות סמנים מבחר שונה (למשל puromycin, hygromycin, GFP, או Thy1.1), אנחנו יכולים גם לבצע זיהומים מרובים בו זמנית עם פרוטוקול זהה. עם זאת, מצאנו כי כאשר באמצעות שני סמנים שונים מבחר אנטיביוטיקה, את הרגישות של התאים להשתנות. יהיה צורך לבצע עיקולים להרוג נוספים כדי לייעל את התנאים לבחירת שני סוגי אנטיביוטיקה בו זמנית. אנחנו יכולים בקלות ליצור כפול עקום וירידות של שני גורמים שונים או דפיקה למטה של גורם אחד בתוספת overexpression של אחר, וכו '
אנחנו צריכים להתאים גם את פרוטוקול B-cell-line מודלים אחרים גם כן. למשל, עם CH12F3-2 תאים (B-cell עכבר קו בשימוש ללמוד CSR) 26,27, השלבים זיהום זהה ניתן להשתמש כדי להדביק 1 x 10 6 CH12F3-2 בתאי זרע ביום של זיהום (וריאציה של צעד 4.1). תאים אלה הם נבחרת עם 1 מיקרוגרם / מ"ל של puromycin. כמו כן, באותו פרוטוקול יכול גםלשמש DT40 תאים עוף - קו תא מודל לגיור-AID יזם גן.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
PMSCV-AID-I-Thy1.1 ו pKat2 וקטורים היו מתנה סוג של DG שץ לבין pVSV-G, pRSV-Rev ו pMDLg / pRRE וקטורים היו מתנה סוג של BR קאלן.
Materials
ריאגנטים מוצע - רוב אלה עשוי להיות מוחלף עם מוצרים דומים מיצרנים אחרים.
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| 6-TC גם ברור שטופלו צלחות | קורנינג | 3516 | |
| 10 מ"ל BD-Luer Loksyringes | BD רפואי | 309604 | |
| 24-TC גם ברור שטופלו צלחות | קורנינג | 3526 | |
| 96-היטב לתחתית ברור קלקר שטוחה TC שטופלו microplates | קורנינג | 3596 | |
| 100 מ"מ TC שטופלו תרבות מנות | קורנינג | 430167 | |
| Acrodisc מסננים מזרק, 0.45 מיקרומטר | מל מדעי החיים | 4604 | |
| אגר | Teknova | A7777 | |
| Agarose | GeneMate | E-3120-500 | |
| אמפיצילין | סיגמא | A0166 | 100 מ"ג / מ"ל מים |
| BD FACSCanto II cytometer זרימה | BD Biosciences | או דומה | |
| BD פלקון קלקר עגול התחתונה צינורות | BD Biosciences | 352054 | עבור FACS |
| בוסק 23 תאים | ATCC | CRL-11270 | |
| CO 2 באינקובטור מסוגל 37 ° C | |||
| DMEM (מדיום שונה Dulbecco של הנשרים) | סיגמא | D6429 | |
| FBS (בסרום שור העובר) | ג'מיני Bio-מוצרים | 100-106 | |
| FITC α-עכברוש CD90/mouse CD90.1 נוגדן | BioLegend | 202503 | FITCα-Thy1.1 |
| FuGENE 6 transfection מגיב | רוש | 11814443001 | |
| HEPES פתרון חיץ | Invitrogen | 15630-080 | |
| KAPA HiFi DNA פולימראז | KAPA Biosystems | KK2101 | |
| LB מרק (מרק lysogeny - לוריא) אבקת | Difco | 240230 | |
| המשימה TRC shRNA מניות גליצרול חיידקי | סיגמא | shRNA וקטורים | |
| NCS (נסיוב עגל בן יומו) | ג'מיני Bio-מוצרים | 100-504 | |
| PBS (פוספט פתרון שנאגרו) | Invitrogen | 70011 | מדולל במים עד 1x |
| Α PE-IgM נוגדנים אנושיים | BioLegend | 314508 | |
| PGS (פניצילין, סטרפטומיצין, גלוטמין פתרון) | ג'מיני Bio-Products | 400-110 | |
| Polybrene (hexadimethrine ברומיד) | סיגמא | 107689 | 10 מ"ג / מ"ל מים |
| PureYield מערכת פלסמיד Midiprep | Promega | A2495 | |
| Puromycin | סיגמא | P8833 | 250 מיקרוגרם / מ"ל מים |
| QIAquick ג'ל ערכת חילוץ | QIAGEN | 28706 | |
| ראמוס (ע"ר 1) תאים | ATCC | CRL-1596 | |
| RPMI-1640 בינוני | סיגמא | R8758 | |
| עילי II | Invitrogen | 18064-022 | |
| SYBR FAST qPCR ערכת | KAPA Biosystems | KK4601 | |
| תקי פולימראז ה-DNA | Invitrogen | 18038-042 | |
| Topo ת"א ערכה שיבוט | מבחנהgen | K4520-01 | |
| TRIzol | Invitrogen | 15596-026 | |
| אשף ה-DNA SV הגנום טיהור מערכת | Promega | A2361 | |
| X-גל [5-bromo-4-כלורו-3-indoyl-β-D-galatopyranoside] | Growcells | C-5687 | 40 מ"ג / מ"ל ב DMSO |
References
- Di Noia, J. M., Neuberger, M. S. Molecular mechanisms of antibody somatic hypermutation. Annu. Rev. Biochem. 76, 1-22 (2007).
- Peled, J. U. The biochemistry of somatic hypermutation. Annu. Rev. Immunol. 26, 481-511 (2008).
- Longerich, S., Basu, U., Alt, F., Storb, U. AID in somatic hypermutation and class switch recombination. Curr. Opin. Immunol. 18, 164-174 (2006).
- Bardwell, P. D. Altered somatic hypermutation and reduced class-switch recombination in exonuclease 1-mutant mice. Nat. Immunol. 5, 224-229 (2004).
- Martomo, S. A., Yang, W. W., Gearhart, P. J. A role for Msh6 but not Msh3 in somatic hypermutation and class switch recombination. J. Exp. Med. 200, 61-68 (2004).
- Phung, Q. H. Increased hypermutation at G and C nucleotides in immunoglobulin variable genes from mice deficient in the MSH2 mismatch repair protein. J. Exp. Med. 187, 1745-1751 (1998).
- Rada, C., Ehrenstein, M. R., Neuberger, M. S., Milstein, C. Hot spot focusing of somatic hypermutation in MSH2-deficient mice suggests two stages of mutational targeting. Immunity. 9, 135-141 (1998).
- Rada, C. Immunoglobulin isotype switching is inhibited and somatic hypermutation perturbed in UNG-deficient mice. Curr. Biol. 12, 1748-1755 (2002).
- Delbos, F., Aoufouchi, S., Faili, A., Weill, J. C., Reynaud, C. A. DNA polymerase eta is the sole contributor of A/T modifications during immunoglobulin gene hypermutation in the mouse. J. Exp. Med. 204, 17-23 (2007).
- Masuda, K. DNA polymerase eta is a limiting factor for A:T mutations in Ig genes and contributes to antibody affinity maturation. Eur. J. Immunol. 38, 2796-2805 (2008).
- Lim, D. S., Hasty, P. A mutation in mouse rad51 results in an early embryonic lethal that is suppressed by a mutation in p53. Mol. Cell. Biol. 16, 7133-7143 (1996).
- Xiao, Y., Weaver, D. T. Conditional gene targeted deletion by Cre recombinase demonstrates the requirement for the double-strand break repair Mre11 protein in murine embryonic stem cells. Nucleic. Acids. Res. 25, 2985-2991 (1997).
- Zhu, J., Petersen, S., Tessarollo, L., Nussenzweig, A. Targeted disruption of the Nijmegen breakage syndrome gene NBS1 leads to early embryonic lethality in mice. Curr. Biol. 11, 105-109 (2001).
- Luo, G. Disruption of mRad50 causes embryonic stem cell lethality, abnormal embryonic development, and sensitivity to ionizing radiation. Proc. Natl. Acad. Sci. U. S. A. 96, 7376-7381 (1999).
- Pavri, R. Activation-induced cytidine deaminase targets DNA at sites of RNA polymerase II stalling by interaction with Spt5. Cell. 143, 122-133 (2010).
- Lee-Theilen, M., Matthews, A. J., Kelly, D., Zheng, S., Chaudhuri, J. CtIP promotes microhomology-mediated alternative end joining during class-switch recombination. Nat. Struct. Mol. Biol. 18, 75-79 (2011).
- Basu, U. The RNA exosome targets the AID cytidine deaminase to both strands of transcribed duplex DNA substrates. Cell. 144, 353-363 (2011).
- Yabuki, M., Fujii, M. M., Maizels, N. The MRE11-RAD50-NBS1 complex accelerates somatic hypermutation and gene conversion of immunoglobulin variable regions. Nat. Immunol. 6, 730-736 (2005).
- Sale, J. E., Neuberger, M. S. TdT-accessible breaks are scattered over the immunoglobulin V domain in a constitutively hypermutating B cell line. Immunity. 9, 859-869 (1998).
- Cumbers, S. J. Generation and iterative affinity maturation of antibodies in vitro using hypermutating B-cell lines. Nat. Biotechnol. 20, 1129-1134 (2002).
- Papavasiliou, F. N., Schatz, D. G. Cell-cycle-regulated DNA double-stranded breaks in somatic hypermutation of immunoglobulin genes. Nature. 408, 216-221 (2000).
- Parsa, J. Y. AID mutates a non-immunoglobulin transgene independent of chromosomal position. Mol. Immunol. 44, 567-575 (2007).
- Zhang, W. Clonal instability of V region hypermutation in the Ramos Burkitt's lymphoma cell line. Int. Immunol. 13, 1175-1184 (2001).
- Ukai, A. Induction of a:T mutations is dependent on cellular environment but independent of mutation frequency and target gene location. J. Immunol. 181, 7835-7842 (2008).
- Dull, T. A third-generation lentivirus vector with a conditional packaging system. J. Virol. 72, 8463-8471 (1998).
- Nakamura, M. High frequency class switching of an IgM+ B lymphoma clone CH12F3 to IgA+ cells. Int. Immunol. 8, 193-201 (1996).
- Muramatsu, M. Specific expression of activation-induced cytidine deaminase (AID), a novel member of the RNA-editing deaminase family in germinal center B cells. J. Biol. Chem. 274, 18470-18476 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved