Quadruples clusters métalliques
Vue d'ensemble
Source : Corey Burns, Tamara M. Powers, département de chimie, Texas A & M University
Roue à aubes complexes sont une classe de composés composé deux ions métalliques (1st, 2èmeou 3rd row les métaux de transition) qui s’est tenues à proximité de quatre ligands pontants (plus communément formamidinates ou carboxylates) (Figure 1). Variant de l’identité de l’ion métallique et le ligand passerelle donne accès aux grandes familles de roue à aubes complexes. La structure des complexes de la roue à aubes permet la liaison métal-métal, qui joue un rôle essentiel dans la structure et la réactivité de ces complexes. En raison de la diversité des structures électroniques qui sont disponibles à la roue à aubes complexes - et les différences correspondantes dans M-M liaison affichée par ces structures - roue à aubes complexes ont trouvé application dans divers domaines, tels que dans homogène catalyse et comme blocs de construction pour cadres métallo-organiques (MOF). Comprendre la structure électronique des liaisons M-M dans les complexes de la roue à aubes est essentielle à la compréhension de leurs structures et donc à l’application de ces complexes en chimie de coordination et de la catalyse.

Figure 1. Structure générale des complexes de roue à aubes, où M peut être un 1st, 2èmeou 3rd row métal de transition.
Quand deux métaux de transition ont lieu à proximité de la d-recouvrement d’orbitales, qui peut entraîner la formation de liaisons M-M. Chevauchement des d -orbitales peut former trois types de liaisons - σ et π δ - selon la symétrie des orbitales impliquées. Si nous attribuons l’axe des z moléculaire pour être coplanaire avec le lien de M-M, une liaison σ est formée par la superposition des orbitales dz2 et liaisons π sont formées par le recouvrement des orbitales dyz dxz . Obligations δ sont générées par superposition des d-orbitales disposant de deux nœuds planaires (dxy et dx2-y2). En conséquence, tous les quatre lobes de la d-recouvrement d’orbitales et la liaison δ correspondant a deux nœuds planes (Figure 2). En théorie, avec l’ajout d’obligations δ, roue à aubes complexes sont capables de supporter des obligations quintuples, ou cinq liaisons entre atomes métalliques. 1 dans la plupart des complexes, le dx2-y2 forme des liaisons métal-ligand fortes et ne contribuent pas utilement au collage de M-M. Ainsi, les liaisons quadruples sont l’ordre de liaison maximale dans les nombreux complexes.

Figure 2. Représentation visuelle de σ et π δ collage MOs résultant de la combinaison linéaire de métal d-orbitales. Les orbitales atomiques dz2 ont le meilleur chevauchement spatial, suivi du dxz et les orbitales dyz . Les orbitales atomiques dxy ont le moins de chevauchement spatial.
Dans cette vidéo, nous résumera la roue à aubes dimolybdenum Mo complexe2(ArNC(H)NAr)4, où Ar = p-(MeO) C6H4, qui dispose d’une liaison quadruple. Nous caractériser le composé par spectroscopie RMN et cristallographie aux rayons x permet d’étudier le lien M-M.
Principles
Nous commençons en construisant un diagramme MO de la liaison de M-M au sein du dimolybdenum général complexe Mo2(ArNC(H)NAr)4. Tout d’abord, nous devons définir nos haches. En supposant que la plus haute symétrie disponible, Mo2(ArNC(H)NAr)4 est le point groupe D4h (Figure 3). L’axe des z sont par définition attribuée à l’axe avec la plus haute symétrie de rotation (axe principal), qui dans ce cas est un axe de rotation de4 Cqui s’étend le long de la liaison de Mo-Mo. Par convention, les axes x et y se trouvent sur les obligations de M-L ; dans notre cas précis, cela signifie que les axes x et y sont colinéaires avec les vecteurs de Mo-N. Selon nos missions d’axe, dx2-y2 orbitales sur chaque atome de Mo est impliqué dans la liaison métal-ligand. Qui laisse le dxy, dxz, dyzet orbitales dz2 M-m de liaison.
Le diagramme de MO qui décrit la liaison FIB Mo2(ArNC(H)NAr)4 est illustré à la Figure 4. Combinaison linéaire de la dz2 orbitales sur chaque atome M se traduit par MOs σ et σ *. Le dxz et les orbitales dyz forment MOs π et π *. Enfin, la combinaison linéaire des orbitales atomiques dxy donne lieu aux MOs δ et δ *. La liaison δ présente le moins de chevauchement spatial entre les orbitales atomiques et, par conséquent, l’énergie relative des orbitales collage est σ < π < δ (Figure 2). Cela correspond à des forces de liaison, où une liaison σ est plus forte qu’une liaison π, qui est plus forte qu’une liaison δ. Nous remplissons les MOs correspondants au nombre total de d e– pour les deux centre de Mo, quiest 8 (Mo2 +, d4). Cela conduit à un ordre de liaison de 4, qui est compatible avec un bond de quadruple.
Dans cette vidéo, nous allons utiliser la cristallographie aux rayons x pour observer la longueur de la liaison Mo-Mo dans le Mo2(ArNC(H)NAr)4 complexes. Avec la distance de liaison Mo-Mo de structure de l’état solide, on peut trouver le ratio d’essoufflement formelle (FSR), qui est la valeur normalisée de la liaison de M-M. La FSR est calculée pour une liaison A-B à l’aide de l’équation 1, ce qui est tout simplement le rapport entre la distance de liaison observée à l’état solide (DA-B) à la somme des rayons ionisants ( et
et  ) des atomes individuels.
) des atomes individuels.
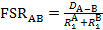 (1)
(1)
La valeur de la FSR est normalisée pour le rayon atomique et offre ainsi un moyen rapide et pratique pour comparer M-M bond des distances, non seulement entre les différents types de métal, mais aussi à des distances de liaison entre les atomes non-métalliques.
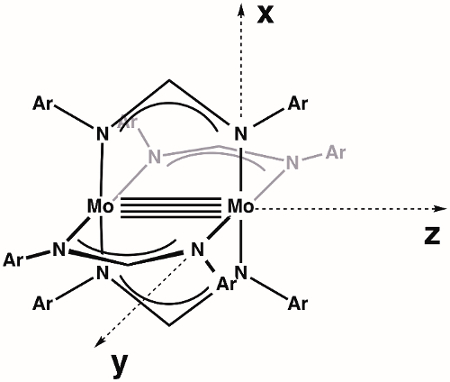
Figure 3. Axes définis pour la molécule Mo2(ArNC(H)NAr)4, en supposant que la plus haute symétrie (D4h).

Figure 4. Diagramme de MO de la liaison de M-M Mo2(ArNC(H)NAr)4.
Procédure
1. synthèse du Ligand ArN (H) C (H) NAr, où Ar = p-(MeO) C6H4 (Figure 5)2
- Combiner les 6,0 g (0,050 mol) de p -anisidine et 4,2 mL (0,025 mol) de triethylorthoformate dans un 100 mL ballon à fond rond avec une barre d’agitation magnétique.
- Fixez une tête de distillation sur le ballon à réaction.
- En remuant, faites chauffer la réaction dans un bain d’huile à reflux (120 ° C). Une fois que le reflux est atteint, l’éthanol sous-produit devrait commencer à distiller de la réaction. Recueillir l’éthanol dans un bécher placé à l’extrémité de la tête de distillation.
- La réaction de la chaleur jusqu'à ce que la distillation de l’éthanol ne répond plus (au moins 1,5 h).
- Enlever le ballon du bain d’huile et laisser le mélange refroidir à température ambiante. Devrait former un précipité. Si le produit ne pas précipité, placer le ballon dans un bain de glace et gratter le fond du flacon avec une spatule afin d’encourager la cristallisation.
- Recristalliser le produit d’une quantité minimale de toluène bouillante (pour une procédure plus détaillée, veuillez consulter la vidéo de « Purification de composés par recristallisation » dans la série Essentials of Organic Chemistry ).
- Recueillir le produit par filtration à travers un entonnoir fritté et laver avec 10 mL d’hexane.
- Isoler le produit blanc et laisser sécher à l’air.
- Recueillir une 1H RMN du solide à l’aide de CDCl3.

Figure 5. Synthèse de l’ArN (H) C (H) NAr, où Ar = p- CMOU6H4.
2. installation de la ligne de Schlenk
Remarque : Pour une procédure plus détaillée, veuillez consulter la vidéo de « Schlenk lignes transfert de solvant » dans la série Essentials of Organic Chemistry . Sécurité de canalisation de Schlenk devrait être révisée avant la tenue de cette expérience. Verrerie doit être inspecté pour fissures étoiles avant utilisation. Il faut pour s’assurer que O2 n’est pas condensée dans le piège de ligne Schlenk si vous utilisez le liquide N2. À température2 N, O2 se condense et est explosif en présence de solvants organiques. Si l'on soupçonne que O2 a été condensée ou un liquide bleu est observé dans le piège froid, laissez le piège froid sous vide dynamique. Ne pas enlever le liquide N2 collecteur ou éteignez la pompe à vide. Au fil du temps le liquide O2 sera sublime dans la pompe ; Il est sécuritaire d’enlever le piège de2 N liquid une fois tous les O2 a sublimé.
- Fermez le robinet de purge.
- Allumez le gaz2 N et la pompe à vide.
- Comme le Schlenk ligne vide atteint sa pression minimale, préparer le piège froid avec liquide N2 ou neige carbonique et d’acétone.
- Assembler le piège froid.
3. synthèse de Mo2(ArNC(H)NAr)4 (Figure 6)2
ATTENTION : La molybdène source utilisée dans la synthèse de Mo2(ArNC(H)NAr)4 est Mo(CO)6, qui est très toxique et peut être mortel en cas d’inhalation, absorbé par la peau ou ingestion. CO est généré lors de la réaction. Par conséquent, la synthèse doit être effectuée sous une hotte ventilée.
- Utiliser des techniques de ligne Schlenk standard pour la synthèse de Mo2(ArNC(H)NAr),4 (voir la vidéo de « Synthèse d’une ligne de TI métallocène Using Schlenk Technique »).
- Ajoutez 0,34 g (1,3 mmol) Mo(CO)6 et 1,0 g (3,9 mmol) de l’ArN (H) C (H) NAr dans un ballon de Schlenk 100 mL et préparer le ballon de Schlenk le transfert de la canule de solvant.
- Ajouter 20 mL de dégazé o- dichlorobenzène dans le ballon de Schlenk via transfert de canule.
- Monter le ballon de Schlenk avec un condensateur raccordé à la canalisation de gaz N2 .
- Reflux la réaction pendant 2 h (180 ° C) dans un bain d’huile de silicone.
Remarque : Mo(CO)6 est volatil et se condensera sur les côtés de la fiole de Schlenk lors de la réaction. Pour obtenir des rendements plus élevés, régulièrement re-dissoudre le tout sublimé Mo(CO)6 en tirant le ballon dans le bain d’huile et en agitant doucement le solvant dans le flacon. - Enlever le ballon de Schlenk du bain d’huile et laisser le mélange refroidir à température ambiante.
- Filtrer la solution brune dans un entonnoir fritté et laver le précipité jaune 10 ml d’hexane, suivi par 5 mL d’acétone grade réactif. Le Mo2(ArNC(H)NAr)4 se décompose lentement en solution lorsque O2 est présent. Par conséquent, la filtration doit être effectuée rapidement, une fois que la réaction est retirée du N2.
- Recueillir le solide jaune Mo2(ArNC(H)NAr)4 et laisser sécher à l’air.
- À l’aide de CDCl3 mesure du spectre de RMN H 1du produit.

La figure 6. Synthèse de Mo2(ArNC(H)NAr)4, où Ar = p- CMOU6H4.
4. monocristal croissance
NOTE : Mo2(ArNC(H)NAr)4 s’oxyde lentement en solution. Le solvant de la cristallisation doit être dégazé avant utilisation, mais les conditions rigoureuses sans air ne sont pas nécessaires pour obtenir des cristaux de qualité aux rayons x de monocristal de diffraction des rayons x.
- Une solution contenant 10 mL de dichlorométhane (CH2Cl2) par propagation N2 gas dans la solution pendant 10 min (voir la vidéo de « Synthèse d’une ligne de TI métallocène Using Schlenk Technique » pour une procédure plus détaillée sur la purge des liquides).
- Préparer une solution saturée de Mo2(ArNC(H)NAr)4 en dissolvant 20 mg du solide dans 2 mL de la dégazé CH2Cl2.
- Faire une pipette fiche Célite en y insérant un petit morceau de Kimwipe une pipette. Ajouter une petite quantité de Célite à la pipette.
- Filtrer la solution à2Cl2 CH par le biais de la fiche de Célite pipette dans un flacon petit 5 mL. Aider à pousser la solution par le biais de la Célite à l’aide d’une ampoule de pipette.
- À l’aide de pinces à épiler, insérez le flacon de 5 mL dans un flacon de 10 mL à scintillation.
- Dans le flacon de scintillation externe, ajouter 2 mL d’hexane.
- Bien Boucher le flacon à scintillation et placez-le sur une étagère où il sera intact.
- Laisser au moins 24 h pour la croissance d’un cristal unique (voir la vidéo de « Diffraction » dans la série Essentials of Organic Chemistry une procédure plus détaillée sur comment faire pousser des cristaux simples).
- Recueillir des données de rayons x sur un cristal unique sur l’échantillon (voir la vidéo de « Single Crystal et poudre x-ray Diffraction » une procédure plus détaillée sur la façon de collecter les données de rayons x).
Résultats
Ligand ArN (H) C (H) NAr
Rendement : 3,25 g (53 %). 1 H RMN (chloroforme -d, 500 MHz, δ, ppm) : 8.06 (s, 1 H, NHC -HN), 6.99 (d, 4 H, aromatiques C -H, J = 8,7 Hz), 6,86 (d, 4 H, aromatiques C -H, J = 9,0 Hz), 3,80 (s, 6 H, - OCH3).
Mo Mo complexe2(ArNC(H)NAr)-4
Rendement : 450 mg (57 %). 1 H RMN (chloroforme -d, 500 MHz, δ, ppm) : 8,38 (s, 4 H, NHC -HN), 6.51 (d, 16 H, aromatiques C -H, J = 8,8 Hz), 6.16 (d, 16 H, aromatiques C -H, J = 8,8 Hz), 3.71 (s, 24 H, - OCH3).
Le tableau 1. Données cristallographiques et paramètres de cellule d’unité
| Formule empirique | C60H70Mo2N8S8 |
| Formule poids (g/mol) | 1223.12 |
| Température (K) | 296.15 |
| Système cristallin | triclinique |
| Groupe d’espace | P-1 |
| un (Å) | 10.1446(4) |
| b (Å) | 10.3351(4) |
| c (Å) | 13.9623(6) |
| Α (°) | 80.151(2) |
| Β (°) | 75.251(2) |
| Γ (°) | 82.226(2) |
| Volume (Å3) | 1388.3(1) |
Le spectre de RMN de H de 1Mo,2(ArNC(H)NAr)4expose deux signaux dans la région aromatique, qui est compatible avec la 4-foldsymmetry. La structure à l’état solide (Figure 7) est en accord avec le point groupe D4 et dispose d’une liaison courte de Mo-Mo (2.0925(3) Å). Le rayon atomique de Mo est 1.45 Å. Par conséquent, à l’aide de l’équation 1, la valeur de la FSR pour la liaison FIB Mo2(ArNC(H)NAr)4est de 0,72. Cette valeur est inférieure à celle observée pour le Mo-Mo quadruply collé complexe Mo(hpp)4 (hpp = 1,3,4,6,7,8-hexahydro-2H- pyrimido [1, 2 -un] pyrimidinate), qui a une valeur FSR 0.797 et est compatible avec la présence d’un M-M bond quadruple3.
La figure 7. Structure à semi-conducteurs pour Mo2(ArNC(H)NAr)4 avec les ellipsoïdes thermiques définie au niveau de probabilité de 50 %. Des atomes d’hydrogène sont omis pour plus de clarté (marine Mo, N bleu, gris C).
Applications et Résumé
Dans cette vidéo, nous avons appris sur la liaison de M-M. Nous avons synthétisé un molybdène dinuclear complexe comportant une liaison quadruple. Les liaisons quadruples se composent de trois types d’obligations différentes, y compris les liaisons σ et π δ. Nous avons recueilli des données de diffraction des rayons x sur un cristal unique et observé une courte longueur de la liaison Mo-Mo compatible avec un composé quadruply servile.
Roue à aubes complexes, tels que le Mo2 complexe établi ici, un large éventail de propriétés d’affichage et donc trouvent application dans divers domaines de la chimie. Par exemple, M-M obligations jouent un rôle important dans la catalyse : le dirhodium roue à aubes complexe Rh2(OAc)4 est un catalyseur connu de fonctionnalisation de liaison C-H via carbène et nitrène réactions de transfert (Figure 8). Dans une réaction de transfert de carbène typique, Rh2(OAc)4 réagit avec un composé diazo pour générer un carbène Rh2 intermédiaire. Insertion ultérieure du carbène dans une liaison C-H génère le produit de fonctionnalisation de C-H et régénère le Rh2(OAc)4 catalyseur. La réactivité exceptionnelle du Rh2 catalyseurs dans ces réactions a été attribuée à l’interaction Rh-Rh via la liaison de M-M. La liaison Rh-Rh dans le résultat intermédiaire agit comme un réservoir d’électrons ; alors qu’un métal est un site de fixation pour le substrat, le deuxième centre métallique navettes densité électronique vers et à partir du centre métallique actif au cours de l’activation du substrat. Le d-orbitale fractionnement diagramme du complexe intermédiaire (base Rh-Rh liée à le carbénoïde) montre que la frontière d-orbitales sont non-liantes en ce qui concerne le centre actif de Rh (Figure 9 a). La densité d’électrons σ et π non-liantes MOs est centrée sur le carbone carbénoïde nucléophile et le centre Rh « spectateur », qui n’est pas directement lié à l’unité (Figure 9 b) de la carbénoïde4.

Figure 8. Fonctionnalisation de liaison C-H via un intermédiaire de métal-carbénoïde.
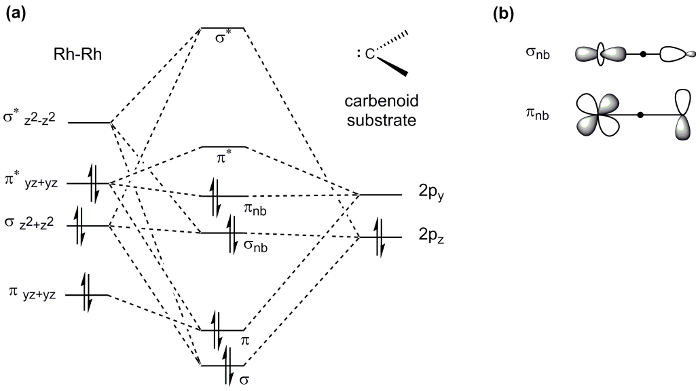
Figure 9. (a) d-orbital MO fractionnement diagramme du noyau Rh-HR dans les complexes de la roue à aubes lié à un substrat de carbénoïde. Notez que seules les orbitales impliquées dans la liaison du substrat sont affichées. (b) le résultant σ et π non-liantes MOs sont remplis d’électrons. La densité électronique dans ces MOs est centrée sur le carbone carbénoïde et le centre Rh « spectateur ».
Complexes de la roue à aubes ont également été utilisées comme blocs de construction dans MOF. MOF est des polymères de coordination poreux qui consistent en des complexes métalliques reliés entre eux par des ligands organiques. La résultante un, deux ou des superstructures en trois dimensions peuvent être utilisés dans une variété d’applications allant de l’absorption de gaz (y compris la séparation et purification) à la catalyse.
References
- Nguyen, T., Sutton, A. D., Brynda, M., Fettinger, J. C., Long, G. J., Power, P. P. Synthesis of a stable compound with fivefold bonding between two chromium(I) centers. Science. 310(5749), 844-847 (2005).
- Lin, C., Protasiewicz, J. D., Smith, E. T., Ren, T. Linear free energy relationship in dinuclear compounds. 2. Inductive redox tuning via remote substituents in quadruply bonded dimolybdenum compounds. Inorg Chem. 35(22), 6422-6428 (1996).
- Cotton, F. A., Murillo, C. A., Walton, R. A. Eds. Multiple Bonds Between Metal Atoms, 3rd ed. Springer. New York, NY. (2005).
- Nakamura, E., Yoshikai, N., Yamanaka, M. Mechanism of C−H Bond Activation/C−C Bond Formation Reaction between Diazo Compound and Alkane Catalyzed by Dirhodium Tetracarboxylate. J Am Chem Soc. 124 (24), 7181-7192 (2002).
Passer à...
Vidéos de cette collection:

Now Playing
Quadruples clusters métalliques
Inorganic Chemistry
15.3K Vues

Synthèse d'un métallocène de Ti(III) avec une ligne Schlenk
Inorganic Chemistry
31.6K Vues

Boîte à gants et capteurs d'impuretés
Inorganic Chemistry
18.6K Vues

Purification du Ferrocène par sublimation
Inorganic Chemistry
54.6K Vues

La méthode Evans
Inorganic Chemistry
68.6K Vues

Diffraction par rayons X : cristal vs poudre
Inorganic Chemistry
104.5K Vues

Spectroscopie par résonance paramagnétique électronique (RPE)
Inorganic Chemistry
25.5K Vues

Spectroscopie Mössbauer
Inorganic Chemistry
22.0K Vues

Interaction des acides et bases de Lewis au sein du complexe Ph3P-BH3
Inorganic Chemistry
38.9K Vues

Structure du ferrocène
Inorganic Chemistry
79.6K Vues

Application de la théorie des groupes à la spectroscopie IR
Inorganic Chemistry
45.3K Vues

Théorie de l’orbital moléculaire (OM)
Inorganic Chemistry
35.4K Vues

Capteurs solaires teintés
Inorganic Chemistry
15.8K Vues

Synthèse d'un complexe de cobalt(II) porteur d'oxygène
Inorganic Chemistry
51.7K Vues

Initiation photochimique des réactions de polymérisation radicalaire
Inorganic Chemistry
16.8K Vues