Vierfach-metallgeklebte Schaufelräder
Überblick
Quelle: Corey Verbrennungen, Tamara M. Powers, Department of Chemistry, Texas A & M University
Schaufelrad-komplexe sind eine Klasse von Verbindungen, bestehend aus zwei Metall-Ionen (1St, 2Ndoder 3rd Zeile Übergangsmetalle) in der Nähe von vier Überbrückung Liganden (meist Formamidinates oder Carboxylates) gehalten (Abbildung 1). Variieren die Identität von der Metall-Ionen und bridging Ligand bietet Zugriff auf große Familien der Schaufelrad-komplexe. Die Struktur der Schaufelrad-komplexe kann für Metall-Metall-Verbindung die spielt eine wichtige Rolle in der Struktur und Reaktivität dieser komplexe. Aufgrund der Vielfalt der elektronischen Strukturen, die Schaufelrad-komplexe- und die entsprechenden Unterschiede bei M-M-Verklebung von diesen Strukturen angezeigt - zur Verfügung stehen fanden Paddlewheel komplexe Anwendung in den verschiedensten Bereichen, wie z. B. homogene in Katalyse und als Bausteine für Metall-organische Gerüste (MOFs). Verständnis der elektronischen Struktur von M-M-Anleihen im Schaufelrad-komplexe ist von entscheidender Bedeutung für das Verständnis ihrer Strukturen und damit zur Anwendung dieser komplexe Koordinationschemie und Katalyse.

Abbildung 1. Allgemeine Struktur der Schaufelrad-komplexe, wo M 1St, 2Ndund 3rd Zeile Übergangsmetall sein kann.
Wann zwei Übergangsmetalle finden statt in der Nähe der d-orbitale überlappen, was die Bildung von M-M Bande führen kann. D -orbitale überlappen kann drei Arten von Anleihen - σ, π und δ - abhängig von der Symmetrie der beteiligten Orbitale bilden. Wenn wir die molekularen z-Achse koplanar mit M-M-Band zu beauftragen, eine σ-Bindung entsteht durch Überlappung der orbitale dZ2 und π-Bindungen entstehen durch Überlappung der dXz und dYz -orbitale. Δ-Bindungen entstehen durch Überlappung der d-orbitale, die zwei planare Knoten (dXy und dX2,y2) haben. Infolgedessen wurden alle vier Lappen von der d-orbitale überlappen und die entsprechenden δ-Bindung hat zwei planare Knoten (Abbildung 2). In der Theorie sind mit dem Zusatz von δ Anleihen, Schaufelrad-komplexe für Quintupel Anleihen oder fünf Bindungen zwischen Metallatomen handlungsfähig. 1 in den meisten komplexen, dX2-y2 bildet starke Metall-Ligand-Bindungen und trägt nicht sinnvoll zu M-M-Verklebung. So sind vierfache Anleihen die maximale Bindung Ordnung in vielen komplexen.

Abbildung 2. Visuelle Darstellung von σ, π und δ kleben MOs infolge der Linearkombination der Metall d-orbitale. Die dZ2 atomarer orbitale haben beste räumliche Überlappung, gefolgt vom dXz und dYz -orbitale. Die dXy atomaren orbitale haben die geringste Menge an räumliche Überschneidungen.
In diesem Video werden wir Dimolybdenum Paddlewheel komplexe Mo2synthetisieren (ArNC(H)NAr)4, wo Ar = p-(MeO) C6H4, verfügt über eine Vierfachbindung. Wir charakterisieren die Verbindung durch NMR-Spektroskopie und Röntgenkristallographie verwenden, um das M-M-Band zu studieren.
Grundsätze
Wir beginnen mit dem Bau einer MO-Diagramms der M-M-Anleihe innerhalb der allgemeinen Dimolybdenum komplexe Mo2(ArNC(H)NAr)4. Erstens müssen wir unsere Achsen definieren. Vorausgesetzt, die höchste verfügbare Symmetrie, Mo2(ArNC(H)NAr)4 ist in dem Punkt Gruppe D4h (Abbildung 3). Die z-Achse ist per Definition der Achse mit höchsten Rotationssymmetrie (primäre Achse), die in diesem Fall eine C4 Rotationsachse, die entlang der Mo-Mo-Anleihe liegt zugewiesen. Standardmäßig liegen die x- und y - Achse entlang der M-L-Anleihen; in unserem konkreten Fall bedeutet dies, dass die X - und y-Achse mit der Mo-N Vektoren kollinear sind. Laut unserer Achse Zuordnungen, die dX2– isty2 orbital auf jeden Mo-Atom in Metall-Ligand-Bindung beteiligt. Das lässt dXy, dXz, dYzund dZ2 orbitale für M-M kleben.
Das MO-Diagramm beschreibt, die das M-M-Band in Mo2(ArNC(H)NAr)4 in Abbildung 4dargestellt ist. Linearkombination der dZ2 auf jedes M Atom orbitale führt σ und σ * MOs. Die dXz und dYz -orbitale bilden π und π * MOs. Schließlich entstehen lineare Kombination der atomaren orbitale dXy δ und δ * MOs. Die δ-Anleihe weist die geringste Menge an räumliche Überschneidungen zwischen den atomaren orbitale und infolgedessen ist die relative Energie der Bindung orbitale σ < π < δ (Abbildung 2). Dies entspricht Klebkräfte, wo eine σ-Bindung ist stärker als eine π-Bindung, die stärker ist als eine δ-Anleihe. Wir füllen die entsprechenden MOs mit der Gesamtzahl der d e– für beide Mo-Center, dieist 8 (Mo2 +, d-4). Dies führt zu einer Anleihe Reihenfolge 4, die eine Vierfachbindung vereinbar ist.
In diesem Video nutzen wir Röntgen-Kristallographie, um zu beobachten, die Bindungslänge Mo-Mo Mo2(ArNC(H)NAr)4 komplexe. Mit dem Mo-Mo-Anleihe-Abstand von solid-State-Struktur finden wir das formale Atemnot Verhältnis (FSR), das den normalisierten Wert der Anleihe an M-M ist. Der FSR errechnet sich für eine Anleihe A-B mit Formel 1, die einfach das Verhältnis von der Anleihe-Abstand ist im festen Zustand (D-A-B) mit der Summe der atomaren Radien beobachtet ( und
und  ) der einzelnen Atome.
) der einzelnen Atome.
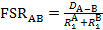 (1)
(1)
Der FSR-Wert ist für Atomradius normalisiert und sorgt so für eine schnelle und bequeme Möglichkeit zum Vergleich von M-M Entfernungen, nicht nur zwischen verschiedenen Metallarten, sondern auch auf Bond Abstände zwischen Nichtmetall-Atome binden.
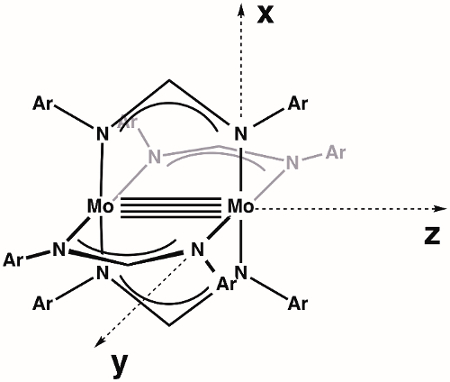
Abbildung 3. Definierten Achsen für das Molekül Mo2(ArNC(H)NAr)4, vorausgesetzt, höchste Symmetrie (D4h).

Abbildung 4. MO-Diagramm der M-M-Bindung in Mo2(ArNC(H)NAr)4.
Verfahren
1. Synthese von Liganden ArN (H) C (H) NAr, wo Ar = p-(MeO) C6H4 (Abbildung 5)2
- Kombinieren Sie 6,0 g (0,050 Mol) des p -Anisidin und 4,2 mL (0,025 Mol) Triethylorthoformate in eine 100 mL Runde untere Kolben mit einer magnetischen Stir Bar.
- Legen Sie eine Destillation-Kopf auf der Reaktionskolben.
- Erhitzen Sie unter Rühren die Reaktion in einem Ölbad zu Reflux (120 ° C). Reflux erreicht, sollte das Nebenprodukt Ethanol beginnen, aus der Reaktion zu destillieren. Sammeln Sie das Ethanol in einem Becherglas am Ende der Destillation Kopf platziert.
- Erhitzen Sie die Reaktion, bis die Destillation von Ethanol (mindestens 1,5 h) aufhört.
- Entfernen Sie die Flasche aus dem Ölbad und lassen Sie das Reaktionsgemisch auf Raumtemperatur abkühlen. Einen Niederschlag bilden sollte. Wenn das Produkt nicht Niederschlag, legen Sie die Flasche in ein Eisbad und kratzen Sie die Unterseite des Kolbens mit einem Spatel Kristallisation zu fördern.
- Recrystallize das Produkt aus einer minimalen Menge an kochendem Toluol (für eine genauere Verfahren, lesen Sie bitte die "Reinigende Substanzen durch Rekristallisation" Video der Serie Essentials of Organic Chemistry ).
- Das Produkt durch Filtration durch einen fritted Trichter zu sammeln und mit 10 mL Hexanes waschen.
- Das weiße Produkt zu isolieren und in der Luft trocknen lassen.
- Sammeln Sie eine 1H NMR des Volumenkörpers mit CDCl-3.

Abbildung 5. Synthese von ArN (H) C (H) NAr, wo Ar = p- MeOC6H4.
2. Einstellung der Schlenk-Linie
Hinweis: Für eine detailliertere Verfahren lesen Sie bitte die "Schlenk Linien übertragen von Lösungsmittel" Video der Serie Essentials of Organic Chemistry . Schlenk Linie Sicherheit sollte überprüft werden, vor der Durchführung dieses Experiments. Gläser sollten für Sterne Risse vor Gebrauch überprüft werden. Darauf sollte geachtet werden, um sicherzustellen, dass O2 ist nicht in der Schlenk Linie Falle kondensiert, wenn Flüssigkeit N2verwenden. Bei N2 Flüssigkeitstemperatur O2 kondensiert und explosiv in Anwesenheit von organischen Lösungsmitteln. Wenn der Verdacht besteht, dass O2 verdichtet worden oder eine blaue Flüssigkeit in die Kühlfalle eingehalten wird, lassen Sie die Falle unter dynamischen Vakuum kalt. Entfernen Sie die Flüssigkeit N2 Falle nicht oder schalten Sie die Vakuumpumpe. Im Laufe der Zeit wird die Flüssigkeit O2 in die Pumpe erhaben; Es ist nur sicher, die flüssige N2 Falle zu entfernen, sobald alle O2 hat sublimiert.
- Schließen Sie das Überdruckventil.
- Aktivieren Sie das N2 Gas und die Vakuumpumpe.
- Als die Schlenk Linie Vakuum erreicht seine Mindestdruck, bereiten die Kühlfalle mit Flüssigkeit N2 oder Trockeneis/Aceton.
- Montieren Sie die Kühlfalle.
3. Synthese von Mo2(ArNC(H)NAr)4 (Abbildung 6)2
Achtung: Die Molybdän-Quelle verwendet bei der Synthese von Mo2(ArNC(H)NAr)4 ist Mo(CO)6, das ist sehr giftig und kann tödlich sein, wenn eingeatmet, über die Haut aufgenommen oder geschluckt. CO entsteht während der Reaktion. Daher muss die Synthese in einem gut gelüfteten Abzug durchgeführt werden.
- Verwenden Sie Schlenk Linie Standardtechniken für die Synthese von Mo2(ArNC(H)NAr)-4 (siehe Video "Synthese einer Ti(III) Metallocen-Katalysatoren mit Schlenk Linie Technik").
- Fügen Sie 0,34 g (1.3 Mmol) Mo(CO)6 und 1,0 g (3,9 Mmol) ArN (H) C (H) NAR in einem 100 mL-Schlenk-Kolben und bereiten Sie die Schlenk-Kolben für die Kanüle Übertragung des Lösungsmittels.
- Schlenk-Kolben per Kanüle 20 mL entgast o- Dichlorbenzol hinzufügen.
- Passen Sie die Schlenk-Kolben mit einem Kondensator an der N2 Gasleitung angeschlossen.
- Rückfluss der Reaktion für 2 h (180 ° C) in einem Silikon-Öl-Bad.
Hinweis: Mo(CO)6 ist flüchtig und wird während der Reaktion auf den Seiten von Schlenk-Kolben kondensieren. Um höhere Erträge zu erzielen, in regelmäßigen Abständen neu lösen sich alle sublimierter Mo(CO)6 durch Ziehen des Kolbens aus dem Ölbad und wirbelnden sanft das Lösungsmittel in die Flasche. - Entfernen Sie die Schlenk-Kolben aus Ölbad und lassen Sie die Mischung auf Raumtemperatur abkühlen lassen.
- Filtern Sie die braune Lösung durch einen fritted Trichter und waschen Sie den gelbe Niederschlag mit 10 mL Hexanes, gefolgt von 5 mL Reagenz Grade Aceton. Mo2(ArNC(H)NAr)4 in Lösung langsam zersetzen, wenn O2 vorhanden ist. Daher sollte die Filtration unverzüglich erfolgen, sobald die Reaktion von N2entfernt wird.
- Sammeln Sie die feste gelbe Mo2(ArNC(H)NAr)4 und es an der Luft trocknen lassen.
- CDCl3 Maßnahme der 1H-NMR-Spektrum des Produkts verwenden.

Abbildung 6. Synthese von Mo2(ArNC(H)NAr)4, wo Ar = p- MeOC6H4.
4. einzelne Kristallwachstum
Hinweis: Mo2(ArNC(H)NAr)4 langsam in Lösung oxidiert. Die Kristallisation Lösungsmittel sollten vor der Verwendung entgast werden, aber strenge luftfreies Bedingungen sind nicht notwendig, x-ray Qualität Kristalle für Einkristall Röntgenbeugung zu erhalten.
- Entgasen von 10 mL Dichlormethan (CH2Cl2) von sprudelnden N2 Gas durch die Lösung für 10 min (sehen Sie das Video "Synthese einer Ti(III) Metallocen-Katalysatoren mit Schlenk Linie Technik" für eine genauere Verfahren Spülung Flüssigkeiten).
- Stellen einer gesättigten Lösung von Mo2(ArNC(H)NAr)4 von 20 mg des Feststoffes in 2 mL entgast CH2Cl2auflösen.
- Machen Sie eine Pipette Celite Stecker, indem man ein kleines Stück Windex in einer Pipette. Die Pipette eine kleine Menge der Celite hinzufügen.
- Filtern Sie die CH2Cl2 Lösung durch die Pipette Celite Stecker in ein kleines 5 mL Fläschchen. Dazu beitragen Sie, um die Lösung durch die Celite mit einer Pipette Glühbirne zu schieben.
- Mit einer Pinzette, fügen Sie 5 mL Fläschchen in ein 10 mL-Fläschchen funkeln.
- Hinzugeben Sie in der äußeren funkeln Ampulle 2 mL Hexanes.
- Fest verschließen Sie das Funkeln-Fläschchen und legen Sie sie auf einem Regal, wo es ungestört sein.
- Mindestens 24 h für einzelne Kristallwachstum zu ermöglichen (siehe "Röntgen-Kristallographie" Video in der Essentials of Organic Chemistry -Serie für eine mehr detaillierte Anleitung wie man einzelne Kristalle wachsen).
- Einkristall Röntgendaten auf die Probe zu sammeln (siehe "Single Crystal und Pulver x-ray Diffraction" Video für eine detailliertere Verfahren wie Röntgen-Daten sammeln).
Ergebnisse
Liganden ArN (H) C (H) NAr
Ausbeute: 3,25 g (53 %). 1 H-NMR (Chloroform -d, 500 MHz, δ, ppm): 8,06 (s, 1 H, NHC -HN), 6,99 (d, 4 H, aromatischen C -H, J = 8,7 Hz), 6,86 (d, 4 H, aromatischen C -H, J = 9,0 Hz), 3.80 (s, 6 H - OCH3).
Mo komplexe Mo2(ArNC(H)NAr)4
Ertrag: 450 mg (57 %). 1 H-NMR (Chloroform -d, 500 MHz, δ, ppm): 8,38 (s, 4 H, NHC -HN), 6.51 (d, 16 H, aromatischen C -H, J = 8,8 Hz), 6.16 (d, 16 H, aromatischen C -H, J = 8,8 Hz), 3.71 (s, 24 H - OCH3).
Tabelle 1. Crystal-Daten und Parameter Einheit Zelle
| Summenformel | C60H70Mo2N8O8 |
| Formel-Gewicht (g/Mol) | 1223.12 |
| Temperatur (K) | 296.15 |
| Kristall-system | triclinic |
| Raumgruppe | P-1 |
| ein (Å) | 10.1446(4) |
| b (Å) | 10.3351(4) |
| c (Å) | 13.9623(6) |
| Α (°) | 80.151(2) |
| Β (°) | 75.251(2) |
| Γ (°) | 82.226(2) |
| Volumen (Å3) | 1388.3(1) |
Die 1H-NMR-Spektrum von Mo2(ArNC(H)NAr)4weist zwei Signale der aromatischen Region, die im Einklang mit 4-Foldsymmetry. Die Solid-State-Struktur (Abbildung 7) steht im Einklang mit dem Punkt Gruppe D4 und verfügt über eine kurze Mo-Mo-Anleihe (2.0925(3) Å). Die atomaren Radien von Mo sind 1,45 Å. Daher ist die Verwendung Gleichung 1, der FSR-Wert für das M-M-Band in Mo2(ArNC(H)NAr)40,72 ist. Dieser Wert ist niedriger als die für die Mo-Mo komplexe Mo(hpp)4 vierfach verklebt (Hpp = 1,3,4,6,7,8-Hexahydro-2H- Pyrimido [1,2 -ein] pyrimidinate), die hat einen FSR-Wert von 0.797 und steht im Einklang mit der Anwesenheit von ein M-M-Vierfachbindung3.
Abbildung 7. Solid-State-Struktur für Mo2(ArNC(H)NAr)4 mit der thermischen Ellipsoide in 50 % iger Wahrscheinlichkeit Höhe festgesetzt. Wasserstoff-Atome sind aus Gründen der Übersichtlichkeit (Mo Marine, N blau, C grau) weggelassen.
Anwendung und Zusammenfassung
In diesem Video erfuhren wir von M-M-Bindung. Wir synthetisiert eine zweikernige Molybdän Komplex mit einem Vierfachbindung. Vierfache Anleihen bestehen aus drei verschiedenen Bond-Typen, einschließlich σ, π und δ Anleihen. Wir sammelten Einkristall Röntgenbeugung Daten und beobachtet ein kurzes Mo-Mo-Anleihe mit einer Vierfach geklebte Verbindung.
Schaufelrad-komplexe, z. B. die Mo2 komplexe vorbereitet, zeigt eine Vielzahl von Eigenschaften und somit finden Anwendung in den verschiedensten Bereichen der Chemie. Z. B. M-M Bande spielen eine wichtige Rolle in der Katalyse: Dirhodium Paddlewheel Komplex Rh2(OAc)4 ist ein bekannter Katalysator für C-H Bindung Funktionalisierung über Carben und Nitrene Transferreaktionen (Abbildung 8). In einer typischen Carben-Transfer-Reaktion reagiert Rh2(OAc)4 mit einer diazo Verbindung, ein Rh2 Carben intermediate zu generieren. Spätere Einfügung das Carben in einer C-H-Bindung erzeugt das Produkt von C-H-Funktionalisierung und Rh2(OAc)4 Katalysator regeneriert. Die außergewöhnlichen Reaktivität von Rh2 Katalysatoren in dieser Reaktionen hat Rh Rh Interaktion über das M-M-Band zugeschrieben worden. Die Rh-Rh-Bindung in der resultierenden zwischen-fungiert als ein Elektron Reservoir; während einem Metall als eine Bindungsstelle für Substrat dient, springt die zweite Metallzentrum Elektronendichte vom aktiven Metallzentrum und während der Substrat-Aktivierung. Das d-Orbital-Aufspaltung schematische Darstellung der mittleren Komplex (Rh-Rh Kern verpflichtet, das Carbenoid) zeigt, dass die Grenze d-orbitale sind nicht-Bindung in Bezug auf die aktive Rh Mitte (Abbildung 9a). Die Elektronendichte im σ und π nicht kleben MOs konzentriert sich auf die nukleophilen Carbenoid Kohlenstoff und der "Zuschauer" Rh Mitte, die nicht direkt an die Carbenoid (Abbildung 9 b)4gebunden ist.

Abbildung 8. C-H Bindung Funktionalisierung über ein Metall-Carbenoid Zwischenprodukt.
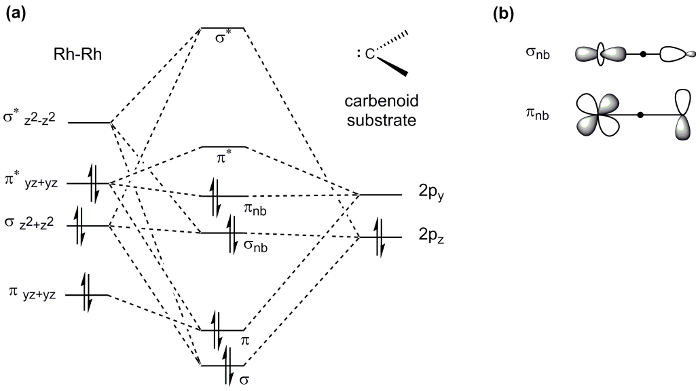
Abbildung 9. (ein) d-orbital MO Aufteilung Diagramm des Rh-Rh-Kerns im Schaufelrad-komplexe an ein Carbenoid Substrat gebunden. Beachten Sie, dass nur orbitale Substrat Bindung beteiligt sind. (b) die resultierende σ und π nicht kleben MOs sind gefüllt mit Elektronen. Die Elektronendichte in die MOs wird auf das Carbenoid Carbon und der "Zuschauer" Rh Mitte zentriert.
Schaufelrad-komplexe haben auch als Bausteine in MOFs verwendet worden. MOFs sind poröser Koordinationspolymere, die Metallkomplexe durch organischen Liganden miteinander bestehen. Die daraus resultierende ein-, zwei- oder dreidimensionale Aufbauten können in einer Vielzahl von Anwendungen, die von Gas-Absorption (einschließlich Trennung und Reinigung) bis hin zur Katalyse verwendet werden.
Referenzen
- Nguyen, T., Sutton, A. D., Brynda, M., Fettinger, J. C., Long, G. J., Power, P. P. Synthesis of a stable compound with fivefold bonding between two chromium(I) centers. Science. 310(5749), 844-847 (2005).
- Lin, C., Protasiewicz, J. D., Smith, E. T., Ren, T. Linear free energy relationship in dinuclear compounds. 2. Inductive redox tuning via remote substituents in quadruply bonded dimolybdenum compounds. Inorg Chem. 35(22), 6422-6428 (1996).
- Cotton, F. A., Murillo, C. A., Walton, R. A. Eds. Multiple Bonds Between Metal Atoms, 3rd ed. Springer. New York, NY. (2005).
- Nakamura, E., Yoshikai, N., Yamanaka, M. Mechanism of C−H Bond Activation/C−C Bond Formation Reaction between Diazo Compound and Alkane Catalyzed by Dirhodium Tetracarboxylate. J Am Chem Soc. 124 (24), 7181-7192 (2002).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Vierfach-metallgeklebte Schaufelräder
Inorganic Chemistry
15.3K Ansichten

Synthese eines Ti(III)-Metallocen-Katalysators mittels Schlenk-Technik
Inorganic Chemistry
31.6K Ansichten

Handschuhbox und Verunreinigungssensoren
Inorganic Chemistry
18.6K Ansichten

Reinigung von Ferrocen durch Sublimation
Inorganic Chemistry
54.6K Ansichten

Die Evans-Methode
Inorganic Chemistry
68.5K Ansichten

Einkristall- und Pulverröntgendiffraktometrie
Inorganic Chemistry
104.4K Ansichten

Elektronenparamagnetische Rezonanzspektroskopie (EPR-Spektroskopie)
Inorganic Chemistry
25.4K Ansichten

Mößbauerspektroskopie
Inorganic Chemistry
22.0K Ansichten

Lewis-Säure-Base-Wechselwirkungen in Ph3P-BH3
Inorganic Chemistry
38.9K Ansichten

Struktur von Ferrocen
Inorganic Chemistry
79.5K Ansichten

Anwendung der Gruppentheorie auf die IR-Spektroskopie
Inorganic Chemistry
45.2K Ansichten

Molekülorbital (MO)-Theorie
Inorganic Chemistry
35.3K Ansichten

Farbstoffsensibilisierte Solarzellen
Inorganic Chemistry
15.8K Ansichten

Synthese eines Sauerstoff-transportierenden Cobalt(II) - Komplex
Inorganic Chemistry
51.7K Ansichten

Photochemische Initiierung von radikalischen Polymerisationsreaktionen
Inorganic Chemistry
16.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten