Principio di Le Châtelier
Panoramica
Fonte: Laboratorio della dott.ssa Lynne O'Connell — Boston College
Quando le condizioni di un sistema all'equilibrio sono alterate, il sistema risponde in modo tale da mantenere l'equilibrio. Nel 1888, Henri-Lewis Le Châtelier descrisse questo fenomeno in un principio che afferma: "Quando un cambiamento di temperatura, pressione o concentrazione disturba un sistema in equilibrio chimico, il cambiamento sarà contrastato da un'alterazione nella composizione dell'equilibrio".
Questo esperimento dimostra il principio di Le Châtelier al lavoro in una reazione reversibile tra ione ferro (III) e ione tiocianato, che produce ferro (III) tiociante ione:
Fe3+(aq) + SCN- (aq)  FeSCN2+ (aq)
FeSCN2+ (aq)
La concentrazione di uno degli ioni viene alterata aggiungendo direttamente una quantità di uno ione alla soluzione o rimuovendo selettivamente uno ione dalla soluzione attraverso la formazione di un sale insolubile. Le osservazioni dei cambiamenti di colore indicano se l'equilibrio si è spostato per favorire la formazione dei prodotti o dei reagenti. Inoltre, si può osservare l'effetto di un cambiamento di temperatura sulla soluzione all'equilibrio, che porta alla capacità di concludere se la reazione è esotermica o endotermica.
Principi
Per comprendere appieno il principio di Le Châtelier, viene considerata una reazione reversibile del tipo espresso dalla seguente equazione chimica:
aA + bB  cC + dD
cC + dD
Questa reazione consiste in realtà di due processi concorrenti: la reazione in avanti, in cui i prodotti C e D sono formati dai reagenti, e la reazione inversa, in cui i reagenti A e B sono formati dai prodotti. Quando i tassi di questi due processi sono uguali tra loro, non vi è alcun cambiamento netto nella concentrazione né dei prodotti né dei reagenti, e si dice che la reazione sia all'equilibrio. Il rapporto tra le concentrazioni di equilibrio dei prodotti e le concentrazioni di equilibrio dei reagenti è una costante, come mostrato dalla seguente equazione:

dove Kc è la costante di equilibrio. Le parentesi indicano le concentrazioni delle varie specie e le lettere minuscole rappresentano il numero di moli di ciascuna sostanza coinvolta nell'equazione bilanciata. Nel caso della reazione tra ioni ferro(III) e tiocianato mostrata in precedenza, la costante di equilibrio è:
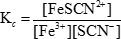
Quando la concentrazione di un reagente o di un prodotto in una soluzione di equilibrio è alterata, le concentrazioni delle altre specie devono cambiare per mantenere il rapporto costante tra prodotti e reagenti. Questi cambiamenti sono indicati come "spostamenti" nell'equilibrio. L'equilibrio può spostarsi a sinistra, il che significa che procede nella direzione inversa e le concentrazioni dei reagenti aumentano, o spostarsi a destra, il che significa che procede nella direzione in avanti e le concentrazioni dei prodotti aumentano. Nella reazione tra ioni ferro (III) e tiocianato, uno spostamento a sinistra significherebbe la formazione di più ioni ferro (III) e tiocianato, mentre uno spostamento a destra significherebbe la formazione di più ioni tiocianato di ferro (III).
La costante di equilibrio dipende dalla temperatura; quindi, un cambiamento nella temperatura di una soluzione di equilibrio può anche comportare uno spostamento a destra oa sinistra, a seconda che la reazione sia esotermica o endotermica. Per una reazione esotermica, il calore generato dalla reazione può essere rappresentato come residente sul lato prodotto dell'equazione, poiché il calore viene prodotto insieme ai prodotti:
aA + bB  cC + dD + calore
cC + dD + calore
Se il calore viene aggiunto al sistema aumentando la temperatura, l'equilibrio si sposta a sinistra e le concentrazioni dei reagenti aumentano. Per una reazione endotermica, l'aggiunta di calore comporterebbe uno spostamento a destra.
aA + bB + calore  cC + dD
cC + dD
In questo caso, le concentrazioni dei reagenti aumenterebbero con un aumento della temperatura.
Procedura
1. Preparazione delle soluzioni di equilibrio del tiocianato di ferro (III)
- Posizionare 1 goccia di 1 M Fe (NO3)3 soluzione in una provetta e diluire con 2 ml di acqua. Posizionare 1 goccia di 1 M KSCN in un'altra provetta e diluire con 2 ml di acqua. Queste due provette servono come controlli da confrontare con le altre provette.
- Posizionare 1 goccia di 1 M Fe (NO3)3 soluzione in una provetta.
- Aggiungere 1 goccia di 1 M KSCN alla provetta.
- Aggiungere 16 ml di acqua alla provetta e mescolare accuratamente il contenuto.
- Registrare eventuali osservazioni.
- Dividere la miscela in porzioni da 2 ml in 8 provette. Una delle provette rimane intatta e funge da controllo FeSCN2+. Numerazione delle altre provette 1–7.
2. Aggiunta di ioni ferro (III) e tiocianato alla soluzione di equilibrio
- Per la provetta 1, aggiungere 1 goccia di 1 M Fe (NO3)3 soluzione.
- Agitare per mescolare e registrare eventuali osservazioni.
- Per la provetta 2, aggiungere 1 goccia di 1 soluzione KSCN.
- Agitare per mescolare e registrare eventuali osservazioni.
3. Aggiunta di nitrato d'argento alla soluzione di equilibrio
- Per la provetta 3, aggiungere 3 gocce di soluzione di AgNO3 da 0,1 M.
- Agitare per mescolare e registrare eventuali osservazioni.
- Aggiungere 3 gocce di 1 M Fe (NO3)3 alla provetta.
- Agitare per mescolare e registrare eventuali osservazioni.
- Per la provetta 4, aggiungere 3 gocce di soluzione di AgNO3 da 0,1 M.
- Agitare per mescolare e registrare eventuali osservazioni.
- Aggiungere 3 gocce di 1 M KSCN alla provetta.
- Agitare per mescolare e registrare eventuali osservazioni.
4. Aggiunta di fosfato di potassio alla soluzione di equilibrio
- Per la provetta 5, aggiungere 3 gocce di soluzione da 0,5 M K3PO4.
- Agitare per mescolare e registrare eventuali osservazioni.
- Aggiungere 3 gocce di 1 M Fe (NO3)3 alla provetta.
- Agitare per mescolare e registrare eventuali osservazioni.
- Per la provetta 6, aggiungere 3 gocce di soluzione 0,5 M K3PO4.
- Agitare per mescolare e registrare eventuali osservazioni.
- Aggiungere 3 gocce di 1 M KSCN alla provetta.
- Agitare per mescolare e registrare eventuali osservazioni.
5. Modifica della temperatura della soluzione di equilibrio
- Posizionare la provetta 7 in un bagno d'acqua a 70-80 °C per 1-2 minuti.
- Confrontare la soluzione calda con la soluzione nella provetta non riscaldata (il controllo FeSCN2+) e registrare eventuali osservazioni.
- Raccogli il contenuto delle provette 3 e 4 nel barattolo dei rifiuti di laboratorio etichettato "Argento". Versare il contenuto di tutte le altre provette nello scarico.
Risultati
Le osservazioni delle soluzioni iniziali e della miscela delle due soluzioni possono essere viste nella Tabella 1.
Le osservazioni delle miscele di equilibrio dopo l'aggiunta di vari reagenti possono essere viste nella Tabella 2.
Osservazione quando la temperatura viene modificata: nella provetta 7, la soluzione diventa più di colore arancione (meno rosso, più giallo) quando riscaldata.
Nelle provette 1 e 2, quando il nitrato di ferro (III), che contiene un reagente, è stato aggiunto alla soluzione di equilibrio, il colore rosso della soluzione si è intensificato. Questa osservazione indica che l'equilibrio si è spostato a destra all'aumentare della concentrazione del prodotto, lo ione tiocianato di ferro (III). Allo stesso modo, quando il tiocianato di potassio, che contiene l'altro reagente, è stato aggiunto alla soluzione di equilibrio, il colore rosso della soluzione si è intensificato. Questa osservazione indica anche che l'equilibrio si è spostato a destra all'aumentare della concentrazione del prodotto.
Nelle provette 3 e 4, quando il nitrato d'argento (AgNO 3 ) è stato aggiunto allasoluzionedi equilibrio, il colore rosso del prodotto è sbiadito e la soluzione è diventata incolore. Questa osservazione indica che l'equilibrio si è spostato a sinistra all'aumentare della concentrazione di reagenti. Inoltre, è stato osservato un precipitato. Il colore rosso riapparve con l'aggiunta di ione tiocianato (SCN-). Questa osservazione indica che l'equilibrio si è spostato a destra all'aumentare della concentrazione del prodotto. Il colore rosso non è riapparso quando è stato aggiunto lo ione ferro (III) (Fe3+).
Da queste osservazioni, si può concludere che il tiocianato d'argento (AgSCN) era il precipitato che si è formato quando il nitrato d'argento è stato aggiunto alla soluzione di equilibrio. La formazione di questo solido è responsabile della torbidità osservata in entrambe le provette. Quando lo ione tiocianato è stato rimosso dalla soluzione per precipitazione, l'equilibrio si è spostato a sinistra, perché la concentrazione di uno dei reagenti era stata ridotta. Quando è stato aggiunto più ione tiocianato, l'equilibrio si è spostato di nuovo a destra per ristabilire il rapporto di equilibrio delle concentrazioni riformando il tiocianato di ferro (III). L'aggiunta di più ione ferro (III) non ha spostato l'equilibrio a destra, perché lo ione tiocianato era stato rimosso dalla soluzione come precipitato di tiocianato d'argento e non era più disponibile a reagire con il ferro (III) per formare lo ione tiocianato di ferro (III).
Nelle provette 5 e 6, quando lo ione fosfato di potassio (K3PO 4 ) è stato aggiunto allasoluzionedi equilibrio, il colore rosso dei prodotti è sbiadito e la soluzione è diventata gialla. Questa osservazione indica che l'equilibrio si è spostato a sinistra all'aumentare della concentrazione di reagenti. Il colore rosso riapparve con l'aggiunta di ione ferro (III) (Fe3+). Questa osservazione indica che l'equilibrio si è spostato a destra all'aumentare della concentrazione del prodotto. Inoltre, è stato osservato un precipitato. Il colore rosso non è riapparso quando è stato aggiunto lo ione tiocianato (SCN-).
Da queste osservazioni, si può concludere che il sale di ferro (III) fosfato (FePO4) si è formato quando il fosfato di potassio è stato aggiunto alla soluzione di equilibrio. Quando lo ione ferro (III) è stato rimosso dalla soluzione per formazione di questo sale, l'equilibrio si è spostato a sinistra, perché la concentrazione di uno dei reagenti era stata ridotta. Quando è stato aggiunto più ione ferro (III), l'equilibrio si è spostato di nuovo a destra per ristabilire il rapporto di equilibrio delle concentrazioni riformando il ferro (III) tiociante. Sebbene non sia stata rilevata alcuna nuvolosità dalla vista quando lo ione fosfato è stato inizialmente aggiunto, una torbidità è apparsa quando è stato successivamente aggiunto lo ione ferro (III), che è il sale fosfato di ferro solido (III). L'aggiunta di più ione tiocianato non ha spostato l'equilibrio verso destra, perché lo ione ferro (III) era stato rimosso dalla soluzione come sale fosfato di ferro (III) e non era più disponibile a reagire con lo ione tiocianato per formare lo ione tiocianato di ferro (III).
Nella provetta 7, con l'aumentare della temperatura, il colore rosso dei prodotti svaniva, indicando uno spostamento di equilibrio a sinistra man mano che si formavano più reagenti. Questa osservazione porta alla conclusione che la reazione è esotermica. Per una reazione esotermica, il calore generato dalla reazione risiede sul lato prodotto dell'equazione:
Fe3+ + SCN-  FeSCN2+ + calore
FeSCN2+ + calore
Quando il calore è stato aggiunto al sistema (aumentando la temperatura), l'equilibrio si è spostato a sinistra.
| Soluzione | Osservazione |
| Fe(NO3)3 | Giallo, chiaro |
| KSCN · | Incolore, chiaro |
| Fe(SCN)2+ | Rosso-arancio, trasparente |
Tabella 1. Osservazioni delle soluzioni iniziali e della miscela delle due soluzioni.
| Provetta # | Primo reagente | Osservazione della soluzione di equilibrio | Secondo reagente | Osservazione della soluzione di equilibrio |
| 1 | Fe(NO3)3
|
Rosso, trasparente | — | — |
| 2 | KSCN ·
|
Rosso, trasparente | — | — |
| 3 | AgNO3 (incolore, trasparente) | Incolore (bianco), nuvoloso | Fe(NO3)3 | Giallo, ancora nuvoloso |
| 4 | AgNO3 · | Incolore (bianco), nuvoloso | KSCN · | Rosso-arancio, ancora nuvoloso |
| 5 | K3PO4 (incolore, trasparente) | Giallo, chiaro | Fe(NO3)3 | Rosso-arancio, nuvoloso |
| 6 | K3PO4 | Giallo, chiaro | KSCN · | Giallo, ancora chiaro |
Tabella 2. Osservazioni delle miscele di equilibrio con aggiunta di vari reagenti.
Applicazione e Riepilogo
Il principio di Le Châtelier è all'opera nei corpi umani. L'ossigeno viene trasportato dai polmoni ai muscoli e ad altri tessuti da una proteina chiamata emoglobina (Hb) che si trova nel sangue. La molecola di ossigeno si lega a questa proteina in una reazione reversibile che può essere descritta da un'equazione di equilibrio:
Hb + 4 O2  Hb(O2)4
Hb(O2)4
Nei polmoni, la pressione parziale del gas ossigeno è elevata (dell'ordine di 100 torr). L'equilibrio si sposta a destra in questo ambiente e le molecole di ossigeno si legano alle molecole di emoglobina fino a quando la proteina non è satura di ossigeno. Quando questa emoglobina satura raggiunge le cellule del tessuto muscolare, dove la pressione dell'ossigeno è molto più bassa, l'equilibrio si sposta a sinistra e l'ossigeno viene rilasciato. Se il muscolo è a riposo, la pressione dell'ossigeno è di circa 30 torr e circa il 40% dell'ossigeno viene rilasciato. Quando il muscolo è attivo, la pressione dell'ossigeno varia da 3 a 18 torr e circa l'85% dell'ossigeno viene rilasciato per soddisfare l'aumento della domanda metabolica.
Un altro esempio fisiologico di un sistema di equilibrio riguarda la regolazione del pH del sangue. L'anidride carbonica nel sangue reagisce in modo reversibile con l'acqua per produrre acido carbonico, che si dissocia per produrre ioni idronio e bicarbonato:
CO2 (aq) + H2O (l)  H2CO3 (aq)
H2CO3 (aq)  H3O+ (aq) + HCO3-(aq)
H3O+ (aq) + HCO3-(aq)
Durante l'esercizio fisico intenso, la quantità di anidride carbonica prodotta dalle cellule aumenta a causa dell'elevata attività metabolica. L'aumento della concentrazione di anidride carbonica nel sangue provoca uno spostamento a destra in questo equilibrio per produrre più acido carbonico. Quando ciò accade, il livello di pH del sangue diminuisce all'aumentare della concentrazione di ioni idronio. Una delle risposte del corpo a questo squilibrio nel pH del sangue è quella di aumentare la velocità di respirazione in modo che più gas di anidride carbonica venga espirato dai polmoni, spostando così l'equilibrio a sinistra e riportando il pH a livelli normali.
Il principio di Le Châtelier deve essere preso in considerazione anche in molti processi industriali. L'ammoniaca è un'importante sostanza chimica utilizzata nei fertilizzanti, nei detergenti e come elemento costitutivo nelle reazioni organiche sintetiche. La produzione industriale di ammoniaca viene effettuata utilizzando il processo Haber, che si basa sulla reazione reversibile tra idrogeno e azoto:
3 H2 (g) + N2 (g)  2 NH3 (g)
2 NH3 (g)
Al fine di ottimizzare la produzione di ammoniaca, la reazione viene eseguita ad alta pressione, di solito intorno ai 200 atm. Ci sono 4 moli di gas sul lato sinistro dell'equazione e 2 moli di gas sul lato destro. Il principio di Le Châtelier impone che un aumento della pressione sul sistema sposti l'equilibrio a destra, perché il volume di 2 moli di gas è inferiore al volume di 4 moli di gas. Poiché il volume e la pressione sono direttamente proporzionali, uno spostamento per ridurre il volume riduce anche la pressione e il sistema ritorna all'equilibrio. Inoltre, il processo prevede la liquefazione del gas di ammoniaca in un condensatore, quindi viene rimosso dalla camera di reazione. Questa diminuzione dell'ammoniaca sposta anche l'equilibrio a destra, massimizzando la quantità di ammoniaca prodotta.
Vai a...
Video da questa raccolta:

Now Playing
Principio di Le Châtelier
General Chemistry
266.1K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
659.7K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
275.8K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
557.3K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
384.0K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
183.9K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.6K Visualizzazioni

Uso del pH-metro
General Chemistry
347.1K Visualizzazioni

Introduzione alla titolazione
General Chemistry
425.9K Visualizzazioni

Legge dei gas perfetti
General Chemistry
79.5K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.9K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
161.0K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.5K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.8K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.8K Visualizzazioni