Princípio de Le Châtelier
Visão Geral
Fonte: Laboratório do Dr. Lynne O'Connell — Boston College
Quando as condições de um sistema em equilíbrio são alteradas, o sistema responde de forma a manter o equilíbrio. Em 1888, Henri-Lewis Le Châtelier descreveu esse fenômeno em um princípio que afirma: "Quando uma mudança de temperatura, pressão ou concentração perturba um sistema em equilíbrio químico, a mudança será neutralizada por uma alteração na composição do equilíbrio.".
Este experimento demonstra o princípio de Le Châtelier no trabalho em uma reação reversível entre íon de ferro (III) e íon tiocianato, que produz íon de tiocário de ferro(III):
Fe3+(aq) + SCN- (aq)  FeSCN2+ (aq)
FeSCN2+ (aq)
A concentração de um dos íons é alterada, seja adicionando diretamente uma quantidade de um íon à solução ou removendo seletivamente um íon da solução através da formação de um sal insolúvel. Observações de mudanças de cor indicam se o equilíbrio mudou para favorecer a formação dos produtos ou dos reagentes. Além disso, pode-se observar o efeito de uma mudança de temperatura na solução em equilíbrio, o que leva à capacidade de concluir se a reação é extermica ou endórmica.
Princípios
Para compreender completamente o Princípio de Le Châtelier, considera-se uma reação reversível do tipo expressa pela seguinte equação química:
aA + bB  cC + dD
cC + dD
Essa reação consiste, na verdade, em dois processos concorrentes: a reação para a frente, na qual os produtos C e D são formados a partir dos reagentes, e a reação reversa, na qual os reagentes A e B são formados a partir dos produtos. Quando as taxas desses dois processos se igualam, não há mudança líquida na concentração dos produtos ou dos reagentes, e diz-se que a reação está em equilíbrio. A razão das concentrações de equilíbrio dos produtos com as concentrações de equilíbrio dos reagentes é uma constante, como mostra a seguinte equação:

onde Kc é a constante de equilíbrio. Os suportes significam as concentrações das várias espécies, e as letras minúsculas representam o número de mols de cada substância envolvida na equação equilibrada. No caso da reação entre íons de ferro(III) e tiocianato mostrados anteriormente, a constante de equilíbrio é:
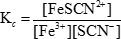
Quando a concentração de um reagente ou de um produto em uma solução de equilíbrio é alterada, as concentrações das outras espécies devem mudar para manter a proporção constante de produtos aos reagentes. Essas mudanças são referidas como "mudanças" no equilíbrio. O equilíbrio pode mudar para a esquerda, o que significa que prossegue na direção inversa e as concentrações dos reagentes aumentam, ou mudam para a direita, o que significa que prossegue na direção dianteira e as concentrações dos produtos aumentem. Na reação entre íons de ferro (III) e tiocianato, uma mudança para a esquerda significaria a formação de mais íons de ferro (III) e tiocianato, enquanto uma mudança para a direita significaria a formação de íons de tiocianato de ferro (III).
A constante de equilíbrio depende da temperatura; assim, uma mudança na temperatura de uma solução de equilíbrio também pode resultar em uma mudança para a direita ou para a esquerda, dependendo se a reação é exotérmica ou endórmica. Para uma reação exotérmica, o calor gerado pela reação pode ser representado como residente no lado do produto da equação, uma vez que o calor é produzido junto com os produtos:
aA + bB  cC + dD + calor
cC + dD + calor
Se o calor for adicionado ao sistema aumentando a temperatura, o equilíbrio muda para a esquerda, e as concentrações dos reagentes aumentam. Para uma reação endotérmica, a adição de calor resultaria em uma mudança para a direita.
aA + bB + calor  cC + dD
cC + dD
Neste caso, as concentrações dos reagentes aumentariam com um aumento na temperatura.
Procedimento
1. Preparação das Soluções de Equilíbrio de Tiocianato de Ferro (III)
- Coloque 1 gota de 1 M Fe(NO3)3 solução em um tubo de ensaio e diluir com 2 mL de água. Coloque 1 gota de 1 M KSCN em outro tubo de ensaio e dilua com 2 mL de água. Estes dois tubos de ensaio servem como controles para comparar com os outros tubos de ensaio.
- Coloque 1 gota de 1 M Fe(NO3)3 solução em um tubo de ensaio.
- Adicione 1 gota de 1 M KSCN ao tubo de ensaio.
- Adicione 16 mL de água ao tubo de ensaio e misture bem o conteúdo.
- Regisso regisário de qualquer observação.
- Divida a mistura em porções de 2 mL em 8 tubos de ensaio. Um dos tubos de ensaio permanece intocado e serve como um controle FeSCN2+. Numerar os outros tubos de ensaio 1-7.
2. Adição de íons de ferro(III) e tiocianato à Solução de Equilíbrio
- Para testar o tubo 1, adicione 1 gota de 1 M Fe(NO3)3 solução.
- Agite para misturar e gravar quaisquer observações.
- Para testar o tubo 2, adicione 1 gota de 1 solução KSCN.
- Agite para misturar e gravar quaisquer observações.
3. Adição de Nitrato de Prata à Solução de Equilíbrio
- Para testar o tubo 3, adicione 3 gotas de solução AgNO 3 de0,1 M.
- Agite para misturar e gravar quaisquer observações.
- Adicione 3 gotas de 1 M Fe(NO3)3 ao tubo de ensaio.
- Agite para misturar e gravar quaisquer observações.
- Para testar o tubo 4, adicione 3 gotas de solução AgNO3 de 0,1 M.
- Agite para misturar e gravar quaisquer observações.
- Adicione 3 gotas de 1 M KSCN ao tubo de ensaio.
- Agite para misturar e gravar quaisquer observações.
4. Adição de Fosfato de Potássio à Solução de Equilíbrio
- Para testar o tubo 5, adicione 3 gotas de 0,5 M K3PO4 solução.
- Agite para misturar e gravar quaisquer observações.
- Adicione 3 gotas de 1 M Fe(NO3)3 ao tubo de ensaio.
- Agite para misturar e gravar quaisquer observações.
- Para testar o tubo 6, adicione 3 gotas de 0,5 M K3PO4 solução.
- Agite para misturar e gravar quaisquer observações.
- Adicione 3 gotas de 1 M KSCN ao tubo de ensaio.
- Agite para misturar e gravar quaisquer observações.
5. Alterar a temperatura da solução de equilíbrio
- Coloque o tubo de ensaio 7 em um banho de água de 70-80 °C por 1-2 min.
- Compare a solução quente com a solução no tubo de ensaio não aquecido (o controle FeSCN2+) e regissou quaisquer observações.
- Recolhe o conteúdo dos tubos de ensaio 3 e 4 no frasco de resíduos de laboratório rotulado "Prata". Despeje o conteúdo de todos os outros tubos de ensaio pelo ralo.
Resultados
Observações das soluções iniciais e da mistura das duas soluções podem ser vistas na Tabela 1.
Observações das misturas de equilíbrio após a adição de vários reagentes podem ser vistas na Tabela 2.
Observação quando a temperatura é alterada: No tubo de ensaio 7, a solução fica mais laranja na cor (menos vermelho, mais amarelo) quando aquecida.
Nos tubos de ensaio 1 e 2, quando o nitrato de ferro (III), que contém um reagente, foi adicionado à solução de equilíbrio, a cor vermelha da solução se intensificou. Esta observação indica que o equilíbrio mudou para a direita como concentração do produto, íon tiocianato de ferro (III), aumentado. Da mesma forma, quando o tiocianato de potássio, que contém o outro reagente, foi adicionado à solução de equilíbrio, a cor vermelha da solução se intensificou. Esta observação também indica que o equilíbrio mudou para a direita à medida que a concentração do produto aumentava.
Nos tubos de ensaio 3 e 4, quando o nitrato de prata (AgNO3) foi adicionado à solução de equilíbrio, a cor vermelha do produto desbotou e a solução ficou incolor. Esta observação indica que o equilíbrio mudou para a esquerda à medida que a concentração de reagentes aumentava. Além disso, foi observado um precipitado. A cor vermelha reapareceu após a adição de íon tiocianato (SCN- ). Esta observação indica que o equilíbrio mudou para a direita à medida que a concentração do produto aumentava. A cor vermelha não reapareceu quando o íon de ferro (III) (Fe3+) foi adicionado.
A partir dessas observações, pode-se concluir que o tiocianato de prata (AgSCN) foi o precipitado que se formou quando o nitrato de prata foi adicionado à solução de equilíbrio. A formação desse sólido é responsável pela nebulosidade observada em ambos os tubos de ensaio. Quando o íon tiocianato foi removido da solução por precipitação, o equilíbrio mudou para a esquerda, porque a concentração de um dos reagentes havia sido reduzida. Quando mais íon tiocianato foi adicionado, o equilíbrio voltou para o direito de restabelecer a razão de equilíbrio das concentrações, re-formando o tiocianato de ferro (III). A adição de mais íon de ferro (III) não mudou o equilíbrio de volta para a direita, porque o íon tiocianato havia sido removido da solução como precipitado tiocianato de prata e não estava mais disponível para reagir com ferro(III) para formar o íon tiocianato de ferro(III).
Nos tubos de ensaio 5 e 6, quando o íon fosfato de potássio (K3PO4) foi adicionado à solução de equilíbrio, a cor vermelha dos produtos desapareceu e a solução ficou amarela. Esta observação indica que o equilíbrio mudou para a esquerda à medida que a concentração de reagentes aumentava. A cor vermelha reapareceu após a adição de íon de ferro (III) (Fe3+). Esta observação indica que o equilíbrio mudou para a direita à medida que a concentração do produto aumentava. Além disso, foi observado um precipitado. A cor vermelha não reapareceu quando o íon tiocianato (SCN-) foi adicionado.
A partir dessas observações, pode-se concluir que o salfosfato de ferro (III) foi formado quando o fosfato de potássio foi adicionado à solução de equilíbrio. Quando o íon de ferro (III) foi removido da solução por formação desse sal, o equilíbrio mudou para a esquerda, pois a concentração de um dos reagentes havia sido reduzida. Quando mais íon de ferro (III) foi então adicionado, o equilíbrio voltou para o direito de restabelecer a razão de equilíbrio das concentrações, re-formando ferro(III) thiocyante. Embora nenhuma nebulosidade tenha sido detectada pela visão quando o íon fosfato foi inicialmente adicionado, uma nebulosidade apareceu quando o íon ferro(III) foi adicionado posteriormente, que é o sal de fosfato de ferro sólido (III). A adição de mais íon tiocianato não mudou o equilíbrio de volta para a direita, pois o íon ferro(III) havia sido removido da solução como sal fosfato de ferro (III) e não estava mais disponível para reagir com o íon tiocianato para formar o íon tiocianato de ferro(III).
No tubo de ensaio 7, à medida que a temperatura aumentava, a cor vermelha dos produtos desbotava, indicando uma mudança de equilíbrio para a esquerda à medida que mais reagentes eram formados. Esta observação leva à conclusão de que a reação é exotérmica. Para uma reação extermica, o calor gerado pela reação reside no lado do produto da equação:
Fe3+ + SCN-  FeSCN2+ + calor
FeSCN2+ + calor
Quando o calor foi adicionado ao sistema (aumentando a temperatura), o equilíbrio mudou para a esquerda.
| Solução | Observação |
| Fe(NO3)3 | Amarelo, claro |
| KSCN | Incolor, claro |
| Fe(SCN)2+ | Vermelho-laranja, claro |
Mesa 1. Observações das soluções iniciais e da mistura das duas soluções.
| Tubo de ensaio # | Primeiro Reagente | Observação da Solução de Equilíbrio | Segundo Reagente | Observação da Solução de Equilíbrio |
| 1 | Fe(NO3)3
|
Vermelho, claro | — | — |
| 2 | KSCN
|
Vermelho, claro | — | — |
| 3 | AgNO3 (incolor, claro) | Incolor (branco), nublado | Fe(NO3)3 | Amarelo, ainda nublado |
| 4 | AgNO3 | Incolor (branco), nublado | KSCN | Laranja-vermelho, ainda nublado |
| 5 | K3PO4 (incolor, claro) | Amarelo, claro | Fe(NO3)3 | Laranja-vermelho, nublado |
| 6 | K3PO4 | Amarelo, claro | KSCN | Amarelo, ainda claro |
Mesa 2. Observações das misturas de equilíbrio após a adição de vários reagentes.
Aplicação e Resumo
O princípio de Le Châtelier está em ação em corpos humanos. O oxigênio é transportado dos pulmões para os músculos e outros tecidos por uma proteína chamada hemoglobina (Hb) que é encontrada no sangue. A molécula de oxigênio se liga a essa proteína em uma reação reversível que pode ser descrita por uma equação de equilíbrio:
Hb + 4 O2  Hb(O2)4
Hb(O2)4
Nos pulmões, a pressão parcial do gás oxigênio é alta (na ordem de 100 torr). O equilíbrio muda para a direita neste ambiente, e as moléculas de oxigênio se ligam a moléculas de hemoglobina até que a proteína esteja saturada de oxigênio. Quando essa hemoglobina saturada atinge as células do tecido muscular, onde a pressão do oxigênio é muito menor, o equilíbrio muda para a esquerda, e o oxigênio é liberado. Se o músculo estiver em repouso, a pressão de oxigênio é de cerca de 30 torr, e aproximadamente 40% do oxigênio é liberado. Quando o músculo está ativo, a pressão de oxigênio varia de 3 a 18 torr, e cerca de 85% do oxigênio é liberado para satisfazer o aumento da demanda metabólica.
Outro exemplo fisiológico de um sistema de equilíbrio envolve a regulação do pH sanguíneo. O dióxido de carbono no sangue reage reversivelmente com a água para produzir ácido carbônico, que se dissocia para produzir íons de hidronium e bicarbonato:
CO2 (aq) + H2O(l)  H2CO3 (aq)
H2CO3 (aq)  H3O+ (aq) + HCO3-(aq)
H3O+ (aq) + HCO3-(aq)
Durante o exercício extenuante, a quantidade de dióxido de carbono produzida pelas células aumenta como resultado da alta atividade metabólica. O aumento da concentração de dióxido de carbono no sangue faz com que a mudança para a direita neste equilíbrio produza mais ácido carbônico. Quando isso acontece, o nível de pH do sangue diminui à medida que a concentração de íons de hidrônio aumenta. Uma das respostas do corpo a esse desequilíbrio no pH sanguíneo é aumentar a taxa de respiração para que mais gás dióxido de carbono seja exalado dos pulmões, deslocando assim o equilíbrio de volta para a esquerda e elevando o pH de volta aos níveis normais.
O princípio de Le Châtelier também deve ser levado em conta em muitos processos industriais. Amônia é um importante produto químico usado em fertilizantes, agentes de limpeza e como um bloco de construção em reações orgânicas sintéticas. A produção industrial de amônia é realizada utilizando-se o processo Haber, que se baseia na reação reversível entre hidrogênio e nitrogênio:
3 H2 (g) + N2 (g)  2 NH3 (g)
2 NH3 (g)
Para otimizar a produção de amônia, a reação é executada em alta pressão, geralmente em torno de 200 atm. Há 4 mols de gás no lado esquerdo da equação e 2 mols de gás no lado direito. O princípio de Le Châtelier determina que um aumento da pressão sobre o sistema desloca o equilíbrio para a direita, porque o volume de 2 mols de gás é menor do que o volume de 4 mols de gás. Como o volume e a pressão são diretamente proporcionais, uma mudança para reduzir o volume também reduz a pressão, e o sistema volta ao equilíbrio. Além disso, o processo envolve liquefazer o gás de amônia em um condensador, por isso é removido da câmara de reação. Essa diminuição da amônia também desloca o equilíbrio para a direita, maximizando a quantidade de amônia produzida.
Pular para...
Vídeos desta coleção:

Now Playing
Princípio de Le Châtelier
General Chemistry
263.9K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
653.2K Visualizações

Soluções e Concentrações
General Chemistry
273.0K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
554.7K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.0K Visualizações

Determinação da Fórmula Empírica
General Chemistry
179.9K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.1K Visualizações

Usando um medidor de pH
General Chemistry
344.2K Visualizações

Introdução à Titulação
General Chemistry
423.3K Visualizações

Lei dos gases ideais
General Chemistry
78.1K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.2K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.4K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
195.7K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.4K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.2K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados