Method Article
Obtention d’une allogreffe de main en composite vascularisé et préparation à l’allotransplantation distale et proximale de l’avant-bras : une approche par étapes
Dans cet article
Résumé
Ici, nous présentons un protocole pour l’obtention et la préparation d’allogreffes de main en composite vascularisé lors d’une transplantation distale ou proximale de l’avant-bras.
Résumé
L’amputation d’un membre supérieur représente un véritable défi médical et chirurgical. Le traitement idéal doit restaurer la fonction, la sensation et l’image corporelle. À l’heure actuelle, ni les reconstructions traditionnelles, ni les prothèses ne répondent à tous ces critères. Cependant, les allogreffes composites vascularisées offrent une option unique pour restaurer la forme et la fonction de manière satisfaisante malgré une immunosuppression nocive.
Idéalement, le tissu du donneur est obtenu en excès pour être réparé sans tension. Le membre supérieur du donneur est obtenu par une incision en forme de bouche de poisson au niveau du milieu du bras. Ensuite, l’artère et la veine brachiales, le nerf médian, ulnaire et radial sont localisés et disséqués. Les muscles biceps, brachioradiaux et triceps sont sectionnés, puis une ostéotomie de l’humérus est effectuée au-dessus du coude. Pour la transplantation distale de l’avant-bras, le membre supérieur du donneur peut également être obtenu sous le coude en se désarticulant à travers l’articulation.
L’artère brachiale est canulée et le greffon est irrigué avec une solution de préservation. La préparation du greffon commence ensuite par deux incisions, antérieure et postérieure, pour soulever deux lambeaux cutanés latéraux. Un lambeau cutané médial expose la veine basilique, le nerf cutané antébrachial médial, les muscles épicondyliens médiaux, le nerf ulnaire, le nerf médian, l’artère brachiale et la veine. Un lambeau cutané latéral, comprenant la veine céphalique, le nerf cutané antébrachial latéral, le nerf radial jusqu’à sa division, le brachioradial et les muscles épicondyliens latéraux, complète la préparation du greffon. Dans le cas d’une transplantation, des guides de coupe sont fixés à la surface postérieure des deux os de l’avant-bras pour effectuer les ostéotomies.
Ce protocole présente une procédure systématisée pour l’obtention et la préparation d’une allogreffe composite d’avant-bras vascularisée afin d’assurer des résultats optimaux et de minimiser les lésions tissulaires lors de l’obtention.
Introduction
Depuis la première transplantation de main réussie par Dubernard en 19981, la communauté médicale a fait beaucoup de recherches et a fait des progrès dans le domaine de l’allotransplantation composite vascularisée (AVC) des membres supérieurs. Le principal avantage est que le VCA offre une option unique pour restaurer la forme et la fonction par rapport aux prothèses ou aux reconstructionstraditionnelles2,3. Le VCA de la main est l’un des meilleurs exemples de VCA, comprenant de nombreux tissus divers : peau, neurovasculaire, os, cartilage et muscle4. À ce jour, il y a eu plus de greffes de membres supérieurs que tout autre type d’allotransplantation composite vascularisée5. Comme il existe quelques publications dans la littérature sur l’obtention et la préparation de la main VCA 6,7,8,9, nous avons simplifié le protocole et rassemblé les principales étapes de cette procédure.
La transplantation du membre supérieur est une procédure reconstructive complexe en plusieurs étapes où les répétitions chirurgicales peuvent réduire le temps d’ischémie et les complications 8,10,11,12. De plus, les greffes du membre supérieur doivent être obtenues avant l’obtention d’organes solides, et l’équipe d’approvisionnement des mains doit être formée et efficace pour s’assurer que les organes solides ne sont pas mis en danger 4,6,11,13. Par conséquent, il est nécessaire de disposer d’un protocole standardisé pour obtenir et préparer de manière fiable une allogreffe composite vascularisée du membre supérieur. Comme l’a dit le Dr Robert Acland, précurseur de la microchirurgie moderne, « la préparation est le seul raccourci dont vous avez besoin en chirurgie ».
Ce protocole détaille tous les processus, du positionnement à la fermeture du membre donneur lors d’une VCA du membre supérieur. Il explique les étapes à suivre pour obtenir le greffon au-dessus du coude ou dans un second temps par le coude. La préparation du membre obtenu est différente selon le niveau de transplantation : avant-bras proximal ou avant-bras distal. Les deux préparations sont décrites dans le présent protocole. Cette procédure détaillée vise à normaliser l’obtention et la préparation d’une allogreffe composite d’avant-bras vascularisée, qui présente un intérêt à la fois pour la recherche et les études translationnelles, ainsi que pour la pratique clinique, compte tenu du nombre croissant de greffes d’avant-bras afin d’assurer des résultats optimaux et de minimiser les lésions tissulaires.
Protocole
Le Laboratoire d’anatomie de la Faculté de médecine de Nice, en France, a généreusement fourni les spécimens et le matériel utilisés pour l’étude. La Commission nationale d’éthique française a approuvé cette étude (numéro d’agrément 83.2024), qui a été menée à la suite de la Déclaration d’Helsinki.
1. Soins préopératoires
- Sur un donneur d’organe décédé sélectionné, positionnez le patient en décubitus dorsal avec le bras enlevé sur une table.
- Appliquez un garrot sur la partie supérieure du bras donneur, aussi proximal que possible.
- Préparez et drapez le membre avec un drap stérile percé enroulé distal au garrot.
- Gonflez le garrot à 100 mmHg au-dessus de la pression artérielle systolique.
2. Approvisionnement du membre supérieur du donneur au-dessus du coude (transsection mi-humérale) (Figure 1)
- Faites une incision circonférentielle de la bouche du poisson avec une lame de scalpel chirurgicale (n° 15) au niveau du milieu du bras.
- Soulevez le lambeau de peau proximale palmaire à l’aide d’une cautérisation à aiguille fine et d’une paire de pinces à tissu Adson, en ligaturant proximal et en divisant les veines céphalique et basilique.
REMARQUE : Librez les structures avec une suture résorbable tressée 0 ou des clips hémostatiques. - Exposez, ligaturez proximal et divisez l’artère brachiale et les veines à quelques centimètres au-dessus du pli du coude.
- Disséquer, avec des ciseaux, sur le bras médial et transecter, avec un scalpel, le nerf médian et le nerf ulnaire profondément jusqu’au septum intermusculaire médial.
- Soulevez le lambeau cutané proximal dorsal à l’aide d’une oreille fine et d’une paire de pinces à tissu Adson, et coupez proximale les veines superficielles avec des clips hémostatiques.
- Identifiez le nerf radial profond du septum intermusculaire latéral. Transectez le nerf radial avec un scalpel proximal à ses branches pour le brachioradial (BR), l’extenseur du carpe radial long (ECRL) et l’extenseur du carpe radial court (ECRB).
- Isolez et transectez les muscles du biceps, du brachial et des triceps avec une diathermie monopolaire.
- Faites une ostéotomie transverse de l’humérus à quelques centimètres au-dessus de l’articulation du coude à l’aide d’une scie oscillante. Lister et diviser le reste du faisceau neurovasculaire pour détacher le membre ( figure 1).
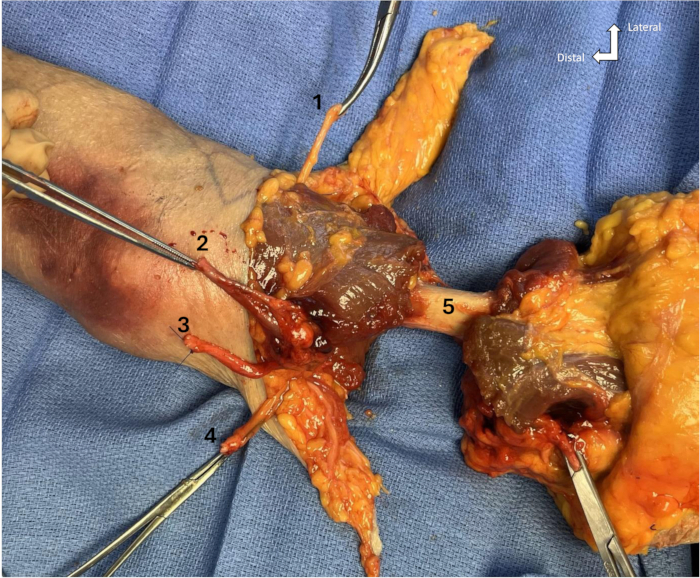
Figure 1 : Milieu du bras avec nerfs, artère, veines et muscles transectés. (1) Nerf radial, (2) Artère et veine brachiale, (3) Nerf médian, (4) Nerf ulnaire, (5) Diaphyse humérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Emballage du greffon
- Transférez le membre sur la table arrière pour la préparation du transport vers le centre receveur.
- Cathétériser l’artère brachiale avec une canule vasculaire avec un robinet d’arrêt et fixer la canule dans la lumière avec une ligature de suture de soie 2-0.
- Rincer le membre à l’aide d’un dispositif d’irrigation universel et le fixer au robinet d’arrêt de l’artère brachiale avec 1 à 3 L de solution de l’Université du Wisconsin (UW) à 4 °C pour préserver le greffon.
REMARQUE : Perfuser jusqu’à ce que l’écoulement veineux soit clair. Notez le système veineux dominant en comparant la vitesse de retour du fluide dans les veines superficielles et profondes. D’autres fluides de conservation, tels que l’histidine-tryptophhankétoglutarate (HTK) perfusé avec 5000 unités d’héparine non fractionnée, peuvent être utilisés.- Débranchez le kit d’irrigation et fermez le robinet d’arrêt.
- Enveloppez le membre dans des serviettes stériles imbibées d’une solution saline, placez-le dans un sac stérile scellé et étiquetez-le. Appliquez un deuxième sac stérile vide, puis mettez-le dans un troisième sac stérile rempli d’eau glacée conformément au protocole standard de transplantation d’organe solide (SOT).
- Placez les sacs dans la glacière à roulettes et étiquetez la glacière.
4. Prise en charge du membre résiduel du donneur
- Retirez le garrot après la récupération de tous les organes solides.
- Effectuez une hémostase soigneuse à l’aide d’une diathermie bipolaire. Fermez l’incision de la bouche du poisson sur le bras à l’aide de sutures sous-cutanées courantes ou interrompues, suivies d’agrafes pour une étanchéité à l’eau.
- Fixez la prothèse esthétique au membre résiduel du donneur et roulez sur le manchon du segment proximal de la prothèse pour restaurer la forme.
5. Obtention d’un membre supérieur du donneur par le coude (transsection du coude)
REMARQUE : Mêmes soins préopératoires, avec le garrot à mi-bras.
- Marquez les épicondyles médial et latéral pour dessiner l’incision de la bouche du poisson sous l’articulation du coude.
- Inciser avec une lame de scalpel chirurgicale (n° 15) et soulever le lambeau de peau palmaire à l’aide d’une cautérisation à aiguille fine et d’une paire de pinces à tissu Adson, ligaturant proximale et divisant les veines céphalique et basilique.
- Inciser l’aponévrose antébrachiale à l’aide d’un scalpel, identifier, puis transecter à l’aide de ciseaux l’artère brachiale et le nerf médian sous le lacertus fibrosis, ulnaire au tendon du biceps brachial.
REMARQUE : Pour la transplantation proximale de l’avant-bras, transectez le nerf médian proximal à l’origine de la branche du rond pronateur. - Transecter le rond pronateur et la masse fléchisseuse de l’avant-bras à travers leur ventre proximal avec une diathermie monopolaire.
REMARQUE : Pour la transplantation proximale de l’avant-bras, les origines des fléchisseurs et des extenseurs sont disséquées librement avec le périoste des épicondyles médiaux et latéraux et ne sont pas transectées. Cela fournit un tissu solide pour la réinsertion dans l’os du receveur. - Identifiez et transectez avec des ciseaux le nerf ulnaire à la sortie du tunnel cubital.
REMARQUE : Pour la transplantation proximale de l’avant-bras, transectez le nerf ulnaire proximal à l’origine de la branche fléchisseur du carpe ulnaire. - Transecter les fléchisseurs du coude avec une diathermie monopolaire près de leur insertion distale pour exposer la capsule articulaire ulnaire du coude et le cubitus proximal.
- Transecter la liasse mobile et la masse extensrice commune dans leur ventre proximal pour identifier le nerf radial et exposer la capsule articulaire radiale du coude. Transect du nerf radial proximal à sa division en branches superficielles et profondes.
REMARQUE : Pour la transplantation proximale de l’avant-bras, transectez le nerf radial proximal à l’origine des branches du brachioradialis, de l’extenseur du carpe radial long et de l’extenseur du carpe radial court. - Inciser la capsule articulaire antérieure du coude à l’aide d’un scalpel. Fléchissez complètement le coude et soulevez le lambeau cutané dorsal à l’aide d’une cautérisation à aiguille fine et d’une paire de pinces à tissu Adson.
- Isolez et transectez le tendon du triceps à l’aide d’un scalpel, puis incisez la capsule articulaire postérieure du coude pour désarticuler le coude et détacher complètement le membre.
REMARQUE : Le même emballage du greffon et la même prise en charge du membre résiduel du donneur sont nécessaires.
6. Préparation du greffon pour la transplantation d’avant-bras proximal (Figure 2 et Figure 3)
REMARQUE : Étiquetez chaque structure avec un morceau rectangulaire de bandage Esmarch marqué avec des marqueurs à encre indélébile et fixé avec des sutures en soie 2-0 ou en titane stérilisé nommées étiquettes.
- Faites une incision palmaire médiane longitudinale avec une lame de scalpel chirurgicale (n° 15) de la proximale à la distale (au niveau du milieu de l’avant-bras) et une incision dorsale longitudinale sur la tige du cubitus jusqu’à 14 cm sous l’olécrâne.
- Soulevez le lambeau cutané médial à l’aide d’une cautérisation à aiguille fine et d’une paire de pinces à tissu Adson et disséquez la peau sur une certaine distance la veine basilique et le nerf cutané antébrachial médial avec des ciseaux.
- Soulevez le lambeau cutané latéral et disséquez la veine céphalique et le nerf cutané antébrachial latéral.
REMARQUE : Les lambeaux médial et latéral sont relevés de cette manière pour s’interdigiter avec les lambeaux cutanés palmaires et dorsaux du membre receveur. - Disséquer avec des ciseaux distalement le nerf ulnaire jusqu’à l’origine de la branche fléchisseuse du carpe ulnaire et le nerf médian jusqu’à l’origine de la branche du rond pronateur.
- Disséquez le nerf radial avec des ciseaux et identifiez les branches motrices BR, ECRL et ECRB. Marquez les branches et transectez-les à leur origine à partir du nerf radial. Étiquetez séparément la branche superficielle et la branche profonde du nerf radial.
REMARQUE : Sur le membre résiduel receveur, les branches nerveuses radiales vers BR, ECRL et ECRB sont transectées près du point d’entrée musculaire afin qu’elles puissent être ultérieurement aplacées sur les branches ECRL, ECRB et BR du donneur.
- Disséquez le nerf radial avec des ciseaux et identifiez les branches motrices BR, ECRL et ECRB. Marquez les branches et transectez-les à leur origine à partir du nerf radial. Étiquetez séparément la branche superficielle et la branche profonde du nerf radial.
- Disséquer distalement l’artère brachiale et ses veines comitantes jusqu’à la division en vaisseaux radiaux et ulnaires (Figure 2).

Figure 2 : Structures neurovasculaires au niveau de l’avant-bras proximal. (1) Nerf cutané antébrachial latéral, (2) Veine céphalique, (3) Nerf cutané antébrachial médial, (4) Veine basilique, (5) Nerf radial avec ses branches pour BR, ECRL, ECRB, branche motrice profonde et branche sensible superficielle dans une anse rouge, (6) Veines brachiales, (7) Artère brachiale, (8) Nerf médian, (9) Nerf ulnaire avec sa branche pour FCU, (10) Biceps brachial. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Élevez avec un scalpel les origines de la masse musculaire fléchisseuse et extensrice des épicondyles médiaux et latéraux dans un plan sous-périosté. Élever le brachioradial de son insertion humérale.
- Disséquez le radius distalement à partir de l’insertion du tendon du biceps avec un scalpel pour permettre la fixation de la plaque.
- Réfléchit le brachial proximal et la masse musculaire de l’avant-bras distalement à partir du cubitus proximal par dissection sous-périostée antérieure et postérieure.
REMARQUE : L’insertion du tendon du biceps est un repère essentiel pour l’orientation et l’ostéotomie. Veillez à préserver la branche profonde du nerf radial et, si nécessaire, à fendre la membrane interosseuse de manière proximale. - Continuer l’élévation, à l’aide d’un scalpel, des muscles de l’avant-bras à partir du radius et du cubitus jusqu’à ce que trois trous des plaques de compression dynamique puissent être logés au-delà des ostéotomies prévues (Figure 3).
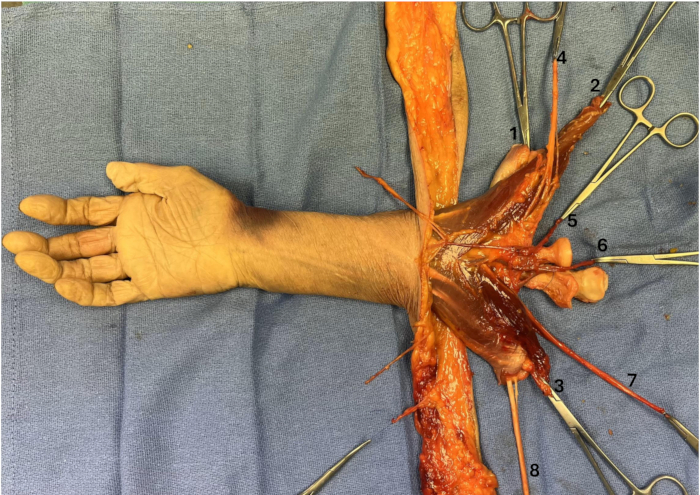
Figure 3 : Masse musculaire de l’avant-bras élevée. (1) Masse extensrice, (2) Brachioradialis, (3) Masse fléchisseuse, (4) Nerf radial, (5) Veines brachiales, (6) Artère brachiale, (7) Nerf médian, (8) Nerf ulnaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Préparation du greffon pour la transplantation distale de l’avant-bras (Figure 4 et Figure 5)
REMARQUE : Étiquetez chaque structure avec un morceau rectangulaire de bandage Esmarch marqué avec des marqueurs à encre indélébile et fixé avec des sutures en soie 2-0 ou en titane stérilisé nommées étiquettes.
- Faites des incisions palmaires et dorsales mi-axiales jusqu’au niveau distal du poignet à l’aide d’une lame de scalpel chirurgicale (n° 15). Relâchez le canal carpien avec l’incision palmaire.
- Soulevez les lambeaux cutanés radiaux et ulnaires avec le fascia antébrachial à l’aide d’une cautérisation à aiguille fine et d’une paire de pinces à tissu Adson. Conservez les perforateurs cutanés de l’avant-bras distal sur les deux rabats.
- Disséquez le lambeau cutané radial, la veine céphalique et le nerf cutané antébrachial latéral avec des ciseaux. Disséquez le lambeau cutané ulnaire, la veine basilique et le nerf cutané antébrachial médial.
- Identifiez et excisez le brachioradial avec une cautérisation à l’aiguille fine et disséquez le nerf sensoriel radial en dessous.
- Élevez le long abducteur du muscle (LPA) et le long du muscle droit extenseur du pied (PEB) en ouvrant le premier compartiment à l’aide d’un scalpel.
REMARQUE : Squelettez tous les tendons avec un scalpel en excisant le muscle pour laisser la partie tendineuse le plus longtemps possible pour la réparation.- Isolez l’ECRL et l’ECRB, et disséquez l’extenseur du pollicis longus (EPL) sans sa gaine.
- Identifiez l’extensor indicis proprius (EIP), l’extensor digitorum communis (EDC) et l’extensor digiti minimi (EDM). Élever l’extenseur du carpe ulnaire (ECU) (Figure 4).
REMARQUE : L’EIP, L’EDC et l’EDM peuvent être suturés ensemble si une réparation individuelle n’est pas possible lors de la transplantation.
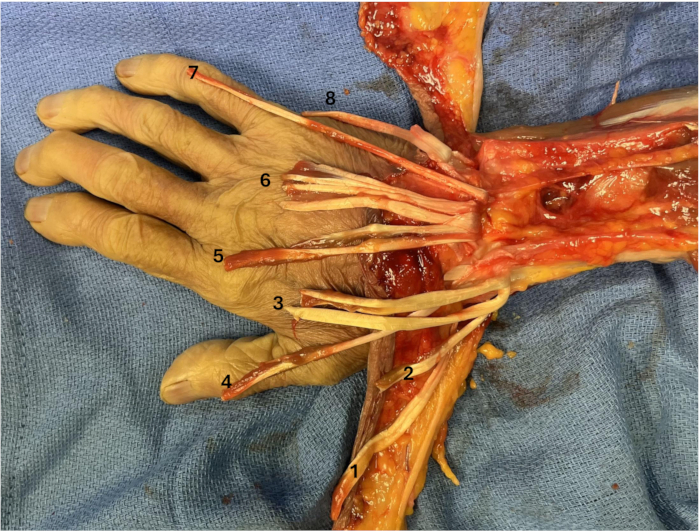
Figure 4 : Tendons extenseurs disséqués : (1) APL, (2) EPB, (3) ECRL et ECRB, (4) EPL, (5) EIP, (6) EDC, (7) EDM, (8) ECU. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Disséquez l’artère radiale et sa veine comitante à l’aide de ciseaux et d’une pince à tissu Adson.
- Isolez le fléchisseur radial du carpe (FCR) et excisez le long du palmaire à l’aide d’un scalpel. Disséquez le nerf médian.
- Identifiez chaque tendon du fléchisseur des doigts superficiels (FDS), le fléchisseur du muscle long (FPL) et les 4 tendons du fléchisseur des doigts profonds (FDP). Élever le fléchisseur du carpe ulnaire (FCU).
REMARQUE : Les FDS peuvent être suturés ensemble, et il en est de même pour les FDP si la réparation individuelle n’est pas possible lors de la transplantation. - Disséquez soigneusement avec des ciseaux l’artère ulnaire et le nerf pour identifier la branche sensorielle dorsale du nerf ulnaire.
- Exciser le pronateur carré (PQ) avec une cautérisation à aiguille fine. Exposez le côté palmaire du radius et le côté ulnaire du cubitus jusqu’à ce que trois trous des plaques d’ostéosynthèse puissent être logés au-delà des ostéotomies prévues (Figure 5).
REMARQUE : Soyez prudent avec l’artère interosseuse antérieure sur la membrane interosseuse à ce niveau.

Figure 5 : Tendons fléchisseurs et faisceaux neurovasculaires disséqués. (1) Branche sensorielle radiale, (2) Veine céphalique, (3) Nerf cutané antébrachial médial, (4) Veine basilique, (5) Artère radiale, (6) Artère interosseuse antérieure, (7) Nerf médian, (8) Nerf ulnaire avec sa branche sensible dorsale, (9) Artère ulnaire, (10) FCR, (11) FCU, (12) FPL, (13) FDS, (14) FDP. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
À la fin de ce protocole, le membre donneur doit être prêt pour la transplantation sur le membre résiduel récepteur. Le radius et le cubitus sont suffisamment exposés pour l’ostéosynthèse avec une plaque de compression verrouillable de 3,5 mm, un radius distal verrouillable palmaire de14, 15, 16 ou 2,7 mm et des plaques cubitus en greffe distale de l’avant-bras. Les artères brachiale ou radiale et ulnaire sont disséquées en fonction du niveau, permettant une anastomose artérielle. Les veines profondes et superficielles sont également isolées, et la première anastomose doit se faire sur le système veineux dominant17. Les tendons donneurs sont disséqués suffisamment longtemps pour être réparés avec la technique de tissage Pulvertaft14 ou une ténorraphie latérale « brune » à armure simple18,19. Dans la transplantation proximale, la masse fléchisseuse, la liasse mobile et la masse extensrice sont fixées aux épicondyles du receveur par des sutures transosseuses20 ou boneanchor16. Les nerfs sont suffisamment disséqués pour permettre une réparation sans tension11. Enfin, les deux lambeaux cutanés s’interdigiteront avec les lambeaux palmaire et dorsal du membre résiduel receveur pour accueillir l’œdème postopératoire, prévenant ainsi la constriction et la contracture cicatricielle au site de fermeture21.
Lors de la dissection de six greffons, nous avons mesuré à l’aide d’un pied à coulisse les dimensions de tous les vaisseaux et nerfs éligibles à l’anastomose. Pour le niveau proximal de l’avant-bras, nous avons trouvé le diamètre moyen suivant (moyenne ± ET) : artère brachiale 5,17 ± 0,85 mm, veine brachiale 3,75 ± 0,95 mm, veine céphalique 2,67 ± 0,79 mm, veine basilique 2,25 ± 0,07 mm, branche nerveuse radiale à brachioradiale 0,84 ± 0,25 mm, branche profonde du nerf radial 2,5 ± 0,54 mm, branche sensible du nerf radial 2,34 ± 0,51 mm, nerf médian 6 ± 0,82 mm, nerf ulnaire 4,75 ± 0,50 mm, nerf cutané antébrachial médial 3 ± 0,82 mm, nerf cutané antébrachial latéral 2,34 ± 0,48 mm.
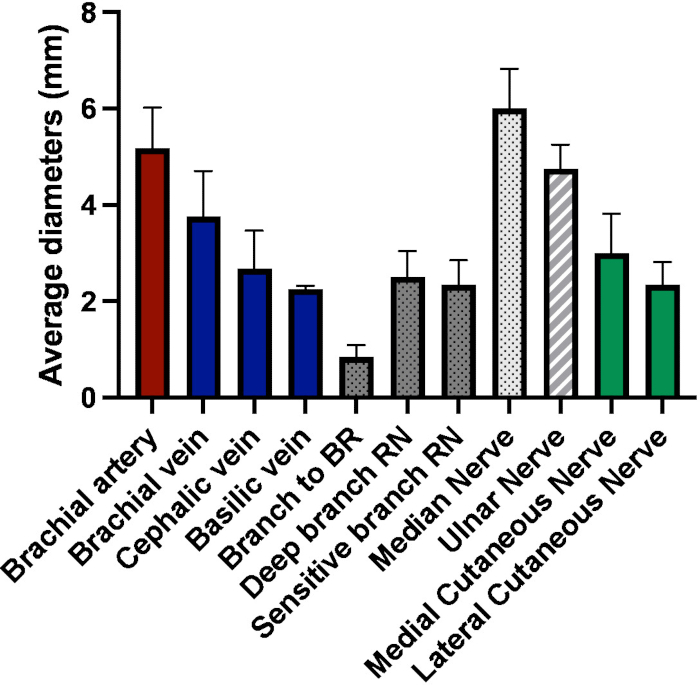
Figure 6 : Diamètres moyens (en mm) des vaisseaux et des nerfs d’intérêt au niveau de l’avant-bras proximal (BR = brachioradialis, RN = nerf radial). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour le niveau distal de l’avant-bras, nous avons trouvé le diamètre moyen suivant (moyenne ± ET) : artère radiale 4 ± 0,41 mm, artère cubitale 4,25 ± 0,50 mm, veine céphalique 1,88 ± 0,25 mm, veine basilique 1,25 ± 0,50 mm, branche sensible du nerf radial 2,08 ± 0,25 mm, nerf médian 4,5 ± 0,58 mm, nerf cubital 4 ± 0,82 mm.
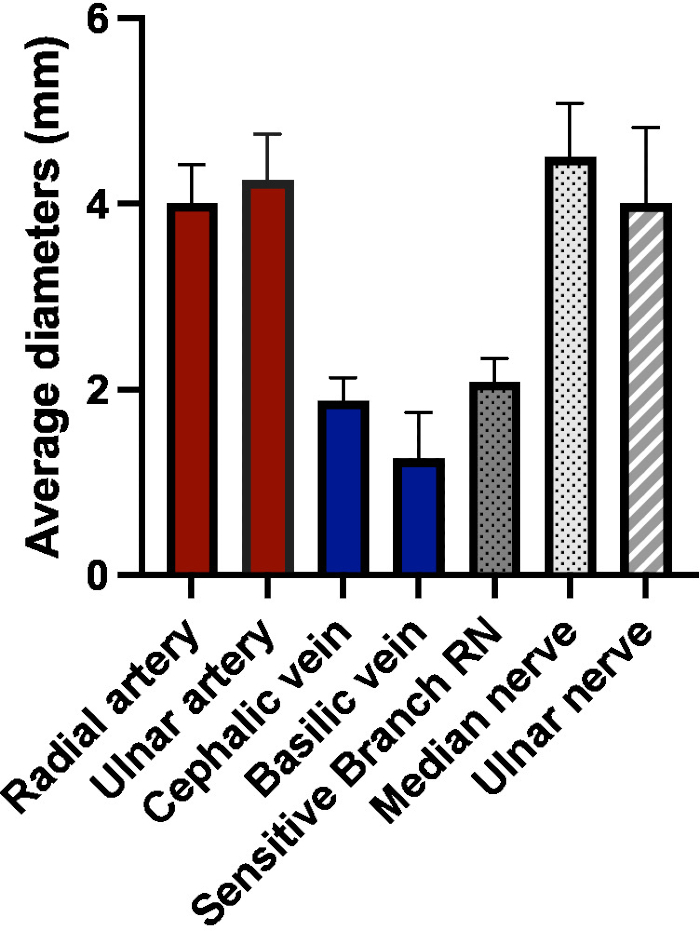
Figure 7 : Diamètres moyens (en mm) des vaisseaux et nerfs d’intérêt au niveau de l’avant-bras distal (RN = nerf radial). Veuillez cliquer ici pour voir une version agrandie de cette figure.
En 2022, une revue systématique des résultats de l’allotransplantation de la main par Wells et al.2 a révélé les résultats suivants : Avec 96 patients recevant 148 greffes de la main, dont au moins 98 au niveau de l’avant-bras ou du poignet, le taux de réussite de la greffe était de 89,2 %. Pour les résultats fonctionnels, les scores DASH ont significativement diminué (P < 0,001) après la greffe de main. Les scores d’invalidité postopératoire pour les greffes distales (médiane, 16 ; IQR, 31,8) étaient significativement inférieurs à ceux des greffes proximales (médiane, 38,5 ; IQR, 36 ; P = 0,035).
Dans la littérature, de multiples cas rapportés de transplantation proximale et distale de l’avant-bras montrent globalement une bonne évolution clinique des patients. Ce protocole décrivait les prélèvements au-dessus du coude (transection mi-humérale) pour la transplantation proximale16 et à travers le coude (désarticulation du coude) pour la transplantation distale22.
Discussion
Ce protocole présente quelques étapes critiques. Tout d’abord, les incisions du lambeau cutané sont marquées. L’objectif est de bien assortir les lambeaux pour assurer une quantité suffisante de tissu pour se refermer sur les anastomoses tendineuses volumineuses sans surplus de peau, ce qui peut entraîner une adaptation cutanée volumineuse. De plus, la perfusion distale de la pointe des rabats doit être assurée. Pour aider à cette planification chirurgicale, la stéréophotogrammétrie tridimensionnelle (3D) et les guides d’incision cutanée imprimés en 3D peuvent être utiles, comme l’ont décrit Hummelink et al.23. Le nerf radial doit être transecté proximal à ses branches pour le BR, l’ECRL et l’ECRB pour la transplantation proximale. Cela permet une anastomose ciblée au niveau de la branche plutôt qu’une anastomose du nerf radial au niveau du tronc proximal, ce qui permet de réduire la perte axonale entre les faisceaux sensoriels et moteurs. De plus, la distance de réinnervation sera diminuéede 21,24.
La réparation du nerf radial dépend du niveau d’amputation initiale. L’anastomose peut être réalisée directement sur la branche radiale sensorielle et la branche radiale interosseuse postérieure motrice14.
Un autre piège est lors de la préparation à une greffe d’avant-bras distale. L’artère interosseuse antérieure doit être soigneusement identifiée lors de l’exposition du radius distal et du cubitus car une anastomose est possible. Cela permet au greffon de s’appuyer sur trois artères principales au lieu de deux1.
Deux méthodes d’approvisionnement sont décrites dans la littérature. La première est l’approche de l’équipe du Massachusetts General Hospital (MGH), où la préparation avec dissection détaillée des structures est réalisée in situ sur le donneur avant un lâchertage de garrot (20 min pour 2 h de dissection), permettant une reperfusion. La deuxième méthode est l’approche « cut and run » de l’Université de Pennsylvanie (Penn). Dans ce cas, l’approvisionnement est très rapide. En 20 min, toute la préparation est faite après le transport à l’hôpital receveur8. Le principal avantage de la méthode MGH est qu’elle réduit le temps d’ischémie pour l’ensemble du cas. Au cours de l’approvisionnement, l’artère brachiale et les veines doivent être disséquées mais pas ligaturées avant la fin de la période de reperfusion18. Le principal problème est l’aspect logistique avec les équipes SOT qui attendent et le risque de compromettre la viabilité des organes solides si le donneur devientinstable11. En comparaison, la méthode Penn permet un approvisionnement rapide et n’empêche pas les équipes supplémentaires pour le prélèvement d’organes. Cependant, le temps d’ischémie commence au gonflage du garrot25.
Les deux niveaux d’approvisionnement décrits dans ce protocole sont possibles pour la transplantation d’avant-bras proximal. Soit au-dessus du coude au niveau moyen de l’humérus 6,14,19,21 ou le coude 26. Cependant, dans le cas d’une désarticulation du coude, certaines étapes de dissection doivent être ajustées : la dissection nerveuse doit être proximale aux branches motrices des nerfs principaux. De plus, la masse fléchisseuse et extensrice doit être respectée et élevée dans un plan sous-périosté plutôt que transectée comme dans une greffe distale d’avant-bras16,26. Cette modification permet la préservation de l’ensemble des unités fonctionnelles musculo-tendineuses essentielles à la transplantation proximale de l’avant-bras.
Concernant la préparation du greffon, il existe de grandes différences en fonction du niveau de transplantation. Dans la transplantation distale, l’inconvénient anatomique, par rapport à la transplantation proximale, est que chaque tendon fléchisseur et extenseur est disséqué et réparé individuellement. Cependant, une amplitude de mouvement active précoce peut être initiée en toute sécurité, et il n’y a pas de retard dû à la réinnervation des fléchisseurs/extenseurs, permettant une bonne fonction tôt après la chirurgie 4,14.
Après des transplantations à des niveaux plus proximaux, le résultat est moins cohérent et apparaît plus tard20,27. La principale différence est la réinnervation à une plus grande distance du muscle intrinsèque. Cette distance provoque une inhibition progressive de la régénération nerveuse et altère la fonction 16,24,26.
Ce protocole présente quelques limites car la recherche a été faite sur des cadavres et non sur un donneur décédé et est basé sur notre expérience à Nice (France). De plus, le niveau d’amputation peut varier sur le membre résiduel receveur, et la préparation de la greffe peut être modifiée selon le protocole décrit ici.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Les auteurs tiennent à remercier les personnes qui ont fait don de leur corps pour faciliter la recherche anatomique.
matériels
| Name | Company | Catalog Number | Comments |
| 11.5” medium premium surgiclip II auto suture vessel clip applier | Covidien | ||
| 2-0 silk suture | N/A | N/A | |
| Adson forceps | MPM | 106-2112A | |
| Bipolar coagulation forceps | Olsen | 20-1320I | |
| Custodiol HTK solution for limb perfusion | Essential Pharmaceuticals Inc. | off-label use | |
| Cysto/Bladder irrigation set | Baxter Healthcare Corp. | 2C4040 | |
| Disposable scalpel #15 | Sklar | ||
| DLP 3 mm vessel cannula blunt tip | Medtronic Inc | https://www.medline.com/product/Medtronic-DLP-Vessel-Cannulae/Cannulas-Tubing/Z05-PF24250?question=vessel%20cannula | |
| Fine needle cautery | Cormedica | ||
| Forceps dilators | WPI | 15910 | |
| IV stopcock | N/A | N/A | |
| Micro scissors | WPI | 504492 | |
| Monopolar diathermy | Medtronic Inc | Valleylab | |
| Oscillating saw | GPC Medical | https://www.gpcmedical.com/1015/BTD1138/battery-operated-oscillating-saw.html | |
| Saline solution 0,9% | GenDepot | S0600-101 | |
| Sterile Esmarch bandage | N/A | N/A | |
| Sterile indelible ink markers | N/A | N/A | |
| Strabismus scissors | Surtex | 102-4109 | |
| Surgical marking pen | Cardinal health | 212PR | |
| Sutures Ethilon 4.0 | Ethicon | 1667G | |
| Syringue 10 mL | Agilent | 9301-6474 | |
| Three sterile procurement plastic bags, and three sterile zip ties | N/A | N/A | |
| Tissue forceps | MPM | 106-0511 | |
| Vessel loop | Deroyal | 30-711 |
Références
- Dubernard, J. M., et al. Human hand allograft: report on first 6 months. Lancet. 353 (9161), 1315-1320 (1999).
- Wells, M. W., Rampazzo, A., Papay, F., Gharb, B. B. Two decades of hand transplantation: a systematic review of outcomes. Ann Plast Surg. 88 (3), 335-344 (2022).
- Kumnig, M., Kobler, C., Zaccardelli, A., Brandacher, G., Talbot, S. G. Advancing vascularized composite allotransplantation: essential factors for upper extremity transplant program development. Front Transplant. 3, 1406626 (2024).
- Schuind, F., Abramowicz, D., Schneeberger, S. Hand transplantation: the stateoftheart. J Hand Surg Eur. 32 (1), 2-17 (2007).
- Hernandez, J. A., et al. OPTN/SRTR 2022 annual data report: vascularized composite allograft. Am J Transplant. 24 (2), S534-S556 (2024).
- Mendenhall, S. D., et al. Technique for rapid hand transplant donor procurement through the elbow. Hand. 16 (3), 391-396 (2021).
- Mendenhall, S. D., Brown, S., BenAmotz, O., Neumeister, M. W., Levin, L. S. Building a hand and upper extremity transplantation program: lessons learned from the first 20 years of vascularized composite allotransplantation. Hand. 15 (2), 224-233 (2020).
- Cetrulo, C. L., Kovach, S. J. Procurement of hand and arm allografts. Tech Hand Up Extrem Surg. 17 (4), 232-238 (2013).
- Dalla Pozza, E., et al. Procurement of extended vascularized skin flaps from the donor enables hand transplantation in severe upper extremity burns: an anatomical study. Plast Reconstr Surg. 142 (2), 425-437 (2018).
- Gittings, D. J., et al. Preparation is the only shortcut you need in surgery: a guide to surgical rehearsals for hand and upper extremity transplantation. Tech Hand Up Extrem Surg. 22 (4), 137-140 (2018).
- Hausien, O., et al. Surgical and logistical aspects of donor limb procurement in hand and upper extremity transplantation. Vasc Compos Allotransplantation. 1 (1-2), 31-41 (2014).
- Griffin, J. M., et al. Using team science in vascularized composite allotransplantation to improve team and patient outcomes. Front Psychol. 13, 935507 (2022).
- Margreiter, R., et al. A doublehand transplant can be worth the effort. Transplantation. 74 (1), 85-90 (2002).
- Hartzell, T. L., et al. Surgical and technical aspects of hand transplantation: is it just another replant. Hand Clin. 27 (4), 521-530 (2011).
- Cavadas, P. C., Ibáñez, J., Thione, A., Alfaro, L. Bilateral transhumeral arm transplantation: result at 2 years. Am J Transplant. 11 (5), 1085-1090 (2011).
- Haddock, N. T., Chang, B., Bozentka, D. J., Steinberg, D. R., Levin, L. S. Technical implications in proximal forearm transplantation. Tech Hand Up Extrem Surg. 17 (4), 228-231 (2013).
- Sharma, M., et al. First two bilateral hand transplantations in India (part 2): technical details. Indian J Plast Surg. 50 (2), 153-160 (2017).
- Tawa, P., Gurunian, R., Rampazzo, A., Papay, F., Bassiri Gharb, B., et al. Upper extremity transplantation: the Massachusetts General Hospital experience. Reconstructive Transplantation. , 231-238 (2023).
- Brown, S. H. M., et al. Mechanical strength of the sidetoside versus Pulvertaft weave tendon repair. J Hand Surg. 35 (4), 540-545 (2010).
- Schneeberger, S., et al. First forearm transplantation: outcome at 3 years. Am J Transplant. 7 (7), 1753-1762 (2007).
- Sharma, M., et al. Indian subcontinent's first proximal forearm level double upper extremity transplantation. Indian J Plast Surg. 52 (3), 277-284 (2019).
- Cavadas, P. C., Landin, L., Ibañez, J. Bilateral hand transplantation: result at 20 months. J Hand Surg Eur. 34 (4), 434-443 (2009).
- Hummelink, S., Kruit, A. S., Hovius, S. E. R., Ulrich, D. J. O. Designing and utilizing 3Dprinted skin incision guides during the first Dutch bilateral handarm transplantation. J Plast Reconstr Aesthet Surg. 74 (11), 2965-2968 (2021).
- Wood, M. D., Kemp, S. W. P., Weber, C., Borschel, G. H., Gordon, T. Outcome measures of peripheral nerve regeneration. Ann Anat. 193 (4), 321-333 (2011).
- Serra López, V. M., et al. . Hand Allotransplantation: The Penn Experience. In Reconstructive Transplantation. , (2023).
- McClelland, B., et al. Proximal forearm transplantation for below elbow amputations: rationale and surgical technique. Vasc Compos Allotransplantation. 2 (1), 26-28 (2015).
- Jablecki, J., Kaczmarzyk, L., Patrzalek, D., Domanasiewicz, A., Chełmoński, A. A detailed comparison of the functional outcome after midforearm replantations versus midforearm transplantation. Transplant Proc. 41 (2), 513-516 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon