Method Article
Obtención y preparación de aloinjerto de mano compuesto vascularizado para el alotrasplante de antebrazo distal y proximal: un enfoque escalonado
En este artículo
Resumen
En este trabajo se presenta un protocolo para la obtención y preparación de aloinjertos de mano compuestos vascularizados durante el trasplante distal o proximal de antebrazo.
Resumen
Las amputaciones de miembros superiores representan un verdadero desafío médico y quirúrgico. El tratamiento ideal debe restaurar la función, la sensibilidad y la imagen corporal. En la actualidad, ni las reconstrucciones tradicionales ni las prótesis cumplen con todos estos criterios. Sin embargo, los aloinjertos compuestos vascularizados ofrecen una opción única para restaurar la forma y la función satisfactoriamente a pesar de la inmunosupresión dañina.
Lo ideal es obtener tejido donante en exceso para repararlo sin tensión. La extremidad superior del donante se obtiene a través de una incisión en la boca de pez a nivel de la mitad del brazo. A continuación, se localizan y diseccionan la arteria y la vena braquial, el nervio mediano, el cubital y el radial. Se seccionan los músculos bíceps, braquiorradial y tríceps, y luego se realiza una osteotomía del húmero por encima del codo. Para el trasplante distal de antebrazo, la extremidad superior donante también se puede obtener por debajo del codo mediante la desarticulación a través de la articulación.
Se canulada la arteria braquial y se irriga el injerto con una solución conservante. A continuación, la preparación del injerto comienza con dos incisiones, anterior y posterior, para elevar dos colgajos laterales de piel. Un colgajo cutáneo medial expone la vena basilical, el nervio cutáneo antebraquial medial, los músculos epicondíleos mediales, el nervio cubital, el nervio mediano, la arteria braquial y la vena. Un colgajo lateral de piel, que incluye la vena cefálica, el nervio cutáneo antebraquial lateral, el nervio radial hasta su división, el braquiorradial y los músculos epicondíleos laterales, completa la preparación del injerto. En el caso del trasplante, se fijan guías de corte a la superficie posterior de los dos huesos del antebrazo para realizar las osteotomías.
Este protocolo presenta un procedimiento sistematizado para la obtención y preparación de un aloinjerto compuesto de antebrazo vascularizado para garantizar resultados óptimos y minimizar el daño tisular durante la obtención.
Introducción
Desde el primer trasplante de mano exitoso realizado por Dubernard en 19981, la comunidad médica ha realizado muchas investigaciones y ha avanzado en el alotrasplante compuesto vascularizado (VCA) de las extremidades superiores. La principal ventaja es que la VCA proporciona una opción única para restaurar la forma y la función en comparación con las prótesis o reconstrucciones tradicionales 2,3. El VCA de la mano es uno de los mejores ejemplos de VCA, ya que comprende muchos tejidos diversos: piel, neurovascular, hueso, cartílago y músculo4. Hasta la fecha, se han realizado más trasplantes de extremidades superiores que cualquier otro tipo de alotrasplante compuesto vascularizado5. Dado que existen algunas publicaciones en la literatura sobre la adquisición y la preparación de VCA manual 6,7,8,9, simplificamos el protocolo y reunimos los pasos principales de este procedimiento.
El trasplante de extremidad superior es un procedimiento reconstructivo complejo de múltiples pasos en el que los ensayos quirúrgicos pueden disminuir el tiempo de isquemia y las complicaciones 8,10,11,12. Además, los trasplantes de extremidades superiores deben procurarse antes de la obtención de órganos sólidos, y el equipo de obtención de la mano debe estar capacitado y ser eficiente para garantizar que los órganos sólidos no corran peligro 4,6,11,13. Por lo tanto, existe la necesidad de un protocolo estandarizado para obtener y preparar de manera confiable un alotrasplante compuesto vascularizado de extremidades superiores. Como dijo el Dr. Robert Acland, precursor de la microcirugía moderna: "La preparación es el único atajo que se necesita en la cirugía".
Este protocolo detalla todos los procesos, desde el posicionamiento hasta el cierre de la extremidad donante durante una VCA de extremidad superior. Explica los pasos para obtener el injerto por encima del codo o, en un segundo método, a través del codo. La preparación de la extremidad procurada es diferente según el nivel de trasplante: antebrazo proximal o antebrazo distal. Ambas preparaciones se describen en este protocolo. Este procedimiento detallado tiene como objetivo estandarizar la obtención y preparación de un aloinjerto compuesto de antebrazo vascularizado, que es de interés tanto para la investigación y los estudios traslacionales, como para la práctica clínica, dado el creciente número de trasplantes de antebrazo para garantizar resultados óptimos y minimizar el daño tisular.
Protocolo
El Laboratorio de Anatomía de la Facultad de Medicina de Niza, Francia, proporcionó generosamente los especímenes y el material utilizado para el estudio. El Comité Nacional de Ética francés aprobó este estudio (número de aprobación 83.2024), que se llevó a cabo a raíz de la Declaración de Helsinki.
1. Cuidados preoperatorios
- En un donante de órganos fallecido seleccionado, coloque al paciente en posición supina con el brazo abducido sobre una mesa de mano.
- Aplique un torniquete sobre la parte superior del brazo donante, lo más proximal posible.
- Prepare y cubra la extremidad con un paño estéril perforado enrollado distal al torniquete.
- Infle el torniquete a 100 mmHg por encima de la presión arterial sistólica.
2. Obtención del miembro superior del donante por encima del codo (transección del húmero medio) (Figura 1)
- Realice una incisión circunferencial en la boca del pez con una hoja de bisturí quirúrgico (n.º 15) a la altura de la mitad del brazo.
- Elevar el colgajo de piel proximal volar con cauterización con aguja fina y un par de pinzas de tejido Adson, ligando proximalmente y dividiendo las venas cefálica y basilical.
NOTA: Ligue las estructuras con una sutura reabsorbible trenzada 0 o clips hemostáticos. - Exponer, ligar proximalmente y dividir la arteria braquial y las venas unos centímetros por encima del pliegue del codo.
- Diseccionar, con tijeras, en el brazo medial y transector, con un bisturí, el nervio mediano y el nervio cubital hasta el tabique intermuscular medial.
- Eleve el colgajo de piel proximal dorsal con una cauterización con aguja fina y un par de pinzas de tejido Adson, y corte proximalmente las venas superficiales con pinzas hemostáticas.
- Identificar el nervio radial profundo del tabique intermuscular lateral. Transsectar el nervio radial con un bisturí proximal a sus ramas para el braquiorradial (BR), el extensor radial largo del carpo (ECRL) y el extensor radial corto del carpo (ECRB).
- Aísle y transecta los vientres de los músculos bíceps, braquiales y tríceps con una diatermia monopolar.
- Realizar una osteotomía de húmero transversal a unos centímetros por encima de la articulación del codo con una sierra oscilante. Ligar y dividir el resto del haz neurovascular para separar la extremidad ( Figura 1).
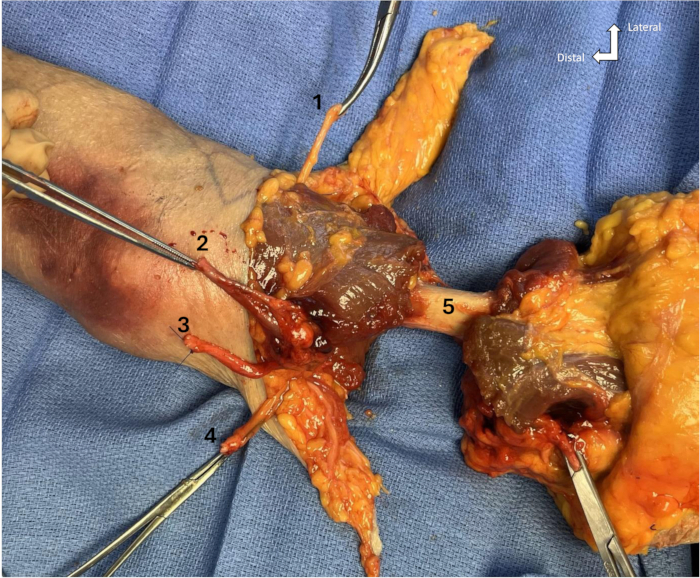
Figura 1: Brazo medio con nervios, arterias, venas y músculos seccionados. (1) Nervio radial, (2) Arteria y vena braquial, (3) Nervio mediano, (4) Nervio cubital, (5) Diáfisis del húmero. Haga clic aquí para ver una versión más grande de esta figura.
3. Embalaje del injerto
- Transfiera la extremidad a la mesa trasera para prepararla para el transporte al centro receptor.
- Cateterizar la arteria braquial con una cánula vascular con llave de paso y asegurar la cánula en el lumen con ligadura de sutura de seda 2-0.
- Enjuague la extremidad a través de un equipo de irrigación universal y fíjela a la llave de paso en la arteria braquial con 1-3 L de solución de la Universidad de Wisconsin (UW) a 4 °C para preservar el injerto.
NOTA: Perfundir hasta que la salida venosa sea clara. Obsérvese el sistema venoso dominante comparando la velocidad de retorno del líquido en las venas superficiales y profundas. Se pueden utilizar otros líquidos de conservación, como la histidina-triptófanotoglutarato (HTK) infundido con 5000 unidades de heparina no fraccionada.- Desconecte el equipo de riego y cierre la llave de paso.
- Envuelva la extremidad en toallas estériles humedecidas con solución salina, colóquela en una bolsa estéril sellada y etiquétela. Aplique una segunda bolsa estéril vacía, luego colóquela en una tercera bolsa estéril llena de agua helada según el protocolo estándar de trasplante de órganos sólidos (SOT).
- Coloque las bolsas en la hielera con ruedas y etiquétela con la hielera.
4. Manejo del muñón del donante
- Retire el torniquete después de la recuperación de todos los órganos sólidos.
- Completar una hemostasia cuidadosa mediante diatermia bipolar. Cierre la incisión de la boca del pez en el brazo con suturas subdérmicas continuas o interrumpidas seguidas de grapas para un sellado hermético.
- Fije la prótesis cosmética al muñón del donante y enrolle el manguito del segmento proximal de la prótesis para restaurar la forma.
5. Obtención del miembro superior del donante a través del codo (transección del codo)
NOTA: Mismo cuidado preoperatorio, con el torniquete a la mitad del brazo.
- Marque los epicóndilos medial y lateral para dibujar la incisión de la boca del pez por debajo de la articulación del codo.
- Incidir con una hoja de bisturí quirúrgico (n.º 15) y elevar el colgajo de piel volar con cauterización con aguja fina y un par de pinzas de tejido Adson, ligando proximalmente y dividiendo las venas cefálica y basilical.
- Incidir la fascia antebraquial con un bisturí, identificar, luego seccionar con tijeras la arteria braquial y el nervio mediano debajo de la fibrosis lacerante, cubital hasta el tendón del bíceps braquial.
NOTA: Para el trasplante proximal del antebrazo, se extirpe el nervio mediano proximal al origen de la rama del pronador redondo. - Seccionar el pronador redondo y la masa flexora del antebrazo a través de sus vientres proximales con diatermia monopolar.
NOTA: Para el trasplante proximal de antebrazo, los orígenes de los flexores y extensores se disecan libres junto con el periostio de los epicóndilos medial y lateral y no se seccionan. Esto proporciona tejido fuerte para la reinserción en el hueso receptor. - Identificar y seccionar con tijeras el nervio cubital por donde sale del túnel cubital.
NOTA: Para el trasplante proximal de antebrazo, se extirpa el nervio cubital proximal al origen de la rama flexor-cubital del carpo. - Seccionar los flexores del codo con diatermia monopolar cerca de su inserción distal para exponer la cápsula de la articulación cubital del codo y el cúbito proximal.
- Seccionar el fauca móvil y la masa extensora común en sus vientres proximales para identificar el nervio radial y exponer la cápsula radial de la articulación del codo. Transecto el nervio radial proximal a su división en ramas superficiales y profundas.
NOTA: Para el trasplante proximal del antebrazo, se extirpa el nervio radial proximal al origen de las ramas braquiorradial, extensor radial largo del carpo y extensor radial corto del carpo. - Incidir la cápsula de la articulación anterior del codo con un bisturí. Flexiona completamente el codo y eleva el colgajo de piel dorsal con una aguja fina, cauterio y un par de pinzas de tejido Adson.
- Aísle y seccione el tendón del tríceps con un bisturí, luego haga una incisión en la cápsula de la articulación posterior del codo para desarticular el codo y separar la extremidad por completo.
NOTA: Se necesita el mismo embalaje del injerto y el mismo manejo del muñón del donante.
6. Preparación del injerto para el trasplante proximal de antebrazo (Figura 2 y Figura 3)
NOTA: Etiquete cada estructura con una pieza rectangular de vendaje Esmarch marcada con marcadores de tinta indeleble y asegurada con suturas de seda 2-0 o etiquetas con nombre de titanio esterilizadas.
- Realizar una incisión circular longitudinal mediana con una hoja de bisturí quirúrgico (n.º 15) de proximal a distal (hasta el nivel medio del antebrazo) y una incisión dorsal longitudinal en la diáfisis del cúbito hasta 14 cm por debajo del olécranon.
- Levante el colgajo de piel medial con una aguja fina, cauterización y un par de pinzas de tejido Adson y diseccione la piel a cierta distancia la vena basilical y el nervio cutáneo antebraquial medial con unas tijeras.
- Elevar el colgajo cutáneo lateral y diseccionar la vena cefálica y el nervio cutáneo antebraquial lateral.
NOTA: Los colgajos medial y lateral se elevan así para interdigitarse con los colgajos de piel volar y dorsal de la extremidad receptora. - Diseccionar con tijeras distalmente el nervio cubital hasta el origen de la rama flexora cubital del carpo y el nervio mediano hasta el origen de la rama pronadora teres.
- Diseccionar el nervio radial con tijeras e identificar las ramas motoras BR, ECRL y ECRB. Marca las ramas y transcórtalas en sus orígenes desde el nervio radial. Etiquete por separado la rama superficial y la rama profunda del nervio radial.
NOTA: En el muñón receptor, las ramas del nervio radial a BR, ECRL y ECRB se seccionan cerca del punto de entrada del músculo para que luego puedan incorporarse a las ramas ECRL, ECRB y BR del donante.
- Diseccionar el nervio radial con tijeras e identificar las ramas motoras BR, ECRL y ECRB. Marca las ramas y transcórtalas en sus orígenes desde el nervio radial. Etiquete por separado la rama superficial y la rama profunda del nervio radial.
- Diseccionar distalmente la arteria braquial y sus vena comitantes hasta la división en vasos radiales y cubitales (Figura 2).

Figura 2: Estructuras neurovasculares en el antebrazo proximal. (1) Nervio cutáneo antebraquial lateral, (2) Vena cefálica, (3) Nervio cutáneo antebraquial medial, (4) Vena basilical, (5) Nervio radial con sus ramas para BR, ECRL, ECRB, rama motora profunda y rama sensible superficial en un bucle rojo, (6) Venas braquiales, (7) Arteria braquial, (8) Nervio mediano, (9) Nervio cubital con su rama para FCU, (10) Bíceps braquial. Haga clic aquí para ver una versión más grande de esta figura.
- Elevar con un bisturí los orígenes de la masa muscular flexora y extensora de los epicóndilos medial y lateral en un plano subperióstico. Elevar el braquiorradial desde su inserción humeral.
- Diseccionar el radio distalmente de la inserción del tendón del bíceps con un bisturí para permitir la fijación de la placa.
- Refleja el braquial proximalmente y la masa muscular del antebrazo distalmente desde el cúbito proximal por disección subperióstica anterior y posterior.
NOTA: La inserción del tendón del bíceps es un punto de referencia esencial para la orientación y la osteotomía. Tenga cuidado de preservar la rama profunda del nervio radial y, si es necesario, divida proximalmente la membrana interósea. - Continúe la elevación, con bisturí, de los músculos del antebrazo desde el radio y el cúbito hasta que se puedan acomodar tres orificios de las placas de compresión dinámica más allá de las osteotomías planificadas (Figura 3).
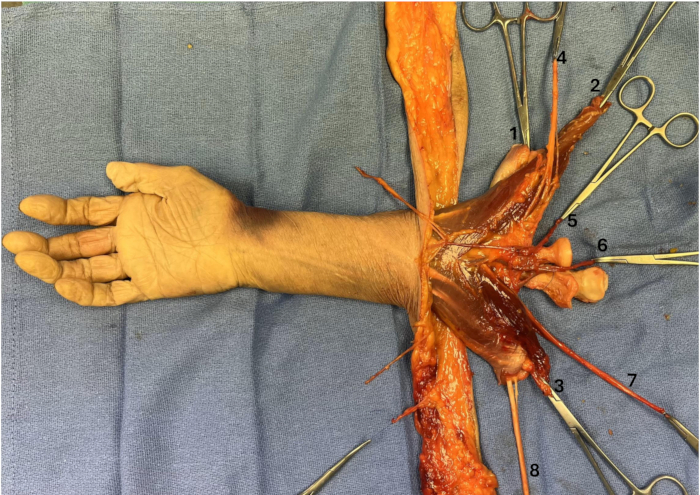
Figura 3: Masa muscular del antebrazo elevada. (1) Masa extensora, (2) Braquiorradial, (3) Masa flexora, (4) Nervio radial, (5) Venas braquiales, (6) Arteria braquial, (7) Nervio mediano, (8) Nervio cubital. Haga clic aquí para ver una versión más grande de esta figura.
7. Preparación del injerto para el trasplante distal de antebrazo (Figura 4 y Figura 5)
NOTA: Etiquete cada estructura con una pieza rectangular de vendaje Esmarch marcada con marcadores de tinta indeleble y asegurada con suturas de seda 2-0 o etiquetas con nombre de titanio esterilizadas.
- Realizar incisiones axiales medias volar y dorsales hasta el nivel de la muñeca distalmente utilizando una hoja de bisturí quirúrgico (n.º 15). Libera el túnel carpiano con la incisión volar.
- Eleve los colgajos de piel radial y cubital con la fascia antebraquial utilizando cauterio con aguja fina y un par de pinzas de tejido Adson. Preservar las perforantes cutáneas del antebrazo distal en ambos colgajos.
- Diseccionar el colgajo radial de piel, la vena cefálica y el nervio cutáneo antebraquial lateral con unas tijeras. Diseccionar el colgajo de piel cubital, la vena basilical y el nervio cutáneo antebraquial medial.
- Identifique y extirpe el braquiorradial con cauterización con aguja fina y diseccione el nervio sensorial radial que se encuentra debajo.
- Eleva el abductor largo del pulgar (LPA) y el extensor corto del pulgar (EPB) abriendo el primer compartimento con un bisturí.
NOTA: Esqueletizar todos los tendones con un bisturí extirpando el músculo para dejar la parte tendinosa el mayor tiempo posible para su reparación.- Aislar ECRL y ECRB, y diseccionar el extensor largo del pulgar (EPL) libre de su vaina.
- Identifique el extensor indicis proprius (EIP), el extensor digitorum communis (EDC) y el extensor de dedos mínimos (EDM). Elevar el extensor cubital del carpo (ECU) (Figura 4).
NOTA: La EIP, la EDC y la EDM se pueden suturar juntas si no es posible la reparación individual durante el trasplante.
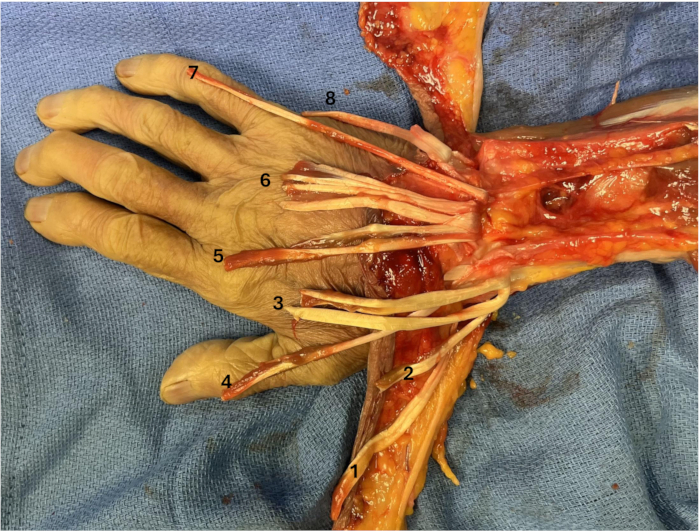
Figura 4: Tendones extensores disecados. (1) APL, (2) EPB, (3) ECRL y ECRB, (4) EPL, (5) EIP, (6) EDC, (7) EDM, (8) ECU. Haga clic aquí para ver una versión más grande de esta figura.
- Diseccionar la arteria radial y sus venas comitantes con tijeras y pinzas de tejido Adson.
- Aislar el flexor radial del carpo (FCR) y extirpar el palmar largo con un bisturí. Disecciona el nervio mediano.
- Identificar cada tendón del flexor superficial de los dedos (FDS), el flexor largo del pulgar (FPL) y los 4 tendones del flexor profundo de los dedos (FDP). Eleva el flexor cubital del carpo (FCU).
NOTA: La FDS se puede suturar junta, y lo mismo ocurre con la FDP si la reparación individual no es posible durante el trasplante. - Diseccionar cuidadosamente con tijeras la arteria cubital y el nervio para identificar la rama sensorial dorsal del nervio cubital.
- Extirpar el pronador cuadrado (PQ) con cauterización con aguja fina. Exponga el lado volar del radio y el lado cubital del cúbito hasta que se puedan acomodar tres orificios de las placas de osteosíntesis más allá de las osteotomías planificadas (Figura 5).
NOTA: Tenga cuidado con la arteria interósea anterior en la membrana interósea a este nivel.

Figura 5: Tendones flexores y haces neurovasculares disecados. (1) Rama sensorial radial, (2) Vena cefálica, (3) Nervio cutáneo antebraquial medial, (4) Vena basilical, (5) Arteria radial, (6) Arteria interósea anterior, (7) Nervio mediano, (8) Nervio cubital con su rama dorsal sensible, (9) Arteria cubital, (10) FCR, (11) FCU, (12) FPL, (13) FDS, (14) FDP. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Al final de este protocolo, la extremidad donante debe estar lista para el trasplante en el muñón receptor. El radio y el cúbito están suficientemente expuestos para la osteosíntesis, con una placa de compresión de bloqueo de 3,5 mm, 14,15,16 o placas de radio distal de bloqueo volar de 2,7 mm y placas de cúbito en el trasplante distal de antebrazo. Las arterias braquial o radial y cubital se disecan según el nivel, permitiendo la anastomosis arterial. Las venas profundas y superficiales también están aisladas, y la primera anastomosis debe ser en el sistema venoso dominante17. Los tendones donantes se diseccionan el tiempo suficiente para ser reparados con la técnica de tejido Pulvertaft14 o tenorrafia de lado a lado "marrón" de tejido simple18,19. En el trasplante proximal, la masa flexora, el faso móvil y la masa extensora se fijan a los epicóndilos del receptor mediante suturas transóseas20 o anclaje óseo16. Los nervios se diseccionan lo suficiente como para permitir una reparación sin tensión11. Finalmente, los dos colgajos cutáneos se interdigitarán con el colgajo volar y dorsal del muñón receptor para acomodar el edema postoperatorio, evitando la constricción y la contractura de la cicatriz en el sitio de cierre21.
Durante la disección de seis injertos, medimos con un calibrador las dimensiones de todos los vasos y nervios susceptibles de anastomosis. Para el nivel proximal del antebrazo, encontramos el diámetro medio de la siguiente manera (media ± DE): arteria braquial 5,17 ± 0,85 mm, vena braquial 3,75 ± 0,95 mm, vena cefálica 2,67 ± 0,79 mm, vena basilical 2,25 ± 0,07 mm, rama del nervio radial al braquiorradial 0,84 ± 0,25 mm, rama profunda del nervio radial 2,5 ± 0,54 mm, la rama sensible del nervio radial 2,34 ± 0,51 mm, nervio mediano 6 ± 0,82 mm, nervio cubital 4,75 ± 0,50 mm, nervio cutáneo antebraquial medial 3 ± 0,82 mm, nervio cutáneo antebraquial lateral 2,34 ± 0,48 mm.
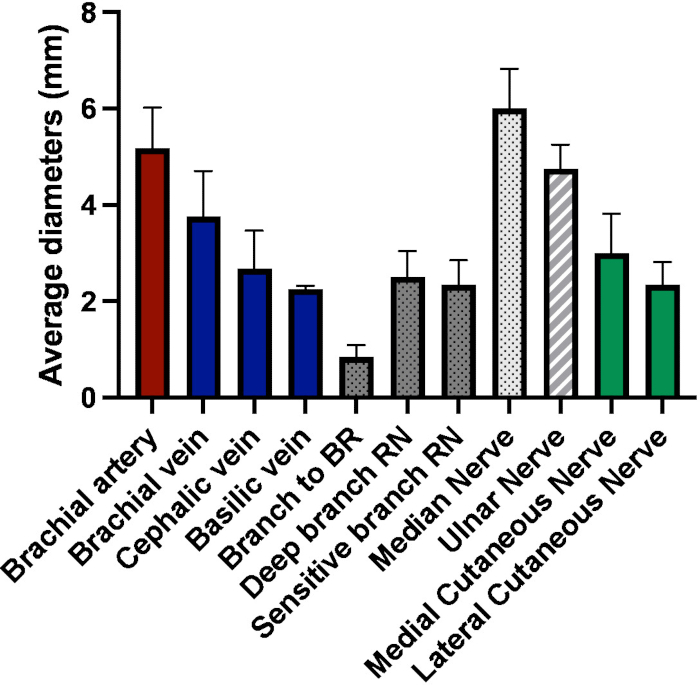
Figura 6: Diámetros medios (en mm) de los vasos y nervios de interés a nivel del antebrazo proximal (BR = braquiorradial, RN = nervio radial).
Para el nivel distal del antebrazo, encontramos el diámetro medio de la siguiente manera (media ± DE): arteria radial 4 ± 0,41 mm, arteria cubital 4,25 ± 0,50 mm, vena cefálica 1,88 ± 0,25 mm, vena basílica 1,25 ± 0,50 mm, rama sensible del nervio radial 2,08 ± 0,25 mm, nervio mediano 4,5 ± 0,58 mm, nervio cubital 4 ± 0,82 mm.
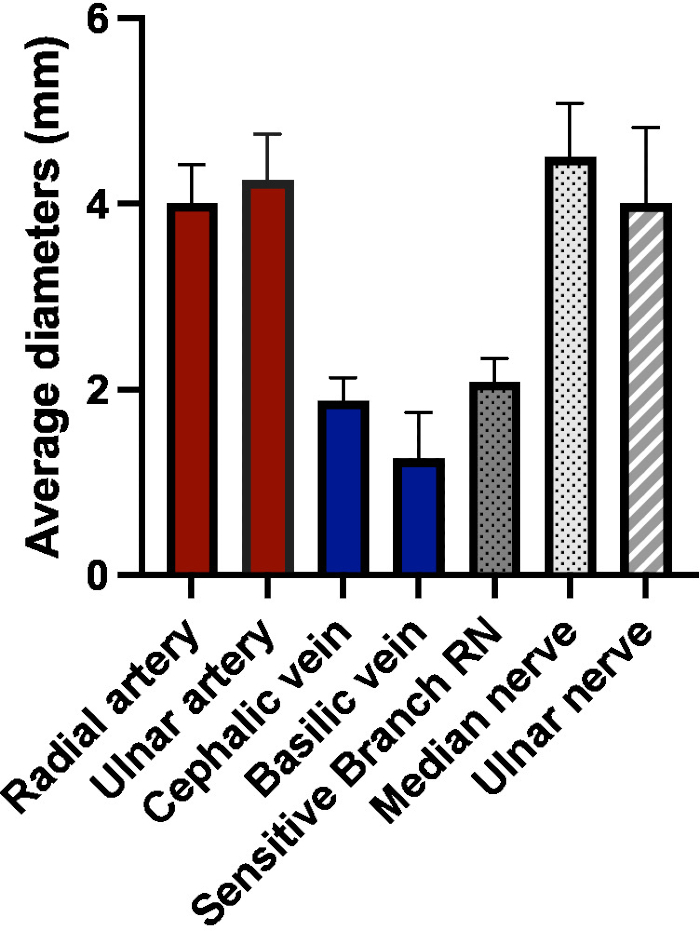
Figura 7: Diámetros medios (en mm) de los vasos y nervios de interés a nivel distal del antebrazo (RN = nervio radial). Haga clic aquí para ver una versión más grande de esta figura.
En 2022, una revisión sistemática de los resultados del alotrasplante de mano realizada por Wells et al.2 encontró los siguientes resultados: Con 96 pacientes que recibieron 148 trasplantes de mano, con al menos 98 a nivel de antebrazo o muñeca, la tasa de éxito del trasplante fue del 89,2%. Para los resultados funcionales, las puntuaciones DASH disminuyeron significativamente (P < 0,001) después del trasplante de mano. Las puntuaciones de discapacidad postoperatoria para los trasplantes distales (mediana, 16; RIC, 31,8) fueron significativamente más bajos que los de los trasplantes proximales (mediana, 38,5; IQR, 36; P = 0,035).
En la literatura, los múltiples casos reportados de trasplante proximal y distal de antebrazo muestran una buena evolución clínica general de los pacientes. En este protocolo se describen las procuraciones por encima del codo (transección humeral media) para el trasplante proximal16 y a través del codo (desarticulación del codo) para el trasplante distal22.
Discusión
Este protocolo presenta algunos pasos críticos. En primer lugar, se marcan las incisiones del colgajo de piel. El objetivo es hacer coincidir correctamente los colgajos para asegurar que haya suficiente tejido para cerrar las anastomosis tendinosas voluminosas sin exceso de piel, lo que puede conducir a la adaptación de la piel voluminosa. Además, debe garantizarse la perfusión distal de la punta de los colgajos. Para ayudar en esta planificación quirúrgica, la estereofotogrametría tridimensional (3D) y las guías de incisión cutánea impresas en 3D pueden ser útiles, como describieron Hummelink et al.23. El nervio radial debe seccionarse proximalmente a sus ramas para BR, ECRL y ECRB para el trasplante proximal. Esto permite una anastomosis dirigida a nivel de rama en lugar de una anastomosis del nervio radial a nivel del tronco proximal, lo que permite una menor pérdida axonal entre los fascículos sensitivos y motores. Además, se disminuirá la distancia para la reinervación21,24.
La reparación del nervio radial depende del nivel de amputación inicial. La anastomosis se puede realizar directamente sobre la rama radial sensitiva y la rama radial interósea posterior motora14.
Otro escollo es durante la preparación para un trasplante de antebrazo distal. La arteria interósea anterior debe identificarse cuidadosamente durante la exposición del radio distal y el cúbito porque es factible una anastomosa. Esto permite que el injerto dependa de tres arterias principales en lugar de dos1.
En la bibliografía se describen dos métodos de adquisición. El primero es el abordaje del equipo del Hospital General de Massachusetts (MGH), donde la preparación con disección detallada de las estructuras se realiza in situ en el donante antes de la liberación de un torniquete (20 min para 2 h de disección), permitiendo la reperfusión. El segundo método es el enfoque de "cortar y correr" de la Universidad de Pensilvania (Pensilvania). En este caso, la adquisición es muy rápida. En 20 min, toda la preparación se realiza después del transporte al hospital receptor8. La principal ventaja del método MGH es que reduce el tiempo de isquemia para todo el caso. Durante la obtención, la arteria braquial y las venas necesitan ser diseccionadas, pero no ligadas hasta el final del período de reperfusión18. El principal problema es el aspecto logístico con los equipos SOT que esperan y el riesgo de comprometer la viabilidad de los órganos sólidos si el donante se vuelve inestable11. En comparación, el método Penn permite una obtención rápida y no impide la creación de equipos adicionales para la recuperación de órganos. Sin embargo, el tiempo de isquemia comienza con el inflado del torniquete25.
Los dos niveles de procuración descritos en este protocolo son posibles para el trasplante proximal de antebrazo. Ya sea por encima del codo a nivel del húmeromedio 6,14,19,21 o del codo26. Sin embargo, en el caso de la desarticulación del codo, es necesario ajustar algunos pasos de disección: la disección del nervio debe ser proximal a las ramas motoras de los nervios principales. Además, la masa flexora y extensora debe ser respetada y elevada en un plano subperióstico en lugar de seccionada como en un trasplante distal de antebrazo16,26. Esta modificación permite la conservación de todas las unidades funcionales musculotendinosas esenciales en el trasplante proximal de antebrazo.
En cuanto a la preparación del injerto, existen grandes diferencias en función del nivel de trasplante. En el trasplante distal, la desventaja anatómica, en comparación con el trasplante proximal, es que cada tendón flexor y extensor se disecciona y repara individualmente. Sin embargo, se puede iniciar de forma segura un rango de movimiento activo temprano, y no hay retraso debido a la reinervación de los flexores/extensores, lo que permite una buena función temprano después de la cirugía 4,14.
Después de trasplantes a niveles más proximales, el resultado es menos consistente y aparece más tarde20,27. La principal diferencia es la reinervación desde una mayor distancia del músculo intrínseco. Esta distancia provoca una inhibición progresiva de la regeneración nerviosa y altera la función 16,24,26.
Este protocolo presenta algunas limitaciones, ya que la investigación se realizó con cadáveres y no con un donante fallecido y se basa en nuestra experiencia de Niza (Francia). Además, el nivel de amputación puede variar en el muñón receptor, y la preparación del trasplante puede modificarse de acuerdo con el protocolo aquí descrito.
Divulgaciones
Los autores no tienen divulgaciones.
Agradecimientos
Los autores desean agradecer a las personas que donaron sus cuerpos para facilitar la investigación anatómica.
Materiales
| Name | Company | Catalog Number | Comments |
| 11.5” medium premium surgiclip II auto suture vessel clip applier | Covidien | ||
| 2-0 silk suture | N/A | N/A | |
| Adson forceps | MPM | 106-2112A | |
| Bipolar coagulation forceps | Olsen | 20-1320I | |
| Custodiol HTK solution for limb perfusion | Essential Pharmaceuticals Inc. | off-label use | |
| Cysto/Bladder irrigation set | Baxter Healthcare Corp. | 2C4040 | |
| Disposable scalpel #15 | Sklar | ||
| DLP 3 mm vessel cannula blunt tip | Medtronic Inc | https://www.medline.com/product/Medtronic-DLP-Vessel-Cannulae/Cannulas-Tubing/Z05-PF24250?question=vessel%20cannula | |
| Fine needle cautery | Cormedica | ||
| Forceps dilators | WPI | 15910 | |
| IV stopcock | N/A | N/A | |
| Micro scissors | WPI | 504492 | |
| Monopolar diathermy | Medtronic Inc | Valleylab | |
| Oscillating saw | GPC Medical | https://www.gpcmedical.com/1015/BTD1138/battery-operated-oscillating-saw.html | |
| Saline solution 0,9% | GenDepot | S0600-101 | |
| Sterile Esmarch bandage | N/A | N/A | |
| Sterile indelible ink markers | N/A | N/A | |
| Strabismus scissors | Surtex | 102-4109 | |
| Surgical marking pen | Cardinal health | 212PR | |
| Sutures Ethilon 4.0 | Ethicon | 1667G | |
| Syringue 10 mL | Agilent | 9301-6474 | |
| Three sterile procurement plastic bags, and three sterile zip ties | N/A | N/A | |
| Tissue forceps | MPM | 106-0511 | |
| Vessel loop | Deroyal | 30-711 |
Referencias
- Dubernard, J. M., et al. Human hand allograft: report on first 6 months. Lancet. 353 (9161), 1315-1320 (1999).
- Wells, M. W., Rampazzo, A., Papay, F., Gharb, B. B. Two decades of hand transplantation: a systematic review of outcomes. Ann Plast Surg. 88 (3), 335-344 (2022).
- Kumnig, M., Kobler, C., Zaccardelli, A., Brandacher, G., Talbot, S. G. Advancing vascularized composite allotransplantation: essential factors for upper extremity transplant program development. Front Transplant. 3, 1406626 (2024).
- Schuind, F., Abramowicz, D., Schneeberger, S. Hand transplantation: the stateoftheart. J Hand Surg Eur. 32 (1), 2-17 (2007).
- Hernandez, J. A., et al. OPTN/SRTR 2022 annual data report: vascularized composite allograft. Am J Transplant. 24 (2), S534-S556 (2024).
- Mendenhall, S. D., et al. Technique for rapid hand transplant donor procurement through the elbow. Hand. 16 (3), 391-396 (2021).
- Mendenhall, S. D., Brown, S., BenAmotz, O., Neumeister, M. W., Levin, L. S. Building a hand and upper extremity transplantation program: lessons learned from the first 20 years of vascularized composite allotransplantation. Hand. 15 (2), 224-233 (2020).
- Cetrulo, C. L., Kovach, S. J. Procurement of hand and arm allografts. Tech Hand Up Extrem Surg. 17 (4), 232-238 (2013).
- Dalla Pozza, E., et al. Procurement of extended vascularized skin flaps from the donor enables hand transplantation in severe upper extremity burns: an anatomical study. Plast Reconstr Surg. 142 (2), 425-437 (2018).
- Gittings, D. J., et al. Preparation is the only shortcut you need in surgery: a guide to surgical rehearsals for hand and upper extremity transplantation. Tech Hand Up Extrem Surg. 22 (4), 137-140 (2018).
- Hausien, O., et al. Surgical and logistical aspects of donor limb procurement in hand and upper extremity transplantation. Vasc Compos Allotransplantation. 1 (1-2), 31-41 (2014).
- Griffin, J. M., et al. Using team science in vascularized composite allotransplantation to improve team and patient outcomes. Front Psychol. 13, 935507 (2022).
- Margreiter, R., et al. A doublehand transplant can be worth the effort. Transplantation. 74 (1), 85-90 (2002).
- Hartzell, T. L., et al. Surgical and technical aspects of hand transplantation: is it just another replant. Hand Clin. 27 (4), 521-530 (2011).
- Cavadas, P. C., Ibáñez, J., Thione, A., Alfaro, L. Bilateral transhumeral arm transplantation: result at 2 years. Am J Transplant. 11 (5), 1085-1090 (2011).
- Haddock, N. T., Chang, B., Bozentka, D. J., Steinberg, D. R., Levin, L. S. Technical implications in proximal forearm transplantation. Tech Hand Up Extrem Surg. 17 (4), 228-231 (2013).
- Sharma, M., et al. First two bilateral hand transplantations in India (part 2): technical details. Indian J Plast Surg. 50 (2), 153-160 (2017).
- Tawa, P., Gurunian, R., Rampazzo, A., Papay, F., Bassiri Gharb, B., et al. Upper extremity transplantation: the Massachusetts General Hospital experience. Reconstructive Transplantation. , 231-238 (2023).
- Brown, S. H. M., et al. Mechanical strength of the sidetoside versus Pulvertaft weave tendon repair. J Hand Surg. 35 (4), 540-545 (2010).
- Schneeberger, S., et al. First forearm transplantation: outcome at 3 years. Am J Transplant. 7 (7), 1753-1762 (2007).
- Sharma, M., et al. Indian subcontinent's first proximal forearm level double upper extremity transplantation. Indian J Plast Surg. 52 (3), 277-284 (2019).
- Cavadas, P. C., Landin, L., Ibañez, J. Bilateral hand transplantation: result at 20 months. J Hand Surg Eur. 34 (4), 434-443 (2009).
- Hummelink, S., Kruit, A. S., Hovius, S. E. R., Ulrich, D. J. O. Designing and utilizing 3Dprinted skin incision guides during the first Dutch bilateral handarm transplantation. J Plast Reconstr Aesthet Surg. 74 (11), 2965-2968 (2021).
- Wood, M. D., Kemp, S. W. P., Weber, C., Borschel, G. H., Gordon, T. Outcome measures of peripheral nerve regeneration. Ann Anat. 193 (4), 321-333 (2011).
- Serra López, V. M., et al. . Hand Allotransplantation: The Penn Experience. In Reconstructive Transplantation. , (2023).
- McClelland, B., et al. Proximal forearm transplantation for below elbow amputations: rationale and surgical technique. Vasc Compos Allotransplantation. 2 (1), 26-28 (2015).
- Jablecki, J., Kaczmarzyk, L., Patrzalek, D., Domanasiewicz, A., Chełmoński, A. A detailed comparison of the functional outcome after midforearm replantations versus midforearm transplantation. Transplant Proc. 41 (2), 513-516 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados