Method Article
Collecte sur le terrain et identification systématique en laboratoire de Rhodiola crenulata
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous décrivons l’identification de Rhodiola Crenulata à partir de l’habitat, de la morphologie des plantes, des propriétés médicinales, des caractéristiques microscopiques et de la chromatographie sur couche mince.
Résumé
L’identification des médicaments est la prémisse et la garantie de la sécurité des médicaments. La majorité des chercheurs scientifiques privilégient le processus d’identification simple, rapide, efficace et peu coûteux des plantes médicinales. Rhodiola crenulata est un médicament traditionnel tibétain cultivé à haute altitude, principalement distribué dans les régions du Tibet, du Yunnan et du Sichuan en Chine. Le crénelé de rhodiola possède de multiples bioactivités, telles que des propriétés anti-inflammatoires, anti-hypoxies et antioxydantes, et a un grand potentiel de développement. Avec la demande croissante du marché et une diminution rapide de la teneur en ressources, un grand nombre de produits confus de Rhodiola crenulata ont troublé les gens. Par conséquent, ce protocole introduit un processus standard pour l’identification de Rhodiola crenulata sur le terrain combiné à des tests de laboratoire de routine. La combinaison de l’habitat, des caractéristiques microscopiques et de la chromatographie sur couche mince permettra sans aucun doute d’identifier Rhodiola crenulata rapidement, efficacement et économiquement, contribuant ainsi au développement continu de la médecine tibétaine et au contrôle de la qualité des matériaux médicinaux.
Introduction
La phytothérapie a une longue histoire et une riche expérience d’application en Chine, et c’était le premier enregistrement systématique dans le classique à base de plantes de Shennong1. La découverte de l’artémisinine appliquée au paludisme a favorisé le développement de la phytothérapie à un nouveau stade1. L’utilisation de la technologie scientifique moderne pour découvrir le mécanisme exact de la phytothérapie augmente le taux d’utilisation et la demande de phytothérapie, ouvrant un nouveau marché international pour elle 2,3,4. Cependant, cela a entraîné une série d’effets négatifs. Les non-professionnels ont une vague compréhension des caractéristiques de la phytothérapie, ce qui fait que l’utilisation de la phytothérapie fait face à un énorme risque de sécurité5.
Rhodiola crenulata, l’une des plantes de l’espèce Rhodiola, est principalement distribuée au Tibet, au nord-ouest du Yunnan et à l’ouest du Sichuan en Chine (Figure 1)6,7. Rhodiola crenulata comprend du salidroside, du tyrosol, de l’acide gallique et d’autres composés pour le traitement des maladies liées à l’hypoxie grâce à la fonction de « revigorer le qi et de favoriser la circulation sanguine, d’éclaircir le pouls et de calmer l’asthme »8,9,10,11. L’étude sur le terrain montre que Rhodiola crenulata peut être trouvé dans les zones d’éboulis alpins, les pentes de ravines et les crevasses rocheuses à une altitude de 4 000 à 5 600 m. Son environnement de culture est froid, plein de soleil et de rayonnement intense, et il appartient à l’écosystème des prairies alpines. Rhodiola crenulata peut être distribué en populations lamellaires et ponctuelles en fonction du terrain de croissance, et le flux génétique peut être effectué par pollinisation croisée.
L’avortement pollinique du genre Rhodiola, l’excavation illégale et l’environnement écologique dégénéré font de Rhodiola crenulata une espèce en voie de disparition 6,12. Compte tenu de la valeur médicinale élevée de Rhodiola crenulata, des produits contrefaits devraient affluer sur le marché. Cet article présente l’habitat de Rhodiola crenulata et quelques méthodes pratiques d’identification en laboratoire. Tout d’abord, nous avons observé l’environnement de croissance de Rhodiola crenulata et ses propriétés médicinales. Deuxièmement, la microstructure de la poudre médicinale a été observée au microscope. La dernière étape est le point clé. Les composants représentatifs de Rhodiola crenulata ont été séparés et identifiés en fonction des différentes propriétés d’adsorption ou de dissolution de ces composants dans une certaine substance. Les méthodes d’authentification par ADN ou d’analyse métabolomique des plantes médicinales sont compliquées et coûteuses13. Ces méthodes de base, pratiques et économiques permettent d’identifier rapidement la Rhodiola crenulata.
Protocole
Rhodiola crenulata est récolté dans la montagne enneigée de Zhuoda, comté de Ganzi, préfecture autonome tibétaine de Ganzi, province du Sichuan, Chine (N 31.44570°, E 99.96086°, 4892 m). Les plantes sont authentifiées comme authentiques par le professeur Yi Zhang de l’École de médecine ethnique de l’Université de médecine traditionnelle chinoise de Chengdu.
1. Collection de Rhodiola crenulata
- Photographiez la carte de l’habitat du Rhodiola crenulata.
- Photographiez la plante entière, les feuilles, le calice et le rhizome de Rhodiola crenulata.
- Utilisez une bêche pour éliminer les mauvaises herbes et les pierres cassées à moins de 1 m de la Rhodiola crenulata afin d’assurer une exploitation minière en douceur.
- Déterrez le sol avec une houe jusqu’à ce que toute la rhizosphère soit visible et récupérez la racine pivotante.
REMARQUE :Les racines et les rhizomes de Rhodiola crenulata utilisés dans les parties médicinales doivent être récoltés en automne, lorsque les tiges florales se fanent.
2. Identification des caractéristiques
- Observez les traits d’apparence de Rhodiola crenulata à l’œil nu : racines pivotantes et rhizomes cylindriques et courts, surface brune, épiderme jaune membraneux avec un motif rose et tranches rouge orangé ou bordeaux.
- Identifiez-le par l’odeur : Il donne une odeur parfumée lorsqu’il est près du nez.
- Identifiez-le par le goût : Prenez un petit morceau de racine dans la bouche, buvez d’abord puis mâchez, goûtez légèrement amer, puis sucré.
3. Identification microscopique des granules d’amidon dans la poudre médicinale
- Retirez la terre à la surface de la Rhodiola crenulata avec une brosse, mettez-la au four à 40 °C et retournez les herbes toutes les 24 h.
REMARQUE : La facilité de rupture des matières médicinales est considérée comme la norme pour sécher l’humidité. - Saupoudrer les médicaments séchés à l’aide d’une machine à poudre et filtrer la poudre médicinale à l’aide du tamis médicamenteux n° 3 (voir le tableau des matériaux).
- Prenez une lame propre (voir Tableau des matériaux), creusez la poudre avec une aiguille de dissection (voir Tableau des matériaux) et placez-la uniformément à un tiers de la lame à moins de 2 mm.
- Utilisez un compte-gouttes en verre (voir tableau des matériaux) pour ajouter une goutte d’eau désionisée à la poudre. Utilisez une pince à épiler (voir Tableau des matériaux) pour tenir une extrémité du verre de protection (voir Tableau des matériaux) pour toucher rapidement le niveau de liquide et couvrir la poudre.
REMARQUE : Utilisez une aiguille anatomique pour mélanger doucement l’eau et la poudre médicinale afin d’assurer un mélange uniforme des échantillons. Il ne doit pas y avoir de bulles d’air entre la lame, la poudre et le verre de protection. - Ouvrez le microscope (voir Tableau des matériaux) et placez la lame à l’étape 3.4 sur la plate-forme pour la fixer. Ajustez la source lumineuse et la spirale de mise au point grossière pour voir la poudre. Ajustez la fine spirale parafocale jusqu’à ce que les tissus soient clairement visibles. Passez à un objectif 40x et observez les granules d’amidon.
REMARQUE : Amidonnez les grains se présentant comme un ou plusieurs grains, et le point ombilical apparaît en forme de chevron ou de fissure.
4. Identification microscopique des cathéters, des cellules de liège, des fibres, des cellules de parenchyme du bois et des masses pigmentaires dans la poudre médicinale
- Prenez une lame propre (voir Tableau des matériaux), creusez la poudre avec une aiguille de dissection (voir Tableau des matériaux) et placez-la au tiers de la lame.
- Utilisez un compte-gouttes en verre (voir le tableau des matériaux) pour ajouter une goutte d’hydrate de chloral (voir le tableau des matériaux) à la poudre. Prenez la diapositive avec une pince à épiler (voir tableau des matériaux) et chauffez-la trois fois dans la lampe à alcool, chaque fois pendant 1 s.
REMARQUE : Les bulles doivent être évitées pendant le chauffage. Le liquide reste non fluide, ce qui indique que la pénétration est complète. - Utilisez un compte-gouttes en verre pour ajouter une goutte de glycérine (voir tableau des matériaux). Utilisez une pince à épiler pour tenir une extrémité du verre de protection afin de toucher rapidement le niveau de liquide.
- Ouvrez le microscope et placez la lame sur la plate-forme pour la fixer. Ajustez la source lumineuse et la spirale de mise au point grossière pour voir la poudre. Ajustez la fine spirale parafocale jusqu’à ce que les tissus soient clairement visibles. Observez le cathéter, les cellules de liège, les fibres, les cellules du parenchyme en bois et le bloc pigmentaire en passant à une lentille d’objectif 40x.
NOTE : Polygone ou long polygonal de cellules de liège, vaisseau en spirale avec structure hélicoïdale évidente, parenchyme du xylème contenant des cristaux de sable d’oxalate de calcium et bloc de pigment rouge ou rouge brunâtre.
5. Préparation d’échantillons chromatographiques sur couche mince (CCM) de Rhodiola crenulata et de sa référence
- Placez le papier de pesée sur la balance (voir tableau des matériaux) et pesez 3 g de poudre de Rhodiola crenulata.
- Prendre la poudre dans un flacon conique de 100 mL (voir Tableau des matériaux) et ajouter 25 mL de méthanol à l’aide d’une grosse pipette ventrale (voir Tableau des matériaux). Placez la bouteille conique dans l’instrument à ultrasons. Réglez la puissance sur 250 W, la fréquence sur 40 kHz et le temps sur 30 min (voir le tableau des matériaux), puis allumez l’instrument.
REMARQUE : Le but de l’appareil à ultrasons est de s’assurer que la poudre de Rhodiola crenulata est complètement dissoute sans affecter les résultats des expériences chromatographiques ultérieures sur couche mince. - Retirez la bouteille conique et rincez la bouteille extérieure à l’eau courante à température ambiante (RT).
- Aspirer 800 μL de liquide préparé à l’étape 5.3 avec une seringue de 1 mL. Filtrer avec une membrane filtrante microporeuse de 0,22 μm (voir le tableau des matériaux) et prélever 400 μL de solution d’échantillon à mi-courant de Rhodiola crenulata dans un flacon d’échantillon chromatographique.
- Peser et ajouter 2 mg de salidroside, de tyrosol et d’acide gallique (voir le tableau des matières) dans 3 flacons coniques distincts de 100 ml, respectivement. Ajoutez 25 mL de méthanol avec une grosse pipette ventrale dans chaque bouteille conique.
- Placez la bouteille conique dans l’instrument à ultrasons, réglez la puissance sur 250 W, la fréquence sur 40 kHz et le temps sur 30 min, puis répétez l’étape 5.3 (voir le tableau des matériaux).
- Aspirer 800 μL de liquide préparé à l’étape 5.6 avec une seringue de 1 mL. Filtrer avec une membrane filtrante microporeuse de 0,22 μm (voir le tableau des matériaux) et prélever 400 μL de solution étalon de salidroside, de tyrosol et d’acide gallique dans les flacons d’échantillon chromatographiques correspondants.
6. Identification TLC
- Pipeter du trichlorométhane (5 mL), de l’acétate d’éthyle (4 mL), du méthanol (2 mL) et de l’acide formique (0,5 mL) (voir le tableau des matières). Ajouter sur un côté du cylindre de chromatographie à double réservoir (voir tableau des matériaux), agiter et mélanger uniformément. Couvrir la culasse supérieure.
- Placer l’acide gallique, le salidroside, la solution étalon de tyrosol et la solution de Rhodiola crenulata sur le support d’échantillons dans les positions A1-A4.
- Placez la feuille de silicone de 5 cm x 10 cm (voir tableau des matériaux) sur la table d’échantillonnage. Démarrez la machine d’échantillonnage automatique (voir tableau des matériaux) et ouvrez la vanne de régulation d’air.
- Ouvrez le logiciel visionCATS (voir Tableau des matériaux). Cliquez sur Nouveau > Nouveau dossier (nommé test d’échantillon de Rhodiola crenulata ) > OK. Cliquez sur Nouvelle méthode (nom Test d’échantillon de Rhodiola crenulata ) > OK > ATS 4.
- Cliquez sur Terminer la définition de l’étape. Cliquez sur Suivre l’affectation pour modifier la description (acide gallique, salidroside, tyrosol et échantillon de Rhodiola crenulata ).
- Cliquez sur Étapes HPTLC. Définissez les paramètres de la couche mince (5 cm x 10 cm). Sélectionnez Type d’application (bande), définissez les paramètres (Tableau 1), puis cliquez sur le bouton OK .
- Qualité de remplissage/rinçage ouvert. Cochez Remplir uniquement le volume programmé. Réglez le niveau du fond du flacon (mm) sur 0,5 et cliquez sur le bouton OK.
- Cliquez sur Exécuter la méthode.
- Cliquez sur le bouton Suivre l’affectation , cochez la case Centre et définissez les paramètres (Tableau 2).
- Cliquez sur le bouton Continuer pour l’échantillonnage automatique.
- Éteignez la machine d’échantillonnage automatique et la vanne d’air. Retirez la feuille de silicone de la machine d’échantillonnage automatique.
- Placez la feuille de silicone de l’autre côté du cylindre de chromatographie à double réservoir à l’étape 6.1, couvrez la culasse supérieure et pré-saturez pendant 20 min.
- Serrez doucement l’extrémité supérieure de la plaque à couche mince avec une pince à épiler, placez rapidement la feuille de silicone dans l’agent de développement et couvrez la culasse supérieure.
REMARQUE : Retirez la feuille de silicone lorsque le bord avant dépliable est à 0.5-1.0 cm de l’extrémité supérieure de la plaque de couche mince. - Une fois le solvant organique évaporé, vaporisez la solution chromogène sur la surface de la feuille de silicone à température ambiante pour obtenir des résultats chromogènes.
NOTE : La solution chromogène est une solution aqueuse contenant 2 % de FeCl3 et 1 % de K3[Fe(CN)6].
Résultats
Ce protocole expérimental décrit l’identification et la collecte de Rhodiola crénelée sur le terrain. Le crénelé de rhodiola a tendance à vivre dans les zones d’éboulis alpines, les pentes des ravins et les crevasses rocheuses à haute altitude. L’habitat, la plante entière, la fleur et les feuilles de Rhodiola crénelée peuvent être représentés à la figure 2. La rhodiola crénelée a un rhizome brun rougeâtre (figure 3A). Une image représentative de la poudre médicinale est présentée à la figure 3B. Selon le protocole expérimental ci-dessus, les résultats microscopiques peuvent être énumérés comme suit : 1) cellules de liège jaune brunâtre ou incolore, d’aspect grand, polygonales ou polygonales longues, avec des parois légèrement plus épaisses (Figure 3C) ; 2) grains d’amidon se présentant sous forme de grains simples ou multiples, et point ombilical apparaissant en forme de chevron ou de fissure (figure 3D) ; 3) principalement des vaisseaux en spirale rapprochés (figure 3E) ; 4) parenchyme xylémique achromateux et ovale se présentant en feuillets et contenant des cristaux de sable d’oxalate de calcium (Figure 3F) ; 5) bloc pigmentaire brun-rouge de forme irrégulière (figure 3G). Les résultats de la séparation en couche mince ont montré que l’échantillon de Rhodiola crenulata (A4) apparaissait sous forme de taches de même couleur dans la position correspondant au chromatogramme de l’acide gallique (A1), du salidroside (A2), de la solution étalon de tyrosol (A3) (Figure 3H). L’acide gallique, le salidroside et le tyrosol sont les composants principaux et représentatifs du crénelat de rhodiola. Ces résultats montrent qu’une identification préliminaire de Rhodiola crenulata est possible avec les tests discutés dans le protocole.
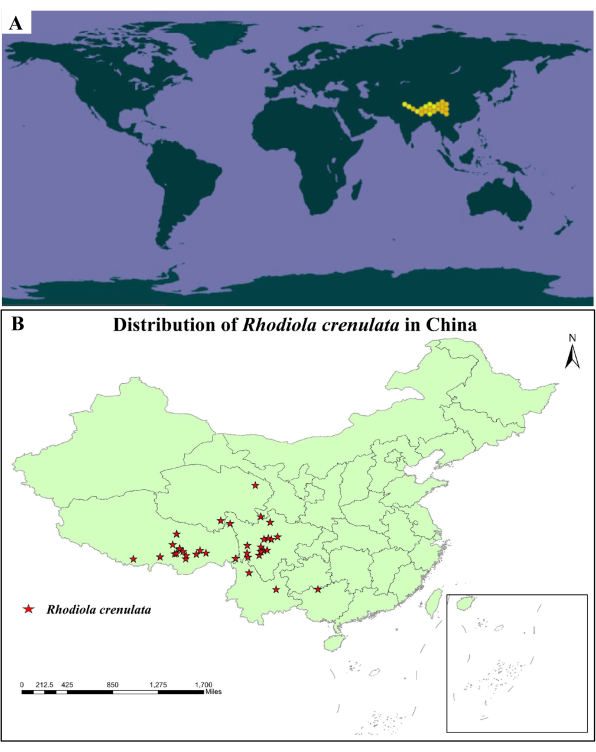
Figure 1 : Carte de répartition de Rhodiola crenulata (A) Rhodiola crenulata est principalement réparti en Chine, en Inde, au Népal et au Bhoutan14. (B) Rhodiola crenulata est principalement distribué au Tibet, au Qinghai, au Sichuan, au Yunnan et au Guizhou en Chine (produit par ArcGis 10.6). Les données statistiques proviennent des sites Web de l’Institut de botanique15,16. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Photo de la plante Rhodiola crenulata. (A) Biotope de Rhodiola crenulate. (B) Plan rapproché de Rhodiola crénelée. (C) Plante entière de Rhodiola crénelée. (D) Fleur de Rhodiola crenulata. (E) Feuilles de Rhodiola crénelées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Caractéristiques microscopiques et chromatogramme en couche mince de Rhodiola crenulata. (A) Racine médicinale de Rhodiola crenulata. (B) Pouvoir de la matière médicinale de Rhodiola crenulata. (C) Cellule de liège. (D) Grains d’amidon. (E) Récipient en spirale. (F) Parenchyme du xylème (cristal d’oxalate de calcium). (G) Pigment. (H) La séparation par chromatographie sur couche mince du salidroside (A1), de l’acide gallique (A2), du tyrosol (A3) et de la Rhodiola crenulata (A4). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Paramètres | Option |
| Position d’application Y (mm) | 10 |
| Première position de la voie (mm) | 10 |
| Distance de la voie (mm) | 10 |
| Longueur d’application (mm) | 5 |
| Largeur d’application (mm) | 0.5 |
Tableau 1 : Réglages des paramètres de la position d’échantillonnage automatique.
| ID du flacon | Description | Volume (μL) | Position | Type |
| 1 | salidroside | 3 | A1 | Référence |
| 11 | acide gallique | 1 | A2 | Référence |
| 12 | Tyrosol | 2 | A3 | Référence |
| 13 | Échantillon de crénelage de rhodiola | 2 | A4 | Échantillon |
Tableau 2 : Réglages des paramètres de l’ordre d’échantillonnage automatique.
Discussion
Il existe plus de 90 espèces de plantes de rhodiola dans le monde, et plus de 60% de toutes les espèces se trouvent en Chine, les plus courantes étant la Rhodiola crenulata, la Rhodiola rosea, la Rhodiolas achalinensis et la Rhodiola algida17. La Rhodiola crenulata, enregistrée dans la première partie de la pharmacopée chinoise (2020), est une médecine traditionnelle tibétaine cultivée en haute altitude. La demande du marché pour Rhodiola crenulata augmente chaque année, il est donc essentiel d’assurer une utilisation correcte de la source pour garantir une utilisation sûre. En particulier, la standardisation de la cueillette sur le terrain à l’identification simple et rapide de la routine de laboratoire ne peut être ignorée. Il a été rapporté que la chromatographie liquide à haute performance, la spectrométrie de masse et les répétitions de séquences inter-simples peuvent identifier avec précision le crénelat de Rhodiola à partir d’autres espèces de Rhodiola, ce qui prend du temps, est complexe et coûteux 18,19,20. Parallèlement, nous avons établi une méthode d’évaluation multidimensionnelle de la reconnaissance sensorielle (E-nose et analyse des couleurs) et une méthode HPLC pour distinguer le crénelé de rhodiola21,22.
Chaque matière médicinale a son environnement de culture, ses caractéristiques de structure microscopique et ses composants d’index. Ce protocole fournit une méthode complète pour identifier Rhodiola crenulata, de l’identification sur le terrain à la microscopie en laboratoire et à la validation par chromatographie sur couche mince. Rhodiola crenulata pousse principalement à des altitudes supérieures à 3000 m, à basse température, à faible teneur en oxygène et dans des zones à fort rayonnement ultraviolet23. Rhodiola crenulata est une herbe succulente, ce qui est sa caractéristique visuelle intuitive. Sa poudre apparaît brun rougeâtre avec une odeur parfumée. Par son port, sa morphologie végétale, ses fleurs et ses feuilles, Rhodiola crenulata se distingue des autres espèces de Rhodiola sur le terrain. Les résultats microscopiques des matériaux médicinaux ont montré l’existence de granules d’amidon, de cellules de parenchyme de bois (y compris des cristaux de sable d’oxalate de calcium), de cellules de liège, de conduit (principalement des conduits filetés) et de grandes quantités de pigment rouge. La CCM est une technique de séparation chromatographique pour la séparation d’échantillons à plusieurs composants, couramment utilisée dans l’identification des matériaux médicinaux chinois. L’acide gallique, le tyrosol et le salidroside sont souvent identifiés comme les composants de référence du crénelé de rhodiola24. Les résultats de la chromatographie sur couche mince ont montré que la solution de Rhodiola crenulata présentait les mêmes taches de couleur à la position correspondante que le témoin (acide gallique, tyrosol et salidroside). Il montre que Rhodiola crenulata contient de l’acide gallique, du tyrosol et du salidroside. Combiné à la connaissance de l’environnement de culture et aux résultats microscopiques, Rhodiola crenulata peut être identifié de manière préliminaire.
Il convient de noter que l’environnement de culture unique détermine qu’il est presque impossible d’avoir des Rhodiola crenulata sauvages en dessous de 3000 m d’altitude. De plus, il n’est pas recommandé de récolter les racines et le rhizome de Rhodiola crenulata pendant la période de floraison. Pour l’identification microscopique en laboratoire, le séchage des racines et le tamisage de la poudre sont des conditions préalables à la préparation réussie d’échantillons microscopiques. S’assurer qu’il n’y a pas de bulle d’air entre la lame, la poudre médicinale et le verre de protection est également essentiel pour observer la composition caractéristique au microscope. Pour la chromatographie sur couche mince, la pré-saturation de la plaque de gel de silice, l’agent de développement raisonnable et la concentration de l’échantillon sont des facteurs importants pour séparer avec succès les différents composants de l’échantillon d’essai. Par rapport à l’échantillonnage manuel traditionnel, le processus d’échantillonnage automatique de ce protocole augmente sans aucun doute la précision des résultats et la répétabilité de l’expérience. La subjectivité de l’identification des arômes et des goûts est trop forte et peut conduire à des erreurs de jugement. Par rapport à la chromatographie liquide à haute performance, à la résonance magnétique nucléaire H et à la spectrométrie de masse, la chromatographie sur couche mince ne peut pas analyser quantitativement la teneur en composés des matériaux médicinaux25. Bien que le code-barres ADN ait une précision supérieure dans l’identification des plantes, son prix élevé détermine qu’il n’est pas universel dans l’identification des matériaux médicinaux26. De plus, l’identification et la microscopie du terrain au laboratoire combinées à la technique de chromatographie sur couche mince fournie dans ce protocole sont applicables à presque tous les matériaux médicinaux. Il s’agit d’un processus bon marché, simple et rapide pour l’identification de tout matériel médicinal à base de plantes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (81973569, 82274207 et 82104533), le projet de promotion de la recherche Xinglin Scholar de l’Université de Chengdu de MTC (XKTD2022013) et le programme clé de recherche et développement du Ningxia (2023BEG02012).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 μm millipore filter | Millipore | SLGP033RB | |
| Automatic sampling machine | CAMAG | ATS 4 | |
| Chloral hydrate | Fuzhou Brunei Technology Co., Ltd | ST1002 | |
| Chromatographic sample bottles | Zhejiang ALWSCI Technology Co., Ltd | C0000008 | |
| Conical flask | Sichuan Shubo Co., Ltd | 1121 | |
| Cover glass | Citotest Labware Manufacturing Co., Ltd | 10211818c | |
| Dissecting needle | Shanghai Bingyu Fluid Technology Co., Ltd | BY-5026 | |
| Electronic balance | SHIMADZU | ATX124 | |
| Ethyl acetate | Chengdu Kelong Chemical Co., Ltd | 2022120901 | |
| Formic acid | Chengdu Kelong Chemical Co., Ltd | 2021110801 | |
| Gallic acid | Chengdu Herbpurify Co., Ltd | M-017 | |
| Glycerol | Sinopharm Chemical Reagent Co., Ltd | 10010618 | |
| High speed crusher | Beijing Zhongxingweiye Instrument Co., Ltd | FW-100 | |
| Methanol | Chengdu Kelong Chemical Co., Ltd | 20230108 | |
| Microscope | Chongqing Oprec Nistrument Co., Ltd | B203 | |
| Microscope slide | Citotest Labware Manufacturing Co., Ltd | 7105P-G | |
| Oven | Shanghai Yuejin Medical Equipment Co., Ltd | DHG-8145 | |
| Pharmacopoeia sieve | Hangzhou Xingrun sieve factory | 572423281330 | |
| Pipette | Changde BKMAM Biotechnology Co., Ltd | 120302008 | |
| Salidroside | Chengdu Herbpurify Co., Ltd | H-040 | |
| Saturate tank | Yancheng Liegu Technology Co., Ltd | 10*20 P-1 | |
| Silica gel plate | Yantai Jiangyou Silica Gel Development Co., Ltd | HSG20211227 | |
| Trichloromethane | Chengdu Kelong Chemical Co., Ltd | 20221013-1 | |
| Tweezer | Changde BKMAM Biotechnology Co., Ltd | 130302027 | |
| Tyrosol | Chengdu Herbpurify Co., Ltd | L-042 | |
| Ultrasound equipment | Ningbo Xinyi Ultrasonic Equipment Co., Ltd | SB-8200DTS | |
| Volumetric pipet | Changde BKMAM Biotechnology Co., Ltd | 120301006 |
Références
- Zhang, J., et al. Traditional herbal medicine and nanomedicine: Converging disciplines to improve therapeutic efficacy and human health. Advanced Drug Delivery Reviews. 178, 113964(2021).
- Yin, R., et al. The positive role and mechanism of herbal medicine in Parkinson's Disease. Oxidative Medicine and Cellular Longevity. 2021, 9923331(2021).
- Li, F. S., Weng, J. K. Demystifying traditional herbal medicine with modern approach. Nature Plants. 3, 17109(2017).
- da Fonseca, L. R., et al. Herbal medicinal products from Passiflora for anxiety: An unexploited potential. The Scientific World Journal. 2020, 6598434(2020).
- Aziato, L., Antwi, H. O. Facilitators and barriers of herbal medicine use in Accra, Ghana: an inductive exploratory study. BMC Complementary and Alternative Medicine. 16, 142(2016).
- Tao, H., et al. Rhodiola species: A comprehensive review of traditional use, phytochemistry, pharmacology, toxicity, and clinical study. Medicinal Research Reviews. 39 (5), 1779-1850 (2019).
- Wang, Y., et al. The dietary supplement Rhodiola crenulata extract alleviates dextran sulfate sodium-induced colitis in mice through anti-inflammation, mediating gut barrier integrity and reshaping the gut microbiome. Food & Function. 12 (7), 3142-3158 (2021).
- Xie, N. Rhodiola crenulate alleviates hypobaric hypoxia-induced brain injury via adjusting NF-κB/NLRP3-mediated inflammation. Phytomedicine. 103, 154240(2022).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. Journal of Ethnopharmacology. 293, 115278(2022).
- Ma, D., et al. Chemical characteristics of Rhodiola Crenulata and its mechanism in acute mountain sickness using UHPLC-Q-TOF-MS/MS combined with network pharmacology analysis. Journal of Ethnopharmacology. 294, 115345(2022).
- Wang, X., et al. Rhodiola crenulata attenuates apoptosis and mitochondrial energy metabolism disorder in rats with hypobaric hypoxia-induced brain injury by regulating the HIF-1α/microRNA 210/ISCU1/2(COX10) signaling pathway. Journal of Ethnopharmacology. 241, 111801(2019).
- d'Avigdor, E., Wohlmuth, H., Asfaw, Z., Awas, T. The current status of knowledge of herbal medicine and medicinal plants in Fiche, Ethiopia. Journal of Ethnobiology and Ethnomedicine. 10, 38(2014).
- Sánchez, M., González-Burgos, E., Divakar, P. K., Gómez-Serranillos, M. P. DNA-based authentication and metabolomics analysis of medicinal plants samples by DNA barcoding and ultra-high-performance liquid chromatography/triple quadrupole mass spectrometry (UHPLC-MS). Plants (Basel, Switzerland). 9 (11), 1601(2020).
- Rhodiola renulata (Hook.fil & Thomson) H.Ohba. , Available from: https://www.gbif.org/species/4200529 (2023).
- Plant + data center. , Available from: https://www.iplant.cn/ (2023).
- Chinese virtual herbarium. , Available from: https://www.cvh.ac.cn/ (2023).
- Cunningham, A. B. There "ain't no mountain high enough"?: The drivers, diversity and sustainability of China's Rhodiola trade. Journal of Ethnopharmacology. 252, 112379(2020).
- Wang, Q., Ruan, X., Jin, Z. H., Yan, Q. C., Tu, S. Identification of Rhodiola species by using RP-HPLC. Journal of Zhejiang University. Science. B. 6 (6), 477-482 (2005).
- Dong, X., Guo, Y., Xiong, C., Sun, L. Evaluation of two major Rhodiola species and the systemic changing characteristics of metabolites of Rhodiola crenulata in different altitudes by chemical methods combined with UPLC-QqQ-MS-based metabolomics. Molecules. 25 (18), 4062(2020).
- Zhao, W., et al. HPLC fingerprint differentiation between natural and ex situ populations of Rhodiola sachalinensis from Changbai Mountain, China. PloS One. 9 (11), 112869(2014).
- Yu, Y. Y. Quality evaluation of Tibetan medicine Rhodiolae crenulatae radix et rhizome based on sensory recognition and near infrared spectrum analysis. Chengdu University of Traditional Chinese Medicine. , Chinese Master's Thesis (2020).
- Lv, X. M. Simultaneous determination of 5 chemical components in 3 kinds of Rhodiola rosea by HPLC. China Pharmacy. 29 (18), 2515-2519 (2018).
- Dong, T., Sha, Y., Liu, H., Sun, L. Altitudinal variation of metabolites, mineral elements and antioxidant activities of Rhodiola crenulata (Hook.f. & Thomson) H.Ohba. Molecules. 26 (23), 7383(2021).
- Ma, D., et al. Application of UHPLC fingerprints combined with chemical pattern recognition analysis in the differentiation of six Rhodiola species. Molecules. 26 (22), 6855(2021).
- Li, X. H., et al. Metabolic discrimination of different Rhodiola species using 1H-NMR and GEP combinational chemometrics. Chemical & Pharmaceutical Bulletin. 67 (2), 81-87 (2019).
- Liu, Y., et al. Identification of Hippophae species (Shaji) through DNA barcodes. Chinese Medicine. 10, 28(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon