Method Article
La culture à grande échelle de nématodes pour étudier leurs comportements collectifs
Dans cet article
Résumé
Ici, un système est rapporté pour étudier les comportements collectifs des nématodes en les cultivant en vrac à l’aide d’un milieu de gélose pour chiens. Ce système permet aux chercheurs de propager un grand nombre de vers de Dauer et peut être appliqué à Caenorhabditis elegans et à d’autres espèces apparentées.
Résumé
Les animaux présentent des comportements collectifs dynamiques, comme on l’observe dans les volées d’oiseaux, les bancs de poissons et les foules d’humains. Les comportements collectifs des animaux ont été étudiés dans les domaines de la biologie et de la physique. En laboratoire, les chercheurs ont utilisé divers animaux modèles tels que la mouche des fruits et le poisson-zèbre pendant environ un siècle, mais l’étude du comportement collectif complexe à grande échelle orchestré par ces animaux modèles génétiquement traitables est restée un défi majeur. Cet article présente un protocole pour créer un système expérimental de comportements collectifs chez Caenorhabditis elegans. Les vers propagés grimpent sur le couvercle de la plaque de Petri et montrent un comportement d’essaimage collectif. Le système contrôle également les interactions et les comportements des vers en modifiant l’humidité et la stimulation lumineuse. Ce système nous permet d’examiner les mécanismes sous-jacents aux comportements collectifs en modifiant les conditions environnementales et en examinant les effets de la locomotion au niveau individuel sur les comportements collectifs à l’aide de mutants. Ainsi, le système est utile pour les recherches futures en physique et en biologie.
Introduction
Les non-scientifiques et les scientifiques sont fascinés par les comportements collectifs des animaux, comme les volées d’oiseaux et les bancs de poissons. Les comportements collectifs ont été analysés dans un large éventail de domaines, notamment la physique, la biologie, les mathématiques et la robotique. En particulier, la physique de la matière active est un domaine de recherche en pleine expansion qui se concentre sur les systèmes composés d’éléments autopropulsés, c’est-à-dire les systèmes dissipatifs, tels que les volées d’oiseaux, les bancs de poissons, les biofilms de bactéries mobiles, les cytosquelettes composés de molécules actives et les groupes de colloïdes autopropulsés. La théorie de la physique de la matière active soutient que, quelle que soit la complexité des comportements des individus, les mouvements collectifs d’un grand nombre d’êtres vivants sont régis par un petit nombre de règles simples. Par exemple, le modèle de Vicsek, candidat pour une description unifiée du mouvement collectif des particules autopropulsées, prédit que l’interaction d’alignement à courte portée des objets en mouvement est nécessaire pour former une phase ordonnée à longue portée avec une fluctuation excentrique en 2D, comme dans les troupeaux d’animaux1. Les approches expérimentales descendantes relatives à la physique de la matière active se développent rapidement. Des expériences antérieures ont confirmé la formation d’une phase ordonnée à longue portée chez Escherichia coli2. D’autres travaux récents ont utilisé des cellules 3,4, des bactéries5, des colloïdes mobiles6 ou des protéines mobiles 7,8. Des modèles minimaux simples tels que le modèle de Vicsek ont décrit avec succès ces phénomènes réels. Contrairement à ces systèmes expérimentaux unicellulaires, les comportements collectifs des animaux sont généralement observés dans la nature, car personne ne pouvait espérer effectuer des expériences contrôlées avec 10 000 oiseaux ou poissons réels.
Les biologistes partagent le même intérêt que les physiciens : comment les individus interagissent les uns avec les autres et se comportent fonctionnellement en tant que groupe. L’un des domaines de recherche traditionnels pour analyser le comportement individuel est la neuroscience, dans laquelle les mécanismes sous-jacents au comportement ont été examinés aux niveaux neuronal et moléculaire. De nombreuses approches neuroscientifiques ascendantes ont été développées jusqu’à présent. Les approches descendantes en physique et ascendantes en biologie peuvent être facilitées en utilisant des animaux modèles tels que la mouche des fruits, le ver Caenorhabditis elegans et la souris9. Cependant, il y a eu peu de résultats sur le comportement collectif à grande échelle de ces animaux modèles en laboratoire10 ; Il est encore difficile de préparer des animaux modèles génétiquement traitables à grande échelle en laboratoire. Par conséquent, dans les recherches actuelles sur les comportements collectifs en biologie et en physique, il a été difficile pour les scientifiques qui font habituellement de la recherche en laboratoire d’étudier les comportements collectifs des animaux.
Dans cette étude, nous avons établi une méthode de culture à grande échelle de nématodes pour étudier leurs comportements collectifs. Ce système nous permet de modifier les conditions environnementales et d’examiner l’effet de la locomotion au niveau individuel sur les comportements collectifs à l’aide de mutants10. En physique de la matière active, les paramètres du modèle mathématique peuvent être contrôlés à la fois dans des expériences et des simulations, ce qui permet de vérifier ce modèle pour identifier des descriptions unifiées. La génétique est utilisée pour comprendre le mécanisme des circuits neuronaux sous-jacents au comportement collectif11.
Protocole
1. Préparation des vers
NOTE : Préparer la souche12 et la souche ZX899 de type sauvage N2 Bristol (lite-1(ce314) ; ljIs123[mec-4p ::ChR2, unc-122p ::RFP])13 pour l’observation des comportements collectifs et des expériences optogénétiques, respectivement. Maintenez la souche ZX899 dans des conditions sombres.
- Déposer quatre vers adultes bien nourris sur une plaque de 60 mm contenant 14 mL de milieu de croissance des nématodes (NGM) avec gélose et ensemencée avec E. coli OP5012.
- Cultivez les vers F1 jusqu’à ce qu’ils meurent de faim dans la plaque NGM à 23 °C pendant 7 jours. Le rendement des vers F1 est d’environ 100 vers par plaque à ce stade. Les stades des vers comprennent une population mixte de larves de Dauer et de larves L1 affamées.
2. Préparation des plaques moyennes de gélose alimentaire pour chiens (DFA)
- Autoclavez une bouteille en verre contenant 2 g de nourriture en poudre pour chiens et 5 mL de milieu gélosé à 1 % et refroidissez-la à température ambiante (figure 1A).
REMARQUE : D’autres aliments pour chiens de différents fabricants peuvent être utilisés dans cette expérience.
3. Inoculation des vers aux plaques moyennes DFA
- Transférez de petites quantités (environ 0,5 g) de milieu DFA au centre d’une plaque NGM ensemencée avec E. coli OP50 (figure 1B). Pour les expériences optogénétiques, verser 40 μL de 50 μM de 50 μM tout-trans-rétinien, le cofacteur de la rhodopsine 2 du canal, sur le DFA avant l’inoculation des vers.
- Prélevez les vers affamés sur quatre plaques NGM à l’aide d’eau autoclave.
- Placez un petit fragment de nourriture pour chien (environ 0,5 g) sur le milieu DFA, à environ 2 mm du couvercle de l’assiette.
- Illuminez la plaque NGM avec une lumière ultraviolette pendant 15 minutes à l’intérieur d’un banc propre pour éviter toute contamination.
- Inoculer les vers collectés (environ 400 vers) sur le milieu DFA sur des plaques NGM. Ne scellez pas la plaque avec du parafilm pour éviter d’augmenter l’humidité à l’intérieur de la plaque de Petri et de générer des gouttelettes d’eau qui piègent les vers sur un couvercle.
- Propagez les vers à 23 °C et laissez-les grimper jusqu’au couvercle de la plaque pendant environ 10 à 14 jours.
REMARQUE : Comme le nombre de vers sur les couvercles n’a guère augmenté après 10 à 14 jours, on a supposé que les vers étaient probablement à court de nourriture.
4. Observation du comportement collectif
- Le jour de l’expérience, placez une nouvelle plaque NGM qui ne contenait pas de milieu gélosé E. coli et d’aliments pour chiens sur une plaque d’aluminium sur la platine d’un microscope macro zoom (Figure 2A). Maintenez le fond de cette nouvelle plaque NGM à 23 °C à l’aide d’un régulateur de température Peltier pendant au moins 5 min (Figure 2B). Ensuite, remplacez le couvercle de cette nouvelle plaque NGM par le couvercle de la plaque sur laquelle les vers ont grimpé. Utilisez l’objectif (x2, NA = 0,5) comme objectif à faible grossissement (Figure 2A).
- Augmenter la température du fond de la plaque de Petri de 23 °C à 26 °C pour modifier l’humidité à l’intérieur de cette plaque (Figure 2).
- Acquérir des images de la surface intérieure du couvercle de la plaque avec la caméra à 20 images s−1 (vidéo supplémentaire S1).
- Enregistrez les images acquises au format Fichier image balisé.
5. Expérience optogénétique
- Utilisez une lampe au mercure de 100 W pour diffuser de la lumière bleue, filtrée avec un jeu de filtres. Contrôlez le temps d’éclairage avec précision à l’aide d’un système d’obturateur électromagnétique (Figure 2B).
- Maintenez le ZX899 sur DFA dans ces conditions pendant 5 min avant l’allumage par lumière bleue.
- Illuminez les vers ZX899 fixés au couvercle d’une plaque de Petri sur la platine du microscope maintenue à 23 °C.
- Acquérir des images de la surface intérieure du couvercle de la plaque avec une caméra à 20 images s−1 (vidéo supplémentaire S2).
Résultats
Ici, des vers de Dauer de type sauvage ont été utilisés pour des observations collectives du comportement. Les vers ont été cultivés à 23 °C pendant environ 10 à 14 jours et ont grimpé jusqu’à la surface intérieure du couvercle d’une plaque moyenne DFA. Le jour expérimental, seul le couvercle a été transféré sur une nouvelle plaque NGM sans E. coli ni milieu DFA. Le fond de cette plaque de Petri a d’abord été maintenu à 23 °C à l’aide du système Peltier, puis sa température a été augmentée à 26 °C. Un film a été pris au microscope. La figure 3 montre des instantanés du film. Les vers ont remodelé dynamiquement leurs modèles de réseau lors des changements d’humidité. À mesure que l’humidité augmente, la taille des compartiments du réseau augmente également. Finalement, les réseaux se sont effondrés et des grappes de vers dormants sont restées sur la surface interne du couvercle.

Figure 1 : Photos d’un milieu DFA pour la culture d’un grand nombre de vers. (A) Photo d’un milieu DFA préparé dans une bouteille en verre. (B) Photo d’une plaque NGM avec un milieu DFA juste après l’inoculation des vers collectés. Abréviations : DFA = gélose alimentaire pour chiens ; NGM = milieu de croissance des nématodes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Système expérimental pour l’observation du comportement collectif. (A) Microscopie pour l’observation du comportement collectif. (B) Contrôleur d’obturateur mécanique et système de contrôle de la température utilisant le système Peltier. Veuillez cliquer ici pour voir une version agrandie de cette figure.
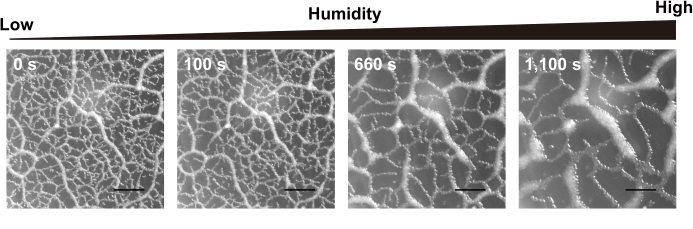
Figure 3 : Données représentatives de la dépendance du réseau collectif à l’humidité. Dépendance du réseau C. elegans à l’humidité ambiante. La fréquence d’images de la caméra est de 1 ips. Barre d’échelle = 4 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo supplémentaire S1 : Formations de réseaux collectifs. Des vers de Dauer de type sauvage ont été propagés à l’aide de DFA sur NGM dans une plaque de Petri. Les vers se sont auto-organisés à l’intérieur du couvercle. L’humidité a été modifiée à l’aide d’un appareil Peltier. Les images ont été prises au-dessus du couvercle. Le film est lu 80 fois plus vite que le taux d’enregistrement en temps réel. Abréviations : DFA = gélose alimentaire pour chiens ; NGM = milieu de croissance des nématodes. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire S2 : Manipulation optogénétique des collectifs de vers. L’optogénétique a été réalisée avec des éclairages de lumière bleue de 1, 2, 4, 8, 32 et 128 s. Cette activation a d’abord provoqué l’arborisation et l’effondrement des fagots. Enfin, un réseau différent de la structure initiale s’est formé. Le film est lu 20 fois plus vite que la cadence d’enregistrement en temps réel. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cette étude, nous montrons un protocole pour préparer un système pour le comportement collectif à grande échelle de C. elegans en laboratoire. La méthode basée sur l’AFD a été établie à l’origine avec Caenorhabditis japonica14 et Neoaplectana carpocapsae Weiser15, qui sont tous deux des animaux non modèles. Cependant, cette méthode n’a pas été appliquée pour étudier les comportements collectifs. Le C. elegans est un animal modèle génétiquement traitable11,12. Des études de génétique comportementale utilisant C. elegans ont contribué à l’étude de la recherche comportementale au niveau individuel. Cependant, dans la longue histoire de la recherche sur C. elegans, bien qu’un simple motif d’agglutination ait été observé 16,17,18,19, aucun rapport n’a démontré la formation de motifs dynamiques via le comportement au niveau du groupe de C. elegans. Une idée clé de cette étude est d’utiliser un milieu DFA pour faciliter le maintien d’un grand nombre de vers pendant une longue période dans une plaque de Petri. En utilisant le médium DFA, nous présentons l’observation du comportement collectif dynamique de C. elegans, introduisant ainsi un nouveau paradigme comportemental.
Auparavant, plusieurs méthodes de production de vers de masse ont été signalées. Par rapport à ces méthodes, l’avantage de cette méthode est de permettre l’étude du comportement collectif sur un couvercle sans procédé d’isolement des vers de Dauer. Récemment, nous avons publié un article rapportant le transfert de vers de Dauer nictanants à travers un espace entre un couvercle et un milieu DFA en utilisant des interactions électrostatiques avec le couvercle20. Ce transfert de vers se produit lorsque les vers forment une colonne de nictation composée d’environ 100 vers. Cette étude montre que seuls les vers de Dauer peuvent se transférer lorsque les formations de Dauer sont induites par un trop grand encombrement dans l’AFD. Le nombre de vers produits par cette méthode est probablement inférieur à celui d’autres méthodes telles que les méthodes à base de jaune d’œuf. Cependant, pour effectuer un test comportemental sur un couvercle, nous pouvons utiliser la population de vers de Dauer, qui comprend à peine d’autres vers de stade tels que les larves de L1 affamées, alors que les méthodes précédentes nécessitaient un processus d’isolement des vers de Dauer. Ainsi, cette méthode permet un examen comportemental collectif plus précis à l’aide de vers de Dauer. De plus, l’expérimentateur peut également contrôler la densité des vers dans la procédure suivante. Tout d’abord, de l’eau autoclavée a été utilisée pour recueillir et laver les vers qui se déplaçaient vers le couvercle. Ensuite, la concentration de vers dans l’eau a été déterminée en comptant les vers dans une aliquote de la suspension de vers, et la suspension de vers a été déposée sur un substrat. Dans l’ensemble, notre système est plus contrôlable en termes de stade de ver et de densité pour les expériences comportementales.
Le comportement collectif a été analysé du point de vue de la physique de la matière active, qui cherche à identifier des descriptions unifiées des mouvements collectifs des particules autopropulsées vivantes et non vivantes. Dans ce but, de nombreux systèmes expérimentaux ont été développés pour des particules et des cellules autopropulsées non vivantes, mais moins de systèmes ont été développés pour des organismes multicellulaires, qui présentent des comportements beaucoup plus complexes basés sur le circuit neuronal. Par conséquent, notre système étend la possibilité que la description unifiée des mouvements collectifs existe. En ce qui concerne la manipulation de l’humidité, notre simulation numérique précédente basée sur un modèle suggérait que les forces d’attraction entre les vers, probablement induites par l’humidité dans l’expérience, induisaient des changements de modèle, qui étaient qualitativement cohérents avec les changements de modèle induits par l’humidité10. Cependant, nous pensons qu’il n’y a pas de preuve expérimentale déterministe montrant que les changements de patron ont été induits par l’humidité plutôt que par la température. Par conséquent, l’expérimentateur doit faire preuve de prudence quant à savoir si les changements de comportement collectif peuvent être attribués uniquement au changement d’humidité plutôt qu’au changement de température ou non.
Comprendre le mécanisme neuronal sous-jacent aux comportements collectifs chez les animaux est un nouveau défi dans le domaine de la biologie. Les comportements collectifs conduisent à l’émergence d’une nouvelle fonction qui n’apparaît pas au niveau individuel. Comme les animaux ont un système nerveux, ils ont une mémoire et des capacités d’apprentissage, et il est intrigant d’examiner les différences dans ces fonctions neuronales aux niveaux individuel et de la population. Il a été noté que les comportements collectifs améliorent la sensibilité de détection des organismes étrangers et des proies et améliorent la capacité de prendre des décisions correctes 21,22,23. C. elegans a également un système nerveux composé de 302 neurones et mémorise ainsi la température de culture passée24 et migre vers un endroit où l’humidité est préférable25. Ainsi, il serait intéressant d’étudier la relation entre les fonctions neuronales et les comportements collectifs chez C. elegans. De plus, on peut s’attendre à extraire des paramètres mécaniques en observant le comportement d’une population de vers. Par exemple, l’observation des propriétés viscoélastiques dans les foules de C. elegans permettrait d’estimer l’élasticité d’un seul ver et la tension superficielle entre les vers. La distribution granulométrique des touffes de vers doit être liée à la tension superficielle entre elles. La force propulsive de l’individu C. elegans peut également être estimée à partir de la fréquence à laquelle le ver se déplace en réponse à la tension superficielle. Ainsi, nous pouvons nous attendre à estimer les paramètres mécaniques au niveau des vers individuels en nous basant uniquement sur les informations macroscopiques de la population de vers.
En conclusion, la physique de la matière active vise à identifier des descriptions unifiées de comportements collectifs, et ce domaine nécessite une vérification plus expérimentale des modèles mathématiques proposés en contrôlant les paramètres. De plus, la signification fonctionnelle de la formation collective de chaque animal et sa pertinence mécanique pour les fonctions neuronales sont d’importantes questions ouvertes. De plus, étant donné que l’un des objectifs de la « robotique douce » est le contrôle précis de collectifs de robots, nous espérons qu’un algorithme pourra être établi à travers les expériences des comportements collectifs des vers pour l’appliquer au contrôle des mouvements collectifs des robots mous.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions le Caenorhabditis Genetics Center d’avoir fourni les souches utilisées dans cette étude. Cette publication a été soutenue par la subvention JSPS KAKENHI pour la recherche scientifique (B) (numéro de subvention JP21H02532), la subvention JSPS KAKENHI pour le projet Innovative Areas « Science of Soft Robot » (numéro de subvention JP18H05474), la subvention JSPS KAKENHI pour les domaines de recherche transformatrice B (numéro de subvention JP23H03845), le PRIME de l’Agence japonaise pour la recherche et le développement médicaux (numéro de subvention JP22gm6110022h9904), le programme JST-Mirai (numéro de subvention JPMJMI22G3), et le programme JST-FOREST (numéro de subvention JPMJFR214R).
matériels
| Name | Company | Catalog Number | Comments |
| Escherichia coli and C. elegans strains | |||
| E. coli OP50 | Caenorhabditis Genetics Center | OP50 | Food for C. elegans. Uracil auxotroph. E. coli B. |
| lite-1(ce314); ljIs123[mec-4p::ChR2, unc-122p::RFP] | author | ZX899 | lite-1(ce314) mutant carrying the genes expressing ChR2 and RFP under the control of the mec-4 and unc-122 promoter, respectively |
| N2 Bristrol | Caenorhabditis Genetics Center | Wild-type C. elegans strain | |
| For worm cultivation | |||
| Agar purified, powder | Nakarai tesque | 01162-15 | For preparation of NGM plates |
| All-trans retinal | Sigma-Aldrich | R2500 | For optogenetics |
| Bacto pepton | Becton Dickinson | 211677 | For preparation of NGM plates |
| Calcium chloride | Wako | 036-00485 | For preparation of NGM plates |
| Cholesterol | Wako | 034-03002 | For preparation of NGM plates |
| di-Photassium hydrogenphosphate | Nakarai tesque | 28727-95 | For preparation of NGM plates |
| Dog food | Nihon Pet Food | VITA-ONE | For preparation of dog food agar medium |
| LB broth, Lennox | Nakarai tesque | 20066-95 | For culture of E. coli OP50 |
| Magnesium sulfate anhydrous | TGI | M1890 | For preparation of NGM plates |
| Petri dishes (60 mm) | Nunc | 150270 | For preparation of NGM plates |
| Potassium Dihydrogenphosphate | Nakarai tesque | 28720-65 | For preparation of NGM plates |
| Sodium Chloride | Nakarai tesque | 31320-05 | For preparation of NGM plates |
| Observation | |||
| Computer | CT solution | CS6229 | Windows10 Pro with Intel Xeon Gold 6238R CPU and 768 GB of RAM |
| CMOS Camera | Hamamatsu photonics | ORCA-Lightning C14120-20P | For data acquisition |
| CMOS Camera | Olympus | DP74 | For data acquisition |
| Microscope with SZX-MGFP set | Olympus | MVX10 | For data acquisition |
| x2 Objective lens | Olympus | MV PLAPO 2XC | Working distance 20 mm and numerical aperture 0.5 |
| Shutter control | |||
| Shutter | OptoSigma | BSH2-RIX | For controlling temporal pattern of light illumination |
| Shutter controller | OptoSigma | SSH-C2B-A | For controlling temporal pattern of light illumination |
| Temperature control | |||
| Peltier temperature controller unit | VICS | WLVPU-30 | For controlling humidity inside a Petri plate |
| UNI-THEMO CONTROLLER | Ampere | UTC-100 | For controlling humidity inside a Petri plate |
| Data acquisition software | |||
| HCImage | Hamamatsu photonics | For data acquisition |
Références
- Vicsek, T., Czirók, A., Ben-Jacob, E., Cohen, I., Shochet, O. Novel type of phase transition in a system of self-driven particles. Physical Review Letters. 75 (6), 1226-1229 (1995).
- Nishiguchi, D., Nagai, K. H., Chaté, H., Sano, M. Long-range nematic order and anomalous fluctuations in suspensions of swimming filamentous bacteria. Physical Review E. 95 (2), 020601-020606 (2017).
- Saw, T. B., et al. Topological defects in epithelia govern cell death and extrusion. Nature. 544 (7649), 212-216 (2017).
- Kawaguchi, K., Kageyama, R., Sano, M. Topological defects control collective dynamics in neural progenitor cell cultures. Nature. 545 (7654), 327-331 (2017).
- Chen, C., Liu, S., Shi, X., Chaté, H., Wu, Y. Weak synchronization and large-scale collective oscillation in dense bacterial suspensions. Nature. 542 (7640), 210-214 (2017).
- Bricard, A., Caussin, J. -. B., Desreumaux, N., Dauchot, O., Bartolo, D. Emergence of macroscopic directed motion in populations of motile colloids. Nature. 503 (7474), 95-98 (2013).
- Sumino, Y., et al. Large-scale vortex lattice emerging from collectively moving microtubules. Nature. 483 (7390), 448-452 (2012).
- Schaller, V., Weber, C., Semmrich, C., Frey, E., Bausch, A. R. Polar patterns of driven filaments. Nature. 467 (7311), 73-77 (2010).
- Lin, A., et al. Imaging whole-brain activity to understand behaviour. Nature Reviews Physics. 4 (5), 292-305 (2022).
- Sugi, T., Ito, H., Nishimura, M., Nagai, K. H. C. elegans collectively forms dynamical networks. Nature Communications. 10 (1), 1-9 (2019).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nature Methods. 8 (2), 153-158 (2011).
- Tanaka, R., Okumura, E., Yoshiga, T. A simple method to collect phoretically active dauer larvae of Caenorhabditis japonica. Nematological Research. 40 (1), 7-12 (2010).
- Hara, A. H., Lindegren, J. E., Kaya, H. K. Monoxenic mass production of the entomogenous nematode Neoaplectana carpocapsae. Weiser on dog food/agar medium. 16, 1-8 (1981).
- de Bono, M., Bargmann, C. I. Natural variation in a neuropeptide Y receptor homolog modifies social behavior and food response in C. elegans. Cell. 94 (5), 679-689 (1998).
- Artyukhin, A. B., Yim, J. J., Cheong, M. C., Avery, L. Starvation-induced collective behavior in C. elegans. Scientific Reports. 5, 10647 (2015).
- Ding, S. S., Schumacher, L. J., Javer, A. E., Endres, R. G., Brown, A. E. Shared behavioral mechanisms underlie C. elegans aggregation and swarming. eLife. 8, 1181 (2019).
- Chen, Y., Ferrell, J. E. C. elegans colony formation as a condensation phenomenon. Nature Communications. 12 (1), 4947 (2021).
- Chiba, T., et al. Caenorhabditis elegans transfers across a gap under an electric field as dispersal behavior. Current Biology. 33 (13), 2668-2677 (2023).
- Ioannou, C. C., Guttal, V., Couzin, I. D. Predatory fish select for coordinated collective motion in virtual prey. Science. 337 (6099), 1212-1215 (2012).
- Couzin, I. D., Krause, J., Franks, N. R., Levin, S. A. Effective leadership and decision-making in animal groups on the move. Nature. 433 (7025), 513-516 (2005).
- Sumpter, D. J. T., Krause, J., James, R., Couzin, I. D., Ward, A. J. W. Consensus decision making by fish. Current Biology: CB. 18 (22), 1773-1777 (2008).
- Sugi, T., Nishida, Y., Mori, I. Regulation of behavioral plasticity by systemic temperature signaling in Caenorhabditis elegans. Nature Neuroscience. 14 (8), 984-992 (2011).
- Russell, J., Vidal-Gadea, A. G., Makay, A., Lanam, C., Pierce-Shimomura, J. T. Humidity sensation requires both mechanosensory and thermosensory pathways in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8269-8274 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon