Method Article
Die großflächige Kultivierung von Nematoden, um ihr kollektives Verhalten zu untersuchen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier wird über ein System zur Untersuchung des kollektiven Verhaltens von Nematoden berichtet, indem sie in großen Mengen mit Hundefutter-Agar-Medium kultiviert werden. Dieses System ermöglicht es Forschern, eine große Anzahl von Dauerwürmern zu vermehren und kann auf Caenorhabditis elegans und andere verwandte Arten angewendet werden.
Zusammenfassung
Tiere zeigen dynamische kollektive Verhaltensweisen, wie sie in Vogelschwärmen, Fischschwärmen und Menschenmassen beobachtet werden. Das kollektive Verhalten von Tieren wurde sowohl in der Biologie als auch in der Physik untersucht. Im Labor verwenden die Forscher seit etwa einem Jahrhundert verschiedene Modelltiere wie die Fruchtfliege und den Zebrafisch, aber es ist nach wie vor eine große Herausforderung, das komplexe kollektive Verhalten dieser genetisch manipulierbaren Modelltiere zu untersuchen. In diesem Artikel wird ein Protokoll vorgestellt, um ein experimentelles System kollektiver Verhaltensweisen bei Caenorhabditis elegans zu erstellen. Die vermehrten Würmer klettern auf den Deckel der Petriplatte und zeigen ein kollektives Schwarmverhalten. Das System steuert auch die Interaktionen und das Verhalten von Würmern, indem es die Luftfeuchtigkeit und die Lichtstimulation ändert. Dieses System ermöglicht es uns, die Mechanismen zu untersuchen, die kollektivem Verhalten zugrunde liegen, indem wir die Umweltbedingungen ändern und die Auswirkungen der Fortbewegung auf individueller Ebene auf kollektives Verhalten mit Hilfe von Mutanten untersuchen. Daher ist das System sowohl für die zukünftige Forschung in der Physik als auch in der Biologie nützlich.
Einleitung
Sowohl Nichtwissenschaftler als auch Wissenschaftler sind fasziniert vom kollektiven Verhalten von Tieren, wie z. B. in Vogelschwärmen und Fischschwärmen. Kollektive Verhaltensweisen wurden in einer Vielzahl von Bereichen analysiert, darunter Physik, Biologie, Mathematik und Robotik. Insbesondere die Physik der aktiven Materie ist ein wachsendes Forschungsgebiet, das sich auf Systeme konzentriert, die aus selbstfahrenden Elementen bestehen, dh dissipativen Systemen, wie Vogelschwärmen, Fischschwärmen, Biofilmen beweglicher Bakterien, Zytoskeletten, die aus aktiven Molekülen bestehen, und Gruppen von selbstfahrenden Kolloiden. Die Theorie der aktiven Materiephysik behauptet, dass, egal wie komplex das Verhalten von Individuen ist, die kollektiven Bewegungen einer enormen Anzahl von Lebewesen von einer kleinen Anzahl einfacher Regeln bestimmt werden. Zum Beispiel sagt das Vicsek-Modell, ein Kandidat für eine einheitliche Beschreibung der kollektiven Bewegung von selbstfahrenden Teilchen, voraus, dass eine Nahbereichsausrichtungsinteraktion von sich bewegenden Objekten erforderlich ist, um eine langreichweitige geordnete Phase mit exzentrischen Fluktuationen in 2D zu bilden, wie in Tierherden1. Experimentelle Top-down-Ansätze zur Physik der aktiven Materie entwickeln sich rasant. Frühere Experimente bestätigten die Bildung einer langreichweitigen geordneten Phase in Escherichiacoli 2. Andere neuere Arbeiten verwendeten Zellen 3,4, Bakterien5, bewegliche Kolloide6 oder bewegliche Proteine 7,8. Einfache Minimalmodelle wie das Vicsek-Modell beschrieben diese realen Phänomene erfolgreich. Im Gegensatz zu diesen einzelligen Versuchssystemen werden kollektive Verhaltensweisen von Tieren in der Regel in freier Wildbahn beobachtet, da niemand hoffen konnte, kontrollierte Experimente mit 10.000 echten Vögeln oder Fischen durchzuführen.
Biologen teilen das gleiche Interesse wie Physiker: wie Individuen miteinander interagieren und sich funktional als Gruppe verhalten. Eines der traditionellen Forschungsfelder zur Analyse des individuellen Verhaltens sind die Neurowissenschaften, in denen die Mechanismen, die dem Verhalten zugrunde liegen, auf neuronaler und molekularer Ebene untersucht wurden. Bisher wurden viele neurowissenschaftliche Bottom-up-Ansätze entwickelt. Top-down-Ansätze in der Physik und Bottom-up-Ansätze in der Biologie können anhand von Modelltieren wie der Fruchtfliege, dem Wurm Caenorhabditis elegans und der Maus ermöglicht werden9. Es gab jedoch nur wenige Erkenntnisse über das großräumige kollektive Verhalten dieser Modelltiere im Labor10; Noch ist es schwierig, genetisch manipulierbare Modelltiere im großen Maßstab im Labor herzustellen. Daher war es in der aktuellen Forschung zu kollektivem Verhalten in Biologie und Physik für Wissenschaftler, die normalerweise im Labor forschen, schwierig, das kollektive Verhalten von Tieren zu untersuchen.
In dieser Studie haben wir eine Methode für die großflächige Kultivierung von Nematoden etabliert, um ihr kollektives Verhalten zu untersuchen. Dieses System ermöglicht es uns, Umweltbedingungen zu verändern und die Auswirkungen der Fortbewegung auf individueller Ebene auf kollektives Verhalten mit Hilfe von Mutantenzu untersuchen 10. In der Physik der aktiven Materie können die Parameter des mathematischen Modells sowohl in Experimenten als auch in Simulationen gesteuert werden, was die Überprüfung dieses Modells ermöglicht, um einheitliche Beschreibungen zu identifizieren. Die Genetik wird verwendet, um den neuronalen Schaltkreismechanismus zu verstehen, der dem kollektiven Verhalten zugrunde liegt11.
Protokoll
1. Vorbereitung von Würmern
HINWEIS: Bereiten Sie den Wildtyp-N2-Bristol-Stamm12 und den ZX899-Stamm (lite-1(ce314); ljIs123[mec-4p::ChR2, unc-122p::RFP])13 für die Beobachtung kollektiver Verhaltensweisen bzw. optogenetischer Experimente vor. Pflegen Sie den ZX899-Stamm unter dunklen Bedingungen.
- Legen Sie vier gut genährte erwachsene Würmer auf eine 60-mm-Platte mit 14 ml Nematodenwachstumsmedium (NGM) mit Agar und besiedelt mit E. coli OP5012.
- Züchten Sie F1-Würmer 7 Tage lang in der NGM-Platte bei 23 °C bis zum Verhungern. Die Ausbeute an F1-Schnecken beträgt zu diesem Zeitpunkt etwa 100 Schnecken/Platte. Die Stadien der Würmer umfassen eine gemischte Population von Dauer- und ausgehungerten L1-Larven.
2. Zubereitung von Hundefutter-Agar (DFA) Mittelplatten
- Autoklavieren Sie eine Glasflasche mit 2 g Hundefutterpulver und 5 ml 1% Agarmedium und kühlen Sie sie auf Raumtemperatur ab (Abbildung 1A).
HINWEIS: In diesem Experiment können andere Hundefutter verschiedener Hersteller verwendet werden.
3. Inokulation von Würmern auf DFA-Mediumplatten
- Übertragen Sie kleine Mengen (ca. 0,5 g) DFA-Medium auf die Mitte einer NGM-Platte, die mit E. coli OP50 besiedelt ist (Abbildung 1B). Für optogenetische Experimente gießen Sie vor der Inokulation von Würmern 40 μl 50 μM all-trans-Retinal, den Cofaktor von Kanal Rhodopsin 2, auf die DFA.
- Sammeln Sie die ausgehungerten Würmer von vier NGM-Platten mit autoklaviertem Wasser.
- Legen Sie ein kleines Fragment des Hundefutters (ca. 0,5 g) ca. 2 mm vom Tellerdeckel entfernt auf das DFA-Medium.
- Beleuchten Sie die NGM-Platte 15 Minuten lang mit ultraviolettem Licht in einer sauberen Bank, um eine Kontamination zu vermeiden.
- Die gesammelten Würmer (ca. 400 Würmer) auf dem DFA-Medium auf NGM-Platten impfen. Verschließen Sie die Platte nicht mit Parafilm, um zu vermeiden, dass die Luftfeuchtigkeit in der Petriplatte erhöht wird und Wassertropfen entstehen, die Würmer auf einem Deckel einfangen.
- Vermehren Sie die Würmer bei 23 °C und lassen Sie sie ca. 10-14 Tage bis zum Tellerdeckel klettern.
HINWEIS: Da die Anzahl der Würmer auf den Deckeln nach 10-14 Tagen kaum zunahm, wurde vermutet, dass den Würmern wahrscheinlich das Futter ausgegangen war.
4. Beobachtung des kollektiven Verhaltens
- Legen Sie am Tag des Experiments eine neue NGM-Platte, die kein E. coli und Hundefutter-Agar-Medium enthielt, auf eine Aluminiumplatte auf dem Tisch eines Makro-Zoom-Mikroskops (Abbildung 2A). Halten Sie den Boden dieser neuen NGM-Platte mit einem Peltier-Temperaturregler mindestens 5 Minuten lang bei 23 °C (Abbildung 2B). Ersetzen Sie dann den Deckel dieser neuen NGM-Platte durch den Deckel der Platte, auf die die Würmer geklettert sind. Verwenden Sie die Objektivlinse (x2, NA = 0,5) als Objektiv mit geringer Vergrößerung (Abbildung 2A).
- Erhöhen Sie die Temperatur am Boden der Petriplatte von 23 °C auf 26 °C, um die Luftfeuchtigkeit in dieser Platte zu verändern (Abbildung 2).
- Nehmen Sie Bilder der Innenfläche des Plattendeckels mit der Kamera bei 20 Bildern s−1 auf (Ergänzendes Video S1).
- Speichern Sie die erfassten Bilder im Format Tagged Image File.
5. Optogenetisches Experiment
- Verwenden Sie eine 100-W-Quecksilberlampe, um blaues Licht zu liefern, das mit einem Filterset gefiltert wird. Steuern Sie die Beleuchtungszeit präzise mit einem elektromagnetischen Verschlusssystem (Abbildung 2B).
- Lassen Sie den ZX899 unter diesen Bedingungen 5 Minuten lang auf DFA, bevor Sie mit blauem Licht aufleuchten.
- Beleuchten Sie ZX899-Würmer, die am Deckel einer Petriplatte auf dem Mikroskoptisch bei 23 °C befestigt sind.
- Nehmen Sie Bilder der Innenfläche des Plattendeckels mit einer Kamera bei 20 Bildern s−1 auf (Ergänzendes Video S2).
Ergebnisse
Hier wurden Wildtyp-Dauerwürmer für kollektive Verhaltensbeobachtungen verwendet. Die Würmer wurden bei 23 °C für ca. 10-14 Tage kultiviert und kletterten bis zur Innenfläche des Deckels einer DFA-Mediumplatte. Am Versuchstag wurde nur der Deckel auf eine neue NGM-Platte ohne E. coli und DFA-Medium übertragen. Der Boden dieser Petriplatte wurde zunächst mit dem Peltier-System auf 23 °C gehalten und dann auf 26 °C erhöht. Ein Film wurde unter dem Mikroskop aufgenommen. Abbildung 3 zeigt Schnappschüsse des Films. Würmer modellierten ihre Netzwerkmuster dynamisch um, wenn sich die Luftfeuchtigkeit änderte. Mit zunehmender Luftfeuchtigkeit werden auch die Kammergrößen des Netzwerks größer. Schließlich brachen die Netzwerke zusammen, und ruhende Wurmcluster blieben auf der Innenfläche des Deckels zurück.

Abbildung 1: Fotos von DFA-Medium zur Kultivierung einer großen Anzahl von Würmern. (A) Foto von DFA-Medium, das in einer Glasflasche zubereitet wurde. (B) Foto der NGM-Platte mit DFA-Medium kurz nach der Inokulation der gesammelten Würmer. Abkürzungen: DFA = Hundefutter-Agar; NGM = Nematoden-Wachstumsmedium. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Experimentelles System zur Beobachtung kollektiven Verhaltens. (A) Mikroskopie zur Beobachtung kollektiven Verhaltens. (B) Mechanischer Rollladenregler und Temperaturregelungssystem mit dem Peltier-System. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
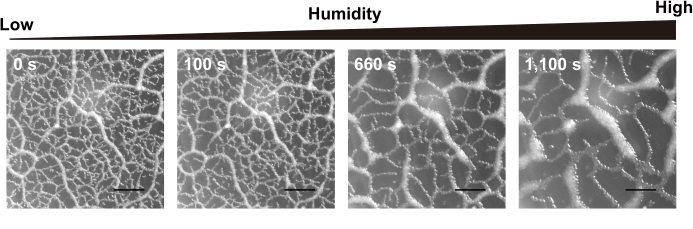
Abbildung 3: Repräsentative Daten der Abhängigkeit des kollektiven Netzwerkmusters von der Luftfeuchtigkeit. Abhängigkeit des C . elegans-Netzwerks von der Umgebungsfeuchte. Die Bildrate der Kamera beträgt 1 fps. Maßstabsleiste = 4 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzungsvideo S1: Kollektive Netzwerkbildungen. Wildtyp-Dauerwürmer wurden mit DFA auf NGM in einer Petriplatte vermehrt. Die Würmer organisierten sich selbst im Deckel. Die Luftfeuchtigkeit wurde mit einem Peltier-Gerät verändert. Die Bilder wurden von oberhalb des Deckels aufgenommen. Der Film wird 80-mal schneller abgespielt als die Echtzeit-Aufnahmerate. Abkürzungen: DFA = Hundefutter-Agar; NGM = Nematoden-Wachstumsmedium. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video S2: Optogenetische Manipulation von Wurmkollektiven. Die Optogenetik wurde mit 1, 2, 4, 8, 32 und 128 s Blaulichtbeleuchtung durchgeführt. Diese Aktivierung verursachte zunächst die Baumbildung und den Zusammenbruch von Bündeln. Schließlich wurde ein Netzwerk gebildet, das sich von der ursprünglichen Struktur unterscheidet. Der Film wird 20-mal schneller abgespielt als die Echtzeit-Aufnahmerate. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In dieser Studie zeigen wir ein Protokoll zur Vorbereitung eines Systems für das großräumige kollektive Verhalten von C. elegans im Labor. Die DFA-basierte Methode wurde ursprünglich mit Caenorhabditis japonica14 und Neoaplectana carpocapsae Weiser15 etabliert, die beide keine Modelltiere sind. Diese Methode wurde jedoch nicht angewendet, um kollektive Verhaltensweisen zu untersuchen. Der C. elegans ist ein genetisch manipulierbares Modelltier11,12. Verhaltensgenetische Studien mit C. elegans haben zur Untersuchung der Verhaltensforschung auf individueller Ebene beigetragen. In der langen Geschichte der C. elegans-Forschung wurde jedoch zwar ein einfaches Verklumpungsmuster beobachtet 16,17,18,19, aber keine Berichte haben eine dynamische Musterbildung über das Verhalten von C. elegans auf Gruppenebene gezeigt. Eine Schlüsselidee dieser Studie ist die Verwendung von DFA-Medium, um die Aufrechterhaltung einer großen Anzahl von Würmern über einen langen Zeitraum in einer Petriplatte zu erleichtern. Mit Hilfe des DFA-Mediums präsentieren wir die Beobachtung des dynamischen kollektiven Verhaltens von C. elegans und führen damit ein neues Verhaltensparadigma ein.
Zuvor wurde über mehrere Massenproduktionsmethoden für Würmer berichtet. Im Vergleich zu diesen Methoden besteht der Vorteil dieser Methode darin, dass sie die Untersuchung des kollektiven Verhaltens auf einem Deckel ohne ein Verfahren zur Isolierung von Dauerwürmern ermöglicht. Kürzlich veröffentlichten wir eine Arbeit, in der wir über die Übertragung von Nickwürmern über einen Spalt zwischen einem Deckel und DFA-Medium unter Verwendung elektrostatischer Wechselwirkungen mit dem Deckelberichteten 20. Diese Wurmübertragung tritt auf, wenn Würmer eine Nicksäule bilden, die aus etwa 100 Würmern besteht. Diese Studie zeigt, dass nur Dauerwürmer übertragen werden können, wenn Dauerbildungen durch zu viel Engstand in DFA induziert werden. Die Anzahl der Würmer, die mit dieser Methode hergestellt werden, ist wahrscheinlich geringer als bei anderen Methoden, wie z. B. Methoden auf Eigelbbasis. Um jedoch einen Verhaltenstest an einem Deckel durchzuführen, können wir die Population der Dauerwürmer verwenden, zu denen kaum andere Stadienwürmer wie ausgehungerte L1-Larven gehören, während bisherige Methoden ein Verfahren zur Isolierung von Dauerwürmern erfordern. Somit ermöglicht diese Methode eine genauere kollektive Verhaltensuntersuchung mit Hilfe von Dauerwürmern. Darüber hinaus kann der Experimentator im folgenden Verfahren auch die Dichte der Würmer kontrollieren. Zuerst wurde autoklaviertes Wasser verwendet, um die Würmer, die sich zum Deckel bewegten, zu sammeln und zu waschen. Dann wurde die Konzentration der Würmer in Wasser bestimmt, indem die Würmer in einem Aliquot der Wurmsuspension gezählt wurden, und die Wurmsuspension wurde auf ein Substrat getropft. Zusammengenommen ist unser System in Bezug auf das Wurmstadium und die Dichte für Verhaltensexperimente besser kontrollierbar.
Kollektives Verhalten wurde aus der Perspektive der Physik der aktiven Materie analysiert, die versucht, einheitliche Beschreibungen der kollektiven Bewegungen lebender und nicht lebender selbstangetriebener Teilchen zu identifizieren. Um dieses Ziel zu erreichen, wurden viele experimentelle Systeme für nicht lebende selbstfahrende Partikel und Zellen entwickelt, aber weniger Systeme für mehrzellige Organismen, die viel komplexere Verhaltensweisen auf der Grundlage des neuronalen Schaltkreises zeigen. Daher erweitert unser System die Möglichkeit, dass die einheitliche Beschreibung kollektiver Bewegungen existiert. In Bezug auf die Feuchtigkeitsmanipulation deutete unsere frühere numerische Simulation auf der Grundlage eines Modells darauf hin, dass Anziehungskräfte zwischen Würmern, die wahrscheinlich durch Feuchtigkeit im Experiment induziert wurden, Musteränderungen induzieren, die qualitativ mit feuchtigkeitsinduzierten Musteränderungen übereinstimmten10. Wir glauben jedoch, dass es keine deterministischen experimentellen Beweise gibt, die zeigen, dass Musteränderungen eher durch Feuchtigkeit als durch Temperatur induziert wurden. Daher sollte der Experimentator vorsichtig sein, ob die kollektiven Verhaltensänderungen ausschließlich auf die Feuchtigkeitsänderung und nicht auf die Temperaturänderung zurückzuführen sind oder nicht.
Das Verständnis des neuronalen Mechanismus, der dem kollektiven Verhalten bei Tieren zugrunde liegt, ist eine neue Herausforderung auf dem Gebiet der Biologie. Kollektive Verhaltensweisen führen zur Entstehung einer neuen Funktion, die auf individueller Ebene nicht auftritt. Da Tiere ein Nervensystem haben, verfügen sie über Gedächtnis- und Lernfähigkeiten, und es ist faszinierend, die Unterschiede in diesen neuronalen Funktionen auf individueller und Populationsebene zu untersuchen. Es wurde festgestellt, dass kollektives Verhalten die Erkennungsempfindlichkeit für fremde Organismen und Beute verbessert und die Fähigkeit zur korrekten Entscheidungsfindung verbessert 21,22,23. C. elegans hat auch ein Nervensystem, das aus 302 Neuronen besteht, und merkt sich dadurch die vergangene Kultivierungstemperatur24 und wandert an einen Ort mit bevorzugter Luftfeuchtigkeit25. Daher wäre es interessant, die Beziehung zwischen neuronalen Funktionen und kollektivem Verhalten bei C. elegans zu untersuchen. Darüber hinaus kann man erwarten, mechanische Parameter durch Beobachtung des Verhaltens einer Wurmpopulation zu extrahieren. Die Beobachtung der viskoelastischen Eigenschaften in C. elegans-Crowds würde es beispielsweise ermöglichen, die Elastizität eines einzelnen Wurms und die Oberflächenspannung zwischen Würmern abzuschätzen. Die Größenverteilung von Wurmklumpen sollte sich auf die Oberflächenspannung zwischen ihnen beziehen. Die Vortriebskraft des C. elegans-Individuums kann auch aus der Frequenz abgeschätzt werden, mit der sich der Wurm als Reaktion auf die Oberflächenspannung bewegt. Daher können wir erwarten, mechanische Parameter auf der Ebene einzelner Würmer nur auf der Grundlage makroskopischer Informationen der Wurmpopulation abzuschätzen.
Zusammenfassend lässt sich sagen, dass die Physik der aktiven Materie darauf abzielt, einheitliche Beschreibungen kollektiven Verhaltens zu identifizieren, und dieses Gebiet erfordert eine experimentellere Überprüfung der vorgeschlagenen mathematischen Modelle durch die Kontrolle von Parametern. Darüber hinaus sind die funktionelle Bedeutung der kollektiven Musterbildung jedes Tieres und seine mechanische Relevanz für neuronale Funktionen wichtige offene Fragen. Da eines der Ziele der "weichen Robotik" die präzise Steuerung von Roboterkollektiven ist, hoffen wir, dass durch die Experimente des kollektiven Verhaltens von Würmern ein Algorithmus etabliert werden kann, der auf die Steuerung der kollektiven Bewegungen von weichen Robotern angewendet werden kann.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken dem Caenorhabditis Genetics Center für die Bereitstellung der in dieser Studie verwendeten Stämme. Diese Veröffentlichung wurde unterstützt durch JSPS KAKENHI Grant-in-Aid for Scientific Research (B) (Fördernummer JP21H02532), JSPS KAKENHI Grant-in-Aid für das Projekt Innovative Areas "Science of Soft Robot" (Fördernummer JP18H05474), JSPS KAKENHI Grant-in-Aid for Transformative Research Areas B (Fördernummer JP23H03845), PRIME der Japan Agency for Medical Research and Development (Fördernummer JP22gm6110022h9904), JST-Mirai-Programm (Fördernummer JPMJMI22G3), und JST-FOREST-Programm (Fördernummer JPMJFR214R).
Materialien
| Name | Company | Catalog Number | Comments |
| Escherichia coli and C. elegans strains | |||
| E. coli OP50 | Caenorhabditis Genetics Center | OP50 | Food for C. elegans. Uracil auxotroph. E. coli B. |
| lite-1(ce314); ljIs123[mec-4p::ChR2, unc-122p::RFP] | author | ZX899 | lite-1(ce314) mutant carrying the genes expressing ChR2 and RFP under the control of the mec-4 and unc-122 promoter, respectively |
| N2 Bristrol | Caenorhabditis Genetics Center | Wild-type C. elegans strain | |
| For worm cultivation | |||
| Agar purified, powder | Nakarai tesque | 01162-15 | For preparation of NGM plates |
| All-trans retinal | Sigma-Aldrich | R2500 | For optogenetics |
| Bacto pepton | Becton Dickinson | 211677 | For preparation of NGM plates |
| Calcium chloride | Wako | 036-00485 | For preparation of NGM plates |
| Cholesterol | Wako | 034-03002 | For preparation of NGM plates |
| di-Photassium hydrogenphosphate | Nakarai tesque | 28727-95 | For preparation of NGM plates |
| Dog food | Nihon Pet Food | VITA-ONE | For preparation of dog food agar medium |
| LB broth, Lennox | Nakarai tesque | 20066-95 | For culture of E. coli OP50 |
| Magnesium sulfate anhydrous | TGI | M1890 | For preparation of NGM plates |
| Petri dishes (60 mm) | Nunc | 150270 | For preparation of NGM plates |
| Potassium Dihydrogenphosphate | Nakarai tesque | 28720-65 | For preparation of NGM plates |
| Sodium Chloride | Nakarai tesque | 31320-05 | For preparation of NGM plates |
| Observation | |||
| Computer | CT solution | CS6229 | Windows10 Pro with Intel Xeon Gold 6238R CPU and 768 GB of RAM |
| CMOS Camera | Hamamatsu photonics | ORCA-Lightning C14120-20P | For data acquisition |
| CMOS Camera | Olympus | DP74 | For data acquisition |
| Microscope with SZX-MGFP set | Olympus | MVX10 | For data acquisition |
| x2 Objective lens | Olympus | MV PLAPO 2XC | Working distance 20 mm and numerical aperture 0.5 |
| Shutter control | |||
| Shutter | OptoSigma | BSH2-RIX | For controlling temporal pattern of light illumination |
| Shutter controller | OptoSigma | SSH-C2B-A | For controlling temporal pattern of light illumination |
| Temperature control | |||
| Peltier temperature controller unit | VICS | WLVPU-30 | For controlling humidity inside a Petri plate |
| UNI-THEMO CONTROLLER | Ampere | UTC-100 | For controlling humidity inside a Petri plate |
| Data acquisition software | |||
| HCImage | Hamamatsu photonics | For data acquisition |
Referenzen
- Vicsek, T., Czirók, A., Ben-Jacob, E., Cohen, I., Shochet, O. Novel type of phase transition in a system of self-driven particles. Physical Review Letters. 75 (6), 1226-1229 (1995).
- Nishiguchi, D., Nagai, K. H., Chaté, H., Sano, M. Long-range nematic order and anomalous fluctuations in suspensions of swimming filamentous bacteria. Physical Review E. 95 (2), 020601-020606 (2017).
- Saw, T. B., et al. Topological defects in epithelia govern cell death and extrusion. Nature. 544 (7649), 212-216 (2017).
- Kawaguchi, K., Kageyama, R., Sano, M. Topological defects control collective dynamics in neural progenitor cell cultures. Nature. 545 (7654), 327-331 (2017).
- Chen, C., Liu, S., Shi, X., Chaté, H., Wu, Y. Weak synchronization and large-scale collective oscillation in dense bacterial suspensions. Nature. 542 (7640), 210-214 (2017).
- Bricard, A., Caussin, J. -. B., Desreumaux, N., Dauchot, O., Bartolo, D. Emergence of macroscopic directed motion in populations of motile colloids. Nature. 503 (7474), 95-98 (2013).
- Sumino, Y., et al. Large-scale vortex lattice emerging from collectively moving microtubules. Nature. 483 (7390), 448-452 (2012).
- Schaller, V., Weber, C., Semmrich, C., Frey, E., Bausch, A. R. Polar patterns of driven filaments. Nature. 467 (7311), 73-77 (2010).
- Lin, A., et al. Imaging whole-brain activity to understand behaviour. Nature Reviews Physics. 4 (5), 292-305 (2022).
- Sugi, T., Ito, H., Nishimura, M., Nagai, K. H. C. elegans collectively forms dynamical networks. Nature Communications. 10 (1), 1-9 (2019).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nature Methods. 8 (2), 153-158 (2011).
- Tanaka, R., Okumura, E., Yoshiga, T. A simple method to collect phoretically active dauer larvae of Caenorhabditis japonica. Nematological Research. 40 (1), 7-12 (2010).
- Hara, A. H., Lindegren, J. E., Kaya, H. K. Monoxenic mass production of the entomogenous nematode Neoaplectana carpocapsae. Weiser on dog food/agar medium. 16, 1-8 (1981).
- de Bono, M., Bargmann, C. I. Natural variation in a neuropeptide Y receptor homolog modifies social behavior and food response in C. elegans. Cell. 94 (5), 679-689 (1998).
- Artyukhin, A. B., Yim, J. J., Cheong, M. C., Avery, L. Starvation-induced collective behavior in C. elegans. Scientific Reports. 5, 10647 (2015).
- Ding, S. S., Schumacher, L. J., Javer, A. E., Endres, R. G., Brown, A. E. Shared behavioral mechanisms underlie C. elegans aggregation and swarming. eLife. 8, 1181 (2019).
- Chen, Y., Ferrell, J. E. C. elegans colony formation as a condensation phenomenon. Nature Communications. 12 (1), 4947 (2021).
- Chiba, T., et al. Caenorhabditis elegans transfers across a gap under an electric field as dispersal behavior. Current Biology. 33 (13), 2668-2677 (2023).
- Ioannou, C. C., Guttal, V., Couzin, I. D. Predatory fish select for coordinated collective motion in virtual prey. Science. 337 (6099), 1212-1215 (2012).
- Couzin, I. D., Krause, J., Franks, N. R., Levin, S. A. Effective leadership and decision-making in animal groups on the move. Nature. 433 (7025), 513-516 (2005).
- Sumpter, D. J. T., Krause, J., James, R., Couzin, I. D., Ward, A. J. W. Consensus decision making by fish. Current Biology: CB. 18 (22), 1773-1777 (2008).
- Sugi, T., Nishida, Y., Mori, I. Regulation of behavioral plasticity by systemic temperature signaling in Caenorhabditis elegans. Nature Neuroscience. 14 (8), 984-992 (2011).
- Russell, J., Vidal-Gadea, A. G., Makay, A., Lanam, C., Pierce-Shimomura, J. T. Humidity sensation requires both mechanosensory and thermosensory pathways in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8269-8274 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten