Method Article
Manipulation du tuina pour réduire l’inflammation et la perte de cartilage chez les rats souffrant d’arthrose du genou
Dans cet article
Résumé
Nous présentons un protocole de manipulation de Tuina réalisé sur des rats souffrant d’arthrose du genou induite par un plâtre. Sur la base des résultats préliminaires, il a suggéré que l’efficacité de la méthode reposait sur la réduction de l’inflammation et de la perte de cartilage.
Résumé
Les essais cliniques suggèrent que la manipulation du Tuina est efficace dans le traitement de l’arthrose du genou (KOA), tandis que d’autres études sont nécessaires pour découvrir son mécanisme. Par conséquent, la manipulation de modèles animaux d’arthrose du genou est essentielle. Ce protocole fournit un processus standard pour la manipulation du Tuina sur les rats KOA et une exploration préliminaire du mécanisme du Tuina pour le KOA. La méthode de manipulation de la presse et du pétrissage (une sorte de manipulation Tuina qui fait référence au pressage et au pétrissage de la zone spécifique de la surface du corps) est appliquée sur 5 points d’acupuncture autour de l’articulation du genou des rats. La force et la fréquence de la manipulation ont été normalisées par des enregistrements de la pression des doigts, et la position du rat pendant la manipulation est décrite en détail dans le protocole. L’effet de la manipulation peut être mesuré par des tests de comportement à la douleur et des résultats microscopiques dans le synovial et le cartilage. Les rats KOA ont montré une amélioration significative du comportement de la douleur. L’infiltration inflammatoire du tissu synovial a été réduite dans le groupe Tuina, et l’expression du facteur de nécrose tumorale (TNF)-α était significativement plus faible. Par rapport au groupe témoin, l’apoptose des chondrocytes était moindre dans le groupe Tuina. Cette étude fournit un protocole standardisé pour la manipulation du Tuina sur des rats KOA et des preuves préliminaires que les effets thérapeutiques du Tuina peuvent être liés à la réduction de l’inflammation synoviale et à l’apoptose retardée des chondrocytes.
Introduction
L’arthrose du genou (KOA) est une maladie dégénérative qui se manifeste principalement par des douleurs articulaires. La fibrose, la fissuration, l’ulcération et la perte de cartilage articulaire sont les principales causes de cette maladie1. Le KOA a une prévalence élevée et peut avoir un impact profond sur la vie quotidienne des patients, entraînant une invalidité dans les cas graves. Chez les personnes âgées de 45 à 84 ans, la prévalence de KOA augmente avec l’âge, et la prévalence chez les personnes âgées de 85 ans et plus est de 15 %, avec une prédominance chez les femmes 2,3. De plus, le KOA pourrait représenter un lourd fardeau économique à la fois pour l’individu et pour la société. Une enquête a montré que les coûts directs des soins de santé par habitant atteignaient jusqu’à 8 858 $ ± 5 120 $ par an4. Avec le vieillissement de la société, le KOA est devenu un problème de santé mondial et un enjeu sociétal majeur, ainsi qu’un sujet d’actualité pour la recherche scientifique.
Des études fondées sur des preuves ont montré l’efficacité de la manipulation de Tuina dans le traitement du KOA5. La manipulation du Tuina pourrait soulager la douleur et améliorer le dysfonctionnement chez les patients KOA, dont le mécanisme est lié aux effets anti-inflammatoires 6,7. Les chercheurs ont découvert que la manipulation de Tuina inhibait efficacement l’expression des facteurs inflammatoires interleukine (IL)-β et 5-hydroxytryptamine et ralentissait la dégénérescence du cartilage articulaire chez un lapin KOA modèle8. Il a suggéré que Tuina pouvait favoriser la circulation sanguine et le métabolisme au site de la lésion, ce qui a aidé à éliminer les facteurs inflammatoires tels que l’IL-1, l’IL-6 et le facteur de nécrose tumorale (TNF)-α, soulageant ainsi les symptômes cliniques de KOA9. De plus, le mouvement passif de l’articulation par la manipulation du Tuina peut favoriser la pénétration et la diffusion du liquide synovial dans le cartilage articulaire et améliorer le métabolisme des nutriments tissulaires10. D’autres études ont suggéré que la manipulation de Tuina peut améliorer efficacement les indices biomécaniques chez les patients KOA11. Les manipulations appliquées sur les tissus mous peuvent améliorer la répartition du stress sur les membres et améliorer la fonction d’équilibre12,13. Dans le même temps, avec quelques manipulations d’ajustement articulaire, l’alignement des membres inférieurs peut également être ajusté pour corriger les allures anormales14,15.
Le mécanisme d’action de la manipulation du Tuina dans le traitement du KOA reste à explorer, et par conséquent, une étude expérimentale est nécessaire. La clé de l’application du Tuina chez les animaux de laboratoire est la standardisation des méthodes de modélisation, de fixation et d’intervention chez les animaux16. La méthode de modélisation détermine si l’animal de laboratoire peut présenter les caractéristiques de la maladie. Pendant ce temps, des méthodes de fixation appropriées peuvent faciliter l’intervention de la manipulation Tuina et mieux refléter l’effet de Tuina. La standardisation des méthodes d’intervention est la partie la plus difficile de la manipulation du Tuina. En 2010, le système de base des normes d’acupuncture chinoises mentionnait les normes de points d’acupuncture pour les animaux de laboratoire, offrant la possibilité d’opérations d’acupuncture et de Tuina dans l’expérimentation animale17. Cependant, il y a encore des difficultés à normaliser la manipulation du Tuina. Il existe plusieurs types de manipulation de Tuina18. Le choix de la manipulation spécifique dépend principalement de la maladie à traiter et des théories thérapeutiques préférées de l’interprète. Dans l’étude du Tuina pour le KOA, une plus grande attention a été accordée à la manipulation par pression de points (pression sur les points d’acupuncture spécifiques avec le pouce ou le coude), à la manipulation de poussée Yizhichan (une manipulation de poussée en remuant le pouce) et à la manipulation de la presse et du pétrissage (qui fait référence à la pression et au pétrissage de la zone spécifique de la surface du corps par le doigt ou la paume)19. La manipulation par presse et pétrissage est l’une des manipulations les plus utilisées par Tuina, qui combine le pressage et le pétrissage pour déplacer le tissu sous-cutané20. La manipulation de la presse et du pétrissage appliquée sur les points d’acupuncture peut favoriser la circulation sanguine et soulager la douleur et représente l’effet thérapeutique du Tuina sur KOA19.
Dans ce protocole, le fonctionnement de la manipulation de la presse et du pétrissage sur les rats KOA sera décrit en détail, y compris les points d’acupuncture sélectionnés, l’intensité et la fréquence de la manipulation et la position du corps du rat, afin de fournir une référence pour les recherches futures.
Protocole
Cette étude a passé avec succès l’examen de l’éthique animale mené par le comité d’éthique des animaux expérimentaux de l’hôpital Yueyang de médecine traditionnelle chinoise et occidentale intégrée affiliée à l’Université de médecine traditionnelle chinoise de Shanghai (YYLAC-2022-166).
1. Préparation et regroupement d’animaux de laboratoire
- Préparation des animaux
- Élever un total de 10 rats femelles SPF SD en bonne santé de 200-220 g à température ambiante (18-21 °C), humidité 40%-50%, 12 h : 12 h d’alternance du rythme circadien. Mener des expériences sur des animaux liés à la douleur dans le strict respect des dispositions pertinentes des directives et directives éthiques sur les animaux.
- Groupement d’animaux
- Divisez au hasard les rats en deux groupes, le groupe Tuina et le groupe témoin. Traitez les rats du groupe Tuina avec une presse et une manipulation de pétrissage pendant 21 jours après le modelage. Placez les rats du groupe témoin dans la même pièce Tuina et placez-les simultanément dans un sac en tissu noir pendant que le groupe Tuina subit un traitement.
2. Modélisation des animaux
- Anesthésier l’animal
- Utilisez l’isoflurane pour l’anesthésie gazeuse. Placez le rat dans la boîte d’induction avec une concentration d’induction de 3%. Secouez la boîte après avoir couché le rat et confirmez l’anesthésie lorsque le rat se retourne sans tenter de revenir à la position couchée.
- Retirez le rat de la boîte d’induction et fixez son nez dans le masque anesthésique. Ajustez la concentration d’isoflurane à 2 % pour maintenir l’anesthésie. Confirmez l’anesthésie lorsque le rat ne réagit pas lorsqu’il se pince les pattes. Appliquez une pommade oculaire sur les rats pour éviter la sécheresse lorsque les rats sont anesthésiés, car les paupières ne peuvent pas être fermées.
- Méthode de modélisation21
- Utilisez une machine à raser pour enlever les poils du membre postérieur droit. Placez un coton médical entre la cheville droite et l’articulation de la hanche du rat. Fixez uniformément l’articulation droite du genou à l’extension de 180° avec 5 à 6 couches de pansement humide. Enroulez le bandage en spirale en partant de la cheville et en couvrant 1/3 du précédent. Utilisez un sèche-cheveux pour sécher et durcir le plâtre.
- Enveloppez le plâtre avec un matériau de base pour prothèses dentaires une fois que le pansement a séché et durci pour fixer le plâtre et l’empêcher de ronger.
- Mélangez les matériaux de base de la prothèse dentaire pour la rendre collante et faites adhérer le mélange à l’extérieur du pansement (le mélange ne doit pas dépasser le bord du pansement, Figure 1). Une fois que le mélange devient dur, éteignez l’appareil d’anesthésie et attendez que l’animal se réveille naturellement. Surveillez les rats pour éviter les accidents d’anesthésie avant qu’ils ne se réveillent.
- Fixez le pansement de manière appropriée sur la patte arrière droite du rat, car une fixation serrée restreint la circulation sanguine, tandis qu’une fixation lâche a tendance à tomber. Observez la circulation sanguine dans le membre terminal. Si vous détectez un gonflement de l’extrémité terminale ou un teint violet, coupez rapidement une partie du pansement pour aider à rétablir la circulation. Refaites le pansement s’il est cassé et ne parvient pas à maintenir l’extension du membre inférieur.
- Retirez le pansement après 3 semaines d’immobilisation continue. Utilisez des ciseaux chirurgicaux pour couper le matériau de base de la prothèse dentaire à l’extérieur et le pansement plâtré. Rincez le membre inférieur du rat avec du sérum physiologique et séchez-le avec de la gaze. S’il y a des lésions cutanées locales, stériliser avec de l’iodophore.
- Vérification du modèle22
- Vérification par rayons X
- Effectuer une radiographie du genou droit 1 jour après la fin de la modélisation. Prenez des radiographies antéropostérieures en décubitus dorsal avec flexion de la hanche à 30°, extension du genou à 0° et abduction de la hanche à 15°. Gardez la rotule directement devant le genou et placez le tube de radiateur à 110 mm de l’articulation du genou.
- Prenez des radiographies latérales en position de décubitus latéral droit avec la flexion de la hanche droite à 30° et l’extension du genou droit à 0°. Faites la flexion de la hanche du membre gauche à 70° et la flexion du genou à 45°, et placez le tube de radiateur à 110 mm de l’articulation du genou. Réglez les paramètres de détection comme tension d’exposition 50 kV, courant 250 mA, dose d’exposition 32 mAs et temps d’exposition 128 ms.
- Comparez avec la radiographie de rats normaux, vérifiez que la radiographie modélisée du genou montre un espace articulaire plus étroit avec une hyperplasie ostéophyte au bord.
- Société internationale de recherche sur l’arthrose (OARSI) :score de 23
- Placez le rat dans la boîte d’euthanasie et perfusez du CO2 à raison de 30 % à 70 % de volume de cage par minute. Arrêtez de perfuser le CO2 après avoir détecté que le rat est immobile, qu’il ne respire pas et que la pupille est dilatée. Observez pendant encore 2 minutes pour confirmer la mort.
REMARQUE : La luxation cervicale peut être pratiquée après une euthanasie à base de CO2 comme forme secondaire pour confirmer le décès. Fixez le rat sur la table et saisissez sa queue d’une main. Appuyez sur la tête du rat avec le pouce et l’index de l’autre main. Confirmez la mort lorsque vous entendez le bruit d’un craquement, et le rat perd ses mouvements et son rythme cardiaque en même temps. - Fixez le rat en position couchée sur le dos à l’aide d’une aiguille de seringue sur une planche en mousse avec le membre postérieur droit fléchi en abduction et rotation externe. Pincez la peau autour de l’articulation du genou avec des ciseaux chirurgicaux. Exposez les muscles autour de l’articulation du genou en coupant la peau, puis en coupant le fascia sous-cutané.
- Coupez la diaphyse du fémur et du tibia avec des ciseaux à os et retirez l’articulation du genou droit. Retirez délicatement les tissus mous supplémentaires, tels que les muscles et les ligaments, à l’extérieur de l’articulation.
- Fixer le joint dans du paraformaldéhyde à 4 % pendant 24 à 48 h à 4 °C. Détartrer l’articulation dans une solution d’acide formique à 10 % pendant 3 jours jusqu’à ce que le tissu osseux puisse être facilement piqué avec une aiguille.
- Placez et coupez le tissu détartré dans la hotte et transférez-le dans une boîte de déshydratation dans la machine de déshydratation. Ajouter 75 % d’éthanol pendant 4 h, puis 90 % d’éthanol pendant 2 h, puis 95 % d’éthanol pendant 1 h, de l’éthanol absolu pendant 30 min, une autre série d’éthanol absolu frais pendant 30 min, du benzène alcoolique pendant 5 à 10 min, du xylène pendant 5 à 10 min, une autre série de xylène frais pendant 5 à 10 min, de la cire pendant 1 h, une autre série de cire fraîche pendant 1 h, et dernier tour de cire fraîche pendant 1 h pour la déshydratation et l’immersion dans la cire transparente.
- Ensuite, placez le mouchoir dans la machine pour l’enrobage. Coupez le bloc de cire en tranches de cire de 4 μm après la prise de la paraffine et aplatissez la tranche dans de l’eau tiède. Placez la tranche sur une lame de verre et séchez-la. Conservez-le à température ambiante.
- Observez l’échantillon de cartilage et notez-le selon l’évaluation du grade d’histopathologie du cartilage de l’arthrose (tableau 1)23. Si le score des rats après modélisation est significativement plus élevé que celui des rats normaux, la modélisation a réussi.
- Placez le rat dans la boîte d’euthanasie et perfusez du CO2 à raison de 30 % à 70 % de volume de cage par minute. Arrêtez de perfuser le CO2 après avoir détecté que le rat est immobile, qu’il ne respire pas et que la pupille est dilatée. Observez pendant encore 2 minutes pour confirmer la mort.
- Vérification par rayons X
Tableau 1. Évaluation du grade d’histopathologie du cartilage arthrosique. Le grade est la progression de la profondeur dans le cartilage. Note totale = Note x Mise en scène. 0 pour les articulations normales, 24 pour l’arthrite sévère. Veuillez cliquer ici pour télécharger ce tableau.

Graphique 1. Rats immobilisés dans le plâtre. Après l’anesthésie des rats, leurs membres inférieurs droits ont été enveloppés de bandages en plâtre, fixés en position hyperétendue et recouverts d’une couche de matériaux de base de prothèses dentaires à l’extérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Manipulation du tuina
- Domaine d’application
- Sélectionnez un total de 5 points d’acupuncture sur le membre postérieur droit des rats, y compris ST34, ST35, SP10, EX-LE4 et BL40 (Figure 2). Localisez les points d’acupuncture selon les principes de positionnement des points d’acupuncture en 24.
- Position pour l’application
- Découpez un chiffon noir dans un sac de 9 cm x 15 cm avec une ouverture latérale et serrez l’ouverture avec une corde. Avant la manipulation du Tuina, tirez doucement sur la queue du rat pour qu’il s’enfouisse dans le sac et expose ses membres postérieurs à l’extérieur du sac.
- Utilisez une main pour maintenir le rat en position couchée, en tenant sa queue et sa patte arrière pendant que l’autre main applique une pression et une manipulation de pétrissage sur un point d’acupuncture spécifique (Figure 3).
- Manipulation du Tuina
- Opérer la presse et la manipulation du pétrissage sur les 5 points d’acupuncture du membre postérieur droit pendant 2 min chacun. Placez le pouce de l’interprète sur le point d’acupuncture sélectionné pour effectuer une pression rythmique et un pétrissage, en rapprochant la peau et le tissu sous-cutané dans un mouvement circulaire.
- Utilisez des enregistrements de pression des doigts (unités en Newton) pour assurer une intensité et une fréquence constantes de la manipulation. Maintenez l’intensité entre 3 et 5 N et la fréquence à 2 Hz (Figure 4). Appliquez la manipulation une fois par jour pendant 21 jours.

Graphique 2. Position des points d’acupuncture. SP10 est situé à 5 mm au-dessus de l’articulation interne du genou chez le rat. ST34 est situé à 5 mm au-dessus de l’articulation externe du genou chez le rat. EX-LE4 est situé dans la face médiale du ligament du genou chez le rat. ST35 est situé sur la face latérale du ligament du genou chez le rat. BL40 est situé au milieu de la bande poplitée transversale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 3. Manipulation de Tuina appliquée sur des rats. Les rats ont été gardés dans un sac noir avec leurs membres postérieurs exposés. L’interprète tenait la queue du rat avec la main gauche tandis que la main droite effectuait la manipulation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 4. Enregistrements de la pression des doigts. Un appareil qui enregistre la force et la fréquence de la pression des doigts est utilisé pour un retour en temps réel sur l’intensité et la fréquence dans le processus de manipulation du Tuina. (A) Capteur de pression et équipement de transmission. (B) Enregistrements de la pression des doigts. (C) La force enregistrée lors de la manipulation de Tuina. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Tests de comportement à la douleur
- Testez le comportement de la douleur avant et après la modélisation, et à 1 jour après (J1), 7 jours après (J7), 14 jours après (J14) et 21 jours après (J21) la manipulation de Tuina, y compris les tests de seuil de retrait mécanique et de latence de retrait des pattes.
- Seuil de retrait mécanique (MWT)
- Placez les rats dans une cabine en verre trempé transparent de 20 cm x 10 cm x 20 cm située sur une scène de 40 cm de haut qui est constituée d’un treillis métallique d’une taille de 10 mm x 10 mm d’ouverture. Maintenez la température ambiante entre 23 °C ± 2 °C.
- Installer les rats dans le laboratoire comportemental pendant au moins 2 h par jour pendant la phase de test comportemental afin d’éviter toute interférence avec les résultats du test en raison du manque d’adaptation des animaux à l’environnement au début du test formel. Placez les rats dans le laboratoire comportemental pendant 30 minutes avant le début du test formel pour faciliter leur adaptation à l’environnement et réduire les facteurs de distraction.
- Utilisez des fibres électroniques de Von Frey pour mesurer le MWT. Stimulez le rat avec la fibre au centre de son pied et retirez la fibre lorsque le rat montre des mouvements évidents tels que lever la patte et éviter. La machine peut enregistrer automatiquement la valeur de pression maximale (N) à ce moment-là.
- Commencez la stimulation suivante chez le même rat au moins 15 s après la stimulation en cours. Ne pas dépasser 5 s lors de chaque stimulation pour éviter la sensibilisation aux stimuli tactiles dans les pattes des rats. Répétez le test 5 fois jusqu’à ce que la différence entre les trois mesures consécutives soit insignifiante (à moins de 10 N).
- Supprimez les valeurs présentant de grandes différences (les valeurs maximales et minimales) et prenez la moyenne des trois valeurs restantes comme seuil de retrait mécanique.
- Latence de retrait de la patte (PWL)
- Placez les rats dans un petit compartiment en verre trempé transparent d’une taille de 20 cm x 10 cm x 20 cm. Couvrez le haut du compartiment avec un couvercle en verre transparent avec des trous d’aération. Maintenez la température de la plaque de verre transparente à 28-30 °C, sur laquelle le compartiment est placé.
- Installez les rats dans cet environnement pendant au moins 30 minutes pour qu’ils s’acclimatent avant le début de chaque test formel. Si les rats urinent ou défèquent dans le compartiment, nettoyez-le à temps avec du papier absorbant pour éviter d’affecter le transfert de chaleur par rayonnement lumineux qui s’ensuit.
- Concentrez le projecteur sur le centre de la patte de rat et appuyez sur le bouton Démarrer . Appuyez sur le bouton Stop lorsque le rat montre des comportements évidents tels que la rétraction du pied ou le léchage des pattes et enregistrez l’heure à ce stade. Le temps d’irradiation du projecteur ne doit pas dépasser 20 s pour éviter d’endommager la peau du rat.
- Effectuez la prochaine irradiation sur le même rat après au moins 10 minutes pour éviter la sensibilisation. Mesurez 5x sur chaque rat.
- Supprimez les valeurs présentant de grandes différences (la valeur maximale et la valeur minimale). Prenez la moyenne des valeurs restantes comme PWL.
5. Préparation de l’échantillon
- Pratiquer l’euthanasie sur la souris comme décrit au point 2.3.2.1.
- Préparation de la membrane synoviale
- Fixez le rat en position couchée sur le dos à l’aide d’une aiguille de seringue sur une planche de mousse avec le membre postérieur droit fléchi lors de l’abduction et de la rotation externe. Pincez la peau autour de l’articulation du genou avec des ciseaux chirurgicaux et exposez les muscles autour de l’articulation du genou des rats en coupant la peau, puis en coupant le fascia sous-cutané.
- Prenez le ligament rotulien comme point de repère pour dépouiller les groupes musculaires au-dessus du ligament rotulien. Inciser soigneusement l’extrémité du ligament rotulien (au niveau de la tubérosité tibiale) et trouver la membrane synoviale lorsque le ligament est pincé vers le haut par le bas.
- Coupez soigneusement le tissu synovial avec des ciseaux ophtalmiques et rincez le sang et le liquide synovial avec une solution saline pré-refroidie. Fixez la membrane synoviale dans du paraformaldéhyde à 4 % pendant au moins 48 h après avoir absorbé l’eau de la surface du tissu avec une gaze propre.
- Préparez l’échantillon comme indiqué aux étapes 2.3.2.5 à 2.3.2.6. Effectuez la notation comme à l’étape 2.3.2.7.
- Effectuer une coloration à l’hématoxyline et à l’éosine
- Épaffiner dans l’eau avec du xylène pendant 20 min, remplacer par un autre tour de xylène frais pendant 20 min, suivi d’un traitement à l’éthanol anhydre pendant 5 min, remplacer par un autre tour d’éthanol anhydre frais pendant 5 min, puis ajouter 90% d’éthanol en volume pendant 5 min, 80% d’éthanol en volume pendant 5 min, 70% d’éthanol en volume pendant 5 min, et enfin de l’eau distillée pendant 5 min.
- Plongez la lame dans une solution de coloration à l’hématoxyline pendant 3 à 8 minutes. Retirez la lame et rincez la tache à l’eau distillée. Déplacez-le dans le liquide de différenciation (alcool acide chlorhydrique à 1 %) pendant près de 30 s, de sorte que la lame s’estompe en bleu pâle. Rincez-le à l’eau distillée et placez-le dans une solution de coloration à l’éosine pendant 1 à 3 minutes.
- Déshydrater la lame avec une fraction volumique d’éthanol à 95 % pendant 5 min, la remplacer par une autre série d’éthanol frais à 95 % pendant 5 min, suivie d’éthanol anhydre pendant 5 min, remplacer par une autre série d’éthanol anhydre frais pendant 5 min.
- Rendez la lame transparente en ajoutant du xylène pendant 5 min, remplacez-la par un autre rond de xylène frais pendant 5 min, puis scellez-la avec de la résine neutre.
- Marquage de l’extrémité de l’entaille médiée par la désoxynucléotidyl transférase terminale (TUNEL) sur le cartilage
- Déshydrater l’échantillon de cartilage dans de l’éthanol anhydre, de l’éthanol à 90 %, de l’éthanol à 85 % et de l’éthanol à 75 % jusqu’à ce que l’hydratation de déparaffinage soit terminée. Faire tremper dans le PBS pendant 5 min. Ajouter 3% H2 O2 goutte à goutte pendant 10 min.
- Ajouter la protéinase K, solution de travail goutte à goutte et digérer à 37 °C pendant 10 min. Ajouter 20 μL de tampon d’étiquetage par tranche pour le garder humide et secouer l’excès de liquide après avoir préparé la solution de travail. Ajouter 20 μL de solution de travail à chaque lame et incuber pendant 2 h à 37 °C dans une boîte humide.
- Ajouter 50 μL de solution de fermeture goutte à goutte et fermer pendant 30 min. Ajouter ensuite 50 μL d’anticorps anti-digoxine biotinylé dilué (dilution 1 :100) goutte à goutte et incuber à 37 °C pendant 2 h dans une boîte humide. Ajouter 10 μL de diluant pour anticorps SABC (dilution 1 :100) goutte à goutte et incuber à 37 °C pendant 2 h dans une boîte humide.
- Ajouter la solution de développement de couleurs DAB (50 μL de réactifs A, B et C dans 1000 μL d’eau distillée) goutte à goutte pendant 10 à 15 min. Le développement de la couleur se termine lorsqu’il est granulaire jaune brunâtre.
- Recolorer avec de l’hématoxyline pendant 3 s. Après une déshydratation en gradient et un traitement transparent, séchez à température ambiante et scellez soigneusement la lame avec de la gomme neutre. Faites attention à ne pas laisser de bulles et de colle qui déborde.
- Analyse immunohistochimique de l’IL-1β et du TNF-α
- Cépatisser régulièrement les lames dans du xylène et les hydrater dans de l’alcool de gradient. Inactiver la peroxydase endogène dans les coupes avec 3% H 2O2. Placez le porte-lames dans un tampon de citrate à 95 °C (pH 6,0) et incubez-le au bain-marie à une température supérieure à 95 °C pendant plus de 20 minutes. Sortez la boîte d’incubation et laissez-la à température ambiante pendant au moins 20 min.
- Incuber 5 % de sérum de chèvre normal avec du PBS pendant 10 min à 37 °C et secouer l’excès de liquide. Ajouter 150 μL d’anticorps I goutte à goutte et laisser reposer à 37 °C pendant 1 h, puis conserver toute la nuit à 4 °C. Le lendemain, réchauffer à 37 °C pendant 45 min.
- Laver 3 fois avec du PBS pendant 5 min chacun. Recouvrez le tissu de la lame avec 3 % de BSA et fermez-le à 37 °C pendant 30 min. Ajouter 150 μL d’anticorps II goutte à goutte et laisser reposer à température ambiante pendant 1 h. Laver 3 fois avec du PBS pendant 5 min chacun et ajouter 150 pL de liquide de développement des couleurs DAB goutte à goutte. Observez le degré de coloration au microscope jusqu’à ce que l’échantillon devienne jaune brunâtre, même à l’œil nu.
- Rincez immédiatement avec du PBS pendant 10 min. Teindre à nouveau avec de l’hématoxyline, déshydrater dans de l’alcool dégradé, rendre les lames transparentes dans du xylène et sceller avec de la gomme neutre.
- Analyse statistique
- Les coupes colorées immunohistochimiquement avec une expression positive de la protéine associée sont jaunes ou jaune brunâtre. Évaluez l’intensité de l’expression positive par le logiciel Image J pour chaque groupe de coupes immunohistochimiques et utilisez les critères d’évaluation de la densité optique moyenne (AOD), calculée par IOD divisé par la surface.
- Utilisez un logiciel d’analyse pour l’analyse statistique. Utilisez le test t si les données sont conformes à la distribution normale et au khi-deux et utilisez le test non paramétrique si elles ne sont pas conformes à la distribution normale. Analysez les données de mesure répétées à l’aide d’équations d’estimation généralisées.
Résultats
Tests de comportement à la douleur
Les résultats de la MWT ont montré que la MWT du membre postérieur droit après modélisation était significativement plus faible qu’avant (p<0,05). Par rapport au groupe témoin, le MWT des rats était significativement élevé après Tuina (p<0,05 ; Figure 5 et tableau 2).

Graphique 5. Résultats de l’essai de seuil de retrait mécanique ( , Newton). Il y avait 5 rats chacun dans le groupe Tuina et dans le groupe témoin. Le MWT des rats à différents moments est indiqué sur la figure. Après la modélisation, le MWT des rats a diminué de manière significative, ce qui suggère que la douleur des rats a été aggravée et que le modèle KOA a été préparé avec succès. Par la suite, le MWT s’est progressivement amélioré, suggérant un soulagement de la douleur. L’équation d’estimation généralisée a été utilisée pour le calcul statistique. La différence de MWT entre le groupe Tuina et le groupe témoin était statistiquement significative au jour 21 par rapport à celle après la modélisation. La comparaison entre les deux groupes était statistiquement significative à J7, J14 et J21, *p<0,05. De plus, les rats du groupe Tuina ont un MWT plus élevé que celui du groupe témoin. Veuillez cliquer ici pour voir une version agrandie de cette figure.
, Newton). Il y avait 5 rats chacun dans le groupe Tuina et dans le groupe témoin. Le MWT des rats à différents moments est indiqué sur la figure. Après la modélisation, le MWT des rats a diminué de manière significative, ce qui suggère que la douleur des rats a été aggravée et que le modèle KOA a été préparé avec succès. Par la suite, le MWT s’est progressivement amélioré, suggérant un soulagement de la douleur. L’équation d’estimation généralisée a été utilisée pour le calcul statistique. La différence de MWT entre le groupe Tuina et le groupe témoin était statistiquement significative au jour 21 par rapport à celle après la modélisation. La comparaison entre les deux groupes était statistiquement significative à J7, J14 et J21, *p<0,05. De plus, les rats du groupe Tuina ont un MWT plus élevé que celui du groupe témoin. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 2. Seuil de retrait mécanique (  , N). Comparaison avant et après modélisation, #p<0.05. Comparaison entre le groupe Tuina et le groupe témoin, *p<0,05. Veuillez cliquer ici pour télécharger ce tableau.
, N). Comparaison avant et après modélisation, #p<0.05. Comparaison entre le groupe Tuina et le groupe témoin, *p<0,05. Veuillez cliquer ici pour télécharger ce tableau.
Les résultats de la PWL ont montré que la PWL du membre postérieur droit après modélisation était significativement plus courte qu’avant (p<0,05). Par rapport au groupe témoin, le MWT des rats a été significativement prolongé après Tuina (p<0,001 ; Figure 6 et tableau 3).
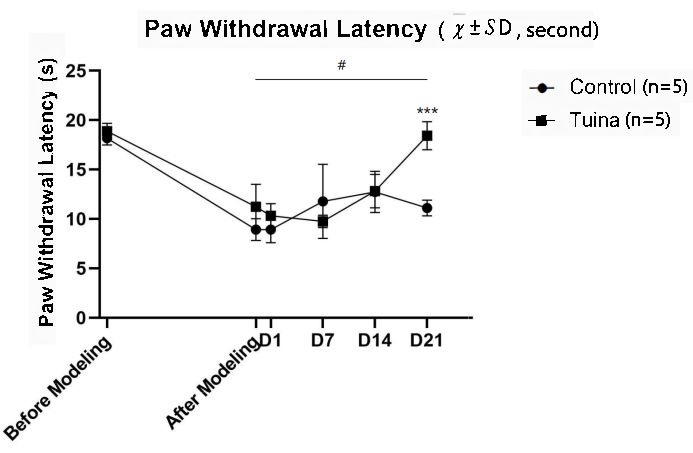
Graphique 6. Résultats du test de latence de retrait de la patte ( , deuxième). Il y avait 5 rats chacun dans le groupe Tuina et dans le groupe témoin. La PWL des rats à différents moments est indiquée sur la figure. Après la modélisation, la PWL des rats a diminué de manière significative, ce qui suggère que la douleur des rats a été aggravée et que le modèle KOA a été préparé avec succès. Dans un premier temps, l’amélioration de la TPP dans le groupe Tuina était plus lente que dans le groupe témoin. Après J7, les rats du groupe Tuina se sont améliorés rapidement et ont dépassé le groupe témoin à J21. L’équation d’estimation généralisée a été utilisée pour le calcul statistique. La différence de MWT entre le groupe Tuina et le groupe témoin était statistiquement significative au jour 21 par rapport à celle après la modélisation. La comparaison entre les deux groupes était statistiquement significative à J7, J14 et J21, ***p<0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
, deuxième). Il y avait 5 rats chacun dans le groupe Tuina et dans le groupe témoin. La PWL des rats à différents moments est indiquée sur la figure. Après la modélisation, la PWL des rats a diminué de manière significative, ce qui suggère que la douleur des rats a été aggravée et que le modèle KOA a été préparé avec succès. Dans un premier temps, l’amélioration de la TPP dans le groupe Tuina était plus lente que dans le groupe témoin. Après J7, les rats du groupe Tuina se sont améliorés rapidement et ont dépassé le groupe témoin à J21. L’équation d’estimation généralisée a été utilisée pour le calcul statistique. La différence de MWT entre le groupe Tuina et le groupe témoin était statistiquement significative au jour 21 par rapport à celle après la modélisation. La comparaison entre les deux groupes était statistiquement significative à J7, J14 et J21, ***p<0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 3. Latence de retrait des pattes ( , s). Comparaison avant et après modélisation, #p<0.05. Comparaison entre le groupe Tuina et le groupe témoin, ***p<0,001. Veuillez cliquer ici pour télécharger ce tableau.
, s). Comparaison avant et après modélisation, #p<0.05. Comparaison entre le groupe Tuina et le groupe témoin, ***p<0,001. Veuillez cliquer ici pour télécharger ce tableau.
Essai histomorphologique
Lors de l’analyse de la membrane synoviale dans le groupe témoin, une infiltration de cellules inflammatoires et une hyperplasie du tissu fibreux ont été observées dans le tissu synovial. Les cellules synoviales étaient désorganisées et une petite quantité d’hyperplasie capillaire a été observée autour du tissu synovial (Figure 7).

Graphique 7. Observation microscopique du tissu synovial. (A) Tissu synovial dans le groupe témoin. La disposition désorganisée des cellules synoviales est visible sur la figure. Les vaisseaux proliférants sont marqués par des flèches rouges et les cellules inflammatoires sont marquées par des flèches noires. (B) Tissu synovial dans le groupe Tuina. Les cellules synoviales étaient mieux disposées. Les cellules inflammatoires sont principalement distribuées sur les bords plutôt que de s’infiltrer vers l’intérieur. Les vaisseaux proliférants sont marqués par des flèches rouges et les cellules inflammatoires sont marquées par des flèches noires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dans le groupe Tuina, les cellules synoviales étaient soigneusement disposées, avec une petite quantité d’infiltration cellulaire inflammatoire, une hyperplasie du tissu fibreux et une petite quantité d’hyperplasie capillaire visible sur les marges tissulaires.
Lors de l’analyse du cartilage, il a été constaté que la zone positive de coloration TUNEL dans le groupe Tuina était significativement plus petite que celle du groupe témoin, ce qui indique qu’il y avait moins de chondrocytes apoptotiques dans le groupe Tuina (Figure 8).

Graphique 8. Coloration TUNEL du cartilage. (A) Cartilage dans le groupe témoin. La partie rouge de la figure est la zone positive de la coloration TUNEL. (B) Cartilage chez le groupe Tuina. La partie rouge de la figure est la zone positive de la coloration TUNEL. La zone positive dans le groupe Tuina est significativement plus petite que celle dans le groupe témoin. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Immunohistochimie
Pour le TNF-α, il y avait une différence significative dans l’expression synoviale du TNF-α entre les deux groupes, et l’expression dans le groupe Tuina était significativement inférieure à celle du groupe témoin (tableau 4).
Tableau 4. Expression du TNF-α dans Synovium ( , *10-2). Deux échantillons t indépendants ont été utilisés pour l’analyse statistique, *p<0,05. Veuillez cliquer ici pour télécharger ce tableau.
, *10-2). Deux échantillons t indépendants ont été utilisés pour l’analyse statistique, *p<0,05. Veuillez cliquer ici pour télécharger ce tableau.
Pour l’IL-1β, il n’y avait pas de différence significative dans la quantité d’expression synoviale de l’IL-1β entre les deux groupes, telle que mesurée par les statistiques de l’image J. Cependant, la valeur moyenne du groupe Tuina était légèrement inférieure, ce qui indique une expression moindre (tableau 5).
Tableau 5. Expression de l’IL-β dans Synovium ( , *10-2). Un test t sur deux échantillons indépendants a été utilisé pour l’analyse statistique. Veuillez cliquer ici pour télécharger ce tableau.
, *10-2). Un test t sur deux échantillons indépendants a été utilisé pour l’analyse statistique. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Cette étude fournit un protocole pour la manipulation du Tuina sur des rats KOA. Grâce à des tests de comportement à la douleur et à des résultats histomorphologiques, il a suggéré qu’une telle série de manipulations de Tuina appliquées à des rats KOA pourrait réduire l’inflammation synoviale et l’apoptose du cartilage, ce qui pourrait être une référence de la manipulation de Tuina sur des modèles animaux de KOA.
Il y a plusieurs procédures critiques au cours du protocole. Tout d’abord, il est important de choisir une méthode appropriée pour induire le modèle KOA. Il existe différentes méthodes pour induire le modèle KOA, y compris l’injection de cavité articulaire25, la chirurgie intra-articulaire 26,27, la méthode de freinage articulaire28,29, etc. Étant donné que les modèles KOA induits par des méthodes invasives laisseraient des plaies près des articulations, ce qui pourrait interférer avec l’effet de la manipulation du Tuina, nous avons choisi la méthode non invasive d’immobilisation articulaire. La méthode d’immobilisation articulaire peut être divisée en fixation d’hyper-extension et d’hyper-flexion. Shang et al. ont comparé les effets de ces deux méthodes de fixation et ont constaté qu’il y avait peu de différence dans l’effet de l’apoptose cartilagineuse23. Cependant, leurs sujets expérimentaux étaient des lapins, qui sont de plus grande taille et relativement faciles à réparer par rapport aux rats. Le plâtre fixe en position de flexion est plus susceptible de tomber sous les rats qui le rongent. Par conséquent, nous avons choisi la méthode d’immobilisation de fixation en hyper-extension pour induire le KOA. Nous nous sommes référés à He et al. et avons utilisé le bandage en plâtre avec un abaisse-langue comme dispositif de fixation30. Cependant, la capacité de rongement des rats était plus forte que prévu, et l’appareil ne pouvait pas servir de fixation. Plus tard, nous avons trouvé une sorte de matériau de base de prothèse, qui peut former une coquille malléable mais dure à l’extérieur du plâtre, et réduire efficacement l’usure du dispositif de fixation par les rats qui rongent. Une fixation serrée affecterait la circulation sanguine des membres inférieurs, tandis qu’une fixation trop lâche serait facile à tomber. Par conséquent, la circulation des membres inférieurs des rats doit être observée quotidiennement pendant les 3 semaines de modelage. La fixation doit être relâchée lorsque les membres inférieurs deviennent enflés et violacés. Réinstallez la fixation lorsqu’elle est desserrée et que les rats peuvent fléchir les genoux. Au cours de cette étude, les rats n’ont pas été empêchés de socialiser pendant la modélisation, mais il a été constaté qu’ils mâchaient la fixation de l’autre pour s’aider mutuellement à se libérer. Peut-être que l’isolement des rats aurait permis une meilleure modélisation. Cependant, l’isolement peut contribuer à la dépression et au comportement stéréotypé des rats.
Nous considérons que le point clé de la manipulation du Tuina est de garder la cohérence de l’intensité et de la fréquence. Des recherches antérieures ont conclu que l’intensité optimale pour le Tuina animal devrait être de 80 % de son intensité maximale tolérable31. À ce stade, les rats devraient montrer des signes de stimulation mécanique, mais sans aucun signe de douleur ou de rétraction de la patte. Nous avons testé l’intensité maximale tolérable des rats, qui est d’environ 5 à 8 N. Nous réglons donc l’intensité de poussée sur 3-5 N, ce qui peut conduire à une meilleure efficacité. La fréquence de la manipulation est de 2 Hz, selon le manuel de Tuina. Des études antérieures n’ont pas établi de norme pour la manipulation du Tuina, et l’intensité et la fréquence peuvent varier après avoir utilisé différents points d’acupuncture et modifié les mains gauche et droite pendant l’expérience, ce qui peut affecter la précision des résultats. Les enregistrements de pression des doigts utilisés dans cette expérience permettent d’observer en temps réel l’intensité et la fréquence de la manipulation pendant l’expérience, ce qui permet de conserver la cohérence de la manipulation. Certains chercheurs utilisent des machines pour simuler la manipulation du Tuina et l’appliquer sur des animaux, ce qui présente l’avantage de standardiser la manipulation32.
Pour la sélection des points d’acupuncture, nous nous sommes référés à l’étude de Wang et Liu et avons choisi cinq points d’acupuncture autour de l’articulation du genou pour faciliter la manipulation33,34. Nous avons choisi la méthode d’immobilisation par plâtre pour induire le KOA, qui se termine le plus souvent par une atrophie musculaire et une raideur articulaire35. ST34 et ST35 appartiennent au méridien de l’estomac de Yangming du pied qui est essentiel dans le traitement de l’atrophie (se manifestant principalement par une faiblesse et une atrophie musculaire) dans la théorie de la médecine traditionnelle chinoise et a une bonne adaptabilité pour le KOA induit par la méthode d’immobilisation du plâtre. EX-LE4 est un point d’acupuncture commun pour le traitement clinique du KOA, principalement utilisé avec ST35. Tan et al. ont découvert que l’acupuncture et la moxibustion sur ST35, ST36 et EX-LE4 pouvaient réduire l’expression du facteur inflammatoire dans la membrane synoviale36. SP10 et BL40 sont les principaux points d’acupuncture du traitement clinique de Tuina pour KOA 37,38, et SP10 est le plus fréquemment utilisé dans les prescriptions de Tuina pour KOA39.
Une partie difficile de la manipulation du Tuina est la fixation des rats. Les rats peuvent se débattre ou éviter la manipulation, ce qui augmente la difficulté de réaliser l’expérience. Bien que les immobilisateurs de rats puissent immobiliser les rats et exposer leurs membres postérieurs, le développement de KOA limite la flexion et l’extension des membres postérieurs. Par conséquent, l’installation de rats avec des dispositifs d’immobilisation peut entraîner des douleurs et une exposition incomplète des membres postérieurs, ce qui peut affecter la manipulation du Tuina. Nous avons conçu un sac en tissu à sortie unique en fonction de la préférence du rat pour les environnements sombres et de sa tendance à creuser. Fermez le sac en tissu lorsque le rat entre, c’est-à-dire que la tête et les membres antérieurs sont situés dans le sac et que ses membres postérieurs sont exposés à l’extérieur. Cette méthode peut réduire efficacement la lutte des rats et les garder calmes pendant le Tuina.
Les résultats de la pré-expérience suggèrent que la manipulation de Tuina peut réduire la réponse inflammatoire du tissu synovial et diminuer l’apoptose des chondrocytes, agissant ainsi comme un traitement pour KOA. Cependant, d’autres études sont nécessaires pour le vérifier.
Il y a plusieurs lacunes dans ce protocole. Tout d’abord, la petite taille des rats rend difficile la localisation précise des points d’acupuncture. Les doigts de l’opérateur sont trop grands par rapport aux points d’acupuncture des rats, ce qui peut affecter l’effet de la manipulation du Tuina. Nous avions envisagé d’ajouter une particule de caoutchouc d’environ 2 mm de diamètre sur le bout du doigt pour augmenter la précision de la stimulation des points d’acupuncture. Mais les particules peuvent entraîner une intensité de pression plus élevée et augmenter la difficulté à contrôler la consistance. De plus, il était plus susceptible d’endommager les enregistrements de pression des doigts, nous n’avons donc pas choisi cette méthode. Deuxièmement, notre étude a ignoré le changement des facteurs inflammatoires dans le liquide synovial et l’apoptose des chondrocytes, ce qui peut affaiblir la crédibilité de l’étude. Nous allons intensifier la recherche dans ce domaine à l’avenir. Troisièmement, la manipulation de la presse et du pétrissage est l’une des manipulations de Tuina et ne peut pas englober les effets de Tuina dans le traitement de la KOA. D’autres manipulations de Tuina mises en œuvre chez les animaux doivent être explorées plus avant, y compris les manipulations de mouvements articulaires et les manipulations de frottement. De plus, un contrôle positif montrerait mieux l’efficacité de la manipulation, mais il n’a pas été conçu dans cette étude, et nous l’ajouterons dans une étude de suivi.
Dans l’ensemble, cette étude fournit un protocole standardisé pour la manipulation de Tuina sur des rats KOA, et l’efficacité de la manipulation a été vérifiée par des tests de comportement à la douleur et des résultats microscopiques. Le protocole préliminaire prouve que les effets thérapeutiques de Tuina peuvent être liés à la réduction de l’inflammation synoviale et au retard de l’apoptose des chondrocytes. Des recherches supplémentaires sont nécessaires pour explorer le mécanisme du Tuina pour le KOA.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Ces travaux ont été financés par le projet de construction de spécialités cliniques critiques de Shanghai (numéro de subvention : Shslczdzk04001) ; le programme de voile de la Commission des sciences et de la technologie de Shanghai (numéro de subvention : 22YF1444300) ; Projets dans le cadre du budget de l’Université de médecine traditionnelle chinoise de Shanghai (numéro de subvention : 2021LK091).
matériels
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
Références
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24(2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734(2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4(2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l, Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131(2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224(2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon