Method Article
推拿操作以减少膝关节骨关节炎大鼠的炎症和软骨损失
摘要
我们提出了一种对石膏固定诱导的膝关节骨关节炎大鼠进行推拿操作的方案。根据初步结果,它表明该方法的功效依赖于减少炎症和软骨损失。
摘要
临床试验表明,推拿手法可有效治疗膝关节骨关节炎(KOA),同时需要进一步研究以发现其机制。因此,膝关节骨关节炎动物模型的操作至关重要。该协议为推拿对KOA大鼠的操作提供了标准过程,并对推拿对KOA的机制进行了初步探索。将按压揉捏操作法(一种推拿操作,是指按压和揉捏体表的特定区域)应用于大鼠膝关节周围的5个穴位。通过手指压力记录标准化操作的力和频率,并且在协议中详细描述了操作过程中大鼠的位置。手法的效果可以通过疼痛行为测试和滑膜和软骨的显微镜检查来测量。KOA大鼠的疼痛行为有显著改善。推拿组滑膜组织炎症浸润减少,肿瘤坏死因子(TNF)-α表达明显降低。与对照组相比,推拿组软骨细胞凋亡较少。本研究为推拿对KOA大鼠的操作提供了标准化的方案,并初步证明推拿的治疗效果可能与减少滑膜炎症和延迟软骨细胞凋亡有关。
引言
膝关节骨关节炎(KOA)是一种退行性疾病,主要表现为关节疼痛。纤维化、开裂、溃疡和关节软骨脱落是本病的主要原因1。KOA患病率高,可能对患者的日常生活造成深远影响,严重者致残。在 45-84 岁的人群中,KOA 的患病率随着年龄的增长而增加,85 岁及以上人群的患病率为 15%,其中女性占优势 2,3。此外,KOA可能会给个人和社会带来严重的经济负担。一项调查显示,人均KOA的直接医疗保健费用高达8,858美元±每年5,120美元4。随着社会老龄化,KOA已成为一个全球性的健康问题和重大的社会问题,也是科学研究的热点问题。
循证研究表明,推拿手法在治疗KOA5方面的有效性。推拿手法可以缓解KOA患者的疼痛并改善功能障碍,其机制与抗炎作用有关6,7。学者发现,推拿操作有效抑制了炎症因子白细胞介素(IL)-β和5-羟色胺的表达,减缓了兔KOA模型8中关节软骨的退化。结果表明,推拿可促进病灶部位血液循环和代谢,有助于清除IL-1、IL-6和肿瘤坏死因子(TNF)-α等炎症因子,从而缓解KOA9的临床症状。此外,通过推拿操作使关节被动运动,可以促进滑液渗透和扩散到关节软骨中,改善组织营养代谢10。其他研究表明,推拿操作可以有效改善KOA患者的生物力学指标11。对软组织进行手法可以改善四肢的压力分布并增强平衡功能12,13。同时,通过一些关节调整操作,也可以调整下肢的排列以纠正异常步态14,15。
推拿操作治疗KOA的作用机制仍有待探索,因此有必要进行实验研究。推拿在实验动物中的应用关键是建模、动物固定和干预方法的标准化16。建模方法决定了实验动物是否可以表现出疾病的特征。同时,适当的固定方法可以方便推拿操作的干预,更好地体现推拿的效果。干预方法的标准化是推拿操纵中最难的部分。2010年,中国针灸标准基本体系提到了实验动物穴位标准,为动物实验中的针灸和推拿手术提供了可能17.但是,在标准化推拿操作方面仍然存在困难。推拿操纵有多种类型18.具体操作的选择主要取决于要治疗的疾病和表演者喜欢的治疗理论。在推拿对KOA的研究中,更多的关注是按点操作(用拇指或肘部按压特定的穴位)、Yizhichan推手法(通过摆动拇指进行推力操作)和按压揉捏操作(指用手指或手掌按压和揉捏体表的特定区域)19.按压和揉捏操作是应用最广泛的推拿操作之一,它结合了按压和揉捏来移动皮下组织20。穴位按压揉捏可促进血液循环,缓解疼痛,代表推拿对KOA19的治疗效果。
在本协议中,将详细描述按压和揉捏操作对KOA大鼠的操作,包括所选穴位,操作的强度和频率以及大鼠的身体位置,以便为未来的研究提供参考。
研究方案
本研究通过了上海中医药大学附属岳阳市中西医结合医院实验动物伦理委员会(YYLAC-2022-166)的动物伦理评审。
1. 实验动物的制备和分组
- 动物制备
- 在室温(18-21°C),湿度40%-50%,12小时:12小时昼夜节律交替下饲养10只健康的SPF SD雌性大鼠200-220克。严格按照动物伦理准则和准则的有关规定进行与疼痛有关的动物实验。
- 动物分组
- 将大鼠随机分为推拿组和对照组。建模后用按压和揉捏操作治疗推拿组的大鼠21天。将对照组的大鼠放在同一个推拿房间内,并在推拿组接受治疗时同时将它们放入黑布袋中。
2. 动物建模
- 麻醉动物
- 使用异氟醚进行气体麻醉。将大鼠放入诱导浓度为3%的诱导盒中。放下大鼠后摆动盒子,并在大鼠翻身时确认麻醉,不尝试返回俯卧位。
- 将大鼠从诱导盒中取出,并将其鼻子固定在麻醉面罩中。将异氟醚浓度调节至2%以维持麻醉。当大鼠在捏爪子时没有反应时确认麻醉。在大鼠身上涂抹眼膏以防止大鼠麻醉时干燥,因为眼睑不能闭合。
- 建模方法21
- 使用剃须机去除右后肢的毛发。在大鼠的右脚踝和髋关节之间放置医用化妆棉。用5-6层湿石膏绷带均匀地固定右膝关节180°伸展。螺旋缠绕石膏绷带,从脚踝开始,覆盖前一个绷带的1/3。使用吹风机干燥和硬化石膏。
- 在石膏绷带干燥并硬化后,用假牙基材外包裹石膏,以固定石膏并防止其啃咬。
- 混合假牙基材使其粘稠,并将混合物粘附在石膏的外部(混合物不应超过绷带的边缘, 图1)。混合物变硬后,关闭麻醉机,等待动物自然醒来。在大鼠醒来之前监督大鼠以防止麻醉事故。
- 将石膏适当地固定在大鼠的右后肢上,因为紧密固定会限制血液循环,而松散的固定物往往会脱落。观察末端肢体的血液循环。如果检测到末端肢体肿胀或肤色发紫,请立即切断部分石膏以帮助恢复血液循环。如果石膏破损且无法保持下肢伸展,请重新制作石膏。
- 连续固定3周后取出石膏。用手术剪刀剪掉外面的假牙基材和石膏绷带。用生理盐水冲洗大鼠的下肢,并用纱布擦干。如果有局部皮肤病变,用碘化消毒。
- 模型验证22
- 基于 X 射线的验证
- 建模结束后1天对右膝进行X射线检查。仰卧位前后位 X 线片,髋关节屈曲 30°,伸膝 0°,髋外展 15°。将髌骨直接放在膝盖前方,并将散热器管放在距离膝关节110毫米的地方。
- 在右侧卧位进行侧位 X 线检查,右髋关节屈曲 30°,右膝伸展 0°。使左肢髋关节屈曲70°,膝关节屈曲45°,并将散热器管放在距离膝关节110毫米的地方。将检测参数设置为暴露电压50 kV,电流250 mA,暴露剂量32 mA,曝光时间128 ms。
- 与正常大鼠的 X 射线相比,检查建模的膝关节 X 射线是否显示更窄的关节空间,边缘有骨赘增生。
- 国际骨关节炎研究学会(OARSI)得分23
- 将大鼠放入安乐死盒中,并以每分钟30%-70%的笼子体积的速度灌注CO2 。在检测到大鼠不动、不呼吸和瞳孔散大后停止灌注 CO2 。再观察2分钟以确认死亡。
注意:颈椎脱位可以在基于CO2的安乐死后进行,作为确认死亡的次要形式。将老鼠固定在桌子上,用一只手抓住它的尾巴。用另一只手的拇指和食指向下按压老鼠的头部。听到裂缝声确认死亡,老鼠同时失去运动和心跳。 - 用注射器针头将大鼠固定在仰卧位,右后肢在外展和外旋中弯曲。用手术剪刀捏住膝关节周围的皮肤。通过切割皮肤然后切割皮下筋膜来暴露膝关节周围的肌肉。
- 用骨剪刀切断股骨和胫骨骨干,切除右膝关节。轻轻去除关节外多余的软组织,如肌肉和韧带。
- 在4°C下将关节固定在4%多聚甲醛中24-48小时。 在10%甲酸溶液中将关节脱钙3天,直到骨组织可以很容易地用针戳。
- 将脱钙组织放入通风橱中并修剪,然后将其转移到脱水机中的脱水盒中。加入75%乙醇4小时,然后加入90%乙醇2小时,然后加入95%乙醇1小时,无水乙醇30分钟,另一轮新鲜无水乙醇30分钟,醇苯5-10分钟,二甲苯5-10分钟,另一轮新鲜二甲苯5-10分钟,蜡1小时,另一轮新鲜蜡1小时, 最后一轮新鲜蜡脱水和透明浸蜡1小时。
- 然后,将组织放入机器中进行包埋。石蜡凝固后,将蜡块切成4μm的蜡片,并在温水中压平。将切片放在载玻片上并干燥。在室温下储存。
- 观察软骨样本,并根据OA软骨组织病理学等级评估进行评分(表1)23。如果建模后大鼠的得分明显高于正常大鼠,则建模成功。
- 将大鼠放入安乐死盒中,并以每分钟30%-70%的笼子体积的速度灌注CO2 。在检测到大鼠不动、不呼吸和瞳孔散大后停止灌注 CO2 。再观察2分钟以确认死亡。
- 基于 X 射线的验证
表 1.OA软骨组织病理学分级评估。 等级是深度进展到软骨。总分 = 年级 x 分期。正常关节为0,严重关节炎为24。 请按此下载此表格。

图1.大鼠固定在石膏中。 大鼠麻醉后,用石膏绷带包裹右下肢,固定在过度伸展位置,并在外面覆盖一层假牙基材。 请点击此处查看此图的大图。
3. 推拿操纵
- 应用领域
- 在大鼠右后肢共选择5个穴位,包括ST34,ST35,SP10,EX-LE4和BL40(图2)。根据24中的穴位定位原理定位穴位。
- 申请职位
- 将一块黑布切成一个 9 厘米 x 15 厘米的袋子,一侧开口,然后用绳子拧紧开口。在推拿操作之前,轻轻拉动老鼠的尾巴,让它钻进袋子里,把后肢露在袋子外面。
- 用一只手使大鼠保持俯卧位,握住尾巴和后腿,另一只手在特定穴位上按压和揉捏操作(图3)。
- 推拿操纵
- 对右后肢的5个穴位进行按压和揉捏操作,每个穴位2分钟。将表演者的拇指放在选定的穴位上进行有节奏的按压和揉捏,以圆周运动带动皮肤和皮下组织在一起。
- 使用手指压力记录(牛顿单位)以确保操作的强度和频率一致。将强度保持在 3-5 N 之间,频率保持在 2 Hz(图 4)。每天应用一次操作,持续 21 天。

图2.穴位。 SP10位于大鼠膝关节内侧上方5mm处。ST34位于大鼠膝关节外上方5毫米处。EX-LE4位于大鼠膝关节韧带的内侧。ST35位于大鼠膝关节韧带的外侧。BL40位于横向腘条条纹的中点。 请点击此处查看此图的大图。

图3.推拿操作应用于大鼠。 老鼠被关在一个黑色的袋子里,后肢暴露在外。表演者用左手握住老鼠的尾巴,右手进行操作。 请点击此处查看此图的大图。

图4.手指压力记录。 记录手指按压力度和频率的装置用于实时反馈推拿操作过程中的强度和频率。(一)压力传感器及传动设备。(B) 手指按压记录。(C)推拿操作过程中记录的力。 请点击此处查看此图的大图。
4. 疼痛行为测试
- 测试建模前后的疼痛行为,以及推拿操作后1天(D1),后7天(D7),14天(D14)和21天(D21),包括机械撤回阈值和爪子撤回潜伏期测试。
- 机械撤退阈值
- 将大鼠放置在位于40厘米高舞台上的20厘米x 10厘米x 20厘米透明钢化玻璃隔间中,该载物台由孔径为10毫米x 10毫米的线格组成。将室温保持在23°C±2°C。
- 在行为测试阶段,每天将大鼠安置在行为实验室中至少2小时,以避免由于动物在正式测试开始时缺乏对环境的适应而干扰测试结果。在正式测试开始前将大鼠置于行为实验室中30分钟,以促进它们适应环境并减少分散注意力的因素。
- 使用电子冯弗雷光纤测量MWT。用脚中心的纤维刺激大鼠,当大鼠表现出明显的动作,如抬腿和躲避时,撤回纤维。此时机器可以自动记录最大压力值(N)。
- 在当前刺激后至少15秒在同一只大鼠中开始下一次刺激。每次刺激期间不要超过5秒,以防止对大鼠爪子中的触觉刺激敏感。重复测试5次,直到三次连续测量之间的差异不显着(在10 N内)。
- 删除差异较大的值(最大值和最小值),并将其余三个值的平均值作为机械退出阈值。
- 爪子撤回延迟 (PWL)
- 将大鼠放在尺寸为20cm x 10cm x 20cm的透明钢化玻璃小隔间中。用带有通风孔的透明玻璃盖覆盖隔间的顶部。将透明玻璃板的温度保持在28-30°C,将隔间放置在其上。
- 在每次正式测试开始之前,将大鼠在这种环境中放置至少30分钟以适应环境。如果老鼠在隔间内小便或排便,请及时用吸水纸清洁,以免影响后续的光辐射传热。
- 将聚光灯聚焦在老鼠脚的中心,然后按 "开始" 按钮。当老鼠表现出明显的行为(例如脚缩回或舔爪子)时,按下 停止 按钮并记录此时的时间。聚光灯照射时间不应超过20秒,以免损坏大鼠皮肤。
- 至少10分钟后对同一只大鼠进行下一次照射以防止致敏。在每只大鼠上测量 5 倍。
- 删除差异较大的值(最大值和最小值)。将剩余值的平均值作为 PWL。
5. 样品制备
- 按照2.3.2.1中所述对鼠标执行安乐死。
- 滑膜制备
- 用注射器针将大鼠固定在仰卧位,在外展和外旋中右后肢弯曲。用手术剪刀捏住膝关节周围的皮肤,通过切割皮肤然后切割皮下筋膜,暴露大鼠膝关节周围的肌肉。
- 以髌韧带为标志,剥离髌韧带上方的肌肉群。小心切开髌韧带的末端(在胫骨结节处),当韧带从下方向上挤压时,找到滑膜。
- 用眼科剪刀小心地切断滑膜组织,并用预冷的盐水冲洗掉血液和滑液。用干净的纱布从组织表面吸收水分后,将滑膜固定在4%多聚甲醛中至少48小时。
- 按照步骤2.3.2.5-2.3.2.6制备样品。按照步骤 2.3.2.7 中的方式执行评分。
- 进行苏木精和伊红染色
- 用二甲苯脱蜡到水中20分钟,用另一轮新鲜二甲苯代替20分钟,然后用无水乙醇处理5分钟,用另一轮新鲜无水乙醇代替5分钟,然后加入90%乙醇体积5分钟,80%乙醇体积5分钟,70%乙醇体积5分钟, 最后蒸馏水5分钟。
- 将载玻片浸入苏木精染色溶液中3-8分钟。取下载玻片,用蒸馏水冲洗掉污渍。将其移入分化液(1%盐酸醇)中近30秒,使载玻片褪色为淡蓝色。用蒸馏水冲洗,放入伊红染色溶液中1-3分钟。
- 用95%乙醇体积分数使载玻片脱水5分钟,用另一轮新鲜的95%乙醇代替5分钟,然后用无水乙醇5分钟,用另一轮新鲜无水乙醇替换5分钟。
- 通过添加二甲苯5分钟使载玻片透明,用另一轮新鲜二甲苯代替5分钟,然后用中性树脂密封。
- 末端脱氧核苷酸转移酶介导的软骨上的切口末端标记(TUNEL)
- 将软骨样品在无水乙醇,90%乙醇,85%乙醇和75%乙醇中脱水,直到脱蜡水合完成。在PBS中浸泡5分钟。滴加3%H2O2 ,持续10分钟。
- 滴加蛋白酶K工作溶液,在37°C下消化10分钟。每片加入 20 μL 标记缓冲液以保持湿润,并在制备工作溶液后抖去多余的液体。向每张载玻片中加入20μL工作溶液,并在37°C的湿箱中孵育2小时。
- 逐滴加入 50 μL 封盖溶液并关闭 30 分钟。然后滴加50μL稀释的生物素化抗地高辛抗体(1:100稀释),并在37°C下在湿箱中孵育2小时。滴加10μLSABC抗体稀释剂(1:100稀释液),并在37°C下在湿箱中孵育2小时。
- 滴加DAB显色溶液(试剂A,B和C在1000μL蒸馏水中各50μL)10-15分钟。当它呈棕黄色颗粒时,显色完成。
- 用苏木精重新染色3秒。梯度脱水和透明处理后,在室温下干燥并用中性胶小心密封载玻片。注意避免留下气泡和溢出的胶水。
- IL-1β和TNF-α的免疫组织化学分析
- 定期在二甲苯中对载玻片进行脱蜡,并在梯度醇中水合。用3%H2O2灭活切片中的内源性过氧化物酶。将载玻片支架置于95°C柠檬酸盐缓冲液(pH 6.0)中,并在高于95°C的水浴中孵育20分钟以上。取出孵育箱,在室温下放置至少20分钟。
- 将5%普通山羊血清与PBS在37°C孵育10分钟,并甩掉多余的液体。逐滴加入150μL抗体I,在37°C下静置1小时,然后在4°C下储存过夜。 第二天,在37°C下重新加热45分钟。
- 用PBS洗涤3次,每次5分钟。用3%BSA覆盖载玻片上的组织,并在37°C下密封30分钟。逐滴加入 150 μL 抗体 II,在室温下静置 1 小时。用PBS洗涤3次,每次5分钟,并滴加150pL的DAB显色液。在显微镜下观察染色程度,直到样品变成棕黄色,即使是肉眼。
- 立即用PBS冲洗10分钟。再次用苏木精染色,在梯度酒精中脱水,使载玻片在二甲苯中透明,并用中性胶密封。
- 统计分析
- 具有相关蛋白阳性表达的免疫组化染色切片为黄色或棕黄色。用图像J软件对每组免疫组织化学切片的阳性表达强度进行评分,并使用平均光密度(AOD)的评估标准,由IOD除以面积计算。
- 使用分析软件进行统计分析。如果数据符合正态分布和卡方,则使用 t 检验;如果数据不符合正态分布,则使用 t 检验。通过广义估计方程分析重复的测量数据。
结果
疼痛行为测试
MWT结果显示,建模后右后肢MWT明显低于前(p<0.05)。与对照组相比,推拿后大鼠MWT显著升高(p<0.05; 图 5 和 表 2)。

图5.机械抽出阈值检验的结果 ( 牛顿)。 推拿组和对照组各有5只大鼠。大鼠在不同时间点的MWT如图所示。建模后,大鼠MWT明显下降,提示大鼠疼痛加重,成功制备KOA模型。随后,MWT逐渐改善,提示疼痛缓解。采用广义估计方程进行统计计算。与建模后相比,推拿组和对照组在第21天MWT的差异具有统计学意义。两组比较在D7、D14和D21有统计学意义,*p<0.05。此外,推拿组大鼠的MWT高于对照组。 请点击此处查看此图的大图。
牛顿)。 推拿组和对照组各有5只大鼠。大鼠在不同时间点的MWT如图所示。建模后,大鼠MWT明显下降,提示大鼠疼痛加重,成功制备KOA模型。随后,MWT逐渐改善,提示疼痛缓解。采用广义估计方程进行统计计算。与建模后相比,推拿组和对照组在第21天MWT的差异具有统计学意义。两组比较在D7、D14和D21有统计学意义,*p<0.05。此外,推拿组大鼠的MWT高于对照组。 请点击此处查看此图的大图。
表 2.机械戒断阈值 (  , N)。 建模前后的比较, #p<0.05。推拿组与对照组比较,*p<0.05。 请按此下载此表格。
, N)。 建模前后的比较, #p<0.05。推拿组与对照组比较,*p<0.05。 请按此下载此表格。
PWL结果表明,建模后右后肢PWL明显短于前(p<0.05)。与对照组相比,推拿后大鼠MWT显著延长(p<0.001; 图 6 和 表 3)。
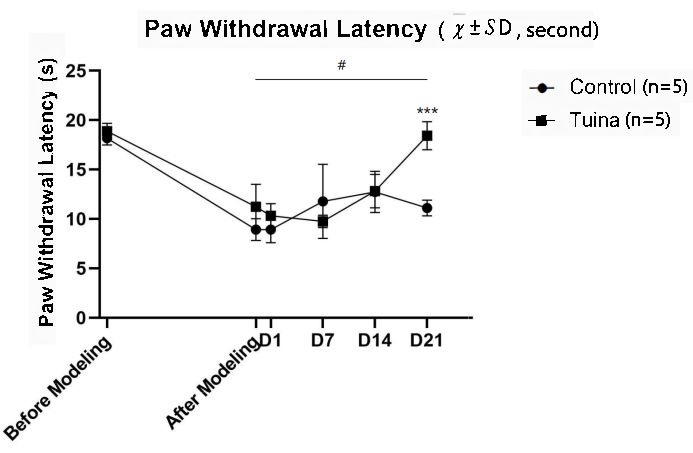
图6.爪子撤回延迟测试的结果 ( ,秒)。 推拿组和对照组各有5只大鼠。图中显示了大鼠在不同时间点的PWL。建模后,大鼠PWL明显下降,提示大鼠疼痛加重,成功制备KOA模型。起初,推拿组PWT的改善速度慢于对照组。D7后,推拿组大鼠改善迅速,在D21处超过对照组。采用广义估计方程进行统计计算。与建模后相比,推拿组和对照组在第21天MWT的差异具有统计学意义。两组比较在D7、D14和D21有统计学意义,***p<0.001。 请点击此处查看此图的大图。
,秒)。 推拿组和对照组各有5只大鼠。图中显示了大鼠在不同时间点的PWL。建模后,大鼠PWL明显下降,提示大鼠疼痛加重,成功制备KOA模型。起初,推拿组PWT的改善速度慢于对照组。D7后,推拿组大鼠改善迅速,在D21处超过对照组。采用广义估计方程进行统计计算。与建模后相比,推拿组和对照组在第21天MWT的差异具有统计学意义。两组比较在D7、D14和D21有统计学意义,***p<0.001。 请点击此处查看此图的大图。
表 3.爪子撤回延迟 ( , s)。 建模前后的比较, #p<0.05。推拿组与对照组比较,***p<0.001。 请按此下载此表格。
, s)。 建模前后的比较, #p<0.05。推拿组与对照组比较,***p<0.001。 请按此下载此表格。
组织形态学测定
在分析对照组滑膜时,滑膜组织中可见炎性细胞浸润和纤维组织增生。滑膜细胞杂乱无章,滑膜组织周围可见少量毛细血管增生(图7)。

图7.滑膜组织的显微镜观察。 (A)对照组中的滑膜组织。滑膜细胞的杂乱排列如图所示。增殖血管用红色箭头标记,炎症细胞用黑色箭头标记。(B)推拿组滑膜组织。滑膜细胞排列更整齐。炎症细胞主要分布在边缘,而不是向内浸润。增殖血管用红色箭头标记,炎症细胞用黑色箭头标记。 请点击此处查看此图的大图。
推拿组滑膜细胞排列整齐,组织边缘可见少量炎性细胞浸润、纤维组织增生和少量毛细血管增生。
经分析软骨,发现推拿组的TUNEL染色阳性区明显小于对照组,表明推拿组的凋亡软骨细胞较少(图8)。

图8.软骨的TUNEL染色。 (A)对照组的软骨。图中的红色部分是TUNEL染色的阳性区域。(B)推拿组软骨。图中的红色部分是TUNEL染色的阳性区域。推拿组阳性面积明显小于对照组。 请点击此处查看此图的大图。
免疫组化
对于TNF-α,两组滑膜TNF-α表达差异有统计学意义,推拿组表达明显低于对照组(表4)。
表 4.TNF-α在滑膜中的表达( , *10-2).采用两个独立样本t检验进行统计分析,*p<0.05。 请按此下载此表。
, *10-2).采用两个独立样本t检验进行统计分析,*p<0.05。 请按此下载此表。
对于IL-1β,两组间滑膜IL-1β表达量无显著差异,由图像J统计测量。然而,推拿组的平均值略低,表明表达较少(表5)。
表 5.IL-β在滑膜中的表达 ( , *10-2)。 采用两个独立样本t检验进行统计分析。 请按此下载此表格。
, *10-2)。 采用两个独立样本t检验进行统计分析。 请按此下载此表格。
讨论
本研究为KOA大鼠的推拿操作提供了方案。通过疼痛行为试验和组织形态学发现,将这一系列推拿手法应用于KOA大鼠可以减少滑膜炎症和软骨凋亡,可为KOA动物模型的推拿手法提供参考。
协议期间有几个关键程序。首先,选择适当的方法来诱导KOA模型很重要。诱导KOA模型的方法多种多样,包括关节腔内注射25、关节内手术26、27、关节制动法28、29等。由于侵入性方法诱导的KOA模型会在关节附近留下伤口,这可能会干扰推拿手法的效果,因此我们选择了关节固定的非侵入性方法。关节固定方法可分为过度伸展和过度屈曲固定。Shang等比较了这两种固定方法的效果,发现软骨凋亡的效果差异不大23。然而,他们的实验对象是兔子,与大鼠相比,兔子的体型更大,相对容易修复。屈曲位置的固定石膏在老鼠啃咬下更容易脱落。因此,我们选择了过度伸展固定的固定化方法来诱导KOA。我们参考了He等人,并使用带有压舌板的石膏绷带作为固定装置30。然而,老鼠的啃咬能力比预期的要强,该装置不能作为固定装置。后来我们发现了一种义齿基材,可以在石膏外面形成可模塑但坚硬的外壳,有效减少老鼠啃咬固定装置的磨损。紧固定会影响下肢的血液循环,而太松的固定很容易脱落。因此,在建模的3周内应每天观察大鼠下肢的循环。当下肢肿胀和发紫时,应松开固定。松动时重新安装固定装置,老鼠可以弯曲膝盖。在这项研究中,大鼠在建模过程中没有被限制社交,但发现它们会互相咀嚼对方的固定以帮助彼此挣脱。也许隔离大鼠会导致更好的建模。然而,孤立可能会导致老鼠的抑郁和刻板行为。
我们认为推拿操作的关键点是保持强度和频率的一致性。先前的研究得出结论,动物推拿的最佳强度应为其最大可耐受强度的80%31.此时,大鼠应该表现出接受机械刺激的迹象,但没有疼痛或爪子缩回的迹象。我们测试了大鼠的最大耐受强度,约为5-8 N。因此,我们将推动强度设置为 3-5 N,这可能会带来更好的效果。根据推拿教科书,操作的频率为 2 Hz。以前的研究还没有为推拿手法设定标准化,在实验过程中操作不同的穴位和改变左右手后,强度和频率可能会有所不同,这会影响结果的准确性。本实验中使用的手指压力记录提供了实验过程中操作强度和频率的实时观察,可以保持操作的一致性。有学者用机器模拟推拿操作,应用到动物身上,具有操作标准化的优点32。
对于穴位的选择,我们参考了王、刘的研究,选择了膝关节周围的5个穴位,以方便操作33、34。我们选择了石膏固定方法来诱导KOA,KOA大多以肌肉萎缩和关节僵硬35结束。ST34和ST35属于足阳明胃经,在中医理论中对治疗萎缩(多表现为肌无力和肌肉萎缩)至关重要,对石膏固定法诱导的KOA具有良好的适应性。EX-LE4是临床治疗KOA的常用穴位,大多与ST35配合使用。Tan等发现,针灸对ST35、ST36和EX-LE4可以降低滑膜炎症因子表达36。SP10和BL40是KOA37、38临床推拿治疗的核心穴位,SP10最常用于KOA39的推拿处方。
推拿操作的一个困难部分是固定老鼠。大鼠可能会挣扎或避免操作,这增加了进行实验的难度。虽然大鼠固定器可以固定大鼠并暴露其后肢,但KOA的发展限制了后肢的屈曲和伸展。因此,用固定器安置大鼠可能会导致后肢疼痛和不完全暴露,这可能会影响推拿操作。我们根据老鼠对黑暗环境的偏好和挖洞的倾向设计了一个单出口布袋。大鼠进入时关闭布袋,即头部和前肢位于袋子中,后肢暴露在外面。这种方法可以有效减少老鼠的挣扎,让它们在推拿期间保持安静。
预实验结果表明,推拿操作可降低滑膜组织的炎症反应,减少软骨细胞的凋亡,从而起到KOA的治疗作用。然而,需要更多的研究来验证这一点。
该协议有几个缺点。首先,大鼠体型小,难以精确定位穴位。与大鼠身上的穴位相比,操作者的手指太大,可能会影响推拿手法的效果。我们曾考虑在指尖上添加直径约2毫米的橡胶颗粒,以提高刺激穴位的准确性。但是颗粒可能会导致更高的压力强度,并增加控制稠度的难度。此外,它更有可能损坏手指压力记录,所以我们没有选择这种方法。其次,我们的研究忽略了滑液和软骨细胞凋亡中炎症因子的变化,这可能会削弱研究的可信度。今后将加强这方面的研究。第三,按压揉捏手法是推拿手法之一,不能涵盖推拿治疗KOA的效果。在动物身上实施的其他推拿操作需要进一步探索,包括关节运动操作和摩擦操作。此外,阳性对照会更好地显示操作的有效性,但它不是本研究中设计的,我们将在后续研究中添加这一点。
总体而言,本研究为KOA大鼠的推拿操作提供了标准化的方案,并且该操作的有效性已通过疼痛行为测试和显微镜检查结果得到验证。该方案初步证明,推拿的治疗效果可能与减少滑膜炎症和延迟软骨细胞凋亡有关。需要更多的研究来探索推拿对KOA的机制。
披露声明
提交人声明他们没有竞争利益。
致谢
这项工作得到了上海市重点临床专科建设项目(批准号:Shslczdzk04001)的支持;上海市科委帆船项目(批准号:22YF1444300);上海中医药大学预算范围内的项目(批准号:2021LK091)。
材料
| Name | Company | Catalog Number | Comments |
| absolute ethanol | Supelco | PHR1070 | For making specimen |
| ALMEMO admeasuring apparatus | ahlborn | 2450-1 | For Mechanical Withdrawal Threshold test |
| Anti-Digoxin antibody | Sigma-Aldrich | SAB4200669 | For HE stain IHC or TUNEL |
| Anti-IL-1 beta | abcam | ab283818 | For HE stain IHC or TUNEL |
| DAB Substrate kit | Solarbio | DA1010 | For HE stain IHC or TUNEL |
| Denture base materials | Shanghai New Century | 20000356 | For model making |
| eosin | bioswamp | PAB180016 | For HE stain IHC or TUNEL |
| Finger pressure recordings | Suzhou Changxian Optoelectronic Technology | CX1003w | For Tuina manipulation |
| formic acid solution | Sigma-Aldrich | 695076 | For decalcification |
| H2O2 | Sigma-Aldrich | 386790-M | For HE stain IHC or TUNEL |
| hematoxylin | bioswamp | PAB180015 | For HE stain IHC or TUNEL |
| Isoflurane | Shanghai Yuyan Scientific Instrument Company | S10010533 | For gas anesthesia |
| neutral resins | bioswamp | PAB180017 | For HE stain IHC or TUNEL |
| Paraformaldehyde Fix Solution | Sigma-Aldrich | 100496 | For histology |
| PBS | Sigma-Aldrich | P3813 | For HE stain IHC or TUNEL |
| Plantar Test Apparatus | IITC Life Science | / | For Paw Withdrawal Latency test |
| plaster of Paris bandage | WANDE | 20150023 | For model making |
| Proteinase K | Sigma-Aldrich | 124568 | For HE stain IHC or TUNEL |
| TNF Alpha Monoclonal antibody | Proteintech | 60291-1-Ig | For HE stain IHC or TUNEL |
| TUNEL | Servicebio | GDP1042 | For HE stain IHC or TUNEL |
| Wax | Sigma-Aldrich | 327204 | For making specimen |
| xylene | Shanghai Sinopharm Group | 100092 | For making specimen |
参考文献
- Joint Surgery Group of Chinese Orthopaedic Association, Chinese Association of Orthopaedic Surgeons, National Clinical Research Center for Geriatric Diseases, Chinese Journal of Orthopaedics. Chinese Osteoarthritis Treatment Guidelines (2021 Edition). Chinese Journal of Orthopaedics. 41 (18), 24(2021).
- David, S., et al. Epidemiology of knee osteoarthritis in general practice: a registry-based study. BMJ Open. 10 (1), 031734(2020).
- Callahan, L. F., Cleveland, R. J., Allen, K. D., Golightly, Y. Racial/Ethnic, Socioeconomic, and Geographic Disparities in the Epidemiology of Knee and Hip Osteoarthritis. Rheumatic Disease Clinics of North America. 47 (1), 1-20 (2021).
- Wang, K., Dong, X., Lin, J. H. Investigation of Medical Costs of Disease In Patients With Osteoarthritis of the Knee Joint. National Medical Journal of China. 97 (1), 4(2017).
- Perlman, A., et al. Efficacy and Safety of Massage for Osteoarthritis of the Knee: a Randomized Clinical Trial. Journal of General Internal Medicine. 34 (3), 379-386 (2019).
- Xing, H., et al. Therapeutic massage for knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Journal of Acupuncture and Tuina Science. 19 (5), 354-363 (2021).
- Seo, B. R., et al. Skeletal muscle regeneration with robotic actuation-mediated clearance of neutrophils. Science translational medicine. 13 (614), (2021).
- Wu, J. H., Zhang, C., Dong, S. J., Yin, H. Effects of Massage with #34;Relaxing Tendons" Technique on the Interleukin-1B and 5-hydroxytryptamine Levels in the Joint Fluid of a Rabbit Knee Osteoarthritis Model. Chinese General Practice. 21 (6), 688-693 (2018).
- Luo, R. The effects of IL-1B,IL-6,IL-13,IL-26,TNF-a by patellar manipulations on rabbit knee osteoarthritis model. Guangxi University of Traditional Chinese Medicine. , (2017).
- Qiu, F., Li, C., Wu, X., Liu, Y., Zhang, X. Effect of Massage on the Function of Foot-Yangming Meridian-Muscle in Patients with Knee Osteoarthritis. Acta Chinese Medicine. 36 (3), 649-655 (2021).
- Yang, B., Li, S. Research Progress of Massage in Improving Biomechanical Indexes of Knee Osteoarthritis. Acta Chinese Medicine. 37 (12), 2571-2576 (2022).
- Li, C., Qiu, F., Ding, J., Hu, G., Zhang, X. Curative Observation of Retaining of Heated Needle at Trigger Points Combined with Manipulation for Muscles along Meridians in Treating Knee Osteoarthritis. Journal of Guangzhou University of Traditional Chinese Medicine. 37 (11), 2157-2162 (2020).
- Ding, X., Zhang, X., Hou, Y., Zhao, Z., Ye, X. Effect of massage manipulation on joint stiffness of knee osteoarthritis patients based on "spine-pelvis-knee" holistic diagnosis and treatment pattern. Shanghai Journal of Traditional Chinese Medicine. 55 (08), 54-57 (2021).
- Fu, Y., Gong, L., Li, Y. The clinical studies of Rolling combined with Pulling Manipulation on Early and Middle-term. Jilin Journal of Chinese Medicine. 40 (07), 958-962 (2020).
- Jiang, J., Hu, X., Tang, R., Qiu, F., Huang, L. Change of lower limb force line in treating knee osteoarthritis with manipulation. Journal of Changchun University of Chinese Medicine. 34 (01), 129-132 (2018).
- Liang, Y., et al. Some issues on animal experiments standardization of acupuncture and moxibustion. Lishizhen Medicine and Materia Medica Research. 25 (09), 2299-2300 (2014).
- Guo, Y., Liu, Y., Liu, Q., Chen, Z., Zhao, X. Basic System of Chinese Acupuncture Standard. Chinese Acupuncture & Moxibustion. 31 (6), 549-550 (2011).
- YAN, X., Yan, J. Study on the Standardization of Classification of Tuina Manipulation. Acta Chinese Medicine. 32 (5), 875-878 (2017).
- Aikebaier, G., Lu, X., Liu, J., Liu, l, Wang, S. Analysis on Manipulation and Acupoint Selection Laws of Massage for Treatment of Knee Osteoarthritis Based on Data Mining Technology. Chinese Journal of Information on Traditional Chinese Medicine. 29 (5), 23-29 (2022).
- Gong, L., Wuquan, S., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Qian, J., Xing, X., Liang, J. Two Methods to Establish Rat Model of Osteoarthritis of the Knee. Research and Exploration in Laboratory. 33 (11), 23-27 (2014).
- Liu, J., et al. Experimental study of a modified Videman method for replicating knee osteoarthritis on rabbit. Rehabilitation Medicine. 30 (03), 212-219 (2020).
- Moskowitz, R. W. Osteoarthritis cartilage histopathology: grading and staging. Osteoarthritis and Cartilage. 14 (1), 1-2 (2005).
- Shen, M., Li, Z., Shen, J. Preliminary Exploration of Experiment Teaching on Experiment Acupuncture Science. Chinese Medicine Modern Distance Education of China. 7 (02), 130-131 (2009).
- Jeong, J., et al. Anti-osteoarthritic effects of ChondroT in a rat model of collagenase-induced osteoarthritis. BMC complementary and alternative medicine. 18 (1), 131(2018).
- Hulth, A., Lindberg, L., Telhag, H. Experimental osteoarthritis in rabbits. Preliminary report. Acta orthopaedica Scandinavica. 41 (5), 522-530 (1970).
- Tawonsawatruk, T., Sriwatananukulkit, O., Himakhun, W., Hemstapat, W. Comparison of pain behaviour and osteoarthritis progression between anterior cruciate ligament transection and osteochondral injury in rat models. Bone & Joint Research. 7 (3), 244-251 (2018).
- Zhou, Q., et al. Cartilage matrix changes in contralateral mobile knees in a rabbit model of osteoarthritis induced by immobilization. BMC musculoskeletal disorders. 16, 224(2015).
- Zeng, J., et al. Establishment and identification of experimental rabbit model of knee osteoarthritis. Chinese Journal of Clinical Research. 29 (5), 679-682 (2016).
- Shang, P., et al. Comparison with two kind osteoarthritis animal models reduced by plaster immobilization in extend excessive position and bend excessive position respectively. Orthopaedic Biomechanics Materials and Clinical Study. (1), 11-14 (2006).
- He, Y., et al. Evaluation of the effect of improved cast immobilization method on rabbit knee osteoarthritis model. Chinese Imaging Journal of Integrated Traditional and Western Medicine. 18 (2), 198-219 (2020).
- Pengfei, S., et al. Possible mechanism underlying analgesic effect of Tuina in rats may involve piezo mechanosensitive channels within dorsal root ganglia axon. Journal of Traditional Chinese Medicine. 38 (6), 834-841 (2018).
- Wang, Y. Mechanisms of Massage Mediating Chondrocyte Apoptosis in Knee Osteoarthritis Through Piezo 1/JAK2 Signaling Pathway. Shandong University of Traditional Chinese Medicine. , (2019).
- Liu, J. Effect of Massage on TLR4/MyD88 Signal Transduction Pathway in Rat Knee Osteoarthritis Model. Guangzhou University of Traditional Chinese Medicine. , (2019).
- Yu, S., Zhou, J., Pang, X. Advances in induced animal models of knee osteoarthritis. Journal of Guangxi University of Chinese Medicine. 25 (5), 50-55 (2022).
- Tan, Q., et al. Acupuncture combined with moxibustion regulates the expression of circadian clock protein in the synovium of rats with osteoarthritis. Chinese Journal of Tissue Engineering Research. 26 (11), 1714-1719 (2022).
- Zhang, Z., et al. A Review of Massage Therapy for Knee Osteoarthritis. Henan Traditional Chinese Medicine. 39 (1), 146-149 (2019).
- Gong, L., Sun, W., Zhang, H., Chen, Z. Research of Yan Juntao's Academic Experiences of Differential Treatment and Manipulation for Treating of Knee Osteoarthritis. Chinese Journal of Traditional Medical Traumatology & Orthopedics. 24 (7), 16-19 (2016).
- Chen, C., Zhang, H. Research on the rules of acupoint selection for the treatment of knee osteoarthritis with massage based on data mining. Hainan Medical Journal. 29 (18), 2617-2619 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。