Method Article
Prélèvement d’ovocytes laparoscopiques et cryoconservation au cours de la vaginoplastie pour le traitement du syndrome de Mayer-Rokitansky-Kuster-Hauser
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Une équipe dédiée peut offrir aux patientes Mayer-Rokitansky-Kuster-Hauser la possibilité d’effectuer une stimulation ovarienne contrôlée et une cryoconservation ovocytaire au moment de la vaginoplastie laparoscopique.
Résumé
Chez les patientes atteintes du syndrome de Mayer-Rokitansky-Kuster-Hauser (MRKHS) qui doivent subir une vaginoplastie laparoscopique et qui souhaitent une maternité biologique, nous proposons qu’un prélèvement concomitant d’ovocytes par laparoscopie pour la cryoconservation soit effectué. Le prélèvement d’ovocytes est poursuivi au début de la laparoscopie. Des trocarts droit et gauche de 5 mm sont positionnés, à travers lesquels une aiguille d’aspiration d’ovule de 17 G est utilisée pour la ponction des ovaires droit et gauche, respectivement. Pour faciliter l’exposition des follicules, les ovaires sont mobilisés et maintenus avec des pinces laparoscopiques.
Lors de l’aspiration de plusieurs follicules proches les uns des autres, la pointe de l’aiguille est retenue dans l’ovaire pour réduire le nombre de fois que le cortex ovarien est transpercé et en raison du risque inhérent de saignement. Les étapes suivantes sont inchangées par rapport à la technique modifiée laparoscopique de Davydov pour la vaginoplastie. Avant la chirurgie, une stimulation ovarienne contrôlée est réalisée avec un protocole d’antagoniste de l’hormone de libération de l’hormone gonadotrophine (Gn-RH), et la procédure concomitante de prélèvement d’ovocytes et de vaginoplastie est prévue 36 heures après le déclencheur final de la maturation folliculaire. Le liquide folliculaire est recueilli dans les mêmes tubes stériles de 10 ml utilisés lors du prélèvement transvaginal d’ovocytes et transféré dans un bloc chauffant (37 °C) au laboratoire de reproduction assistée, où les ovocytes matures (métaphase II) sont vitrifiés.
Dans ce cas, une série de 23 femmes atteintes de MRKH, les ovocytes ont été prélevés avec succès et cryoconservés chez tous les patients; La vaginoplastie a ensuite été réalisée sans modifications, et les soins postopératoires hospitaliers et ambulatoires (jour du retrait du cathéter urinaire, jour de sortie de l’hôpital, utilisation du dilatateur et confort lors du suivi) n’ont pas été affectés. Une complication postopératoire est survenue chez un patient (fièvre se développant le jour 5 après la chirurgie et détection de liquide intrapéritonéal à l’échographie transabdominale) et résolue après un traitement conservateur. Plutôt que d’effectuer une vaginoplastie chirurgicale et de retarder le prélèvement d’ovocytes chez les patientes atteintes de MRKH, cette approche combine les deux procédures en une seule laparoscopie, minimisant ainsi le caractère invasif chirurgical et les risques anesthésiques.
Introduction
Avec une incidence d’environ 1 femme sur 4 à 10 000, MRKHS est la cause de 15% des cas d’aménorrhée primaire. MRKHS se caractérise par l’absence congénitale du segment supérieur du vagin et de l’utérus, tandis que les anomalies des voies urinaires et du squelette sont associées de manière variable. Plus précisément, une voûte vaginale d’une profondeur de 1 à 2 cm est généralement présente et deux cornes utérines rudimentaires peuvent être trouvées1.
Dans le passé, l’intérêt médical principal de MRKHS était de permettre des rapports sexuels normaux, ce qui nécessite généralement la construction d’un néovagin par des approches non chirurgicales ou chirurgicales2. Cependant, les progrès de la médecine de la reproduction permettent actuellement la maternité génétique chez les patientes MRKHS, soit par maternité de substitution3,4 ou, plus récemment, par transplantation utérine5. Bien que la transplantation d’utérus soit encore une procédure expérimentale, la maternité de substitution est disponible dans de nombreux pays du monde6, et les résultats obstétricaux et psychosociaux rapportés sont comparables à ceux de la fécondation in vitro standard et du don d’ovocytes7.
La maternité de substitution et la transplantation d’utérus nécessitent la récupération d’ovocytes et la fécondation in vitro, mais il n’existe aucun consensus sur la façon d’effectuer la collecte d’ovules chez les patientes atteintes de MRKHS. Une approche transvaginale peut être irréalisable en raison d’une élasticité vaginale insuffisante8 même après une vaginoplastie, d’une localisation atypique des ovaires9, ou d’une distance excessive entre les ovaires et la coiffe vaginale 4,10. Dans ces cas, le prélèvement d’ovocytes par laparoscopie représente l’approche optimale en termes d’accès chirurgical. Cependant, comme la plupart des patients atteints de MRKHS subissent actuellement une néovaginoplastie laparoscopique, nous suggérons d’effectuer un prélèvement d’ovocytes par laparoscopie au moment de la chirurgie pour la vaginoplastie11, suivi d’une cryoconservation des ovocytes pour une utilisation future, minimisant ainsi le caractère invasif tout en combinant le traitement de la fonction sexuelle et reproductive des patients MRKHS.
Données démographiques des patients
Vingt-trois patients atteints de MRKH ont subi un traitement avec ce protocole jusqu’à présent. Les résultats anamnestiques, instrumentaux et de laboratoire des patients sont résumés dans le tableau 1. À moins d’indication contraire dans le tableau 1, aucune anomalie congénitale associée n’a été observée.
Protocole
Le comité d’éthique local du centre de référence tertiaire pour MRKHS (IRCCS San Raffaele University Hospital, Milan, Italie) a été informé et approuvé le protocole avant sa mise en œuvre en juillet 2017. Tous les patients ou tuteurs ont donné leur consentement éclairé signé pour le prélèvement et la cryoconservation des ovocytes par laparoscopie pendant la vaginoplastie et pour l’utilisation de données cliniques / de laboratoire anonymisées à des fins scientifiques.
1. Composition de l’équipe
- Désignez une équipe dédiée, composée d’un chirurgien laparoscopique expérimenté, d’un chirurgien vaginal expérimenté, d’un expert en infertilité, d’un psychologue dédié et d’une infirmière engagée.
- Assister le patient en équipe pendant toute la configuration et l’exécution de la procédure.
2. Bilan diagnostique et conseils
- Effectuer une échographie pelvienne et abdominale transabdominale sur le patient pour la visualisation des ovaires et l’estimation du nombre de follicules antraux (AFC). Évaluer les taux sanguins d’hormone anti-müllérienne (AMH) afin d’optimiser la dose initiale de gonadotrophine pour une stimulation ovarienne contrôlée. Effectuer des tests sérologiques pour les maladies infectieuses (VIH-Ab, VHC-Ab, HBV-Ab, RPR-TPHA) selon les protocoles nationaux / locaux pour la cryoconservation des tissus / gamètes.
- Conseiller la patiente sur les aspects sexuels et reproductifs du MRKHS, y compris la vaginoplastie non chirurgicale et chirurgicale, les coûts et la législation liés à la maternité de substitution, la perspective de la transplantation utérine dans le contexte d’un programme expérimental, les différentes approches disponibles pour le prélèvement d’ovocytes et la performance de la cryoconservation des ovocytes en termes de taux de naissances vivantes.
- Offrez à la patiente une évaluation psychologique pour la soutenir tout au long de la procédure et évaluez la stabilité émotionnelle et l’engagement et le désir de maternité future. Obtenir un consentement éclairé signé pour le prélèvement d’ovocytes laparoscopiques concomitants, la cryoconservation des gamètes et la vaginoplastie laparoscopique. Dans le cas d’un patient mineur, effectuer les évaluations cliniques en présence des parents qui signent également le consentement éclairé du parent.
3. Planification de l’intervention chirurgicale et de la stimulation ovarienne contrôlée
- Planifier la procédure de prélèvement d’ovocytes laparoscopique concomitante, de cryoconservation des gamètes et de vaginoplastie laparoscopique, en tenant compte de la disponibilité de l’équipe clinique (voir ci-dessus) ainsi que de celle du personnel de laboratoire effectuant la vitrification des ovocytes.
- Commencez la stimulation ovarienne contrôlée (COS) le jour -14 à partir du jour de la chirurgie, en tenant compte d’une durée prévue de COS de n = 12 jours et des 36 heures nécessaires entre le déclenchement de l’ovulation et le prélèvement des ovocytes et la vitrification.
- Dans le cas où le COS nécessite une durée différente de celle prévue, reprogrammez la chirurgie en conséquence.
4. Stimulation ovarienne contrôlée : dose initiale, ajustements posologiques et surveillance, déclenchement de la maturation ovocytaire finale
- Commencez COS dans n’importe quelle phase du cycle ovarien, comme cela se fait couramment dans le contexte des protocoles de « démarrage aléatoire » pour la préservation de la fertilité.
- Choisissez la dose initiale d’hormone folliculo-stimulante (FSH)/gonadotrophine ménopausique humaine (hMG) en fonction de l’AFC et de l’AMH du patient, et demandez à la patiente de continuer à s’auto-administrer quotidiennement des injections sous-cutanées. Effectuer par la suite des ajustements posologiques individualisés en fonction de la réponse ovarienne.
- Surveiller la réponse ovarienne par échographie transabdominale en série et mesures concomitantes de E2 et P (jour 1, jour 6, jour 8, jour 10 et jour 12).
- Déclencher la maturation finale des ovocytes par administration sous-cutanée de 0,2 mL d’un analogue de la Gn-RH (triptoréline).
5. Procédure clinique (laparoscopie): prélèvement d’ovocytes
- Placez le patient en position de lithotomie dorsale modifiée, ce qui permet un excellent accès simultané à l’abdomen et au périnée. Induire une anesthésie générale et administrer 2 g de céfazoline par voie intraveineuse selon la prophylaxie antibiotique peropératoire de routine. Placez un cathéter de Foley intravésical.
- Établir un pneumopéritoine avec une aiguille Veress péri-ombilicale, positionner un trocart ombilical de 10 mm pour l’insertion du laparoscope et deux trocarts de 5 mm dans les quadrants supérieur droit et gauche. Sous vision laparoscopique, utilisez une aiguille à lumière unique de 17 G reliée à une pompe d’aspiration, comme couramment utilisé pour le prélèvement transvaginal, à travers les trocarts droit et gauche pour la ponction de l’ovaire droit et gauche, respectivement.
- Soulevez et maintenez les ovaires avec une pince laparoscopique pour faciliter l’exposition des follicules. Lorsque vous aspirez plusieurs follicules proches les uns des autres, retenez la pointe de l’aiguille dans l’ovaire pour réduire le nombre de fois que le cortex ovarien est transpercé et le risque inhérent de saignement.
6. Procédure clinique (laparoscopie): vaginoplastie
NOTE: Les étapes de vaginoplastie restent inchangées par rapport à la technique modifiée laparoscopique de Davydov12.
- Disséquer le péritoine en soulevant et en incisant le brin péritonéal transversalement entre les deux cornes utérines rudimentaires, puis en étendant l’incision antérieurement, latéralement et postérieurement.
- Commencer une suture à cordon coulissant en monofilament synthétique absorbable (PDS) polydioxanone 2-0 dans chaque hémibassin, à partir du péritoine mobilisé au-dessus de la vessie, avec transfixion consécutive du ligament rond, de l’isthme tubaire, du ligament utérovarien et de la feuille péritonéale latérale. Ensuite, inclure dans les deux sutures la face latérale du mésorectum et la face antérieure de la séreuse rectale, immédiatement en dessous de la jonction rectosigmoïde.
- Exposer la fossette vaginale sur l’approche périnéale et effectuer une incision en forme de H, et créer un espace néovaginal par dissection nette et émoussée de l’espace vésico-rectal. Ensuite, tirez vers le bas les marges péritonéales disséquées jusqu’au bord du vestibulum vaginal. Sutures interrompues en position dans PDS 3-0 pour l’anastomose péritonéale-vestibulaire. Enfin, placez une gaze enduite de paraffine dans le néovagin recouvert de péritoine.
7. Laboratoire de FIV : la veille du prélèvement d’ovocytes
- Préparer 2 à 5 tubes à fond rond contenant 9 ml de milieu Quinn’s Advantage avec HEPES (supplémenté en albumine sérique humaine à 5 % [HSA]) selon le nombre de follicules attendus et les incuber pendant une nuit à 37 °C.
- Préparer un ou deux plats à 4 puits avec 0,5 mL/puits de milieu fertilisant (complété par 5 % HSA), recouverts de 0,5 mL d’huile minérale pour la culture embryonnaire et l’incuber pendant la nuit à 37 °C dans une atmosphère contrôlée (6 % CO2, 5 %O2).
- Préparer un plat contenant 9 gouttes (30 μL) de milieu de culture unique continue (CSCM) (complété par un supplément de substitut de sérum à 10 % [SSS]) recouvert de 6 mL d’huile minérale. Incuber pendant une nuit à 37 °C en atmosphère contrôlée (6% CO2, 5%O2).
8. Laboratoire de FIV: procédure de prélèvement d’ovocytes
- Préparer une solution de milieu Avantage de Quinn avec HEPES (complétée par 5% HSA) avec de l’héparine à une concentration finale de 10 UI / mL dans laquelle des aspirations folliculaires seront recueillies.
- Comme pour le prélèvement transvaginal systématique d’ovocytes 13, recueillir les aspirations folliculaires dans des tubes à fond rond de 10 ml, les garder au chaud (37 °C) dans un incubateur portatif et les transporter immédiatement au laboratoire d’embryologie, avec un temps de transportd’environ 10 minutes.
- Examiner le liquide folliculaire dans une boîte de Petri stérile préchauffée de 90 mm pour identifier les complexes cumulus-ovocytes (COC). Une fois qu’un COC est détecté, rincez-le dans un plat central rempli de 1 ml de milieu Quinn’s Advantage préchauffé avec HEPES (complété par 5% HSA).
- Au fur et à mesure que tous les COC sont collectés, placez-les dans le plat à 4 puits contenant le milieu de fertilisation et étiquetez le couvercle et le fond avec des données relatives à l’identité du patient.
- Incuber à 37 °C en atmosphère contrôlée (6% CO2, 5%O2).
- S’assurer qu’une double vérification de la procédure est effectuée par un deuxième membre du personnel du laboratoire.
9. Dénudation des ovocytes
- Effectuer l’élimination des cumulus / cellules corona dans les 38 heures suivant le déclenchement de l’ovulation.
- Préparer une solution de Quinn’s Advantage Medium avec HEPES (supplémentée avec 5% HSA) avec Hyaluronidase à une concentration finale de 10 UI/mL.
- Préparer un plat central contenant 1 mL de milieu Quinn’s Advantage préchauffé avec HEPES (complété par 5 % de HSA) contenant de la hyaluronidase et un autre avec 1 mL de milieu tamponné HEPES préchauffé (complété par 5 % HSA).
- Étiquetez les boîtes de dénudation des ovocytes avec les données d’identification du patient.
- Placer les COC dans le puits central contenant l’enzyme pour disperser les cellules du cumulus avec une pipette Pasteur en verre, en pipetant doucement la solution contenant les COC de haut en bas pendant 30 s maximum.
- Déplacez les ovocytes vers le deuxième plat central contenant uniquement un milieu tamponné HEPES, en veillant à déplacer une quantité minimale de l’enzyme.
- Retirez les cellules corona restantes à l’aide de pipettes de dénudage dont le diamètre intérieur est décroissant (170-140 μm).
- Évaluer le stade de maturation des ovocytes, en séparant les ovocytes de métaphase II (MII), caractérisés par l’extrusion du premier corps polaire, des ovocytes de métaphase I (IM) et des vésicules germinales (GV).
- Transférer les ovocytes MII dans une boîte de Petri de culture FIV de 60 mm contenant neuf gouttes (30 μL) de milieu de culture unique continue (CSCM) (complétée par un supplément de substitut sérique à 10% [SSS]) recouverte de 6 mL d’huile minérale.
- Incuber à 37 °C en atmosphère contrôlée (6% CO2, 5%O2).
10. Vitrification ovocytaire
- Effectuer la vitrification des ovocytes MII immédiatement après la dénudation des ovocytes, en suivant le protocole fourni par le fabricant du kit de vitrification.
- Porter à température ambiante (25-27 °C) : la solution d’équilibration (ES), la solution de vitrification (VS) et la solution de lavage (WS), près de 30 min avant l’intervention.
REMARQUE: Comme indiqué par les fabricants, ES contient 7,5% de DMSO, 7,5% d’éthylène glycol, 20% de supplément de sérum de dextrane (DSS), Gentamicine dans un milieu tamponné M-199 HEPES; VS contient 15% de DMSO, 15% d’éthylène glycol, 0,5 M de saccharose, 20% de DSS, de gentamicine dans un milieu tamponné M-199 HEPES, et WS contient 20% de DSS, de gentamicine dans un milieu tamponné M-199 HEPES. - Pour un cryodispositif, utilisez Cryotop constitué d’une fine bande de film transparent fixée à une poignée en plastique.
- Étiquetez les cryodispositifs avec le nom de la patiente, sa date de naissance, son identifiant, sa date de cryoconservation et le nombre d’ovocytes chargés sur un seul dispositif.
- Étiquetez le plat de vitrification avec le nom et l’ID du patient.
- Assurez-vous qu’un opérateur témoin vérifie les données correctes du patient sur les cryodispositifs et la parabole.
- Remplissez une boîte de refroidissement jusqu’au sommet avec de l’azote liquide frais et couvrez jusqu’à utilisation pour minimiser la dispersion et l’évaporation.
- Utilisez une pipette décapante d’un diamètre intérieur de 170 μm pour éviter d’endommager les ovocytes pendant la manipulation.
- Agiter délicatement chaque flacon de ES, VS et WS pour mélanger le contenu avant utilisation.
- Préparer le couvercle d’une boîte de Petri de 60 mm avec une goutte de 50 μL de WS1 (Figure 1A).
- Placez les gouttes juste avant utilisation pour limiter l’évaporation du milieu.
- Prenez le plat d’ovocytes de l’incubateur et transférez les ovocytes MII (jusqu’à 3 à la fois) avec un volume minimal de milieu de la boîte de culture dans les 50 μL de WS.
- Distribuer 50 μL de gouttes de WS2, ES1 et ES2 à proximité immédiate et transférer les ovocytes de la goutte WS1 à la goutte WS2 (Figure 1B).
- Fusionner la goutte de ES1 à WS2 et attendre 2 min pour le mélange spontané des deux solutions.
- Ensuite, fusionnez la goutte de ES2 aux gouttes précédemment fusionnées et laissez reposer 2 minutes supplémentaires.
- Enfin, fusionnez une nouvelle goutte de 100 μL d’ES3 aux gouttes précédemment fusionnées et laissez reposer 1 minute supplémentaire.
- Placez les ovocytes dans une goutte de 100 μL d’ES4 pendant 10 min (Figure 1C).
- Distribuer deux gouttes de 50 μL de VS et une de 100 μL de VS (figure 1D).
- Déplacez les ovocytes séquentiellement dans les trois gouttes de VS pendant 60 s afin que les ovocytes restent dans chaque goutte pendant ~20 s.
- Lorsqu’il reste environ 10 s avant la fin des 60 s d’incubation, placer le cryodispositif au microscope.
- Transportez les ovocytes à l’extrémité de la pipette et placez-les sur le cryodispositif avec la quantité minimale de VS.
- Aspirer l’excès de VS, laissant les ovocytes recouverts d’une fine couche de VS.
- Plongez le cryodispositif directement dans l’azote liquide et déplacez-le rapidement. Gardez l’appareil dans de l’azote liquide et recouvrez-le avec le couvercle de protection.
- Entreposer le cryodispositif dans un système de stockage (p. ex., visiotube) et le placer dans le réservoir cryogénique. Consigner les données de cryoconservation dans la base de données et la feuille du laboratoire.
11. Soins postopératoires aux patients hospitalisés
- Retirez le cathéter urinaire et la gaze vaginale recouverte de paraffine 48 h après la chirurgie.
- Explorez numériquement le néovagin des patientes après le retrait et expliquez à la patiente comment effectuer l’exploration numérique. Ensuite, enduisez un moule vaginal (9 cm de longueur et 2 cm de diamètre) de gel œstrogène (pour favoriser l’épithélialisation) et expliquez à la patiente comment insérer et maintenir la moisissure.
- À partir du jour 3 après la chirurgie et chaque jour suivant, expliquez au patient comment positionner le moule et le maintenir en place pendant au moins 2 heures par jour.
- Si aucune complication ne survient, donner congé au patient le jour 5-6 après la chirurgie.
12. Soins postopératoires ambulatoires
- Expliquez à la patiente comment effectuer une dilatation néovaginale pendant 2 mois avec le même moule (9 cm de longueur et 2 cm de diamètre) utilisé pendant le séjour à l’hôpital, puis un plus grand (11 cm de longueur et 2,5 cm de diamètre).
- Après la visite de 3 mois, permettez à la patiente de commencer une activité sexuelle et informez-la de continuer à utiliser les moules les jours où il n’y a pas de rapports sexuels.
13. Suivi
- Planifiez des visites de suivi 1, 3, 6 et 12 mois après l’intervention.
- À chaque visite de suivi, évaluez l’observance des exercices de dilatation et demandez à la patiente si elle a éprouvé une limitation de ses activités quotidiennes, de la douleur, des symptômes urinaires ou un dysfonctionnement sexuel (à compter de la visite après le troisième mois après la chirurgie). Effectuer un examen gynécologique à chaque visite de suivi pour mesurer la largeur, la longueur, la suspension et la mobilité vaginales des annexes.
Résultats
Le tableau 2 comprend les données de stimulation ovarienne des patientes, tandis que les principaux résultats chirurgicaux et fonctionnels sont décrits dans le tableau 3. Les procédures laparoscopiques concomitantes de prélèvement d’ovocytes et de vaginoplastie ont été combinées avec succès chez toutes les patientes. En moyenne, 11,4 ± 5,4 ovocytes (moyenne ± écart-type) ont été prélevés et 9,6 ± 4,3 ovocytes MII ont été cryoconservés (tableau 3). Dans notre expérience de la cryoconservation des ovocytes chez les patientes subissant un TAR, le taux de survie des ovocytes post-réchauffement suivant ce protocole de vitrification - défini comme la proportion d’ovocytes morphologiquement intacts au moment de l’injection intracytoplasmique de spermatozoïdes - était de 84,5 ± 19,3. La durée opératoire moyenne totale était de 114 ± 17 minutes, la perte de sang peropératoire était insignifiante (<50 ml) chez tous les patients et aucun événement indésirable peropératoire n’a été observé. Le cathéter urinaire et la gaze vaginale ont été retirés le jour 2 après la chirurgie chez tous les patients. Le jour 3 après la chirurgie, les patients ont commencé à utiliser quotidiennement des dilatateurs et ont reçu leur congé le jour 6,0 ± 1,0. Une complication postopératoire est survenue chez un patient (fièvre se développant le jour 5 après la chirurgie et détection de liquide intrapéritonéal à l’échographie transabdominale). Le patient a été traité avec succès avec des antibiotiques administrés par voie orale et a reçu son congé le jour 9 après l’opération. Le suivi après la chirurgie a confirmé le succès anatomique et fonctionnel de la procédure. Aucun des patients n’a signalé de limitation de ses activités quotidiennes, de douleur ou de symptôme urinaire.
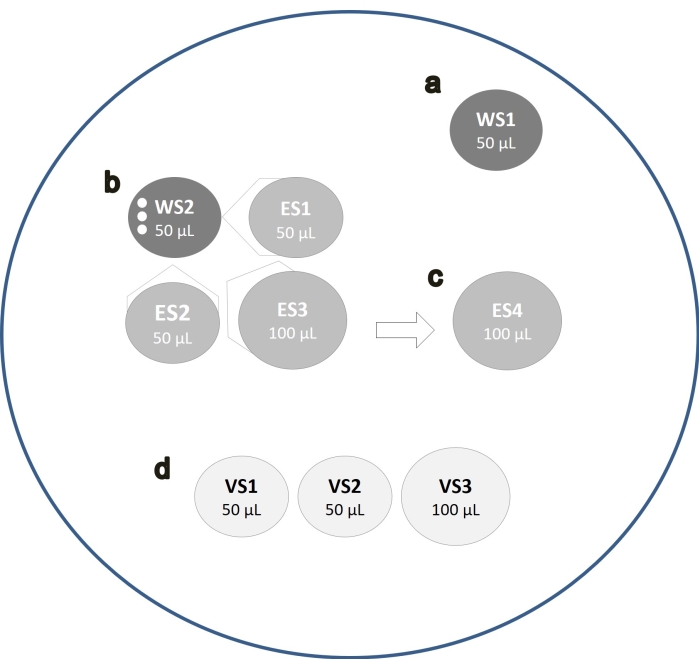
Figure 1 : Protocole de vitrification des ovocytes. Schéma montrant les différentes étapes du flux de travail de vitrification des ovocytes. Les ovocytes sont d’abord placés dans une goutte de WS1 (A), puis dans une goutte de WS2 (B). Mélanger la goutte d’ES1 dans WS2 et après 2 minutes d’incubation, fusionner la goutte de ES2 avec les gouttes précédemment fusionnées (B). Après 2 min, une troisième goutte d’ES3 est fusionnée (B). Après 1 min, placer les ovocytes dans une goutte d’ES4 en incubant pendant 10 min (C). Ensuite, les ovocytes sont déplacés séquentiellement dans les trois gouttes de VS pendant 60 s (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Caractéristique | Moyenne ± écart-type ou n (%) | |
| Âge au moment du diagnostic, années | 13,8 ± 1,5 | |
| 46 XX caryotype | 23 | |
| Âge au moment de la chirurgie, années | 20,3 ± 3,4 | |
| Nombre de follicules antraux (AFC), n | 13,2 ± 4,1 | |
| Résultats pertinents (instrumentaux/laboratoires) | ||
| Rein en fer à cheval | 2 (8.7) | |
| Ovaire/ovaires pelviens extra | 3 (13.0) | |
| Agénésie rénale unilatérale | 2 (8.7) | |
| Cardiomyopathie dilative | 1 (4.3) | |
| Mésocardie | 1 (4.3) | |
| Vater Syndrome | 1 (4.3) | |
| Perte auditive neurosensorielle | 1 (4.3) | |
| Pied bot congénital | 1 (4.3) | |
| Scoliose | 1 (4.3) | |
| Maladie cœliaque | 1 (4.3) | |
| Diabète de type 1 | 1 (4.3) | |
| Hypothyroïdie auto-immune | 1 (4.3) | |
Tableau 1 : Données démographiques, anamnestiques et cliniques des 23 patients traités jusqu’à présent.
| Moyenne ± ET | |
| Dose initiale de FSH, UI | 196 ± 44 |
| Dose totale de FSH, UI | 2 174 ± 506 |
| Jours de stimulation, n | 12,1 ± 0,4 |
| E2 niveaux au déclenchement, pg/mL | 4 330 ± 2 007 |
| Taux de P au moment du déclenchement, ng/mL | 1,06 ± 0,95 |
Tableau 2 : Données de stimulation ovarienne contrôlée des 23 patientes traitées jusqu’à présent. Abréviations : FSH = hormone folliculo-stimulante; E2 = œstradiol; P = progestérone.
| Moyenne ± écart-type ou n (%) | |
| Temps opératoire, min | 114 ± 17 |
| Séjour à l’hôpital, jours | 6,0 ± 1,0 |
| Perte de sang, ml | insignifiant |
| Ovocytes récupérés, n | 11,4 ± 5,4 |
| Ovocytes matures (vitrifiés), n | 9,6 ± 4,3 |
| Complications | |
| Aucun | 22 (95.6) |
| Fièvre postopératoire et détection du liquide intrapéritonéal | 1 (4.3) |
Tableau 3 : Résultats de la procédure laparoscopique combinée de prélèvement d’ovocytes et de vaginoplastie chez les 23 patientes traitées jusqu’à présent.
Discussion
Ce protocole réduit le caractère invasif dans le traitement du MRKHS en combinant les procédures de vaginoplastie et de prélèvement d’ovocytes. À cette fin, il est essentiel qu’une équipe dédiée soit désignée pour s’assurer que le moment de la COS, de l’intervention chirurgicale et de la vitrification ovocytaire est planifié efficacement.
Les patients atteints de MRKHS pour lesquels cette méthode laparoscopique combinée devrait être la plus bénéfique sont ceux chez qui un prélèvement transvaginal serait considéré comme techniquement difficile ou irréalisable en raison d’ovaires extrapelviens situés latéralement le long des parois pelviennes14 ou à proximité d’organes tels que le foie et la vésicule biliaire9, ou en raison de la présence de reins pelviens. Chez ces patients, une approche transabdominale pourrait être hypothétique et a été rapportée dans la littérature: néanmoins, un nombre moyen de 4,92 ± 1,7 ovocytes a été recueilli15, suggérant un prélèvement sous-optimal en raison de limitations techniques. En outre, une approche transabdominale peut être difficile ou impossible dans certains cas, comme chez les patientes présentant une épaisseur de paroi abdominale marquée ou une mauvaise visibilité des ovaires en raison des anses sus-jacentes de l’intestin16.
La sécurité est une force remarquable de cette approche. En plus des avantages d’une visualisation et d’un accès optimaux décrits ci-dessus, la combinaison de deux procédures en une seule réduit les risques anesthésiques. Il convient de noter qu’un temps opératoire similaire est maintenu par rapport à celui de la vaginoplastie laparoscopique de Davydov seule, pour laquelle une durée moyenne de 125 minutes a été rapportée dans la littérature12. De plus, le fait que les patientes subissent le COS à un très jeune âge plutôt que plus tard dans la vie n’implique pas un risque accru de syndrome d’hyperstimulation ovarienne pour elles, car cette complication est efficacement évitée en déclenchant la maturation folliculaire finale avec un analogue de la Gn-RH.
Les lignes directrices actuelles pour les MRKHS exigent que les cliniciens examinent les options futures pour avoir des enfants avec des patients et des parents au moment du diagnostic afin de les aider à faire face à la maladie et à ses implications1. L’adoption, la maternité de substitution ou la greffe utérine sont les solutions disponibles, les deux options pour la maternité biologique nécessitant le prélèvement d’ovocytes17. Cette approche laparoscopique combinée pourrait donc également être particulièrement bénéfique chez les patients atteints de MRKHS exprimant une détresse majeure à propos de leur diagnostic d’infertilité18. En fait, des enquêtes ont montré que l’infertilité peut être l’une des conditions les plus difficiles à accepter pour les patients recevant le diagnostic de MRKHS19. La cryoconservation précoce des ovocytes chez les patientes désireuses d’une future progéniture génétique pourrait atténuer leur détresse psychologique, par rapport au report de cette intervention invasive nécessaire à une date indéfinie dans le futur.
Cependant, comme principale limite à cette approche, toutes les patientes qui optent pour la cryoconservation des ovocytes dès le moment de la vaginoplastie ne poursuivront pas leur désir de maternité génétique dans leurs dernières années d’âge adulte. Pour cette raison, l’équipe devrait également obtenir et consigner la décision de la patiente concernant l’utilisation de ses ovocytes dans le cas où elle cesserait de rénover la cryoconservation (c.-à-d. élimination, don à des fins de recherche, don ou vente pour reproduction hétérologue lorsque cela est légal).
Comme modification possible de cette technique, nous prévoyons l’utilisation de sondes échographiques laparoscopiques, qui pourraient aider l’expert en infertilité à perforer les follicules situés loin de la surface ovarienne. Enfin, nous envisageons que le renforcement de l’expertise dans le prélèvement d’ovocytes laparoscopiques pour la préservation de la fertilité à l’occasion d’autres procédures pourrait permettre la disponibilité de cette option. À titre d’exemple, les patients subissant d’autres procédures laparoscopiques telles que la myomectomie et présentant une indication de préservation de la fertilité pourraient bénéficier de cette approche.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Aucun financement spécifique n’a été reçu pour ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| Oocyte retrieval procedure | |||
| Equipment | |||
| CO2 O2 Incubator | Sanyo | ||
| Incubator | Thermo Scientific | ||
| Laminar Flow Hood | Cooper Surgical | ||
| Portable incubator | Cooper Surgical | ||
| Stereomicroscope | Nikon | ||
| Consumables | |||
| 14 mL Polystyrene Round-Bottom Tube | Falcon | 352057 | |
| 4-well dish | Nunc | 144444 | |
| 60 mm Petri dish | Nunc | FA9150270 | |
| 90 mm Petri dish | Nunc | FA9150360 | |
| Human Serum Albumin 100 mg/ml in Normal Saline (5%) | Origio | 3001 | |
| Mineral oil for embryo culture | Origio | 4008 | |
| One Well Dish | Oosafe | OOPW-CW05 | |
| Quinn’s Advantage Fertilization medium SAGE | Origio | 1020 | |
| Quinn’s Advantage medium with HEPES | Origio | 1024 | |
| Sterile glass pasteur pipettes | |||
| Oocyte denudation | |||
| Equipment | |||
| CO2 O2 Incubator | Sanyo | ||
| Flexipet adjustable handle set | Cook | G18674 | |
| Incubator | Thermo Scientific | ||
| Laminar Flow Hood | Cooper Surgical | ||
| Stereomicroscope | Nikon | ||
| Consumables | |||
| 4-well dish | Nunc | 144444 | |
| CSCM (Continuos single culture) medium | Fujifilm irvine Scientific | 90165 | |
| Human Albumin 100 mg/mL in Normal Saline (5%) | Origio | 3001 | |
| Hyaluronidase | Fujifilm Irvine Scientific | 90101 | |
| IVF culture 60 mm petri dish | Nunc | FA9150270 | |
| Mineral oil for embryo culture | Origio | 4008 | |
| One Well Dish | Oosafe | OOPW-CW05 | |
| Quinn’s Advantage medium with HEPES | Origio | 1024 | |
| Serum Substitute Supplement | Fujifilm irvine Scientific | 99193 | |
| Sterile glass pasteur pipettes | |||
| Stripping pipette tips (140 μm) | Cook | K-FPIP-1140-10BS-5 | |
| Stripping pipette tips (170 μm) | Cook | K-FPIP-1170-10BS-5 | |
| Oocyte vitrification | |||
| 35 mm Petri dish | NUNC | 150255 | |
| 60 mm Petri dish | NUNC | 150270 | |
| 90 mm Petri dish | NUNC | 150360 | |
| Container for Cooling rack | Kitazato | ||
| Cryodevice/cryotop | Kitazato | 81111 | |
| Electronic timer | |||
| Flexipet | COOK | K- 1000 | |
| Gilson Pipetman | Gilson | F123601 | |
| Lab Printer LabXpert | Brady | XSL-86-461 | |
| Tips 20-200 µL | Thermo Scientific | 2160G | |
| Tips 2-20 µL | Thermo Scientific | 2139-HR | |
| Visotubes | Cryo Bio System | 20 | |
| Vitrification Freeze Kit | Fujifilm Irvine Scientific | 90133-SO | |
| Vitrification Thaw kit | Fujifilm Irvine Scientific | 90137-SO |
Références
- Committee on Adolescent Health Care. ACOG Committee Opinion No. 728: Müllerian Agenesis: Diagnosis, Management, And Treatment. Obstetrics and Gynecology. 131 (1), 35-42 (2018).
- Reichman, D. E., Laufer, M. R. Mayer-Rokitansky-Küster-Hauser syndrome: Fertility counseling and treatment. Fertility and Sterility. 94 (5), 1941-1943 (2010).
- Ben-Rafael, Z., Bar-Hava, I., Levy, T., Orvieto, R. Simplifying ovulation induction for surrogacy in women with Mayer-Rokitansky-Kuster-Hauser syndrome. Human Reproduction. 13 (6), 1470-1471 (1998).
- Beski, S., Gorgy, A., Venkat, G., Craft, I. L., Edmonds, K. Gestational surrogacy: a feasible option for patients with Rokitansky syndrome. Human Reproduction. 15 (11), 2326-2328 (2000).
- Brännström, M., et al. Livebirth after uterus transplantation. Lancet. 385 (9968), 607-616 (2015).
- Sreenivas, K., Campo-Engelstein, L. Domestic and international surrogacy laws: implications for cancer survivors. Cancer Treatment and Research. 156, 135-152 (2010).
- Soderstrom-Anttila, V., et al. Surrogacy: outcomes for surrogate mothers, children and the resulting families-a systematic review. Human Reproductive Update. 22 (2), 260-276 (2016).
- Wood, E. G., Batzer, F. R., Corson, S. L. Ovarian response to gonadotrophins, optimal method for oocyte retrieval and pregnancy outcome in patients with vaginal agenesis. Human Reproduction. 14 (5), 1178-1181 (1999).
- Raziel, A., et al. Surrogate in vitro fertilization outcome in typical and atypical forms of Mayer-Rokitansky-Kuster-Hauser syndrome. Human Reproduction. 27 (1), 126-130 (2012).
- Egarter, C., Huber, J. Successful stimulation and retrieval of oocytes in patient with Mayer-Rokitansky-Küster syndrome. Lancet. 1 (8597), 1283(1988).
- Candiani, M., et al. Oocyte retrieval during laparoscopic vaginoplasty to reduce invasiveness in the treatment of Mayer-Rokitansky-Küster-Hauser syndrome. Journal of Minimally Invasive Gynecology. 27 (1), 74-79 (2020).
- Fedele, L., et al. Creation of a neovagina by Davydov's laparoscopic modified technique in patients with Rokitansky syndrome. American Journal of Obstetrics and Gynecology. 202 (1), 1-6 (2010).
- ESHRE Working Group on Ultrasound in ART et al. Recommendations for good practice in ultrasound: oocyte pick up. Human Reproduction Open. 2019 (4), (2019).
- Callens, N., et al. An update on surgical and non-surgical treatments for vaginal hypoplasia. Human Reproductive Update. 20 (5), 775-801 (2014).
- Sönmezer, M., Gülümser, Ç, Sönmezer, M., Sükür, Y. E., Atabekoğlu, C. Transabdominal ultrasound guided oocyte retrieval using vaginal ultrasound probe: Definition of the technique. The Journal of Obstetrics and Gynaecology Research. 47 (2), 800-806 (2021).
- Raju, G. A., Haranath, G. B., Krishna, K. M., Prakash, G. J., Madan, K. Successful pregnancy with laparoscopic oocyte retrieval and in vitro fertilization in Mullerian agenesis. Singapore Medicine Journal. 47 (4), 329-331 (2006).
- Liszewska-Kapłon, M., Strózik, M., Kotarski, Ł, Bagłaj, M., Hirnle, L. Mayer-Rokitansky-Küster-Hauser syndrome as an interdisciplinary problem. Advances in Clinical and Experimental Medicine. 29 (4), 505-511 (2020).
- Wagner, A., et al. Treatment management during the adolescent transition period of girls and young women with Mayer-Rokitansky-Küster-Hauser syndrome (MRKHS): A systematic literature review. Orphanet Journal of Rare Diseases. 11 (1), 152(2016).
- Bean, E. J., Mazur, T., Robinson, A. D. Mayer-Rokitansky-Küster-Hauser syndrome: sexuality, psychological effects, and quality of life. Journal of Pediatric and Adolescent Gynecology. 22 (6), 339-346 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon