Method Article
Recuperación laparoscópica de ovocitos y criopreservación durante la vaginoplastia para el tratamiento del síndrome de Mayer-Rokitansky-Kuster-Hauser
* Estos autores han contribuido por igual
En este artículo
Resumen
Un equipo dedicado puede ofrecer a las pacientes de Mayer-Rokitansky-Kuster-Hauser la opción de realizar estimulación ovárica controlada y criopreservación de ovocitos en el momento de la vaginoplastia laparoscópica.
Resumen
En pacientes con síndrome de Mayer-Rokitansky-Kuster-Hauser (MRKHS) que están programadas para vaginoplastia laparoscópica y tienen un deseo de maternidad biológica, proponemos que se realice una recuperación laparoscópica concomitante de ovocitos para criopreservación. La recuperación de ovocitos se persigue al comienzo de la laparoscopia. Se colocan trócares de 5 mm derecho e izquierdo, a través del cual se utiliza una aguja de aspiración de óvulo de 17 G para la punción de los ovarios derecho e izquierdo, respectivamente. Para facilitar la exposición de los folículos, los ovarios se movilizan y se sostienen con fórceps laparoscópicos.
Al aspirar múltiples folículos cerca uno del otro, la punta de la aguja se retiene en el ovario para reducir el número de veces que la corteza ovárica está paralizada y debido al riesgo inherente de sangrado. Los pasos posteriores no cambian en comparación con la técnica modificada laparoscópica de Davydov para la vaginoplastia. Antes de la cirugía, la estimulación ovárica controlada se realiza con un protocolo antagonista de la hormona liberadora de hormona gonadotropina (Gn-RH), y el procedimiento concomitante de recuperación de ovocitos y vaginoplastia se programa 36 h después del desencadenante final de la maduración folicular. El líquido folicular se recoge en los mismos tubos estériles de 10 ml utilizados durante la recuperación transvaginal de ovocitos y se transfiere en un bloque de calentamiento (37 °C) al laboratorio de reproducción asistida, donde se vitrifican ovocitos maduros (metafase II).
En este caso, una serie de 23 mujeres con MRKH, ovocitos fueron recuperados con éxito y criopreservados en todas las pacientes; La vaginoplastia se realizó posteriormente sin modificaciones, y la atención postoperatoria para pacientes hospitalizados y ambulatorios (día de la retirada del catéter urinario, día del alta hospitalaria, uso del dilatador y comodidad en el seguimiento) no se vio afectada. Una complicación postoperatoria ocurrió en un paciente (fiebre que se desarrolló el día 5 después de la cirugía y detección de líquido intraperitoneal en la ecografía transabdominal) y se resolvió después del tratamiento conservador. En lugar de realizar vaginoplastia quirúrgica y retrasar la recuperación de ovocitos en pacientes con MRKH, este enfoque combina ambos procedimientos en una sola laparoscopia, minimizando así la invasividad quirúrgica y los riesgos anestésicosicos.
Introducción
Con una incidencia de aproximadamente 1 de cada 4-10.000 mujeres, MRKHS es la causa del 15% de los casos de amenorrea primaria. MRKHS se caracteriza por la ausencia congénita del segmento superior de la vagina y el útero, mientras que las anomalías del tracto urinario y esquelético se asocian de manera variable. Más específicamente, una bóveda vaginal con una profundidad de 1-2 cm suele estar presente, y se pueden encontrar dos cuernos uterinos rudimentarios1.
En el pasado, el interés médico primario en MRKHS era permitir las relaciones sexuales normales, que generalmente requieren la construcción de una neovagina por abordajes no quirúrgicos o quirúrgicos2. Sin embargo, los avances en medicina reproductiva actualmente permiten la maternidad genética en pacientes con MRKHS, ya sea por subrogación3,4 o, más recientemente, por trasplante de útero5. Si bien el trasplante de útero es todavía un procedimiento experimental, la subrogación está disponible en muchos países del mundo6, y los resultados obstétricos y psicosociales informados son comparables a los de la fertilización in vitro estándar y la donación de ovocitos7.
Tanto la gestación subrogada como el trasplante de útero requieren la recuperación de ovocitos y la fertilización in vitro, pero no existe consenso sobre cómo realizar la recolección de óvulos en pacientes con MRKHS. El abordaje transvaginal puede ser inviable debido a la elasticidad vaginal insuficiente8 incluso después de la vaginoplastia, la localización atípica de los ovarios9 o la distancia excesiva entre los ovarios y el manguito vaginal 4,10. En estos casos, la recuperación laparoscópica de ovocitos representa el enfoque óptimo en términos de acceso quirúrgico. Sin embargo, como la mayoría de las pacientes con MRKHS actualmente se someten a neovaginoplastia laparoscópica, sugerimos realizar una recuperación laparoscópica de ovocitos en el momento de la cirugía para la vaginoplastia11, seguida de la criopreservación de ovocitos para uso futuro, minimizando así la invasividad y combinando el tratamiento de la función sexual y reproductiva de las pacientes con MRKHS.
Datos demográficos de los pacientes
Veintitrés pacientes con MRKH se sometieron a tratamiento con este protocolo hasta el momento. Los hallazgos anamnésicos, instrumentales y de laboratorio de los pacientes se resumen en la Tabla 1. A menos que se especifique en la Tabla 1, no se encontraron anomalías congénitas asociadas.
Protocolo
El comité ético local en el centro de referencia terciaria para MRKHS (IRCCS San Raffaele University Hospital, Milán, Italia) fue notificado y aprobó el protocolo antes de su implementación en julio de 2017. Todos los pacientes o tutores dieron su consentimiento informado firmado para la recuperación laparoscópica de ovocitos y la criopreservación durante la vaginoplastia y para el uso de datos clínicos/de laboratorio anónimos con fines científicos.
1. Composición del equipo
- Designe un equipo dedicado, compuesto por un cirujano laparoscópico experimentado, un cirujano vaginal experimentado, un experto en infertilidad, un psicólogo dedicado y una enfermera comprometida.
- Ayudar al paciente como equipo durante toda la configuración y realización del procedimiento.
2. Análisis diagnóstico y asesoramiento
- Realizar ecografía pélvica y abdominal transabdominal en la paciente para visualización de los ovarios y estimación del recuento de folículos antrales (AFC). Evaluar los niveles sanguíneos de hormona antimülleriana (AMH) para optimizar la dosis inicial de gonadotropina para la estimulación ovárica controlada. Realizar pruebas serológicas para enfermedades infecciosas (VIH-Ab, VHC-Ab, VHB-Ab, RPR-TPHA) de acuerdo con los protocolos nacionales/locales para la criopreservación de tejidos/gametos.
- Asesorar a la paciente sobre los aspectos sexuales y reproductivos de MRKHS, incluida la vaginoplastia quirúrgica y no quirúrgica, los costos y la legislación relacionada con la subrogación, la perspectiva del trasplante uterino en el contexto de un programa experimental, los diferentes enfoques disponibles para la recuperación de ovocitos y el rendimiento de la criopreservación de ovocitos en términos de tasas de nacidos vivos.
- Ofrecer a la paciente una evaluación psicológica para apoyarla durante el procedimiento y evaluar la estabilidad emocional y el compromiso y el deseo de una futura maternidad. Obtener el consentimiento informado y firmado para la recuperación laparoscópica concomitante de ovocitos, la criopreservación de gametos y la vaginoplastia laparoscópica. En el caso de un paciente menor de edad, realizar las evaluaciones clínicas en presencia de los padres que también firman el consentimiento informado del familiar.
3. Programación del procedimiento quirúrgico y de la estimulación ovárica controlada
- Programe el procedimiento de recuperación laparoscópica concomitante de ovocitos, criopreservación de gametos y vaginoplastia laparoscópica, teniendo en cuenta la disponibilidad del equipo clínico (ver arriba), así como la del personal de laboratorio que realiza la vitrificación de ovocitos.
- Iniciar la estimulación ovárica controlada (COS) el día -14 desde el día de la cirugía, teniendo en cuenta una duración planificada de COS de n = 12 días y las 36 h necesarias entre la activación de la ovulación y la recuperación y vitrificación de ovocitos.
- En caso de que COS requiera una duración diferente de la esperada, reprograme la cirugía en consecuencia.
4. Estimulación ovárica controlada: dosis inicial, ajustes de dosis y seguimiento, activación de la maduración final de los ovocitos
- Iniciar COS en cualquier fase del ciclo ovárico, como se hace comúnmente en el contexto de protocolos de "inicio aleatorio" para la preservación de la fertilidad.
- Elija la dosis inicial de hormona foliculoestimulante (FSH)/gonadotropina menopáusica humana (hMG) en función de la AFC y la AMH del paciente, e indique al paciente que continúe con las inyecciones subcutáneas autoadministradas diariamente. Realizar ajustes de dosis individualizados posteriormente en función de la respuesta ovárica.
- Monitorizar la respuesta ovárica mediante ecografía transabdominal seriada y mediciones concomitantes de E2 y P (día 1, día 6, día 8, día 10 y día12 ).
- Desencadenar la maduración final de los ovocitos mediante la administración subcutánea de 0,2 mL de un análogo de Gn-RH (triptorelina).
5. Procedimiento clínico (laparoscopia): recuperación de ovocitos
- Posicionar al paciente en posición de litotomía dorsal modificada, lo que permite un excelente acceso simultáneo al abdomen y al perineo. Inducir anestesia general y administrar 2 g de cefazolina por vía intravenosa según la profilaxis antibiótica intraoperatoria de rutina. Coloque un catéter de Foley intravesical.
- Establecer neumoperitoneo con una aguja de Veress periumbilical, colocar un trócar umbilical de 10 mm para la inserción del laparoscopio y dos trócares de 5 mm en los cuadrantes superior derecho e izquierdo. Bajo visión laparoscópica, use una aguja de 17 G de un solo lumen conectada a una bomba de aspiración, como se emplea comúnmente para la recuperación transvaginal, a través de los trócares derecho e izquierdo para la punción del ovario derecho e izquierdo, respectivamente.
- Levante y sostenga los ovarios con fórceps laparoscópicos para facilitar la exposición de los folículos. Al aspirar múltiples folículos que están uno cerca del otro, retenga la punta de la aguja en el ovario para reducir el número de veces que la corteza ovárica está paralizada y el riesgo inherente de sangrado.
6. Procedimiento clínico (laparoscopia): vaginoplastia
NOTA: Los pasos de la vaginoplastia permanecen sin cambios en comparación con la técnica modificada laparoscópica de Davydov12.
- Diseccionar el peritoneo levantando e incisando la hebra peritoneal transversalmente entre los dos cuernos uterinos rudimentarios, y luego extendiendo la incisión anterior, lateral y posteriormente.
- Comience una sutura de cuerda de bolso en monofilamento 2-0 absorbible sintético (PDS) de polidioxanona en cada hemipelvis, desde el peritoneo movilizado por encima de la vejiga, con transfixión consecutiva del ligamento redondo, el istmo tubárico, el ligamento uteroovárico y la hoja peritoneal lateral. Luego, incluya en las dos suturas la cara lateral del mesorrecto y la cara anterior de la serosa rectal, inmediatamente debajo de la unión rectosigmoidea.
- Exponga el hoyuelo vaginal en el enfoque perineal y realice una incisión en forma de H, y cree un espacio neovaginal mediante la disección aguda y roma del espacio vesicorectal. Luego, tire hacia abajo de los márgenes peritoneales disecados hasta el borde del vestíbulo vaginal. Posición de suturas interrumpidas en PDS 3-0 para la anastomosis peritoneal-vestibular. Por último, coloque una gasa recubierta de parafina en la neovagina recubierta de peritoneo.
7. Laboratorio de FIV: el día antes de la recuperación de ovocitos
- Preparar de 2 a 5 tubos de fondo redondo con 9 ml de Quinn's Advantage Medium con HEPES (suplementado con albúmina sérica humana al 5% [HSA]) de acuerdo con el número de folículos esperados e incubarlos durante la noche a 37 °C.
- Preparar uno o dos platos de 4 pocillos con 0,5 mL/pocillo de Medio de Fertilización (suplementado con 5% HSA), cubiertos con 0,5 mL de aceite mineral para cultivo embrionario e incubarlo durante la noche a 37 °C en atmósfera controlada (6% CO2, 5%O2).
- Prepare un plato que contenga 9 (30 μL) gotas de medio de cultivo único continuo (CSCM) (suplementado con suplemento sustituto de suero [SSS] al 10%) cubierto con 6 ml de aceite mineral. Incubarlo durante la noche a 37 °C en atmósfera controlada (6% CO2, 5%O2).
8. Laboratorio de FIV: procedimiento de recuperación de ovocitos
- Preparar una solución de Quinn's Advantage Medium con HEPES (suplementada con HSA al 5%) con heparina a una concentración final de 10 UI/ml en la que se recogerán aspirados foliculares.
- Similar a la recuperación transvaginal de ovocitos 13 de rutina, recoger los aspirados foliculares en tubos de fondo redondo de 10 ml, mantenerlos calientes (37 °C) en una incubadora portátil y transportarlos inmediatamente al laboratorio de embriología, con un tiempo de transporte de aproximadamente10 min.
- Examinar el líquido folicular en una placa de Petri estéril de 90 mm precalentada para identificar complejos cúmulo-ovocitos (AOC). Una vez que se detecte un AOC, enjuáguelo en un plato de pocillo central lleno de 1 ml de Quinn's Advantage Medium precalentado con HEPES (complementado con HSA al 5%).
- A medida que se recolectan todos los AOC, colóquelos en el plato de 4 pocillos que contiene el medio de fertilización y etiquete la tapa y el fondo con datos relacionados con la identidad del paciente.
- Incubarlos a 37 °C en atmósfera controlada (6% CO2, 5%O2).
- Asegúrese de que un segundo miembro del personal del laboratorio realice una doble verificación del procedimiento.
9. Denudación de ovocitos
- Realice la eliminación de células cúmulos/coronas dentro de las 38 h posteriores al desencadenante de la ovulación.
- Preparar una solución de Quinn's Advantage Medium con HEPES (suplementado con HSA al 5%) con hialuronidasa a una concentración final de 10 UI/ml.
- Prepare un plato de pocillo central con 1 ml de medio Quinn's Advantage precalentado con HEPES (suplementado con HSA al 5%) que contenga hialuronidasa y otro con 1 ml de medio tamponado con HEPES precalentado (suplementado con HSA al 5%).
- Etiquete las placas de denudación de ovocitos con los datos de identificación del paciente.
- Colocar los AOC en el pocillo central que contiene la enzima para dispersar las células del cúmulo con una pipeta de vidrio Pasteur, pipeteando suavemente la solución que contiene AOC hacia arriba y hacia abajo durante un máximo de 30 s.
- Mover los ovocitos a la segunda placa de pocillo central que contenga solo medio tamponado con HEPES, asegurándose de desplazar una cantidad mínima de la enzima.
- Retire las células corona restantes utilizando pipetas desnudas con diámetros interiores decrecientes (170-140 μm).
- Evaluar la etapa de maduración de los ovocitos, separando los ovocitos de metafase II (MII), caracterizados por la extrusión del primer cuerpo polar, de los ovocitos de metafase I (IM) y las vesículas germinales (GV).
- Transfiera los ovocitos MII en una placa de Petri de 60 mm de cultivo de FIV que contenga nueve (30 μL) gotas de medio de cultivo único continuo (CSCM) (suplementado con suplemento sustituto de suero al 10% [SSS]) cubierto con 6 ml de aceite mineral.
- Incubarlos a 37 °C en atmósfera controlada (6% CO2, 5%O2).
10. Vitrificación de ovocitos
- Realizar la vitrificación de ovocitos MII inmediatamente después de la denudación de ovocitos, siguiendo el protocolo proporcionado por el fabricante del kit de vitrificación.
- Llevar a temperatura ambiente (25-27 °C): la solución de equilibrio (ES), la solución de vitrificación (VS) y la solución de lavado (WS), casi 30 min antes del procedimiento.
NOTA: Según lo informado por los fabricantes, ES contiene 7.5% DMSO, 7.5% etilenglicol, 20% suplemento de suero de dextrano (DSS), gentamicina en M-199 HEPES-buffered Medium; VS contiene 15% de DMSO, 15% de etilenglicol, 0,5 M de sacarosa, 20% de DSS, gentamicina en un medio tamponado con M-199 HEPES y WS contiene 20% de DSS, gentamicina en un medio tamponado con M-199 HEPES. - Para un criodispositivo, use Cryotop que consiste en una tira fina de película transparente unida a un mango de plástico.
- Etiquete los criodispositivos con el nombre del paciente, la fecha de nacimiento, la identificación, la fecha de criopreservación y el número de ovocitos cargados en cualquier dispositivo.
- Etiquete la placa de vitrificación con el nombre y la identificación del paciente.
- Asegúrese de que un operador testigo verifique los datos correctos del paciente en los criodispositivos y la plata.
- Llene una caja de enfriamiento hasta la parte superior con nitrógeno líquido fresco y cubra hasta que la use para minimizar la dispersión y la evaporación.
- Utilice una pipeta pelante con un diámetro interior de 170 μm para evitar dañar los ovocitos durante la manipulación.
- Agite suavemente cada vial de ES, VS y WS para mezclar el contenido antes de usarlo.
- Prepare la tapa de una placa de Petri de 60 mm con una gota de 50 μL de WS1 (Figura 1A).
- Coloque las gotas justo antes de usarlas para limitar la evaporación media.
- Tome la placa de ovocitos de la incubadora y transfiera los ovocitos MII (hasta 3 a la vez) con un volumen mínimo de medio desde la placa de cultivo a los 50 μL de WS.
- Dispensar gotas de 50 μL de WS2, ES1 y ES2 en estrecha proximidad y transferir ovocitos de la gota WS1 a la gota WS2 (Figura 1B).
- Combine la gota de ES1 a WS2 y espere 2 minutos para la mezcla espontánea de ambas soluciones.
- Luego, combine la gota de ES2 con las gotas previamente fusionadas y déjela durante otros 2 minutos.
- Finalmente, combine una nueva gota de 100 μL de ES3 con las gotas previamente fusionadas y déjela durante 1 minuto adicional.
- Colocar los ovocitos en una gota de 100 μL de ES4 durante 10 min (Figura 1C).
- Dispensar dos gotas de 50 μL de VS y una de 100 μL de VS (Figura 1D).
- Mueva los ovocitos secuencialmente en las tres gotas de VS durante 60 s para que los ovocitos permanezcan en cada gota durante ~ 20 s.
- Cuando queden aproximadamente 10 s antes del final de los 60 s de incubación, coloque el criodispositivo bajo el microscopio.
- Llevar los ovocitos en la punta de la pipeta y colocarlos en el criodispositivo con la cantidad mínima de VS.
- Aspirar el exceso de VS, dejando los ovocitos cubiertos por una fina capa de VS.
- Sumerja el criodispositivo directamente en nitrógeno líquido y muévalo rápidamente. Mantenga el dispositivo en nitrógeno líquido y cúbralo con la tapa protectora.
- Guarde el criodispositivo en un sistema de almacenamiento (por ejemplo, visiotube) y colóquelo en el tanque criogénico. Registre los datos de criopreservación en la base de datos y la hoja del laboratorio.
11. Atención postoperatoria para pacientes hospitalizados
- Retirar el catéter urinario y la gasa vaginal recubierta de parafina 48 h después de la cirugía.
- Explore digitalmente la neovagina de la paciente después de la extracción e instruya a la paciente sobre cómo realizar la exploración digital. Luego, cubra un molde vaginal (9 cm de largo y 2 cm de diámetro) con gel de estrógeno (para favorecer la epitelización) e instruya a la paciente sobre cómo insertar y mantener el moho.
- A partir del día 3 después de la cirugía y cada día siguiente, instruya al paciente sobre cómo colocar el molde y mantenerlo en su lugar durante al menos 2 h diarias.
- Si no se producen complicaciones, dar de alta al paciente el día 5-6 después de la cirugía.
12. Atención postoperatoria ambulatoria
- Instruir a la paciente sobre cómo realizar la dilatación neovaginal durante 2 meses con el mismo molde (9 cm de longitud y 2 cm de diámetro) utilizado durante la estancia hospitalaria, y luego uno más grande (11 cm de longitud y 2,5 cm de diámetro).
- Después de la visita de 3 meses, permita que la paciente comience la actividad sexual e infórmele que siga usando los moldes en los días en que no haya relaciones sexuales.
13. Seguimiento
- Programe visitas de seguimiento a los 1, 3, 6 y 12 meses después del procedimiento.
- En cada visita de seguimiento, evalúe el cumplimiento de los ejercicios de dilatación y pregunte al paciente si ha experimentado alguna limitación en sus actividades de la vida diaria, dolor, síntomas urinarios o disfunción sexual (a partir de la visita después del tercer mes después de la cirugía). Realice un examen ginecológico en cada visita de seguimiento para medir el ancho, la longitud, la suspensión y la movilidad de los anexos vaginales.
Resultados
La Tabla 2 incluye los datos de estimulación ovárica de las pacientes, mientras que los principales resultados quirúrgicos y funcionales se describen en la Tabla 3. Los procedimientos laparoscópicos concomitantes de recuperación de ovocitos y vaginoplastia se combinaron con éxito en todas las pacientes. Se recuperaron un promedio de 11,4 ± 5,4 ovocitos (media ± DE) y 9,6 ± 4,3 ovocitos MII fueron criopreservados (Tabla 3). En nuestra experiencia con la criopreservación de ovocitos en pacientes sometidas a TRA, la tasa de supervivencia de ovocitos postcalentamiento siguiendo este protocolo de vitrificación, definida como la proporción de ovocitos morfológicamente intactos en el momento de la inyección intracitoplasmática de espermatozoides, fue de 84,5 ± 19,3. El tiempo operatorio promedio total fue de 114 ± 17 min, la pérdida de sangre intraoperatoria fue insignificante (<50 ml) en todos los pacientes y no se observaron eventos adversos intraoperatorios. El catéter urinario y la gasa vaginal se retiraron el día 2 después de la cirugía en todas las pacientes. En el día 3 después de la cirugía, los pacientes comenzaron el uso diario del dilatador y fueron dados de alta en el día 6,0 ± 1,0. Una complicación postoperatoria ocurrió en un paciente (fiebre que se desarrolló el día 5 después de la cirugía y detección de líquido intraperitoneal en la ecografía transabdominal). El paciente fue tratado con éxito con antibióticos administrados por vía oral y dado de alta el día 9 después de la cirugía. El seguimiento después de la cirugía confirmó el éxito anatómico y funcional del procedimiento. Ninguno de los pacientes informó ninguna limitación a sus actividades de la vida diaria, ningún dolor o síntoma urinario.
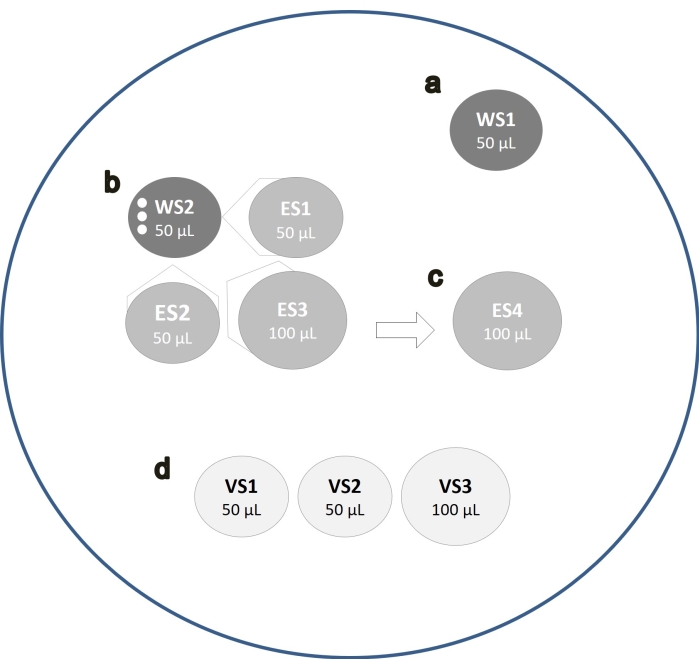
Figura 1: Protocolo de vitrificación ovocitos. Esquema que muestra los diversos pasos del flujo de trabajo de vitrificación de los ovocitos. Los ovocitos se colocan primero en una gota de WS1 (A) y luego en una gota de WS2 (B). Mezcle la gota de ES1 en WS2 y después de 2 minutos de incubación, combine la gota de ES2 con las gotas previamente fusionadas (B). Después de 2 minutos, una tercera gota de ES3 se fusiona (B). Después de 1 min, colocar los ovocitos en una gota de ES4 incubando durante 10 min (C). Luego, los ovocitos se mueven secuencialmente en las tres gotas de VS durante 60 s (D). Haga clic aquí para ver una versión más grande de esta figura.
| Característica | Media ± DE o n (%) | |
| Edad en el momento del diagnóstico, años | 13,8 ± 1,5 | |
| Cariotipo 46 XX | 23 | |
| Edad en el momento de la cirugía, años | 20,3 ± 3,4 | |
| Recuento de folículos antrales (AFC), n | 13.2 ± 4.1 | |
| Hallazgos relevantes (instrumentales/de laboratorio) | ||
| Riñón en herradura | 2 (8.7) | |
| Ovario/ovarios pélvicos adicionales | 3 (13.0) | |
| Agenesia renal unilateral | 2 (8.7) | |
| Miocardiopatía dilatativa | 1 (4.3) | |
| Mesocardia | 1 (4.3) | |
| Síndrome de Vater | 1 (4.3) | |
| Pérdida auditiva neurosensorial | 1 (4.3) | |
| Pie zambo congénito | 1 (4.3) | |
| Escoliosis | 1 (4.3) | |
| Enfermedad celíaca | 1 (4.3) | |
| Diabetes tipo 1 | 1 (4.3) | |
| Hipotiroidismo autoinmune | 1 (4.3) | |
Tabla 1: Datos demográficos, anamnésicos y clínicos de los 23 pacientes tratados hasta el momento.
| Media ± SD | |
| Dosis inicial de FSH, UI | 196 ± 44 |
| Dosis total de FSH, UI | 2.174 ± 506 |
| Días de estimulación, n | 12,1 ± 0,4 |
| Niveles de E2 en el momento de la activación, pg/mL | 4.330 ± 2.007 |
| Niveles de p en el momento de la activación, ng/mL | 1,06 ± 0,95 |
Tabla 2: Datos de estimulación ovárica controlada de las 23 pacientes tratadas hasta el momento. Abreviaturas: FSH = hormona foliculoestimulante; E2 = estradiol; P = progesterona.
| Media ± DE o n (%) | |
| Tiempo operatorio, min | 114 ± 17 |
| Estancia hospitalaria, días | 6.0 ± 1.0 |
| Pérdida de sangre, mL | insignificante |
| Ovocitos recuperados, n | 11,4 ± 5,4 |
| Ovocitos maduros (vitrificados), n | 9.6 ± 4.3 |
| Complicaciones | |
| Ninguno | 22 (95.6) |
| Fiebre postoperatoria y detección de líquido intraperitoneal | 1 (4.3) |
Tabla 3: Resultados del procedimiento laparoscópico combinado de recuperación de ovocitos y vaginoplastia en las 23 pacientes tratadas hasta el momento.
Discusión
Este protocolo reduce la invasividad en el tratamiento de MRKHS al combinar los procedimientos de vaginoplastia y recuperación de ovocitos. Para este propósito, es crucial que se designe un equipo dedicado para garantizar que el momento del COS, el procedimiento quirúrgico y la vitrificación de ovocitos se programen de manera eficiente.
Los pacientes con MRKHS para quienes se espera que este método laparoscópico combinado sea más beneficioso son aquellos en quienes una recuperación transvaginal se consideraría técnicamente desafiante o inviable debido a los ovarios extrapélvicos ubicados lateralmente a lo largo de las paredes pélvicas14 o en las proximidades de órganos como el hígado y la vesícula biliar9, o debido a la presencia de riñones pélvicos. En estas pacientes, se podría hipotetizar un abordaje transabdominal y ha sido reportado en la literatura: sin embargo, se recolectó un número medio de 4,92 ± 1,7 ovocitos15, lo que sugiere una recuperación subóptima debido a limitaciones técnicas. Además, un abordaje transabdominal puede ser difícil o imposible en algunos casos, como en pacientes con marcado grosor de la pared abdominal o mala visibilidad de los ovarios debido a asas suprayacentes del intestino16.
La seguridad es una fortaleza notable de este enfoque. Además de las ventajas de visualización y acceso óptimos descritos anteriormente, la combinación de dos procedimientos en uno solo reduce los riesgos anestésicosicos. Cabe destacar que se mantiene un tiempo operatorio similar en comparación con el de la vaginoplastia laparoscópica de Davydov sola, para la cual se informó una duración media de 125 min en la literatura12. Además, el hecho de que las pacientes se sometan a COS a una edad muy temprana en lugar de más tarde en la vida no implica un mayor riesgo de síndrome de hiperestimulación ovárica para ellas, ya que esta complicación se evita de manera eficiente al desencadenar la maduración folicular final con un análogo de Gn-RH.
Las guías actuales para MRKHS requieren que los médicos aborden las opciones futuras para tener hijos con pacientes y padres en el momento del diagnóstico como un medio para ayudarlos a enfrentar la enfermedad y sus implicaciones1. La adopción, la gestación subrogada o el trasplante uterino son las soluciones disponibles, con ambas opciones para la maternidad biológica que requieren recuperación de ovocitos17. Por lo tanto, este enfoque laparoscópico combinado también podría ser particularmente beneficioso en aquellos pacientes con MRKHS que expresan una gran angustia por su diagnóstico de infertilidad18. De hecho, las encuestas han demostrado que la infertilidad puede ser una de las condiciones más difíciles de aceptar para los pacientes que reciben el diagnóstico de MRKHS19. La criopreservación temprana de ovocitos en pacientes con un deseo de descendencia genética futura podría aliviar su angustia psicológica, en comparación con retrasar esta intervención invasiva necesaria a una fecha indefinida en el futuro.
Sin embargo, como la principal limitación de este enfoque, no todas las pacientes que optan por la criopreservación de ovocitos tan pronto como en el momento de la vaginoplastia eventualmente perseguirán su deseo de maternidad genética en sus últimos años de edad adulta. Por esta razón, el equipo también debe obtener y registrar la decisión de la paciente con respecto al uso de sus ovocitos en caso de que deje de renovar la criopreservación (es decir, eliminación, donación con fines de investigación, donación o venta para reproducción heteróloga cuando sea legal).
Como posible modificación de esta técnica, prevemos el uso de sondas de ultrasonido laparoscópico, que podrían ayudar al experto en infertilidad a perforar los folículos que se encuentran lejos de la superficie ovárica. Por último, prevemos que la adquisición de experiencia en la recuperación laparoscópica de ovocitos para la preservación de la fertilidad en el momento de otros procedimientos podría permitir la disponibilidad de esta opción. Como ejemplo, los pacientes sometidos a otros procedimientos laparoscópicos como la miomectomía y que muestran una indicación para la preservación de la fertilidad podrían beneficiarse de este enfoque.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que revelar.
Agradecimientos
No se recibió financiación específica para este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Oocyte retrieval procedure | |||
| Equipment | |||
| CO2 O2 Incubator | Sanyo | ||
| Incubator | Thermo Scientific | ||
| Laminar Flow Hood | Cooper Surgical | ||
| Portable incubator | Cooper Surgical | ||
| Stereomicroscope | Nikon | ||
| Consumables | |||
| 14 mL Polystyrene Round-Bottom Tube | Falcon | 352057 | |
| 4-well dish | Nunc | 144444 | |
| 60 mm Petri dish | Nunc | FA9150270 | |
| 90 mm Petri dish | Nunc | FA9150360 | |
| Human Serum Albumin 100 mg/ml in Normal Saline (5%) | Origio | 3001 | |
| Mineral oil for embryo culture | Origio | 4008 | |
| One Well Dish | Oosafe | OOPW-CW05 | |
| Quinn’s Advantage Fertilization medium SAGE | Origio | 1020 | |
| Quinn’s Advantage medium with HEPES | Origio | 1024 | |
| Sterile glass pasteur pipettes | |||
| Oocyte denudation | |||
| Equipment | |||
| CO2 O2 Incubator | Sanyo | ||
| Flexipet adjustable handle set | Cook | G18674 | |
| Incubator | Thermo Scientific | ||
| Laminar Flow Hood | Cooper Surgical | ||
| Stereomicroscope | Nikon | ||
| Consumables | |||
| 4-well dish | Nunc | 144444 | |
| CSCM (Continuos single culture) medium | Fujifilm irvine Scientific | 90165 | |
| Human Albumin 100 mg/mL in Normal Saline (5%) | Origio | 3001 | |
| Hyaluronidase | Fujifilm Irvine Scientific | 90101 | |
| IVF culture 60 mm petri dish | Nunc | FA9150270 | |
| Mineral oil for embryo culture | Origio | 4008 | |
| One Well Dish | Oosafe | OOPW-CW05 | |
| Quinn’s Advantage medium with HEPES | Origio | 1024 | |
| Serum Substitute Supplement | Fujifilm irvine Scientific | 99193 | |
| Sterile glass pasteur pipettes | |||
| Stripping pipette tips (140 μm) | Cook | K-FPIP-1140-10BS-5 | |
| Stripping pipette tips (170 μm) | Cook | K-FPIP-1170-10BS-5 | |
| Oocyte vitrification | |||
| 35 mm Petri dish | NUNC | 150255 | |
| 60 mm Petri dish | NUNC | 150270 | |
| 90 mm Petri dish | NUNC | 150360 | |
| Container for Cooling rack | Kitazato | ||
| Cryodevice/cryotop | Kitazato | 81111 | |
| Electronic timer | |||
| Flexipet | COOK | K- 1000 | |
| Gilson Pipetman | Gilson | F123601 | |
| Lab Printer LabXpert | Brady | XSL-86-461 | |
| Tips 20-200 µL | Thermo Scientific | 2160G | |
| Tips 2-20 µL | Thermo Scientific | 2139-HR | |
| Visotubes | Cryo Bio System | 20 | |
| Vitrification Freeze Kit | Fujifilm Irvine Scientific | 90133-SO | |
| Vitrification Thaw kit | Fujifilm Irvine Scientific | 90137-SO |
Referencias
- Committee on Adolescent Health Care. ACOG Committee Opinion No. 728: Müllerian Agenesis: Diagnosis, Management, And Treatment. Obstetrics and Gynecology. 131 (1), 35-42 (2018).
- Reichman, D. E., Laufer, M. R. Mayer-Rokitansky-Küster-Hauser syndrome: Fertility counseling and treatment. Fertility and Sterility. 94 (5), 1941-1943 (2010).
- Ben-Rafael, Z., Bar-Hava, I., Levy, T., Orvieto, R. Simplifying ovulation induction for surrogacy in women with Mayer-Rokitansky-Kuster-Hauser syndrome. Human Reproduction. 13 (6), 1470-1471 (1998).
- Beski, S., Gorgy, A., Venkat, G., Craft, I. L., Edmonds, K. Gestational surrogacy: a feasible option for patients with Rokitansky syndrome. Human Reproduction. 15 (11), 2326-2328 (2000).
- Brännström, M., et al. Livebirth after uterus transplantation. Lancet. 385 (9968), 607-616 (2015).
- Sreenivas, K., Campo-Engelstein, L. Domestic and international surrogacy laws: implications for cancer survivors. Cancer Treatment and Research. 156, 135-152 (2010).
- Soderstrom-Anttila, V., et al. Surrogacy: outcomes for surrogate mothers, children and the resulting families-a systematic review. Human Reproductive Update. 22 (2), 260-276 (2016).
- Wood, E. G., Batzer, F. R., Corson, S. L. Ovarian response to gonadotrophins, optimal method for oocyte retrieval and pregnancy outcome in patients with vaginal agenesis. Human Reproduction. 14 (5), 1178-1181 (1999).
- Raziel, A., et al. Surrogate in vitro fertilization outcome in typical and atypical forms of Mayer-Rokitansky-Kuster-Hauser syndrome. Human Reproduction. 27 (1), 126-130 (2012).
- Egarter, C., Huber, J. Successful stimulation and retrieval of oocytes in patient with Mayer-Rokitansky-Küster syndrome. Lancet. 1 (8597), 1283(1988).
- Candiani, M., et al. Oocyte retrieval during laparoscopic vaginoplasty to reduce invasiveness in the treatment of Mayer-Rokitansky-Küster-Hauser syndrome. Journal of Minimally Invasive Gynecology. 27 (1), 74-79 (2020).
- Fedele, L., et al. Creation of a neovagina by Davydov's laparoscopic modified technique in patients with Rokitansky syndrome. American Journal of Obstetrics and Gynecology. 202 (1), 1-6 (2010).
- ESHRE Working Group on Ultrasound in ART et al. Recommendations for good practice in ultrasound: oocyte pick up. Human Reproduction Open. 2019 (4), (2019).
- Callens, N., et al. An update on surgical and non-surgical treatments for vaginal hypoplasia. Human Reproductive Update. 20 (5), 775-801 (2014).
- Sönmezer, M., Gülümser, Ç, Sönmezer, M., Sükür, Y. E., Atabekoğlu, C. Transabdominal ultrasound guided oocyte retrieval using vaginal ultrasound probe: Definition of the technique. The Journal of Obstetrics and Gynaecology Research. 47 (2), 800-806 (2021).
- Raju, G. A., Haranath, G. B., Krishna, K. M., Prakash, G. J., Madan, K. Successful pregnancy with laparoscopic oocyte retrieval and in vitro fertilization in Mullerian agenesis. Singapore Medicine Journal. 47 (4), 329-331 (2006).
- Liszewska-Kapłon, M., Strózik, M., Kotarski, Ł, Bagłaj, M., Hirnle, L. Mayer-Rokitansky-Küster-Hauser syndrome as an interdisciplinary problem. Advances in Clinical and Experimental Medicine. 29 (4), 505-511 (2020).
- Wagner, A., et al. Treatment management during the adolescent transition period of girls and young women with Mayer-Rokitansky-Küster-Hauser syndrome (MRKHS): A systematic literature review. Orphanet Journal of Rare Diseases. 11 (1), 152(2016).
- Bean, E. J., Mazur, T., Robinson, A. D. Mayer-Rokitansky-Küster-Hauser syndrome: sexuality, psychological effects, and quality of life. Journal of Pediatric and Adolescent Gynecology. 22 (6), 339-346 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados